KARAKTERISTIK
IMUNOGLOBULIN Y ANTITETANUS
DIISOLASI DARI TELUR AYAM SEBAGAI
PENGGANTI ANTITETANUS
SERUM KUDA
I NYOMAN SUARTHA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Karakteristik Imunoglo bulin Y Antitetanus Diisolasi Dari Telur Ayam Sebagai Pengganti Antite tanus Serum Kuda adalah karya saya sendiri dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutif dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir disertasi ini.
ABSTRAK
I NYOMAN SUARTHA. Karakteristik Imunoglobulin Y Antitetanus Diisolasi dari Telur Ayam sebagai Pengganti Antitetanus Serum Kuda. Dibawah bimbingan I WAYAN TEGUH WIBAWAN, RETNO DAMAYANTI SOEJOEDONO, dan BIBIANA W. LAY.
Produksi antibodi poliklonal pada ayam lebih menguntungkan dibandingkan dengan produksi pada mamalia. Pemeliharaan ayam lebih sederhana dan murah, ekstraksi dan purifikasi imunoglobulin Y (IgY) dari telur lebih sederhana, cepat dan biayanya murah. Penggunaan ayam juga dapat mengurangi pemakaian hewan mamalia dan menjadikan kondisi hewan coba lebih baik. Selain itu IgY di dalam telur memberikan prospek yang sangat berarti, untuk mengatasi masalah produksi antitetanus serum pada kuda. Telur dikoleksi dari ayam betina jenis Isa Brown yang telah diimunisasi dengan toksoid tetanus dosis bertingkat. Toksoid tetanus dicampur dengan Freund adjuvant complete dan Freund adjuvant incomplete. Ekstraksi IgY antitetanus dari kuning telur dilakukan dengan metode PEG–Kloroform selanjutnya dipurifikasi dengan fast protein liquid chromatography. Identifikasi IgY antitetanus ditentukan secara fotometris dengan metode Bradford (λ = 595 nM), uji Agar Gel Presipitation. Berat molekul IgY antitetanus dideteksi dengan Sodium Dodecyl Sulphate Polyacrylamide Gel Electrophoresis. IgY antitetanus diber ikan perlakuan pH, panas , dan enzim. Aktivitas biologis IgY antitetanus setelah perlakuan diamati dengan metode
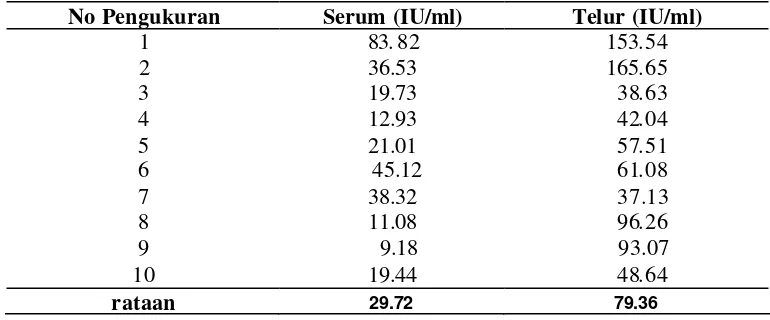
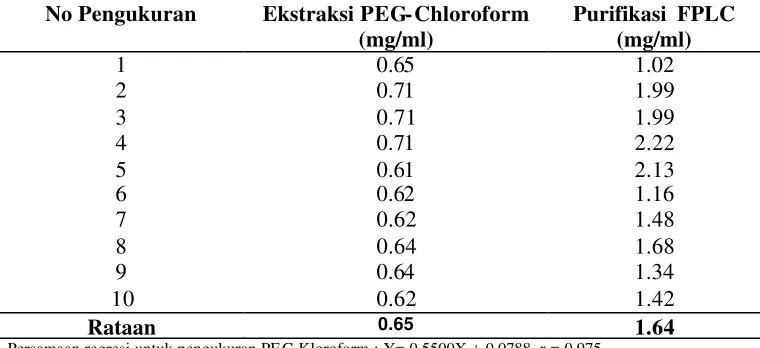
enzyme linked imunosorbent assay. Uji Potensi IgY anti tetanus ditentukan dengan metode Spearman-Karber. Titer IgY antitetanus mencapai punca k pada telur minggu ke tujuh dari awal imunisasi. Rataa n titer tertinggi pada telur 80.16 ± 33.55 IU/ml dan terendah 1.69 ± 0.63 IU/ml. Konsentrasi protein (IgY) setelah ekstraksi diperoleh sebesar 0.652 ± 0.041 mg/ml. Sedangkan setelah purifikasi konsentrasi protein sebesar 1.644 ± 0.424 mg/ml. Aktivitas biologis IgY anti tetanus menurun sangat nyata (p<0.01) pada pH 2 dan pH 3, suhu 72.5 oC, dan hilang pada perlakuan suhu 90 oC. Larutan sukrosa konsentrasi 25% mampu mempertahankan aktivitas IgY antitetanus sampai 50 % pada suhu 75 oC selama 5 menit, sedangkan larutan glukosa konsentrasi 50% mampu meningkatkan aktivitas IgY antitetanus pada suhu 75 oC dan suhu 80 oC selama 5 menit. Aktivitas IgY antitetanus menurun setelah perlakuan enzim pepsin, tripsin dan protease. Berdasarkan perhitungan Spearman-Karber diperoleh nilai potensi IgY antitetanus sebesar 35 IU/ml. Pemberian IgY antitetanus 0.2 dan 0.4 IU/ekor mampu melindungi mencit dari dosis letal toksin tetanus . Pada pemberian dosis IgY lebih tinggi (0.8 IU/ekor dan 1 IU/ekor) mampu melindungi mencit dari peningkatan dua kali dosis letal toksin. Pemberian IgY antitetanus secara oral pada hewan dewasa tidak efektif untuk tujuan imunoterapi pasif dalam usaha pencegahan penyakit secara sistemik . Kesimpulan dari penelitian ini yaitu ayam mampu memproduksi IgY antitetanus pada kuning telur dan dapat digunakan sebagai sumber antitetanus serum untuk menggantikan produksi antitetanus serum di kuda.
ABSTRACT
I NYOMAN SUARTHA. The Characteristic of Antitetanus Immunoglobulin Y Isolated from Eggs to substitute Horse Antitetanus Serum. Under advisory of I WAYAN TEGUH WIBAWAN, RETNO DAMAYANTI SOEJOEDONO, and BIBIANA W. LAY.
Laying hens are highly profitable producers of polyclonal antibodies in comparison with mammals as antibodies can be purified from egg yolks. The cost for producing IgY is lower than for mammalian antibodies since chicken housing is cheap and isolation process is economical, high yielding, uncomplicated and fast. The purpose of the study was to explore the opportunity of using antitetanus IgY from egg yolks to substitute the production of antitetanus serum from horses. The eggs were collected from adult Isa brown hens which have been immunized by tetanus toxoid. The immunization was applied intra venously with an initial dose of 15 Lf. The immunization was repeated three times with gradual dose of 100, 200, and 300 Lf with an interval of one week intra muscularly. The first immunization was tetanus toxoid mixed with Freund adjuvant complete and subsequently mixed with Freund adjuvant incomplete. Antitetanus IgY was extracted from egg yolks by means of PEG–Chloroform and purifie d using fast protein liquid chromatography. The purity of antitetanus IgY was determined by Bradford method (λ = 595 nm) and Agar Gel Precipitation test. The molecular weight of purified antitetanus IgY was determined with Sodium Dodecyl Sulphate Polyacrylamide Gel Electrophoresis. The antitetanus IgY were treated by pH, heat, and enzyme. The biological activities of treated antitetanus IgY was determined by enzyme linked immunosorbent assay. Neutralization potency test of antitetanus IgY was determined by Spearman-Karber method. The antitetanus IgY highest titer of egg yolks was 80.16 ± 33.55 IU/ml reached at seven weeks after starting immunization schedule and the lowest was 1.69 ± 0.63 IU/ml. Protein concentration (IgY) after extraction and purification were 0.652 ± 0.041 mg/ml and 1.644 ± 0.424 mg/ml respectively . Biological activity of antitetanus IgY decreased significantly (p<0.01) at of pH 2, pH 3, and at 72.5 oC, and lost its activity at 90 oC after 20 minute s. Addition of 25% sucrose solution was able to maintain antitetanus IgY activity until 50 % at 75 oC for 5 minutes, while addition of 50% glucose solution increase antitetanus IgY activity at 75 oC and 80 oC for 5 minutes. The effect of pepsin, trypsin, and protease enzyme s decreased the activities of antitetanus IgY. Spearman-Karber value of potency of antitetanus IgY was 35 IU/ml. The injection of 0.2 and 0.4 IU antitetanus IgY per mice respectively, protect all mice from the letal dose tetanus toxin. The doses of 0.8 IU and 1 IU anti tetanus IgY per mice protected twice dose of letal tetanus toxin. Antitetanus IgY given orally on adult animal was ineffective as passive immunotherapy. This research concluded that the hens were capable of produc ing antitetanus in egg yolks and can be used as a resource of antitetanus serum to substitute horse antitetanus serum.
Hak cipta milik I nstitut Pertanian Bogor , tahun 2006 Hak cipta dilindungiDilarang mengutip dan memperbanyak tanpa izin tertulis dari Institut Pertanian Bogor, sebagian atau seluruhnya dalam bentuk apa pun, baik cetak, fotokopi,
KARAKTERISTIK
IMUNOGLOBULIN Y ANTITETANUS DIISOLASI DARI
TELUR AYAM SEBAGAI PENGGANTI ANTITETANUS
SERUM KUDA
I NYOMAN SUARTHA
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Sains Veteiner
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Disertasi : KARAKTERISTIK IMUNOGLOBULIN Y
ANTITETANUS DIISOLASI DARI TELUR AYAM SEBAGAI PENGGANTI ANTITETANUS SERUM KUDA
Nama Mahasiswa : I NYOMAN SUARTHA Nomor pokok : B161030021
Program Studi : SAINS VETERINER
Disetujui Komisi Pembimbing
Dr. drh. I Wayan Teguh Wibawan, MS. Ketua
Dr. Retno Damayanti Soejoedono, MS. Prof. Dr. Bibiana W. Lay, M.Sc. Anggota Anggota
Diketahui
Ketua Program Studi Sains Veteriner Dekan Sekolah Pascasarjana
drh. Bambang P. Priosoeryanto, MS, PhD. Dr.Ir.Khairil Anwar Notodiputro,MS.
PRAKATA
Puji syukur penulis panjatkan kehadapan Ida Sang Hyang Widi Wasa, Tuhan Yang Maha Esa atas segala rahmatNya, sehingga penulisa n disertasi ini dapat diselesaikan. Karya ilmiah ini berjudul : Karakteristik Imunoglobulin Y Antitetanus Diisolasi Dari Telur Ayam Sebagai Pengganti Antitetanus Serum Kuda.
Ucapan terimakasih dan penghargaan penulis sampaikan kepada Yang terhormat: Dr. drh. I Wayan Teguh Wibawan MS selaku ketua komisi pembimbing, Dr. Retno Damayanti Soejoedono, MS, dan Prof. Dr. Bibiana W. Lay, MSc. Sebagai anggota komisi pembimbing yang telah memberikan semangat, bimbingan, saran, petunjuk dan tuntunan yang tulus selama mengikuti pendidikan, persiapan dan perencanaan penelitian, pencarian dana penelitian sampai pada penyusunan disertasi ini.
Terima kasih penulis sampaikan kepada DIRJEN DIKTI atas beasiswa BPPS yang telah diberikan, Direktur P3M DIKTI atas sebagian dana penelitian yang diberikan melalui proyek Hibah bersaing XII/tahun ke-1 dan ke-2, Dr. drh Risa Tiuria, MS atas masukannya saat ujian tertutup. Prof. Dr. Fachriyan H. Pasaribu, dan Dr. drh. A.E.T.H. Wahyuni, MSi atas masukannya saat sidang terbuka untuk memperluas kasanah tulisan ini. Ibu drh Lia Siti Halimah, MSi dan staf di laboratorium uji hewan PT Bio Farma Bandung atas segala bantuan yang telah diberikan, Dr Ita Djuwitha, MPhil dan staf di laboratorium Embriologi FKH IPB atas bantuannya. Ucapan terima kasih juga penulis sampaikan kepada drh Okti Nadia putri, drh Putu Ika Mayangsari, drh Candramaya Siska Damayanti, Dra Elisabeth Maria, MSi, saudara Imam Bayu serta tema n–teman Punhawacana Bali atas bantuannya.
Kepada ayahanda I Wayan Budiasa, BA, Ibunda Ni Ketut Sangi, AMAPd, Ayah mertua I Nyoman Padet dan Ibunda Ni Wayan Rambu (Alm) , Kakak, Adik serta seluruh keluarga, penulis mengucapkan terima kasih dan penghargaan atas segala doa, bimbingan dan dorongan semangat yang telah diberikan selama ini. Terima kasih, penghargaan dan hormat yang tulus penulis sampaikan kepada istri tercinta drh Ni Made Sri Widiyani, yang penuh rasa kasih dan pengertian, sabar, selalu mendoakan, memberikan dorongan, semangat, dan banyak berkorban selama penulis mengikuti pendidikan sampai selesainya disertasi ini. Terima kasih pula untuk anak-anak tercinta dan tersayang Ni Luh Vigyan Witharni, Ni Made Praba Viswandari, dan I Nyoman Gede Prajnam Magha Vadantha yang senantiasa memberikan semangat dan dorongan dalam kehidupan penulis.
Penulis dengan rendah hati mohon maaf atas segala kekurangan dalam disertasi ini dan semoga karya ini bermanfaat.
Bogor, September 2006
RIWAYAT HIDUP
Penulis dilahirkan di Badung Bali pada tanggal 1 Maret 1968, sebagai anak kedua dari empat saudara dari pasangan ayah I Wayan Budiasa BA, dan Ibu Ni Ketut Sangi, AMAPd. Pendidikan sarjana dan profesi dokter hewan di tempuh di Fakultas Kedokteran Hewan Universitas Udayana, lulus tahun 1993. Pada tahun 1997 penulis mendapat kesempatan mengikuti pendidikan program Magister di Program Studi Sains Veteriner Program Pascasarjana Institut Pertanian Bogor dan menamatkannya pada tahun 1999. Kesempatan untuk melanjutkan ke program doktor pada program studi dan pada perguruan tinggi yang sama di peroleh pada tahun 2003. Beasiswa pendidikan pascasarjana diperoleh dari Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional Republik Indonesia melalui Biaya Pendidikan Program Pascasarjana (BPPS).
KARAKTERISTIK
IMUNOGLOBULIN Y ANTITETANUS
DIISOLASI DARI TELUR AYAM SEBAGAI
PENGGANTI ANTITETANUS
SERUM KUDA
I NYOMAN SUARTHA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Karakteristik Imunoglo bulin Y Antitetanus Diisolasi Dari Telur Ayam Sebagai Pengganti Antite tanus Serum Kuda adalah karya saya sendiri dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutif dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir disertasi ini.
ABSTRAK
I NYOMAN SUARTHA. Karakteristik Imunoglobulin Y Antitetanus Diisolasi dari Telur Ayam sebagai Pengganti Antitetanus Serum Kuda. Dibawah bimbingan I WAYAN TEGUH WIBAWAN, RETNO DAMAYANTI SOEJOEDONO, dan BIBIANA W. LAY.
Produksi antibodi poliklonal pada ayam lebih menguntungkan dibandingkan dengan produksi pada mamalia. Pemeliharaan ayam lebih sederhana dan murah, ekstraksi dan purifikasi imunoglobulin Y (IgY) dari telur lebih sederhana, cepat dan biayanya murah. Penggunaan ayam juga dapat mengurangi pemakaian hewan mamalia dan menjadikan kondisi hewan coba lebih baik. Selain itu IgY di dalam telur memberikan prospek yang sangat berarti, untuk mengatasi masalah produksi antitetanus serum pada kuda. Telur dikoleksi dari ayam betina jenis Isa Brown yang telah diimunisasi dengan toksoid tetanus dosis bertingkat. Toksoid tetanus dicampur dengan Freund adjuvant complete dan Freund adjuvant incomplete. Ekstraksi IgY antitetanus dari kuning telur dilakukan dengan metode PEG–Kloroform selanjutnya dipurifikasi dengan fast protein liquid chromatography. Identifikasi IgY antitetanus ditentukan secara fotometris dengan metode Bradford (λ = 595 nM), uji Agar Gel Presipitation. Berat molekul IgY antitetanus dideteksi dengan Sodium Dodecyl Sulphate Polyacrylamide Gel Electrophoresis. IgY antitetanus diber ikan perlakuan pH, panas , dan enzim. Aktivitas biologis IgY antitetanus setelah perlakuan diamati dengan metode
enzyme linked imunosorbent assay. Uji Potensi IgY anti tetanus ditentukan dengan metode Spearman-Karber. Titer IgY antitetanus mencapai punca k pada telur minggu ke tujuh dari awal imunisasi. Rataa n titer tertinggi pada telur 80.16 ± 33.55 IU/ml dan terendah 1.69 ± 0.63 IU/ml. Konsentrasi protein (IgY) setelah ekstraksi diperoleh sebesar 0.652 ± 0.041 mg/ml. Sedangkan setelah purifikasi konsentrasi protein sebesar 1.644 ± 0.424 mg/ml. Aktivitas biologis IgY anti tetanus menurun sangat nyata (p<0.01) pada pH 2 dan pH 3, suhu 72.5 oC, dan hilang pada perlakuan suhu 90 oC. Larutan sukrosa konsentrasi 25% mampu mempertahankan aktivitas IgY antitetanus sampai 50 % pada suhu 75 oC selama 5 menit, sedangkan larutan glukosa konsentrasi 50% mampu meningkatkan aktivitas IgY antitetanus pada suhu 75 oC dan suhu 80 oC selama 5 menit. Aktivitas IgY antitetanus menurun setelah perlakuan enzim pepsin, tripsin dan protease. Berdasarkan perhitungan Spearman-Karber diperoleh nilai potensi IgY antitetanus sebesar 35 IU/ml. Pemberian IgY antitetanus 0.2 dan 0.4 IU/ekor mampu melindungi mencit dari dosis letal toksin tetanus . Pada pemberian dosis IgY lebih tinggi (0.8 IU/ekor dan 1 IU/ekor) mampu melindungi mencit dari peningkatan dua kali dosis letal toksin. Pemberian IgY antitetanus secara oral pada hewan dewasa tidak efektif untuk tujuan imunoterapi pasif dalam usaha pencegahan penyakit secara sistemik . Kesimpulan dari penelitian ini yaitu ayam mampu memproduksi IgY antitetanus pada kuning telur dan dapat digunakan sebagai sumber antitetanus serum untuk menggantikan produksi antitetanus serum di kuda.
ABSTRACT
I NYOMAN SUARTHA. The Characteristic of Antitetanus Immunoglobulin Y Isolated from Eggs to substitute Horse Antitetanus Serum. Under advisory of I WAYAN TEGUH WIBAWAN, RETNO DAMAYANTI SOEJOEDONO, and BIBIANA W. LAY.
Laying hens are highly profitable producers of polyclonal antibodies in comparison with mammals as antibodies can be purified from egg yolks. The cost for producing IgY is lower than for mammalian antibodies since chicken housing is cheap and isolation process is economical, high yielding, uncomplicated and fast. The purpose of the study was to explore the opportunity of using antitetanus IgY from egg yolks to substitute the production of antitetanus serum from horses. The eggs were collected from adult Isa brown hens which have been immunized by tetanus toxoid. The immunization was applied intra venously with an initial dose of 15 Lf. The immunization was repeated three times with gradual dose of 100, 200, and 300 Lf with an interval of one week intra muscularly. The first immunization was tetanus toxoid mixed with Freund adjuvant complete and subsequently mixed with Freund adjuvant incomplete. Antitetanus IgY was extracted from egg yolks by means of PEG–Chloroform and purifie d using fast protein liquid chromatography. The purity of antitetanus IgY was determined by Bradford method (λ = 595 nm) and Agar Gel Precipitation test. The molecular weight of purified antitetanus IgY was determined with Sodium Dodecyl Sulphate Polyacrylamide Gel Electrophoresis. The antitetanus IgY were treated by pH, heat, and enzyme. The biological activities of treated antitetanus IgY was determined by enzyme linked immunosorbent assay. Neutralization potency test of antitetanus IgY was determined by Spearman-Karber method. The antitetanus IgY highest titer of egg yolks was 80.16 ± 33.55 IU/ml reached at seven weeks after starting immunization schedule and the lowest was 1.69 ± 0.63 IU/ml. Protein concentration (IgY) after extraction and purification were 0.652 ± 0.041 mg/ml and 1.644 ± 0.424 mg/ml respectively . Biological activity of antitetanus IgY decreased significantly (p<0.01) at of pH 2, pH 3, and at 72.5 oC, and lost its activity at 90 oC after 20 minute s. Addition of 25% sucrose solution was able to maintain antitetanus IgY activity until 50 % at 75 oC for 5 minutes, while addition of 50% glucose solution increase antitetanus IgY activity at 75 oC and 80 oC for 5 minutes. The effect of pepsin, trypsin, and protease enzyme s decreased the activities of antitetanus IgY. Spearman-Karber value of potency of antitetanus IgY was 35 IU/ml. The injection of 0.2 and 0.4 IU antitetanus IgY per mice respectively, protect all mice from the letal dose tetanus toxin. The doses of 0.8 IU and 1 IU anti tetanus IgY per mice protected twice dose of letal tetanus toxin. Antitetanus IgY given orally on adult animal was ineffective as passive immunotherapy. This research concluded that the hens were capable of produc ing antitetanus in egg yolks and can be used as a resource of antitetanus serum to substitute horse antitetanus serum.
Hak cipta milik I nstitut Pertanian Bogor , tahun 2006 Hak cipta dilindungiDilarang mengutip dan memperbanyak tanpa izin tertulis dari Institut Pertanian Bogor, sebagian atau seluruhnya dalam bentuk apa pun, baik cetak, fotokopi,
KARAKTERISTIK
IMUNOGLOBULIN Y ANTITETANUS DIISOLASI DARI
TELUR AYAM SEBAGAI PENGGANTI ANTITETANUS
SERUM KUDA
I NYOMAN SUARTHA
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Sains Veteiner
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Disertasi : KARAKTERISTIK IMUNOGLOBULIN Y
ANTITETANUS DIISOLASI DARI TELUR AYAM SEBAGAI PENGGANTI ANTITETANUS SERUM KUDA
Nama Mahasiswa : I NYOMAN SUARTHA Nomor pokok : B161030021
Program Studi : SAINS VETERINER
Disetujui Komisi Pembimbing
Dr. drh. I Wayan Teguh Wibawan, MS. Ketua
Dr. Retno Damayanti Soejoedono, MS. Prof. Dr. Bibiana W. Lay, M.Sc. Anggota Anggota
Diketahui
Ketua Program Studi Sains Veteriner Dekan Sekolah Pascasarjana
drh. Bambang P. Priosoeryanto, MS, PhD. Dr.Ir.Khairil Anwar Notodiputro,MS.
PRAKATA
Puji syukur penulis panjatkan kehadapan Ida Sang Hyang Widi Wasa, Tuhan Yang Maha Esa atas segala rahmatNya, sehingga penulisa n disertasi ini dapat diselesaikan. Karya ilmiah ini berjudul : Karakteristik Imunoglobulin Y Antitetanus Diisolasi Dari Telur Ayam Sebagai Pengganti Antitetanus Serum Kuda.
Ucapan terimakasih dan penghargaan penulis sampaikan kepada Yang terhormat: Dr. drh. I Wayan Teguh Wibawan MS selaku ketua komisi pembimbing, Dr. Retno Damayanti Soejoedono, MS, dan Prof. Dr. Bibiana W. Lay, MSc. Sebagai anggota komisi pembimbing yang telah memberikan semangat, bimbingan, saran, petunjuk dan tuntunan yang tulus selama mengikuti pendidikan, persiapan dan perencanaan penelitian, pencarian dana penelitian sampai pada penyusunan disertasi ini.
Terima kasih penulis sampaikan kepada DIRJEN DIKTI atas beasiswa BPPS yang telah diberikan, Direktur P3M DIKTI atas sebagian dana penelitian yang diberikan melalui proyek Hibah bersaing XII/tahun ke-1 dan ke-2, Dr. drh Risa Tiuria, MS atas masukannya saat ujian tertutup. Prof. Dr. Fachriyan H. Pasaribu, dan Dr. drh. A.E.T.H. Wahyuni, MSi atas masukannya saat sidang terbuka untuk memperluas kasanah tulisan ini. Ibu drh Lia Siti Halimah, MSi dan staf di laboratorium uji hewan PT Bio Farma Bandung atas segala bantuan yang telah diberikan, Dr Ita Djuwitha, MPhil dan staf di laboratorium Embriologi FKH IPB atas bantuannya. Ucapan terima kasih juga penulis sampaikan kepada drh Okti Nadia putri, drh Putu Ika Mayangsari, drh Candramaya Siska Damayanti, Dra Elisabeth Maria, MSi, saudara Imam Bayu serta tema n–teman Punhawacana Bali atas bantuannya.
Kepada ayahanda I Wayan Budiasa, BA, Ibunda Ni Ketut Sangi, AMAPd, Ayah mertua I Nyoman Padet dan Ibunda Ni Wayan Rambu (Alm) , Kakak, Adik serta seluruh keluarga, penulis mengucapkan terima kasih dan penghargaan atas segala doa, bimbingan dan dorongan semangat yang telah diberikan selama ini. Terima kasih, penghargaan dan hormat yang tulus penulis sampaikan kepada istri tercinta drh Ni Made Sri Widiyani, yang penuh rasa kasih dan pengertian, sabar, selalu mendoakan, memberikan dorongan, semangat, dan banyak berkorban selama penulis mengikuti pendidikan sampai selesainya disertasi ini. Terima kasih pula untuk anak-anak tercinta dan tersayang Ni Luh Vigyan Witharni, Ni Made Praba Viswandari, dan I Nyoman Gede Prajnam Magha Vadantha yang senantiasa memberikan semangat dan dorongan dalam kehidupan penulis.
Penulis dengan rendah hati mohon maaf atas segala kekurangan dalam disertasi ini dan semoga karya ini bermanfaat.
Bogor, September 2006
RIWAYAT HIDUP
Penulis dilahirkan di Badung Bali pada tanggal 1 Maret 1968, sebagai anak kedua dari empat saudara dari pasangan ayah I Wayan Budiasa BA, dan Ibu Ni Ketut Sangi, AMAPd. Pendidikan sarjana dan profesi dokter hewan di tempuh di Fakultas Kedokteran Hewan Universitas Udayana, lulus tahun 1993. Pada tahun 1997 penulis mendapat kesempatan mengikuti pendidikan program Magister di Program Studi Sains Veteriner Program Pascasarjana Institut Pertanian Bogor dan menamatkannya pada tahun 1999. Kesempatan untuk melanjutkan ke program doktor pada program studi dan pada perguruan tinggi yang sama di peroleh pada tahun 2003. Beasiswa pendidikan pascasarjana diperoleh dari Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional Republik Indonesia melalui Biaya Pendidikan Program Pascasarjana (BPPS).
PENDAHULUAN
Latar Belakang
Kejadian penyakit tetanus dilaporkan masih tetap tinggi, setiap tahun dilaporkan terjadi 350 000 sampai 400 000 kasus tetanus di seluruh dunia. Kejadian kasus lebih tinggi di negara berkembang terutama negara yang program imunisasinya tidak teratur dan tingkat kesadaran masyarakat tentang kesehatan rendah (Bruggemann et al. 2003; Kiefer 2004). Pada negara industri dilaporkan kasus tetanus terjadi secara sporadik. Penyakit tetanus dilaporkan bersifat endemis pada 90 negara berkembang (Bruggemann et al. 2003).
Strategi pencegahan penyakit tetanus dengan meningkatkan kebersihan dan imunisasi. Imunisasi dapat dilakukan secara aktif dengan toksoid tetanus dan pasif dengan antitetanus serum. Pada daerah yang beresiko tinggi, imunisasi aktif minimal dilakukan sebanyak tiga kali (Vandelaer et al. 2003). Antibodi yang terbentuk akan berikatan dan menginaktivasi toksin sebelum toksin itu menyerang otot dan saraf. Clostridium tetani dapat dibunuh dengan antibiotik penicilin, tetapi antibiotik tidak mampu menetralisasi toksin (Kiefer 2004). Pencegahan dengan antitetanus serum dan pengobatan dengan antibiotik merupakan pendekatan yang masih relevan untuk mengurangi penyakit tetanus (Covarelli dan Marconi 1980; Bleck 1991; Forrat et al. 1998; Bruggemann et al. 2003).
Pencegahan tetanus difokuskan pada imunisasi awal. Imunisasi diulang setiap 10 tahun atau pada saat berumur 40 sampai 50 tahun untuk menghindari terinfeksi tetanus saat umur tua (Schatz et al. 1998; Cavuslu et al. 2003). Maral et al. (2001) melaporkan kejadian tetanus menyerang lebih dari satu juta orang di seluruh dunia, dengan 80% kejadian terjadi pada masa neonatal.
2 Kekhawatiran akan kejadian tetanus sampai saat ini pada manusia masih mendapat perhatian yang serius, khususnya aplikasi antitetanus ser um (ATS) tetap dilakukan pada saat terjadi perlukaan. Hal yang sama juga terjadi pada kesehatan hewan, terutama pada kawasan kebun binatang atau kawasan wisata dengan obyek binatang. Penggunaan kandang yang sempit, daya dukung kawasan yang terbatas akan mempermudah kejadian luka, seperti halnya pada daerah kawasan wisata monkey forest Ubud Bali yang dihuni oleh monyet ekor panjang, kejadian luka berkisar sampai 10%. Tipe luka yang banyak diderita adalah kulit robek, luka tusuk, dan kulit robek sampai otot rusak. Kondisi luka ini akan mempermudah kejadian tetanus terutama luka yang terjadi di daerah badan yang sulit dibersihkan. Kesembuhan luka yang diderita oleh monyet itu berkisar antara satu minggu sampai 3 minggu (Suartha et al. 2002). Waktu itu merupakan periode masa inkubasi dari kuman tetanus (Lewis 1998). Hal yang sama juga sangat rentan dialami oleh praktisi kesehatan hewan di lapangan, terutama yang bertugas di wilayah terpencil. Seorang praktisi kesehatan hewan dilaporkan tewas akibat tetanus sete lah terinjak sapi, begitu juga halnya di daerah bekas bencana (Soeharsono 2005).
Produksi ATS saat ini umumnya dilakukan pada kuda, yakni dengan menyuntikkan toksoid tetanus pada kuda yang terpilih. Masalah sering muncul karena penggunaan serum spesifik sering menyebabkan reaksi silang seperti reaksi anafilaktik atau serum sickness. Hal itu telah mendorong penggunaan imunoglobulin antitetanus dari sumber lain seperti serum manusia, tetapi kesulitan menyedia kan donor (Forrat et al. 1998). Penggunaan telur (Imunoglobulin Y) diharapkan dapat mengurangi resiko itu dan digunakan sebagai sumber antitetanus .
3 menggunakan imunoglobulin dari mamalia seperti kelinci, tikus, quinea pig, dan hewan mamalia besar seperti kuda, kambing, domba, dan sapi (Svendsen et al.
1995).
Beberapa peneliti melaporkan keuntungan penggunaan telur sebagai pabrik bahan biologi adalah : kandungan IgY tinggi dalam telur, mudah diproduksi dalam jumlah besar, tidak menimbulkan efek samping karena tidak bereaksi silang dengan faktor rheumatoid dan komponen jaringan mamalia, tidak bereaksi dengan reseptor Fc yang dimiliki oleh mikrob sehingga bereaksi lebih spesifik terhadap antigen yang dikehendaki, memiliki aktivitas dan daya netralisasi lebih tinggi dibandingkan IgG mamalia, biaya produksi secara masal lebih murah dibandingkan menggunakan mamalia, dan dari segi Animal welfare
lebih dapat diterima dibandingkan dengan menggunakan mamalia (Davis dan Reeves 2002).
Pemanfaatan IgY untuk pengobatan dan pencegahan penyakit masih sedikit dan terbatas pada skala laboratorium. Perkembangan dan penelitian ke arah pemanfaatan telur unggas baru berkembang dalam satu setengah dekade terakhir. Antibodi spesifik di dalam kuning telur dapat ditimbulkan dari berbagai macam patogen. Kermani-Arab e t al. (2001) melaporkan IgY spesifik terhadap penyakit Marek yang diaplikasi secara pasif mampu menahan infeksi virus Marek. Efek yang sama diamati terhadap berbagai penyakit misalnya influenza (Bogoyavlensky et al. 1999), EPEC K11 (Rawendra 2005) , Salmonella enteridis
dan typhimurium (Lee et al. 2002; Babu et al. 2003) , Helicobacter pylori (Shin
et al. 2002; Shin et al. 2004).
IgY juga digunakan untuk deteksi antigen pe rmukaan penderita hepatitis B (Makvandi dan Fiuzi 2002), caries gigi (Hamada et al.1991), pembentukan
plaque gigi karena Streptokokus mutans (Hatta et al. 1997), diare pada pedet (Erhard et al. 1997), deteksi kanker (Yang et al. 1997; Fortgens et al. 1997; Sasse et al. 1998; Sriram et al. 1999), Virus horsesickness (Plessis et al. 1999) , Bovine coronavirus (Ikemori et al. 1997) , dan deteksi insulin (Song et al. 1985).
Teknologi IgY sangat baik digunakan untuk produksi antibodi dari antigen
4
al.1997; Losonczy et al.1999; Coillie et al. 2004; Ester 2004), dan diagnostik yang lain (Katz et al.1985). Pemberian secara oral sebagai food suplemen untuk pencegahan kuman (Shimizu et al. 1988; Yokohama et al. 1998; Carlander et al.
2000; Hedlund dan Hau 2001, Sunwoo et al. 2002). IgY dapat di absor psi dan ditransfer secara efisien sebagai antibodi kolustrum (Yokohama et al. 1993).
Adanya IgY dalam telur memberikan prospek untuk pemberian kekebalan pasif pada kasus penya kit (Polson et al. 1980). Prinsip pengebalan adalah pasif, artinya transfer kekebalan terhadap beberapa penyakit dilakukan dengan mengkonsumsi telur yang mengandung zat kebal dan dipreparasi secara khusus. IgY unggas mengenal lebih banyak epitop protein mamalia dibandingkan dengan imunoglobulin kelinci, sehingga cocok untuk percobaan imunologi protein mamalia (Schade et al.1996). IgY unggas dapat diproduksi apabila antigen dalam jumlah sedikit atau memerlukan pengawetan tinggi seperti hormon. Dalam pemerik saan imunologi, IgY memberikan hasil lebih akurat karena dapat mengurangi ikatan dengan antigen non spesifik, yang menyebabkan hasil negatif palsu atau positif palsu (Schade et al. 1996; Warr dan Higgins 1995).
Laporan penelitian di atas memberikan inspirasi untuk mempelajari karakteristik dan efikasi atau daya netralisasi IgY spesifik terhadap toksin tetanus. Sampai saat ini keperluan akan antitetanus serum (ATS) untuk pencegahan infeksi tetanus, khususnya pada kasus perlukaan masih sangat dibutuhkan.
Pe rumusan masalah
5 Hal ini menyebabkan penderitaan kronis pada kuda. Endapan amiloid sering dijumpai pada organ limpa, limfoglandula dan organ limfoid lainnya. Produksi ATS pada kuda sangat mahal.
Adanya masalah-masalah di atas maka terpikirkan untuk memproduksi ATS pada telur ayam. Hal ini sangat mungkin dilakukan karena antibodi dalam darah induk ayam dapat ditransfer ke dalam telur dalam jumlah yang cukup banyak. Schade et al. (1996) melaporkan imunisasi pada ayam menghasilkan konsentrasi antibodi spesifik yang sama antara serum da n kuning telur. Konsentrasi IgY pada kuning telur konstan sampai oosit matang (maturasi), dengan kandungan 10 sampai 20 mg/ml (Carlander 2002). Biaya produksi imunoglobulin pada telur unggas sangat murah (Warr dan Higgins 1995; Makvandi da n Fiuzi 2002)
Penggunaan ayam untuk produksi antibodi menghilangkan dan mengurangi penggunaan mamalia sebagai hewan laboratorium. Menghilangkan yang di maksud adalah menghilangkan langkah yang menyakitkan saat koleksi darah, yang digantikan dengan ekstraksi antibodi dari kuning telur. Pengurangan yang di maksud adalah mengurangi jumlah hewan yang digunakan, sebab ayam menghasilkan antibodi yang lebih efisien dibandingkan hewan mamalia seperti kelinci maupun mamalia besar lainnya (Karlsson et al. 2004). Berkenaan dengan
animal welfare dan efisiensi biaya, penggunaan antibodi dalam telur lebih bisa diterima dibandingkan dengan penggunakan hewan percobaan mamalia (Svendsen
et al. 1995).
Tujuan Penelitian
Tujuan penelitian ini adalah mengetahui sifat karakteristik IgY spesifik terhadap toksin tetanus yang diisolasi dari telur, untuk menggantikan produksi antitetanus serum pada kuda.
Manfaat Penelitian
6 produksinya lebih murah, aman, mudah, dan kualitas yang lebih baik daripada ATS konvensional yang diproduksi dari kuda.
Hipotesis
Berdasarkan atas latar belakang dan permasalahan yang diajukan di atas, maka disusun suatu hipotesis sebagai berikut :
1 Ayam mampu memproduksi IgY spesifik terhadap toksin tetanus yang tersimpan pada telur,
2 IgY yang terbentuk mempunyai daya tahan terhadap pengaruh suhu, pH, dan enzim pencernaan,
viii DAFTAR ISI
Halaman
DAFTAR TABEL ... x DAFTAR GAMBAR ... xi DAFTAR LAMPIRAN ... xiii PENDAHULUAN ... 1
ix Uji Imunodifusi ... 40
Sodium Dodecyl Sulphate Polyacrylamide Gel
Electrophoresis ... 41 Teknik ELISA ... 42 Aktivitas Biologis IgY... ... 43 Uji Aktivitas IgY Setelah Perlakuan pH ... ... 43 Uji Aktivitas IgY Setelah Perlakuan Suhu ... 43 Uji Aktivitas IgY Setelah Perlakuan Enzim Pepsin, Tripsin, dan Protease ... 44 Uji Potensi IgY ... 44 Uji Tantang pada Hewan Coba ... 45 HASIL DAN PEMBAHASAN ... 47 Produksi IgY antitetanus pada Telur Ayam ... 47 Ekstraksi, Purifikasi dan Karakterisasi IgY Antitetanus dari
Kuning Telur ... 52 Aktivitas Biologis IgY antitetanus ... 59 Titrasi Toksoid, Sampel IgY Ayam, dan Konjugate Enzim .... 59 Aktivitas IgY Antitetanus Setelah Perlakuan pH ... 59 Aktivitas IgY Antitetanus Setelah Perlakuan Suhu ... 62 Aktivitas IgY Antitetanus Setelah Perlakuan Enzim Pepsin,
Tripsin, dan Protease ... 67 Hasil SDS-PAGE IgY Antitetanus Setelah Perlakuan Fisik dan
x
DAFTAR TABEL
Halaman 1. Karakter imunoglobulin itik ... 12 2. Kelebihan IgY dibandingkan dengan IgG mamalia ... 16 3. Hasil uji AGP IgY antitetanus pada serum dan telur ayam ... 47 4. Hasil pengukuran titer IgY antitetanus (IU/ml) ... 51 5. Konsentrasi protein hasil ekstraksi dan purifikasi IgY antitetanus ... 54 6. Uji potensi IgY antitetanus ... 71
7. Protective dose-50 ATS standar ……… 71
8. Protective dose-50 ATS uji ……… 71
9. Persentase mencit yang bertahan hidup pada setiap
kelompok perlakuan ... 73 10. Persentase mencit yang hidup setelah diberi IgY antitetanus
xi
DAFTAR GAMBAR
Halaman 1 Perbedaan struktur IgY dan IgG. ... 12 2 Fragmen Hc toksin tetanus ... 25 3 Proses perlekatan toksin bakteri pada sel ... 27 4 Interaksi ganggliosida pada dua permukaan binding site fragmen Hc... 28 5 Patogenesis penyakit tetanus ... 31 6 Proses penghambatan toksin tetanus terhadap reseptor transmiter
inhibitor ... 32 7. Rataan konsentrasi IgY antitetanus pada serum dan telur ... 48 8. Hasil uji imunodifusi IgY antitetanus Ayam ... 48 9. Penambahan kloroform pada laruta n kuning telur. B. Pemisahan
supernatan yang mengandung IgY antitetanus dari lemak telur yang telah mengendap ...
52 10
.
A. Penambahan PEG 6000 pada supernatan. B. Pemisahan pelet dari
supernatan setelah disentrifuse ... 53 11
.
Profil pita protein dari IgY antitetanus hasil ekstraksi dengan metode
PEG – kloroform ... 55 12 Kromatogram hasil FPLC IgY antitetanus ... 56 13 Hasil uji agar gel presipitasi IgY antitetanus setelah pemurnian dengan
FPLC. ... ... 57 14 Hasil SDS-PAGE IgY antitetanus setelah pemurnian FPLC. ... 58 15 Pola aktifitas IgY antitetanus setelah perlakuan pH ... 60 16 Penurunan aktivitas IgY antitetanus setelah perlakuan pH ... 61 17 Pola aktifitas IgY antitetanus setelah perlakuan suhu ... 62 18 Penurunan aktivitas IgY antitetanus setelah perlakuan suhu dengan
waktu inkubasi berbeda ... 63 19 Penambahan larutan sukrosa pada larutan IgY antitetanus ... 64 20 Penambahan larutan glukosa ke dalam larutan IgY antitetanus ... 65 21 Pola aktifitas IgY antitetanus setelah perlakuan enzim pepsin, tripsin,
xiii
DAFTAR LAMPIRAN
Halaman 1. Reagensia untuk Fast Protein Liquid Chromatography (FPLC) ... 99 2. Reagensia untuk ELISA ... 100 3. Perhitungan berat molekul protein ... 101 4. Prosedur pengenceran serum antitetanus standar dan toksin
tetanus ...
PENDAHULUAN
Latar Belakang
Kejadian penyakit tetanus dilaporkan masih tetap tinggi, setiap tahun dilaporkan terjadi 350 000 sampai 400 000 kasus tetanus di seluruh dunia. Kejadian kasus lebih tinggi di negara berkembang terutama negara yang program imunisasinya tidak teratur dan tingkat kesadaran masyarakat tentang kesehatan rendah (Bruggemann et al. 2003; Kiefer 2004). Pada negara industri dilaporkan kasus tetanus terjadi secara sporadik. Penyakit tetanus dilaporkan bersifat endemis pada 90 negara berkembang (Bruggemann et al. 2003).
Strategi pencegahan penyakit tetanus dengan meningkatkan kebersihan dan imunisasi. Imunisasi dapat dilakukan secara aktif dengan toksoid tetanus dan pasif dengan antitetanus serum. Pada daerah yang beresiko tinggi, imunisasi aktif minimal dilakukan sebanyak tiga kali (Vandelaer et al. 2003). Antibodi yang terbentuk akan berikatan dan menginaktivasi toksin sebelum toksin itu menyerang otot dan saraf. Clostridium tetani dapat dibunuh dengan antibiotik penicilin, tetapi antibiotik tidak mampu menetralisasi toksin (Kiefer 2004). Pencegahan dengan antitetanus serum dan pengobatan dengan antibiotik merupakan pendekatan yang masih relevan untuk mengurangi penyakit tetanus (Covarelli dan Marconi 1980; Bleck 1991; Forrat et al. 1998; Bruggemann et al. 2003).
Pencegahan tetanus difokuskan pada imunisasi awal. Imunisasi diulang setiap 10 tahun atau pada saat berumur 40 sampai 50 tahun untuk menghindari terinfeksi tetanus saat umur tua (Schatz et al. 1998; Cavuslu et al. 2003). Maral et al. (2001) melaporkan kejadian tetanus menyerang lebih dari satu juta orang di seluruh dunia, dengan 80% kejadian terjadi pada masa neonatal.
2 Kekhawatiran akan kejadian tetanus sampai saat ini pada manusia masih mendapat perhatian yang serius, khususnya aplikasi antitetanus ser um (ATS) tetap dilakukan pada saat terjadi perlukaan. Hal yang sama juga terjadi pada kesehatan hewan, terutama pada kawasan kebun binatang atau kawasan wisata dengan obyek binatang. Penggunaan kandang yang sempit, daya dukung kawasan yang terbatas akan mempermudah kejadian luka, seperti halnya pada daerah kawasan wisata monkey forest Ubud Bali yang dihuni oleh monyet ekor panjang, kejadian luka berkisar sampai 10%. Tipe luka yang banyak diderita adalah kulit robek, luka tusuk, dan kulit robek sampai otot rusak. Kondisi luka ini akan mempermudah kejadian tetanus terutama luka yang terjadi di daerah badan yang sulit dibersihkan. Kesembuhan luka yang diderita oleh monyet itu berkisar antara satu minggu sampai 3 minggu (Suartha et al. 2002). Waktu itu merupakan periode masa inkubasi dari kuman tetanus (Lewis 1998). Hal yang sama juga sangat rentan dialami oleh praktisi kesehatan hewan di lapangan, terutama yang bertugas di wilayah terpencil. Seorang praktisi kesehatan hewan dilaporkan tewas akibat tetanus sete lah terinjak sapi, begitu juga halnya di daerah bekas bencana (Soeharsono 2005).
Produksi ATS saat ini umumnya dilakukan pada kuda, yakni dengan menyuntikkan toksoid tetanus pada kuda yang terpilih. Masalah sering muncul karena penggunaan serum spesifik sering menyebabkan reaksi silang seperti reaksi anafilaktik atau serum sickness. Hal itu telah mendorong penggunaan imunoglobulin antitetanus dari sumber lain seperti serum manusia, tetapi kesulitan menyedia kan donor (Forrat et al. 1998). Penggunaan telur (Imunoglobulin Y) diharapkan dapat mengurangi resiko itu dan digunakan sebagai sumber antitetanus .
3 menggunakan imunoglobulin dari mamalia seperti kelinci, tikus, quinea pig, dan hewan mamalia besar seperti kuda, kambing, domba, dan sapi (Svendsen et al.
1995).
Beberapa peneliti melaporkan keuntungan penggunaan telur sebagai pabrik bahan biologi adalah : kandungan IgY tinggi dalam telur, mudah diproduksi dalam jumlah besar, tidak menimbulkan efek samping karena tidak bereaksi silang dengan faktor rheumatoid dan komponen jaringan mamalia, tidak bereaksi dengan reseptor Fc yang dimiliki oleh mikrob sehingga bereaksi lebih spesifik terhadap antigen yang dikehendaki, memiliki aktivitas dan daya netralisasi lebih tinggi dibandingkan IgG mamalia, biaya produksi secara masal lebih murah dibandingkan menggunakan mamalia, dan dari segi Animal welfare
lebih dapat diterima dibandingkan dengan menggunakan mamalia (Davis dan Reeves 2002).
Pemanfaatan IgY untuk pengobatan dan pencegahan penyakit masih sedikit dan terbatas pada skala laboratorium. Perkembangan dan penelitian ke arah pemanfaatan telur unggas baru berkembang dalam satu setengah dekade terakhir. Antibodi spesifik di dalam kuning telur dapat ditimbulkan dari berbagai macam patogen. Kermani-Arab e t al. (2001) melaporkan IgY spesifik terhadap penyakit Marek yang diaplikasi secara pasif mampu menahan infeksi virus Marek. Efek yang sama diamati terhadap berbagai penyakit misalnya influenza (Bogoyavlensky et al. 1999), EPEC K11 (Rawendra 2005) , Salmonella enteridis
dan typhimurium (Lee et al. 2002; Babu et al. 2003) , Helicobacter pylori (Shin
et al. 2002; Shin et al. 2004).
IgY juga digunakan untuk deteksi antigen pe rmukaan penderita hepatitis B (Makvandi dan Fiuzi 2002), caries gigi (Hamada et al.1991), pembentukan
plaque gigi karena Streptokokus mutans (Hatta et al. 1997), diare pada pedet (Erhard et al. 1997), deteksi kanker (Yang et al. 1997; Fortgens et al. 1997; Sasse et al. 1998; Sriram et al. 1999), Virus horsesickness (Plessis et al. 1999) , Bovine coronavirus (Ikemori et al. 1997) , dan deteksi insulin (Song et al. 1985).
Teknologi IgY sangat baik digunakan untuk produksi antibodi dari antigen
4
al.1997; Losonczy et al.1999; Coillie et al. 2004; Ester 2004), dan diagnostik yang lain (Katz et al.1985). Pemberian secara oral sebagai food suplemen untuk pencegahan kuman (Shimizu et al. 1988; Yokohama et al. 1998; Carlander et al.
2000; Hedlund dan Hau 2001, Sunwoo et al. 2002). IgY dapat di absor psi dan ditransfer secara efisien sebagai antibodi kolustrum (Yokohama et al. 1993).
Adanya IgY dalam telur memberikan prospek untuk pemberian kekebalan pasif pada kasus penya kit (Polson et al. 1980). Prinsip pengebalan adalah pasif, artinya transfer kekebalan terhadap beberapa penyakit dilakukan dengan mengkonsumsi telur yang mengandung zat kebal dan dipreparasi secara khusus. IgY unggas mengenal lebih banyak epitop protein mamalia dibandingkan dengan imunoglobulin kelinci, sehingga cocok untuk percobaan imunologi protein mamalia (Schade et al.1996). IgY unggas dapat diproduksi apabila antigen dalam jumlah sedikit atau memerlukan pengawetan tinggi seperti hormon. Dalam pemerik saan imunologi, IgY memberikan hasil lebih akurat karena dapat mengurangi ikatan dengan antigen non spesifik, yang menyebabkan hasil negatif palsu atau positif palsu (Schade et al. 1996; Warr dan Higgins 1995).
Laporan penelitian di atas memberikan inspirasi untuk mempelajari karakteristik dan efikasi atau daya netralisasi IgY spesifik terhadap toksin tetanus. Sampai saat ini keperluan akan antitetanus serum (ATS) untuk pencegahan infeksi tetanus, khususnya pada kasus perlukaan masih sangat dibutuhkan.
Pe rumusan masalah
5 Hal ini menyebabkan penderitaan kronis pada kuda. Endapan amiloid sering dijumpai pada organ limpa, limfoglandula dan organ limfoid lainnya. Produksi ATS pada kuda sangat mahal.
Adanya masalah-masalah di atas maka terpikirkan untuk memproduksi ATS pada telur ayam. Hal ini sangat mungkin dilakukan karena antibodi dalam darah induk ayam dapat ditransfer ke dalam telur dalam jumlah yang cukup banyak. Schade et al. (1996) melaporkan imunisasi pada ayam menghasilkan konsentrasi antibodi spesifik yang sama antara serum da n kuning telur. Konsentrasi IgY pada kuning telur konstan sampai oosit matang (maturasi), dengan kandungan 10 sampai 20 mg/ml (Carlander 2002). Biaya produksi imunoglobulin pada telur unggas sangat murah (Warr dan Higgins 1995; Makvandi da n Fiuzi 2002)
Penggunaan ayam untuk produksi antibodi menghilangkan dan mengurangi penggunaan mamalia sebagai hewan laboratorium. Menghilangkan yang di maksud adalah menghilangkan langkah yang menyakitkan saat koleksi darah, yang digantikan dengan ekstraksi antibodi dari kuning telur. Pengurangan yang di maksud adalah mengurangi jumlah hewan yang digunakan, sebab ayam menghasilkan antibodi yang lebih efisien dibandingkan hewan mamalia seperti kelinci maupun mamalia besar lainnya (Karlsson et al. 2004). Berkenaan dengan
animal welfare dan efisiensi biaya, penggunaan antibodi dalam telur lebih bisa diterima dibandingkan dengan penggunakan hewan percobaan mamalia (Svendsen
et al. 1995).
Tujuan Penelitian
Tujuan penelitian ini adalah mengetahui sifat karakteristik IgY spesifik terhadap toksin tetanus yang diisolasi dari telur, untuk menggantikan produksi antitetanus serum pada kuda.
Manfaat Penelitian
6 produksinya lebih murah, aman, mudah, dan kualitas yang lebih baik daripada ATS konvensional yang diproduksi dari kuda.
Hipotesis
Berdasarkan atas latar belakang dan permasalahan yang diajukan di atas, maka disusun suatu hipotesis sebagai berikut :
1 Ayam mampu memproduksi IgY spesifik terhadap toksin tetanus yang tersimpan pada telur,
2 IgY yang terbentuk mempunyai daya tahan terhadap pengaruh suhu, pH, dan enzim pencernaan,
TINJAUAN PUSTAKA
Sistem Imun
Sistem imun dimiliki oleh semua spesies, digunakan untuk mempertahankan diri melawan benda asing yang masuk ke dalam tubuh. Keberadaan protein asing dan patogen dimonitor secara rutin oleh tubuh melalui pelepasan imunoglobulin. Sistem kekebalan akan mampu mengenali spesifik zat kimia yang membedakan sebuah patogen asing dari yang lainnya, serta mampu mengenali molekul asing dengan sel-sel tubuh beserta protein -proteinnya (Kuby 1997). Antibodi mampu mengenali dan berikatan dengan antigen spesifik sampai ribuan atau jutaan antigen. Interaksi antigen-antibodi merupakan interaksi biologi yang sangat spesifik. Sifat khusus itu yang dimanfaatkan dalam teknik imunologi (Abbas et al. 1997).
Pertahanan tubuh melawan infeksi dapat diba gi atas dua yaitu : kekebalan alamiah (non spesifik) dan kekebalan spesifik (adaptive). Kekebalan non spesifik meliputi empat tipe pertahanan yaitu : pertahanan secara anatomi, fisiologi, fagositik, dan peradangan. Pertahanan secara anatomi merupakan pertahanan tubuh yang pertama mencegah masuknya mikrob patogen ke dalam tubuh. Pertahanan secara anatomi terdiri atas barier fisik kulit, selaput lendir, silia, proses batuk, dan bersin. Barier fisik berperan mencegah penetrasi patogen ke dalam tubuh dengan cara melisiskan dan menghambat kolonisasi kuman. Sebagian besar bakteri gagal untuk hidup lebih lama pada kulit karena pengaruh hambatan langsung dari asam laktat dan asam lemak yang disekresikan kelenjar keringat dan sekresi glandula sebaseus (Roitt 1988) .
8 Respon imun spesifik terbentuk dari kemampuan tubuh menghasilkan respon yang spesifik untuk melawan patogen yang masuk ke dalam tubuh. Secara klasik respon imun spesifik dikelompokkan menjadi kekebalan humoral dan kekebalan berperantara sel (Roitt 1988). Dua tipe sel yang berperan secara aktif yaitu makrofag dan limfosit. Makrofag menguraikan antigen untuk disajikan pada sistem imum, dan limfosit mengenali fragmen antigen yang disajikan untuk produksi antibodi (Halliwell dan Gorman 1989). Imunitas spesifik selama merespon substansia asing juga membentuk sel memori sehingga mudah mengenali antigen jika terjadi paparan yang berulang (Roitt 1988).
Respon humoral meliputi interaksi sel B (sel plasma) dengan antigen dan selanjutnya proliferasi dan diferensiasi membentuk antibodi dengan atau tanpa bantuan sel T. Limfosit B mengekspresikan imunoglobulin permukaan yang spesifik terhadap epitop dari antigen, dan limfosit T mengenali antigen yang telah diproses pada sel presenting antigen. Antibodi yang disekresikan oleh sel plasma menghasilkan antibodi soluble (terlarut). Respon imun selular meliputi interaksi reseptor sel T dan antigen yang telah diproses. Respon itu melalui dua jalur. Pertama , interaksi sel T dengan antigen dan sekresi limfokin untuk menarik makrofag yang akan memfagositosis antigen. Kedua, interaksi sel T sitotoksik dengan antigen yang dipresentasikan oleh MHC II yang akan menyebabkan lisis sel (Roitt 1988).
Berdasarkan proses terbentuknya kekebalan dalam tubuh, kekebalan dibedakan atas dua tipe, yaitu kekebalan aktif dan kekebalan pasif. Pada proses imunisasi aktif tubuh akan memproduksi antibodi dan memberi kekebalan yang lama. Pada imunisasi pasif antibodi terbentuk segera tetapi memberikan perlindungan dalam waktu singkat (Abbas et al. 1997).
9 optimal memproduksi antibodi, dibandingkan dengan mamalia yang hanya memproduksi kolustrum saat partus (Da vis and Reeves 2002). Produk imun itu memberikan perlindungan secara alami terhadap infeksi selama perkembangan sistem imun anak belum berfungsi optimal (Anonim 2002).
Imunoglobulin
Imunoglobulin atau antibodi adalah kelompok protein yang mempunyai kema mpuan berikatan secara spesifik pada antigen dan mengeluarkan antigen itu dari tubuh. Antibodi adalah molekul protein yang dihasilkan oleh sel plasma sebagai akibat interaksi antara limfosit B peka antigen dengan antigen khusus (Kuby 1997). Struktur dasar dari antibodi tersusun atas empat rantai polipeptida yaitu dua rantai berat dan dua rantai ringan yang identik (Male et al. 1987).
Rantai berat (H) dan rantai ringan (L) disatukan oleh ikatan kovalen disulfida. Posisi ikatan sulfida bervariasi tergantung dari kelas dan subkelas antibodi. Setiap molekul antibodi terbagi atas bagian yang dapat berubah (variable) dan bagian yang tetap (konstan). Bagian variable merupakan tempat pertautan antigen, sedangkan bagian konstan tempat sifat biologi antibodi. Bagian variabel dihubungkan dengan bagian konstan oleh bagian engsel. Pada bagian variabel terdapat bagian hipervariabel untuk mengenali berbagai variasi antigen. Bagian variabel dan konstan terdapat pada rantai berat dan rantai ringan antibodi (Kuby 1997).
10
fabricius, bone marrow, limpa, timus, glandula harderian, limponodus, limfosit yang bersirkulasi, dan jaringan limfoid pada saluran cerna (Shimizu et al. 1992; Hatta et al. 1993; Sharma 1997).
Imunoglobulin Y
Terminologi (istilah) IgY telah diperkenalkan sejak tahun 1969 dalam literatur yang diistilahkan dengan 7-S Ig terutama yang terdapat di serum, tetapi juga ditemukan dalam isi duodenum, bilasan trakea, dan plas ma seminal (Hadge dan Ambrosius 1984). Imunoglobulin Y telah diisolasi dari unggas (kalkun, ayam, itik, angsa) , ampibi, reptil (Hadge 1985), dan kura-kura darat (Hadge dan Ambrosius 1986). Pada awalnya, beberapa peneliti menduga bahwa IgY yang dihasilkan bangsa unggas sama dengan IgG mamalia, sedangkan kenyataannya berbeda (Szabo et al. 1998).
Transpor IgY dari serum induk ke anak meliputi dua proses. Pertama , IgY ditransfer melewati epitel folikular dari ovari dan berakumulasi dalam kuning telur selama masa oogenesis, yang mirip dengan proses transfer IgG melalui plasenta pada mamalia. Kedua, pemindahan IgY dari kuning telur ke embrio yang sedang berkembang. Isotipe antibodi yang lain seperti IgA dan IgM ditransfer dalam jumlah terbatas ke putih telur (Sharma 1997). Konsentrasi IgY dalam kuning telur konstan sampai oosit matang. IgY tidak terdapat dalam putih telur, sedangkan IgA dan IgM hanya terdapat dalam putih telur. Tidak terjadi seleksi atau destruksi IgY selama proses transfer itu (Davis and Reeves 2002). IgY dalam kuning telur dipersiapkan untuk memberikan kekebalan pasif pada anak ayam. Kuning telur mengandung 8 sampai 20 mg IgY per ml atau 136 sampai 340 mg per kuning telur. Dalam setahun dapat diisolasi 30 g sampai 40 g IgY (Shimizu et al. 1992), sedangkan pada mamalia hanya 1.3 g (Davis and Reeves 2002). Hal itu menyebabkan ayam sebagai sumber IgY mendapat perhatian serius (Shimizu et al. 1992). Penelitian dan penggunaan Ig dari ayam, terutama IgY untuk terapi, pencegahan, dan diagnostik dalam satu setengah dekade terakhir berkembang dengan pesat.
11 antigen yang diberikan (protein, bakteri, virus dan parasit) (Hatta et al. 1993). Sedangkan berat molekul, morfologi, dan mobilitas imunoelektroforetik dari IgA dan IgM ayam mirip dengan IgA dan IgM mamalia (Davis and Reeves 2002). IgY tidak bereaksi silang dengan komponen struktural jaringan mamalia (Larsson et al. 1993). Hal ini me mberikan indikasi penggunaan IgY dalam diagnostik imunologis akan menghasilkan reaksi yang lebih spesifik. Hassl et al. (1987) melaporkan spesifisitas antibodi serum IgY ayam yang di imunisasi dengan antigen toxoplasma gondii lebih tinggi dibandingkan dengan serum antibodi IgG kelinci. Lebih lanjut, antibodi spesifik (IgY) yang ada dalam darah induk ayam, secara baik dapat ditransfer ke dalam telur. Titer IgY dalam darah dan dalam telur tidak berbeda secara signifikan (Larsson et al. 1993), dan tidak ada perbedaan kandungan IgY pada dua spesies ayam berbeda (Li et al. 1998). Sehingga telur dapat digunakan sebagai sumber protein hewani dan sebagai pabrik produksi antibodi (Regenmortel 1993; Losch et al. 1986).
12
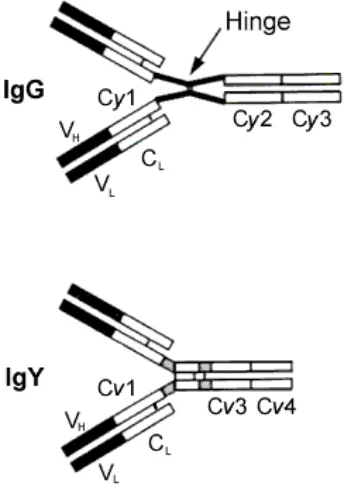
Gambar 1 Perbedaan struktur IgY dan IgG (Sumber. Schade et al. 1996).
Pada itik dilaporkan memiliki tiga tipe imunoglobulin serum yaitu IgM dan dua bentuk mirip (isoform) IgY yaitu IgY utuh dan IgY terpotong. IgY utuh memiliki berat molekul 200 kDa dengan koefisien sidementasi 7.8 S dan IgY terpotong memiliki berat molekul 130 kDa dengan koefisien sidementasi 5.7 S. IgY terpotong kehilangan dua domain terminal pada regio konstan dari rantai berat yaitu domain 3 dan 4 (Warr dan Higgins 1995).
Tabel 1 Karakter imunoglobulin itik
Berat Molekul Jenis imuno
globulin
Koefisien
sidementasi Molekul utuh
(kDa)
Rantai Berat (kDa)
Rantai Ringan (kDa)
Ig M 800 –900 86 23 – 25
Ig Y utuh 7.8 S 178 – 200 62 – 67 22 – 25
Ig Y terpotong 5.7 S 118 - 130 35 – 42 22 – 25
Dikutip dari :Warr dan Higgins, (1995)
13
al. 1994). Struktur dan antigenitas 5.7S IgY mirip dengan fragmen F(ab’)2 dari 7.8S IgY (Warr dan Higgins 1995). Itik membentuk dalam jumlah besar IgY()Fc). Bentuk ini cacat karena kehilangan dua domain C-terminal pada rantai H (υ). Struktur abnormal dari IgY()Fc) menyebabkan penurunan fungsi biologis Ig seperti aglutinasi, presipitasi, fiksasi komplemen, opsonisasi (Chan et al. 1999; Lundqvist et al. 2001), walaupun level serum dari boster meningkat (Warr dan Higgins 1995). Faktor lain yang berpengaruh yaitu pembentukan sterik dari lengan Fab (berfungsi monovalensi), regio engsel (hinge) yang kaku, keragaman yang sempit atau terbatas, kegagalan dalam pematangan ikatan antigen pada antibodi (Magor et al. 1994). Respon imun mukosa dependen-IgA itik perkembangannya terlambat selama penetasan dibandingkan dengan ayam (Lundqvist et al. 2001). Pada itik IgA mulai dideteksi pada umur 14 hari setelah menetas dan berfungsi optimal setelah umur 35 hari, sedangkan pada ayam telah berfungsi optimal pada umur 5 hari setelah menetas (Magor et al. 1998; Chan et al. 1999).
Berbagai metode ekstraksi dan purifikasi telah dilaporkan oleh beberapa ahli. Ekstraksi IgY me lalui water dilusi (pelarutan dalam air) kuning telur (Akita dan Nakai 1992); presipitasi lemak dengan dektran sulfat yang mengandung CaCl2 (Szabo et al. 1998). Hasil ekstraksi dilakukan purifikasi dengan
kromatografi menggunakan ion exchange (DEAE-Sephacel) dan filtrasi gel (Szabo et al.1998), mencampur serum dengan asam caprylat, diendapkan dengan amonium sulfat dan didialisis dengan PBS. Teknik ini sangat cepat, murah, sederhana dibandingkan dengan menggunakan metode ion exchange atau gel filtrasi kromatografi (Bhanushali et al. 1994). Purifikasi IgY dari telur dengan
thiophilic interaction chromatography merupakan prosedur purifikasi untuk homogenitas IgY dalam langkah kromatogra fi tunggal setelah fraksinasi amonium sulfat. Recoveri dengan prosedur ini mampu sampai 100% (Hansen et al. 1998).
Metode pelarutan dalam air dilakukan untuk memisahkan plasma protein terlarut dari granul kuning telur. IgY aktif dengan tingkat kemurnian yang tinggi didapat dari kombinasi beberapa teknik seperti presipitasi garam, filtrasi gel dan
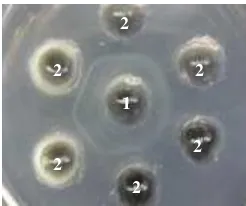
14 lain untuk isolasi adalah metode dua langkah purifikasi yaitu presipitasi dengan PEG diikuti de ngan perlakuan alkohol. Uji spesifisitas dilakukan dengan cara hemaglutinasi indirek, uji imunodifusi, dan imunoelektroporesis (Hassl et al. 1987). Jumlah Ig spesifik yang terdapat dalam telur dari ayam yang diimunisasi adalah 1% dari total IgY (Hansen et al. 1998).
Keuntungan Penggunaan Imunoglobulin Y
Sistem imun ayam dilaporkan telah dipelajari lebih dari satu abad yang lalu, di awali dengan pengamatan pada ayam yang diimunisasi menunjukkan adanya transfer imunoglobulin dari serum ke kuning telur (Ca menisch et al. 1999). Transfer ini diperlukan embrio aves dan anak untuk melawan berbagai penyakit. Penelitian pada sistem imun ayam berkontribusi secara substansial untuk memahami konsep mendasar dari imunologi dan perkembangan kelas Ig yang berbeda. Perkembangan penelitian pada imunoglobulin unggas terutama ayam juga di dukung oleh perkembangan ilmu pengetahuan dan semakin tingginya kesadaran akan animal welfare. Perkembangan penelitian itu melaporkan ayam sebagai alternatif terbaik untuk produksi antibodi poliklonal (Akita dan Nakai 1992; Shimizu et al.1992; Hatta et al. 1993; Schade dan Hlinak 1996; Camenisch et al. 1999).
Penggunaan ayam sebagai sumber imunoglobulin mempunyai beberapa keuntungan antara lain : pemeliharaan ayam tidak mahal, koleksi te lur tida k invasif, isolasi dan afinitas purifikasi IgY cepat dan sederhana, aplikasi IgY sangat luas (Camenisch et al. 1999) . Ekstraksi IgY dari telur lebih menguntungkan dibandingkan dengan ekstraksi Ig mamalia. Keuntungan yang nyata adalah : lebih mudah mengkoleksi telur dari ayam dibandingkan koleksi serum dari mamalia, ketika mengambil darah dari mamalia memerlukan keahlian khusus sedangkan telur dapat dikoleksi oleh tenaga yang tidak dilatih secara khusus, harga pakan dan kandang ayam lebih murah diba ndingkan dengan hewan laboratorium (Camenisch
15 tidak mengalami cekaman meskipun dalam periode bertelur. Sehingga penggunaan ayam menjadi metode alternatif untuk mengurangi penderitaan hewan. Jumlah hewan yang diperlukan untuk produksi antibodi lebih sedikit, karena ayam mampu memproduksi antibodi lebih tinggi dibandingkan kelinci (Gross dan Speck 1996).
Antibodi ayam memiliki lebih banyak epitop terhadap antigen mamalia (Carlander et al. 1999) , dapat digunakan untuk menghindari kesalahan
immunoassay akibat sistem komplemen (Fryer et al. 1999), faktor rheumatoid, dan reseptor Fc bakteri (Carlander et al. 1999). Pada pengukuran High-sensitivity C-reaktive protein (hs-CRP) yang merupakan salah satu marker untuk pengukuran resiko jantung, penggunaan antibodi mamalia seperti kelinci, tikus, dan kambing memberikan hasil kurang memuaskan, hal ini akibat faktor rheumatoid dalam sampel meyebabkan reaksi positif palsu. Permasalaha n itu dapat ditanggulangi dengan penggunaan IgY (Tsen et al. 2003).
Perbedaan jarak pilogenetik antara mamalia dan avian menyebabkan protein mamalia yang conserved (sulit isolasi juga unik) lebih imunogenik pada ayam dibandingkan dengan mamalia dan respon antibodi spesifik yang dihasilkan sangat tinggi (Akita dan Nakai 1992; Lee et al. 1997; Halper et al. 1999; Orsini et al. 2001). Sehingga ayam sebagai pilihan terbaik untuk produksi antibodi dibandingkan dengan mamalia jika antigen berasal dari manusia atau mamalia.
Isolasi dan metode purifikasi IgY sederhana dan mudah (Gassmann, 2002). Kuning telur mengandung lemak yang tinggi (lipoprotein, granul phospitin yang bercampur dengan livetin dan low density lipoprotein), yang bermasalah jika digunakan secara langsung (Makvandhi dan Fiuzi 2002). IgY yang telah dimurnikan dapat bertahan satu tahun pada suhu 4 oC dengan ditambahkan anti pertumbuhan bakteri seperti Na-azide. Pada suhu kamar stabil selama sebulan. Untuk freeze antibodi hendaknya dibuat aliquot dan hindari freeze dan thawing.
Freeze dan thawing lebih merusak antibodi dibandingkan disimpan pada suhu 4
oC selama satu minggu atau sebulan (Polson 1990) .
16 Beberapa dari metode itu telah dimodifikasi untuk menyesuaikan dengan sifat antibodi ayam. Hasil penelitian menunjukkan IgY ayam mampu menggantikan IgG yang dihasilkan dengan metode tradisional dari mamalia. Penggunaan IgY sangat memperhatikan keamanan hewan, produktivitas tetap tinggi, dan kekhususan tertentu yang dimiliki IgY untuk tujuan diagnosis (Gross dan Speck 1996), dan modifikasi diagnostik (Higgins et al.1995; Doellgast et al. 1997; Kummer dan Li-Chan 1998; Kim et al. 1999). Penggunaan IgY pada uji ELISA tidak berkompetitor dibandingkan dengan menggunakan antibodi mamalia (Benkirane et al. 1998). Aplikasi potensial penggunaan IgY terus meningkat untuk pencegahan penyakit, agen diagnostik dan biologis, suplemen pakan, dan pemberian secara oral untuk propilaksis (Akita dan Nakai 1992).
Tabel 2 Kelebihan IgY dibandingkan dengan IgG mamalia
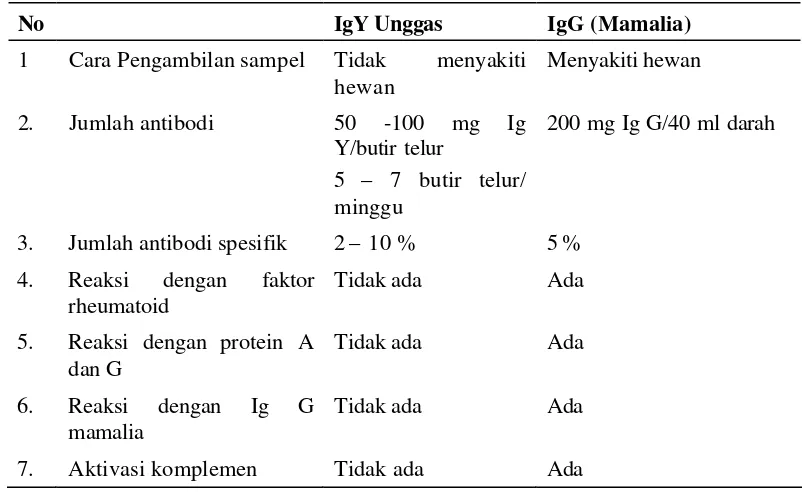
No IgY Unggas IgG (Mamalia)
1 Cara Pengambilan sampel Tidak menyakiti hewan 4. Reaksi dengan faktor
rheumatoid
17 kelinci (Schade dan Hlinak 1996). Secara ringkas beberapa kelebihan lain dari IgY dibandingkan dengan IgG mamalia dipaparkan pada Tabel 2.
Penggunaan Teknologi IgY
Teknologi IgY telah digunakan untuk berbagai hal sehubungan dengan imunoterapi dan imunodiagnostik (Sugita-Konishi et al. 1996). Telur (IgY) ayam sebagai makanan mempunyai peran ganda yaitu peran fungsional dan
neutraceutical. Secara fungsional sebagai sumber protein, dan secara
neutraceutical mampu meningkatkan fungsi imun. Peningkatan kekebalan dengan pemberian secara oral Ig telah dilakukan oleh sejumlah peneliti. Pemberian IgY dilakukan melalui produk makanan, terutama untuk formula anak-anak, karena anak-anak merupakan kelompok rentan terhadap penularan patogen melalui makanan (Akita dan Nakai 1992; Makoto et al. 1998). Dilaporkan `pencegahan E coli pada pedet sapi dengan pemberian kolustrum dicampur IgY, pencegaha n rotavirus berhasil dengan baik pada mencit, serta pencegahan diare perjalanan (wisata) (Davis dan Reeves 2002).
Penggunaan IgG mamalia untuk diagnostik pada uji ELISA sering menghasilkan reaksi positif palsu. Hal itu akibat reaksi silang dari IgG suatu spesies dengan spesies lain. Masalah itu dapat ditanggulangi dengan pemakaian IgY ayam. Davis dan Reeves (2002) melaporkan IgY tidak bereaksi silang pada pemeriksaan laktoferin dan proteoglikan manusia dan sapi pada uji ELISA. Spesifitas IgY dari ayam dapat dimanfaatkan sebagai reagen standar untuk alat diagnostik dan mampu meningkatkan akurasi dalam penelitia n.
18 Stabilitas IgY
Pengetahuan terhadap stabilitas molekul IgY sangat penting, jika IgY digunakan sebagai reagen dalam berbagai kondisi. Stabilitas dari molekul IgY dapat dipengaruhi oleh berbagai perubahan fisik maupun kimia seperti suhu, asam, dan enzim pencernaan. Stabilitas IgY menjadi sangat penting jika dipakai untuk terapi imunisasi pasif yang diberikan secara oral. Aplikasi yang praktis pemberian suatu antibodi pasif dilakukan dengan mencampur antibodi dengan makanan atau material farmaceutikal, sehingga pertimbangan stabilitas antibodi terhadap panas, pH atau enzim digesti harus diketahui dengan baik (Hatta et al. 1993).
Valensi dari IgY adalah dua, sama dengan antibodi mamalia. Regio engsel pada IgY tidak ada menyebabkan IgY kurang fleksibel. Mobilitas yang terbatas akibat kakunya regio engsel berpengaruh terhadap kemampuan antibodi dalam presipitasi atau aglutinasi antigen. Stabilitas IgY dibawah kondisi asam dan digesti pepsin lebih rendah dibandingkan dengan IgG sapi. Tetapi IgY lebih stabil terhadap digesti enzim protease internal seperti tripsin dan kemotripsin, dan terlihat ada subpopulasi IgY tahan terhadap digesti papain (Hatta et al. 1993).
Para peneliti melaporkan, stabilitas IgG kelinci terhadap panas dan asam lebih tinggi dibandingkan dengan IgY. Bentuk dari molekul IgY sering berubah karena pengaruh asam, yang berakibat penurunan aktivitas antibodi (Shimizu et al. 1992). Stabilitas IgY anti HRV pada temperatur di atas 70 oC dan pH 2 sampai 3 lebih rendah diba ndingkan dengan IgG anti HRV kelinci. Temperatur maksimum untuk denaturasi IgG kelinci adalah 77 oC (Hatta et al. 1993). Aktivitas IgY pada kuning telur dan ekstrak kasar menurun dengan meningkatnya suhu dari 70 oC sampai 80 oC, tetapi denaturasi panas antara kedua sampel tidak berbeda. (Chang et al. 1999).
19 Digesti pepsin sangat cocok untuk preparasi dan purifikasi Fab. Isolasi Fab optimum didapat setelah digesti pepsin terhadap IgY pada pH 4 selama 9 jam dalam konsentrasi NaCl rendah. Kondisi itu mendigesti secara lengkap fragmen Fc antibodi dan hanya menyisakan fragmen Fab (Akita dan Nakai 1993a). Liofilisasi kuning telur dengan 5% gum arabic serbuk sangat baik untuk menjaga stabilitas terhadap protease (Chang et al. 1999).
Tetanus
Tetanus adalah salah satu penyakit yang lazim terjadi pada manusia dan hewan vertebrata. Tetanus telah dikenal oleh manusia sejak sejarah kesehatan mulai dikenal, tetapi sampai saat ini masih merupakan masalah besar pada kesehatan masyarakat di beberapa negara berkembang, terutama pada negara miskin dengan kondisi kesehatan buruk, beriklim panas dan lembab (Bizzini 1993).
Agen penyebab tetanus adalah Clostridium tetani, tumbuh dalam kondisi anaerob, spora berbentuk batang (Kiefer 2004) , di bawah mikroskop terlihat seperti stik drum dengan gelembung di kedua ujungnya, dengan pewarnaan gram sel bakteri menyerap warna sedangkan spora tidak terwarnai. C. tetani tumbuh optimum pada media agar darah yang diinkubasikan pada suhu tubuh manusia. Bakteri akan berada dalam bentuk inaktif dengan menghasilkan spora ketika lingkungan tempat tumbuhnya tertekan. Dalam kondisi seperti itu, bakteri sangat toleran dengan kondisi lingkungan yang ekstrim, sedangkan dalam bentuk aktif mensekresikan eksotoksin yang sangat poten menyebabkan penyakit tetanus (Anonim 2003).
Habitat alami kuman tetanus adalah tanah, debu, saluran cerna beberapa hewan, dan kadang-kadang pada feses manusia (Ray 2004). Beberapa varian dari kuman ini telah dipetakan secara genomik. C. tetani E88 merupakan varian dari
20 gen terlihat tidak berfungsi karena terjadi penurunan ORF akibat insertion, delesi, dan poin mutasi. Variasi G+C pada genom sangat rendah, hanya pada region yang kandungan G+C nyata tinggi (sebanding 50%) memiliki 6 gen cluster rRNA dan gen penyanding protein ribosom. Rendahnya fluktuasi dari G+C menyebabkan genom dari C. tetani lebih stabil dibandingkan enteropatogen lain.
C. tetani terus dapat tumbuh apabila tersedia ion sodium secara ekstensif sebagai bioenergetik (Bruggemann e t al. 2003).
Semua spesies hewan rentan terhadap toksin tetanus, tetapi tingkat kerentanannya berbeda -beda. Manusia dan kuda paling rentan sedangkan kucing dan burung lebih tahan. Berdasarkan LD50/kgBB, pada burung diperlukan 10 000 sampai 300 000 kali dosis toksin lebih tinggi dibandingkan dengan kuda untuk menimbulkan sakit (Bizzini 1993).
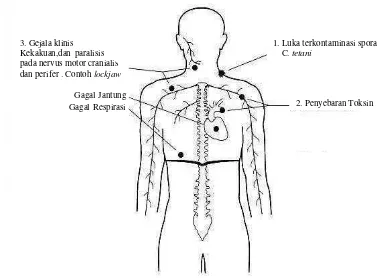
Manifestasi penyakit tetanus dikelompokkan menjadi empat yaitu : paralisis spastis umum (general), cephalic, lokal, dan neonatal. Tetanolisin dan tetanospasmin merupakan toksin yang dihasilkan oleh kuman tetanus dan sangat berbahaya (Ray 2004). Pada manusia dosis letal dari toksin adalah 1 ng/kg BB. (Bruggemann et al. 2003). Tetanus lokal ditandai dengan kekakuan otot disekitar luka. Gejala ini akibat kegagalan inhibisi dari inervasi syaraf spinal dan medula pada otot yang terserang. Tetanus lokal serangan ringan dan mortalitas kurang dari 1%. Tetanus cephalic kejadiannya jarang. Masa inkubasi sangat pendek yaitu satu sampai dua hari, dan penyakit muncul apabila te rjadi luka di daerah wajah dan kepala. Kelumpuhan daerah wajah dan okulomotoris merupakan gejala utama dan sering diikuti dengan dispagia. Prognosisnya jelek karena penyakit sering ke arah tetanus general. Tetanus neonatal terjadi karena kontaminasi pada daerah umbilikalis. Dengan masa inkubasi yang sangat pendek sehingga bayi tak bisa terawat. Kegagalan terjadi karena gangguan pernafasan dengan kematian empat sampai 14 hari (Bizzini 1993).