PENGARUH KONSENTRASI NATRIUM DIOKSIDA DALAM
ALUMINA TERHADAP KONSUMSI ALUMINIUM FLUORIDA
PADA BATH TUNGKU REDUKSI
DI PT INALUM
TUGAS AKHIR
MHD. SAID IBRAHIM HASIBUAN
092401063
PROGRAM STUDI D-3 KIMIA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATRA UTARA
PENGARUH KONSENTRASI NATRIUM DIOKSIDA DALAM ALUMINA TERHADAP KONSUMSI ALUMINIUM FLUORIDA
PADA BATH TUNGKU REDUKSI DI PT INALUM
TUGAS AKHIR
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Ahli Madya
MHD. SAID IBRAHIM HASIBUAN 092401063
PROGRAM STUDI D-3 KIMIA DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATRA UTARA
PERSETUJUAN
Judul : PENGARUH KONSENTRASI NATRIUM DIOKSIDA DALAM ALUMINA TERHADAP KONSUMSI ALUMINIUM FLUORIDA PADA BATH TUNGKU REDUKSI DI PT INALUM
Kategori : TUGAS AKHIR
Nama : MHD. SAID IBRAHIM HASIBUAN Nomor Induk Mahasiswa : 092401063
Program studi : DIPLOMA TIGA (D-3) KIMIA Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM (MIPA)
UNIVERSITAS SUMATERA UTARA
Disetujui di
Departement Kimia FMIPA USU Ketua,
PERNYATAAN
PENGARUH KONSENTRASI NATRIUM DIOKSIDA DALAM ALUMINA TERHADAP KONSUMSI ALUMINIUM FLUORIDA PADA BATH TUNGKU
REDUKSI DI PT INALUM
KARYA ILMIAH
Saya mengakui bahwa karya ilmiah ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juni 2012
PENGHARGAAN
Bismillahirrahmanirrahim,
Puji dan syukur penulis panjatkan kehadirat ALLAH SWT Yang Maha Pengasih dan
Maha Penyayang, atas berkat, rahmat dan karunia-Nya penulis dapat menyalesaikan
karya ilmiah ini yang berjudul “PENGARUH KONSENTRASI NATRIUM DIOKSIDA DALAM ALUMINA TERHADAP KONSUMSI ALUMINIUM FLUORIDA PADA BATH TUNGKU REDUKSI DI PT INALUM”.
Dalam penyusunan karya ilmiah ini dilakukan berdasarkan pengalaman dan
pengetahuan penulis selama melakukan Praktik Kerja Lapangan (PKL) di PT
Indonesia Asahan Aluminium (INALUM) Kuala Tanjung Kabupaten Batubara
tepatnya di seksi operasi tungku reduksi aluminium selama rentang waktu 5 Desember
2011 s.d. 13 Januari 2012.
Semoga karya ilmiah ini dapat member manfaat kepada penulis dan juga
kepada orang lain. Penulis menyadari akan fitrahnya seorang manusia yang tidak
sempurna, pastilah ada kekhilafan dalam penyusunan karya ilmiah ini. Oleh sebab itu,
sangat diharapkan kritik dan saran terhadap bentuk kekurangan dalam penyusunan
karya ilmiah ini.
Dalam kesempatan ini dengan segala kerendahan hati penulis ingin
mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Bapak Dr. Sutarman, M.Sc selaku dekan FMIPA USU
2. Ibu Dr. Rumondang Bulan, M.S dan Drs. Albert P. M.Sc selaku ketua dan
sekertaris Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan
Alam.
3. Ibu Dra. Emma Zaidar, M.Si dan Dra. Herlince Sihotang, M.Si selaku ketua
dan sekertaris program studi DIII Kimia Fakultas Matematika dan Ilmu
Pengetahuan Alam.
4. Dosen pembimbing penulis, Dr. Marpongahtun, M.Sc Semoga segala kebaikan
yang diberikan dapat menjadi amal sholeh di hadapan pencipta.
5. Ibunda Herlina Harahap seorang wanita yang telah mengandung, melahirkan,
mendidik serta mendo’akan penulis hingga menjadi seperti ini, semoga segala
untuk menjadi yang terbaik dan mencapai apa yang diinginkan. Ayahanda Drs.
Abdul Jalil Hasibuan yang telah banyak memberikan pengajaran moral kepada
penulis.
6. Kakak (Ummi kalsum Hasibuan) dan adik (Juli Khairani Hasibuan) penulis
yang telah memberikan motivasi dan semangat terhadap penulis.
7. Bapak Faisal Amri, Damiyanus, Faisal Hidayat dan seluruh karyawan PT
INALUM yang bersedia membimbing dan mengarahkan penulis.
8. Teman – teman “AndTheBro”, Dede, Evan, Yusup, Diki, Darna, Harry,
Zulfadli, Didi, Ariansyah, Mahadi, Ali, Arif, Devi, Get – Get, dan Davit
Terima kasih sebesar – besarnya atas semuanya.
9. Sri Mas Bulan Siregar yang bisa dengan mudahnya membuat penulis
tersenyum dengan segala tekniknya untuk menjalani hari – hari dan juga telah
memaksa penulis untuk segera menyelesaikan karya ilmiah ini. Terima kasih
bulan “Unlimitednya”. Serta penulis juga berharap semoga skripsinya juga
bisa selesai tepat waktu sesuai yang diinginkan “Go..Go.. Go.. SEMANGAT”.
Semoga segala dukungan, bantuan dan kebaikan dalam bentuk apa pun yang
telah diberikan kepada penulis akan memperoleh balasan dari ALLAH SWT.
Penulis menyadari bahwa karya ilmiah ini masih terdapat kekurangan dan
masih jauh dari kesempurnaan. Oleh karena itu, penulis sangat mengharapkan
kritikan dan saran yang membangun untuk kesempurnaan karya ilmiah ini.
Semoga karya ilmiah ini bisa bermanfaat terutama bagi penulis dan bagi kita
semua. Akhir kata saya ucapkan terima kasih.
Medan, Juni 2012
Penulis
ABSTRAK
Telah dilakukan pengujian penentuan berat AlF3 yang akan bereaksi dengan Na2O.
Reaksi AlF3 dengan konsentrasi Na2O yang bervariasi berlangsung dengan proses
elektrolisis di dalam bath tuingku reduksi. Berdasarkan hasil proses elektrolisis diperoleh 0,44%Na2O akan bereaksi dengan 22582,55 g AlF3; 0,43% Na2O akan
bereaksi dengan 22040,58 g AlF3; 0,34% Na2O akan bereaksi dengan 17524,07 g AlF3
THE EFFECT CONCENTRATE SODIUM OXIDE IN ALUMINA TO
CONSUMTION ALUMINIUM FLUORIDE IN BATH REDUCTION STOVE IN PT INALUM
ABSTRACT
Determination the weight of AlF3 that reaction by Na2O. Reaction AlF3 by different
concentration Na2O processing by electrolysis process directly in reduction bath stove.
By the eletrolisis 0,44%Na2O will reaction by 22582,55 g AlF3; 0,43% Na2O will
reaction by 22040,58 g AlF3; 0,34% Na2O will reaction by17524,07 g AlF3 and
DAFTAR ISI
2.3. Kegunaan Aluminium 7
2.4. Bahan Baku Utama Elektrolisa Aluminium 8
2.4.1. Alumina 8
2,4.2. Anoda dan Katoda 10
2.5. Bahan Baku Penunjang Elektrolisa Aluminium 11 2.5.1. Kriolit
11
2.5.2. Soda Abu 12
2.5.3. Aluminium Fluorida 12
2.6. Proses Peleburan Aluminium 13
2.6.1. Aliran Bahan Baku 13
2.6.2. Gas Cleaning 15
2.7. Proses Elektrolisa Aluminium 16
3.2.1.1. Metode Gas Baking 19
3.2.1.2. Metode Electrikal Baking 21
3.2.2. Pemasukan Alumina 22
3.2.3. Pengambilan Metal Cair 22
BAB 4 HASIL DAN PEMBAHASAN
4.1. Hasil 23
4.2. Perhitungan 24
4.3. Pembahasan 31
BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan 34
5.2 Saran 34
DAFTAR TABEL
Tabel 2.1 Spesifikasi Alumina 10
Tabel 4.1 Data Bath Material Bulan Desember 2011 23 Tabel 4.2 Data Spesifikasai %Na2O dalam Alumina Pada Bulan Desember 2011 24
Tabel 4.3 Tabel 4.3 Data Hasil Perhitungan g AlF3 yang bereaksi dengan Na2O 26
Tabel 4.4. Pengamatan ANAVA 27
DAFTAR GAMBAR
Gambar 2.1 Aliran Material
DAFTAR GRAFIK
ABSTRAK
Telah dilakukan pengujian penentuan berat AlF3 yang akan bereaksi dengan Na2O.
Reaksi AlF3 dengan konsentrasi Na2O yang bervariasi berlangsung dengan proses
elektrolisis di dalam bath tuingku reduksi. Berdasarkan hasil proses elektrolisis diperoleh 0,44%Na2O akan bereaksi dengan 22582,55 g AlF3; 0,43% Na2O akan
bereaksi dengan 22040,58 g AlF3; 0,34% Na2O akan bereaksi dengan 17524,07 g AlF3
THE EFFECT CONCENTRATE SODIUM OXIDE IN ALUMINA TO
CONSUMTION ALUMINIUM FLUORIDE IN BATH REDUCTION STOVE IN PT INALUM
ABSTRACT
Determination the weight of AlF3 that reaction by Na2O. Reaction AlF3 by different
concentration Na2O processing by electrolysis process directly in reduction bath stove.
By the eletrolisis 0,44%Na2O will reaction by 22582,55 g AlF3; 0,43% Na2O will
reaction by 22040,58 g AlF3; 0,34% Na2O will reaction by17524,07 g AlF3 and
BAB 1
PENDAHULUAN
1.1Latar Belakang
Industri peleburan aluminium mulai berkembang sejak Charless Hall dan Paul
Heroult yang secara terpisah menemukan proses produksi aluminium yang lebih
sederhana pada tahun 1886, yaitu dengan cara mereduksi aluminium (Al) dari bahan
baku alumina (Al2O3) dengan proses elektrolisis. Dalam proses ini, bahan karbon (C)
dipakai sebagai elektroda, kriolit (Na3AlF6) sebagai larutan elektrolit, dan arus listrik
searah (DC) sebagai sumber energi pemisah Al dari senyawa (Al2O3) dan menjaga
agar elektrolit maupun metal cair yang terbentuk tetap terjaga dalam fase cair di dalam
tungku reduksi (Austin,1996).
Di dalam bahan baku alumina terdapat senyawa-senyawa selain Al2O3 (dalam
keadaan kering) itu sendiri yang dapat mempengaruhi proses produksi aluminium
tersebut. Masing-masing senyawa tersebut memiliki spesifikasi tertentu yang
disesuaikan dengan atandar dalam peleburan aluminium di PT INALUM.
Senyawa-senyawa tersebut antara lain : (SiO2, Fe2O3, TiO2, Na2O dan CaO). Na2O merupakan
senyawa yang terdapat dalam bahan baku alumina. Na2O berperan langsung dalam
pembentukan kriolit (Na3AlF6).
Kriolit adalah salah satu bahan baku penunjang yang sangat penting yang
digunakan sebagai elektrolit dalam proses elektrolisa peleburan aluminium.Kriolit
dapat melarutkan alumina dalam jumlah besar. Kriolit ditambahkan ke dalam pot
ditentukan dengan standar pada pengoperasian awal (start-up) pot reduksi. Pada saat
pot beroperasi secara normal akan terjadi pembentukan kriolit yang dipengaruhi oleh
reaksi tertentu yang tetrjadi di dalam pot reduksi. Pembentukan kriolit dipengaruhi
oleh reaksi antara Na2O dengan aluminium flourida (AlF3). Senyawa AlF3 juga
termasuk bahan baku penunjang yang ditambahkan ke dalam pot reduksi dengan
tujuan untuk menjaga keasaman bath dan merupakan bahan yang dituangkan secara
manual jika AlF3 kurang di dalam bath.
Oleh karena itu, bahan baku alumina secara langsung mempengaruhi reaksi
yang terjadi antara Na2O dengan AlF3. Melalui reaksi tersebut akan diperoleh
perbandingan serta perhitungan untuk mrengetahui berapa banyak AlF3 yang bereaksi
dengan asumsi Na2O yang terdapat dalam alumina. Untuk spesifikasi Na2O sendiri
memiliki persentase konsentrasi yang berbeda-beda pada setiap bahan baku yang
masuk ke dalam pabrik reduksi, meskipun demikian standar Na2O harus tetap sesuai
dengan yang diinginkan untuk proses elektrolisa di tungku reduksi agar pembentukan
kriolit di dalam pot tetap stabil (Kelvin,1994).
Berdasarkan uraian di atas, maka dapat menjadi suatu alasan bagi penulis
untuk menentukan : “Pengaruh Konsentrasi Natrium Dioksida Dalam Alumina Terhadap Konsumsi Aluminium Fluorida pada Bath Tungku Reduksi Di PT Inalum.
Berapa banyak jumlah aluminum fluorida (AlF3) yang bereaksi dengan berbagai
konsentrasi natrium dioksida (Na2O) yang terkandung di dalam bahan baku alumina
(Al2O3).
1.3Tujuan
a. Untuk menentukan berapa jumlah aluminium fluorida yang bereaksi dengan
konsentrasi Na2O yang berbeda.
b. Untuk mengetahui bagaimana hubungan antara konsentrasi Na2O dengan
aluminium fluorida
1.4Manfaat
Dengan diketahui berapa banyak aluminium fluorida yang bereaksi dengan Na2O pada
konsentrasi yang berbeda yang terkandung di dalam bahan baku alumina sehinga
komposisi bath untuk AlF3 bisa ditentukan dan proses elektrolisa dapat berlangsung
BAB 2
TINJAUAN PUSTAKA
2.1. Sejarah Aluminium
Aluminium ditemukan kira – kira sekitar 160 tahun yang lalu dan dimulai produksi
skala industri sekitar 90 tahun yang lalu. Berikut sejarah perkembangan tentang
penemuan aluminium : . (Davis,1993)
1. Pada tahun1782, seorang ilmuwan Perancis bernama Lavoiser telah
menduga bahwa aluminium merupakan logam yang terkandung di dalam
alumina,
2. Pada tahun 1807, ahli kimia Inggris bernama Humphrey Davy berhasil
memisahklan alumina secara elektrokimia logam dan yang diperoleh dari
pengujian tersebut adalah aluminium,
3. Pada tahun 1821, biji sumber aluminium ditemukan di Perancis Selatan,
tepatnya di kota Lesbaux, yang dinamakan bauksit,
4. Pada tahun 1825, ahli kimia Denmark, Osted berhasil memisahkan
aluminium murni dengan cara memanaskan aluminium khlorida dengan
kalium amalgam dan kemudian memisahkan merkuri dengan cara destilasi,
5. Pada tahun 1886, mahasiswa Oberlin College di Ohio, Amerika Serikat
bernama Charles Martin – Hall menemukan dengan cara melarutkan
uang dilapisi logam karbon dan kemudian melewatkan arus listrik melalui
ruang tersebut. Cara ini dikenal dengan proses Hall – Heroult, karena ini
terjadi pada tahun yang sama dengan seorang berkebangsaan Perancis yang
bernama Paul Heroult,
6. Pada tahun 1888, ahli kimia Jerman Karlf Josef Bayer menemukan cara
memperoleh alumina dari bauksit secara pelarutan kimia. Sampai saat ini
cara Bayer masih digunakan untuk memproduksi alumina dari bauksit
secara industri dan disebut dengan proses Bayer.
2.2. Aluminium
Aluminium adalah logam yang ringan dan cukup penting dalam kehidupan manusia.
Aluminium merupakan unsur kimia golongan IIIA dalam sistim periodik unsur,
dengan nomor atom 13 dan berat atom 26,98 gram per mol. Didalam udara bebas
aluminium mudah teroksidasi membentuk lapisan tipis oksida (Al2O3) yang tahan
terhadap korosi. Aluminium juga bersifat amfoter yang mampu bereaksi dengan
larutan asam maupun basa (Hartomo,1992).
Aluminmium adalah unsur melimpah ketiga terbanyak dalam kerak bumi
(sesudah oksigen dan silikon), mencapai 8,2% dari masa total. Keberadaanya
umumnya bersamaan dengan silikon dan aluminosilikat dari feldspar dan mika dan di
dalam lempung, yaitu aluminium oksida terhidrasi yang mengandung 50% sampai
60% Al2O3; 1% sampai 20% Fe2O3; 1% sampai 10% silika; sedikit sekali titanium,
zirkonium, vanadium dan oksida logam transisiyang lain dan sisanya (20% sampai
30%) adalah air. Bauksit (Inggris : bauxite) adalah biji utama aluminium terdiri dari
Al(OH)3, boehmite -AlO(OH), dan diaspore -AlO(OH), bersama – sama dengan
oksida besi goethite dan bijih besi, mineral tanah liat kaolinit dan sejumlah kecil
anatase TiO2. Bauksit sebagai bahan baku peleburan aluminium dimurnikan melalui
proses Bayer, yang mengambil manfaat dimana fakta menunjukkan bahwa oksida
alumina amfoter larut dalam basa kuat tapi besi (III) oksida tidak. Bauksit mentah
dilarutkan dalam natrium hidroksida sehingga tebentuk AL(OH) 4- menurut reaksi :
Al2O3(s) + 2 OH-(aq) + 3 H2O(l) 2 Al(OH)4-(aq)
Kemudian Al(OH)4- yang terbentuk dipisahkan dari besi oksida dalam bentuk
terhidrasi serta zat asing terlarut lainnya dengan penyaringan. Aluminium oksida
dalam bentuk terhidrasi murni mengendap bila larutan didinginkan sampai lewat –
jenuh dan dipancing menjadi kristal dari produk:
2 Al(OH)4-(aq) Al2O3.3H2O(s) + 2 OH-(aq)
2.3. Kegunaan Aluminium
Dilihat dari segi kuantitas dan kualitas, kegunaan aluminium dapat mengatasi
kegunaan logam lain kecuali besi. Karena itu aluminium sangat penting dalam
kehidupan sehari – hari dan berpengaruh terhadap perkembangan ekonomi dunia,
dikarenakan aluminium diprediksi akan menjadi komoditi ekspor dunia.
Aluminium murni mempunyai kekuatan logam yang rendah, tetapi mempunyai
kemampuan untuk membentuk alloy bersama dengan banyak unsur seperti tembaga,
seng, magnesium, mangan dan silikon. Pada saat ini hampir semua bahan yang
dianggap aluminium sebenarnya sejenis alloy aluminium bukan aluminium murni.
Apabila digabung secara proses termomekanikal, alloy aluminium menunjukkan
peningkatan kekuatan dari segi sifat mekanikal. Alloy aluminium membentuk
komponen penting dalam pesawat udara dan roket, ini dikarenakan kekuatan yang
meningkat.
Sebagian dari kegunaan – kegunaan aluminium yaitu : (Oxtoby,2003)
1. Pengangkutan (kendaraan, kapal terbang, kendaraan landasan, kapal
laut dan sebagainya),
2. Pembungkus (tin aluminium, keranjang aluminium dan sebagainya),
3. Perawatan air,
4. Pembinaan ( pintu, dwai binaan dan sebagainya),
5. Barangan pengguna tahan lama (perkakas, peralatan dapur dan
6. Talian penghantaran elektrik (berat pengalir aluminium adalah
setengah dari dari berat tembaga dengan kekonduksian yang sama dan
lebih murah),
7. Jendela,
8. Aluminium murni,
9. Serbuk aluminium, yang mempunyai bentuk perak yang biasa
digunakan dalam cat.
2.4 Bahan Baku Utama Elektrolisis Aluminium
2.4.1 Alumina
Alumina adalah bahan baku utama untuk memproduksi aluminium. Alumina
mempunyai morfologi sebagai bubuk berwarna putih dengan berat molekul102,titik
leleh (temperatur pada dimana zat cair dari suatu zat berada dalam kesetimbangan)
pada 20500C, dan densitas 3.5 – 4,0 gr/cm3. Dalam industri peleburan aluminium,
alumina mempunyai 4 fungsi yaitu :
1. Sebagai bahan baku utama dalam memproduksi aluminium,
2. Sebagai insulasi termal untuk mengurangi kehilangan panas dari
atas pot, dan untuk mempertahankan temperatur operasi,
3. Melindungi anoda dari oksidasi udara,
Alumina (Al2O3) merupakan senyawa oksida dari aluminium yang diperoleh
dari proses pemurnian bauksit (Al2O3 x H2O) yang disebut sebagai Proses Bayer.
Alumina yang dihasilkan melalui proses Bayer ini, mempunyai kemurnian yang tinggi
dengan komsumsi energi yang relatif rendah.
PT INALUM memperoleh alumina yang diimpor dari Australia dan
mengangkut alumina tersebut dengan menggunakan kapal laut. Selain dari Australia
PT INAL:UM juga mendapatkan alumina dari Jepang, namun karena Australia lebih
banyak menghasilkan alumina, maka PT INALUM hanya mengimpor alumina dari
Australia saja, PT INALUM mengim[por alumina dari Australia sebanyak 20.000 ton
per tahunnya, sehingga dengan begitu PT INALUM tidak akan kekurangan alumina
dalam waktu setahun.
Spesifikasi alumina yang digunakan oleh PT INALUM yang berasal dari
ALCAN bauxite, Alumina dan Specially Chemicals, Australia, dapat dilihat pada tabel
2.1
Tabel 2.1. Spesifikasi Alumina
Anoda adalah elektroda bermuatan positif. Jenis anoda yang dipakai adalah jenis
anoda prebaked, anoda yang digunakan di seksi reduksi dibuat dari gedung karbon
dengan bahan kokas dan hard pitch.
Katoda adalah elektroda bermuatan listrik negatif. Ditinjau dari bahan bakunya dan
1. Blok katoda Amorphus, bahan bakunya antrasit, dipanggang pada suhu
1.2000C
2. Blok katoda semi graphitic, bahan bakunya grafit, dipanggang pada suhu
1.2000C
3. Blok katoda semi graphitic, bahan bakunya yang mengalami proses
pemanasan sampai 2.3000C
4. Blok katoda graphitic, bahan bakunya kokas mengalami proses grafitasi
suhu 3.0000C.
2.5 Bahan Baku Penunjang Proses Elektrolisa
2.5.1 Kriolit
Kriolit dapat mengandung CaF2 dan AlF3 yang dapat membentuk kriolit Na3AlF6. Sifat
– sifat kriolit adalah :
1) Konduktifitas l;istrik baik,
2) Memiliki berat jenis yang rendah,
3) Temperature kristaluisasi primer rendah,
5) Dapat melarutkan alumina dalam jumlah besar,
Untuk memperbaiki sifat – sifat kriolit tersebut, bath biasanya ditambah dengan
beberapa tambahan seperti fluoride, alkil metal, AlF3 dan CaF2.
2.5.2. Soda Abu
Soda abu berfungsi memperkuat struktur katoda dan dinding samping agar sulit
tererosi. Lapisan dinding samping dengan Na2CO3 dilakukan pada tahap transisi untuk
membantu proses pembentukan kerak samping. Selain mencegah erosi oleh bath, soda
abu berfungsi sebagai isolasi thermal.
2.5.3. Aluminium Fluorida
Aluminium fluorida berfungsi menjaga keasaman bath dan merupakan bahan yang
2.6. Proses Peleburan Aluminium
2.6.1. Aliran Bahan Baku
Bahan – bahan untuk keperluan produksi aluminium pertama sekali didatangkan
melalui pelabuhan. Bahan – bahan tersebut adalah alumina, kokas dan hard pitch.
Alumina akan dimasukkan ke silo alumina (alumina silo), kokas ke dalam silo kokas
(coke silo), pitch kedalam pitch storage house. Pemasukan bahan – bahan tersebut
menggunakan belt conveyer.
Alumina yang berada di dalam silo alumina kemudian di bawa ke dry scrub
ber system untuk direaksikan dengan gas hidrogen fluorida (HF) yang berasal dari
tungku reduksi. Hasil dari reaksi ini adalah reacted alumina yang akan dimasukkan ke
dalam hopper pot dengan menggunakan Anode Changging Crane (ACC). Dari hopper
pot, reacted alumina akan dimasukkan ke dalam tungku reduksi.
Kokas yang ada dalam silo kokas akan bercampur dengan butt (puntung
anoda) dan mengalami pemanasan. Kemudian dicampur dengan hard pitch yang
berfungsi sebagai perekat (binder). Campuran ketiga bahan ini akan dicetak
menggunakan Shaking Machine di Anode Green Plant dan selanjutnya mengalami
pemanggangan pada baking furnace. Hasilnya adalah blok anoda (anode block) di
Anode Baking Plant.
Blok – blok anoda kemudian akan dipasangi tangkai (anode assembly) di
Anode Baking Plant. Anoda tersebut kemudian akan dikirimkan ke Reduction Plant
untuk keperluan proses elektrolisis alumina menjadi aluminium. Setelah ±28 hari
dihancurkan dan dimasukkan ke silo butt. Butt kemudian dipakai kembali (recycle)
sebagai bahan pembuatan anoda bersama kokas dan pitch.
Pada tungku reduksi akan terjadi proses elektrolisis alumina. Proses ini akan
menghasilkan gas HF yang akan ke dry scrubber system untuk bereaksi dengan
alumina dan dibersihkan lalu dibuang melalui cerobong gas cleaning sistem.
Aluminium cair (molten) yang dihasilkan di bawa ke Casting Shop menggunakan
Metal Transport Car (MTC). Di casting shop aluminium cair dimasukkan kedalam
holding furnace, lalu dituang ke casting machine untuk dicetak menjadi ingot
aluminium dengan berat masing – masing ingot seberat 50 lbs (22,7kg). Aliran
2.6.2. Gas Cleaning
a. Fresh Alumina Handling System
Sistem ini menangani penyimpanan fresh alumina di dalam silo alumina dan
pengirimannya ke dry scrubbing system. Banyaknya alumina yang dikirimkan diukur
dengan flowmeter.
b. Dry Scrubbing System
Sistem ini berfungsi menyaring debu dan mengadsorbsi gas fluorida yang berasal dari
pot reduksi. Fresh alumina dari silo dialirkan melalui air slide ke dalam reactor dan
direaksikan dengan gas buang dari pot reduksi. Gas dihisap dari pot reduksi dengan
menggunakan main exhaust fan. Debu dan alumina yang bereaksi ini kemudian
disaring di dalam bag filter. Udara yang sudah bersih dibuang ke atmosfer melalui
exhaust stack.
Untuk menjaga tekanan di dalam bag filter stabil, alumina dan debu yang
menempel di kain bag filter perlu dihembus secara periode dengan udara bertekanan
rendah yang diatur melalaui damper. Udara ini berasal dari reverse flow fan. Alumina
yang jatuh kemudian ditampung di dalam hopper bag filter, dialirkan dan
disirkulasikan kembali ke dalam reactor untuk bereaksi kembali dengan gas buang.
Dengan cara demikian kontak antara gas buang dengan alumina di dalam reactor lebih
efektif.
Setelah reaksi adsorpsi selesai melalui sistem overflow., alumina dari bag filter
c. Reacted Alumina Handling System
Sistem ini menangani penyimpanan sementara reacted alumina di bin reacted
alumina. Reacted alumina kemudian dialirkan menuju Bath Material Mixing Centre
(BMMC) untuk dicampur dengan material bath. Campuran alumina dengan material
bath kemudian disimpan sementara di day-bin melalui belt conveyer. Campuran ini
selanjutnya digunakan di pot reduksi sebagai bahan baku (Anonim,2009).
2.7. Proses Elektrolisa Aluminium
Hampir semua logam aluminium primer dihasilkan dengan proses elektrolisa
Hall-Heroult. Bahan baku yang digunakan terdiri dari alumina, karbon, kriolit, CaF2, HF,
AlF3 dan tenaga listrik. Terdapat dua jenis tungku reduksi yang dipergunakan dalam
industri peleburan aluminium yaitu Prebaked Anode Furnace (PAF) dan Soderberg
Anode Furnace (SAF). Perbedaan kedua tipe tungku tersebut terletak pada cara
pemanggangan anodanya, dalam sistem PAF anoda dipanggang terlebih dahulu
(prebaked) sebelum dipergunakan. Sedangkan pada sistem SAF tidak dilakukan
pemanggangan pendahuluan, melainkan dimasukkan langsung kedalam tungku
reduksi.
Reaksi kimia yang terpenting yang terjadi ditungku reduksi, adalah reaksi elektrolisa untuk m
terbentuk aluminium. Demikian juga ion zat asam mendekati anoda kemudian
dinetralisir. Selain itu terjadi juga reaksi reduksi, dimana karbon yang berasal dari
anoda berfungsi sebagai reduktor mengikat asam :
Aluminium cair yang terkumpul dibagian bawah tungku selanjutnya dihisap dan
dibawa ke pabrik penuangan. Pada proses Hall-Heroult, logam aluminium diperoleh
dari alumina dengan menggunakan cairan kriolit (Na3AlF6), (titik lebur 10000C) yang
digunakan sebagai pelarut. Sejumlah besar alumina (Al2O3) dilarutkan dalam kriolit,
dimana larutan kriolit dapat menurunkan titik lebur alumina. Campuran kriolit dan
aluminium oksida dielektrolisa dalam sel dan sel lapisan karbon yang berfungsi
sebagai katoda tersimpan didalam cairan aluminium. Pada operasi sel, cairan
BAB 3
BAHAN DAN METODE PERCOBAAN
3.1 Alat dan Bahan
Beberapa peralatan dan bahan yang digunakan antara lain adalah:
3.1.1 Alat
a. Tungku Peleburan
- Kerangka Tungku
- Tempat Alumina (Alumina Hopper)
- Pemecah Kerak (Blade)
- Anode Block
- Kathode Block
- Gas Duct
- Penutup tungku (side Cover)
- Penjepit Anoda (Anode Clamp)
- Blade
b. Alarm Indikator
- Anode Changging Crane (ACC)
- Ladle metal
- Ladle Bath
- Anopde Jacking Flame
3.1.2 Bahan Olahan pada Proses Elektrolisa
- Alumina (Al2O3)
- Anoda karbon
- Kriolit (Na3AlF6)
- Katoda Karbon
- Aluminium Fluorida (AlF3)
- Soda Abu (Na2CO3)
- Dimatikan gas LPG, kemudian burner dilepaskan dari dalam pot
- Dibuka Cover yang ada di sekeliling pot, kemudian arus diturunkan hingga
130 kA
- Ditaburkan serbuk kriolit disekeliling dinding pot, ini dilakukan agar tidak
- Dimasukkan bath cair sebanyak 12 ton, kemudian setelah bath telah habis di
tuang, maka Pasak Hubungan Singkat (PHS) dicabut, diatur posisi busbar
sehingga terjadi funken atauAnode Effect dan arus dinaikkan hingga normal
- Dimasukkan alumina ke dalam pot
- Dipertahankan funken selama 10 – 15 menit dan setelah itu funken dimatikan
dengan cara menyemprotkan udara kering ke dalam bath cair dengan
menggunakan pipa AE
- Dimasukkan bath cair yang pertama sebanyak ± 4 ton
- Ditutup Hood seluruhnya kemudian peralatan dikembalikan ke tempat yang
telah ditentukan
- Dilakukan metal charging yaitu pemasukan metal cair ke dalam tungku
sebanayak 12 ton setelah satu hari
3.2.1.2Metode Electrikal Baking
- Dikeluarkan kokas isolasi dengan menggunakan ladel kokas
- Dimasukkan PHS untuk memutus arus listrik, alat control Anode Current
Distribution Device (ACDD) dilepas dan diletakkan ditempat yang telah
ditentukan
- Diatur posisi busbar pada 280 mm kemudian anoda diangkat ±100 mm dan
anoda di klem menggunakan ACC
- Dianaikkan posisi busbar ke posisi 100mm dengan menggunakan motor jack
Didorong kokas dasar ke bagian sisi panjang arus masuk dengan menggunakan
sapu kokas yang dibantu dengan forklift putar dan kokas dasar dihisap dengan
ladle kokas sampai habis
- Diturunkan Busbar ke posisi 360 mm kemudian arus dituruinkan sampai 130
kA
- Diambil Bath cair sebanyak ± 6 ton dari pot penyedia bath dituang ke dalam
pot
- Dicabut PHS dan posisi busbar diatur hingga terjadi funken dan arus dinaikkan
kembali hingga normal
- Dimasukkkan alumina ke dalam pot
- Dipertahankan Funken selama 10 – 15 menit dan setelah itu funken dimatikan
dengan jalan menyemprotkan udara kering ke dalam bath cair dengan
menggunakan pipa AE
- Dimasukkan Bath cair yang ke dua sebanyak ± 6 ton ke dalam pot
- Ditutup Hood seluruhnya kemudian peralatan dikembalikan ke tempat yang
- Dilakukan metal charging yaitu pemasukan metal cair ke dalam tungku
sebanyak 12 ton setelah satu hari
- Dicatat data – data operasi start up
3.2.2 Pemasukan Alumina
Dilakukan pengisian alumina ( Alumina Feeding ) secara komputerisasi
setelah pot reduksi beroperasi secara normal.
3.2.3 Pengambilan Metal Cair
Diambil metal cair hasil proses produksi setiap hari dengan cara dihisap
menggunakan ladel metal yang digantungkan pada ACC. Banyaknya metal
yang diambil dari setiap pot disesuaikan dengan tinggi metalnya dan juga
BAB 4
HASIL DAN PEMBAHASAN
4.1Hasil
Hasil pengamatan operasi harian pada Departemen Smelter Reduction and Casting
(SRC) pada pabrik peleburan aluminium di PT INALUM , Kuala Tanjung, Kabupaten
Batubara, ditunjukkan pada Tabel 4.1
Tabel 4.1 Data Bath Material Bulan Desember 2011
No Jenis Keterangan
1. Line current 190 kA 2. Current efisien 92,32% 3. Pot reduksi 504
4. UC alumina 1900 kg/T.Al
Hasil pengamatan alumina yang masuk ke dalam tungku reduksi dengan persen
konsentrasi Na2O pada Departemen Smelter Reduction and Casting (SRC) di PT
INALUM , Kuala Tanjung, Kabupaten Batubara, ditunjukkan pada Tabel 4.2
Tabel 4.2 Data Spesifikasai %Na2O dalam Alumina Pada Bulan Desember 2011
4.2. Perhitungan
1. mencari berat aluminium
Dimana : W = berat aluminium (g)
M = berat atom aluminium
n = jumlah electron tiap mol zat
F = konstanta Faraday (96500)
I = kuat arus
maka :
4. Mencari jumlah AlF3 yang bereaksi
Mol Na2O = g/Mr
= 12500/ 61,98
= 201,6779
Mol AlF3 =
= 268.9039
Berat AlF3 = 268.9039 x 83.98
= 22582,55 g
Dengan cara yang sama seperti perhitungan diatas maka hasil perhitungan jumlah g
aluminium fluorida yang bereraksi dengan persentase Na2O dapat dilihat pada Tabel
4.3
Tabel 4.3 Data Hasil Perhitungan g AlF3 yang bereaksi dengan Na2O
Na2O (%) AlF3 (g)
0,44 22582,55
0,43 22040,58
0,34 17525,07
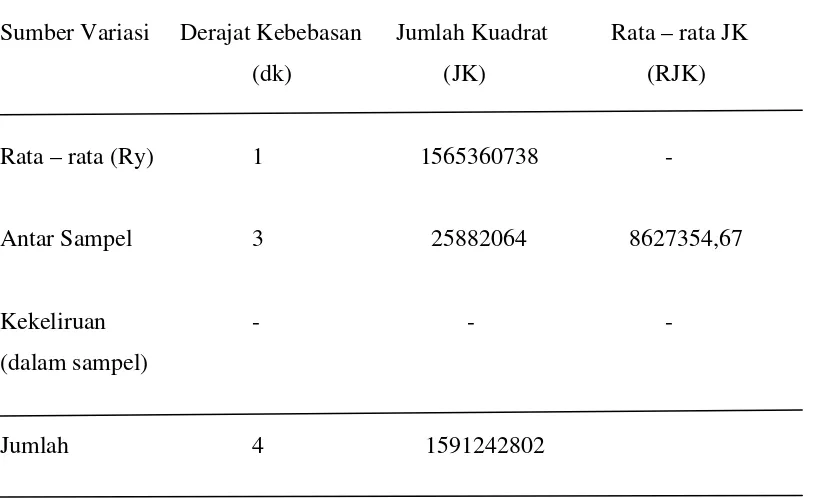
Data pengamatan ANAVA ditunjukkan pada Tabel 4.4
Tabel 4.4. Pengamatan ANAVA
Perlakuan Data Pengamatan Banyak Pengamatan
No Sampel Nilai berat AlF3 (g)
1 22582,55 1
2 22040,58 1
3 17524,07 1
4 16982,08 1
Jumlah nilai berat untuk tiap sampel
J = 79129,28
Rata – rata seluruh sampel :
= 79129,28
4
Untuk melakukan perhitungan ANAVA diperlukan data sebagai berikut:
1. , jumlah kuadrat – kuadrat semua nilai dari sampel
= 22582,552 + 22040,582 + 17524,072 + 16982,082
= 1591242802
2. Ry, Jumlah kuadrat rata – rata keseluruhan
= ( 22582,55 + 22040,58 + 17524,07 + 16982,08)2
4
= 1565360738
3. Py jumlah kuadrat tiap – tiap sampel
= k
( Ji2 / ni )- Ry
i=1
= (22582,552 + 22040,582 + 17524,072 + 16982,082) – 1565360738
4. Ey jumlah kuadrat keliruan
= ∑Y2 – Ry – Py
= 1591242802 – 1565360738 – 25882064
= 0
Setelah nilai – nilai di atas diperoleh, maka disusun data analisis variasi (ANAVA)
pada Tabel 4.5 berikut :
Tabel 4.5. ANAVA Perhitungan Nilai Berat dan Sampel
Sumber Variasi Derajat Kebebasan Jumlah Kuadrat Rata – rata JK
(dk) (JK) (RJK)
Rata – rata (Ry) 1 1565360738 -
Antar Sampel 3 25882064 8627354,67
Kekeliruan - - -
(dalam sampel)
Taraf yang digunakan adalah sebagai berikut :
F tabel (α = 0,05)
Adapun hipotesa yang dibandingkan ialah :
H0 = Tidak ada pengaruh yang signifikan %Na2O terhadap g ALF3
H1 = terdapat pengaruh yang signifikan %Na2O terhadap g ALF3
Dari tabel distribusi diperoleh nilai tabel(α= 0,05 )adalah 6,59 maka:
F hitung < F tabel
8627354,67 > 6,59
H1 diterima
Kesimpulan bahwa terdapat pengaruh yang signifikan %Na2O terhadap gram AlF3
4.3.Pembahasan
Proses elektrolisis secara umum merupakan proses elektrokimia yang mengurai
suatu zat dengan anoda bertindak sebagai elektroda negatif dan katoda bertindak
sebagai elektroda positif di dalam larutan elektrolit sebagai medium serta
menggunakan arus listrik searah.
Proses yang terjadi dalam pot reduksi adalah proses elektrolisa, yaitu proses
penguraian suatu elektrolit oleh arus listrik, dimana energi listrik diubah menjadi
energy kima. Proses reduksi peleburan aluminium di PT INALUM menggunakan
metode Hall – Heroult. Hampir seluruh produksi aluminium pada saat ini dibuat
dengan cara meleburkan alumina pada elektrolit di dalam tungku, dimana jenis
tungku yang dipakai adalah Prebaked Anode Furnace (PAF) dan Soederberg
Anode Furnace (SAF). PT INALUM sendiri menmggunakan jenis tungku
Prebaked Anode Furnace (PAF).
Pada proses peleburan aluminium di PT Inalum yang menggunakan bahan
baku alumina dan karbon bertindak sebagai anoda dan katoda di dalam medium
bath. Bath merupakan cairan elektrolit yang juga tempat penguraian alumina yang
di dalamnya terdapat ( SiO2, Fe2O3, Na2O dll). Bath juga memiliki komposisi
seperti ( fluorida, CaF2, AlF3,dll). Maka pada saat terjadinya reaksi antara alumina
dengan bath akan terjadi beberapa reaksi, diantaranya:
3Na2O(s) + 4AlF3(l) 2Na3AlF6(l) + Al2O3(g)
Dari reaksi tersebut kita dapat mengetahui hubungan Na2O dengan AlF3. Sesuai
dengan % Na2O yang berbeda – beda akan menghasilkan g AlF3 juga yang
Dari hasil perhitungan diketahui apabila %Na2O = 0,44% maka g AlF3 yang
bereaksi ialah 22582,55 g; %Na2O = 0,43% maka g AlF3 yang bereaksi ialah
22040,58 g; %Na2O = 0,34% maka g AlF3 yang bereaksi ialah 17524,07 g; dan
%Na2O = 0,33% maka g AlF3 yang bereaksi ialah 16982,08 g. Maka hubunganya
ialah berbanding lurus, artinya apabila %Na2Onya besar maka g AlF3 yang
bereaksi juga besar dan apabila %Na2Onya kecil maka g ALF3 yang bereaksi juga
kecil. Hubungannya juga bisa kita lihat dari grafik antara %Na2O dengan g AlF3
berikut ini.
BAB 5
KESIMPULAN DAN SARAN
5.1Kesimpulan
a. Dari hasil perhitungan diketahui bahwa gram AlF3 untuk 0,44% Na2O =
22582,55; 0,43% Na2O = 220400,58; 0,34% Na2O = 17524,07; 0,33% Na2O =
16982,08.
b. Hubungan antara konsentrasi natrium dioksida dengan aluminium fluorida
adalah apabila konsentrasi natrium dioksida besar maka aluminium fluorida
yang bereaksi juga gramnya semakin besar, dan apabila konsentrasi natrium
dioksida kecil maka aluminium fluorida yang bereaksi juga gramnya semakin
kecil.
5.2 Saran
Sebaiknya dilakukan penelitian selanjutnya pengaruh senyawa lain yang terkandung
dalam alumina, sehingga proses elektrolisa berlangsung maksimal dan produksi
DAFTAR PUSTAKA
Austin, G.T., 1996. Industri Proses Kimia. Jilid 1. Edisi Kelima. Jakarta: Erlangga. Davis, J.R., 1993. Aluminium and Aluminium Alloys. USA: Davis and Chargin Falls.
Grjotheim, K. and Welch, B.L., 1988. Aluminium Smelter Technology.
Second Edition. Desserldorf: Aluminium Verlag.
Hartomo, J.A., 1992. Mengenal Lapisan Logam. Yogyakarta: Andi Offset.
Jody, B., 1992. Recyling of Aluminium Salt Cake. London: J.Res Management and Technology.
Kelvin, G.V., 1994. The Chemical World Concept and Aplication. Orlando: Harcourt Brace & Company.
Berat AlF3 = 208,6695 x 83,98
= 17525,07 g
Contoh untuk Na2O 0,33%
Berat Na2O = 0,33% x 2,8428
= 0,0094 T
= 9400 g
Mol Na2O = g/Mr
= 9400 / 61,98
Mol AlF3 =
= 202,2158
Berat AlF3 = 202,2158 x 83,98