TEKNOLOGI PRODUKSI FIKOSIANIN
Spirulina platensis
DAN PEMANFAATANNYA SEBAGAI IMUNOSTIMULAN
PADA IKAN KERAPU BEBEK (
Cromileptes altivelis
)
WORO HASTUTI SATYANTINI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi berjudul Teknologi Produksi Fikosianin Spirulina platensis dan Pemanfaatannya Sebagai Imunostimulan Pada Ikan Kerapu Bebek (Cromileptes altivelis) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, September 2013
Woro Hastuti Satyantini
RINGKASAN
WORO HASTUTI SATYANTINI. Teknologi Produksi Fikosianin Spirulina platensis dan Pemanfaatannya sebagai Imunostimulan Pada Ikan Kerapu Bebek (Cromileptes altivelis). Dibimbing oleh SUKENDA, ENANG HARRIS dan NUR BAMBANG PRIYO UTOMO.
Kementrian Kelautan dan Perikanan (KKP) telah mentargetkan produksi ikan kerapu sebanyak 9000 ton di tahun 2011 dari 7000 ton di tahun 2010. Permasalahan muncul dengan semakin intensifnya budidaya ikan kerapu yaitu adanya serangan penyakit. Vibriosis merupakan salah satu penyakit yang dapat mengakibatkan kegagalan produksi dalam budidaya ikan kerapu. Penanggulangan penyakit dengan penggunaan bahan kimia dan antibiotik telah dilarang oleh pemerintah dikarenakan berdampak buruk bagi lingkungan dan menimbulkan bakteri resisten. Untuk menekan tingkat kegagalan akibat serangan penyakit ini maka pemberian imunostimulan dari bahan alami mikroalga adalah salah satu cara yang dapat digunakan untuk menanggulangi masalah tersebut. Bioaktif fikosianin dan polisakarida Spirulina larut air diketahui dapat meningkatkan aktivitas pertahanan biologi melawan infeksi penyakit melalui peningkatan proliferasi sel darah merah, granulosit-monosit yang berasal dari sel-sel sum-sum tulang. Penelitian ini bertujuan untuk memproduksi fikosianin dari Spirulina platensis
dan mengkaji pemanfaatannya sebagai imunostimulan dalam meningkatkan sistem imun pada ikan kerapu bebek. Penelitian dibagi menjadi tiga (3) tahap penelitian : 1) Teknologi produksi, ekstraksi dan karakterisasi fikosianin Spirulina platensis, 2) Penentuan dosis pemberian fikosianin terbaik, 3) Lama pemberian fikosianin.
Penelitian pertama bertujuan untuk mengetahui kombinasi nutrien komersial teknis dan intensitas cahaya optimum yang memberikan pertumbuhan populasi Spirulina platensis dan kandungan fikosianin terbaik, serta penggunaan pelarut ekstraksi fikosianin terbaik. Penelitian terdiri dari dua tahap yaitu tahap pertama melakukan pengujian penggunaan kombinasi dua nutrien (modifikasi Kabinawa, KT dan modifikasi teknis, MT) dengan tiga intensitas cahaya berbeda (2000, 3000 dan 4000 lux). Tahap kedua, pengujian ekstraksi fikosianin dengan menggunakan tiga pelarut berbeda yaitu air, 0.1 M Na buffer fosfat dan 1% CaCl2.
Setiap perlakuan diulang 3 kali. Dari data diperoleh bahwa pertumbuhan populasi
Penelitian kedua bertujuan untuk melihat pengaruh pemberian fikosianin pada pertumbuhan, peningkatan respons imun non spesifik dan resistensi juvenil ikan kerapu bebek, Cromileptes altivelis terhadap Vibrio alginolyticus. Berat awal ikan kerapu bebek yang digunakan adalah 8.46 ± 0.22 g dengan kepadatan 10 ekor per wadah (56 L). Ikan kerapu bebek diberi pakan dengan penambahan fikosianin sebesar 0, 150, 250, 350 dan 450 mg kg-1 pakan dan dipelihara selama 28 hari. Uji tantang dilakukan dengan menginfeksi bakteri V. alginolyticus 0.1 mL/ekor secara
intra peritoneal menggunakan dosis LD50 3.26x108 cfu mL-1. Setiap perlakuan
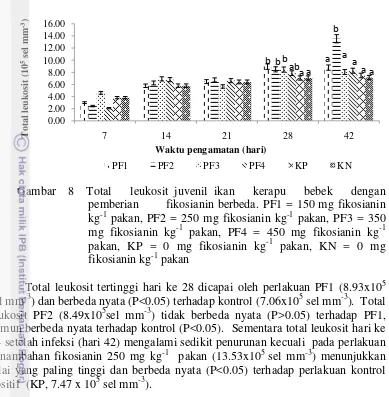
diulang tiga kali. Penambahan fikosianin 250 mg kg-1 pakan memberikan berat akhir (Wt=14.32g), laju pertumbuhan harian (SGR=1.89%) tertinggi, dan rasio konversi pakan (FCR=1.13) paling rendah dan berbeda nyata (P<0.05) terhadap kontrol. Total leukosit, hemoglobin, aktivitas fagositosis, aktivitas lisozim, protein, albumin dan globulin serum darah juvenil ikan kerapu bebek dengan pemberian fikosianin 250 mg kg-1 pakan memberikan hasil lebih tinggi daripada kontrol yaitu 8.49x105 sel mm-3, 5.7 g%, 59.67%; 0.97 OD; 2.4 g dL-1, 0.98 g dL-1 dan 1.42 g dL-1 masing-masing. Nilai Relative Percent Survival (RPS) tertinggi dicapai pada perlakuan penambahan fikosianin 250 mg kg-1 pakan sebesar 81.83%. Penambahan fikosianin Spirulina 250 mg kg-1 pakan meningkatkan pertumbuhan, respon imun non spesifik dan daya tahan juvenil ikan kerapu bebek terhadap infeksi V. alginolyticus.
Penelitian ketiga bertujuan untuk mengetahui pengaruh lama pemberian fikosianin Spirulina terhadap respons imun non spesifik dan daya tahan juvenil ikan kerapu bebek, Cromileptes altivelis terhadap infeksi bakteri V. alginolyticus. Ikan dengan berat awal 5.24 ± 0.48 g dipelihara dengan kepadatan 15 ekor per wadah pemeliharaan (60 L). Ikan dibagi menjadi tujuh kelompok perlakuan, lima kelompok ikan diberi pakan dengan penambahan fikosianin 250 mg kg-1 selama 7 hari, 7 hari berselang-seling, 14 hari, 21 hari, 28 hari dan dua kelompok lagi diberi pakan basal (kontrol) dengan tiga ulangan. Setelah 28 hari pemeliharaan, ikan selanjutnya diinfeksi dengan V. alginolyticus dengan dosis LD50 4.02x108 cfu
mL-1 sebanyak 0.1 mL/ekor. Total eritrosit, leukosit, hemoglobin, hematokrit, aktivitas fagositosis, aktivitas lisozim lebih tinggi pada perlakuan dengan penambahan fikosianin selama 14 hari berturut-turut yaitu 12.90x105 sel mm-3, 5.84x105 sel mm-3, 4.40 g%, 12.41% , 58.0%, dan 1.05 (OD) masing-masing dan berbeda nyata (P<0.05) terhadap kontrol. Nilai RPS tertinggi diperoleh pada perlakuan penambahan fikosianin selama 14 hari berturut-turut yaitu sebesar 85.71%. Hasil ini menunjukkan bahwa pemberian fikosianin Spirulina 250 mg kg-1 pakan selama 14 hari berturut-turut meningkatkan respons imun non spesifik dan resistensi juvenil ikan kerapu bebek, C.altivelis terhadap V. alginolyticus.
Secara keseluruhan dapat disimpulkan bahwa produksi fikosianin dapat dilakukan dengan kultur Spirulina platensis menggunakan nutrien teknis MT dan hasil ekstraksi fikosianin dapat digunakan sebagai imunostimulan. Pemberian fikosianin 250 mg kg-1 pakan dapat meningkatkan pertumbuhan dan respons imun non spesifik juvenil ikan kerapu bebek. Aplikasi pemberian fikosianin dengan dosis 250 mg kg-1 pakan selama 14 hari cukup efektif dan efisien dalam meningkatkan produksi juvenil ikan kerapu bebek.
Kata kunci: Cromileptes altivelis, fikosianin, imun non spesifik, pertumbuhan,
SUMMARY
WORO HASTUTI SATYANTINI Production Technology and Utilization of Phycocyanin of Spirulina platensis as an Immunostimulant in Humpback Grouper (Cromileptes altivelis). Under direction of SUKENDA, ENANG HARRIS and NUR BAMBANG PRIYO UTOMO.
Ministry of Marine Affairs and Fisheries Republic of Indonesia has targeted the grouper production as much as 9,000 tonnes of grouper in 2011 from 7,000 tonnes in 2010. Problems arise with the more intensive cultivation of grouper that lead to failure of production is precense of disease attack. Vibriosis is fish disease that can lead to failure in the production of grouper. The use of chemotherapeutics and antibiotics for prophylaxis have been prohibited by government because of negative impact to the environment and bacteria resistant. Giving an immunostimulant from natural plants microalgae is one way that can be used to resolve the problem reducing the failure rate due to this infectious disease. Phycocyanin bioactive and water soluble polysaccharide of Spirulina may enhance biological defence activity against infectious diseases through enhancement of proliferation of erythrocyte, granulocyte-monocyte that comes from bone marrow. This study aims to produce phycocyanin from Spirulina platensis and assess its utilization as an immunostimulant to improve the immune system of grouper. This research divided into three steps of study: 1) Production technology, extraction and phycocyanin characterization of Spirulina platensis, 2) Determination of the best dose of phycocyanin administration, and 3) Term of phycocyanin administration.
The first research was to determine the combination of technical nutrient and the optimum light intensity for the best population growth and phycocyanin content, and used of the best phycocyanin extraction solvent. The research divided into two steps of experiment; first experiment used Kabinawa modification (KT) and technical modification (MT) nutrients with different of light intensity (2000, 3000 and 4000 lux). The second experiment utilized different phycocyanin extraction solvent water, 0.1 M Na phosphate buffer and 1% CaCl2. Each
treatment was triplicates. Data showed the best population growth was gained on day 12th in the combination of MT nutrients and 3000 lux light intensity (MT3) was 0.611 OD. The highest phycocyanin content obtained at the exponential stage of KT2 treatment at 12th but not significantly different (p>0.05) from the treatment of MT3 and KT4. The phycocyanin extract solvent of 0.1 M Na phosphate buffer resulted in yield and highest purity levels of phycocyanin compared to the other two solvents. Protein content and molecular weight of two fractions protein phycocyanin result of SDS-PAGE were 26.64%, 19.23 and 63.32 kDa, respectively. This research showed that for the mass production of Spirulina
can be use the combination of technical nutrient MT with 3000 lux light intensity and 0.1 M Na phosphate buffer is the best solvent for phycocyanin extraction as an immunostimulant.
The second research was to examine the effect of administration of
juveniles to Vibrio alginolyticus infection. Initial body weight of grouper was 8.46±0.22 g with the density of 10 fish per container (56 L). The humpback grouper was fed with the addition of phycocyanin at 0, 150, 250, 350 and 450 mg kg-1 diet and reared for 28 days. Challenge test performed by infecting V. alginolyticus bacteria with dose 3.26x108 cfu mL-1, via intraperitoneal injection of 0.1 mL/fish. Each treatment was triplicates. The highest of final weight (Wt=14.32 g), specific growth rate (SGR=1.89%), and lowest of feed conversion ratio (FCR=1.13) was gained in fish addition at 250 mg phycocyanin kg-1 diet and significantly different (P <0.05) to the control. Total leucocytes, haemoglobin, hematocrit, phagocytic activity, lysozyme activity, serum protein, albumin and globulin increased in phycocyanin supplemented in diet. Administration of phycocyanin 250 mg kg-1 diet resulted in higher total leucocytes, haemoglobin, phagocytic activity, lysozyme activity, blood serum protein, albumin and globulin were 8.49x105 cells mm-3, 5.7 g%, 59.67%, 0.97 OD, 2.4 g dL-1,0.98 g dL-1 and 1.42 g dL-1 respectively compared to the control. The highest Relative Percent Survival (RPS) value was achieved at addition of phycocyanin 250 mg kg-1 diet was 81.83%. Dietary Spirulina phycocyanin at 250 mg kg-1 diet enhances growth, non-specific immune responses and diseases resistance in humpback grouper juvenile against V. alginolyticus infection.
The third experiment was to determine different term of administration on non-specific immune responses and resistance of humpback grouper, Cromileptes altivelis juveniles to V. alginolyticus bacteria infection. Fish with initial body weight of 5.24 ± 0.48 g were reared with a density 15 fish per vessel (60 L). Fish were divided in seven groups, five groups of fish fed with the addition of phycocyanin 250 mg kg-1 diet for 7 days; 7 days intermittent; 14 days; 21 days; 28 days and the remaining group was fed the basal feed (control) for 28 days. After 28 days rearing, fish are challenged with V. alginolyticus via intraperitoneal injected with dose 4.02x108 cfu mL-1 of 0.1 mL/fish. Total erythrocytes, leukocytes, haemoglobin, haematocrit, phagocytic activity, lysozyme activity was higher in the treatment with the addition of phycoacyanin for 14 days were 12.90x105 cells mm-3, 5.84x105 cells mm-3, 4.40g%, 12.41%, 58.0%, and 1.05 OD respectively and significantly different (P <0.05) to the control. The highest RPS (Relative Percent Survival) was achieved at addition 250 mg phycocyanin kg-1 diet for 14 days consecutive was 85.71%. This result suggested that the administration of Spirulina phycocyanin at 250 mg kg-1 diet for 14 days enhancement of non-specific immune response, and disease resistance in humpback grouper C. altivelis juvenile against V. alginolyticus.
In summary it can be concluded that the production of phycocyanin can be done by culturing Spirulina platensis using technical nutrient MT and the phycocyanin extract can be applied as an immunostimulant. The administration phycocyanin at 250 mg kg-1 diet increase the growth and non-specific immune response of humpback grouper juvenile. The application of phycocyanin administration at 250 mg kg-1 diet for the 14 consecutive days was effectively and efficiently increasing the production of humpback grouper juvenile.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Ilmu Akuakultur
TEKNOLOGI PRODUKSI FIKOSIANIN
Spirulina platensis
DAN PEMANFAATANNYA SEBAGAI IMUNOSTIMULAN
PADA IKAN KERAPU BEBEK (
Cromileptes altivelis
)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Penguji pada Ujian Tertutup: 1. Dr.Ir. Zafril Imran Azwar, M,Sc.
Peneliti pada Pusat Penelitian dan Pengembangan Perikanan Budidaya
Kementrian Kelautan dan Perikanan RI
2. Dr.Ir. Munti Yuhana, M.Si.
Staf Pengajar Departemen Budidaya Perairan Fakultas Perikanan dan Ilmu Kelautan, IPB
Penguji pada Ujian Terbuka: 1. Dr.drh. Angela Mariana Lusiastuti, M.Si.
Peneliti pada Balai Penelitian dan Pengembangan Budidaya Air Tawar
Kementrian Kelautan dan Perikanan RI 2. Dr.Ir. Mia Setiawati, M.Si.
Judul Disertasi : Teknologi Produksi Fikosianin Spirulina platensis dan Pemanfaatannya Sebagai Imunostimulan Pada Ikan Kerapu Bebek (Cromileptes altivelis)
Nama : Woro Hastuti Satyantini
NIM : C161090011
Disetujui oleh Komisi Pembimbing
Dr.Ir. Sukenda, MSc Ketua
Prof.Dr.Ir. Enang Harris, MS Anggota
Dr.Ir. Nur Bambang PU, MS Anggota
Diketahui oleh
Ketua Departemen Budidaya Perairan
Dr.Ir. Sukenda, MSc
Dekan Sekolah Pascasarjana
Dr.Ir. Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Mei 2011-Nopember 2012 ini adalah “Teknologi Produksi Fikosianin Spirulina platensis dan Pemanfaatannya Sebagai Imunostimulan Pada Ikan Kerapu Bebek, Cromileptes altivelis”. Disertasi ini disusun sebagai salah satu syarat untuk memperoleh gelar Doktor di Program Studi Ilmu Akuakultur, Sekolah Pascasarjana, Institut Pertanian Bogor.
Penulis menyadari sepenuhnya bahwa proses penelitian dan penulisan disertasi ini tidak akan dapat berjalan lancar tanpa dukungan banyak pihak, sehingga pada kesempatan ini penulis mengucapkan terima kasih kepada Dr.Ir. Sukenda, M.Sc; Prof.Dr.Ir. Enang Harris, MS; Dr.Ir. Nur Bambang Priyo Utomo, MS selaku komisi pembimbing atas waktu, saran dan masukannya mulai dari penyusunan proposal, penelitian dan penulisan disertasi. Penulis juga mengucapkan terima kasih kepada Dr.Ir. Zafril Imran Azwar, M.Sc dan Dr.Ir. Munti Yuhana, M.Si. selaku penguji luar komisi pada ujian tertutup, Dr.drh. Angela Mariana Lusiastuti, M.Si. dan Dr.Ir. Mia Setiawati, M.Si. selaku penguji luar komisi pada ujian terbuka atas saran yang diberikan.
Terima kasih penulis ucapkan kepada Dekan Sekolah Pascasarjana IPB, Dekan Fakultas Perikanan dan Ilmu Kelautan IPB, Ketua Program Studi Ilmu Akuakultur dan Ketua Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan IPB serta semua staf pengajar dan administrasi atas berkenannya saya diterima sebagai mahasiswa IPB, mendapat pelayanan, fasilitas pendidikan dan pengajaran yang baik. Terima kasih kepada Rektor Universitas Airlangga dan Dekan Fakultas Perikanan dan Ilmu Kelautan, Universitas Airlangga yang telah memberikan kesempatan kepada penulis untuk mengikuti pendidikan Program Doktor di IPB. Terima kasih kepada Direktorat Jenderal Pendidikan Tinggi, Kementerian Pendidikan dan Kebudayaan Republik Indonesia atas beasiswa Biaya Pendidikan Pasca Sarjana (BPPS) dan Program Sandwich-Like S3 Luar Negeri angkatan Tahun 2011 yang telah diberikan kepada penulis. Disamping itu, penghargaan penulis sampaikan kepada Prof. Shunsuke Koshio dan Prof. Manabu Ishikawa atas fasilitas laboratorium dan bimbingannya selama penulis mengikuti Program Sandwich-Like S3 di Laboratorium Nutrisi Hewan Akuatik, Fakultas Perikanan, Universitas Kagoshima, Jepang dalam rangkaian penyelesaian studi S3 di IPB Bogor. Penghargaan disampaikan juga kepada Kepala Laboratorium Bioteknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan IPB, Ir. Dwi Suharmanto, MM selaku Kepala Balai Budidaya Air Payau Situbondo dan Ir. I Made Yodriksa selaku Kepala Tata Usaha, Balai Budidaya Air Payau Situbondo atas ijin penggunaan fasilitas laboratorium dan tempat penelitian bagi penulis.
Hamzah, M.Si, Dr.Ir. Siti Subaidah, M.Si, Ir. Suciantoro M.Sc, Ir. Muhammad, M.Si, Ir. Rini M, M.Si, Ir. St.Hidayah T, M.Si, Ir. Rina M.Si. atas kebersamaan, masukan dan diskusinya selama ini dan semoga komunikasi ini tetap terjalin setelah kembali bertugas ke institusi masing-masing. Ungkapan terima kasih disampaikan kepada kedua orang tua (alm) tercinta, keluarga Ir. Harry Purwanto, Ir. Dwi Haryanto, G. Haryono, Sariyono, suami tercinta Triyono Winaryanto SE, dan anak-anak tercinta Dizza Ramadhan, Fabio Brestianto dan Dayanara Satyadhanti atas doa, kasih sayang, kesabaran dan motivasi yang selalu memberikan semangat.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2013
DAFTAR ISI
DAFTAR TABEL xv
DAFTAR GAMBAR xvii
DAFTAR LAMPIRAN xix
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 5
Manfaat Penelitian 5
Ruang Lingkup Penelitian 5
Hipotesis Penelitian 6
Kebaruan (Novelty) 6
2 TINJAUAN PUSTAKA 7 3 METODE 13 Tempat dan Waktu Penelitian 13 Bahan 13 Parameter yang Diamati 13 Analisis Data 16 4 TEKNOLOGI PRODUKSI, EKSTRAKSI DAN KARAKTERISASI 18 FIKOSIANIN Spirulina platensis SEBAGAI BAHAN IMUNOSTIMULAN Pendahuluan 19
Bahan dan Metode 20
Hasil 24 Pembahasan 29
Simpulan 32
Saran 32
5 PENINGKATAN RESPONS PERTUMBUHAN, IMUN NON 33
SPESIFIK DAN RESISTENSI JUVENIL IKAN KERAPU BEBEK, Cromileptes altivelis DENGANPEMBERIAN FIKOSIANIN Spirulina Pendahuluan 34 Bahan dan Metode 35
Hasil 40
Pembahasan 53 Simpulan 62 Saran 62
6 RESPONS IMUN NON SPESIFIK DAN RESISTENSI JUVENIL 63
IKAN KERAPU BEBEK, Cromileptes altivelis TERHADAP Vibrio alginolyticus DENGAN LAMA PEMBERIAN FIKOSIANIN BERBEDA Pendahuluan 64
Bahan dan Metode 65
Pembahasan 75
Simpulan 79
Saran 79
7 PEMBAHASAN UMUM 80
8 SIMPULAN DAN SARAN 84
DAFTAR PUSTAKA 85 LAMPIRAN 93
DAFTAR TABEL
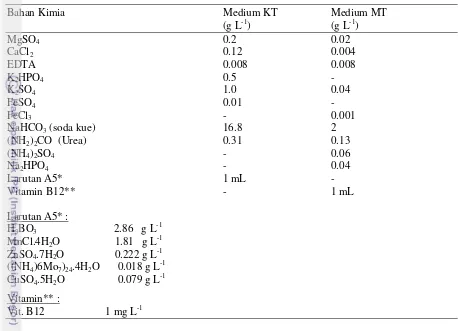
Halaman 1 Komposisi medium modifikasi Kabinawa (KT) dan modifikasi
medium teknis (MT) 21
2 Kandungan ekstrak kasar fikosianin Spirulina platensis pada fase
eksponensial akhir dan stasioner 25
3 Data kualitas air media kultur Spirulina platensis selama
pemeliharaan 26
4 Produksi kultur massal Spirulina platensis dengan nutrien berbeda
dan kualitas air media kultur selama pemeliharaan 26 5 Hasil ekstraksi fikosianin dengan menggunakan beberapa
pelarut berbeda 27
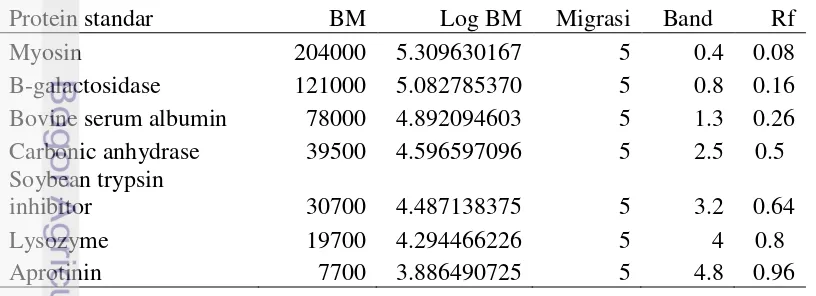
6 Hubungan berat molekul protein standar dengan migrasi relatif
(Rf) 28
7 Berat molekul protein fikosianin Spirulina platensis 29 8 Susunan dan kandungan asam amino fikosianin Spirulina platensis
dengan menggunakan analisa HPLC 36
9 Komposisi pakan basal ikan kerapu bebek 37
10 Hasil analisa proksimat pakan juvenil ikan kerapu bebek yang diberi
penambahan fikosianin pada pakan 38
11 Berat akhir (Wt), laju pertumbuhan harian (SGR), rasio konversi pakan (FCR) dan tingkat kelangsungan hidup juvenil ikan kerapu
bebek (SR) (sebelum infeksi V. alginolyticus) 40 12 Perubahan biokimia darah juvenil ikan kerapu bebek dengan
pemberian fikosianin berbeda 47
13 Tingkat Relative Percent Survival (RPS) juvenil ikan kerapu bebek
yang diuji tantang dengan V. alginolyticus 49
14 Hasil uji morfologi dan biokimia bakteri yang diisolasi dari organ
ginjal dan hati juvenil ikan kerapu bebek pada saat uji tantang 51 15 Lama pemberian pakan dengan dan tanpa penambahan fikosianin
Spirulina pada juvenil ikan kerapu bebek. C. altivelis 66 16 Protein, albumin dan globulin serum juvenil ikan kerapu bebek pada
pemberian fikosianin dengan lama pemberian berbeda 73 17 Tingkat Relative Percent Survival (RPS) juvenil ikan kerapu bebek
yang diuji tantang V. alginolyticus dengan lama pemberian fikosianin berbeda
DAFTAR GAMBAR
Halaman
1 Alur kerangka pemikiran penelitian 4
2 Struktur fikosianin 8
3 Alur pelaksanaan penelitian Teknologi produksi fikosianin Spirulina platensis dan pemanfaatannya sebagai imunostimulan pada ikan
kerapu bebek (Cromileptes altivelis) 17
4 Pertumbuhan populasi Spirulina platensis pada kombinasi nutrien
dan intensitas cahaya berbeda 24
5 SDS-PAGE fikosianin Spirulina platensis 28
6 Regresi antara berat molekul protein standar dengan migrasi
relatif (Rf) 29
7 Total eritrosit juvenil ikan kerapu bebek dengan pemberian fikosianin
berbeda 41
8 Total leukosit juvenil ikan kerapu bebek dengan pemberian
fikosianin berbeda 42
9 Diferensial leukosit A=monosit, B=limfosit, C=neutrofil juvenil ikan
kerapu bebek dengan pemberian fikosianin berbeda 43 10 Hemoglobin juvenil ikan kerapu bebek dengan pemberian fikosianin
berbeda 44
11 Persentase hematokrit juvenil ikan kerapu bebek dengan pemberian
fikosianin berbeda 45
12 Aktivitas fagositosis juvenil ikan kerapu bebek dengan pemberian
fikosianin berbeda 45
13 Nitroblue tetrazolium (NBT) juvenil ikan kerapu bebek dengan
pemberian fikosianin berbeda 46
14 Aktivitas lisozim juvenil ikan kerapu bebek dengan pemberian
fikosianin berbeda 47
15 Kematian kumulatif juvenil ikan kerapu bebek pada perlakuan infeksi
V.alginolyticus 48
16 Tingkah laku juvenil ikan kerapu bebek setelah infeksi V. alginolyticus
49
17 Tanda-tanda makroskopis juvenil ikan kerapu bebek terinfeksi V. alginolyticus
18 Kultur bakteri hasil isolasi dari organ ginjal dan hati juvenil ikan
kerapu bebek pada media TCBS dan TSA 50
19 Histopatologi kerusakan organ ginjal juvenil ikan kerapu bebek yang
terinfeksi V. alginolyticus 52
20 Histopatologi kerusakan organ hati dan limpa juvenil ikan kerapu
bebek yang terinfeksi V. alginolyticus 53
21 Total eritrosit juvenil ikan kerapu bebek yang diberi fikosianin
dengan lama pemberian berbeda 67
22 Total leukosit juvenil ikan kerapu bebek yang diberi fikosianin
dengan lama pemberian berbeda 68
23 Diferensial leukosit juvenil ikan kerapu bebek yang diberi fikosianin
Spirulina dengan lama pemberian berbeda 69
24 Hemoglobin juvenil ikan kerapu bebek yang diberi fikosianin
Spirulina dengan lama pemberian berbeda 70
25 Aktivitas fagositosis juvenil ikan kerapu bebek yang diberi fikosianin
Spirulina dengan lama pemberian berbeda 71
26 NBT juvenil ikan kerapu bebek yang diberi fikosianin dengan lama
pemberian berbeda 72
27 Aktivitas lisozim juvenil ikan kerapu bebek yang diberi fikosianin
dengan lama pemberian berbeda 72
28 29
Kematian kumulatif juvenil ikan kerapu bebek setelah infeksi
V. alginolyticus dengan lama pemberian fikosianin berbeda
Mekanisme fikosianin dalam meningkatkan respons imun non spesifik dan pertumbuhan juvenil ikan kerapu bebek
74
DAFTAR LAMPIRAN
Halaman
1 Prosedur kerja pengukuran beberapa parameter 93
2 Pertumbuhan populasi dan berat kering rata-rata Spirulina platensis 96 3 Ekstraksi fikosianin Spirulina platensis dengan beberapa pelarut
berbeda (air, sodium buffer fosfat dan 1% CaCl2)
97
4 Ekstrak fikosianin Spirulina platensis setelah didialis dan dikering bekukan
98
5 Pengukuran kadar protein fikosianin (Analisa Bradford) dengan menggunakan alat spektrofotometer UV Vis
98
6 Komposisi vitamin mix dan mineral mix pakan uji 99
7 Gambaran darah juvenil ikan kerapu bebek 100
8 Tingkah laku juvenil ikan kerapu bebek selama uji tantang dengan V. alginolyticus
100
9 Tes API 20E terhadap bakteri yang menginfeksi juvenil ikan kerapu bebek
PENDAHULUAN
Latar Belakang
Ikan kerapu bebek, Cromileptes altivelis merupakan salah satu jenis ikan kerapu yang memiliki nilai ekonomi tinggi. Negara-negara yang menjadi tujuan ekspor jenis ikan ini diantaranya China dan Hongkong. Permintaan dari China dan Hongkong terus meningkat. Direktur Pemasaran Luar Negeri Ditjen Pengolahan dan Pemasaran Hasil Perikanan, Kementerian Kelautan dan Perikanan di sela Workshop International APEC Fisheries Working Group, di Denpasar, menyampaikan bahwa permintaan ikan karang hidup sejak 1998 terus meningkat, bahkan nilai ekspor 2009 sesuai data Biro Pusat Statistik (BPS), mencapai USD 50,7 juta, melonjak menjadi USD 100 juta pada akhir 2010 (KKP 2011). Tahun 2011 Kementrian Kelautan dan Perikanan mentargetkan produksi ikan kerapu sebanyak 9000 ton dari tahun 2010 sebesar 7000 ton sebelumnya (KKP 2011). Ikan jenis ini telah dapat dibudidayakan di karamba jaring apung (KJA). Ikan kerapu biasanya diekspor dalam keadaan hidup, karena harga kerapu hidup lebih tinggi dibandingkan harga ikan kerapu beku. Harga ikan kerapu bebek hidup dengan ukuran konsumsi bisa mencapai Rp. 500,000,- per kilogram. Ikan kerapu bebek berukuran panjang total 5-10 cm berharga sekitar Rp. 8000,- sampai Rp. 15000,-/ekor (Balai Besar Pengembangan Budidaya Air Laut, BBPBAL Lampung, 2011, komunikasi pribadi).
Permintaaan dan nilai jual ikan kerapu cukup tinggi di Hongkong. Namun, peningkatan permintaan ikan kerapu tidak selalu diiringi dengan peningkatan produksi (Kompas 2011). Rendahnya produksi ini diakibatkan tingginya tingkat kematian pada ikan kerapu. Kematian tinggi pada ikan kerapu dikarenakan masalah lingkungan seperti kondisi kualitas air jelek yang mengakibatkan ikan stres dan mudah terserang penyakit. Ikan kerapu mudah sekali mengalami stres akibat penangananan yang kurang tepat dan ikan dapat terinfeksi bakteri. Bakteri Gram negatif, khususnya Vibrio parahaemolyticus dan V. alginolyticus, menyebabkan septisemia hemorargi pada ikan kerapu dalam pemeliharaan sistem pembenihan dan pembesaran (Punitha et al. 2008). Stresor lingkungan mengakibatkan daya imunitas ikan menurun sehingga rentan terhadap penyakit. Infeksi bakteri patogen menjadi penyebab utama terjadinya kematian.
2
Spirulina adalah salah satu jenis mikroalga dari kelompok cyanophyceae yang dikarakterisasi dengan bentuk trichome yang tersusun secara spiral.
Spirulina platensis merupakan kelompok alga hijau biru yang dapat dimakan, karena kaya akan protein, vitamin, mineral dan asam lemak esensial. Spirulina platensis biasanyadigunakan untuk pakan larva ikan ataupun non ikan. Spirulina
mengandung protein tinggi (hingga 65% berat kering), sejumlah asam lemak baik (Gamma linolenic acid, GLA), polisakarida, fikobiliprotein, karotenoid, vitamin (khususnya vitamin B12) dan mineral, membuat Spirulina dibutuhkan sebagai sumber makanan (Hu 2004; Kozenko dan Henson 2010; Capelli dan Cysewski 2010).
Fikobiliprotein adalah protein antena fotosintesis yang diketemukan dalam cyanobacteria dan beberapa Rhodophyta, Cryptophyta dan Dinoflagelata (Tomaselli 2004). Fikobiliprotein khususnya fikosianin (PC) dari cyanobacteria memiliki kemampuan anti oksidatif (Estrada et al. 2001; Benedetti et al. 2004; Eriksen 2008; McCarty 2007), aktivitas pemangsaan radikal (McCarty 2007), anti inflamasi (Romay et al. 2003; Jensen et al. 2001; McCarty 2007), anti tumor (Jensen et al. 2001).
Fikosianin merupakan pigmen biru yang dimiliki oleh alga hijau biru
Spirulina platensis. Fikosianin merupakan pigmen utama pada cyanobacteria sebagai pigmen penerima cahaya dalam fotosintesa, terutama fotosistem II (PS II) (Lips dan Avissar 1986). Fikosianin digunakan untuk pewarna makanan dan neutrasetikal (Ciferri 1983; Benedetti et al. 2004). Didalam sel Spirulina
mengandung pigmen karotenoid, khlorofil dan fikosianin sebesar 0.4, 1.0 ( Belay 1997) dan 14 % (Belay 1997; McCarty 2007) masing-masing dari berat kering.
Menurut Kozenko dan Henson (2010), fikosianin mempengaruhi sel stem
dalam sum-sum tulang. Sel stem adalah sel induk baik sel darah putih yang membuat sistem imun seluler maupun sel darah merah yang mengoksigenasi tubuh. Ilmuwan Cina mencatat fikosianin sebagai penstimulasi hematopoiesis, mempengaruhi hormon erythropoetin (EPO). EPO diproduksi oleh ginjal yang sehat dan mengatur sel stem sum-sum tulang memproduksi sel-sel darah merah. Ilmuwan Cina mengklaim fikosianin juga mengatur produksi sel-sel darah putih meskipun sel stem sum-sum tulang rusak akibat bahan kimia toksik atau radiasi (seperti yang terjadi di Chernobyl).
Bioaktif fikosianin dan polisakarida Spirulina larut dalam air bertanggung jawab untuk meningkatkan aktivitas pertahanan biologi melawan infeksi penyakit dan menurunkan inflamasi alergi melalui fungsi sistem kekebalan mukosa secara terus menerus (Balachandran et al. 2006). Komponen ini dilaporkan juga karena pengaturan imun melalui peningkatan proliferasi sel darah merah, granulosit-monosit dan sel-sel turunan fibroblast (serabut) yang berasal dari sel-sel sum-sum tulang tikus (Hayashi et al. 2006). Kultur supernatan sel limpa tikus yang distimulasi dengan fikosianin atau dinding sel Spirulina khususnya, meningkatkan pembentukan koloni sel-sel sum-sum tulang, mengandung GM-CSF (Granulocyte Macrophage Colony Stimulating Factor) dan interleukin-3 (IL-3) yang tinggi (Hayashi et al. 2006).
3 imunostimulan belum banyak dilakukan di Indonesia yang potensi lautnya cukup tinggi. Oleh karena itu penelitian tentang pemanfaatan bioaktif fikosianin
Spirulina sebagai peningkat daya tahan tubuh (imunitas) ikan dan aktivitas pendorong pertumbuhan sel, perlu untuk dilakukan. Diharapkan dengan mengaplikasi penambahan fikosianin pada pakan dalam pemeliharaan benih ikan kerapu dapat menekan atau meniadakan penggunaan bahan kimia maupun antibiotik.
Perumusan Masalah
Permasalahan yang dihadapi dalam pengembangan budidaya ikan kerapu di Indonesia adalah tingkat kelangsungan hidup rendah karena serangan penyakit yang salah satunya diakibatkan oleh bakteri Vibrio (Murdjani et al. 2004; Punitha
et al. 2008; Desrina et al. 2006; Sarjito et al. 2007). Bakteri patogen yang menyebabkan kematian tinggi pada pembenihan (100% dalam waktu 2 minggu) (Desrina et al. 2006) dan pembesaran ikan kerapu berhubungan dengan pengelolaan yang kurang baik, kondisi kualitas air yang jelek dan kualitas pakan yang kurang baik.
Ikan kerapu mudah sekali mengalami stres akibat penanganan yang kurang tepat dan ikan mudah terinfeksi bakteri apabila berada dalam kondisi stres dan lemah. Bakteri Gram negatif khususnya V. parahaemolyticus dan V. alginolyticus, menyebabkan perdarahan septisemia pada ikan kerapu yang dipelihara pada sistem pendederan dan pembesaran di karamba jaring apung (Murdjani 2002; Punitha et al. 2008; Murdjani et al. 2004;).
Berbagai upaya penanggulangan penyakit pada budidaya ikan kerapu termasuk penggunaan obat-obatan dan antibiotik dan bahan kimia telah dilakukan, namun penggunaan antibiotik saat ini mulai dilarang, karena dapat menimbulkan permasalahan baru yaitu timbulnya resistensi bagi bakteri, residu dan keamanan pangan. Dampak dari bakteri resisten antibiotik terhadap kesehatan manusia menjadi perhatian internasional dalam beberapa tahun ini. Bakteri resisten ini dapat berpindah dari hewan ke manusia lewat rantai makanan (Yuan et al., 2007).
Agar kegiatan budidaya kerapu mencapai target produksi yang diharapkan, maka dibutuhkan benih dengan kuantitas dan kualitas yang baik. Salah satu upaya yang dilakukan adalah meminimalkan serangan penyakit pada masa pemeliharaan benih agar tidak terjadi kematian yang cukup tinggi dengan mengaplikasikan penambahan fikosianin Spirulina melalui pakan buatan untuk meningkatkan imunitas ikan.
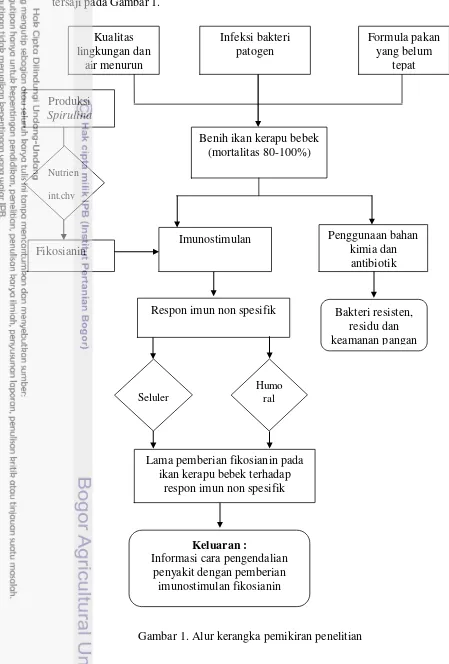
4
non spesifik pada juvenil ikan kerapu bebek. Alur kerangka pemikiran penelitian tersaji pada Gambar 1.
Gambar 1. Alur kerangka pemikiran penelitian Infeksi bakteri
patogen Kualitas
lingkungan dan air menurun
Formula pakan yang belum
tepat
Respon imun non spesifik
Lama pemberian fikosianin pada ikan kerapu bebek terhadap
respon imun non spesifik
Benih ikan kerapu bebek (mortalitas 80-100%)
Penggunaan bahan kimia dan
antibiotik Imunostimulan
Produksi
Spirulina
Nutrien
int.chy
Fikosianin
Keluaran :
Informasi cara pengendalian penyakit dengan pemberian
imunostimulan fikosianin
Bakteri resisten, residu dan keamanan pangan
Seluler
5 Tujuan Penelitian
Penelitian ini bertujuan untuk menghasilkan fikosianin dari Spirulina platensis yang dikultur dengan menggunakan nutrien teknis secara massal dan dapat diaplikasikan pada pemeliharaan benih ikan kerapu bebek dalam upaya meningkatkan sistem imun non spesifik ikan. Secara khusus penelitian ini bertujuan untuk :
1. Memproduksi fikosianin dari Spirulina platensis yang dikultur dengan nutrien teknis dan intensitas cahaya optimum.
2. Mengevaluasi peningkatan sistem pertahanan non spesifik ikan kerapu bebek (C. altivelis) dari pemberian fikosianin dengan dosis berbeda. 3. Mengevaluasi lama pemberian fikosianin terbaik terhadap peningkatan
sistem imun non spesifik ikan kerapu bebek (C. altivelis).
Manfaat Penelitian
Hasil penelitian pemberian fikosianin Spirulina platensis dapat menjadi salah satu pemecahan masalah akibat dilarangnya penggunaan antibiotik dalam menanggulangi serangan penyakit pada ikan kerapu. Dengan penggunaan bahan alami ini diharapkan tidak ada dampak negatif terhadap lingkungan pemeliharaan ikan kerapu.
Ruang Lingkup Penelitian
Secara umum ruang lingkup disertasi ini adalah sebagai berikut :
1. Menentukan kombinasi nutrien teknis dan intensitas cahaya yang optimum yang mampu meningkatkan pertumbuhan populasi dan berat kering Spirulina platensis,
2. Menentukan waktu panen terbaik untuk mendapatkan populasi dan fikosianin tertinggi pada masa kultur S. platensis,
3. Menentukan pelarut terbaik untuk menghasilkan ekstraksi fikosianin dari S. platensis,
4. Melakukan karakterisasi dari ekstrak fikosianin yang dihasilkan dari ekstraksi
S. platensis,
5. Menentukan dosis pemberian fikosianin optimum yang mampu meningkatkan pertumbuhan dan respons imun non spesifik juvenil ikan kerapu bebek (Cromileptes altivelis),
6. Menguji respons imun non spesifik ikan kerapu bebek yang telah diberi penambahan fikosianin melalui pakan terhadap bakteri patogen V. alginolyticus,
7. Menentukan lama pemberian fikosianin optimum yang mampu meningkatkan respons imun non spesifik juvenil ikan kerapu bebek (C. altivelis),
6
Hipotesis Penelitian
Hipotesis yang diajukan dalam penelitian ini adalah :
1. Nutrien teknis dan intensitas cahaya optimum berbeda menghasilkan fikosianin berbeda.
2. Fikosianin dapat meningkatkan sistem imun non spesifik dan pertumbuhan ikan kerapu bebek (C. altivelis).
3. Lama pemberian fikosianin yang tepat memberikan peningkatan sistem imun non spesifik ikan kerapu bebek (C. altivelis) terbaik.
Kebaruan (novelty)
1. Teknologi aplikatif produksi fikosianin dari Spirulina platensis untuk imunostimulan ikan kerapu bebek (C. altivelis).
2. Metode pemberian fikosianin untuk meningkatkan pertumbuhan dan imun non spesifik pada ikan kerapu bebek (C. altivelis).
7
TINJAUAN PUSTAKA
Spirulina platensis
Spirulina adalah multiseluler Cyanobacteria berbentuk filamen. Cyanobacteria atau yang dikenal sebagai Cyanophyceae dalam terminologi mikroalga phycology mengarah kepada bakteri fotosintetik oksigen (Tomaselli 2004). Spirulina termasuk kedalam kelompok alga prokariot yang mengandung khlorofil a. Cyanophyceae disebut juga sebagai alga hijau biru, hal ini dikarenakan adanya fikosianin dan fikoeritrin yang memberi pewarnaan khlorofil (Tomaselli 2004).
Dinding sel tersusun dari murein (peptidoglikan) dengan lipopolisakarida pada lapisan terluarnya dan juga memiliki mucilagineous sheath. Sel dapat berbentuk single (tunggal) atau filamen. Sel-sel tunggal bergabung membentuk koloni yang diselaputi oleh a firm atau amorphous mucilage. Beberapa cyanobacteria bersifat planktonis melayang karena memiliki vakuola gas dan hampir semua bentuk filamen memiliki kemampuan bergerak memutar (gliding). Struktur dan organisasi sel Spirulina adalah bentuk khas Cyanobacteria. Cyanobacteria memiliki empat lapis dinding sel (Tomaselli 2004; Hu 2004) yang merupakan tipe bakteri gram negatif dengan lapisan utamanya adalah peptidoglikan.
Spirulina platensis berkembang biak secara aseksual dengan cara membelah diri. Siklus hidup Spirulina adalah cukup sederhana. Reproduksi terjadi melalui fragmentasi dari trichome yang matang menjadi beberapa segmen (potongan-potongan) pendek melalui pemutusan antar sel yang disebut necridia
(Richmond 1986).
Banyak faktor yang akan mempengaruhi fotosintesa yang akhirnya akan berpengaruh pada pertumbuhan mikroalga ini. Faktor utama yang mempengaruhi adalah nutrien, intensitas cahaya, temperatur, salinitas dan alkalinitas. Umumnya dalam ruang kultur intensitas cahaya yang dibutuhkan untuk mikroalga 500 – 5000 lux (Taw 1990 diacu dalam Diharmi 2001). Di bawah kondisi laboratorium, intensitas cahaya untuk pertumbuhan Spirulina platensis berkisar antara 150-200 µmol m-2 detik-1. Dari hasil penelitian Diharmi (2001), kandungan fikosianin
Spirulina tertinggi dicapai pada intensitas cahaya 3000 lux dengan lama penyinaran 16 jam (0.135mg L-1). Temperatur optimum untuk pertumbuhan
Spirulina berkisar antara 35-37oC.
Spirulina dapat tumbuh maksimum pada kisaran pH 9.5-9.8, dimana mikroorganisme lain sulit untuk tumbuh, ini merupakan kunci keberhasilan kultur monoalga Spirulina (Hu 2004). Richmond (1986) mengatakan bahwa pH 10.5 di
outdoor tidak membatasi petumbuhan Spirulina, tetapi pH 11 mengakibatkan pertumbuhan terbatas. Natrium bikarbonat dapat ditambahkan dalam medium untuk mengatur pH pada kultur Spirulina, kisaran pH optimum Spirulina berkisar 8.7 – 10 (Richmond 2004). Sumber nitrogen untuk kultur alga dapat diperoleh dari senyawa kalium nitrat (KNO3), natrium nitrat (NaNO3), ammonium nitrat
(NH4NO3), ammonium phospat (NH4)3PO4, ammonium sulfat (NH4)3SO4. Urea
8
Spirulina diketahui memiliki nilai nutrisi yang sangat menguntungkan dari kandungan proteinnya dan komponen-komponen lainnya seperti; vitamin (kuhususnya vitamin B12), polisakarida, fikobiliprotein (Hu, 2004), mineral dan
asam lemak esensial termasuk -linolenic acid, GLA (Belay et a.l. 199γ), dan -karoten (Hu 2004; Belay et al. 1993) yang menjadikan mikroalga ini diinginkan sebagai sumber makanan (Hu 2004). Spirulina aman dikonsumsi oleh manusia dan telah dibuktikan melalui sejumlah studi toksikologi. Spirulina telah dipertimbangkan menjadi modulasi dari sistem imun inang (Hirahasi et al. 2002). Estrak air panas Spirulina telah diberikan secara oral pada pasien sebagai bahan anti kanker dan anti virus meskipun aktivitas Spirulina pada sistem imun melalui mekanisme molekuler belum banyak diketahui (Hirahasi et al. 2002). Eksperimen mengenai fungsi immunomodulator Spirulina, dilaporkan pertama kali pada tikus sejak tahun 1994 (Hirahashi et al. 2002).
Fikosianin
Spirulina memiliki pigmen biru yang umum disebut fikosianin (Kozenko dan Henson 2010; Wang 2008; Richmond 1986; Eriksen 2008). Spirulina
mengakumulasi fikosianin dan khlorofil secara intraseluler. Fikosianin merupakan pigmen utama pada cyanobacteria sebagai pigmen penerima cahaya dalam fotosintesa, terutama fotosistem II (PS II) (Lips dan Avissar 1986).
Fikosianin termasuk fikosianin, R-fikosianin dan allofikosianin. C-fikosianin (C-PC) merupakan fikobiliprotein utama pada beberapa alga hijau biru. Alpha dan Beta adalah sub unit pigmen C-fikosianin. Sub unit alpha dan beta jumlahnya hampir sama. Jumlah alpha dan beta fikosianin bervariasi diantara spesies. Warna biru kuat pada alga hijau biru diakibatkan oleh fikosianin. Fikosianin menjalani fungsi sebagai penyimpan protein dan sebagai anti oksidan (Benedetti 2004).
Fikosianin merupakan pigmen biru yang secara struktural mirip dengan -karoten (Gambar 2). Pigmen protein ini sering digunakan dalam produk makanan dan kosmetik, karena warna birunya sangat kuat berpendar. Spirulina merupakan sumber fikobiliprotein yang baik sekali, kandungannya bisa mencapai 17% (Boussiba dan Richmond 1979), 20% dari berat kering (Becker 2004).
Gambar 2. Struktur fikosianin (Romay et al. 2003).
9 (fikoeritrobilin, fikosianobilin dan fikourobilin) yang linier dengan tetrapyrrol. Pigmen ini mengabsorbsi sinar hijau-biru, hijau, kuning atau orange (500-560 nm) (Masojidek et al. 2004). Biosintesis fikobiliprotein pada mikroalga Spirulina platensis sangat dipengaruhi oleh kondisi lingkungan tumbuhnya, seperti intensitas cahaya dan konsentrasi nitrogen dalam mediumnya (Kim 1991).
Kandungan pigmen bioaktif mikroalga sangat berkaitan dengan pertumbuhan sel dan kondisi lingkungannya seperti cahaya (Becker 1994). Secara fisiologis, cahaya mempunyai pengaruh langsung maupun tidak langsung. Pengaruh langsung adalah dalam proses metabolisme melalui proses fotosintesis serta pengaruh tidak langsung melalui pertumbuhan dan perkembangan.
Fikosianin dapat dijadikan sumber kehidupan bagi mahluk hidup dan merupakan prekursor bagi khlorofil dan hemoglobin karena mengandung Mg (Arlyza 2005) dan Fe (Hu 2004; Arlyza 2005). Selain itu, fikosianin mempengaruhi sel stem dalam sum-sum tulang. Sel stem adalah sel induk dari sel darah putih yang membuat sistem imun seluler dan sel darah merah yang memberi oksigen tubuh (Kozenko dan Henson 2010).
Spirulina dan bentuk ekstraknya, seperti ekstrak air panas dan fikosianin dapat meningkatkan fungsi imun termasuk imunitas mukosa dan imunitas non spesifik melalui makrofag (Liu et al. 2000; Nemoto-Kawamura et al. 2004; Belay 2002). Bioaktif fikosianin dan polisakarida Spirulina larut dalam air bertanggung jawab untuk meningkatkan aktivitas pertahanan biologi melawan infeksi penyakit dan menurunkan inflamasi alergi melalui fungsi sistem kekebalan mukosa secara terus menerus (Balachandran et al. 2006).
Beberapa studi melaporkan kemungkinan aplikasi fikosianin pada bidang farmasi, terutama sebagai bahan antioksidan dan anti inflamasi melalui berbagai percobaan secara in vitro dan in vivo (Estrada et al. 2001; Becker, 2004; Benedetti
et al. 2004; Eriksen 2008; McCarty 2007; Romay et al. 2003; Jensen et al. 2001). Dari hasil penelitian yang dilakukan Hayashi et al. (2006) menunjukkan bahwa ekstrak Spirulina : ekstrak air panas Spirulina, fikosianin dan dinding sel spirulina meningkatkan proliferasi sel-sel sum-sum tulang dan menginduksi aktivitas pembentukan koloni pada kultur supernatan sel limpa tikus.
Sistem Imun Ikan
Sistem pertahanan tubuh terbagi atas sistem pertahanan non spesifik dan spesifik (Baratawidjaja 2006). Pertahanan non spesifik merupakan pertahanan tubuh terdepan menghadapi serangan berbagai mikroorganisme, oleh karena dapat memberikan respons langsung terhadap antigen, sedangkan sistem pertahanan spesifik membutuhkan waktu untuk mengenal antigen terlebih dahulu sebelum dapat memberikan responsnya. Disebut sistem pertahanan non spesifik, karena tidak ditujukan terhadap mikroorganisme tertentu dan telah ada sejak lahir.
10
Peranan utama sistem imun alami (imun non spesifik) adalah sebagai pertahanan pertama inang dari serangan organisme patogen dan beberapa bahan asing sampai sistem imun adaptif (imun spesifik) muncul dan mengambil alih fungsi tersebut (Whyte 2007). Respons humoral merupakan respons spesifik (respons limfosit) timbul lebih lambat, sedangkan respons seluler bersifat non spesifik yang meliputi barier mekanik dan kimiawi (mukus, kulit, sisik, dan insang), sel makrofag, leukosit, sel Natural Killer (NK) (Baratawidjaja 2006). Mekanisme kerja respons tersebut saling menunjang, diantaranya melalui mediator limfokin dan sitokin. Sistem pertahanan ini diperlukan untuk proteksi tubuh terhadap serangan virus, bakteri, jamur dan parasit. Aktivitas respons imunitas tersebut dapat distimulasi oleh imunostimulator (Anderson 1992).
Respons imunitas dibentuk oleh jaringan limfoid, pada ikan jaringan limfoidnya menyatu dengan jaringan mieloid, sehingga dikenal sebagai jaringan limfomie-loid. Produk jaringan limfomieloid adalah sel-sel darah dan respons imunitas baik seluler maupun humoral. Sistem pertahanan ikan pada dasarnya sama dengan hewan mamalia (Iwama dan Nakanishi 1996). Sistem pertahanan seluler, ikan teleostei memiliki sel-sel makrofag, neutrofil, sel NK, sel T dan sel B. Ikan teleostei juga memiliki beberapa macam komponen sistem pertahanan humoral seperti: komplemen, lisozim, hemolisin alami, transferin dan C-reaktif protein (Sakai 1999). Beberapa tipe sel darah putih (leukosit) terlibat dalam pertahanan seluler ikan yaitu monosit/makrofag, granulosit dan sel-sel sitotoksi nonspesifik. Sel-sel sitotoksik non spesifik pada ikan sama fungsinya dengan sel NK. Makrofag dan granulosit adalah sel-sel fagosit yang banyak ditemukan dalam darah dan jaringan limfoid sekunder dan sangat penting dalam inflamasi (Secombes 1996).
Peningkatan kekebalan tubuh dapat diketahui dari peningkatan aktivitas sel fagosit dari hemosit. Sel fagosit (monosit dan makrofag) berperan sebagai sel yang menangkap antigen, mengolah dan selanjutnya mempresentasikan kepada sel T yang dikenal sebagai sel penyaji atau APC (Antigen Presenting Cell). Fagositosis yang efektif pada invasi kuman dini akan mencegah timbulnya infeksi. Dalam kerjanya, sel fagosit juga berinteraksi dengan komplemen dan sistem imun spesifik (Baratawidjaja 2006).
Fagosit mononuklear berasal dari sel progenitor umum sumsum tulang. Sesudah berproliferasi dan matang, sel tersebut masuk peredaran darah. Sel-sel monosit yang diproduksi dalam sumsum tulang akan masuk ke pembuluh darah. Setelah 24 jam, sel monosit akan bermigrasi dari peredaran darah ke tempat tujuan di berbagai jaringan untuk berkembang (berdiferensiasi) menjadi makrofag. Makrofag tersebut bukan bentuk stadium akhir, karena sel itu masih dapat membelah diri membentuk protein dan dapat hidup berbulan-bulan (Baratawidjaja 2006). Fungsi utama sel sistem fagositik mononuklear ini adalah melakukan fagositosis dan menghancurkan partikel asing dan jaringan mati, atau mengolah bahan asing sehingga bahan tersebut dapat membangkitkan tanggap kebal.
11 Mekanisme pertahanan tubuh yang sinergis antara pertahanan humoral dan seluler dimungkinkan oleh adanya interleukin, interferon dan sitokin. Anderson (1992) mengemukakan bahwa interleukin, interferon dan sitokin tersebut berperan sebagai komunikator dan amplikasi dalam mekanisme pertahanan humoral dan seluler ikan.
Imunostimulan
Imunostimulan merupakan senyawa kimia, obat atau bahan lainnya yang mampu meningkatkan mekanisme respons spesifik dan non spesifik ikan (Anderson 1992; Galeotti 1998). Pada mamalia, imunostimulan telah digunakan untuk meningkatkan respons imunitas baik seluler maupun humoral (Anderson 1992). Imunostimulan ini dapat diberikan sebelum, bersamaan atau setelah vaksinasi utuk memperbesar respons imun dengan peningkatan sirkulasi antibodi dan sejumlah sel pembentuk plak (plaque forming cells).
Imunostimulan penting untuk kesehatan sebagai pembangun mekanisme sistem pertahanan dan perlindungan melawan penyakit. Beberapa imunostimulan seperti ajuvan, bahan-bahan alami maupun sintetik dan bahan-bahan biologi telah diuji pada ikan secara in vitro dan in vivo. Beberapa bahan yang memiliki efek imunostimulator seperti glukan, chitin, lactoferin, levamisole, vitamin B, vitamin C, hormon pertumbuhan dan prolaktin telah banyak dilaporkan pada ikan dan udang (Sakai 1999).
Apabila masuk ke dalam tubuh ikan, imunostimulan akan merangsang makrofag untuk memproduksi interleukin yang akan menggiatkan sel limfosit yang kemudian membelah menjadi limfosit-T dan B. Limfosit-T memproduksi interferon yang meningkatkan kemampuan makrofag sehingga dapat memfagositosis bakteri, virus dan partikel asing lainnya yang masuk ke dalam tubuh ikan. Masuknya imunostimulan juga akan merangsang makrofag untuk memproduksi lisozim dan komplemen. Interleukin juga menggiatkan limfosit-B untuk memproduksi antibodi (Raa etal. 1992).
Kozenko dan Henson (2010) menyatakan bahwa ekstrak murni air
Spirulina dinamakan Calcium Spirulan dapat menghambat replikasi HIV-1, herpes simplex, human cytomegalovirus, virus influenza A, virus gondok, dan virus campak (cacar air) secara in vitro, dan sampai sekarang sangat aman untuk sel manusia. Ketika menyerang sel, sebuah virus pertama menempel pada permukaan sel, karena ada ekstrak Spirulina, virus tidak dapat penetrasi (masuk) ke dalam membran sel untuk menginfeksi sel. Virus tertahan (terselubungi) sehingga tidak dapat bereplikasi.
Ikan Kerapu Bebek (Cromileptes altivelis)
12
Keberhasilan budidaya ikan kerapu dipengaruhi oleh beberapa faktor, antara lain kualitas air, pakan dan pengendalian penyakit. Hingga saat ini masalah yang sering muncul dalam kegiatan budidaya ikan kerapu adalah serangan penyakit yang salah satunya disebabkan oleh bakteri Vibrio. Penyakit ini merupakan penyakit bakterial utama pada benih ikan kerapu yang dapat menimbulkan kematian sampai 100% (Desrina et al. 2006; Sarjito et al. 2007). Beberapa bakteri Vibrio yang banyak menyerang ikan kerapu adalah Vibrio alginolyticus (Taslihan et al. 2000; Murdjani et al. 2004; Desrina et al. 2006; Sarjito et al. 2007; Punitha et al. 2008; Taufik 2001), bakteri V. parahaemolyticus
(Murdjani et al. 2004; Punitha et al. 2008).
Pemberian Spirulina Sebagai Imunostimulan Pada Ikan
Pemberian imunostimulan pada ikan menghasilkan peningkatan respons imun. Pemberian pakan dengan penambahan 2.7% Spirulina menghasilkan peningkatan respons imun non spesifik seluler seperti kemotaksis dan fagositik ikan channel catfish, tetapi tidak memberikan perlindungan terhadap infeksi
Edwardsiella ictaluri (Duncan dan Klesius 1996).
13 METODE
Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Nutrisi Ikan Departemen Budidaya Perairan, Laboratorium Bioteknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan IPB, Bogor; Laboratorium Penyakit dan Kesehatan Lingkungan, Laboratorium Bioteknologi dan Laboratorium Nutrisi, Balai Budidaya Air Payau Situbondo. Penelitian dilaksanakan dari bulan Mei 2011 sampai Nopember 2012.
Bahan
Ikan uji yang digunakan dalam penelitian ini adalah juvenil ikan kerapu bebek (Cromileptes altivelis), diperoleh dari Balai Budidaya Air Payau Situbondo yang berasal dari sumber induk yang sama dan dalam kondisi sehat. Sebelum digunakan untuk penelitian dilakukan pengamatan secara morfologi maupun mikrobiologi pada ikan kerapu bebek terhadap infeksi Vibrio alginolyticus.
Stok murni Spirulina platensis diperoleh dari Balai Besar Pengembangan Budidaya Air Payau (BBPBAP) Jepara. Isolat bakteri V. alginolyticus diperoleh dari Balai Budidaya Air Payau Situbondo. Bakteri ditumbuhkan pada media TCBSA (Thiosulfate Citrate Bile Sucrose Agar) selama 24 jam pada suhu kamar. Selanjutnya satu koloni bakteri yang tumbuh diambil dan dikultur pada media SWC selama 24-36 jam.
Parameter yang Diamati
Beberapa parameter uji yang diamati dalam penelitian ini diantaranya adalah populasi dan berat kering Spirulina platensis, ekstrak fikosianin, pertumbuhan dan kelangsungan hidup ikan, gejala klinis dan gambaran sistem imun ikan.
Populasi dan berat kering Spirulina platensis
Selama kultur berlangsung, dilakukan penghitungan biomassa populasi
14
� � � � �= A−B
sampel
A = berat kertas saring dan mikroalga (mg) B = berat kertas saring (mg)
Sampel = volume sampel (mL) Ekstrak Fikosianin
Untuk menghitung hasil ekstraksi fikosianin terhadap konsentransi, tingkat kemurnian dan produksinya digunakan beberapa rumus.
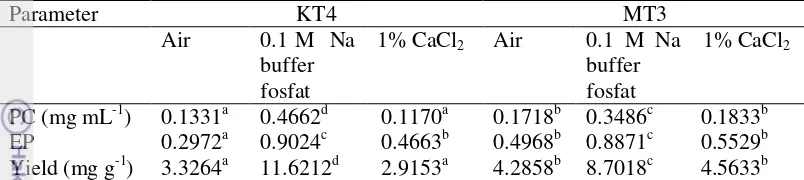
Konsentrasi fikosianin (PC,mg mL-1) dihitung dengan menggunakan rumus :
� = (OD615−0,474(OD652)
5,34 (Bennett dan Boggorad 1973; Silveira et al. 2007)
PC = konsentrasi fikosianin (mg mL-1),
OD615 = pembacaan optical density sampel pada panjang gelombang 615, OD652 = pembacaan optical density sampel pada panjang gelombang 652. Penghitungan tingkat kemurnian ekstrak fikosianin dapat dilakukan dengan mengukur absorbsi fikosianin pada panjang gelombang 615 nm dan 280 nm. Dengan menggunakan rumus :
� = OD615
OD280 (Bennett dan Boggorad 1973; Silveira et al. 2007)
EP = ekstrak murni fikosianin,
OD615 = pembacaan optical density sampel pada panjang gelombang 615,
OD280 = pembacaan optical density sampel pada panjang gelombang 280.
Hubungan persamaan ini menunjukkan kemurnian ekstrak fikosianin berhubungan dengan kontaminasi protein. Absorban 615 nm menunjukkan konsentrasi fikosianin, absorban 280 nm menunjukkan konsentrasi total protein dalam larutan.
Untuk menghitung produksi hasil ekstraksi fikosianin (mg g-1) dilakukan dengan menggunakan rumus :
� � � �� � = PC x V
DB (Silveira et al. 2007) PC = konsentrasi fikosianin (mg mL-1),
15 Gejala klinis
Gejala klinis ikan diamati dengan melihat tingkah laku makan, berenang dan perubahan anatomi bagian luar tubuh maupun organ dalam ikan.
Histopatologi
Pengamatan gambaran histopatologi dilakukan untuk mengetahui efek dari serangan penyakit vibriosis (infeksi V. alginolyticus) terhadap ikan kerapu bebek. Hematologi dan gambaran sistem imun
Pengamatan hematologi dan gambaran sistem imun dilakukan dengan mengamati sampel darah yang diambil dari caudal vena ikan, kemudian dilakukan pengukuran total leukosit dan eritrosit dilakukan dengan mengikuti prosedur Blaxhall dan Daisley (1973), kadar hemoglobin diukur dengan metode Sahli dengan Sahlinometer (Wedemeyer dan Yasutake 1977), kadar hematokrit, aktivitas fagositosis diukur menurut metode Anderson dan Siwicki (1995) dan Watanuki et al. (2006).
Produksi radikal oksigen (anion superoksida, O-) dari sel-sel fagosit dalam darah diukur dengan reduksi dari pewarnaan nitroblue tetrazolium (NBT) menurut metode Jha et al. (2007); Sharifuzzaman dan Austin (2009). Aktivitas lisozim diuji menggunakan metode Lygren et al. (1999). Pengukuran protein dan albumin serum darah dilakukan dengan menggunakan kit analisa protein dan albumin (DiaSys Kit. Germany) sesuai manual prosedur dari kit. Globulin diperoleh dari nilai protein serum dikurangi albumin serum. Semua prosedur kerja dijelaskan pada Lampiran 1.
Pertumbuhan, kelangsungan hidup ikan dan rasio konversi pakan
Laju pertumbuhan harian (Specific Growth Rate, SGR) dihitung dengan menggunakan rumus Choudhury et al. (2005) :
= � � −� � �100%
,
Dimana: Wt = berat saat akhir pemeliharaan (g), Wo = berat saat awal pemeliharaan (g), t = waktu pemeliharaan (hari)
Tingkat kelangsungan hidup (Survival Rate, SR) ikan dihitung dengan menggunakan rumus Effendie (1997) :
(%) = �
� � 100 ,
16
FCR pakan dihitung dengan menggunakan rumus Choudhury et al. (2005) :
FCR =
� −� ,
dimana : FCR = Rasio konversi pakan, F = jumlah pakan yang dikonsumsi (g), Wt = berat akhir ikan (g), Wo = berat awal ikan (g),
Relative Percent Survival (RPS)
Tingkat kelangsungan hidup setelah uji tantang kemudian dihitung menjadi nilai RPS (Relative Percent Survival) dihitung dengan menggunakan rumus Choudhury et al. (2005):
� = 1− % ikan yang mati pada perlakuan
% ikan yang mati pada kontrol � 100%
Analisis Data
17
Gambar 3. Alur pelaksanaan penelitian teknologi produksi fikosianin Spirulina platensis dan pemanfaatannya sebagai imunostimulan pada ikan kerapu bebek (Cromileptes altivelis)
TAHAP I
TEKNOLOGI PRODUKSI, EKSTRAKSI DAN KARAKTERISASI FIKOSIANIN
Kultur Spirulina platensis, ekstraksi dan pemurnian fikosianin, karakterisasi fikosianin (berat molekul protein, susunan asam amino)
TAHAP II
1. PENGUJIAN FIKOSIANIN SEBAGAI IMUNOSTIMULAN SISTEM IMUN NON SPESIFIK DAN PERTUMBUHAN
2. PENGUJIAN RESISTENSI IKAN KERAPU BEBEK
Melakukan analisis respons imun non spesifik seluler (gambaran darah, aktivitas fagosistosis, NBT), dan humoral (aktivitas lisozim, biokimia darah)
Pengamatan kematian ikan, RPS, tingkah laku makan, perubahan patologi anatomi organ dalam dan luar tubuh, respons imun non spesifik seluler dan humoral, histopatologi
TAHAP III
1. PENGUJIAN LAMA PEMBERIAN FIKOSIANIN TERHADAP
SISTEM IMUN NON SPESIFIK 2. PENGUJIAN RESISTENSI IKAN KERAPU BEBEK
Melakukan analisis respons imun non spesifik seluler (gambaran darah, aktivitas fagosistosis, NBT), dan humoral (aktivitas lisozim, biokimia darah)
18
TEKNOLOGI PRODUKSI, EKSTRAKSI DAN
KARAKTERISASI FIKOSIANIN
Spirulina platensis
SEBAGAI
BAHAN IMUNOSTIMULAN
Abstrak
Studi ini bertujuan untuk mengetahui kombinasi nutrient teknis dan intensitas cahaya optimum yang memberikan pertumbuhan populasi Spirulina platensis, kandungan fikosianin dan pelarut ekstraksi fikosianin terbaik. Penelitian terdiri dari dua tahap yaitu tahap pertama dilakukan dengan menggunakan kombinasi dua nutrien (modifikasi Kabinawa, KT dan modifikasi teknis, MT) dan tiga intensitas cahaya berbeda (2000, 3000 dan 4000 lux). Tahap kedua, pengujian ekstraksi fikosianin dengan menggunakan tiga pelarut berbeda yaitu air, 0.1 M Na buffer fosfat dan 1% CaCl2. Setiap perlakuan diulang tiga kali. Dari data diperoleh
bahwa pertumbuhan populasi Spirulina terbaik diperoleh pada hari ke 12 pada perlakuan dengan kombinasi antara nutrien MT dan intensitas cahaya 3000 lux (MT3) sebesar 0.611 OD. Kandungan ekstrak kasar fikosianin terbaik diperoleh pada tahap ekponensial hari ke 12 pada perlakuan KT2, namun tidak berbeda nyata (P>0.05) terhadap MT3 dan KT4. Pelarut ekstraksi fikosianin 0.1 M Na buffer fosfat memberikan hasil ekstraksi fikosianin dan tingkat kemurnian fikosianin tertinggi dibandingkan dua pelarut lainnya. Hasil karakterisasi fikosianin mengandung protein sebesar 26.64%, dan berat molekul dua fraksi protein fikosianin hasil SDS-PAGE adalah 19.23 dan 63.32 kDa masing-masing. Dari hasil penelitian ini menunjukkan bahwa untuk produksi massal Spirulina
dapat menggunakan kombinasi nutrien teknis MT dengan intensitas cahaya 3000 lux, dan pelarut 0.1 M Na buffer fosfat merupakan pelarut terbaik untuk ekstraksi fikosianin sebagai bahan imunostimulan.
Kata kunci : fikosianin, Na buffer fosfat, Spirulina platensis Abstract
The aim of this study was to determine combination of nutrient and the optimum light for population growth, phycocyanin content and the best extraction solvent of phycocyanin of Spirulina platensis. The first experiment used Kabinawa modification (KT) and technical modification (MT) with different of light intensity (2000, 3000 and 4000 lux). Second experiment used different solvent phycocyanin extraction were water, 0.1 M Na phosphate buffer and 1% CaCl2. Each treatment was triplicates. Data showed that the best population
19 3000 lux light intensity, and 0.1 M Na phosphate buffer is the best solvent for phycocyanin extraction as an immunostimulant.
Keywords : Na buffer fosfat, phycocyanin, Spirulina platensis
Pendahuluan
Spirulina platensis adalah plankton fotosintetik cyanobakteri berbentuk filamen. Plankton jenis ini banyak ditemukan pada perairan dengan pH alkalin di daerah tropis dan sub tropis. Selain sebagai sumber makanan, Spirulina memiliki kemampuan sebagai bahan neutrasetikal. Komposisi kimia Spirulina
menunjukkan kandungan nilai nutrisi yang tinggi dikarenakan kandungan akan nutrien esensialnya seperti protein, vitamin, mineral dan asam lemak tak jenuh seperti GLA (gamma-linoleic acid) cukup tinggi. Ketertarikan pertama dalam memproduksi Spirulina secara komersial adalah karena kandungan nutriennya, namun perhatian saat ini selain kandungan nutriennya adalah bahwa Spirulina
juga memiliki sifat terapeutik seperti efek antioksidan, imunomodulasi, potensi anti kanker, anti virus dan sifat pengaturan kolesterol (Belay 2002).
Fikosianin merupakan pigmen biru yang dimiliki oleh alga hijau biru
Spirulina platensis. Kandungan pigmen fikosianin Spirulina mencapai 20% dari total protein selnya (Richmond 1988) dan 14 % dari berat kering (McCarty, 2007). Kandungan fikosianin yang tinggi ini dapat menjadi daya tarik bagi pengembangan kultur mikroalga Spirulina secara ekonomis. Fikosianin memiliki aktivitas antioksidan (Estrada et al. 2001; Romay et al. 2003; Jensen et al. 2001), anti inflamatori (Jensen et al. 2001; Romay et al. 2003), menurunkan faktor tumor nekrosis dan melindungi sel-sel syaraf (Romay et al. 2003), anti viral, anti kanker dan menurunkan kadar kolesterol (Jensen et al. 2001). Fikosianin telah dipasarkan di Jepang sebagai makanan dan bahan pewarna kosmetik (Eriksen 2008). Di Jepang fikosianin murni dijual dengan harga cukup mahal yaitu 17500 yen atau sekitar 1.75 juta rupiah untuk 500 µg.
Penggunaan antibiotik maupun bahan-bahan kimia untuk pencegahan dan pengobatan dalam kegiatan akuakultur telah dilarang karena menimbulkan dampak negatif yaitu menimbulkan bakteri patogen resisten, residu pada tubuh ikan dan lingkungan (FAO 2003). Penelitian yang mengarah pada interaksi antara imunitas, pertumbuhan dan ramah lingkungan merupakan alternatif dari larangan penggunaan antibiotik seperti penggunaan probiotik dan imunostimulan berbasis dari tanaman meningkat (Das et al. 2009). Dengan melihat potensi yang dimiliki oleh fikosianin, dan pelarangan penggunaan antibiotik dan bahan kimia, maka fikosianin dapat dijadikan alternatif pilihan sebagai bahan imunostimulan pada budidaya ikan.
20
sangat berkaitan dengan pertumbuhan sel dan kondisi lingkungannya seperti cahaya (Becker 1994).
Banyak penelitian telah dilakukan untuk mengkaji pertumbuhan mikroalga
Spirulina, namun disamping itu masih perlu dilakukan upaya optimasi pertumbuhan dan produksi fikosianin yang memiliki nilai ekonomi. Penelitian ini bertujuan untuk melakukan pengkajian kultur mikroalga Spirulina platensis
dengan menggunakan nutrien teknis komersial murah dan intensitas cahaya optimum yang memberikan pertumbuhan populasi, produksi fikosianin, dan hasil ekstraksi terbaik, serta karakterisasi fikosianin sebagai bahan yang dapat digunakan sebagai bahan imunostimulan untuk budidaya ikan.
Bahan dan Metode
1. Waktu dan tempat penelitian
Penelitian dilakukan di Laboratorium Bioteknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan IPB Bogor dan Balai Besar Pengembangan Budidaya Air Payau Jepara. Penelitian dilaksanakan mulai bulan Mei-Agustus 2011.
2. Organisme dan kultur Spirulina platensis
Stok murni mikroalga Spirulina platensis diperoleh dari Balai Besar Pengembangan Budidaya Air Payau (BBPBAP) Jepara. Pengujian dilakukan dengan penggunaan kombinasi modifikasi dari nutrien Zarouk (Kabinawa 1998) yang selanjutnya disebut nutrien KT dan modifikasi medium teknis komersil (MT) (Tabel 1) dengan tiga intensitas cahaya berbeda (2000, 3000 dan 4000 lux) dengan ulangan 3 kali untuk masing-masing perlakuan. Kultur Spirulina
dilakukan dengan menggunakan air laut dengan salinitas 15 ppt 2.5 L, stok awal sebesar 10% dari volume kultur, temperatur ruang ± 30oC dan lama pencahayaan 16 jam terang, 8 jam gelap.
3. Pengukuran kepadatan populasi dan biomasa kering
Selama kultur berlangsung, dilakukan penghitungan kepadatan populasi
Spirulina dengan mengambil sampel sebanyak 10 mL dari masing-masing ulangan kultur setiap 24 jam dan diukur optical densitynya (OD) dengan menggunakan spektrofotometer dengan panjang gelombang 670 nm (Costa et al.