EFEKTIVITAS PEMBERIAN SEDUHAN TEH HITAM, TEH
HIJAU (Camelia sinensis var. assamica), TEH DAUN MURBEI
(Morus kanva) DAN CAMPURANNYA DALAM AKTIVITAS
HIPOGLIKEMIK PADA TIKUS (Rattus norvegicus) DIABETES
YOYANDA BAIT
SEKOLAH PASCASARJANA
PROGRAM STUDI ILMU GIZI MASYARAKAT
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis “Efektivitas Pemberian Seduhan Teh Hitam, Teh Hijau (Camelia sinensis var. assamica), Teh Daun Murbei (Morus kanva) dan Campurannya dalam Aktivitas Hipoglikemik pada Tikus (Rattus norvegicus) Diabetes” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir tesis ini.
Bogor, Februari 2010
ABSTRACT
YOYANDA BAIT. The effectiveness of black tea, green tea (Camelia sinensis var. asamica), mulberry leaf tea (Morus kanva) and their mixtures in
hypoglicemic activities of diabetic rats (Rattus norvegicus). Supervised by EVY DAMAYANTHI and RIMBAWAN.
Diabetes mellitus was a degenerative disease with a high prevalence that happened in many countries. Several studies had been done to control diabetes by using such as green tea, mulberry leaf tea, and their mixtures. The aim of this study was investigated the effect of black tea, green tea, mulberry tea and their mixtures on controlling blood glucose level. This experiment used fourty two rats, aged 2.5-3.0 months, 150-200 g bw. The rats were divided into 7 groups, each group consisted of 3 rats, namely; normally control group, negative control group, black tea group, green tea group, mulberry leaf tea group, black tea+mulberry leaf tea group and green tea+mulberry leaf tea group. The study was carried out for 16 days intervention. The dose of alloxan 125 mg/kg bw were given by intraperitonial. After blood glucose level >200 mg/dl, rats were given tea with dose 1 ml/day/100 g bw, equivalent with EGCG 44.47 mg/kg bw for green tea and for black tea, EGCG 0.36 mg/kg bw, theaflavin 11.19 mg/kg bw, thearubigin 134.4 mg/kg bw. This research consisted two phases, first determined the phytochemichal of leaf tea, second phases, observed the capability of black tea, green tea and mulberry leaf tea also their mixtures to control of blood glucose level during 16 days on diabetic rats, glycosilated hemoglobin level (HbA1c) and insulin level. The results were showed that the green tea significantly decreased blood glucose level (p<0,05) was compared to the others treatment but not significant with a black tea. The tea treatments were not significantly (p>0,05) affected to glycosilated hemoglobin level (HbA1c) and insulin level from rats blood.
RINGKASAN
YOYANDA BAIT. Efektivitas Pemberian Seduhan Teh Hitam, Teh Hijau (Camelia sinensis var. assamica), Teh Daun Murbei (Morus kanva) dan Campurannya dalam Aktivitas Hipoglikemik pada Tikus (Rattus norvegicus) Diabetes. Dibimbing oleh EVY DAMAYANTHI dan RIMBAWAN.
Diabetes melitus adalah penyakit degeneratif yang angka kejadiannya cukup tinggi di berbagai negara dan merupakan salah satu penyakit yang menjadi masalah kesehatan masyarakat. Banyak penelitian yang telah dilakukan untuk mengendalikan diabetes mellitus, diantaranya dengan mengembangkan minuman fungsional yang mempunyai khasiat antidiabetes, salah satunya yang banyak diteliti adalah khasiat dari daun teh dan daun murbei. Penelitian betujuan untuk melihat efektifitas teh hitam, teh hijau, teh daun murbei dan campurannya dalam pengendalian kadar glukosa darah dalam rangka pencegahan penyakit DM.
Penelitian ini merupakan bagian dari penelitian Prioritas Nasional yang diketuai oleh Kustiyah (2009) dan dibiayai oleh DIKTI. Penelitian dilakukan di Laboratorium Pusat Penelitian Teh dan Kina (PPTK) Bandung untuk pembuatan teh hijau, teh hitam dan teh daun murbei serta menganalisis kandungan fitokimia teh hijau dan teh hitam. Analisis proksimat dilakukan di Laboratorium Departemen Gizi Masyarakat, Institut Pertanian Bogor (IPB). Pemeliharaan dan perlakuan pada hewan percobaan dilakukan di Laboratorium Pusat Penelitian dan Pengembangan Gizi, Departemen Kesehatan. Analisis kadar insulin darah dilakukan di Laboratorium Balai Penelitian Ternak (Balitnak) Ciawi – Bogor dan analisis HbA1c dilakukan di Laboratorium Klinik Nugraha Bogor.
Penelitian ini dilakukan dalam dua tahap. Tahap pertama yaitu pembuatan teh hitam dan teh hijau, pengujian kandungan EGCG, theaflavin dan thearubigin, analisis proksimat (protein, abu, lemak, karbohidrat dan kadar air) dari teh hitam, teh hijau, teh daun murbei. Pada tahap ini penelitian dilaksanakan di Laboratorium Pusat Penelitian Teh dan Kina (PPTK) Bandung dan Laboratorium Departemen Gizi Masyarakat. Tahap kedua dilakukan intervensi pada tikus percobaan normal dan tikus diabetes (yang diinduksi dengan aloksan) selama 16 hari pengamatan serta dilakukan analisa pada darah tikus meliputi uji toleransi glukosa, kadar glukosa, kadar hemoglobin glikosilat dan kadar insulin dari serum darah. Pengukuran lainnya juga dilakukan antara lain berat badan tikus selang dua hari, berat ransum, volume air minum dan volume urin tikus dilakukan setiap hari selama 16 hari pengamatan.
Berdasarkan kandungan fitokimia menunjukkan bahwa teh hitam mempunyai kandungan theaflavin yaitu 1,14% dan thearubigin 13,10%. Theaflavin merupakan hasil oksidasi dari katekin yang terjadi selama proses oksidasi enzimatis. Hasil analisis kandungan EGCG, teh hijau yang dibuat secara non oksidasi enzimatis menunjukkan kandungan EGCG yang lebih tinggi, yaitu 4,50%, sedangkan kandungan EGCG teh hitam hanya 0,37%. Dosis filtrat yang dicekokkan ke tikus (1 ml/100 g BB tikus) setara dengan EGCG untuk teh hijau 44,47 mg/kg BB, untuk teh hitam EGCG 0,36 mg/kg BB, theaflavin 11,19 mg/kg BB dan thearubigin 134,4 mg/kg BB.
Hasil uji toleransi glukosa secara oral menunjukkan terjadi peningkatan kadar glukosa darah setelah 30 menit pemberian glukosa, kemudian pada menit ke-60 terjadi penurunan kadar glukosa tetapi naik lagi pada menit ke-90. Setelah 120 menit terjadi kembali penurunan kadar glukosa darah.
Pengukuran berat badan, kelompok tikus yang mendapatkan perlakuan campuran teh hijau +TDM mengalami peningkatan berat badan paling besar, yaitu 43,20 g dibandingkan dengan pelakuan lainnya. Hal ini sejalan dengan banyaknya ransum yang dikonsumsi selama 16 hari perlakuan. Pada penelitian ini ditunjukkan bahwa peningkatan berat badan pada tikus diabetes tanpa perlakuan/kontrol negatif (25,53 g) lebih kecil dibanding tikus normal (35,43 g).
Hasil pengukuran menunjukkan bahwa banyaknya volume air minum linier dengan banyaknya urin yang dikeluarkan. Tikus yang diberi teh hijau + TDM paling banyak minum air (758,33 ml) selama 16 hari pengamatan, sehingga volume urin yang dikeluarkan tikus yang diberi teh hijau + TDM juga paling banyak (284,67 ml).
Hasil uji statistik menunjukkan bahwa perlakuan pemberian teh memberikan pengaruh yang nyata (p<0,05) terhadap perubahan kadar glukosa darah tikus, sedangkan selisih (delta) tidak memberikan pengaruh terhadap perubahan kadar glukosa darah tikus. Hasil uji beda menunjukkan bahwa perlakuan teh hijau berbeda nyata dengan perlakuan kontrol normal, kontrol negatif, teh daun murbei (TDM), teh hitam + TDM dan teh hijau + TDM dan tidak berbeda nyata dengan teh hitam.
Pengukuran HbA1c dilakukan pada hari ke-8 dan hari ke-16 setelah perlakuan. Data hasil pengukuran HbA1c menunjukkan bahwa kadar Hba1c tikus yang diberi teh hijau pada perlakuan 8 hari telah berada pada kadar HbA1c normal bawah (4%), dibandingkan dengan perlakuan lainnya.
Data pengukuran insulin menunjukkan penurunan konsentrasi insulin pada tikus yang diberi teh hitam dan teh daun murbei pengamatan pada hari ke-16 bila dibandingkan pengamatan dengan hari ke-8, sedangkan pada perlakuan lainnya terjadi peningkatan konsentrasi insulin.
Hasil dari penelitian ini dapat disimpulkan bahwa teh hijau paling efektif dalam menurunkan kadar glukosa darah. Penelitian ini diharapkan dapat membantu dalam pengendalian penyakit DM.
@ Hak Cipta Milik IPB, tahun 2010
Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
EFEKTIVITAS PEMBERIAN SEDUHAN TEH HITAM, TEH
HIJAU (Camelia sinensis var. assamica), TEH DAUN MURBEI
(Morus kanva) DAN CAMPURANNYA DALAM AKTIVITAS
HIPOGLIKEMIK PADA TIKUS
(Rattus norvegicus) DIABETES
YOYANDA BAIT
Tesis
sebagai salah satu syarat memperoleh gelar Magister Sains pada
Program Studi Ilmu Gizi Masyarakat
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Efektivitas Pemberian Seduhan Teh Hitam, Teh Hijau (Camelia sinensis var. assamica), Teh Daun Murbei (Morus kanva) dan Campurannya dalam Aktivitas Hipoglikemik Tikus (Rattus norvegicus) Diabetes
Nama : Yoyanda Bait
NRP : I 151070021
Disetujui, Komisi Pembimbing
Dr. Ir. Evy Damayanthi, MS. Dr. Rimbawan
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Ilmu Gizi Masyarakat
Dr. drh. Rizal M.Damanik, MRep,Sc Prof. Dr. Ir. Khairil A. Notodiputro, MS
PRAKATA
Alhamdulillahi Rabbil’alamiin. Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga tesis yang berjudul “Efektivitas Pemberian Seduhan Teh Hitam, Teh Hijau (Camelia sinensis var.
assamica), Teh Daun Murbei (Morus kanva) dan Campurannya dalam Aktivitas Hipoglikemik pada Tikus (Rattus norvegicus) Diabetes” berhasil diselesaikan.
Selama perkuliahan hingga selesai tersusunnya tesis ini, penulis banyak mendapatkan bantuan baik moral maupun material dari berbagai pihak. Oleh karena itu, penulis ingin menyampaikan rasa terima kasih setulus dan seikhlasnya kepada:
1. Keluargaku tercinta: Papa, Mama, Suamiku, Anak-anaku serta seluruh keluarga yang selalu memberikan doa, perhatian, curahan kasih sayang, dukungan dan semangat yang terus mengalir tak kenal henti.
2. Ibu Dr. Ir. Evy Damayanthi, MS dan Bapak Dr. Rimbawan, terima kasih atas perhatian, pengertian, dan bimbingannya, sehingga tesis ini dapat diselesaikan. 3. Ibu Dr. Ir. Lilik Kustiyah, M.Si. selaku dosen penguji yang telah memberikan
masukan dan saran demi tercapainya kesempurnaan tesis ini.
4. Bapak Prof. Dr. Ir. Hi. Nelson Pomalingo, MPd. selaku Rektor Universitas Negeri Gorontalo yang telah memberikan kesempatan untuk melanjutkan studi.
5. Bapak Ir. Zulzain Ilahude, M.Si. selaku Dekan Fakultas Ilmu – ilmu Pertanian Universitas Negeri Gorontalo yang selalu memotivasi selama studi.
6. Direktorat Pendidikan Tinggi Terimakasih telah memberikan bantuan beasiswa (BPPS).
7. Tim peneliti Hibah Prioritas Nasional (DIKTI) yang telah banyak membantu selama proses penelitian dan atas dana bantuan penelitian yang telah diberikan.
9. Bapak drh. Endi Ridwan selaku Kepala Laboratorium Hewan-Pusat Penelitian dan Pengembangan Gizi dan Makanan, Departemen Kesehatan, Bogor atas bantuan, saran dan kerjasamanya selama penulis melakukan penelitian.
10.Bapak Pandi selaku Laboran Laboratorium Hewan-Pusat Penelitian dan Pengembangan Gizi dan Makanan, Departemen Kesehatan Bogor, atas bantuan dan kerjasamanya selama penelitian.
11.Laboran Departemen Gizi Masyarakat (Pak Mashudi dan Bu Nina), Ibu Ida dan Ibu Sri di Lab. Fisiologi Hewan, Fakultas Kedokteran Hewan, Institut Pertanian Bogor, Laboran di Balitnak, Ibu Widi dan Ibu Susi di Lab. Klinik Nugraha yang telah membantu selama penelitian.
12.Teman-teman staf dosen dan administrasi di Fakultas Ilmu – ilmu Pertanian, khususnya Jurusan Teknologi Pertanian atas dukungannya.
13.Teman-teman di Program Studi Ilmu Gizi Masyarakat: Rini, Mba Nita, Mba Reisi, Mba Ririn, Mba Reni, Bu Maya, Mba Nur, Athie, Afrin, Nisa, Bu Mimi, Mas Rusman dan teman-teman lain yang tidak bisa disebutkan satu persatu, atas dukungan semangat selama studi.
14.Partnerku di dalam penelitian Dina Nikmatina Ritonga, Yuges Syahputri dan Vita Nurhikmah yang telah banyak membantu dan memberikan semangat. 15.Teman-teman mahasiswa Gorontalo di Bogor: Ibu Lisna, Ibu Marini, Ibu
Yanne, Amy, Lian, Wiwin, Ibu Rita H., Rita B., Pak Hasyim, Pak Wawan, Pak Samad, Pak Irwan, Pak Iswan, Pak Zainal, Fadli, Vicky, Mamad, Rizal, Pak Herwin, Pak Tahir, Pak Sahrudin, Pak Faisal, Pak Amir, Pak Kifli, Pak Fahrul, Pak Yanto dan Pak Nurdin terima kasih atas dukungan moril, perhatian, curahan kasih sayang, dukungan dan semangat yang terus mengalir tak kenal henti.
Akhirnya hanya ucapan terima kasih yang dapat penulis haturkan kepada semua pihak yang mungkin terlupa untuk disebutkan. Allah-lah Maha pembalas kebaikan. Amin. Semoga karya ini mendapatkan ridho-Nya dan bermanfaat bagi semua pihak yang membutuhkan. Jazakumullah khairan katsiran.
Bogor, Februari 2010
RIWAYAT HIDUP
Penulis dilahirkan di Gorontalo pada tanggal 29 Nopember 1979 dari Bapak Ahmad Bait dan Ibu Sartje Ahmad. Penulis merupakan putri pertama dari tiga bersaudara, yaitu Ronaldi Aks Bait dan Reagenda Ems Bait, Amd. Penulis menikah dengan Hartono Hadjarati, M.Pd dan telah dikarunia dua putra, yaitu Noerja Fadhylla Hadjaratie dan Alief Prasetyo Hadjarati.
Pendidikan formal penulis dimulai dari Sekolah Dasar Negeri 63 Gorontalo. Tahun 1994 penulis lulus dari Sekolah Lanjutan Tingkat Pertama Negeri 2 Gorontalo. Tahun 1997 penulis menyelesaikan pendidikan di Sekolah Lanjutan Tingkat Atas Negeri 1 Gorontalo dan lulus sebagai Mahasiswa di Perguruan Tinggi Negeri Universitas Sam Ratulangi Manado pada Jurusan Teknologi Pertanian Fakultas Pertanian. Pada tahun 2002 penulis menamatkan pendidikan di Negeri Universitas Sam Ratulangi Manado pada Program Studi Teknologi Hasil Pertanian Jurusan Teknologi Pertanian Fakultas Pertanian.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 4
Manfaat ... 5
Hipotesis ... 5
TINJAUAN PUSTAKA Teh ... 6
Murbei ... 12
Diabetes Melitus ... 13
Insulin ... 16
Aloksan ... 17
Hemoglobin Glikosilat ... 18
METODOLOGI Tempat dan Waktu Penelitian ... 21
Bahan dan Alat ... 21
Metode ... 21
Penyiapan Bahan Uji ... 22
Hewan Percobaan ... 22
Induksi Aloksan untuk Membuat Tikus Diabetes ... 23
Pembuatan Ransum Standar ... 25
Prosedur Pengujian dan Rancangan Percobaan ... 25
Analisis Data ... 31
HASIL DAN PEMBAHASAN Analisis Fitokimia Teh Hitam dan Teh Hijau ... 32
Analisis Proksimat Teh Hitam, Teh Hijau dan Teh Daun Murbei ... 34
Tes Toleransi Glukosa ... 34
Induksi Aloksan dan Konfirmasi Kondisi Diabetes pada Tikus ... 39
Perubahan Berat Badan dan Jumlah Konsumsi Ransum Tikus ... 41
Total Volume Air Minum dan Urin Tikus ... 43
Kadar Glukosa Darah Tikus Diabetes ... 44
Kadar Hemoglobin Glikosilat ... 48
Kadar Insulin ... 50
SIMPULAN DAN SARAN Simpulan ... 53
Saran ... 53
DAFTAR PUSTAKA ... 54
DAFTAR TABEL
Halaman
1. Perbedaan teh hitam ortodoks dan CTC ... 7
2. Kelompok tikus percobaan yang akan diberi perlakuan ... 23
3. Komposisi ransum standar tikus ... 25
4. Kandungan fitokimia teh hitam dan teh hijau ... 32
5. Analisis proksimat teh hitam, teh hijau dan teh daun murbei ... 34
6. Rata-rata kadar glukosa darah tes toleransi glukosa secara oral ... 37
7. Perubahan berat badan dan jumlah ransum yang dikonsumsi tikus ... 42
DAFTAR GAMBAR
Halaman
1. Diagram alir proses pengolahan teh hitam CTC ... 8
2. Struktur kimia theaflavin dan thearubigin ... 9
3. Proses pengolahan teh hijau berkatekin tinggi ... 10
4. Struktur kimia polifenol teh hijau ... 11
5. Pembentukan HbA1c ... 20
6. Bagan Alur Percobaan ... 24
7. Prosedur kerja pengujian HbA1c ... 28
8. Skema oksidasi enzimatis teh hitam ... 33
9. Grafik rata-rata kadar glukosa darah hasil uji toleransi glukosa... 38
10. Kadar glukosa darah sebelum dan sesudah induksi aloksan ... 40
11. Fotomikrograf jaringan pankreas tikus normal ... 40
12. Fotomikrograf jaringan pankreas tikus diabetes ... 41
13. Kadar glukosa darah tikus diabetes ... 45
14. Perubahan kadar glukosa darah ... 47
15. Kadar hemoglobin glikosilat ... 49
DAFTAR LAMPIRAN
Halaman
1. Pembuatan teh hijau dan teh hitam ... 60
2. Prosedur analisis kadar katekin/polifenol teh ... 63
3. Metode analisis kimia ... 66
4. Hasil analisis statistik tes toleransi glukosa ... 68
5. Hasil analisis statistik kadar glukosa darah ... 69
6. Hasil analisis statistik kadar hemoglobin glikosilat ... 71
7. Hasil analisis statistik kadar insulin ... 72
PENDAHULUAN
Latar Belakang
Dewasa ini telah terjadi perubahan gaya hidup pada masyarakat. Salah satu diantaranya adalah pergeseran pola makan. Ada kecenderungan masyarakat untuk mengkonsumsi makanan cepat saji atau fast food. Komposisi makanan cepat saji tersebut pada umumnya banyak mengandung karbohidrat dan lemak. Hasil studi yang dilakukan oleh Nuryati (2009) menunjukkan bahwa pria dengan umur > 45 tahun berisiko 12,7 kali lebih tinggi terkena diabetes melitus (status gizi obes) dibanding umur < 45 tahun, sedangkan wanita dengan umur > 45 tahun berisiko 13,0 kali lebih tinggi terkena diabetes melitus (status gizi obes) dibanding umur < 45 tahun.
Diabetes melitus (DM) merupakan salah satu masalah kesehatan yang berdampak pada produktivitas dan dapat menurunkan mutu sumber daya manusia. Sejalan dengan perubahan gaya hidup, penderita DM di Indonesia diperkirakan semakin meningkat, terutama pada kelompok umur dewasa ke atas pada seluruh status sosial ekonomi (Dirjen Bina Kesmas Depkes RI 2003). Tidak seperti penyakit lain yang biasanya menunjukkan gejala penyakit yang khas dan mudah dikenali, penyakit ini agak berbeda. Lebih dari 50% penderita tidak menyadari sudah mengidap penyakit DM. Bila tidak ditangani lebih dini dan tidak dilakukan pengobatan, maka timbul berbagai macam komplikasi kronis yang sering berakibat fatal seperti penyakit jantung, ginjal, kebutaan, impotensia dan koma diabetik yang dapat menyebabkan kematian.
direktorat baru di Departemen Kesehatan untuk menangani penyakit tidak menular. Berdasarkan data Riset Kesehatan Dasar (Riskesdas) Nasional 2007, memperlihatkan bahwa proporsi penyakit tidak menular mengalami peningkatan cukup tinggi dari 42 persen menjadi 60 persen. Proporsi penyebab kematian pada kelompok umur 45 – 54 tahun menurut tipe daerah, DM menempati posisi kedua untuk wilayah perkotaan yaitu sebesar 14,7%, sedangkan untuk wilayah pedesaan menempati posisi kelima yaitu sebesar 5,8%.
DM yang tidak dikelola dengan baik dapat mengakibatkan berbagai penyakit menahun. Langkah pertama yang harus dilakukan dalam pengelolaan DM dapat dengan perencanaan diet dan kegiatan jasmani (Ristanti 2009). Bahan alami yang telah banyak diteliti untuk mengendalikan DM adalah daun teh. Teh merupakan salah satu minuman yang terpopuler di dunia karena selain nikmat juga memberikan manfaat bagi kesehatan. Kandungan polifenol dalam teh hijau mampu menangkal radikal bebas dalam tubuh. Menurut Song et al. (2003) polifenol terutama epigalokatekin galat (EGCG) dapat melindungi kerusakan sel
pankreas dari pengaruh oksidasi. Kobayashi et al. (2000) dan Maeda et al. (2005) melakukan penelitian dengan pemberian teh hijau secara oral,
menemukan bahwa pemberian teh hijau dapat menekan kadar gula darah. EGCG pada teh hijau bekerja dengan cara menghambat transport sodium glukosa pada mukosa.
Berdasarkan penelitian Damayanthi et al. (2008) pemberian teh hijau menunjukkan secara ilmiah adanya indikasi bahwa secara in vivo mampu mengendalikan kadar glukosa darah pada tikus DM, namun hasil penelitian tersebut sangat terbatas, karena hanya dilakukan pada teh hijau. Penelitian terbaru oleh Cameron et al. (2008) tentang manfaat teh hitam untuk mengendalikan DM, menunjukkan bahwa theaflavin dan thearubigin dari teh hitam dapat meniru kerja insulin dalam mengendalikan DM. Terdapat tiga jenis theaflavin yang diidentifikasi meniru kerja insulin tersebut yaitu theaflavin 3-o-galat, theaflavin 3'-o-galat, theaflavin 3,3'di-o-galat.
Penelitian dengan menggunakan tikus diabetes yang diinduksi dengan
oleh Anderson & Polansky (2002), theaflavin dapat meningkatkan aktivitas insulin secara in vitro pada percobaan sel lemak epididymal. Meskipun mekanisme antihiperglikemik dari theaflavin belum jelas, aktivitas antihipeglikemik dari theflavin tidak diragukan (Wang & Li 2006).
Menurut Bambang (2006) teh hijau Indonesia merupakan produk yang unik karena diolah dari pucuk teh Camelia. sinensis var. assamica. Dibandingkan
dengan teh hijau Cina, teh hijau Indonesia berbeda bahan bakunya (C. sinensis var. sinensis). Karena perbedaan bahan baku ini, maka secara khusus
teh hijau Indonesia diduga lebih potensial menjadi minuman fungsional. Teh hijau Indonesia yang terbuat dar C. sinensis var. assamica memiliki kandungan katekin yang lebih tinggi yaitu 11,60% daripada sencha (teh hijau Jepang) yang hanya 5,06%.
Bahan alami lainnya yang dikembangkan sebagai minuman fungsional yang mempunyai khasiat antihiperglikemik adalah daun murbei. Daun murbei telah diketahui merupakan ramuan kuno obat tradisional Cina untuk mengobati pengidap penyakit DM. Menurut Asano et al. (2001) penelitian pada daun murbei (Morus alba) telah berhasil mengisolasi sekitar limabelas polyhydroxylated
alkaloids, salah satunya yaitu 1-Deoxynojirimycin (DNJ) yang mempunyai potensi berfungsi menghambat -glucosidase. Alpha-glucosidase merupakan enzim yang mengkatalisis hidrolisis ikatan pada maltose untuk menghasilkan dua molekul. Penelitian yang dilakukan oleh Damayanthi, et al. (2008) pemberian teh daun murbei dan campuran teh hijau dan teh daun murbei menunjukkan bahwa pada hari keempat pengamatan terjadi penurunan kadar glukosa pada tikus DM. Hasil penelitian Ama (2009) menunjukkan bahawa ekstrak daun murbei dapat menurunkan kadar glukosa darah dan berpengaruh nyata (p<0,05) dalam menurunkan kadar glukosa darah tikus yang diinduksi dengan aloksan.
seduhan teh hitam, teh hijau, teh daun murbei dan campuran teh hitam + TDM serta campuran teh hijau + TDM.
Tujuan
Tujuan Umum
Secara umum tujuan penelitian ini untuk melihat efektifitas teh hitam, teh hijau, teh daun murbei dan campurannya dalam pengendalian kadar glukosa darah dalam rangka pencegahan penyakit DM.
Tujuan Khusus
1. Menganalisis kandungan fitokimia (theaflavin, thearubigin dan EGCG) dari teh hitam dan teh hijau
2. Menganalisis kandungan air, protein, lemak dan karbohidrat dari teh hitam, teh hijau dan teh daun murbei.
3. Menganalisis perubahan kadar glukosa darah melalui uji toleransi glukosa selama pengamatan 150 menit.
4. Membandingkan pengaruh pemberian seduhan dari teh hitam, teh hijau, teh daun murbei dan campurannya terhadap kadar glukosa darah tikus diabetes selama 16 hari pengamatan.
5. Menganalisis perubahan hemoglobin glikosilat darah tikus yang diinduksi dengan aloksan kemudian diberi seduhan dari teh hitam, teh hijau, teh daun murbei dan campurannya.
Manfaat
1. Memperoleh perbandingan mengenai efektivitas dari teh hitam, teh hijau, teh daun murbei dan campurannya dalam mengendalikan kadar glukosa darah sebagai dasar penerapannya pada penderita diabetes.
2. Memberikan informasi ilmiah mengenai pengaruh dari pemberian seduhan dari teh hitam, teh hijau, teh daun murbei dan campurannya terhadap perubahan hemoglobin glikosilat, toleransi glukosa dan kadar insulin darah.
Hipotesis
1. Pemberian seduhan teh hitam, teh hijau, teh daun murbei dan campurannya memberikan pengaruh dalam penurunan kadar glukosa darah.
TINJAUAN PUSTAKA
TehTeh merupakan salah satu minuman terpopuler di dunia karena selain nikmat juga bermanfaat untuk kesehatan. Kombinasi antara kenikmatan dan kesehatan menjadikan teh memiliki daya saing kuat dibandingkan minuman kesegaran lainnya (Suprihatini 2007).
Perbedaan kelompok dan penamaan teh dilakukan berdasarkan cara pengolahan sebelum dan sesudah dipetik dari pohon, yaitu 1) teh hitam (black tea), yaitu teh yang dalam pengolahannya melalui proses fermentasi penuh. Sering juga dikenal dengan nama teh merah;2) teh oolong, teh ini dalam pengolahannya melalui setengah proses fermentasi; 3) teh hijau, teh ini dalam pengolahannya tidak melalui proses fermentasi, setelah daun teh dipetik langsung diolah; 4) teh putih, teh ini dalam pengolahannya tidak melalui proses oksidasi. Saat di pohon, daun teh juga terlindung dari sinar matahari agar tidak menghasilkan klorofil atau zat hijau daun, karena diproduksi lebih sedikit, sehingga harganya lebih mahal (Anonim 2008a).
Diantara keempat jenis teh di atas, ada dua bentuk teh yang paling banyak dikonsumsi, yakni teh hitam dan teh hijau. Teh hitam paling banyak dikonsumsi yaitu 69% dari total konsumsi teh dunia. Teh hijau mengandung epikatekin sebagai komponen polifenol utama yang memiliki aroma khas teh hijau, sedangkan pada teh hitam selain mengandung katekin, juga mengandung theaflavin (TF) dan thearubigin (TR) sebagai hasil dari proses oksidasi enzimatik yang juga merupakan suatu antioksidan kuat yang memiliki manfaat khusus bagi kesehatan (Suprihatini 2007; Silalahi 2006).
Katekin yang mendominasi ±20% berat kering teh merupakan substansi utama yang menyebabkan teh memenuhi persyaratan sebagai minuman
fungsional. Senyawa ini dikandung lebih banyak pada pucuk tanaman teh
tanaman tersebut 80% diolah menjadi teh hitam, sedangkan sisanya diolah menjadi teh hijau (Bambang 2006).
Teh Hitam
Berdasarkan sistem pengolahannya, teh hitam di Indonesia dapat dibagi menjadi dua, yaitu 1) sistem ortodoks terdiri atas ortodoks murni dan ortodoks rotorvane; 2) sistem baru, seperti crushing, tearing and curling (CTC). Pengolahan teh CTC di Indonesia mulai dicoba di Pusat Penelitian Teh dan Kina Gambung sejak awal 1984. Perbedaan teh hitam ortodoks dan CTC dapat dilihat pada Tabel 1.
Tabel 1. Perbedaan Teh Hitam Ortodoks dan CTC
Uraian Ortodoks CTC
Bentuk Cita rasa Penyajian
Kebutuhan penyeduhan
Agak pipih Kuat Lambat
400-500 cangkir/kg teh
Butiran Kurang Cepat
800-1000 cangkir/kg teh Sumber : PPTK (2008)
Mesin giling yang digunakan dalam pembuatan teh merupakan gabungan sistem giling CTC Kenya dan India Utara (Doars). Pada proses oksidasi enzimatis dipakai continuous fermenting machine, sedangkan pengeringan teh pada umumnya menggunakan fluid bed dryer 6 section. Pengolahan teh hitam secara CTC meliputi pelayuan, pengayakan pucuk layu, penggilingan persiapan, penggilingan CTC, oksidasi, pengeringan dan sortasi kering (Gambar 1).
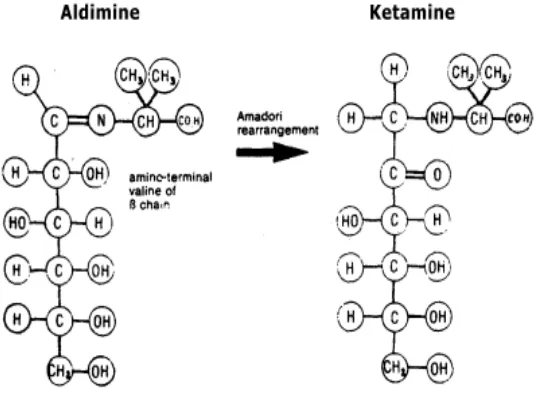
Gambar 1. Diagram Alir Proses Pengolahan Teh Hitam CTC(PPTK 2008) Terdapat tiga jenis theaflavinyang diidentifikasi yaitu theaflavin 3-o-galat, theaflavin 3'-o-galat, theaflavin 3,3'di-o-galat. Beberapa studi telah menunjukkan bahwa katekin dan theaflavin memiliki aktivitas menangkal radikal bebas secara
in vitro dan in vivo. Kehadiran theaflavin dalam teh hitam memiliki potensi antioksidan yang sedikitnya sama dengan katekin yang ada dalam teh hijau dan konversi dari katekin menjadi theaflavin selama fermentasi dalam pembuatan teh hitam, tidak merubah secara signifikan aktivitas radikal bebasnya (Leung et al. 2001).
BAHAN BAKU
PELAYUAN
PENGAYAKAN PUCUK LAYU
PENGGILINGAN PERSIAPAN
PENGGILINGAN CTC
OKSIDASI
PENGERINGAN
SORTASI KERING
Gamba
Konsumsi teh resiko penyakit jantung konsumsi satu sampa hari akan menguran komsumsi kafein (Ga Diantara sekia dipublikasikan adalah tekanan darah tinggi hitam yang sangat pent (Suprihatini 2007). menunjukkan bahwa melitus. Zat aktif y thearubigin dapat meni Teh Hijau
Kualitas teh hi pengolahan teh hijau pelayuan untuk meng tidak teroksidasi. Pros 80-100 0C selama 5 m teh hijau yang dihasil
bar 2. Struktur kimia Theaflavin dan Thearubig (Mukhtar & Ahmad 2008)
eh hitam 3 gelas per hari dihubungkan denga ntung koroner dan meningkatkan status anti pai enam gelas per hari. Konsumsi maksimal de
angi beberapa resiko yang berhubungan de ardner 2007).
kian banyak manfaat teh bagi kesehatan, yang lah manfaatnya untuk mencegah dan mengenda nggi dan kesehatan jantung. Manfaat teh lainnya
penting untuk mengendalikan diabetes belum ba 2007). Studi yang dilakukan oleh Cameron
a teh hitam dapat digunakan untuk mengend yang terkandung dalam teh hitam berupa
eniru kerja insulin.
h hijau ditentukan oleh kualitas kandungan kateki au yang paling menentukan kandungan kateki ngaktivasi enzim polifenol oksidase, sehingga s roses pelayuan dengan cara steaming (pembe 5 menit) memberikan kandungan katekin yang l
silkan (Gambar 3).
bigin
ngan pengurangan ntioksidan dengan l delapan gelas per dengan kelebihan
ng paling banyak ngendalikan kanker, ya khususnya teh banyak diketahui on et al. (2008) ndalikan diabetes theaflavin dan
Gambar 3 Proses pengolahan teh hijau berkatekin tinggi (Damayanthi et al. 2008; PPTK 2008)
Ekstrak daun teh hijau (green tea extract/GTE) mengandung sejumlah kompenen termasuk katekin, saponin dan flavanoid. Katekin dapat mengurangi tekanan darah, oksidasi selular dan mutasi, kadar glukosa darah dan absorpsi kolesterol. Saponin dan flavanoid juga memiliki manfaat kesehatan. Oleh karena itu, konsumsi GTE akan mencegah atau menunda onset dari penyakit seperti penyakit kardiovaskuler, diabetes dan kanker (Shirai & Suzuki 2004). Menurut Polychronopoulus et al. (2008) konsumsi teh dihubungkan dengan pengurangan tingkat glukosa darah dari glukosa darah setelah puasa hanya pada pada orang tua (usia lanjut) yang tidak obes.
Efek kesehatan dari teh hijau terutama dikaitkan dengan kandungan polifenol. Teh hijau merupakan sumber yang kaya akan polifenol terutama flavanol dan flavonol, yang setara 30% dari berat daun kering. Katekin merupakan bentuk utama dari flavanol yang terdiri dari epigalokatekin galat (EGCG), epigalokatekin (EGC), epikatekin galat (ECG) dan epikatekin (EC) (Gambar 4). Beberapa penelitian yang terbaru menyatakan bahwa efek dari teh hijau sebagian besar dikaitkan dengan katekin, yaitu EGCG. Penelitian sebelumnya memperlihatkan bahwa penggunaan EGCG mempunyai potensi efek antiobesitas pada tikus percobaan yang obes karena pola makan, yang merupakan dampak langsung dari EGCG pada jaringan adipose (Wolfram et al. 2006).
Studi yang dilakukan oleh Waltner-Lat et al. (2002) menunjukkan bukti in vitro bahwa EGCG menurunkan produksi glukosa dari H4IIE sel hepatoma tikus. Pada penelitian ini diperlihatkan bahwa EGCG menyerupai insulin yaitu meningkatkan fosfolirasi tirosin dari reseptor insulin dan substrat reseptor insulin dan mengurangi ekspresi gen dari enzim glukonegenik PEPCK (phosphoenolpyruvate carboxykinase). Jika efek ini relevan untuk pengamatan
in vivo, maka EGCG memiliki potensi untuk digunakan sebagai antidiabetes. Potenza et al. (2007) EGCG, polifenol teh hijau dapat meningkatkan fungsi
endotelial dan sensitivitas insulin, mengurangi tekanan darah. Penelitian yang dilakukan Collins et al. (2007) menyatakan bahwa EGCG menekan glukoneogenesis hepatik melalui 5’-AMP-activated Protein Kinase (AMPK) dengan memblokade aktivitas AMPK.
Gambar 4 Stuktur Kimia Polifenol Teh Hijau (Kobayashi et al. 2000) Dosis Teh
Bahan alami yang telah banyak diteliti untuk mengendalikan DM adalah daun teh. Penelitian tersebut dilakukan dengan menggunakan teh dalam bentuk seduhan, ekstrak maupun zat aktif misalnya epigalokatekin galat (EGCG).
Pemberian polifenol teh hijau (500 mg/kg berat badan) pada tikus normal meningkatkan toleransi glukosa secara signifikan pada menit ke 60. polifenol teh hijau juga ditemukan mengurangi level serum glukosa pada tikus diabetes melitus yang diinduksi oleh aloksan dengan signifikan pada level dosis 100 mg/kg berat badan. Selanjutnya pemberian setiap hari selama 15 hari dari ekstrak 50, 100 mg/kg berat badan menghasilkan 29-44% pengurangan dari peningkatan level serum glukosa yang disebabkan oleh pemberian aloksan (Sabu et al. 2002).
yang kuat dalam menurunkan kadar glukosa darah setelah pemberian secara oral pada tikus. Pemberian EGCG 200 mg/kg BB/hari dapat meningkatkan sensitivitas insulin (Potenza et al. 2007).
Damayanthi et al. (2008) dalam studinya menggunakan dosis seduhan teh hijau dan teh daun murbei dengan berat masing – masing 20 g serta campuran teh hijau + teh daun murbei (1:1), diseduh dengan air panas 70-80 0C selama 15 menit. Hasil dari studi tersebut menunjukkan bahwa teh hijau, teh daun murbei dan campurannya dapat mengendalikan kadar glukosa darah tikus DM secara in vivo. Studi yang dilakukan Widowati (2007) menunjukkan bahwa suhu ekstraksi berpengaruh terhadap aktivitas antioksidan teh, sehingga kondisi ekstraksi yang dipilih adalah suhu 85 0C, perbandingan teh dengan air 10:100 b/v dan waktu ekstraksi 8 menit. Hal ini karena pada kondisi ekstrasi tersebut memiliki aktivitas antioksidan yang sama dengan trolox 9,42 mM.
Murbei
Murbei (Morus alba L.) termasuk dalam famili moraceae, dan berasal dari Cina. Tanaman murbei tumbuh baik pada ketinggian lebih dari 100 m dpl. dan memerlukan cukup sinar matahari. Tumbuhan yang sudah dibudidayakan ini menyukai daerah-daerah yang cukup basa seperti lereng gunung dan tanah yang berdrainase baik. Tanaman ini kadang ditemukan tumbuh liar. Murbei dikenal dengan nama yang berbeda-beda, seperti besaran (Indonesia); murbai, besaran (Jawa); kerta, kitau (Sumatera); sangye (China); may mon, dau tam (Vietnam);
morus leaf, morus bark, morus fruit, mulberry leaf, mulberry bark, mulberry twigs, white mulberry, mulberry (Inggris) (Dalimartha 2000).
Studi yang dilakukan oleh Zhong et al. (2006) terhadap campuran ekstrak teh hijau (0.1 g), teh hitam (0.1 g), dan teh daun murbei (1.0 g), menemukan komponen 1-deoxynojirimycin (DNJ) 5 mg, Epikatekin galat 100 mg, epigalokatekin galat 300 mg, dan theaflavin 100 mg. Senyawa DNJ merupakan zat aktif yang dari daun murbei. Epikatekin galat dan epigalokatekin galat merupakan polifenol yang terdapat dalam teh hijau, sedangkan theaflavin merupakan kandungan yang berasal dari teh hitam.
Penemuan tentang senyawa (DNJ) yang berhasil diisolasi dari tanaman murbei dan ditemukan tepatnya terkandung di dalam getahnya. Senyawa acarbose
yang mirip dengan glukosa dapat menghambat aktivitas - glukosidase dengan cara mengintervensi proses hidrolisis karbohidrat sehingga menghambat penyerapan glukosa dan monosakarida – monosakarida lainnya. Senyawa
acarbose dan DNJ, keduanya mempunyai mekanisme kerja yang sama dalam menurunkan kadar glukosa darah penderita diabetes yaitu menghambat aktivitas enzim - glukosidase yang berfungsi memecah senyawa polisakarida menjadi monomer – monomer glukosa (Sofian 2005).
Diabetes Mellitus
Kelainan yang disebabkan oleh defisiensi insulin disebut diabetes melitus (Ganong 2002). Menurut Dallimunthe (2004) penyakit DM telah diketahui sejak ribuan tahun sebelum masehi. Ebers Papyurus menuliskan bahwa di Mesir sekitar tahun 1550 Sebelum Masehi ditemukan suatu penyakit yang ditandai dengan banyak kencing. Sebagian besar kasus DM disebabkan oleh rusaknya sel pankreas sehingga produksi insulin menjadi terhambat atau tidak ada sama sekali. Beberapa ahli berpendapat bahwa dengan meningkatnya umur, maka intoleransi terhadap glukosa juga meningkat.
penyebab timbulnya DM melalui peningkatan kerentanan sel – sel terhadap penghancuran oleh virus atau mempermudah perkembangan antibodi autoimun melawan sel – sel , sehingga mengarah pada penghancuran sel – sel .
Gejala klinis DM meliputi gejala – gejala pada stadium kompensasi dan dekompensasi pankreas, serta gejala – gejala kronik lainnya. Gejala – gejala pada stadium kompensasi, misalnya polifagia, poliuria, polidipsia dan penurunan berat badan. Adanya gejala klinis hiperglikemia dan glukosuria akan menyebabkan tekanan osmotik di dalam tubuli ginjal naik dan menghambat rearbsorsi air sehingga menyebabkan poliuria dan akibat adanya poliuria akan terus menerus menyebabkan dehidrasi tingkat jaringan. Penderita DM tidak dapat menggunakan glukosa dalam darah dan akan menggunakan lemak tubuhnya untuk mengganti energi atau makanan bagi sel, sehingga terjadi ketonemia dan ketonuria dan tubuh terlihat kurus. Adanya badan – badan keton di dalam darah akan menimbulkan terjadinya asidosis, sehingga frekuensi nafas meningkat dan penderita mengalami koma (Ressang 1984).
Cara umum yang digunakan untuk mendiagnosa penyakit DM didasarkan pada berbagai tes kimiawi terhadap urin dan darah (Guyton & John 1997). Pemeriksaan glukosa urin melalui tes sederhana atau kuantitatif laboratorium, dapat digunakan untuk menentukan jumlah glukosa yang hilang dalam urin.
Klasifikasi Diabetes Melitus
Menurut Misnadiarly (2006) DM diklasifikasikan ke dalam dua tipe yaitu DM tipe 1, DM yang tergantung insulin atau Diabetes Mellitus Dependen-Insulin
(IDDM) dan tipe 2 DM tidak tergantung insulin atau Diabetes Mellitus Non-Dependent Insulin (NIDDM).
Diabetes Tipe 1
Diabetes tipe 1 adalah kondisi yang ditandai oleh tingginya kadar glukosa darah yang disebabkan oleh ketiadaan total hormon insulin. Diabetes tipe 1 terjadi ketika sistem imun tubuh menyerang sel yang menghasilkan insulin pada pankreas dan menghancurkannya (Jacquie et al. 2004). Menurut PERKENI (2002) diabetes tipe 1 memiliki karakteristik mudah terjadi ketoasidosis, pengobatannya harus dengan insulin, onset akut, penderita biasanya kurus, terjadi pada umur muda, di dapatkan antibodi sel islet, 10% ada riwayat diabetes pada keluarga, 30-50% terjadi pada kembar identik.
Individu yang mengalami DM tipe 1 mempunyai ciri – ciri poliuria, polidipsia dan poliphagia. Berdasarkan pengujian glukosa darah, pasien yang mengalami tipe ini jika diberi 75 gram glukosa secara oral dan sebelumnya telah melakukan puasa selama satu malam, konsentrasi gula darahnya akan meningkat lebih dari 200 md/dl, sedangkan pada individu normal dengan perlakuan yang sama akan meningkat glukosa darah berkisar 140 mg/dl. Tingginya kandungan darah dalam tubuh, mengakibatkan laju filtrasi glomerulus terhadap glukosa menjadi berlebihan dan urin akan mengandung banyak glukosa (Champe & Harvey 1994).
Diabetes Tipe 2
Kasus diabetes terbanyak adalah DMT2 yang umumnya mempunyai latar belakang resistensi insulin. Pada awalnya, resistensi insulin belum menyebabkan diabetes klinis. Sel pankreas masih dapat mengkompensasi, sehingga terjadi hiperinsulinemi, kadar glukosa darah masih normal atau sedikit meningkat. Jika terjadi kelelahan sel beta pankreas, maka dapat mengakibatkan DM klinis, yang ditandai dengan kadar glukosa darah yang meningkat.
Pada DMT2, sekresi insulin di fase 1 tidak dapat menurunkan glukosa darah, sehingga merangsang fase 2 untuk menghasilkan insulin lebih banyak, tetapi tidak mampu meningkatkan sekresi insulin seperti pada orang normal. Gangguan sekresi sel menyebabkan sekresi insulin pada fase 1 tertekan. Kadar insulin dalam darah turun menyebabkan produksi glikogen oleh hati meningkat, sehingga kadar glukosa darah puasa meningkat. Secara berangsur-angsur kemampuan fase 2 untuk menghasilkan insulin akan menurun. Mekanisme DMT2 dimulai dengan gangguan fase 1 yang menyebabkan hiperglikemi dan selanjutnya gangguan fase 2 di mana tidak terjadi hiperinsulinemi akan tetapi gangguan sel (Merentek 2006).
Menurut PERKENI (2002) karakteristik dari DMT2 , yaitu sukar terjadi ketoasidosis, pengobatannya tidak harus menggunakan insulin, onsetnya lambat, penderitanya gemuk atau tidak gemuk, biasanya terjadi pada umur tua, tidak ada antibody sel islet, 30% ada riwayat diabetes pada keluarga, 100% terjadi pada kembar identik.
Insulin
golgi untuk membentuk insulin sebelum terbungkus dalam granula sekretorik. Kurang lebih seperenam dari hasil akhirnya tetap dalam bentuk proinsulin. Proinsulin ini tidak memiliki aktivitas insulin (Guyton & John 1997).
Sekresi insulin oleh sel beta tergantung 3 faktor utama, yaitu kadar glukosa darah, ATP-sensitive K channels dan Voltage-sensitive Calcium Channels sel pankreas. Mekanisme kerja ketiga faktor ini sebagai berikut : pada keadaan puasa saat kadar glukosa darah turun, ATP sensitive K channels di membran sel akan terbuka sehingga ion kalium akan meninggalkan sel (K-efflux), dengan demikian mempertahankan potensial membran dalam keadaan hiperpolar, sehingga Ca-channels tertutup, akibatnya kalsium tidak dapat masuk ke dalam sel , sehingga perangsangan sel untuk mensekresi insulin menurun. Sebaliknya pada keadaan setelah makan, kadar glukosa darah yang meningkat akan ditangkap oleh sel melalui glucose transporter 2 (GLUT2) dan dibawa ke dalam sel. Di dalam sel, glukosa akan mengalami fosforilase menjadi glukosa-6 fosfat (G6P) dengan bantuan enzim penting, yaitu glukokinase. Glukosa 6 fosfat kemudian akan mengalami glikolisis dan akhirnya akan menjadi asam piruvat. Dalam proses glikolisis ini akan dihasilkan 6 – 8 ATP. Penambahan ATP akan meningkatkan rasio ATP/ADP dan ini akan menutup terowongan kalium. Dengan demikian kalium akan tertumpuk dalam sel dan terjadilah depolarisasi membran sel, sehingga membuka terowongan kalium dan kalsium akan masuk ke dalam sel. Dengan meningkatnya kalsium intrasel, akan terjadi translokasi granul insulin ke membran dan insulin akan dilepaskan ke dalam darah (Merentek 2006).
Aloksan
Aloksan (2,4,5,6-tetraoxypyrimidine; 5,6-dioxyuracyi) pertama kali ditemukan oleh Brugnatelli pada tahun 1818. Wohler dan Liebeg menggunakan nama “aloksan” dan menggambarkan sintesisnya dengan oksidasi asam urat. Efek diabetogenik dari zat ini dilaporkan oleh Dunn, Sheehan dan Mclethie (1943)
dalam Szkudelski T (2001) yang diberikan pada kelinci dan menunjukkan adanya nekrosa spesifik pada pulau langerhans.
berubah menjadi warna merah. Aloksan digunakan untuk merusak sel pankreas pada hewan coba, perubahan pada sel – sel yang ditimbulkan oleh zat ini menyerupai perubahan sel – sel pada diabetes, yaitu pengecilan pulau – pulau pankreas, pengurangan jumlah sel – sel dan degranulasi (Ressang 1984).
Menurut Turner (1976) hewan yang menderita DM secara eksperimental oleh aloksan akan menderita defisiensi insulin karena pada dosis tertentu aloksan dapat merusak sel – sel pulau langerhans pankreas. Pemberian bahan yang berkhasiat akan meningkatkan sekresi insulin oleh sel – sel yang sehat pada individu yang menderita DM akibat induksi aloksan sehingga terjadi perbaikan metabolisme.
Dosis aloksan optimum yang dapat menghasilkan kondisi hiperglikemia permanen tergantung dari jenis kelamin, umur dan kondisi hewan percobaan. Andayani (2003) melaporkan bahwa tikus putih berumur tiga bulan dengan berat badan 200 – 270 g yang diinduksi dengan alokasan 75 mg/kg berat badan hanya menghasilkan tikus dengan kadar glukosa sesaat 150 – 200 mg/dl sebanyak 25%, tetapi dalam waktu satu minggu kadar glukosa akan kembali normal. Selanjutnya digunakan dosis 125 mg/kg berat badan untuk menghasilkan tikus DM sedang, ternyata dapat menghasilkan 80% tikus DM sedang dengan kadar glukosa darah 200 – 450 mg/dl.
Pada penelitian yang dilakukan oleh Ama (2009) digunakan aloksan dengan dosis Andayani (2003) dan dosis tersebut setelah tiga hari tikus yang mengalami hiperglikemia permanen (kadar glukosa darah sesaat lebih besar dari 200 mg/dl) lebih dari 90% dengan peningkatan kadar glukosa darah sebesar 386,7%. Rata – rata kadar glukosa darah setelah induksi masing – masing kelompok berkisar antara 200 mg/dl sampai 450 mg/dl. Aloksan lazim digunakan karena zat kimia ini cepat menimbulkan hiperglikemik yang pemanen dalam waktu 2 – 3 hari (Suharmiati 2003).
Hemoglobin Glikosilat
kemungkinan terjadinya komplikasi pada penderita DM (Suryaatmadja 1983). Glikosilasi dari hemoglobin ditemukan pada manusia dan hewan yang DM. Pada tahun 1976 Koenig telah melaporkan kadar hemoglobin glikosilat berkorelasi dengan glukosa serum puasa dan tes toleransi glukosa. Secara umum, diakui bahwa usia berkaitan dengan penurunan progresif toleransi glukosa. Berdasarkan penelitian yang dilakukan oleh Hsu & Hsu (1986), setelah diinduksi aloksan, kinetika hemoglobin glikosilat meningkat linear dalam enam minggu. Hasil akhir menunjukkan bahwa usia merupakan faktor penting yang mempengaruhi kinetika dari hemoglobin glikosilat pada tikus diabetes.
Hemoglobin glikosilat (HbA1c) merupakan tanda dari evaluasi jangka panjang kontrol glikemik pada pasien diabetes dan memprediksi resiko untuk perkembangan dan atau progresi dari komplikasi DM. HbA1c merupakan produk dari reaksi non enzimatis antara glukosa dan asam amino bebas dari hemoglobin, reaksi ini disebut glikosilasi (Calisti & Tognetti 2005).
Gambar 5 Pembentukan HbA1c (Suryaatmadja 1983)
METODE PENELITIAN
Tempat dan Waktu PenelitianPenelitian ini merupakan bagian dari penelitian Prioritas Nasional yang diketuai oleh Kustiyah (2009) dan dibiayai oleh DIKTI. Penelitian dilakukan di Laboratorium Pusat Penelitian Teh dan Kina (PPTK) Bandung untuk pembuatan teh hijau, teh hitam dan teh daun murbei serta menganalisis kandungan fitokimia teh hijau dan teh hitam. Analisis proksimat dilakukan di Laboratorium Departemen Gizi Masyarakat, Institut Pertanian Bogor (IPB). Pemeliharaan dan perlakuan pada hewan percobaan dilakukan di Laboratorium Pusat Penelitian dan Pengembangan Gizi, Departemen Kesehatan. Analisis kadar insulin darah dilakukan di Laboratorium Balai Penelitian Ternak (Balitnak) Ciawi – Bogor dan analisis HbA1c dilakukan di Laboratorium Klinik Nugraha Bogor.
Bahan dan Alat
Bahan yang digunakan dalam penelitian meliputi bahan utama antara lain : teh hitam dan teh hijau klon Gambung 7 yang diperoleh dari Laboratorium Pusat Penelitian Teh dan Kina (PPTK) Bandung, daun murbei Morus kanva yang didapatkan dari Lembaga Masyarakat disekitar Hutan (LMDH) Sukamanah, Bandung, aloksan dari Sigma (A7413-10G) untuk membuat tikus normal menjadi diabetes, tikus jantan jenis Spraque Dawley yang diperoleh dari Puslitbang Gizi Depkes, ransum standar dan bahan kimia untuk analisis fitokimia serta proksimat. Peralatan yang digunakan adalah timbangan berat badan tikus, glukometer (Abbott Optium Omega Blood Glucose Monitoring System) untuk pengukuran kadar glukosa darah, spuit untuk menyuntikkan alloksan dan Sonde untuk mencekokan minuman, alat bedah (pinset, gunting, skapel), kandang metabolit, serta alat untuk analisis fitokimia dan proksimat.
Metode
penelitian dilaksanakan di Laboratorium Pusat Penelitian Teh dan Kina (PPTK) Bandung dan Laboratorium Departemen Gizi Masyarakat.
Tahap kedua dilakukan intervensi pada tikus percobaan normal dan tikus diabetes (yang diinduksi dengan aloksan) selama 16 hari pengamatan serta dilakukan analisa pada darah tikus meliputi uji toleransi glukosa, kadar glukosa, kadar hemoglobin glikosilat dan kadar insulin dari serum darah. Pengukuran lainnya juga dilakukan antara lain berat badan tikus selang dua hari, berat ransum, volume air minum dan volume urin tikus dilakukan setiap hari selama 16 hari pengamatan.
Penyiapan Bahan Uji (Damayanthi et al. 2008)
Sebanyak 20 gram teh hitam, 20 gram teh hijau, 20 gram teh daun murbei dan campuran teh hitam + teh daun murbei serta teh hijau + teh daun murbei (campuran 1:1), masing – masing bahan diseduh dengan cara direndam menggunakan air panas (70–80 0C) sebanyak 200 ml selama ±15 menit, kemudian disaring dan diambil filtratnya.
Hewan Percobaan
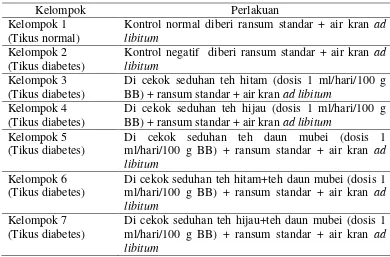
Sebanyak 42 ekor tikus jenis Sprague Dawley umur 2,5 – 3 bulan dengan berat badan 150 – 200 g digunakan dalam penelitian ini. Semua tikus dipelihara terlebih dahulu diadaptasi selama 5 hari untuk penyesuaian lingkungan. Tikus dikandangkan dengan pengaturan suhu (220C) dan kelembaban (55%). Ruangan dikontrol dengan siklus 12 jam penerangan dan 12 jam gelap (Kim et al. 2006). Semua tikus dibagi menjadi 7 kelompok (Tabel 2).
Tabel 2 Kelompok tikus percobaan berdasarkan jenis perlakuan
Kelompok Perlakuan
Kelompok 1 (Tikus normal)
Kontrol normal diberi ransum standar + air kran ad libitum
Kelompok 2 (Tikus diabetes)
Kontrol negatif diberi ransum standar + air kran ad libitum
Kelompok 3 (Tikus diabetes)
Di cekok seduhan teh hitam (dosis 1 ml/hari/100 g BB) + ransum standar + air kran ad libitum
Kelompok 4 (Tikus diabetes)
Di cekok seduhan teh hijau (dosis 1 ml/hari/100 g BB) + ransum standar + air kran ad libitum
Kelompok 5 (Tikus diabetes)
Di cekok seduhan teh daun mubei (dosis 1 ml/hari/100 g BB) + ransum standar + air kran ad libitum
Kelompok 6 (Tikus diabetes)
Di cekok seduhan teh hitam+teh daun mubei (dosis 1 ml/hari/100 g BB) + ransum standar + air kran ad libitum
Kelompok 7 (Tikus diabetes)
Di cekok seduhan teh hijau+teh daun mubei (dosis 1 ml/hari/100 g BB) + ransum standar + air kran ad libitum
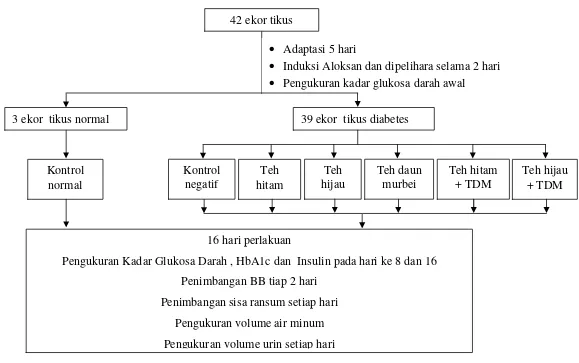
Gambar 6 Bagan Alur Percobaan 42 ekor tikus
3 ekor tikus normal 39 ekor tikus diabetes
• Adaptasi 5 hari
• Induksi Aloksan dan dipelihara selama 2 hari • Pengukuran kadar glukosa darah awal
Kontrol normal
Kontrol negatif
Teh hitam
Teh hijau
Teh daun murbei
Teh hitam + TDM
Teh hijau + TDM
16 hari perlakuan
Pengukuran Kadar Glukosa Darah , HbA1c dan Insulin pada hari ke 8 dan 16 Penimbangan BB tiap 2 hari
Pembuatan Ransum Standar
[image:40.595.183.442.209.323.2]Ransum tikus yang digunakan adalah ransum standar berdasarkan AOAC (1990) yang dimodifikasi oleh Laboratorium Biokimia dan Fisiologi Gizi Puslitbang Gizi dan Makanan Bogor. Ransum tikus yang digunakan adalah dalam bentuk bubuk. Komposisi ransum tikus dapat dilihat pada Tabel 3.
Tabel 3 Komposisi ransum standar tikus
Bahan Jumlah (gram)
Tepung beras Tepung kedele Susu skim Minyak kelapa
Mineral mix1 dan Vitamin2 Garam 2500 1360 500 200 60 40 Keterangan : 1
Campuran mineral per kilogram ransum, terdiri dari : 139,3 gram NaCl, 0,79 gram KI, 389 gram KH2PO4, 57,3 gram MgSO4, 381,4 gram CaCO3, 27 gram FeSO4, 4,01 gram MnSO4, 0,549
gram ZnSO4, 0,477 gram CuSO4, dan 0,023 gram CaCl2. 2
Campuran vitamin per kilogram ransum, terdiri dari : 6000 IU vitamin A, 400 IU vitamin D, 10 mg vitamin E, 1 mg vitamin K, 5 mg folat, 30 mg tiamin HCl, 20 mg riboflavin, 5 mg piridoksin HCl, 20 mg Ca pantotenat, 100 mg nikotinamida, dan 150 g vitamin B12
Prosedur Pengujian dan Rancangan Percobaan
Uji Toleransi Glukosa
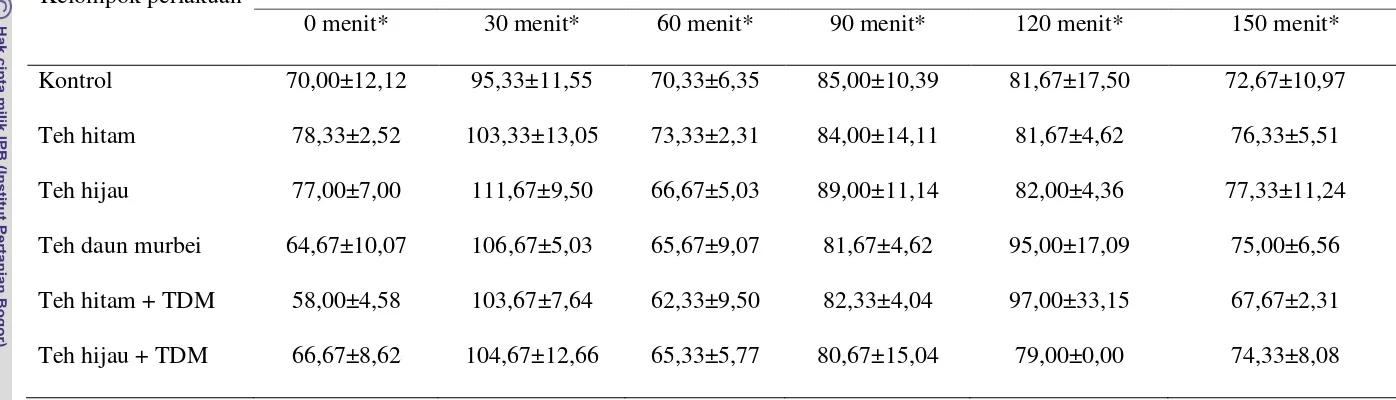
Pengujian toleransi glukosa dilakukan menurut metode Varley & Gowenblock dalam Yulinah et al. (2001). Tiap kelompok uji terdiri dari tiga ekor tikus jantan dan secara keseluruhan terdiri dari enam kelompok. Sebelum percobaan tikus dipuasakan selama 18 jam, tetapi air minum tetap diberi. Setiap tikus diberi bahan uji sesuai dengan kelompoknya dan 1 jam kemudian diberi larutan glukosa 10% pada dosis 2,0 g/kg bb secara oral. Glukosa darah ditentukan sebelum pemberian glukosa dan pada 30, 60, 90,120 dan 150 menit setelah pemberian glukosa.
Rancangan percobaan yang digunakan adalah rancangan acak lengkap (RAL) faktorial, yang terdiri atas dua perlakuan, masing-masing enam taraf. Jika perlakuan menunjukan berbeda nyata, maka untuk mengetahui perbedaan rerataan diantara perlakuan dilakukan dengan uji lanjut Duncan Multiple Range Test
A. Pemberian cekok (kontrol (tanpa cekok), teh hitam, teh hijau, teh daun murbei, campuran teh hitam + TDM dan campuran teh hijau + TDM).
B. Waktu (menit ke-0, menit ke-30, menit ke-60, menit ke-90, menit ke-120 dan menit ke-150)
n = 3 kali ulangan.
Model linear yang digunakan adalah : Y
ijk = + i+ j+( ij)+ ijk
Keterangan: Y
ijk = nilai pengamatan pada pemberian cekok ke-i, waktu ke-j dan ulangan ke-k. m = nilai rata-rata.
i = pengaruh pemberian cekok ke-i. j = pengaruh waktu ke-j.
ij = pengaruh reaksi pemberian cekok ke-i dan reaksi waktu ke-j. ijk = galat error dari cekok ke-i, waktu ke-j dan ulangan ke-k.
Metode Analisa Kadar Glukosa Darah
Pengukuran kadar glukosa darah dengan glukometer menggunakan metode elektrokimia, yaitu berdasarkan pada pengukuran potensial (daya listrik) yang disebabkan oleh reaksi dari glukosa dengan bahan pereaksi glukosa pada elektroda strip. Stip uji mengandung bahan kimia, yaitu glucose oksidase 29,1% b/b, heksasianoferat (III) 32,0% b/b dan bahan – bahan tidak reaktif yaitu 38,9 b/b.
Cara mengukur glukosa darah tikus percobaan : ekor tikus uji digunting selanjutnya darah yang menetes dikenakan pada strip glukometer. Kadar glukosa darah dinyatakan dalam mg/dl.
Rancangan percobaan yang digunakan adalah rancangan acak lengkap (RAL) faktorial, yang terdiri atas dua perlakuan, masing-masing tujuh taraf dan dua taraf. Jika perlakuan menunjukan berbeda nyata, maka untuk mengetahui perbedaan rerataan diantara perlakuan dilakukan dengan uji lanjut Duncan Multiple Range Test (DMRT). Perlakuan yang diberikan adalah :
A. Pemberian cekok (kontrol normal (tikus normal dan tanpa cekok), kontrol negatif (tikus diabetes) teh hitam (tikus diabetes), teh hijau (tikus diabetes), teh daun murbei (tikus diabetes), campuran teh hitam + TDM (tikus diabetes) dan campuran teh hijau + TDM (tikus diabetes)).
B. Selisih (d1 (selisih kadar glukosa darah hari ke-0 dan ke-8, d2 (selisih kadar glukosa darah hari ke-0 dan ke-16)
n = 3 kali ulangan.
Model linear yang digunakan adalah : Y
ijk = + i+ j+( ij)+ ijk
Keterangan: Y
ijk = nilai pengamatan pada pemberian cekok ke-i, waktu ke-j dan ulangan ke-k. m = nilai rata-rata.
i = pengaruh pemberian cekok ke-i. j = pengaruh waktu ke-j.
ij = pengaruh reaksi pemberian cekok ke-i dan reaksi waktu ke-j. ijk = galat error dari cekok ke-i, waktu ke-j dan ulangan ke-k.
Kadar Hemoglobin Glikosilat (HbA1c)
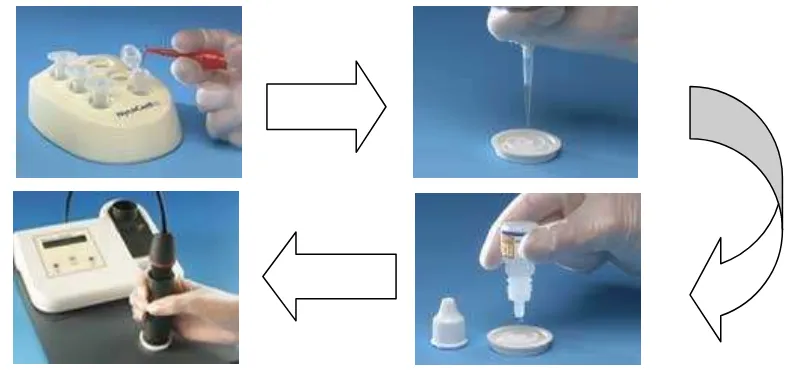
HbA1c diukur dengan menggunakan Nycocard Reader II HbA1c Test (Axis-Shield USA). Cara pengukuran HbA1c dapat dilihat pada Gambar 6. Pertama masukkan sebanyak 5 µl sampel dalam cairan pelarut dan kocok dengan baik. Kemudian masukkan 50 µl sampel yang telah diencerkan ke Test Device
solution. Biarkan meresap sempurna selama ±10 detik. Baca hasil dengan menggunakan Nycocard Reader II dalam waktu kurang 5 menit.
Gambar 7 Prosedur Kerja Pengujian HbA1c
Rancangan percobaan yang digunakan adalah rancangan acak lengkap (RAL) faktorial, yang terdiri atas dua perlakuan, masing-masing tujuh taraf dan dua taraf. Jika perlakuan menunjukan berbeda nyata, maka untuk mengetahui perbedaan rerataan diantara perlakuan dilakukan dengan uji lanjut Duncan Multiple Range Test (DMRT). Perlakuan yang diberikan adalah :
A. Pemberian cekok (kontrol normal (tikus normal dan tanpa cekok), kontrol negatif (tikus diabetes) teh hitam (tikus diabetes), teh hijau (tikus diabetes), teh daun murbei (tikus diabetes), campuran teh hitam + TDM (tikus diabetes) dan campuran teh hijau + TDM (tikus diabetes)).
B. Waktu pengamatan (8 dan 16 hari) n = 3 kali ulangan.
Model linear yang digunakan adalah : Y
ijk = + i+ j+( ij)+ ijk
Keterangan: Y
ijk = nilai pengamatan pada pemberian cekok ke-i, waktu ke-j dan ulangan ke-k. m = nilai rata-rata.
i = pengaruh pemberian cekok ke-i. j = pengaruh waktu ke-j.
Kadar Insulin Darah
Pengukuran kadar insulin pada darah tikus ditentukan secara
Radioimmunoassay (RIA) dengan menggunakan prosedur sesuai peunjuk kit RIA insulin Coat-A-Count dari Diagnostic Products Coorporation.
Cara kerjanya : pipet 200 µl serum darah pada kalibrator nol A dalam NSB (nonspesifific binding) dan tabung A, dan 200 µl dari setiap kalibrator yang tersisa, kontrol dan sampel darah ke dalam tabung yang telah disediakan. Tambahkan 1.0 ml buffer insulin ke setiap tabung. Vorteks sebentar dan hati – hati (sampel jangan sampai tumpah dari tabung). Inkubasi selama 3 jam pada suhu 37 0C. Sampel dituangkan (pindahkan semua cairan dengan hati – hati. Gunakan rak busa penuangan, tuangkan kandungan dari semua tabung (kecuali tabung T) dan biarkan semua mengalir selama 2 – 3 menit. Kemudian pukulkan tabung pada kertas absorbent untuk mengeluarkan semua sisa tetesan. Hitung selama 1 menit pada gamma counter.
Net Counts = rata – rata CPM – rata – rata NSB CPM.
Kemudian untuk menentukan ikatan dari masing – masing tabung sebagai persen dari maximum binding (MB), dengan NSB-angka yang telah dikoreksi dari tabung A diambil sebagai 100% :
Persen ikatan =
Rancangan percobaan yang digunakan adalah rancangan acak lengkap (RAL) faktorial, yang terdiri atas dua perlakuan, masing-masing tujuh taraf dan dua taraf. Jika perlakuan menunjukan berbeda nyata, maka untuk mengetahui perbedaan rerataan diantara perlakuan dilakukan dengan uji lanjut Duncan Multiple Range Test (DMRT). Perlakuan yang diberikan adalah :
A. Pemberian cekok (kontrol normal (tikus normal dan tanpa cekok), kontrol negatif (tikus diabetes) teh hitam (tikus diabetes), teh hijau (tikus diabetes), teh daun murbei (tikus diabetes), campuran teh hitam + TDM (tikus diabetes) dan campuran teh hijau + TDM (tikus diabetes)).
n = 3 kali ulangan.
Model linear yang digunakan adalah : Y
ijk = + i+ j+( ij)+ ijk
Keterangan: Y
ijk = nilai pengamatan pada pemberian cekok ke-i, waktu ke-j dan ulangan ke-k. m = nilai rata-rata.
i = pengaruh pemberian cekok ke-i. j = pengaruh waktu ke-j.
Pengukuran Jumlah Ransum
Pemberian ransum dilakukan setiap hari secara ad libitum, ransum dan sisa ransum ditimbang setiap hari pada waktu yang sama dan dinyatakan dalam satuan gram untuk mengetahui keadaan diabetes berpengaruh pada total konsumsi ransum tikus selama percobaan. Jumlah konsumsi ransum dihitung dengan mengurangi jumlah ransum yang diberikan dengan sisa ransum yang telah ditimbang.
Pengukuran Volume Minum
Pemberian air minum dilakukan setiap hari secara ad libitum, air minum dan sisa air minum dihitung volume setiap hari pada waktu yang sama dan dinyatakan dalam satuan ml untuk mengetahui keadaan diabetes berpengaruh pada total konsumsi air minum tikus selama percobaan. Jumlah volume air minum dihitung dengan mengurangi volume air minum yang diberikan dengan sisa air minum yang telah diukur volumenya.
Pengukuran Berat Badan Tikus
Pengukuran Volume Urin
Pengukuran volume urin untuk melihat perubahan volume urin yang dihasilkan. Urin ditampung dalam gelas ukur dan dikumpulkan selama 24 jam kemudian dilihat volume urin yang dihasilkan selama 24 jam.
Analisis Data
Hasil yang diperoleh dari penelitian ini dianalisis dengan menggunakan
HASIL DAN PEMBAHASAN
Analisis Fitokimia Teh Hitam dan Teh Hijau
[image:47.595.116.509.259.302.2]Komposisi kimia dari setiap daun teh beda. Perbedaan komposisi kimia menimbulkan perbedaan sifat dan susunan kimia yang spesifik pada daun teh, sehingga untuk melihat perbedaan tersebut dilakukan analisis fitokimia pada teh hitam dan teh hijau. Analisis fitokimia teh hitam dan teh hijau dapat dilihat pada Tabel 4.
Tabel 4 Kandungan fitokimia teh hitam dan teh hijau (% berat kering)
Sampel Theaflavin Thearubigin EGCG
Teh hitam 1,14± 0,07 13,10± 0,79 0,37±0,05
Teh hijau - - 4,50±0,22
Berdasarkan kandungan fitokimia (Tabel 4) menunjukkan bahwa teh hitam mempunyai kandungan theaflavin yaitu 1,14% dan thearubigin 13,10%. Kandungan theaflavin dan thearubigin merupakan zat yang bisa dijadikan standar untuk menentukan kualitas dari daun teh. Theaflavin merupakan hasil oksidasi dari katekin yang terjadi selama proses oksidasi enzimatis. Dalam seduhan teh hitam, theaflavin memberikan warna merah kekuningan, sedangkan thearubigin memberi warna merah kecoklatan. Kafein bersama dengan theaflavin memberikan rasa segar dalam hal rasa,.
Theaflavin memiliki struktur kimia yang terdiri atas empat senyawa utama, yaitu theaflavin (TF1), theaflavin-3-falat (TF2A), theaflavin-3’-galat (TF2B) dan theaflavin-3,3’-digalat (TF3). Penelitian yang dilakukan oleh Honda dan Hara (1993) tentang efek antidiabetik dari theaflavin dan katekin menyatakan bahwa mekanisme antidiabetik terjadi karena adanya penghambatan glukosa dalam usus.
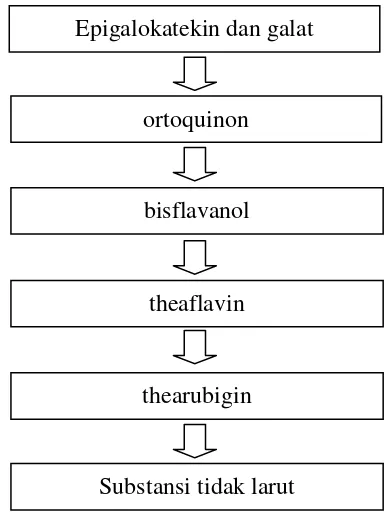
dan thearubigin. Saat terjadi proses kondensasi dan polimerisasi terbentuk substansi – substansi yang tidak larut. Secara skematis proses oksidasi enzimatis dapat dilihat pada Gambar 8 (PPTK 2008).
Gambar 8 Skema oksidasi enzimatis teh hitam (PPTK 2008)
Pengolahan teh hijau di Indonesia merupakan serangkaian proses fisik dan mekanis tanpa atau sedikit proses oksidasi enzimatis terhadap pucuk teh dengan menggunakan sistem steaming. Oleh karena itu tidak dilakukan pengujian kadar theaflavin dan thearubigin pada teh hijau karena diasumsikan tidak terjadi proses oksidasi enzimatis (PPTK 2008).
Pada penelitian ini menggunakan dosis 20 gram teh yang diseduh dengan air panas (70-80 0C) sebanyak 200 ml. Filtratnya dicekokkan ke tikus 1 ml/100 g berat badan. Berdasarkan hasil analisis fitokimia ini, maka dapat dihitung jumlah konsumsi (intik) EGCG, theaflavin dan thearubigin. Menurut perhitungan yang dilakukan oleh Ritonga (2010) menyatakan bahwa, dosis filtrat yang dicekokkan ke tikus (1 ml/100 g BB tikus) setara dengan EGCG untuk teh hijau 44,47 mg/kg BB, untuk teh hitam EGCG 0,36 mg/kg BB, theaflavin 11,19 mg/kg BB dan thearubigin 134,4 mg/kg BB.
Epigalokatekin dan galat
ortoquinon
bisflavanol
theaflavin
thearubigin
Analisis Proksimat Teh Hitam, Teh Hijau dan Teh Daun Murbei
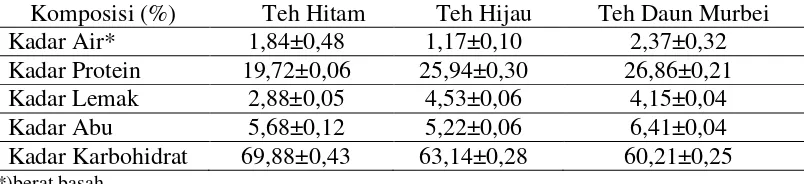
[image:49.595.115.517.293.385.2]Analisis proksimat dilakukan untuk mengetahui kandungan dan komposisi zat gizi yang terdapat dalam teh hitam, teh hijau dan teh daun murbei. Metode pemanasan langsung digunakan untuk menentukan kadar air dan kadar abu, reaksi hidrolisis untuk menetapkan serat kasar, ekstraksi soklet untuk mengukur kadar lemak, metode Kjeldahl untuk menentukan kadar protein. Penentuan kadar karbohidrat by difference dengan cara 100% dikurangi kadar air, abu, protein dan lemak. Hasil analisis terhadap komposisi zat gizi teh hitam, teh hijau dan teh daun murbei disajikan dalam Tabel 5.
Tabel 5 Analisis proksimat teh hitam, teh hijau dan teh daun murbei
Komposisi (%) Teh Hitam Teh Hijau Teh Daun Murbei
Kadar Air* 1,84±0,48 1,17±0,10 2,37±0,32
Kadar Protein 19,72±0,06 25,94±0,30 26,86±0,21
Kadar Lemak 2,88±0,05 4,53±0,06 4,15±0,04
Kadar Abu 5,68±0,12 5,22±0,06 6,41±0,04
Kadar Karbohidrat 69,88±0,43 63,14±0,28 60,21±0,25 *)berat basah
Kadar Air
Hasil analisis kadar air teh hitam, teh hijau dan teh daun murbei menunjukkan kadar air teh daun murbei paling tinggi, yaitu 2,37% bk, sedangkan kadar air teh hitam dan teh hijau, yaitu 1,84% bk dan 1,17%bk. Bila dibandingkan dengan SNI teh hitam (SNI 01-1902-2000), ketiga jenis teh memenuhi persyaratan SNI teh yang mensyaratkan kadar air maksimal adalah 8%.
Kadar Protein
Hasil analisis menunjukkan teh daun murbei memiliki kandungan protein yang paling tinggi, yaitu 26,86% bk dibanding dengan teh hitam dan teh hijau, yaitu 19,72% bk dan 25,94% bk. Daun teh mengandung protein yang berperan dalam pembentukan aroma terutama pada teh hitam. Perubahan utama selama pelayuan adalah hidrolisis protein menjadi asam – asam amino. Asam amino bersama karbohidrat dan katekin akan membentuk senyawa aromatis asam amino. Seluruh protein dan asam amino bebas berkisar antara 1,4 – 5% bk daun (PPTK
2008). Berdasarkan Cabrera et al. (2006) kandungan protein teh hijau sebesar 15 – 20% bk.
Kadar Lemak
Hasil analisis menunjukkan teh hijau memiliki kandungan lemak paling tinggi, yaitu 4,53% bk dibanding teh daun murbei dan teh hitam, yaitu 2,88% bk dan 4,15% bk. Hampir semua bahan pangan mengandung lemak dan minyak. Dalam tanaman, lemak disintesis dari suatu molekul gliserol dengan tiga molekul asam lemak yang terbentuk dari kelanjutan oksidasi karbohidrat dalam proses respirasi. Proses pembentukan lemak dalam tanaman dapat dibagi menjadi tiga tahap, yaitu pembentukan gliserol, pembentukan molekul asam lemak, kemudian kondensasi asam lemak dengan gliserol membentuk lemak. Pada daun teh kandungan lemak lebih tinggi pada daun yang lebih tua (Rohdiana 2009).
Kadar Abu
Pengukuran kadar abu dilakukan untuk mengetahui kandungan mineral yang terdapat pada teh. Kadar abu (Tabel 4) menunjukkan teh daun murbei mempunyai kadar abu yang paling tinggi, yaitu 6,41% bk dibandingkan dengan teh hitam dan teh hijau masing-masing yaitu 5,68% bk dan 5,22% bk. Berdasarkan SNI teh hitam (SNI 01-1902-2000) kadar abu miniman untuk teh 4% dan maksimal 8%, maka ketiga jenis teh telah memenuhi persyaratan SNI untuk kadar abu.
Karbohidrat
Hasil analisis karbohidrat by difference menunjukan teh hitam memiliki kandungan teh paling tinggi, yaitu 69,88% bk dibandingkan teh hijau dan teh daun murbei, yaitu 63,14% bk dan 60,21% bk. Daun teh mengandung karbohidrat baik dalam bentuk sederhana maupun kompleks. Kelompok karbohidrat yang perannya sangat penting yaitu pektin.
Berdasarkan penelitian yang dilakukan oleh Ama (2008) daun murbei segar memiliki kandungan karbohidrat lebih rendah dibandingkan ekstrak daun murbei. Daun muda segar memiliki kandungan karbohidrat sebesar 12,16% bk sedangkan kandungan karbohidrat dauntua, yaitu 14,75% bk.
Tes Toleransi Glukosa
Tes toleransi glukosa dilakukan pada tikus normal (n=3) untuk semua perlakuan. Hasil uji tolerans