KARAKTERISASI DAN EKSPRESI GEN COAT PROTEIN
Tomato infectious chlorosis virus PADA Escherichia coli
FITRIANINGRUM KURNIAWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis berjudul “Karakterisasi Dan Ekspresi Gen Coat Protein Tomato infectious chlorosis virus Pada Escherichia coli”
adalah karya saya sendiri, dengan arahan Komisi Pembimbing dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir tesis ini.
Bogor, Januari 2012
ABSTRACT
FITRIANINGRUM KURNIAWATI. Characterization and Expression of Tomato infectious chlorosis virus Coat Protein Gene in Escherichia coli. Supervised by GEDE SUASTIKA and GIYANTO.
Tomato infectious chlorosis virus (TICV) is a member of Crinivirus genus. TICV infects tomato crop in Garut and Cipanas, West Java Indonesia. Tomato initially showed bright interveinal yellowing symptoms. The coat protein gene (CP-TICV) was amplified by RT-PCR from total RNA extracted from infected tomato leaves and the amplified fragment was cloned and completely sequenced. The fragment was subsequently subcloned into the pET-21b expression vector. The recombinant plasmid was transformed to Escherichia coli strain BL21(DE3)pLysS to express the coat protein. The coat protein fused to a 6xhistag, was purified by affinity chromatography using a NiNTA spin column. The identity of the purified protein was confirmed by SDS-PAGE. In this experiment, 792 bp of CP-TICV gene of TICV virus has been successfully cloned, sequenced, and expressed in E. coli. Based on nucleotide sequences alignment analysis, TICV-Indonesia strain showed 100% identity to TICV –Spain strain and 99% identity to North America, France, and California strains and based on amino acid sequences alignment analysis, TICV-Indonesia strain showed 100% identity to TICV –Spain, North America, France strains and 99.2% identity to California strain. CP-TICV showed over expressed in E. coli when it is induced with 1 mM IPTG and incubated at 37oC. Purified CP-TICV-Histag recombinants protein sized 29 kDa based on SDS-PAGE analysis.
RINGKASAN
FITRIANINGRUM KURNIAWATI. Karakterisasi dan Ekspresi Gen Coat Protein Tomato infectious chlorosis virus pada Escherichia coli. Dibimbing oleh
GEDE SUASTIKA dan GIYANTO.
Penyakit klorosis pada tanaman tomat telah ditemukan di Indonesia. Penyebab penyakit klorosis ini adalah Tomato infectious chlorosis virus (TICV) anggota dari genus Crinivirus (famili Closteroviridae). Pada tanaman tomat, infeksi TICV menyebabkan berbagai gejala antara lain: klorosis antar tulang daun (interveinal yellowing), nekrotik, daun rapuh, ukuran buah mengecil, dan proses pemasakan buah terganggu. Deteksi virus dapat dilakukan dengan reverse transcription–polymerase chain reaction (RT-PCR) dan dengan pendekatan serologi yaitu enzyme-linked immunosorbent assay (ELISA), tissue blot immunosorbent assay (TBIA), dan dot blot immunosorbent assay (DIBA). Antiserum merupakan komponen utama dalam uji serologi, namun demikian antiserum terhadap TICV belum tersedia di Indonesia. Usaha penyediaan antiserum bermanfaat sebagai sarana dalam mendeteksi TICV. Ekspresi gen coat protein (CP) TICV pada Escherichia coli menjanjikan tersedianya antigen dalam jumlah yang cukup untuk produksi antiserum.
diketahui berukuran 792 bp. Berdasarkan hasil analisis alignment two sequence runutan nukleotida gen CP tersebut, TICV isolat Indonesia mempunyai kemiripan 100% dengan TICV isolat Spanyol, dan 99% dengan isolat Amerika Utara, Perancis, dan California. Sedangkan berdasarkan hasil analisis alignment two sequence runutan asam amino protein CP tersebut, TICV isolat Indonesia mempunyai kemiripan 100% dengan Spanyol, Amerika Utara, dan perancis, serta 99.2% dengan California. Ekspresi gen CP-TICV berhasil dilakukan pada E. coli dengan menginduksinya menggunakan 1 mM IPTG pada 37 oC selama semalam. Protein CP-TICV berhasil dipurifikasi dengan NiNTA spin column dan melalui analisis SDS-PAGE CP-TICV diketahui berukuran 29 kDa.
© Hak cipta milik Institut Pertanian Bogor, tahun 2012
Hak cipta dilindungi Undang Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
KARAKTERISASI DAN EKSPRESI GEN COAT PROTEIN
Tomato infectious chlorosis virus PADA Escherichia coli
FITRIANINGRUM KURNIAWATI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Entomologi-Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Karakterisasi dan Ekspresi Gen Coat Protein Tomato infectious chlorosis virus pada Escherichia coli
Nama Mahasiswa : FITRIANINGRUM KURNIAWATI
NIM : A352080051
Disetujui
Komisi Pembimbing
Dr. Ir. Gede Suastika, M.Sc Dr. Ir. Giyanto, M.Si Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Fitopatologi
Dr. Ir. Sri Hendrastuti Hidayat, M.Sc Dr. Ir. Dahrul Syah, M.Sc Agr
Tanggal Ujian: Tanggal Lulus:
PRAKATA
Puji dan syukur alkhamdulillah penulis panjatkan kehadirat Allah Subhanahuwata’ala karena berkat dan rahmat-Nya sehingga tesis yang berjudul
”Karakterisasi dan Ekspresi Gen Coat Protein Tomato infectious chlorosis virus pada Escherichia coli” dapat terselesaikan.
Penulis menyampaikan rasa terima kasih yang tak terhingga kepada Dr. Ir. Gede Suastika, M.Sc selaku ketua komisi pembimbing dan Dr. Ir. Giyanto, M.Si selaku anggota komisi pembimbing, atas segala kesabaran, bimbingan, nasihat, kritik, dan sarannya sehingga tesis ini dapat terselesaikan. Penulis juga mengucapkan terima kasih kepada Dr. Ir. Sri Hendrastuti Hidayat, M.Sc selaku Ketua program studi Fitopatologi dan semua dosen Departemen Proteksi Tanaman IPB atas ilmu yang bermanfaat. Terimaksih juga penulis ucapkan kepada Dr. Ir. Tri Asmira Damayanti, M. Agr selaku dosen penguji tamu.
Penulis juga mengucapkan terima kasih kepada Ketua Kelompok Peneliti (Kelti) Biokimia Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian (BB-BIOGEN) Dr. I Made Samudera, yang telah memberikan ijin kepada penulis untuk mengerjakan penelitian di Laboratorium Biokimia BB-BIOGEN, dan kepada Dr. Ir. Tri Puji Priyatno M.Sc, Dr. Ifa Manzila, M.Si terimakasih atas bimbingan, arahan, dan masukan selama penulis mengerjakan penelitian di BB-BIOGEN.
Secara khusus penulis menyampaikan penghargaan dan terima kasih kepada yang tercinta ayahanda dan ibunda atas segala pengertian, dorongan, dan doa yang tiada henti sehingga penulis dapat menyelesaikan pendidikan, serta kepada bapak dan ibu mertua terimakasih atas doa dan semangatnya. Ungkapan terima kasih juga disampaikan kepada suami Bangun Sulistyobudi, ST dan ananda tersayang Ayazid Iqbal Budialbani atas segala semangat, pengertian, kasih sayang, motivasi dan inspirasi selama penulis menempuh studi.
Akhirnya penulis berharap mudah-mudahan tulisan ini dapat bermanfaat bagi kita semua.
Bogor, Januari 2012
RIWAYAT HIDUP
Penulis dilahirkan di Sukoharjo, Jawa Tengah pada tanggal 28 Juni 1983 dari pasangan Bapak Kumpul Hermawan dan ibu Tri Budiarsi. Penulis merupakan putri pertama dari empat bersaudara.
DAFTAR TABEL
No Halaman
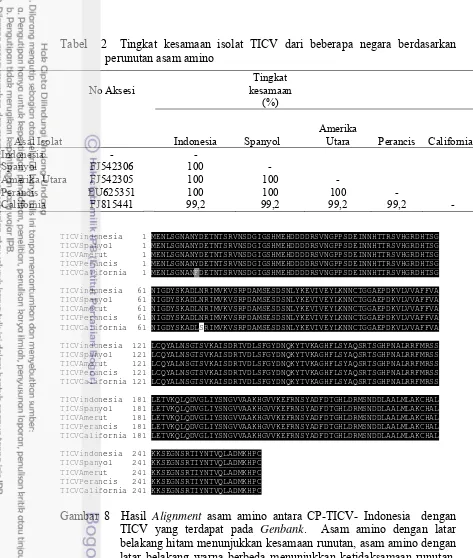
1. Tingkat kesamaan isolat TICV dari beberapa negara
berdasarkan perunutan nukleotida... 29 2. Tingkat kesamaan isolat TICV dari beberapa negara
19
DAFTAR GAMBAR
No Halaman
1. Partikel TICV berbentuk seperti benang memanjang
(filamentous) dan lentur... 5
2. Organisasi genom TICV... 6
3. Vektor ekspresi pET-21b... 12
4. Gejala penyakit klorosis di lapangan... 26
5. Deteksi RT-PCR TICV dan ToCV dengan primer spesifik pada tanaman tomat yang bergejala klorosis... 27
6. Amplifikasi gen CP-TICV... 28
7. Hasil Alignment nukleotida antara genom TICV- Indonesia dengan genom TICV yang terdapat pada Genbank ... 30
8. Hasil Alignment asam amino antara genom TICV- Indonesia dengan genom TICV yang terdapat pada Genbank ... 31
9. Pohon filogenetik berdasarkan runutan nukleotida (A) dan asam amino (B) gen protein selubung isolat TICV-Indonesia 32 10. Hasil elektroforesis 1% gel agarose A) pemotongan plasmid rekombinan pET-21b-CP, B) hasil PCR koloni tunggal E. coli rekombinan... 33
11. Optimasi ekspresi protein CP TICV pada beberapa suhu 35
12. Analisis SDS-PAGE ekspresi CP-TICV pada bakteri E. coli strain BL21(DE3)pLysS yang diinduksi dengan IPTG dan yang tidak diinduksi IPTG... 36
1
PENDAHULUAN
Latar Belakang
Tanaman tomat (Lycopersicon esculentum Mill. ) merupakan salah satu komoditas hortikultura yang penting di Indonesia. Tomat mempunyai kandungan zat gizi yang banyak, seperti vitamin A, C, karbohidrat, lemak, protein, dan kalsium. Selain kaya kandungan gizinya, tomat juga mengandung likopen yang berfungsi sebagai antioksidan, mengobati gangguan pencernaan, memulihkan fungsi lever dan mencegah penggumpalan dan pembekuan darah (Astawan 2008).
Penyakit klorosis merupakan salah satu penyakit yang menyerang tomat. Penyakit klorosis sudah banyak dilaporkan menyerang tanaman tomat di berbagai negara. Di Indonesia, penyakit ini telah ditemukan di beberapa sentra produksi tomat, seperti di Garut, Cianjur, Bogor, Magelang, dan Yogyakarta (Fitriasari 2010; Hartono & Wijonarko 2007). Penyakit klorosis disebabkan oleh Tomato infectious chlorosis virus (TICV) (Dalmon et al. 2005; Tsai et al. 2004). TICV merupakan anggota dari genus Crinivirus (famili Closteroviridae) (Wisler et al. 1996; Li et al. 1998; Jacquemond et al. 2008).
Gejala serangan TICV pada tanaman tomat ditunjukan oleh klorosis pada bagian antara tulang daun (interveinal yellowing). Jika gejala klorosis sangat parah, daun akan mengalami nekrotik (kematian jaringan) dan menjadi rapuh, serta ukuran buah menjadi lebih kecil, mudah gugur dan proses pemasakan terganggu sehingga hasil panen menurun (Wisler et al. 1998a; Wisler et al. 1998b; Vaira et al. 2002).
TICV ditularkan dari satu tanaman ke tanaman lainnya oleh serangga vektor Trialeurodes vaporariorum (Hemiptera: Aleyrodidae) yang dikenal dengan nama kutu kebul. Penularan dapat terjadi secara cepat ke seluruh areal pertanaman karena serangga vektor bersifat aktif. TICV ditularkan oleh serangga vektor secara semipersisten (Duffus et al. 1994; Wintermantel 2004).
2
yang mahal. Selain RT-PCR, pendekatan serologi enzyme linked immunosorbent assay (ELISA), tissue blot immunosorbent assay (TBIA), dan dot blot immunosorbent assay (DIBA) juga diterapkan untuk deteksi virus tanaman karena lebih murah namun tetap cepat. Deteksi secara serologi ini memerlukan antiserum. Antiserum TICV belum tersedia di Indonesia, sehingga menyulitkan dalam mendeteksi virus ini. Usaha ke arah penyediaan antiserum akan sangat bermanfaat sebagai sarana dalam mendeteksi TICV.
Secara konvensional, siapan virus murni digunakan sebagai antigen dalam produksi antiserum. Untuk mendapatkan siapan virus murni diperlukan titer virus yang tinggi pada jaringan tanaman sumber virus. Syarat ini tidak dapat dipenuhi oleh TICV dalam jaringan tanaman tomat. TICV adalah virus yang penyebarannnya di dalam tanaman inang terbatas pada jaringan floem, oleh karena itu konsentrasi partikelnya sangat rendah dalam keseluruhan jaringan tanaman. Penyebaran yang terbatas pada jaringan floem ini menyebabkan TICV sangat sulit untuk diekstraksi agar mendapatkan jumlah yang memadai.
3
Tujuan Penelitian
4
TINJAUAN PUSTAKA
Tomato infectious chlorosis virus (TICV)
Tomato infectious chlorosis virus (TICV) pertama kali ditemukan pada tahun 1993 di daerah Irvine Orange, California. Pengamatan pertama kali dilakukan oleh Bill Glover (Crops Production Service-Riverside menunjukkan adanya gejala serangan TICV pada pertanaman tomat). Tanaman yang sakit ini menunjukkan gejala menguning pada bagian di antara tulang daun (interveinal yellowing) dan nekrosis. Survei untuk mengetahui kejadian penyakit yang disebabkan oleh TICV dilakukan di daerah dekat Irvine dan sebelah selatan Irvine pada musim semi tahun 1994. Survei penyakit ini dilakukan kembali di Orange, San Diego dan Carlsbad. Pada bulan Juli 1994 Dr. Bryce Falk menemukan gejala serangan TICV yang sama pada pertanaman tomat di daerah Yolo, California (pertanian organik Universitas California). TICV diisolasi dari pertanaman tomat di lapang dan rumah kaca di kampus Davis. Penyakit kemudian ditemukan di pembibitan tomat komersial rumah kaca, 15 mil dari Davis bagian utara dan California Tengah (daerah San Benito) (Duffus et al. 1996). Penyakit ini menyebar dan menimbulkan kerugian yang sangat besar di Negara penghasil tomat seperti Yunani (Dovas et al. 2002), Italia dan Jepang (Hartono et al. 2003), Taiwan (Tsai et al. 2004) dan Spanyol (Font et al. 2004).
Survei lapang terhadap penyakit ini telah dilakukan di Indonesia pada tahun 2005 sampai awal 2006, yaitu di daerah Magelang, Jawa Tengah dan Purwakarta, Jawa Barat. Penyakit yang disebabkan TICV ini sering disebut dengan penyakit ungu oleh petani di Magelang. Rata-rata intensitas penyakit ini di Magelang mencapi 30% sampai 80% (Hartono dan Wijonarko 2007). Serangan TICV telah ditemukan di dataran tinggi di Kecamatan Cikajang, Kabupaten Garut, Jawa Barat (Fitriasari 2010).
5
dengan simetri helix. Menurut Wisler et al. (1996) partikel virus TICV, yang dilihat pada siapan murni hasil ekstraksi tanaman tomat sakit, berbentuk seperti benang (threadlike), memanjang (filamentous), dan lentur (flexuous). Partikel TICV memiliki panjang 850 – 900 nm (Duffus et al. 1996, Liu et al. 2000).
Gambar 1 Partikel TICV berbentuk seperti benang (threadlike), memanjang (filamentous) dan lentur (flexuous) (Liu 2000).
6
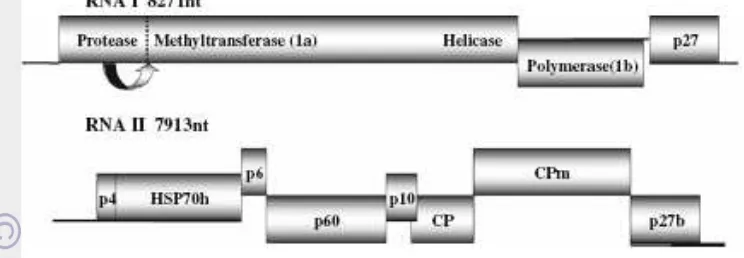
Gambar 2 Organisasi genom TICV (Wintermantel et al. 2009).
Infeksi TICV pada tanaman tomat menyebabkan daun-daun tomat klorosis, yaitu menguning di antara tulang daun (interveinal yellowing) yang berasosiasi dengan berkurangnya kemampuan fotosintesisnya. Pada perkembangan selanjutnya daun-daun menjadi rapuh (leaf brittleness), mengalami nekrotik pada beberapa bagian dan warna bagian yang nekrotik menjadi merah keunguan (bronzing), kebugaran (vigor) tanaman menjadi sangat berkurang, dan apabila menghasilkan buah maka ukurannya jauh lebih kecil dari normal dan proses pematangannya terganggu, serta mudah gugur (early senescence) sehingga sangat menurunkan bahkan meniadakan nilai ekonomi tanaman yang terinfeksi (Duffus et al. 1996; Dalmon et al. 2005).
TICV tidak dapat ditularkan secara mekanis, tetapi dapat ditularkan dengan serangga vektor (kutu kebul rumah kaca (Trialeurodes vaporariorum Westwood.) (Hemiptera: Aleyrodidae)) secara semipersisten. Berdasarkan ketidakmampuan virus tumbuhan melakukan sirkulasi dalam vektor, virus semipersisten sama non-persisten. Sebaliknya, berdasarkan kemampuan penularannya virus semipersisten lebih menyerupai virus persisten, yaitu membutuhkan waktu yang relative lama. Menurut Wisler et al. (1998a) TICV memiliki periode persistensi selama 4 hari. Periode makan akuisisi di atas 48 jam. TICV dapat ditularkan dengan waktu yang terbatas antara 1-9 hari tergantung dari virusnya.
7
yang meliputi: famili Solanaceae (Tomat (Lycopersicon esculentum Mill., tomatillo (Physalis ixocarpa Brot.), Physalis alkekengi L., P. floridana. Rybd., P. wrightii Gray., dan kentang (Solanum tuberosum L.), Nicotiana benthamiana Domin., N. clevelandii Gray., N. glauca Graham., petunia (Petunia hybrida Vilm.)) ; Chenopodiaceae (Chenopodium capitatum L., C. murale L.) ; Compositae (artichoke (Cynara scolymus L.), Cynara scolymus L., lettuce (Lactuca sativa L.), Picris echioides L., Senecio vulgaris L., Sonchus oleraceus L., Zinnia elegans Jacq) ; Cruciferae (Capsella bursa-pastoris (L.) Medic)) ; Geraniaceae (Erodium cicutarium (L.)L’Her., Geranium dissectum L.) ; Leguminosae (Trifolium subterraneum L.) ; Malvaceae ( Anoda cristata (L.) Schlecht.) ; Umbelliferae (Conium maculatum L.) (Duffus et al. 1996; Wisler et al. 1996; Li et ai. 1998).
Deteksi TICV pada tomat sangat diperlukan dalam strategi pengendalian. Seiring dengan pesatnya kemajuan pada bidang bioteknologi, metode deteksi virus tumbuhan juga berkembang sangat cepat. Teknik RT-PCR dikembangkan untuk melakukan analisis terhadap molekul RNA hasil transkripsi yang terdapat dalam jumlah sangat sedikit di dalam sel. Oleh karena PCR tidak dapat dilakukan dengan menggunakan RNA sebagai cetakan, maka terlebih dahulu dilakukan proses transkripsi balik (reverse transcription) terhadap molekul RNA sehingga diperoleh molekul cDNA (complementary DNA). Molekul cDNA tersebut kemudian digunakan sebagai cetakan dalam proses PCR. Teknik RT-PCR ini sangat berguna untuk mendeteksi ekspresi gen, untuk amplifikasi RNA sebelum dilakukan kloning dan analisis, maupun untuk diagnosis agensia infektif maupun penyakit genetik (Yuwono 2006).
8
mampu menyintesis cDNA sampai sepanjang 10 kb, sedangkan Tth DNA polymerase mampu menyintesis cDNA sampai sepanjang 1-2 kb (Yuwono 2006).
Teknik deteksi TICV dengan RT-PCR telah dilakukan oleh para peneliti menggunakan beberapa primer. Hartono & Wijonarko (2007) dan Jaquemond (2008) telah melakukan deteksi TICV dengan teknik RT-PCR menggunakan primer HSP-70 h, Fitriasari (2010) mendeteksi TICV dengan primer CP, serta Andini (2011) dan Nurulita (2011) dengan primer CPm.
Teknik serologi juga merupakan salah satu cara deteksi dan identifikasi suatu patogen dalam suatu inang. Teknik serologi dengan hibridisasi dot blot menggunakan label digoxigenin TICV probe cRNA, ELISA (Enzyme linked immunosorbent assay), western blot telah dikembangkan dan digunakan untuk mendeteksi TICV pada tanaman tembakau (Nicotiana clevelandii), Physalis wrightii, dan tomat di laboratorium (Duffus et al. 1996; Wisler 1996, dan Li et al. 1998). Uji serologi merupakan pengujian berdasarkan sifat protein suatu virus. Pada dasarnya uji serologi adalah suatu uji yang memerlukan antigen dan antibodi, yang kemudian reaksi akan terjadi antara antigen dan antibodi dalam suatu substrat (Bos 1994 ; Wahyuni 2005).
9
Kloning
Salah satu teknologi DNA rekombinan yang dikembangkan saat ini adalah kloning gen. Menurut Glick & Pasternak (2003) kloning gen adalah sejumlah eksperimen yang bertujuan memindahkan DNA dari satu organism ke organism lain. Eksperimen DNA rekombinan secara umum meliputi: (1) ekstraksi DNA sisipan dari organisme donor, (2) pemotongan dan penyambungan secara enzimatis ke DNA vektor untuk membentuk molekul DNA rekombinan baru, (3) pemindahan hasil konstruksi vektor kloning-DNA sisipan ke dalam suatu sel inang dan pemeliharaan di dalam sel tersebut, dan (4) penyeleksian sel-sel inang yang membawa konstruksi DNA.
Prinsip dari ekstraksi DNA dalam proses kloning adalah menghancurkan dinding sel, baik secara mekanis atau enzimatis; melisis sel dengan menambahkan deterjen (seperti: SDS; membersihkan debris sel menggunakan pelarut organik fenol dan chloroform-isoamilalkohol; dan mengendapkan DNA dari lisat jernih dengan menambahkan etanol dan garam natrium (Old & Primrose 2003).
10
asing masuk kedalam sel melalui membran sel dari lingkungannya (sel kompeten). Sel kompeten dibuat dengan menurunkan suhu pertumbuhan sel beberapa lama, lalu memberikan kejutan panas. Kemungkinan DNA asing masuk kedalam sel menjadi lebih besar jika pada lingkungannya terdapat ion-ion divalen Ca2+ dan Mg2+. Suatu inang yang baik hendaknya memenuhi prasyarat: pertumbuhan cepat, non patogenik, mampu menangkap molekul DNA dan stabil dalam kultur memiliki enzim yang sesuai untuk replikasi vektor rekombinan, mempunyai informasi genetik selengkap mungkin, dan mempunyai genotip spesifik untuk efektifitas hasil kloning (Glick & Pasternak 2003)
11
Keberhasilan transformasi dipengaruhi oleh: jenis plasmid yang digunakan, suhu, jumlah dan ukuran DNA, lama perlakuan, adanya enzim nuclease pada sel inang, lama dan cara pemberiannya kejutan panas, spesifitas panas, kekuatan ion, konformasi dan konsentrasi DNA. Untuk menghindari religasi vektor plasmid maka alkalin fosfatase dapat digunakan sehingga tidak muncul transforman yang tidak mengandung insert (Glick & Pasternak 2003).
Ekspresi Gen
Proses ekspresi gen merupakan proses transformasi informasi genetik melalui transkripsi dan translasi, untuk pembentukan protein atau enzim. Protein dan enzim sangat penting dalam proses metabolisme, sehingga ekspresi gen sebenarnya merupakan proses pengendalian metabolisme oleh gen (Jusuf 2009).
Secara umum dikenal dua sistem regulasi ekspresi gen, yaitu regulasi positif dan negatif. Regulasi ekspresi gen melibatkan suatu operon lac. Operon lac adalah operon yang dibutuhkan dalam transpor dan metabolisme dari laktosa di E.coli. Operon ini diregulasi oleh berbagai faktor seperti adanya glukosa dan laktosa. Gen struktural pada operan lac tersebut baru akan aktif bila ada induksi dari laktosa. Sistem regulasinya terjadi pada tahapan transkripsinya karena energi yang diperlukan akan menjadi lebih sedikit dan efisien. Bila tidak ada laktosa, gen lacI akan menghasilkan protein represor yang mengikat operator lac dan mencegah terjadinya transkripsi karena enzim RNA polimerase tidak lagi dapat melekat di situs tersebut. Akan tetapi, saat laktosa ditambahkan ke dalam mediumnya, represor LacI akan terlepas karena terikat pada alolaktosa lalu transkripsi ketiga gen struktural akan berjalan (Kimball 2006).
12
sebagai elemen ekstra kromosomal, (2) penanda seleksi, biasanya merupakan gen-gen penyandi resistensi terhadap senyawa toksik, seperti antibiotik, dan (3) situs-situs enzim restriksi unik sebagai situs kloning sisipan DNA. Plasmid yang berkualitas tinggi biasanya berukuran kecil, berbentuk sirkular, dan mempunyai banyak jumlah kopi (Glick & Pasternak 2003).
Salah satu pendekatan untuk mengendalikan ekspresi adalah dengan menggunakan vektor ekspresi yang mengandung T7 lac promoter (Studier et al. 1990). Sistem pET adalah alat ekspresi protein yang kuat, karena dapat mengatur ekspresi protein dengan T7 / T7 lac promoter, pLysS atau host pLysS E (Novagen 2003). Vektor pET-21b merupakan vektor ekspresi yang memiliki promoter T7, yang semakin optimal dengan adanya elemen operator yang mengandung runutan operator lac yang mampu meningkatkan ikatan repressor lac dan memastikan rendahnya represi promoter T7.
pET-21b berukuran sekitar 5.4 kb yang memiliki promoter T7, lacO, synthetic ribosome-binding site (RBS), ATG (start codon), runutan 6xhis-tag, multiple cloning site (MCS) dan stop codons (Gambar 5). Vektor ini memiliki situs yang resisten terhadap ampisilin. Plasmid pET-21b dapat ditransformasi dalam sel E. coli BL21(DE3)pLysS. Ekspresi protein diinduksi dengan penambahan isopropyl-thio-D-galactoside (IPTG).
13
Vektor pET-21b menghasilkan 6xhis-tag pada ujung C dari protein yang terekspresi. His-tag ini memudahkan dalam proses purifikasi karena afinitasnya terhadap resin nickel-nitrilotriacetic (Ni-NTA) (Qiagen 2003). pET-21b mempunyai kelebihan antara lain: mampu mengatur transkripsi gen target, hanya membutuhkan induser dengan konsentrasi yang kecil untuk dapat mengekspresikan gen target, dan hampir semua sel dari gen target terekspresi (Novagen 2003).
Menurut Glick & Pasternak (2003), penyisipan gen dalam suatu vektor tidak memberikan jaminan bahwa gen yang bersangkutan akan diekspresikan. Proses-proses dalam ekspresi suatu protein antara lain: (1) transkripsi, (2) translasi, (3) proses proteolitik dan degradasi, (4) lokalisasi seluler, (5) pelipatan protein, dan (6) pertumbuhan sel.
Laju ekspresi gen asing sangat tergantung pada karakteristik organisme inang yang digunakan. Pada umumnya produksi protein rekombinan masih menggunakan E.coli sebagai inang. Keunggulan produksi protein rekombinan dengan E. coli adalah produksi cepat dan murah, informasi genetik, karakteristik biologi molekuler, biokimia, dan fisiologinya paling banyak diketahui dan diteliti. Namun demikian, penggunaan sistem inang dengan E. coli mempunyai kelemahan. Kelemahan tersebut antara lain: (1) Sinyal transkripsi dan translasi spesies lain tidak dikenali dengan baik oleh inang E. coli, sehingga ekspresi gen-gen heterolog di E. coli lemah, (2) sulit mempelajari fungsi gen-gen-gen-gen dengan lintasan metabolic dan pengaturan yang tidak terdapat di E. coli, seperti degradasi hidrokarbon, dan (3) kemungkinan toksisitas dari produk-produk gen-gen heterolog terhadap sel E. coli. Selain hal-hal tersebut di atas, ada masalah serius pada ekspresi protein rekombinan pada E. coli, yaitu degradasi protein produk secara cepat dan seringkali protein rekombinan terakumulasi dalam sel inang dalam bentuk agregat kompak, bersifat inaktif tak larut, yang disebut badan inklusi (inclusion bodies). Hal ini terjadi akibat keterbatasan E. coli membentuk struktur tiga dimensi protein secara benar dalam proses pelipatan pasca translasi (Glick & Pasternak 2003).
14
15
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilakukan di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dan Laboratorium Biokimia Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian (BB-BIOGEN) sejak Maret 2009 hingga April 2011.
Tanaman Sumber Virus
Koleksi dan Pengumpulan Tanaman Sakit. Koleksi dan pengumpulan tanaman sakit dilakukan di sentra produksi tomat di Cikajang-Garut (pada ketinggian 1287 m dpl), Cipanas-Cianjur (1225 m dpl). Pengamatan ditujukan terhadap tanaman tomat yang bergejala klorosis, yaitu klorosis diantara tulang daun, daun berwarna keunguan dan nekrotik, serta mudah rapuh. Tanaman tomat yang menunjukkan gejala tersebut kemudian diambil bagian pucuk daun yang berkembang penuh, dan ditempatkan di dalam coolbox agar daun tersebut tetap segar sampai di laboratorium sebelum diberi perlakuan lebih lanjut. Keberadaan TICV pada sampel daun yang diambil dipastikan melalui metode RT-PCR.
Deteksi TICV dan ToCV dengan RT-PCR. Sebanyak 0.1 g jaringan daun tomat didinginkan dengan nitrogen cair, kemudian dilumatkan dengan mortar sampai menjadi tepung halus dan RNA total diekstraksi menggunakan RNeasy Plant Mini Kits (Qiagen). RNA hasil ekstraksi disintesis menjadi cDNA dengan menggunakan teknik RT. Reaksi RT dibuat dengan total volume 10 µl yang mengandung 2 µl RNA total, 1 µl buffer RT 10X, 0,35 µl 50 mM DTT (dithiothreitol), 2 µl 10 mM dNTP (deoksiribonukleotida triphosphat), 0,35 µl M-MuLV Rev, 0,35 µl RNase inhibitor, 0,75 µl oligo (dT), dan 3,2 µl H2O. Reaksi
5’-16
AATTAAAAGCTTTTAGCAACCAGTTATCGATGCAAG-3’ dan ToCV-CP F-Bam no ATG: 5’-AATTAAGGATCCGAGAACGATGCTGTTAC-3’) dan spesifik TICV (TICV–CP F-Bam no ATG ( 5’-AATTAAGGATCCGAAAACTTATCTGGTAATGCAAAC-3’ dan TICV–CP R-Hind 5’-AATTAAAAGCTTTTAGCATGGGTGTTTCATATCAGCC-3’), 2,5 µl buffer PCR 10X + Mg2+, 0,5 µl 10 mM dNTP, 2,5 µl sucrose cresol 10X, 0,3 µl Taq DNA polymerase, 14,2 µl H2O, dan 1 µl DNA template. PCR dilakukan pada
Automated Thermal cycler (Gene Amp PCR System 9700; PE Applied Biosystem, USA). Proses ini didahului dengan denaturasi awal pada 94ºC selama 4 menit, dilanjutkan dengan 30 siklus yang terdiri dari denaturasi pada 94ºC selama 1 menit, penempelan primer (annealing) pada 55ºC selama 1 menit, dan pemanjangan (Extension) pada 72ºC selama 2 menit, dan diikuti pemanjangan akhir pada 72ºC selama 10 menit. Amplikon hasil PCR dielektroforesis dengan 1% agarose gel yang mengandung ethidium bromida (EtBr) dan TAE bufer dengan voltase 50V selama 60 menit. Hasil elektroforesis divisualisasikan dengan Transluminator UV dan didokumentasikan dengan kamera digital.
Karakterisasi Gen CP TICV
17
dibuang dan mini column diletakan balik dalam tabung koleksi untuk dikeringkan dengan cara disentrifugasi dengan kecepatan 10000 rpm selama 2 menit. RNA total yang terikat dalam mini column dielusi dengan 40 µl RNAse free water ke dalam Rneasy dan disentrifugasi dengan kecepatan 10000 rpm selama 1 menit dalam tabung mikro yang baru setelah didiamkan selama 10 menit.
Sintesis complementary (c) DNA. RNA hasil ekstraksi disintesis menjadi cDNA dengan menggunakan teknik Reverse Transcription Polymerase Chain Reaction (RT-PCR). Reaktan RT-PCR dibuat dengan total volume 10 µl yang mengandung 2 µl RNA total, 1 µl buffer RT 10X, 0,35 µl 50 mM DTT (dithiothreitol), 2 µl 10 mM dNTP (deoksiribonukleotida triphosphat), 0,35 µl M-MuLV Rev, 0,35 µl RNase inhibitor, 0,75 µl oligo (dT), dan 3,2 µl H2O.
Komponen-komponen tersebut digunakan untuk satu kali reaksi RT. Reaksi RT dilakukan dalam sebuah Automated Thermal cycler (Gene Amp PCR System 9700; PE Applied Biosystem, USA) yang diprogram untuk satu siklus pada suhu 25ºC selama 5 menit, 42ºC selama 60 menit, dan 70ºC selama 15 menit. Siapan cDNA hasil RT digunakan sebagai template dalam reaksi PCR.
Amplifikasi Gen CP-TICV dengan PCR. Reaktan PCR dengan total volume 25 µl terdiri atas 1 µl masing-masing primer, 2,5 µl buffer PCR 10X + Mg2+, 0,5 µl 10 mM dNTP, 2,5 µl sucrose cresol 10X, 0,3 µl Taq DNA polymerase, 14,2 µl H2O, dan 1 µl cDNA. PCR dilakukan pada Automated
18
Perunutan Nukleotida dan Asam Amino Gen CP-TICV. Sebanyak 50µl PCR sampel yang positif mengandung CP-TICV dikirim ke PT. Macrogen Incorporation (Korea Selatan). Hasil perunutan nukleotida dan asam amino kemudian digunakan untuk analisis kesejajaran dengan runutan nukleotida dan asam amino TICV yang telah dipublikasikan di GenBank dengan program BLAST (Basic Local Alignment Search Tools) (NCBI 2010). Analisis filogenetika dilakukan menggunakan program PHYLIP versi 3.6 (University of Washington). Sebelum dianalisis, runutan nukleotida semua isolat yang terpilih dimodifikasi dengan software Clustal X 1.83 untuk menyamakan format runutannya. Matrik jarak genetika dihitung dengan menggunakan matrik parameter dalam program komputer DNA ML dan untuk runutan asam amino CP menggunakan ProML. Pohon filogenetika digambarkan dengan program DRAWTREE dalam paket program PHYLIP. Analisis boostrap dengan 1000 ulangan dilakukan menggunakan program SEQBOOT dan konsensus pohon filogenetika dibuat dengan program CONSENSE. Pohon filogenetik digambarkan dengan program Mega 4 dalam paket program PHYLIP.
Ekspresi Gen CP-TICV pada E. coli strain BL21(DE3)pLysS
Kloning CP-TICV. Kloning gen CP-TICV telah dilakukan di Jepang (kerjasama dengan Utsunomiya University). Hasilnya plasmid pGEM-CP yang ditransformasi ke dalam E.coli strain DH5α.
Konstruksi Vektor Ekspresi. Ekpresi gen CP-TICV dalam pET-21b(+) dilakukan dengan menggunakan promoter T7. Gen CP-TICV disisipkan pada tempat pemotongan BamHI/HindIII yang terletak antara promoter T7 pada ujung depan setelah start kodon dan 6xhis-tag pada ujung belakang sebelum stop kodon dari pET-21b(+) sehingga terbentuk pET21-CP.
19
kemudian diinkubasi pada suhu 37 °C semalam. Sekitar 2 ml kultur semalam tersebut diambil dan dipindahkan ke dalam 40 ml media A (LB, MgSO47H2O 10
mM, gukosa 0.2%), lalu diinkubasi selama 2 jam. Setelah 2 jam kultur bakteri dipindahkan ke tabung Falcon steril dan diinkubasi dalam es selama 10 menit. Sentrifugasi biakan yang berada pada tabung Falcon dengan kecepatan 4000 rpm, selama 15 menit pada suhu 4 °C. Supernatan dibuang dan diambil peletnya. Pelet diresuspensi dengan 2.5 ml media B (LB, glyserol 36%, PEG 7000 12%, dan MgSO47H2O 12 mM). Siapan bakteri tersebut kemudian dipindahpisahkan
masing-masing 100 µl ke tabung eppendorf 1.5 ml dan disimpan di freezer -80 °C sampai digunakan untuk transformasi (Nishimura et al. 2003).
Transformasi. Sebelum dilakukan transformasi terlebih dahulu dilakukan ligasi antara fragmen CP-TICV dengan vektor ekspresi pET-21b(+) (Novagen, Germany) yang masing-masing telah dipotong dengan enzim restriksi BamH1 dan HindIII. Ligasi dilakukan dalam volume 10 µl yang terdiri dari plasmid pET-21b 2 µl, CP-TICV 2 µl, buffer T4 DNA ligase 2x sebanyak 5 µl, dan T4 DNA ligase 1 µl (3 U/µl). Kemudian diinkubasi pada suhu 4oC selama 16 jam. Transformasi dilakukan dengan mencampur 10 µl hasil ligasi dengan 100 µl sel kompeten BL21(DE3)pLySs. Terhadap siapan ini berturut-turut dilakukan diinkubasi dalam es batu selama 20 menit, heat shock pada suhu 42 °C selama 1 menit, didinginkan dalam es batu selama 2 menit, ditambahkan 500 µl LB cair, dan diinkubasi dengan dishaker pada suhu 37 °C selama 4 jam, kemudian disentrifuse 12000 rpm 1 menit, supernatan dibuang, pelet dan LB yang masih tersisa sampai 100 µl dihomogenasi, dan terakhir ditumbuhkan dalam media LB agar yang telah diberi ampisilin 50 µg/ml dan kloramfenikol 20 µg/ml.
(Sambrook & Russel 2001).
20
Isolasi Plasmid dengan Metode Alkalin Lisis. Satu koloni bakteri diinokulasi ke dalam 10 ml LB dan diinkubasi semalam pada suhu 37 °C, kemudian dipindahkan ke tabung eppendorf 1.5 ml dan disentrifugasi 12.000 rpm pada 4 °C selama 2 menit. Setelah itu supernatan dibuang. Resuspensi pelet dengan 100 µl larutan I (50 mM glukosa, 10 mM EDTA, 25 mM Tris pH 8.0, 2 mg/ml lisozyme (ditambahkan saat akan digunakan)), kemudian divortex, ditambahkan 200 µl larutan II (0.2 M NaOH, 1% SDS dibuat saat akan digunakan), divortex, ditambahkan 150 µl larutan III (3 M NaOAc pH 4.8), tabungnya dibolak-balik agar bercampur, disentrifuse 12.000 rpm selama 5 menit. Supernatan dipindahkan ke tabung eppendorf baru, ditambahkan 300 µl phenol kloroform, vortex, sentrifuse 12.000 rpm 5 menit. Larutan yang paling atas dipindahkan ke tabung yang baru, kemudian ditambahkan etanol absolut 2 x volume, sentrifuse 12.000 rpm selama 20 menit, supernatan dibuang, dicuci dengan 800 µl etanol 70%, vortex, disentrifuse 12.000 rpm 5 menit, supernatan dibuang, pelet dikering-anginkan, kemudian diresuspensi dengan 30 µl buffer TE atau ddH2 O (Sambrook & Russel 2001).
Koloni PCR. Satu klon transforman diambil dengan tusuk gigi, kemudian dimasukkan ke dalam tabung eppendorf yang telah diisi dengan ddH2O 10 µl,
kemudian diinkubasi pada suhu 95 °C selama 10 menit, setelah itu dimasukkan ke dalam komponen PCR. Koloni tersebut digunakan sebagai templatenya. Reaktan PCR dilakukan dengan volume total 12.5 µl, terdiri dari 2.5 µl buffer PCR (500 mM KCl; 100 mM Tris-HCl, pH 9; 1% Triton X-100), dan 0.3 µl taq DNA polymerase, H2O 7.2 µl, dNTP 10 mM 0.5 µl, primer forward TICV – CP
21
selama 30 menit. Hasil elektroforesis divisualisasikan dengan Transluminator UV dan didokumentasikan dengan kamera digital.
Pemotongan pET-21CP dengan Enzim Restriksi. Plasmid pET 21-b(+) dipisahkan dengan insertnya (CP-TICV) dengan menggunakan enzim restriksi BamHI dan HindIII dengan komposisi 1 µl plasmid pET 21-CP, 1 µl enzim restriksi BamHI dan HindIII, 1 µl buffer 2, dan dd H2O 7 µl. Larutan tersebut
diinkubasi 37 °C selama 3 jam. Hasil pemotongan dengan enzim restriksi dielektroforesis pada gel agarose 1% dalam TAE buffer yang mengandung EtBr dengan voltase 90 V selama 30 menit. Hasil elektroforesis divisualisasikan dengan Transluminator UV dan didokumentasikan dengan kamera digital.
Purifikasi Protein CP-TICV
Kultur Ekspresi. E.coli strain BL21 (DE3)pLysS yang membawa plasmid rekombinan pET21-CP diinokulasi ke dalam 3 ml media LB yang mengandung
50 μg/ml ampisilin dan 20 μg/ml kloramfenikol. Biakan diinkubasi di dalam
orbital shaker (75 rpm) pada suhu 37 oC semalam. Kemudian sebanyak 100 μl biakan di inokulasikan ke dalam 10 ml media LB yang mengandung antibiotik dan diinkubasikan di dalam orbital shaker (75 rpm) pada suhu 37 oC. Setelah pertumbuhan bakteri mencapai OD600 0.5 (kira-kira 5-6 jam), biakan diinduksi
dengan 1 mM IPTG dan diinkubasikan semalam. Sel bakteri yang mengekpresikan protein rekombinan dipanen dengan sentrifugasi (12.000 rpm, 4oC, 15 menit) dan dilisis dengan buffer B-7M Urea 300 µl dan turbonuclease 3 Unit/ml kultur (0.4 µl) (Nacalai, Japan). Sel hasil lisis disentrifugasi dengan kecepatan 12.000 rpm pada suhu 4oC selama 15 menit. Protein rekombinan yang ada dalam supernatan (soluble protein) dan pelet (insoluble protein) dianalisis dengan analisis SDS-PAGE.
22
menit. 600 µl supernatan jernih yang mengandung protein 6xHis-tagged diambil dan dimasukkan pada Ni-NTA spin column (Qiagen). Kemudian disentrifugasi dengan kecepatan 1600 rpm selama 5 menit dan diambil bawahnya, dimasukkan ke tabung mikro untuk dianalisis SDS-PAGE. Kemudian Ni-NTA spin column dicuci dengan 600 µl buffer C, disentrifugasi 2900 rpm selama 2 menit, dilakukan sebanyak dua kali. Kemudian protein dimurnikan (elusi) dua kali dengan menambahkan 200 µl buffer E, disentrifugasi 2900 rpm selama 2 menit dan hasil elusi disimpan pada -20 oC sampai digunakan untuk analisis SDS-PAGE.
Analisis SDS-PAGE. Setelah diperoleh protein murni, dilakukan analisis SDS-PAGE (Laemmli 1970). Sebanyak 10.000 µl separating gel 12,5% 0.375 M tris pH 8.8 dibuat dengan mencampur akuades 3355 µl, tris HCl 1.5 M pH 8.8 2500 µl, SDS 10% 100 µl, acrylamide/bis 4000 µl, amonium persulfat (APS) 10% 35 µl, dan temed (Merck) 10 µl, kemudian dipipet pada cetakan gel. Setelah separating gel membeku maka stacking gel 4% 0.125 M tris pH 6.8 dibuat dengan mencampur akuades 3027.5 µl, tris HCl 0.5 M pH 6.8 1250 µl, SDS 10% 50 µl, acrylamide/bis 650 µl, APS 10% 17.5 µl, dan temed (Merck) 5 µl, kemudian dipipet dan diletakkan diatas separating gel yang sudah membeku dan stacking gel ditunggu sampai membeku. Setelah stacking gel membeku, dipindahkan ke dalam alat elektroforesis. Sebanyak 10 µl marker protein (Fermentas) dan 60 µl (30 µl hasil purifikasi + 30 µl loading buffer (Sigma)) didenaturasi pada suhu 95
o
C selama 10 menit. Sekitar 10 µl marker dipipet dan dimasukkan ke dalam gel yang diletakkan pada alat elektroforesis, sedangkan untuk hasil purifikasi yang telah dicampur dengan loading buffer diambil 15 µl dan dimasukkan ke dalam gel yang diletakkan pada alat elektroforesis.
23
HASIL DAN PEMBAHASAN
TICV Isolat Indonesia
Penyakit klorosis saat ini sudah ditemukan di Indonesia. Pertama kali ditemukan di sentra pertanaman tomat di Magelang, Jawa Tengah dan Purwakarta, Jawa Barat (Hartono & Wijonarko 2007). Berdasarkan hasil survei Fitriasari (2010), penyakit klorosis telah ditemukan menyerang areal pertanaman tomat di daerah Bogor, Cianjur, dan Garut dengan persentase kejadian penyakit yang berbeda-beda.
Koleksi dan pengumpulan tanaman bergejala klorosis yang dilakukan di daerah Cipanas-Cianjur dan Cikajang-Garut Jawa Barat berhasil mendapatkan tanaman tomat yang terinfeksi TICV. Varietas tanaman tomat yang ditanam antara lain: Synta, Marta, dan Warani. Menurut pengamatan di lapangan, semua varietas yang ditanam oleh petani di Cikajang-Garut dan Cipanas dapat menunjukkan gejala klorosis akibat infeksi TICV. Hal ini menunjukkan bahwa varietas yang ditanam diwilayah tersebut rentan terhadap TICV. Selain varietas yang ditanam rentan, sistem pertanaman yang dilakukan oleh petani adalah monokultur, sehingga menyebabkan tingkat serangan TICV yang tinggi, karena sumber inokulumnya selalu ada.
Adanya serangga vektor TICV T. vaporariorum memperluas penyebaran virus ini dari satu tanaman ke tanaman yang lain.Populasi T. vaporariorum sangat tinggi pada musim kemarau sehingga penyebaran virus terjadi secara meluas dan merata pada pertanaman tomat, hal ini sesuai dengan penelitian Fitriasari (2010).
Korelasi antara penyebaran penyakit klorosis dengan populasi kutukebul T. vaporariorum juga telah dibuktikan dalam penelitian Navas-Castillo et al. (2000) yang menyatakan bahwa tingkat kejadian penyakit klorosis di lapangan berkorelasi positif dengan tingkat populasi kutukebul. Budidaya tanaman tomat di Indonesia selalu mendapatkan cekaman infeksi TICV karena varietas tanaman yang ditanam rentan, sehingga petani terancam menanggung kerugian.
24
terbawah, kemudian berkembang cepat secara merata ke daun-daun bagian atasnya (Gambar 4 A dan D). Pada serangan klorosis yang parah akan menyebabkan daun menjadi rapuh dan berubah warna menjadi ungu keabu-abuan (bronzing) (Gambar 4 E) dan lama kelamaan daun mengalami nekrotik (Gambar 4 B dan F). Hal ini menyebabkan proses fotosintesis terganggu sehingga ukuran buah mengecil dan mengakibatkan penurunan produksi (Gambar 4 C) (Wisler et al. 1998).
25
Gambar 4 Gejala penyakit klorosis di lapangan, A dan D: interveinal yellowing, B dan F: nekrotik, C: produksi buah menurun, dan E: bronzing.
Gejala penyakit yang disebabkan oleh TICV maupun ToCV tidak dapat dibedakan (Dovas et al. 2002). Namun, jika dilakukan deteksi melalui deteksi molekuler dengan menggunakan metode RT-PCR, maka akan diperoleh hasil yang berbeda. Berdasarkan hasil penelitian, setelah dilakukan amplifikasi, ternyata panjang fragmen DNA TICV lebih panjang daripada panjang fragmen DNA ToCV (Gambar 5). Deteksi RT-PCR menggunakan primer spesifik ToCV berhasil mendapatkan fragmen DNA ToCV yang berukuran 700 bp dan dengan primer spesifik TICV berhasil mendapatkan fragmen DNA TICV yang berukuran 792 bp (Gambar 5). Teknik RT-PCR merupakan modifikasi dari teknik PCR. Metode RT-PCR merupakan metode yang sangat sensitif karena dapat mendeteksi virus pada konsentrasi rendah (Ram et al. 2005).
A B C
26
Gambar 5 Deteksi RT-PCR TICV dan ToCV dengan primer spesifik pada tanaman tomat yang bergejala klorosis. Lajur M = 1kb DNA ladder (Fermentas), lajur 3 dan 6 = ToCV berukuran 700 bp, lajur 8 = TICV berukuran 792 bp.
Karakterisasi Gen CP-TICV
Amplifikasi Gen CP-TICV
Gen CP-TICV isolat Cipanas (lajur 3 dan 4) dan Cikajang (lajur 2) berhasil diamplifikasi menggunakan sepasang primer spesifik TICV. Produk PCR berukuran 792 bp yang disajikan dalam Gambar 7, sesuai dengan hasil penelitian Orillio & Navas-Castillo (2009). Fragmen gen CP-TICV isolat Cipanas hasil PCR selanjutnya digunakan dalam perunutan nukleotida dan asam amino, serta digunakan untuk kloning dan ekspresi gen .
750 bp 1000 bp
792 bp
M 1 2 3 4 5 6
5
M 1 2 3 4 6 7 8
792 bp 700 bp
5
M 1 2 3 4 6 7 8
27
Gambar 6 Amplifikasi Gen CP-TICV berhasil mendapatkan fragmen DNA yang berukuran sekitar 792 bp menggunakan pasangan primer spesifik terhadap daun tomat yang sakit dari Cipanas (lajur 3 dan 4)), dan Cikajang (lajur 2 dan 4). Lajur 1 adalah 1 kb DNA ladder (Fermentas).
Metode deteksi virus yang akurat dan banyak dikembangkan saat ini adalah berdasarkan pendekatan molekuler. Teknik PCR merupakan cara cepat untuk mengamplifikasi DNA secara invitro. Identifikasi virus dengan teknik PCR didasarkan pada sifat primer yang spesifik (Sambrook et al. 1989).
Perunutan Nukleotida dan Asam Amino Gen CP-TICV
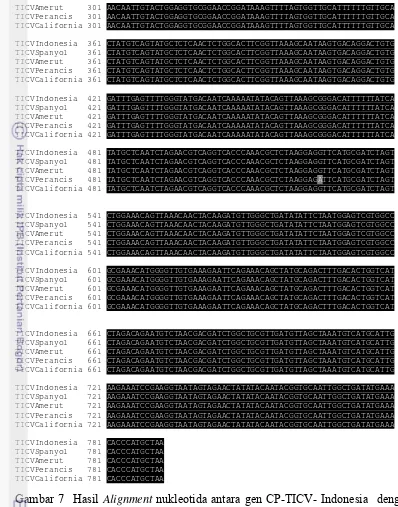
Hasil perunutan menunjukkan kualitas yang sangat baik dan tidak ada sequencing error berdasarkan analisis alignment two sequences (http://blast.ncbi.nlm.nih.gov/). Analisis kekerabatan TICV isolat Indonesia yang dibandingkan dengan empat sikuen gen CP-TICV pada Genbank (http://blast.ncbi.nlm.nih.gov/) menunjukkan hubungan tingkat kesamaan yang tinggi (99-100%) (Tabel 1). Isolat TICV Indonesia memiliki hubungan kekerabatan yang dekat dengan isolat lainnya dari beberapa negara. Isolat TICV Indonesia memiliki kesamaan dan dapat dikatakan merupakan strain yang sama dengan isolat Spanyol (100%). Jika dibandingkan dengan tiga isolat lainnya yaitu isolat Amerika Utara, Perancis dan California tingkat kesamaan juga masih sangat tinggi (99%). Fauquet et al. (2005) menyatakan bahwa apabila terdapat persamaan runutan nukleotida dari gen CP antara satu virus dengan virus yang lain dengan nilai lebih dari 90%, maka virus-virus tersebut merupakan spesies virus yang sama. Berdasarkan hasil tersebut maka dapat dikatakan bahwa isolat virus yang menyerang sejumlah pertanaman tomat di beberapa negara termasuk Indonesia adalah spesies yang sama. Homologi yang tinggi menunjukkan bahwa runutan CP-TICV isolat Indonesia dan negara lain masih conserved dan terdapat kemungkinan bahwa isolat-isolat TICV dari berbagai negara mempunyai epitope yang relatif homogen, sehingga antiserum yang dihasilkan akan dapat mendeteksi seluruh isolat tersebut.
28
menunjukkan tidak terjadi mutasi pada isolat TICV Indonesia jika dibandingkan dengan isolat Spanyol. Perbedaan runutan hanya terjadi dengan tiga isolat lainnya (Amerika Utara, Perancis, dan Caifornia) (Gambar 7). Terjemahan sikuen nukleotida ke asam amino antara semua sikuen menunjukkan bahwa TICV Indonesia hanya mempunyai perbedaan dua asam amino (posisi ke-10 dan ke-69) dengan TICV asal California (kesamaan 99.2%) sedangkan dengan isolat lainnya tidak terjadi perbedaan (kesamaan 100%) (Gambar 8) dan (Tabel 2). Dengan demikian terjadi mutasi tak bermakna pada isolat USA Amerika Utara dan Isolat Perancis karena mutasi nukleotida yang terjadi pada triplet kodon tidak menyebabkan perubahan pada asam amino.
Tabel 1 Tingkat kesamaan isolat TICV dari beberapa negara berdasarkan perunutan nukleotida
Asal Isolat No Aksesi
Tingkat Kesamaan (%)
Indonesia Amerika
Utara Spanyol Perancis California
Indonesia - -
Amerika Utara FJ542306 99 -
Spanyol FJ542305 100 99 -
Perancis EU625351 99 99 99 -
California FJ815441 99 99 99 99 -
TICVIndonesia 1 ATGGAAAACTTATCTGGTAATGCAAACTATGATGAAACTAACACCAGTCGTGTGAACTCT
TICVSpanyol 1 ATGGAAAACTTATCTGGTAATGCAAACTATGATGAAACTAACACCAGTCGTGTGAACTCT
TICVAmerut 1 ATGGAAAACTTATCTGGTAATGCAAACTATGATGAAACTAACACCAGTCGTGTAAACTCT
TICVPerancis 1 ATGGAAAACTTATCTGGTAATGCAAACTATGATGAAACTAACACCAGTCGTGTAAACTCT
TICVCalifornia 1 ATGGAAAACTTATCTGGTAATGCAAACTTTGATGAAACTAACACCAGTCGTGTAAACTCT
TICVIndonesia 61 GATGGAATTGGAAGTCACATGGAGCATGATGATGATGACAGGTCAGTCAACGGACCTCCA
TICVSpanyol 61 GATGGAATTGGAAGTCACATGGAGCATGATGATGATGACAGGTCAGTCAACGGACCTCCA
TICVAmerut 61 GATGGAATTGGAAGTCACATGGAGCATGATGATGATGACAGGTCAGTCAACGGACCTCCA
TICVPerancis 61 GATGGAATTGGAAGTCACATGGAGCATGATGATGATGACAGGTCAGTCAACGGACCTCCA
TICVCalifornia 61 GATGGAATTGGAAGTCACATGGAGCATGATGATGATGACAGGTCAGTCAACGGACCTCCA
TICVIndonesia 121 AGTGATGAGATAAACAATCATACTACGAGATCTGTTCATGGTAGAGATCACACGTCAGGT
TICVSpanyol 121 AGTGATGAGATAAACAATCATACTACGAGATCTGTTCATGGTAGAGATCACACGTCAGGT
TICVAmerut 121 AGTGATGAGATAAACAATCATACTACGAGATCTGTTCATGGTAGAGATCACACGTCAGGT
TICVPerancis 121 AGTGATGAGATAAACAATCATACTACGAGATCTGTTCATGGTAGAGATCACACGTCAGGT
TICVCalifornia 121 AGTGATGAGATAAACAATCATACTACGAGATCTGTTCATGGTAGAGATCACACGTCAGGT
TICVIndonesia 181 AATATAGGAGATTACTCAAAAGCTGACTTGAATAGAATTATGGTCAAAGTCAGTAGACCG
TICVSpanyol 181 AATATAGGAGATTACTCAAAAGCTGACTTGAATAGAATTATGGTCAAAGTCAGTAGACCG
TICVAmerut 181 AATATAGGAGATTACTCAAAAGCTGACTTGAATAGAATTATGGTCAAGGTCAGTAGACCG
TICVPerancis 181 AATATAGGAGATTACTCAAAAGCTGACTTGAATAGAATTATGGTCAAGGTCAGTAGACCG
TICVCalifornia 181 AATATAGGAGATTACTCAAAAGCTGACTTGAGTAGAATTATGGTCAAGGTCAGTAGACCG
TICVIndonesia 241 GATGCTATGAGTGAATCCGATAGTAACTTGTATAAAGAGGTGATTGTTGAATATCTGAAA
TICVSpanyol 241 GATGCTATGAGTGAATCCGATAGTAACTTGTATAAAGAGGTGATTGTTGAATATCTGAAA
TICVAmerut 241 GATGCTATGAGTGAATCCGATAGTAACTTGTATAAAGAGGTGATTGTTGAATATCTGAAA
TICVPerancis 241 GATGCTATGAGTGAATCCGATAGTAACTTGTATAAAGAGGTGATTGTTGAATATCTGAAA
TICVCalifornia 241 GATGCTATGAGTGAATCCGATAGTAACTTGTATAAAGAGGTGATTGTTGAATATCTGAAA
TICVIndonesia 301 AACAATTGTACTGGAGGTGCGGAACCGGATAAAGTTTTAGTGGTTGCATTTTTTGTTGCA
29
TICVAmerut 301 AACAATTGTACTGGAGGTGCGGAACCGGATAAAGTTTTAGTGGTTGCATTTTTTGTTGCA
TICVPerancis 301 AACAATTGTACTGGAGGTGCGGAACCGGATAAAGTTTTAGTGGTTGCATTTTTTGTTGCA
TICVCalifornia 301 AACAATTGTACTGGAGGTGCGGAACCGGATAAAGTTTTAGTGGTTGCATTTTTTGTTGCA
TICVIndonesia 361 CTATGTCAGTATGCTCTCAACTCTGGCACTTCGGTTAAAGCAATAAGTGACAGGACTGTG
TICVSpanyol 361 CTATGTCAGTATGCTCTCAACTCTGGCACTTCGGTTAAAGCAATAAGTGACAGGACTGTG
TICVAmerut 361 CTATGTCAGTATGCTCTCAACTCTGGCACTTCGGTTAAAGCAATAAGTGACAGGACTGTG
TICVPerancis 361 CTATGTCAGTATGCTCTCAACTCTGGCACTTCGGTTAAAGCAATAAGTGACAGGACTGTG
TICVCalifornia 361 CTATGTCAGTATGCTCTCAACTCTGGCACTTCGGTTAAAGCAATAAGTGACAGGACTGTG
TICVIndonesia 421 GATTTGAGTTTTGGGTATGACAATCAAAAATATACAGTTAAAGCGGGACATTTTTTATCA
TICVSpanyol 421 GATTTGAGTTTTGGGTATGACAATCAAAAATATACAGTTAAAGCGGGACATTTTTTATCA
TICVAmerut 421 GATTTGAGTTTTGGGTATGACAATCAAAAATATACAGTTAAAGCGGGACATTTTTTATCA
TICVPerancis 421 GATTTGAGTTTTGGGTATGACAATCAAAAATATACAGTTAAAGCGGGACATTTTTTATCA
TICVCalifornia 421 GATTTGAGTTTTGGGTATGACAATCAAAAATATACAGTTAAAGCGGGACATTTTTTATCA
TICVIndonesia 481 TATGCTCAATCTAGAACGTCAGGTCACCCAAACGCTCTAAGGAGGTTCATGCGATCTAGT
TICVSpanyol 481 TATGCTCAATCTAGAACGTCAGGTCACCCAAACGCTCTAAGGAGGTTCATGCGATCTAGT
TICVAmerut 481 TATGCTCAATCTAGAACGTCAGGTCACCCAAACGCTCTAAGGAGGTTCATGCGATCTAGT
TICVPerancis 481 TATGCTCAATCTAGAACGTCAGGTCACCCAAACGCTCTAAGGAGATTCATGCGATCTAGT
TICVCalifornia 481 TATGCTCAATCTAGAACGTCAGGTCACCCAAACGCTCTAAGGAGGTTCATGCGATCTAGT
TICVIndonesia 541 CTGGAAACAGTTAAACAACTACAAGATGTTGGGCTGATATATTCTAATGGAGTCGTGGCC
TICVSpanyol 541 CTGGAAACAGTTAAACAACTACAAGATGTTGGGCTGATATATTCTAATGGAGTCGTGGCC
TICVAmerut 541 CTGGAAACAGTTAAACAACTACAAGATGTTGGGCTGATATATTCTAATGGAGTCGTGGCC
TICVPerancis 541 CTGGAAACAGTTAAACAACTACAAGATGTTGGGCTGATATATTCTAATGGAGTCGTGGCC
TICVCalifornia 541 CTGGAAACAGTTAAACAACTACAAGATGTTGGGCTGATATATTCTAATGGAGTCGTGGCC
TICVIndonesia 601 GCGAAACATGGGGTTGTGAAAGAATTCAGAAACAGCTATGCAGACTTTGACACTGGTCAT
TICVSpanyol 601 GCGAAACATGGGGTTGTGAAAGAATTCAGAAACAGCTATGCAGACTTTGACACTGGTCAT
TICVAmerut 601 GCGAAACATGGGGTTGTGAAAGAATTCAGAAACAGCTATGCAGACTTTGACACTGGTCAT
TICVPerancis 601 GCGAAACATGGGGTTGTGAAAGAATTCAGAAACAGCTATGCAGACTTTGACACTGGTCAT
TICVCalifornia 601 GCGAAACATGGGGTTGTGAAAGAATTCAGAAACAGCTATGCAGACTTTGACACTGGTCAT
TICVIndonesia 661 CTAGACAGAATGTCTAACGACGATCTGGCTGCGTTGATGTTAGCTAAATGTCATGCATTG
TICVSpanyol 661 CTAGACAGAATGTCTAACGACGATCTGGCTGCGTTGATGTTAGCTAAATGTCATGCATTG
TICVAmerut 661 CTAGACAGAATGTCTAACGACGATCTGGCTGCGTTGATGTTAGCTAAATGTCATGCATTG
TICVPerancis 661 CTAGACAGAATGTCTAACGACGATCTGGCTGCGTTGATGTTAGCTAAATGTCATGCATTG
TICVCalifornia 661 CTAGACAGAATGTCTAACGACGATCTGGCTGCGTTGATGTTAGCTAAATGTCATGCATTG
TICVIndonesia 721 AAGAAATCCGAAGGTAATAGTAGAACTATATACAATACGGTGCAATTGGCTGATATGAAA
TICVSpanyol 721 AAGAAATCCGAAGGTAATAGTAGAACTATATACAATACGGTGCAATTGGCTGATATGAAA
TICVAmerut 721 AAGAAATCCGAAGGTAATAGTAGAACTATATACAATACGGTGCAATTGGCTGATATGAAA
TICVPerancis 721 AAGAAATCCGAAGGTAATAGTAGAACTATATACAATACGGTGCAATTGGCTGATATGAAA
TICVCalifornia 721 AAGAAATCCGAAGGTAATAGTAGAACTATATACAATACGGTGCAATTGGCTGATATGAAA
TICVIndonesia 781 CACCCATGCTAA
TICVSpanyol 781 CACCCATGCTAA
TICVAmerut 781 CACCCATGCTAA
TICVPerancis 781 CACCCATGCTAA
TICVCalifornia 781 CACCCATGCTAA
30
Tabel 2 Tingkat kesamaan isolat TICV dari beberapa negara berdasarkan perunutan asam amino
Utara Perancis California
Indonesia - -
Spanyol FJ542306 100 -
Amerika Utara FJ542305 100 100 -
Perancis EU625351 100 100 100 -
California FJ815441 99,2 99,2 99,2 99,2 -
TICVindonesia 1 MENLSGNANYDETNTSRVNSDGIGSHMEHDDDDRSVNGPPSDEINNHTTRSVHGRDHTSG
TICVSpanyol 1 MENLSGNANYDETNTSRVNSDGIGSHMEHDDDDRSVNGPPSDEINNHTTRSVHGRDHTSG
TICVAmerut 1 MENLSGNANYDETNTSRVNSDGIGSHMEHDDDDRSVNGPPSDEINNHTTRSVHGRDHTSG
TICVPerancis 1 MENLSGNANYDETNTSRVNSDGIGSHMEHDDDDRSVNGPPSDEINNHTTRSVHGRDHTSG
TICVCalifornia 1 MENLSGNANFDETNTSRVNSDGIGSHMEHDDDDRSVNGPPSDEINNHTTRSVHGRDHTSG
TICVindonesia 61 NIGDYSKADLNRIMVKVSRPDAMSESDSNLYKEVIVEYLKNNCTGGAEPDKVLVVAFFVA
TICVSpanyol 61 NIGDYSKADLNRIMVKVSRPDAMSESDSNLYKEVIVEYLKNNCTGGAEPDKVLVVAFFVA
TICVAmerut 61 NIGDYSKADLNRIMVKVSRPDAMSESDSNLYKEVIVEYLKNNCTGGAEPDKVLVVAFFVA
TICVPerancis 61 NIGDYSKADLNRIMVKVSRPDAMSESDSNLYKEVIVEYLKNNCTGGAEPDKVLVVAFFVA
TICVCalifornia 61 NIGDYSKADLSRIMVKVSRPDAMSESDSNLYKEVIVEYLKNNCTGGAEPDKVLVVAFFVA
TICVindonesia 121 LCQYALNSGTSVKAISDRTVDLSFGYDNQKYTVKAGHFLSYAQSRTSGHPNALRRFMRSS
TICVSpanyol 121 LCQYALNSGTSVKAISDRTVDLSFGYDNQKYTVKAGHFLSYAQSRTSGHPNALRRFMRSS
TICVAmerut 121 LCQYALNSGTSVKAISDRTVDLSFGYDNQKYTVKAGHFLSYAQSRTSGHPNALRRFMRSS
TICVPerancis 121 LCQYALNSGTSVKAISDRTVDLSFGYDNQKYTVKAGHFLSYAQSRTSGHPNALRRFMRSS
TICVCalifornia 121 LCQYALNSGTSVKAISDRTVDLSFGYDNQKYTVKAGHFLSYAQSRTSGHPNALRRFMRSS
TICVindonesia 181 LETVKQLQDVGLIYSNGVVAAKHGVVKEFRNSYADFDTGHLDRMSNDDLAALMLAKCHAL
TICVSpanyol 181 LETVKQLQDVGLIYSNGVVAAKHGVVKEFRNSYADFDTGHLDRMSNDDLAALMLAKCHAL
TICVAmerut 181 LETVKQLQDVGLIYSNGVVAAKHGVVKEFRNSYADFDTGHLDRMSNDDLAALMLAKCHAL
TICVPerancis 181 LETVKQLQDVGLIYSNGVVAAKHGVVKEFRNSYADFDTGHLDRMSNDDLAALMLAKCHAL
TICVCalifornia 181 LETVKQLQDVGLIYSNGVVAAKHGVVKEFRNSYADFDTGHLDRMSNDDLAALMLAKCHAL
TICVindonesia 241 KKSEGNSRTIYNTVQLADMKHPC
TICVSpanyol 241 KKSEGNSRTIYNTVQLADMKHPC
TICVAmerut 241 KKSEGNSRTIYNTVQLADMKHPC
TICVPerancis 241 KKSEGNSRTIYNTVQLADMKHPC
TICVCalifornia 241 KKSEGNSRTIYNTVQLADMKHPC
31
(A) TICVSP5131
TICVCA
TICVCP
TICVCA4
TICVINA
0.0002
(B)
Gambar 9 Pohon filogenetika berdasarkan runutan nukleotida (A) dan asam amino (B) gen CP-TICV isolat Indonesia. Dianalisis berdasarkan metode neighbor-joining menggunakan software Mega 4 dalam paket program PHYLIP. Garis pada bagian bawah melambangkan perubahan nukleotida per situs.
Hasil analisis filogenetika berdasarkan runutan nukleotida memperlihatkan
TICV isolat Indonesia sangat dekat dengan isolat Spanyol dan mengelompok dalam satu kelompok utama dengan tiga isolat lainnya (Amerika Utara, Perancis, dan Caifornia) (Gambar 9 A dan B). Tidak terdapat perbedaan pengelompokkan antara hasil runutan asam amino. Perbedaan terjauh dalam kelompok terjadi antara isolat Indonesia dan isolat California yang menegaskan kesamaan hasil antara tingkat kesamaan (Tabel 2) dan alignment nukleotida dan asam amino (Gambar 7 dan 8).
TICV Spanyol
TICV USA (Amerika Utara) TICV Perancis
32
Ekspresi Gen CP-TICV pada E. Coli
Konfirmasi Transforman
Plasmid rekombinan pET21b-CP yang membawa gen CP-TICV berhasil dikonstruksi dengan menyisipkan gen tersebut pada situs pemotongan BamHI/HindIII. Hasil pemotongan plasmid rekombinan pET21b-CP dengan BamHI/HindIII menghasilkan 2 band berukuran 5400 bp dan 792 bp yang masing-masing adalah vektor dan gen CP TICV (Gambar 10). Gen CP-TICV disisipkan pada vektor ekspresi pET-21b diantara start kodon segera setelah T7 promotor dan 6xhis-tag sebelum stop kodon. Fusi 6xhis ke dalam protein target berfungsi untuk proses purifikasi dan deteksi protein rekombinan yang diekspresikan. Klon E.coli strain BL21(DE3)pLySs yang positif membawa plasmid rekombinan telah berhasil diseleksi dengan PCR (Gambar 10). Satu band tunggal dengan ukuran 792 bp berhasil diamplifikasi dari koloni tunggal klon rekombinan dengan primer TICV–CP F-BamHI no ATG dan TICV–CP R-HindIII.
A B
Gambar 10 Hasil elektroforesis pada 1% gel agarose dari (A) pemotongan plasmid rekombinan pET21b-CP dengan enzim restriksi BamHI dan HindIII. Lajur 1 : 1 kb DNA ladder (Gibco), lajur 2 : pET21b-CP yang tidak dipotong, lajur 3 : pET-21 CP yang dipotong dan (B) hasil PCR terhadap koloni tunggal E. coli rekombinan yang membawa plasmid pET21b-CP. Lajur 1-5 : koloni PCR pET-21b-CP dengan primer spesifik TICV–CP F-BamHI no ATG dan TICV–CP R-HindIII, lajur 6 : 1 kb DNA ladder (Gibco).
33
Ekspresi Gen CP-TICV pada E. coli strain BL21(DE3)pLysS
Ekspresi gen merupakan proses transformasi informasi genetik melalui transkripsi dan translasi, untuk pembentukan protein (Jusuf 2009). Sistem pengekspresian pET berada dibawah kendali promoter T7 dari bakteriofage yang sangat kuat. Hal ini berarti hanya dalam waktu yang singkat saja dapat dihasilkan jumlah kopi protein yang banyak. Aktivitas operon lac dapat diinduksi dengan adanya laktosa dalam media tumbuh. Dalam transformasi, induksi operon lac dilakukan oleh IPTG. IPTG berperan sebagai induser sistem kloning yang terlibat dalam ekspresi lacZ pada plasmid pET-21-CP (Hogg 2005).
Menurut Jusuf (2009), kehadiran laktosa pada media tumbuh akan mendorong terjadinya ekspresi operon laktosa atau sintesis ß-galaktosidase. Kehadiran laktosa mampu melepaskan protein regulator dari promoter agar terjadi ekspresi gen lacZ untuk menghasilkan ß-galaktosidase. Dalam sistem regulasi ini laktosa diambil oleh bakteri dapat berinteraksi dengan protein regulator dan asosiasi yang akan mengubah konfigurasi molekul protein regulator. Perubahan konfigurasi pada protein represor menyebabkan protein tersebut menjadi tidak mampu berasosiasi dengan operator. Dengan tidak adanya inhibitor pada promoter maka transkriptase menjadi tidak terhalang untuk melakukan inisiasi transkripsi, dan terjadi ekspresi gen-gen pada operon laktosa.
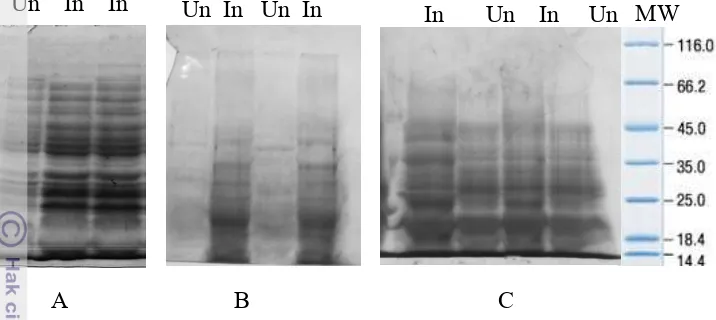
Faktor-faktor yang mempengaruhi ekspresi gen CP-TICV antara lain: waktu inkubasi, konsentrasi IPTG, dan suhu inkubasi. Hasil pengamatan menunjukkan bahwa waktu inkubasi yang optimum untuk ekspresi CP-TICV adalah semalam (overnight). Konsentrasi IPTG 1mM merupakan konsentrasi yang optimum untuk ekspresi CP-TICV, sedangkan suhu inkubasi yang optimum adalah 37 °C (Gambar 11).
34
Gambar 11 Optimasi ekspresi protein CP TICV pada beberapa suhu ( 20 °C (A), 30 °C (B), dan 37 °C (C) dengan konsentrasi IPTG 1 mM dan waktu inkubasi semalam. Un : tidak diinduksi, In : diinduksi dengan IPTG, MW : berat molekul protein (kDa) (Fermentas).
E. coli adalah salah satu inang yang digunakan untuk mengekspresikan protein rekombinan. E. coli paling baik digunakan untuk ekspresi protein intraseluler yang relatif kecil dan tidak memerlukan modifikasi pascatranslasi (posttranslational modification). Protein diekspresikan dengan bantuan vektor plasmid untuk ekspresi, yang dapat diinduksi dengan pemberian IPTG (yang akan melepas represi promoter) untuk menghasilkan ekspresi dalam jumlah tinggi sebelum kemudian dipurifikasi. Melekatkan protein tertentu pada molekul lain, misalnya ß-galaktosidase kadang-kadang dapat lebih menstabilkan protein, yang jika tidak dilekatkan mungkin akan terdegradasi dalam E.coli. Salah satu keuntungan sistem ekspresi pada E. coli adalah mudah untuk melakukan manipulasi DNA rekombinan dan proses seleksi dan ekspresi nya cepat. Kerugiannya adalah ketidakmampuan untuk melakukan prosesing kompleks seperti glikosilasi, dan ada beberapa protein yang bersifat toksik pada inang, selain itu protein besar biasanya tidak diproduksi atau tidak terlipat (folding) dengan efisien (Novagen 2003).
Protein rekombinan yang terekspresi ditranslokasikan ke dalam membran periplasma (Novagen 2003). Ekstraksi protein dalam membran periplasma dilakukan dengan buffer fosfat yang mengandung urea. Hasil analisis dengan SDS-PAGE menunjukkan over ekpresi gen CP-TICV dalam sistem ekspresi pET21b(+) (Gambar 11 C dan 12). Pita protein berukuran 29 kDa yang diduga
In Un In Un MW
A B C
35
sebagai CP TICV terdeteksi pada klon yang diinduksi dengan IPTG dibanding klon yang tidak diinduksi. Hal ini menunjukkan bahwa gen CP TICV telah berhasil diekspresikan dalam pET21b(+) dengan E. coli strain BL21(DE3)pLySs.
Gambar 12 Analisis SDS-PAGE ekspresi CP-TICV pada bakteri E. coli strain BL21(DE3)pLysS yang mengandung pET-21b-CP pada pelet dan supernatan baik yang diinduksi (In) semalam dengan IPTG 1mM pada suhu 37 °C , dan tidak diinduksi (Un), MW: berat molekul protein (kDa) (Fermentas).
Purifikasi CP-TICV dengan NiNTA Spin Column
Purifikasi protein rekombinan dilakukan dengan NiNTA spin column yang mengandung his-trap di dalam resinnya. Protein CP-TICV rekombinan yang mengandung 6xhistag pada ujung N runutan asam aminonya dapat diikat oleh his-trap, sedangkan protein lainnya akan terlepas. Setelah melalui proses pencucian, protein rekombinan dalam his-trap dilepaskan dengan menggunakan buffer E (8M urea, 0.1 M NaH2PO4, 0. 01 Tris-Cl pH 4.5) sehingga didapatkan protein
rekombinan murni yang berukuran sekitar 29 kDa (Gambar 15).
Urutan DNA yang menetapkan serangkaian enam sampai sembilan residu histidin (His) sering digunakan dalam vektor untuk produksi protein rekombinan. Hasilnya adalah ekspresi protein rekombinan dengan 6xHis atau poli His-tag yang digabung pada N atau C terminal. Ekspresi protein His-tag dapat dimurnikan dan dideteksi dengan mudah karena benang atau ikatan residu histidin mengikat untuk beberapa tipe atau jenis ion logam seperti Ni, Cu, dan Co di bawah kondisi bufer tertentu. Selain itu anti His-tag antibodi tersedia secara komersial untuk
36
digunakan dalam metode pengujian yang melibatkan protein His-tag (Thermo 2011).
Gambar 13 Analisis sodium dodecyl sulphate-polyacrylamide gel electrophoresis (SDS-PAGE) protein-protein yang diekstraksi dari E. coli BL21(DE3)pLySs tanpa diinduksi (Un), diinduksi IPTG (In), setelah proses flow through dalam purifikasi menggunakan NiNTA spin column, setelah dicuci dengan buffer C (W), hasil elusi (E), dan MW: Marker protein (Fermentas).
Un In FT W E MW
25 45
14.4 35
37
KESIMPULAN
38
DAFTAR PUSTAKA
Abouzid AM, Astua JF, Purcifull DE, Beckam KA, Crawford WE et al. 2002. Serological studies using polyclonal antisera prepared against the viral coat protein of four Begomovirus expressed in Escherichia coli. P Dis 86:1109-1114.
Andriani A. 2011. Deteksi diferensial Tomato chlorosis virus (ToCV) dan Tomato infectious chlorosis virus (TICV) dengan reverse transcription-polymerase chain reaction (RT-PCR) [skripsi]. Bogor: Institut Pertanian Bogor.
Akin HM. 2006. Virologi Tumbuhan. Yogyakarta: Kanisius.
Astawan M. 2008. Sehat bersama tomat. http://kesehatan.kompas.com/read/2008/10/12/1612441/Sehat.Bersama.Tom
at[23November 2011].
Bos L. 1994. Pengantar Virologi Tumbuhan. Triharso, penerjemah. Yogyakarta: Gajahmada University Press. Terjemahan dari: Introduction to Plant Virologi.
Brown TA. 2003. Gene Cloning an Introduction. Ed ke-2. Oxford: Blackwell Publishing.
Cotillon AC, Desbiez C, Bouyer S, Scheibel CW, Gros C, Delecolle B, Lecoq H. 2005. Production of a polyclonal antiserum against the coat protein of Cucurbit yellow stunting disorder crinivirus expressed in Escherichia coli. EPPO Bulletin 35:99-103.
Dalmon A, Bouyer S, Cailly M, et al. 2005. First report of Tomato chlorosis virus and Tomato infectious chlorosis virus in France. P Dis 89: 1243. Dovas CI, Katis NI, Augelis AD. 2002. Multiplex detection of Criniviruses
associated with epidemics of a yellowing disease of tomato in Greece. P Dis 86:1345-1349.
Duffus JE, Liu HY, Wisler GC. 1994. A new Closterovirus of tomato in Southern California transmitted by the greenhouse whitefly (Trialeurodes vaporariorum). Phytopathol 84(10):1072-1073.
Duffus JE, Liu HY, Wisler GC. 1996. Tomato infectious chlorosis virus-a new closterolike transmitted by Trialeurodes vaporariorum. Eur J of P Pathol 102:219-226.
Fajardo VM, Barros DR, Nickel O, Kuhn GB, Zerbini FM. 2007. Expression of Grapevine leafroll-associated virus 3 coat protein gene in Esherichia coli and production of polyclonal antibodies. Fitopatol Bras 32(6).
39
Fitriasari ED. 2010. Keefektifan kutukebul dalam menularkan virus penyebab penyakit kuning pada tanaman tomat [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Font MJ, Culebras PM, Jorda MC, Louro D, Vaira AM, Accoto GP. 2002. First report of Tomato infectious chlorosis virus in Spain. P Dis 86:696.
Glick BR, Pasternak JJ. 2003. Molecular Biotechnology Principles and Applications of Recombinant DNA. Ed Ke-3. Washington: ASM Press. Hartono S, Natsuaki T, Sayama H, Atarashi, Okuda S. 2003. Yellowing disease
of tomatoes caused by Tomato infectious chlorosis virus newly recognized in Japan. J of Gen P Pathol 69:61-64.
Hartono S, Wijonarko A. 2007. Karakterisasi biologi molekuler Tomato infectious chlorosis virus penyebab penyakit kuning pada tanaman tomat di Indonesia. J Akta Agros 2:139-146.
Hogg S. 2005. Essential Microbiology. West Sussex: John Wiley&Sons.
Hull R. 2002. Matthews’ Plant Virology. Ed ke-4. San Diego: Academic Press. Jacquemond M, Verdin E, Dalmon A, Guilbaud L, Gognalons P. 2008.
Serological and molecular detection of Tomato chlorosis virus and Tomato infectious chlorosis virus in tomato. P Pathol: 1365-3059.
Jusuf M. 2009. Sistem ekspresi gen. [lecture papers]. Bogor: Fakultas Matematika dan ilmu pengetahuan Alam, Institut Pertanian Bogor.
Laemmli UK. 1970. Cleavage of structural protein during the assembly of the head of bacteriophage T4. Nature 227: 680-685.
Li RH, Wisler GC, Liu HY, and Duffus JE. 1998. Comparison of diagnostic techniques for detecting Tomato infectious chlorosis virus. P Dis 82: 84-88. Liu HY, Wisler GC, Duffus JE. 2000. Particle lengths of whitefly-transmitted
Criniviruses. P Dis 84:803-805.
Kimball J. 2006. The Operon. [terhubung berkala]. http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/L/LacOperon.html. [25 September 2011].
Kubota K, Usugi T, Tsuda S. 2011. Production of antiserum and immunodetection of Cucurbit chlorotic yellows virus, a novel whitefly-transmitted Crinivirus. J Gen P Pathol 77: 116-120.
[NCBI] National Center for Biotechnology Information. 2010. Basic Local Alignment Search Tool. http://www.ncbi.nlm.nih.gov/BLAST [18 April 2011].
Nickel O, Targon MLPN, Fajardo TVM, Machado MA, Trivillin Ap. 2004. Polyclonal antibodies to the coat protein of Apple stem grooving virus expressed in Escherichia coli: production and use in immunodiagnosis. Fitopatol Bras 29(5). Nishimura M, Park G, Xu JR. 2003. The G-beta subunit MGB1 is involved in
regulating multiple steps of infection-related morphogenesis in Magnaporthe grisea. Mol Microbiol 50:231-243.