POTENSI BAKTERI ASAM LAKTAT
PROBIOTIK INDIGENUS SEBAGAI ANTIDIARE DAN
IMUNOMODULATOR PADA TIKUS PERCOBAAN
SKRIPSI
DWI FEBIYANTI
F24062963
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
POTENCY OF INDIGENOUS PROBIOTIC LACTIC ACID
BACTERIA AS ANTIDIARRHEA AND IMMUNOMODULATOR
AT RATS
Dwi Febiyanti and Made Astawan
Department of Food and Science Technology
Faculty of Agricultural Technology, IPB. PO Box 220. IPB Darmaga, Bogor 16002
ABSTRACT
The present study was to observe the ability of indigenous probiotic lactic acid bacteria (LAB) Lactobacillus plantarum 2C12 and Lactobacillus fermentum 2B4 as antidiarrhea at rats that infected by Entero-pathogenic Escherichia coli (EPEC), and also to detect the impact toward immunomodulator characteristic. (malonaldehyde level at liver and kidney and proliferation of lymphocyte cell from spleen). A total of 90 male Sprague Dawley rats were used for this study and devided into 6 groups i.e.: (1) Control Negative (without infection of EPEC and LAB), (2) L. plantarum 2C12, (3) L. fermentum 2B4, (4) L. plantarum 2C12 + EPEC, (5) L. fermentum 2B4 + EPEC, and (6) Control Positive (with infection of EPEC). The treatment of LAB as many as 1 ml per day (108cfu/ml) was undertaken from 1th-21thday, while infection of EPEC with 106cfu/ml population as many as 1 ml per day was undertaken from 8th-14thday. Observation of rat body weight growth resulting the body weight groups of L. plantarum 2C12 + EPEC, L. fermentum 2B4 + EPEC, and control positive, was decreased since 12th-21thday. Analysis of variance with Duncan Test has shown that the treatment given to 6 groups of rats give effect significantly (p<0.05) toward PER value, water content (w/w) of feces, amount of lymphocyte cell, and malonaldehyde level at liver and kidney rats.
Dwi Febiyanti.F24062963.Potensi Bakteri Asam Laktat Probiotik Indigenus sebagai Antidiare dan Imunomodulator pada Tikus Percobaan. Di bawah bimbinganMade Astawan. 2011
RINGKASAN
Diare akut merupakan penyebab utama kematian bayi di negara-negara berkembang, termasuk Indonesia. Beberapa bakteri patogen penyebab diare yaitu Escherichia coli,Shigella sp.,
Salmonellasp., danHelicobacter pylori(Lestari, 2009). WHO menyatakan ada sekitar 4 milyar kasus diare infeksi setiap tahun dengan tingkat mortalitas 3-4 juta per tahun (Zeinet. al.,2004). Arief (2008) telah berhasil mengisolasi 10 BAL indigenus dari daging sapi yang berasal dari beberapa pasar tradisional di daerah Bogor. Ke-10 BAL tersebut memiliki karakteristik sebagai bakteri probiotik dan menghasilkan senyawa antimikroba yang menghambat pertumbuhan bakteri enteropatogenik seperti
Enterotoxigenic Escherichia coli (ETEC), Staphylococcus aureus, dan Salmonella typhimurium.
Secara in vitro, ke-10 BAL tersebut diuji aktivitas antimikrobanya terhadap Enteropathogenic Escherichia coli (EPEC). Berdasarkan hasil identifikasi diketahui bahwa Lactobacillus plantarum
2C12 dan Lactobacillus fermentum 2B4 memiliki penghambatan terbaik terhadap EPEC (Arief, 2008). Berdasarkan beberapa fakta tersebut, dalam penelitian ini akan diteliti lebih lanjut mengenai potensi BAL, terutama L. plantarum 2C12 dan L. fermentum 2B4, sebagai antidiare dan imunomodulator. Penelitian ini dilakunan secarain vivomenggunakan tikus percobaan.
Tikus jantan Albino Norway Rats (Rattus novergicus) galur Sprague Dawley umur 5-6 minggu sebanyak 90 ekor dibagi dalam 6 kelompok perlakuan, yaitu kelompok kontrol negatif, L. plantarum2C12, L. fermentum2B4, L. plantarum2C12 + EPEC,L. fermentum2B4 + EPEC, dan kontrol positif. Selama percobaan, semua kelompok tikus diberi pakan ransum standar. Pemberian BAL dilakukan selama tiga minggu penuh (hari ke-1 sampai ke-21), secara oral menggunakan sonde. BAL yang diberikan berupaL. plantarum2C12 danL. fermentum2B4 sebanyak 1 ml dengan populasi 108cfu/ml. Infeksi EPEC dilakukan dengan populasi 106cfu/ml sebanyak 1 ml/hari selama 7 hari (hari ke-8 sampai ke-14), secara oral menggunakan sonde. Pembedahan tikus untuk analisis peubah yang diamati dilakukan pada hari ke-7, 14, dan 21. Organ hati dan ginjal diambil untuk analisis kadar malonaldehida (MDA), serta organ limpa diambil untuk uji proliferasi sel limfosit.
Selama pemeliharaan, tikus yang diberi EPEC mengalami penurunan bobot badan sejak hari ke-12 hingga ke-21. Penurunan bobot badan ini diperkuat dengan nilai PER tikus percobaan. Analisis sidik ragam menunjukkan bahwa perlakuan yang diberikan berpengaruh nyata (p<0.05) terhadap nilai PER tikus percobaan. Tikus kelompok L. fermentum 2B4 memiliki nilai PER yang paling tinggi, sedangkan tikus kelompok kontrol positif memiliki nilai PER yang paling rendah. Uji lanjut Duncan menunjukkan bahwa nilai PER tikus kelompokL. fermentum2B4 + EPEC tidak berbeda nyata dengan nilai PER tikus kelompok L. plantarum2C12 + EPEC dan dengan kontrol positif, namun berbeda nyata dengan kelompok tikus lainnya.
POTENSI BAKTERI ASAM LAKTAT
PROBIOTIK INDIGENUS SEBAGAI ANTIDIARE DAN
IMUNOMODULATOR PADA TIKUS PERCOBAAN
SKRIPSI
Sebagai salah satu syarat untuk mendapat gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh :
DWI FEBIYANTI
F24062963
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Potensi Bakteri Asam Laktat Probiotik Indigenus sebagai Antidiare dan Imunomodulator pada Tikus Percobaan
Nama : Dwi Febiyanti NIM : F24062963
Menyetujui, Pembimbing
(Prof. Dr. Ir. Made Astawan, MS.) NIP: 19620202.198703.1.004
Mengetahui, Ketua Departemen
(Dr. Ir. Dahrul Syah) NIP: 19650814.199002.1.001
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul Potensi Bakteri Asam Laktat Probiotik Indigenus sebagai Antidiare dan Imunomodulator pada Tikus Percobaanadalah hasil karya saya sendiri dengan arahan Dosen Pembimbing Akademik, dan belum diajukan dalam bentuk apapun pada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Maret 2011 Yang membuat pernyataan,
© Hak cipta milik Dwi Febiyanti, tahun 2011
Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari
BIODATA PENULIS
Penulis bernama Dwi Febiyanti dilahirkan pada tangga 09 Februari 1989 di kota Cirebon dan merupakan putri kedua dari tiga bersaudara dari pasangan Mochamad Romli dan Tati Rustiana. Penulis menempuh pendidikan di TK Kemala Bayangkhari 28 Cirebon (1993-1994), pendidikan dasar di SDN Sadagori II dan di SDN Kesambi Dalam III (1994-2000), pendidikan menengah pertama di SMP Negeri 1 Cirebon (2000-2003), dan pendidikan menengah atas di SMU Negeri 1 Cirebon (2003-2006).
Penulis diterima di Institut Pertanian Bogor pada tahun 2006 melalui jalur USMI dan masuk Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian pada tahun 2007. Selama menempuh pendidikan di IPB penulis aktif di HIMITEPA (Himpunan Mahasiswa Ilmu dan Teknologi Pangan) sebagai staf di Departemen Public Relation HIMITEPA (2007-2008), panitia PLASMA (Pelatihan Sertifikasi dan Manajemen Halal) (2007), panitia Masa Perkenalan Fakultas Teknologi Pertanian (Techno-F 2008), panitia BAUR (2008) staf di Departemen Peduli Pangan indonesia (DPPI) HIMITEPA (2008-2009), panitia Penyuluhan Siswa dan Pedagang di SDN Baranangsiang I (2009), ketua panitia Penyuluhan di SDN Cangkrang, Cikarawang (2009), dan panitia Penyuluhan Pedagang di Yellow Corner, Blue Corner, dan red Corner (2008-2009) . Penulis juga tergabung dalam Organisasi Mahasiswa Daerah (OMDA) Ikatan Kekeluargaan Cirebon (IKC).
Penulis pernah menjadi anggota dalam Program Kreativitas Mahasiswa bidang Penelitian yang didanai Dikti (2008). Untuk menyelesaikan tugas akhirnya, penulis menyusun skripsi dengan
KATA PENGANTAR
Alhamdulillahi Robbil’alamin, puji syukur kehadirat Allah SWT atas segala karunia-Nya,
sehingga penulis dapat menyelesaikan tugas akhir yang berjudul “Potensi Bakteri Asam Laktat
Probiotik Indigenus sebagai Antidiare danImunomodulator pada Tikus Percobaan” ini.
Dalam penyusunan tugas akhir ini, penulis banyak diberi dorongan, dukungan, serta doa dari beberapa pihak, baik secara langsung maupun tidak langsung. Oleh karena itu, penulis ingin menyampaikan ucapan terima kasih yang sebesar-besarnya kepada:
1. Allah SWT atas segala karunia dan kemudahan yang diberikan-Nya sehingga penulis dapat menyelesaikan tugas akhir ini dengan baik.
2. Orang tua dan seluruh keluarga atas segala kasih sayang, doa dan nasehat, serta bantuan secara moril maupun materil yang diberikan tanpa henti kepada penulis.
3. Direktorat Jenderal Pendidikan Tinggi Departemen Pendidikan Nasional Republik Indonesia, yang telah memberikan dana penelitian melalui Hibah Kompetitif Penelitian sesuai Prioritas Nasional BACTH II, Nomor: 343/SP 2 H/PP/DP 2 M/VI/2009, atas nama Prof. Dr. Ir. Made Astawan, MS, sehingga penelitian ini dapat terlaksana.
4. Prof. Dr. Ir. Made Astawan, MS. selaku dosen pembimbing akademik dan pembimbing tugas akhir (skripsi) atas dukungan secara materil, pengarahan, perhatian, dan masukan serta kesabaran dalam membimbing penulis selama kuliah dan selama pelaksanaan tugas akhir ini.
5. drh. Tutik Wresdiyati, Ph. D. (dosen pengajar di Fakultas Kedokteran Hewan IPB) dan ibu Irma Isnafia Arief, SPt. MSi (dosen pengajar di Fakultas Peternakan IPB) atas segala dukungan dan pengarahan kepada penulis selama pelaksanaan penelitian.
6. Ir. Arif Hartoyo, MSi. dan drh. Tutik Wresdiyati, Ph. D. yang telah meluangkan waktu untuk menjadi dosen penguji pada ujian tugas akhir penulis.
7. Hj. Yeti Sutewo, SH (Ketua Ikatan Wanita Pengusaha Indonesia di Cirebon) yang telah memberikan dukungan materil kepada penulis sehingga penulis dapat menyelesaikan studi S1 di IPB.
8. Sahabat A1 122+, sahabat ITP 43, dan sahabat IKC-IPB atas segala doa, dukungan, dan kebersamaan selama menempuh pendidikan.
9. Semua pihak yang tidak dapat disebutkan satu per satu yang selama ini telah membantu penulis secara langsung maupun tidak langsung dalam menyelesaikan pendidikan di IPB.
Penulis berharap tugas akhir ini dapat bermanfaat bagi seluruh pihak yang membutuhkan untuk pengembangan ilmu, khususnya di Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Bogor, Maret 2011
DAFTAR ISI
Halaman
KATA PENGANTAR ...i
DAFTAR ISI……….....ii
DAFTAR TABEL ...iv
DAFTAR GAMBAR ...v
DAFTAR LAMPIRAN...vi
I. PENDAHULUAN ...1
A. LATAR BELAKANG...1
B. TUJUAN ...2
II. TINJAUAN PUSTAKA ...3
A. Bakteri asam Laktat Probiotik ...3
B. Bakteri Escherichia coli(E. coli) Penyebab Diare ...4
C. Organ Hati ...6
D. Organ Ginjal ...7
E. Malonaldehida ...7
F. Sistem Imun dan Imunomodulator ...8
G. Sel Limfosit ...9
H. Proliferasi Limfosit...10
I. Studi Pendahuluan yang Telah Dilakukan...11
J. Ujiin vivodengan Pemanfaatan Hewan Percobaan ...14
III. METODOLOGI PENELITIAN ...15
A. BAHAN DAN ALAT...15
1. Bahan...15
2. Alat ...15
B. METODE PENELITIAN ...15
1. Pembuatan Kultur...15
a. Pembuatan Kultur BALL. plantarum2C12 danL. fermentum2B4 ……….15
b. Pembuatan Kultur EPEC ...15
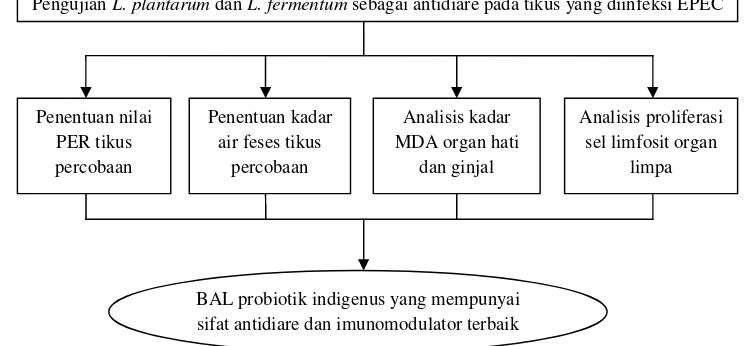
2. Kerangka Penelitian ...16
3. Pengelolaan Tikus Percobaan...16
4. Perlakuan pada Tikus Percobaan...17
C. METODE ANALISIS ...18
1. Pengukuran Bobot Badan dan Nilai PER ...18
2. Kejadian Diare pada Tikus Terinfeksi EPEC ...18
3. Analisis Kadar Malonaldehida (MDA) ...19
4. Analisis Proliferasi Sel Limfosit ...19
IV. HASIL DAN PEMBAHASAN ...21
A. BOBOT BADAN TIKUS DAN NILAI PER ...21
B. KEJADIAN DIARE PADA TIKUS TERINFEKSI EPEC ...22
C. JUMLAH SEL LIMFOSIT ...24
D. KADAR MALONALDEHIDA HATI DAN GINJAL...27
V. SIMPULAN DAN SARAN...32
A. SIMPULAN...32
B. SARAN ...33
DAFTAR PUSTAKA ...34
DAFTAR TABEL
Halaman
Tabel 1. Morfologi Isolat BAL Indigenus ...11
Tabel 2. Hasil Fermentasi terhadap Beberapa Jenis Gula Sederhana ...12
Tabel 3. Sifat Dasar Probiotik Isolat BAL Indigenus ...12
Tabel 4. Hasil Zona Hambat Isolat BAL terhadap EPEC...13
Tabel 5. Hasil Identifikasi BAL dengan Uji API Test...13
Tabel 6. Komposisi Ransum Standar Berdasarkan AOAC ...17
Tabel 7. Kelompok Perlakuan Tikus Percobaan...17
Tabel 8. Kadar Air Feses Tikus Percobaan (%bb)...22
Tabel 9. Rataan Jumlah Sel Limfosit Tikus Percobaan (x104/ml) pada Hari ke-7, 14, dan 21 ...25
Tabel 10. Rataan Kadar MDA Hati Tikus Percobaan (µ mol/g hati) pada Hari ke-7, 14, dan 21 ...27
DAFTAR GAMBAR
Halaman
Gambar 1. Interaksi Beberapa E. coli Patogenik dengan Sel Epithelial
Usus………...5
Gambar 2. EPEC Melekat pada Sel HEp-2 di Permukaan Mukosa Usus ...5
Gambar 3. Mekanisme Induksi EPEC pada Mukosa Usus ...6
Gambar 4. Kompleks MDA-TBA ...8
Gambar 5. Diagram Alir Kerangka Penelitian ...16
Gambar 6. Bagan Perlakuan Terminasi dan Cekok pada Tikus Percobaan………...18
Gambar 7. Pertumbuhan Bobot Badan Tikus selama 21 Hari Percobaan………...21
Gambar 8. Nilai Protein Efficiency RatioTikus Percobaan pada Berbagai Perlakuan ...22
Gambar 9. Feses Tikus Percobaan pada Hari ke-14...23
Gambar 10. Penampakan Sel Limfosit Tikus Percobaan pada Hari ke-21...26
DAFTAR LAMPIRAN
Halaman Lampiran 1. Data Bobot Badan Tikus Percobaan ...38 Lampiran 2. Data Nilai PER Tikus Percobaan ...42 Lampiran 3. Hasil Analisis Sidik Ragam PER Tikus Percobaan Menggunakan SPSS 16.0
(α=0.05)...45 Lampiran 4. Kadar Air Feses Tikus Percobaan……….47 Lampiran 5. Hasil Analisis Sidik Ragam Kadar Air Feses Tikus Percobaan (%bb) Hari
ke-Menggunakan SPSS 16.0 (α=0.05)...48 Lampiran 6. Analisis Sidik Ragam Kadar Air Feses Tikus Percobaan (%bb) Hari ke-21
Menggunakan SPSS 16.0 (α=0.05)...49 Lampiran 7. Data Jumlah Limfosit Organ Limpa Tikus Percobaan ...50 Lampiran 8. Hasil Analisis Sidik Ragam Sel Limfosit Hari ke-7 Menggunakan SPSS 16.0
(α=0.05)...51 Lampiran 9. Hasil Analisis Sidik Ragam Sel Limfosit Hari ke-14 Menggunakan SPSS 16.0
(α=0.05)...52 Lampiran 10. Hasil Analisis Sidik Ragam Sel Limfosit Hari ke-21 Menggunakan SPSS 16.0
(α=0.05)...53 Lampiran 11. Kurva Standar TEP dan Contoh Perhitungan MDA ...54 Lampiran 12. Data Kadar MDA Hati Tikus Percobaan (µ mol/gram hati)...55 Lampiran 13. Hasil Analisis Sidik Ragam Kadar MDA Hati Tikus Percobaan Hari ke-7
Menggunakan SPSS 16.0 (α=0.05)...58 Lampiran 14. Hasil Analisis Sidik Ragam Kadar MDA Hati Tikus Percobaan Hari ke-14
Menggunakan SPSS 16.0 (α=0.05)………...59 Lampiran 15. Hasil Analisis Sidik Ragam Kadar MDA Hati Tikus Percobaan Hari ke-21
Menggunakan SPSS 16.0 (α=0.05)………...60 Lampiran 16. Data Kadar MDA Ginjal Tikus Percobaan (µ mol/gram ginjal)………61 Lampiran 17. Hasil Analisis Sidik Ragam Kadar MDA Ginjal Tikus Percobaan Hari ke-7
Menggunakan SPSS 16.0 (α=0.05)………...64 Lampiran 18. Hasil Analisis Sidik Ragam Kadar MDA Ginjal Tikus Percobaan Hari ke-14
Menggunakan SPSS 16.0 (α=0.05)………...65 Lampiran 19. Hasil Analisis Sidik Ragam Kadar MDA Ginjal Tikus Percobaan Hari ke-21
I. PENDAHULUAN
A. LATAR BELAKANG
Diare akut merupakan penyebab utama kematian bayi di negara-negara berkembang termasuk Indonesia. Di Indonesia diare masih menjadi masalah kesehatan dan penyakit ini dapat terjadi pada semua golongan usia. Hasil Survei Kesehatan Rumah Tangga (SKRT) tahun 2004 melaporkan bahwa angka kematian akibat diare mencapai 23 orang per 100 ribu penduduk dan pada balita sebesar 75 balita per 100 ribu balita (Anonim, 2010). Selama tahun 2006, sebanyak 41 kabupaten di 16 provinsi melaporkan Kejadian Luar Biasa (KLB) diare di wilayahnya (Qauliyah, 2010). Salah satu penyebab diare yaitu infeksi bakteri patogen di saluran pencernaan. Beberapa bakteri patogen penyebab diare antara lainEscherichia coli,Shigella sp.,Salmonella
sp., danHelicobacter pylori(Lestari, 2009).
Diare atau mencret didefinisikan sebagai buang air besar dengan kondisi feses yang tidak berbentuk atau cair, dengan frekuensi lebih dari 3 kali selama 24 jam. Penyebab diare terbesar adalah infeksi dan intoksikasi (poisoning). WHO (World Health Organization) menyatakan ada sekitar 4 milyar kasus diare infeksi setiap tahun dengan tingkat mortalitas 3-4 juta per tahun (Zein
et. al.,2004). Menurut data UNICEF (United Nations Children’s Fund) dan WHO pada 2009,
diare merupakan penyebab kematian nomor 2 pada balita di dunia, nomor 3 pada bayi, dan nomor 5 bagi segala umur. UNICEF memberitakan bahwa 1.5 juta anak meninggal dunia setiap tahunnya karena diare (Anonim, 2010).
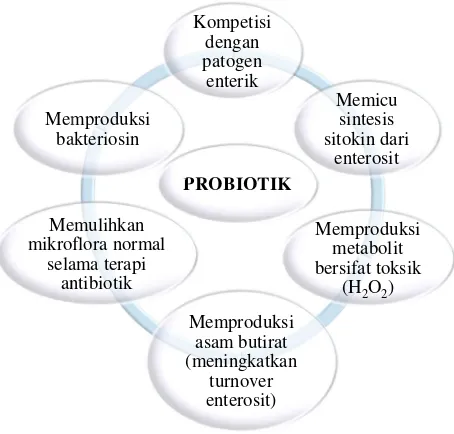
Salah satu cara mencegah diare adalah dengan menjaga keseimbangan mikroflora saluran pencernaan, yaitu dengan mengonsumsi produk probiotik dan prebiotik secara teratur. Probiotik merupakan produk yang mengandung sel-sel mikroorganisme hidup dalam jumlah cukup yang bermanfaat bagi kesehatan manusia (FAO/WHO, 2002). Sebagian besar strain bakteri asam laktat (BAL) merupakan bakteri probiotik yang sangat bermanfaat bagi kesehatan tubuh.
Penelitian mengenai probiotik indigenus Indonesia dan kemampuannya dalam mencegah diare akibat bakteri patogen telah banyak dilakukan. Lestari (2009) menyebutkan bahwa BAL yang diisolasi dari gatot (L. plantarum Mut7 dan L. sake Mut13), growol (L. casei subsp. rhamnosus TGR2), tape singkong (L. plantarum), tempoyak (L. fermentum), asinan rebung (L. acidophilus), dan tempe (L. casei subsp. rhamnosus TTE1) mampu bertahan pada suasana asam di saluran pencernaan, dan tahan dalam konsentrasi garam empedu.
Menurut Fuller (1989), probiotik merupakan mikroorganisme hidup yang dapat dimanfaatkan untuk keseimbangan populasi mikroba dalam usus. Penelitian-penelitian para ahli telah membuktikan bahwa secara in vitro bakteri probiotik galur Lactobacillus dan
Bifidodobacteriadapat menghambat penempelan dan invasi bakteri enteropatogen penyebab diare (Bourlioux et. al., 2003; Ishibashi dan Yamazaki, 2001). Beberapa peneliti juga melaporkan bahwa mengonsumsi BAL golonganLactobacillusmampu meningkatkan sistem imun seluler dan humoral di antaranya peningkatan populasi dan proliferasi sel limfosit, produksi sitokin interferon-γ (IFN-γ), interleukin-12 (IL-12), IL-10, sel imun Th, serta imunoglobulin (Ig) A, IgE, IgG, dan IgM (Gackowskaet. al., 2006; dan Attaouriet. al., 2002).
pertumbuhan bakteri enteropatogenik seperti Enterotoxigenic Escherichia coli (ETEC), Staphylococcus aureus,danSalmonella typhimurium. Secarain vitro, ke-10 BAL tersebut diuji aktivitas antimikrobanya terhadapEnteropathogenic Escherichia coli(EPEC). Berdasarkan hasil identifikasi diketahui bahwa Lactobacillus plantarum 2C12 dan Lactobacillus fermentum 2B4 memiliki penghambatan terbaik terhadap EPEC (Arief, 2008).
Namun demikian, sifat fungsional lainnya belum diteliti, terutama sifat fungsional sebagai pencegah diare karena infeksi EPEC. Selain itu, telah diketahui bahwa beberapa strain probiotik memiliki aktivitas bakterisidal terhadap bakteri patogen, termasuk EPEC, dengan cara meningkatkan status imun inang yang mengonsumsinya (sebagai imunomodulator).
Berdasarkan beberapa fakta yang telah disebutkan di atas, dalam penelitian ini akan diteliti lebih lanjut mengenai potensi BAL, terutamaL. plantarum 2C12 dan L. fermentum2B4 yang merupakan BAL probiotik indigenus Indonesia, sebagai antidiare dan imunomodulator. Penelitian ini dilakunan secarain vivomenggunakan tikus percobaan.
B. TUJUAN
Tujuan dari penelitian ini adalah:
1. Menguji kemampuan BAL probiotik indigenus (L. plantarum2C12 danL. fermentum2B4) sebagai antidiare pada tikus percobaan yang diinduksi dengan bakteri penyebab diare, EPEC. 2. Mengevaluasi dampak pemberian BAL tersebut terhadap beberapa sifat imunomodulator,
yaitu profil proliferasi sel limfosit yang diambil dari organ limpa tikus percobaan dan profil malonaldehida pada organ hati dan ginjal tikus percobaan.
II. TINJAUAN PUSTAKA
A. Bakteri Asam Laktat Probiotik
Bakteri asam laktat (BAL) pertama kali ditemukan oleh Louis Pasteur seorang profesor kimia di University of Lille, di tahun 1878. Pada tahun 1889, Tissier, peneliti Perancis pada Laboratorium Louis Pasteur, menemukan bakteri yang mendominasi saluran usus bayi yang mengonsumsi ASI, yaituBifidobacterium.BAL danBifidobacteriatermasuk ke dalam kelompok bakteri baik bagi manusia, dan umumnya memenuhi status GRAS (Generally Recognized as Safe), yaitu aman bagi manusia (Surono, 2004).
BAL merupakan bakteri gram positif, katalase negatif, tidak membentuk spora, tidak mempunyai sitokrom, aerotoleran, anaerobik hingga mikroaerofilik, membutuhkan nutrisi yang kompleks seperti asam-asam amino, vitamin B kompleks (B1, B6, B12, dan biotin), purin, dan pirimidin. Secara umum, niasin dan asam pantotenat bersifat esensial bagi pertumbuhan BAL. BAL memerlukan nutrisi yang sangat kompleks, oleh karena itu, umumnya memerlukan habitat yang kaya akan nutrisi, seperti susu, daging, minuman, dan sayuran. Namun, beberapa BAL juga terdapat pada mulut, saluran usus, dan vagina mamalia. Variasi karakteristik BAL normal terjadi, namun yang mutlak adalah sifatnya sebagai bakteri gram positif (Surono, 2004).
Beberapa peneliti menganggap Bifidobacterium termasuk ke dalam kelompok BAL, meskipun secara philogenetik berbeda. Beberapa kesamaan di antara keduanya adalah produksi asam laktat, ekologi tempat hidup dan fungsinya, serta pemanfaatannya sebagai kultur fermentasi susu. Seiring dengan kemajuan biologi molekuler, pada tahun 1980 genus BAL berkembang menjadi 15 genus, namun hanya lima genus yang berperan dalam proses fermentasi susu, yaitu
Lactobacillus sp., Lactococcus sp., Leuconostoc sp., Pediococcus sp., dan Streptococcus sp.
Di alam, BAL dapat ditemukan dalam dua sistem ekologi, yaitu saluran pencernaan manusia/hewan mamalia dan produk makanan nabati maupun hewani, baik berupa kontaminasi alami maupun ditambahkan untuk tujuan fermentasi.
Beberapa jenis BAL yang menghuni saluran pencernaan, atau disebutenteric lactic acid bacteria, di antaranya adalah Bifidobacterium bifidum, B. longum, B. infatis (pada bayi), B. adolescentris yang menempati usus besar manusia, Lactobacillus acidophilus, L. gasseri, L. crispatus, L. johnsonii, L. salivarius, L. ruminis, L. vitulinus, L. reuteri,danL. fermentumyang hidup dalam usus halus (Surono, 2004).
Menurut Fuller (1989), probiotik merupakan mikroorganisme hidup yang dapat dimanfaatkan untuk keseimbangan populasi mikroba dalam usus. Efek kesehatan yang menguntungkan dari probiotik antara lain adalah: (1) memperbaiki keluhan malabsorbsi laktosa ataulactose intolerance, (2) meningkatkan ketahanan alami terhadap infeksi di usus dan bahaya kanker, (3) meningkatkan sistem kekebalan (Kim, 1990).
Klein et. al. (1998) melaporkan bahwa taksonomi dan fisiologi spesies Lactobacillus
molekul koagregasi yang mencegah pelekatan dan penyebaran patogen pada sel epithelial, (4) menghasilkan senyawa antibakteri, seperti bakteriosin, (5) menurunkan pH dengan dihasilkannya asam laktat yang menghambat pertumbuhan bakteri patogen, dan (6) menekan aktivitas enzim penghasil amin yang toksik dan karsinogenik dari bakteri usus lainnya.
Kriteria yang harus diperhatikan untuk menentukan strain mikroba probiotik yaitu: (1) mampu memfermentasikan susu dalam waktu yang relatif cepat, (2) mampu menggandakan diri, (3) tahan terhadap suasana asam sehingga mampu hidup dan bertahan dalam saluran pencernaan, (4) menghasilkan produk akhir yang dapat diterima konsumen, dan (5) mempunyai stabilitas yang tinggi selama proses fermentasi, penyimpanan, dan distribusi (Hoier, 1992).
B. Bakteri
Escherichia coli
(
E. coli
) Penyebab Diare
Diare atau mencret didefinisikan sebagai buang air besar dengan kondisi feses yang tidak berbentuk atau cair dengan frekuensi lebih dari 3 kali selama 24 jam. Penyebab diare terbesar adalah infeksi dan intoksikasi (poisoning). Bakteri patogen yang menyebabkan terjadinya diare antara lain Escherichia coli, Salmonella thypii, Salmonella parathypii, Vibrio cholera, dan
Shigella sp.
BakteriEscherichia coliyang ditemukan oleh Theodor Escherich (tahun 1885) merupakan bakteri yang berasal dari kotoran hewan atau manusia, baik sakit maupun sehat. Oleh karena itu, dikenal juga dengan istilah koli tinja. Secara garis besar, klasifikasi bakteri E .coliberasal dari Filum Proteobacteria, Kelas Gamma Proteobacteria, Ordo Enterobacteriales, Familia Enterobacteriaceae, Genus Escherichia, Spesies Escherichia coli. Secara morfologi E. coli
merupakan bakteri berbentuk batang pendek, gemuk, berukuran 2.4 µ x 0.4 sampai 0.7 µ, Gram-negatif, tidak bersimpai, bergerak aktif dan tidak berspora (Hakli, 2009). Menurut Nataro dan Kaper (1998) tipe patogenesis dari strainE. colidapat dibedakan menjadi Enteropathogenic E. coli (EPEC), Enterotoxigenic E. coli (ETEC), Enteroinvasive E. coli, (EIEC),
Enterohaemorrhagic E. coli(EHEC),Enteroagregative E. coli(EAEC), dan Diffusely Adherent
Escherichia coli (DAEC). Interaksi beberapa E. coli patogenik dengan sel epithelial usus ditunjukkan pada Gambar 1.
EPEC melekat pada permukaan mukosa usus dan menyebabkan terjadinya perubahan struktur sel. Pelekatan EPEC pada permukaan mukosa ditunjukkan pada Gambar 2. EPEC kemudian melakukan invasi menembus sel mukosa. Pada dosis 105-1010, sel EPEC dapat menyebabkan diare (Sussman, 1997). EPEC melekat pada sel mukosa yang kecil. Infeksi EPEC yang melibatkan gen EPEC adherence factor (EAF), menyebabkan perubahan konsentrasi kalsium intraseluler dan arsitektur sitoskeleton di bawah membran mikrovilus. Seperti ETEC, EPEC juga menyebabkan diare tetapi dengan mekanisme molekuler kolonisasi yang berbeda. EPEC memiliki sedikit fimbria, tidak menghasilkan sitotoksin, tetapi EPEC menggunakan
D. Organ Ginjal
Seperti halnya hati, ginjal juga merupakan organ yang sering dijadikan sasaran utama zat toksik (Lu, 1995). Menurut Frankel (1985), ginjal merupakan organ yang paling penting untuk menjamin komposisi yang tepat dari darah dan cairan ekstraseluler, dan tugas utamanya adalah mengekskresikan bahan-bahan yang tidak lagi dibutuhkan oleh tubuh ke dalam urin. Urin merupakan jalur utama ekskresi sebagian besar toksikan. Oleh karena itu, ginjal memiliki volume aliran darah yang tinggi, mengkonsentrasikan toksikan pada filtrat, membawa toksikan melalui sel tubulus, dan mengaktifkan toksikan tertentu.
Struktur yang menonjol pada ginjal adalah nefron, kira-kira berjumlah 1.3 x 108. Tiap nefron terdiri atas glomerulus dan serangkaian tubulus. Untuk itu, senyawa-senyawa yang menyebabkan kerusakan pad glomerulus dan tubulus sering disebut sebagai nefrotoksikan. Kelompok utama nefrotoksikan adalah logam berat, antibiotik, analgesik, dan hidrokarbon berhalogen tertentu. Semua bagian nefron secara potensial dapat dirusak oleh efek toksikan.
Pada glomerulus, antibiotika puromisin dapat meningkatkan permeabilitas glomerulus terhadap protein seperti albumin. Hal ini disebabkan oleh perubahan dalam muatan listrik membrane dasar glomerulus. Sebaliknya, antibiotika aminoglikosid, seperti gentamisin dan kanamisin, mengurangi filtrasi glomerulus, selain mempengaruhi tubulus ginjal (Lu, 1995).
Pada tubulus proksimal, kadar toksikan sering lebih tinggi karena terjadi absorpsi dan sekresi aktif tubulus. Dengan demikian, tempat ini sering menjadi sasaran efek toksin. Logam berat seperti merkuri, kromium, cadmium, dan timbal dapat mengubah fungsi tubulus yang ditandai dengan glikosuria, aminoasiduria, dan poliuria. Pada dosis yang lebih tinggi, logam berat menyebabkan kematian sel (Lu, 1995).
E. Malonaldehida
Menurut Koltas et al. (2006) malonaldehida yang merupakan hasil peroksidasi lipid merupakan indikator terjadinya stres oksidatif pada jaringan dan sel. Stres oksidatif menggambarkan kondisi kerusakan oksidatif yang terjadi ketika keseimbangan antara radikal bebas dan antioksidan tidak bertahan dengan baik (Lampe dan Cheryl, 2008). Biomarker stres oksidatif merupakan produk akhir reaksi antara radikal bebas dan komponen lipid, protein, karbohidrat, DNA, dan molekul lainya yang potensial (Mayne, 2003).
Menurut Bird dan Draper (1984), malonaldehida (MDA) merupakan produk hasil peroksidasi lipid dalam tubuh. MDA terutama dihasilkan pada reaksi penguraian sel. Secara biologis MDA dihasilkan dari berbagai macam reaksi. Reaksi tersebut misalnya adalah kebocoran sistem mitokondria, oksidasi lipida, dekomposisi asam amino, dan komponen karbohidrat, serta reaksi yang melibatkan radikal bebas. MDA juga merupakan produk yang dihasilkan oleh radikal bebas melalui radiasi ionisasi di dalam tubuh dan produk sampingan dari biosintesis prostaglandin yang memiliki tiga atom karbon yang sangat reaktif. MDA di dalam material biologis terdapat dalam bentuk bebas dan sebagai kompleks dengan unsur pokok berbagai jaringan.
dengan mikroorganisme tersebut, kompleks ini kemudian dikenal sebagai benda asing oleh fagosit dan kemudian diserang atau dihancurkan.
2. Acute-phase proteins atau early phase, muncul beberapa jam kemudian, diinduksi, tetapi masih bersifat nonspesifik, timbul bila fagosit gagal mengenal mikroorganisme melalui jalur di atas. Mikroorganisme akan terpapar terhadap acute-phase proteins (APPs) yang diproduksi oleh hepatosit dan kemudian dikenali oleh protein komplemen. Kompleks mikroorganisme, APPs, dan protein komplemen kemudian dikenali oleh fagosit dan diserang serta dihancurkan.
3. Late phase, merupakan respon imun spesifik timbul 4 hari setelah infeksi pertama, ditandai oleh clonal selection limfosit spesifik. Pada fase ini dibentuk molekul dan sel efektor pertama.
Imunomodulator adalah zat yang dapat memodulasi (mengubah atau memengaruhi) sistem imun tubuh menjadi ke arah normal. Produk imunomodulator berperan menguatkan sistem imun tubuh (imuno stimulator) atau menekan reaksi sistem imun yang berlebihan (imuno suppressan) (Anonim, 2007). Baratawidjaja (2002) menyebutkan bahwa imunomodulator adalah obat yang dapat mengembalikan dan memperbaiki sistem imun yang fungsinya terganggu atau untuk menekan yang fungsinya berlebihan. Imunomodulator bekerja menurut 3 cara, yaitu melalui imunorestorasi, imunostimulasi, dan imunosupresi. Imunorestorasi dan imunostimulasi disebut imunopotensiasi atauup regulation, sedangkan imunosupresi disebutdown regulation.
1. Imunorestorasiadalah suatu cara untuk mengembalikan fungsi sistem imun yang terganggu dengan memberikan berbagai komponen sistem imun, seperti: immunoglobulin dalam bentuk
Immune Serum Globulin (ISG), Hyperimmune Serum Globulin (HSG), plasma,
plasmapheresis, leukopheresis, transplantasi sumsum tulang, hati, dan timus.
2. Imunostimulasi yang disebut juga imunopotensiasi adalah cara memperbaiki fungsi sistem imun dengan menggunakan bahan yang merangsang sistem tersebut. Biological Response Modifier (BRM) adalah bahan-bahan yang dapat mengubah respons imun, biasanya meningkatkan. Bahan yang disebut imunostimulator itu dapat terdiri atas: biologik dan hormon timus.
3. Imunosupresi merupakan suatu tindakan untuk menekan respons imun. Kegunaannya di klinik terutama pada transplantasi untuk mencegah reaksi penolakan dan pada berbagai penyakit inflamasi yang menimbulkan kerusakan atau gejala sistemik, seperti autoimun atau auto-inflamasi (Baratawidjaja, 2002).
G. Sel Limfosit
Berbagai sistem telah dikembangkan di dalam tubuh untuk menjerat dan kemudian menyingkirkan setiap bahan yang berhasil menghindari pertahanan luar. Sistem penjeratan ini dilakukan oleh sel yang mampu mengikat, menelan, dan menghancurkan bahan asing melalui suatu proses yang disebut fagositosis. Sel fagositik pada mamalia termasuk dalam dua sistem yang komplementer. Salah satu sistemnya yaitu sistem meloid, terdiri dari sel yang bekerja cepat tetapi tidak mampu bertahan lama. Sistem kedua, sistem fagositik mononuklir, terdiri dari sel yang bekerja lebih lambat tetapi mampu melakukan fagositosis berulang-ulang. Sel fagositik mononuklir ini dapat mengolah antigen untuk tanggap kebal (Tizard, 1988).
satu jenis sel yang berfungsi dalam merespon antigen adalah sel darah putih (Baratawidjaja, 2002).
Leukosit atau sel darah putih merupakan salah satu sel dalam sistem pertahanan tubuh. Leukosit memiliki ukuran molekul yang lebih besar dan bebas bergerak (Roitt, 1991). Leukosit terdiri dari 75% sel granulosit dan 25% sel agranulosit yang terbentuk dari dalam sumsum tulang (Baratawidjaja, 2002). Agranulosit sel adalah sel limfosit dan manosit, sedangkan basofil, neutrofil, dan eusinofil termasuk kelompok granulosit (Roitt, 1991). Menurut Gayton (1987) limfosit manusia berjumlah sekitar 30% dari persentase normal sel darah putih.
Limfosit adalah sel darah putih (leukosit) yang berukuran kecil, berbentuk bulat dengan diameter 7-15 µ m dan terdapat juga pada organ limfoid, seperti limpa, kelenjar limfe, dan timus. Limfosit merupakan sel kunci dalam proses respon imun spesifik, untuk mengenali antigen yang beragam, namun setiap limfosit hanya dapat mengenal satu antigen sehingga dalam proses respon imun, limfosit saling bekerja sama untuk mengeliminasi beragam antigen yang masuk ke dalam tubuh (Roitt, 1991). Limfosit merupakan sel imunokompeten nonfagositik yang berfungsi dalam respon imun spesifik, selular, dan humoral. Pada manusia normal, limfosit B (sel B) berjumlah 5-15% dan limfosit T (sel T) 65-80% dari total limfosit (Kresno, 1996). Sel B berperan dalam respon imun humoral sedangkan sel T berfungsi dalam sistem imun seluler (Roitt, 1991). Sel limfosit B dan T bertanggung jawab dalam respon imun spesifik untuk mengenali antigen melalui reseptor antigen. Sel juga mampu membedakan antigen dengan komponen tubuh sendiri atau berfungsi sebagai pengontrol sistem imun (Bellanti, 1993).
Pada penelitian ini, dilakukan isolasi sel limfosit selama pemeliharaan tikus percobaan, kemudian dihitung jumlahnya. Sel limfosit diisolasi dari organ limfa tikus percobaan.
H. Proliferasi Limfosit
Proliferasi merupakan fungsi biologis mendasar limfosit, yaitu proses deferensiasi dan pembelahan (mitosis) sel. Limfosit adalah sel tunggal yang bertahan baik pada saat dikultur dalam media sederhana. Sel limfosit konsisten tetap dalam tahap diam dan membelah sampai ditambahkan mitogen. Respon proliferasi kultur sel limfosit digunakan untuk menggambarkan fungsi limfosit dan status imun individu (Tejasari, 2000).
Zakaria et. al. (1992) menyatakan bahwa kemampuan limfosit untuk berproliferasi atau membentuk klon menunjukkan bahwa sel limfosit mempunyai kemampuan merespon imunologik atau tingkat kekebalan. Bila sel dikultur dengan senyawa nitrogen, maka limfosit akan berproliferasi secara tidak spesifik.
Proliferasi sel limfosit juga dapat meningkat dengan adanya antigen atau hapten. Hapten adalah molekul yang dapat bereaksi dengan antibodi yang sudah ada (preformed) secara langsung, tetapi tidak dapat merangsang pembentukan antibodi secara langsung. Hapten akan diikat oleh sel T (carrier) sehingga hapten tersebut membentuk epitop pada bagian molekul
carrier. Pembentukan epitop pada kompleks hapten-carrierdikenal oleh sistem imun, sehingga dapat merangsang pembentukan antibodi. Limfosit berproliferasi lebih cepat jika dipaparkan antigen atau hapten (Susanti, 2006).
sel mati atau rusak. Sel hidup tidak akan berwarna dan berbentuk bulat, sedangkan sel mati akan berwarna biru dan mengkerut.
Prinsip metode MTT adalah perubahan MTT oleh aktivitas enzim suksinat dehidrogenase mitokondrial dalam sel hidup menjadi formazan yang kemudian diukur absorbansinya dengan
Spectrophotometer Microplate Reader. Kandungan suksinat dehidrogenase relatif konstan di antara berbagai sel dengan tipe spesifik, sehingga jumlah formazan yang terbentuk proporsional terhadap jumlah sel (Jameset. al., 1994).
Dalam penelitian ini, pengujian proliferasi sel limfosit dilakukan dengan menggunakan metode pewarnaantryphane blue.
I. Studi Pendahuluan yang Telah Dilakukan
BAL probiotik seringkali digunakan sebagai suplemen untuk mengobati diare yang disebabkan oleh EPEC maupun ETEC. Beberapa uji penempelan secarain vitrodilakukan pada kultur jaringan untuk menjelaskan mekanisme penghambatan bakteri patogen oleh probiotik. Berdasarkan FAO/WHO (2002) dan kesepakatan internasional, suatu BAL harus memenuhi beberapa kriteria jika akan digunakan sebagai probiotik, yaitu kemampuannya untuk bertahan pada kondisi lambung (pH rendah) dan adanya garam empedu, serta penghambatan terhadap bakteri patogen.
Tabel 1. Morfologi Isolat BAL Indigenus
No. Kode
Isolat Bentuk
Pertumbuhan
pada Suhu Pertumbuhan
Menghasilkan NH3
Menghasilkan gas
15oC 45oC pada NaCl
6.5% dari Arginin dari Glukosa
1. 1A5 Batang + + + -
-2. 1A32 Coccus + + + +
-3. 1B1 Batang + + + - +
4. 2B1 Coccus + + + -
-5. 2B2 Batang + + + +
-6. 2B4 Batang + + + - +
7. 1C4 Batang + + + +
-8. 2C2 Batang + + + -
-9. 2C12 Coccus + + + +
-10. 2D1 Batang + + + -
Tabel 2. Hasil Fermentasi terhadap Beberapa Jenis Gula Sederhana
No. Kode Isolat
Kemampuan Memfermentasi Gula Identifikasi
Presumtif
ara gal glu lak mal man raf rham tre sorb suk xyl Awal*
1. 1A5 - + + + + - + - - - + - Lactobacillus
sp.
2. 1A32 + + + + + - + - - - + - Lactobacillus
lactis
3. 1B1 + + + + + + d + + d + d Lactobacillus
plantarum
4. 2B1 + + + + + - + - - - + + Streptococcus
sp.
5. 2B2 - + + + + - + - - - + + Lactobacillus
fermentum
6. 2B4 + + + + + - + - - - + + Lactobacillus
fermentum
7. 1C4 + + + + + - + - - - + - Lactobacillus
sp.
8. 2C2 + + + + + - + + + - + + Streptococcus
sp.
9. 2C12 - + + + + + + d d d + d Lactobacillus
sp.
10. 2D1 + + + - + - + - - - + + Lactobacillus
sp.
Sumber: Ariefet al. (2008)
Keterangan: * = identifikasi presumtif awal berdasarkansoftwarePIB Win; (+) = dapat memfermentasi; (-) = tidak dapat memfermentasi; (d) = dubius; ara = arabinosa; gal = galaktosa; glu = glukosa; lak = laktosa; mal = maltose; man = manitol; raf = rafinosa; rham = rhamnosa; tre = trehalosa; sorb = sorbitol; suk = sukrosa; xyl = xilosa
Tabel 3. Sifat Dasar Probiotik Isolat BAL indigenus
No .
Kode Isolat
Kemampuan Menghambat Mikroba Patogen
Kemampuan Tumbuh pada Kondisi Saluran Pencernaan
(in vitro) Staphylococc us aureus ATCC 25923 Salmonella typhimurium ATCC 14028 Escherichia coliATCC 25922/ETEC pH Lambung (2.5) pH Usus (7.2) Garam empedu (bile salt)
0.5%
1. 1A5 ++ + +++ + + +
2. 1A32 ++ + +++ + + +
3. 1B1 + + ++ + + +
4. 2B1 ++ + ++ + + +
5. 2B2 ++ + +++ + + +
6. 2B4 ++ +++ +++ + + +
7. 1C4 ++ + ++ + + +
8. 2C2 ++ + +++ + + +
9. 2C12 ++ + ++ + + +
10. 2D1 + +++ ++ + + +
Tabel 4. Hasil Zona Hambat Isolat BAL terhadap EPEC
No. Isolat BAL Zona Hambat terhadap EPEC (mm)
1. 2B1 5,62
2. 1A5 6,37
3. 2B2 6,59
4. 2B4 6,59
5. 1B1 7,01
6. 2D1 6,83
7. 1C4 8,73
8. 2C12 13,87
9. 2C2 7,91
10. 1A32 7,31
Sumber: Arief (2009)
Isolasi 10 BAL golonganLactobacillus, Lactococcus,danStreptococcusdari daging sapi peranakan Ongol di pasar tradisional Bogor telah dilakukan oleh Arief et. al (2008). Hasil penelitian tersebut menunjukkan bahwa kesepuluh BAL isolat indigenus mampu bertahan pada pH 2 (pH lambung) dan pH 7.2 (pH usus), serta mampu bertahan pada kondisi garam empedu 0.5% sesuai dengan kondisi saluran pencernaan. BAL tersebut juga mempunyai aktivitas penghambatan yang baik terhadap bakteri enteropatogenikSalmonella typimuriumATCC 14028,
Escherichia coli ATCC 25922 (ETEC), serta Staphylococcus ATCC 25923. Kemampuan bakterisidal terhadap bakteri patogen tersebut karena BAL mampu menghasilkan senyawa bioaktif asam laktat, asam asetat, serta senyawa bakteriosin. Sifat dasar kesepuluh BAL dan kemampuannya sebagai probiotik ditunjukkan pada Tabel 1, 2, dan 3.
Kemudian, kesepuluh BAL tersebut diuji aktivitas antimikrobanya terhadap EPEC (Tabel 4) oleh Arief (2008) disertai dengan uji konfirmasi identifikasi genus dari BAL tersebut yang dilakukan secara biokimiawi melalui uji API test (Tabel 5).
Tabel 5. Hasil Identifikasi BAL dengan Uji API Test
No Isolat BAL Genus dan Spesies Penamaan
1. 2B1 Lactococcussp Lactococcussp 2B1
2. 1A5 Lactobacillus plantarum Lactobacillus plantarum1A5
3. 2B2 Lactobacillus fermentum Lactobacillus fermentum2B2
4. 2B4 Lactobacillus fermentum Lactobacillus fermentum2B4
5. 1B1 Lactobacillus plantarum Lactobacillus plantarum1B1
6. 2D1 Lactococcussp Lactococcussp 2D1
7. 1C4 Lactococcussp Lactococcussp 1C4
8. 2C12 Lactobacillus plantarum Lactobacillus plantarum2C12
9. 2C2 Lactobacillus plantarum Lactobacillus plantarum2C2
10. 1A32 Lacatobacillus plantarum Lactobacillus plantarum1A32
Berdasarkan hasil identifikasi dapat diketahui bahwa isolat yang dapat diidentifikasi sampai tingkat spesies melalui uji API test adalahL. fermentumdanL. plantarum. DipilihnyaL. plantarum 2C12 karena memiliki penghambatan terbaik terhadap EPEC, sedangkan untuk L. fermentum, keduanya memiliki daya hambat yang sama antara 2B2 dan 2B4, namun berdasarakan karakterisasinya terhadap ketahanan garam empedu di saluran pencernaan maka dipilih L. fermentum2B4.
J. Uji
in vivo
dengan Pemanfaatan Hewan Percobaan
Pengujian secara in vivo adalah pengujian yang dilakukan dengan menggunakan hewan percobaan untuk mengetahui metabolisme suatu senyawa di dalam tubuh. Hewan percobaan yang digunakan pada percobaan secara in vivo harus dari jenis mamalia, karena hasilnya dapat diterapkan pada manusia. Ciri-ciri hewan mamalia adalah hewan yang menyusui anaknya, berambut, berdarah panas, mempunyai empat ruang jantung, dan melahirkan anak.
Beberapa hewan mamalia yang biasa digunakan sebagai hewan percobaan, misalnya, tikus putih, mencit, marmot, kelinci, babi, hamster, monyet, dan anjing. Hewan yang paling sering digunakan dalam penelitian adalah tikus dan kelinci. Tikus banyak digunakan karena sifat-sifatnya telah diketahui dengan baik, yaitu bersifat nocturnal (aktif pada malam hari, tidur di siang hari), tidak mempunyai kantung empedu, tidak muntah, dan tidak berhenti tumbuh (setelah 100 hari pertumbuhan berkurang), mudah dipelihara, dan merupakan hewan yang relatif sehat (Malole dan Pramono, 1989), serta peka terhadap perlakuan dalam komponen dietnya (Kesenja, 2005)
Tikus yang digunakan dalam penelitian adalah galur Sprague Dawley berjenis kelamin jantan berumur kurang lebih 2 bulan. TikusSprague Dawley dengan jenis kelamin betina tidak digunakan karena kondisi hormonal yang sangat berfluktuasi pada saat mulai beranjak dewasa, sehingga dikhawatirkan akan memberikan respon yang berbeda dan dapat mempengaruhi hasil penelitian (Kesenja, 2005). Tikus Sprague Dawley memiliki ciri-ciri berwarna albino putih, berkepala kecil, dan ekornya lebih panjang dari badannya (Malole dan Pramono, 1989).
Zat-zat gizi yang diperlukan untuk pertumbuhan tikus hampir sama dengan manusia, yaitu: karbohidrat, minyak/lemak, asam lemak esensial (terutama linoleat dan linolenat), protein, mineral, dan vitamin (Muchtadi, 1993). Pemberian makanan dan minuman dilakukan secara berlebih (ad libitum). Kekurangan nilai gizi dapat menyebabkan tubuh bersisik, pertumbuhan terhambat, dan kematian.
Beberapa kondisi optimum yang harus diperhatikan untuk pemeliharaan tikus adalah: (1) temperatur kandang 18-27oC, (2) kelembaban relatif 40-70%, dengan ventilasi yang cukup (jangan ada jendela terbuka), dan (3) pencahayaan yang cukup dengan keadaan 12 jam terang dan 12 jam gelap (di daerah tropis seperti di Indonesia, hal ini tidak menjadi masalah) (Malole dan Pramono, 1989).
III. METODOLOGI PENELITIAN
A. BAHAN DAN ALAT
1. Bahan
Bahan utama yang digunakan dalam penelitian ini adalah bahan penyusun ransum tikus yang terdiri atas tepung maizena, kasein, minyak jagung, CMC, mineral mixture, vitamin mixtureFitkom, dan air, suspensi EPEC, suspensi L. plantarum2C12, suspensi L. fermentum 2B4, organ hati, ginjal, limpa, dan feses tikus percobaan. Bahan-bahan untuk analisis MDA yaitu TEP (1,1,3,3-tetraetoksipropana),Phosphat Buffer Saline(PBS) pH 7.4 yang mengandung 11.5 g KCl/L (disimpan pada suhu 2-5oC), HCL 0.25 N yang mengandung 15% TCA, 0.38% TBA, dan 0.5% BHT. Bahan-bahan untuk analisis proliferasi limfosit yaitu PBS, alkohol 70%, RPMI-1640 steril, NH4Cl 0.85% steril, dan pewarnatryphan blue.
2. Alat
Alat utama yang digunakan dalam penelitian adalah oven, autoklaf, alat sentrifus, tabung sentrifus 15 ml steril, spektrofotometer visible, refrigerator, neraca analitik, mikroskop cahaya, alat bedah steril, transfer pipet steril, syringe steril untuk menggerus organ, botol steril untuk wadah menggerus organ, micropipet 10-100 µl, tip micropipet,
microplate96well, hemasitometer dancover glass, kapas, kertastissue, alumunium foil. Alat-alat yang digunakan untuk pembuatan ransum dan pemeliharaan tikus adalah mortar, sendok, neraca, kandang tikus, wadah ransum dan air minum, timbangan tikus.
B. METODE PENELITIAN
1. Pembuatan Kultur
a. Pembuatan Kultur BAL
L. plantarum
2C12 dan
L. fermentum
2B4
Kultur induk L. plantarum 2C12 dan L. fermentum 2B4 dari penelitian Arief (2008) disegarkan terlebih dahulu pada mediade Man Rogosa Sharpe Broth(MRSB). Kemudian, dari kultur yang disegarkan tersebut dibuat kultur kerja. setelah itu, kultur kerja dipupukkan pada media de Man Rogosa Sharpe Agar (MRSA) untuk diketahui populasinya. kultur yang memenuhi syarat untuk dicekokkan pada tikus percobaan adalah kultur dengan jumlah populasi 108cfu/ml.
Kultur stok yang telah dibuat perlu diperbaharui setiap minggu agar aktivitasnya tidak berkurang. Pemeliharaan kultur stok pada penelitian ini akan menggunakan metode Hariyadi et. al (2001) dengan cara membuat tusukan kultur pada MRSA chalk semisolid, kemudian menginokulasikannya pada MRSB, lalu kultur tersebut dapat disimpan direfrigerator.
b. Pembuatan Kultur EPEC
lalu dibiakkan ke dalam tabung berisi media Nutrient Broth. Setelah 24 jam, kultur bakteri uji disetarakan kekeruhannya dengan standar McFarland no 0.5, yang memiliki kesetaraan dengan jumlah populasi bakteri sebesar 8x108sel bakteri/ml. Suspensi bakteri EPEC yang terbentuk kemudian diencerkan sampai diperoleh konsentrasi 8x106 sel bakteri/ml.
2. Kerangka Penelitian
[image:30.612.160.533.223.396.2]Kerangka penelitian ini ditunjukkan pada Gambar 5.
Gambar 5. Diagram Alir Kerangka Penelitian
3. Pengelolaan Tikus Percobaan
Hewan percobaan yang digunakan dalam penelitian ini adalah tikus putih (albino rat) galur Sprague Dawley umur 5-6 minggu berjenis kelamin jantan hasil pengembangbiakan Badan POM RI. Pemeliharaan tikus percobaan dilakukan di Laboratorium Hewan Percobaan SEAFAST CENTER, IPB. Kandang yang digunakan berukuran 17.5 x 23.75 x 17.5 cm, dengan jumlah sesuai dengan jumlah tikus yang digunakan. Kandang terbuat dari plastik. Kandang tikus harus harus bebas dari suara rebut, dan terjaga dari asap industri atau polutan lainnya. Lantai harus mudah dibersihkan dan disanitasi. Suhu optimum ruangan adalah 22-24oC, kelembaban udara 50 - 60%, dengan velintasi cukup namun tidak ada jendela terbuka (Muchtadi, 1993).
Setiap hari tikus percobaan diberi ransum berdasarkan standar AOAC (Tabel 6). Pemberian ransum dilakukan secara ad libitum (berlebih). Hari pertama setiap tikus diberi ransum sebanyak 10 gram. Hari kedua diberi ransum sebanyak 15 gram. Hari ketiga dan seterusnya diberi ransum sebanyak 20 gram.
PengujianL. plantarumdanL. fermentumsebagai antidiare pada tikus yang diinfeksi EPEC
Penentuan nilai PER tikus percobaan
Penentuan kadar air feses tikus
percobaan
Analisis kadar MDA organ hati
dan ginjal
Analisis proliferasi sel limfosit organ
limpa
Tabel 6. Komposisi Ransum Standar Berdasarkan AOAC
Bahan-bahan Campuran Jumlah (%)
Protein kasein 10
Minyak jagung 8
Campuran mineral 5
Campuran vitamin 1
CMC (carboximethylcellulosa) 1
Air 5
Maizena (pati jagung) 70 Sumber: Muchtadiet. al(1992).
4. Perlakuan pada Tikus Percobaan
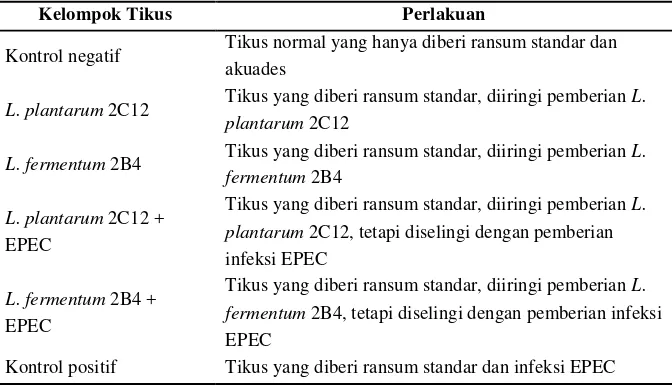
Tikus dibagi dalam 6 kelompok perlakuan (Tabel 7). Tikus diare dipersiapkan dengan cara menginduksi tikus dengan bakteri EPEC. Selama percobaan, semua kelompok tikus diberi pakan ransum standar. Pemberian BAL dilakukan selama tiga minggu penuh, yaitu dari hari ke-1 hingga ke-21, secara oral menggunakan sonde.
Tabel 7. Kelompok Perlakuan Tikus Percobaan
Kelompok Tikus Perlakuan
Kontrol negatif Tikus normal yang hanya diberi ransum standar dan akuades
L. plantarum2C12 Tikus yang diberi ransum standar, diiringi pemberianL.
plantarum2C12
L. fermentum2B4 Tikus yang diberi ransum standar, diiringi pemberianL.
fermentum2B4
L. plantarum2C12 + EPEC
Tikus yang diberi ransum standar, diiringi pemberianL. plantarum2C12, tetapi diselingi dengan pemberian infeksi EPEC
L. fermentum2B4 + EPEC
Tikus yang diberi ransum standar, diiringi pemberianL. fermentum2B4, tetapi diselingi dengan pemberian infeksi EPEC
Kontrol positif Tikus yang diberi ransum standar dan infeksi EPEC
H(-3) H(0) H(7) H(14) H(21)
Keterangan: T0 = terminasi awal; T1 = terminasi hari ke-7; T2 = terminasi hari ke-14; T3 = terminasi hari ke-21, masing-masing 4 tikus setiap kelompok
Gambar 6. Bagan Perlakuan Terminasi dan Cekok pada Tikus Percobaan
C. METODE ANALISIS
1. Pengukuran Bobot Badan dan Nilai PER (Muchtadi, 1993)
Bobot badan tikus ditimbang setiap dua hari sekali untuk mengetahui perubahan bobot badan tikus selama perlakuan. Selain itu, pakan yang diberikan serta sisa pakan ditimbang setiap hari untuk menentukan konsumsi pakan setiap hari. Data tersebut digunakan untuk menentukan nilai PER (Protein Efficiency Ratio) dengan persamaan:
PER = kenaikan berat badan Jumlah protein yang dikonsumsi
2. Kejadian Diare pada Tikus Terinfeksi EPEC (AOAC, 1995)
Kejadian diare tikus percobaan dapat diamati dengan cara mengukur kadar air feses yang dikoleksi pada hari ke-14 dan ke-21. Penentuan kadar air feses mengikuti prosedur analisis kadar air menurut AOAC 1995 (analisis kadar air metode oven biasa). Cawan alumunium dikeringkan dalam oven pada suhu 100oC selama 15 menit, lalu didinginkan dalam desikator selama 10 menit. Ditimbang cawan dengan neraca analitik (a gram). Ditimbang sampel dengan neraca analitik sebanyak 4-5 gram (b gram). Dikeringkan dalam oven pada suhu 100-105oC selama kurang lebih 6 jam, didinginkan dalam desikator kemudian ditimbang (c gram). pengeringan diulangi hingga diperoleh berat sampel yang relative konstan (berat dianggap konstan jika selisih berat sampel kering yang ditimbang
≤0.0003 gram).
Kadar air (%basis basah) = x–y X 100 % x–a
Keterangan:
x = berat cawan dan sampel sebelum dikeringkan (g) y = berat cawan dan sampel setelah dikeringkan (g) a = berat cawan kosong (g)
A
daptasiT0 T1 T2 T3
Cekok BAL
3. Analisis Kadar Malonaldehida (MDA) (Conti
et al.
, 1991)
Kadar MDA organ hati dan ginjal tikus percobaan diukur secara kuantitatif dengan metodeThiobarbituric Acid Reactivity Test. Metode ini didasarkan pada reaksi antara MDA dan TBA (Thiobarbituric acid) dalam suasana asam. Kompleks MDA-TBA yang terbentuk memiliki warna merah jambu dan absorbansinya dapat diukur pada panjang gelombang 532 nm (Contiet al., 1991).
Organ hati atau ginjal yang telah ditimbang, ditambahkan larutan PBS dingin sebanyak 2.5 ml, kemudian digerus, dan divorteks selama 10 detik. Campuran organ dan larutan PBS kemudian disentrifus dengan kecepatan 4000 rpm selama 10 menit. Apabila campuran masih terlihat keruh (belum terpisah dengan baik), maka disentrifus ulang. Setelah disentrifus, campuran akan terpisah menjadi supernatan dan padatan. 1 ml supernatan ditambahkan 4 ml reagen (larutan TCA 15%, TBA 0.38%, dan BHT 0.5% dalam HCl 0.25 N. Larutan kemudian divorteks selama 10 detik, dan diinkubasi dalam water bathbersuhu 80oC selama 60 menit. Setelah 60 menit inkubasi, larutan didinginkan sampai suhu ruang. Larutan yang telah dingin disentrifus dengan kecepatan 4000 rpm selama 10 menit. Supernatan yang dihasilkan kemudian diukur absorbansinya pada panjang gelombang 532 nm.
Sebagai standar MDA digunakan 1,1,3,3-tetraetoksipropana (TEP). pada suasana asam, TEP terhidrolisis dan menghasilkan hemiasetal dan etanol. Hemiasetal yang terbentuk kemudian terdekomposisi menjadi etanol dan malonaldehida. Penentuan kurva standar dilakukan sama dengan penentuan sampel. Perhitungan kadar MDA sampel berdasarkan hasil ploting nilai absorbansi pada kurva standar.
4. Analisis Proliferasi Sel Limfosit (Tejasari, 2000)
Dalam penelitian ini, sel limfosit diekstrak dari organ limpa tikus. Pengujian proliferasi sel limfosit yang diperoleh dari organ limpa, dilakukan dengan metode pewarnaan
tryphan blue.
Organ limpa yang telah diambil langsung dicuci dalam larutan PBS, kemudian dipindahkan ke dalam cawan petri yang berisi 5 ml RPMI-1640 steril. Setelah digerus, ekstrak limpa disentrifus dengan kecepatan 1500 rpm selama 10 menit. Supernatan yang dihasilkan dibuang, sedangkan pelet ditambahkan 2 ml NH4Cl 0.85% steril, didiamkan selama tepat 2 menit. Selanjutnya, segera ditambahkan dengan 3 ml RPMI-1640 steril, kemudian disentrifus dengan kecepatan 1500 rpm selama 10 menit. Pelet yang dihasilkan segera ditambahkan dengan 5 ml RPMI-1640 steril, dan disentrifus kembali dengan kecepatan 1750 rpm selama 10 menit. Pelet yang dihasilkan segera ditambahkan dengan 3 ml RPMI-1640 steril dan dihomogenkan (divorteks).
50 µl suspensi yang mengandung sel limfosit kemudian dipindahkan ke dalam
microplate, kemudian ditambahkan tryphan bluedengan perbandingan 1:1. Penghitungan dilakukan pada perbesaran mikroskop 400 x. Sel limfosit hidup akan terlihat transparan atau bening atau tidak berwarna dan secara visual dinding sel tampak kompak, sedangkan sel limfosit mati akan terlihat berwarna biru karena membrane sel telah rusak sehingga dinding sel terlihat keriput.
Jumlah sel/ml = jumlah sel x fp x 104, di mana fp = 2 2
5. Rancangan Percobaan
Penelitian ini menggunakan Rancangan Acak Lengkap, dengan model matematika sebagai berikut:
Yij = μ +αi +βj +εij
Yij : pengaruh perlakuan ke-i dan ulangan ke-j
μ : nilai tengah perlakuan
αi : pengaruh perlakuan ke-i
βj : pengaruh ulangan ke-j
εij : galat perlakuan ke-i dan ulangan ke-j
IV.
HASIL DAN PEMBAHASAN
A. BOBOT BADAN TIKUS DAN NILAI PER
Selama pemeliharaan, bobot badan tikus ditimbang tiga hari sekali (Lampiran 1). Pertumbuhan bobot badan tikus selama percobaan dapat dilihat pada Gambar 7. Pada umumnya bobot badan tikus mengalami kenaikan selama pemeliharaan. Akan tetapi, pada tikus yang diberi EPEC, yaitu tikus kelompokL. plantarum2C12 + EPEC,L. fermentum2B4 + EPEC, dan kontrol positif (diberi EPEC saja), mengalami penurunan bobot badan sejak hari ke-12 hingga ke-21. Hal ini disebabkan tikus tersebut mengalami infeksi saluran pencernaan oleh EPEC, sehingga proses penyerapan zat-zat gizi di dalam usus menjadi terganggu dan menurunkan bobot badan.
Gambar 7. Pertumbuhan Bobot Badan Tikus selama 21 Hari Percobaan
Adesi atau pelekatan bakteri patogen pada permukaan mukosa menjadi tahap awal infeksi saluran usus. Pelekatannya pada sel epithelial usus akan mengakibatkan kolonisasi, kerusakan sel, gangguan mekanisme pengaturan sel, serta pertumbuhan dan perkembangbiakan intraselular (Coconnieret al., 1993).
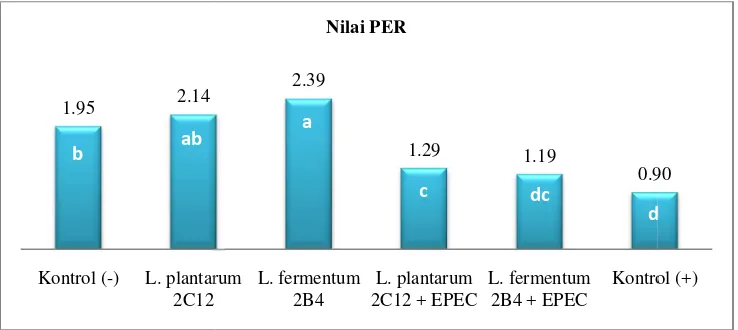
Penurunan bobot badan kelompok tikus yang diberi EPEC, diperkuat dengan nilai PER tikus percobaan (Gambar 8 dan Lampiran 2). Analisis sidik ragam menunjukkan bahwa perlakuan berpengaruh nyata (p<0.05) terhadap nilai PER tikus percobaan (Lampiran 3). Tikus kelompokL. fermentum2B4 memiliki nilai PER yang paling tinggi, sedangkan tikus kelompok kontrol positif memiliki nilai PER yang paling rendah. Uji lanjut Duncan (Lampiran 3) menunjukkan bahwa nilai PER tikus kelompokL. fermentum2B4 + EPEC tidak berbeda nyata dengan nilai PER tikus kelompokL. plantarum2C12 + EPEC dan dengan kontrol positif, namun berbeda nyata dan lebih rendah dibandingkan dengan kelompok tikus lainnya.
0 50 100 150 200 250
H0 H1 H3 H6 H9 H12 H15 H18 H21
B
o
bo
t
B
a
da
n
(g
)
Periode Pemeliharaan (hari ke-)
Kontrol (-)
L. plantarum 2C12 L. fermentum 2B4 L. plantarum 2C12 + EPEC
L. fermentum 2B4 + EPEC
Keterangan: Nilai yang diikuti ol
Gambar 8. NilaiProte
Nilai PER menunjukka berat badan. Rendahnya nila perbedaan sumber protein Pemberian EPEC menyebabk zat gizi, termasuk protein, me
B. KEJADIAN DIARE PADA T
[image:36.612.152.521.80.245.2]BAL memberikan ma mikroflora dan saluran penc dan Kesejahteraan Jepang me meningkatkan kesehatan, Manfaat kesehatan yan dalam saluran pencernaan (S dapat menyebabkan diare. E perubahan struktur sel, kemud
Tabel 8. Kadar Air Feses Tik
Kelompok Perlakuan
Kontrol (-)
L. plantarum2C12
L. fermentum2B4
L. plantarum2C12 + EPEC
L. fermentum2B4 + EPEC Kontrol (+)
Keterangan: Nilai yang diikuti ol
1.95 2.14
Kontrol (-) L. plantar 2C12
b ab
i oleh huruf yang sama menunjukkan tidak berbeda nyata (p>0.05)
otein Efficiency RatioTikus Percobaan pada Berbagai Perlaku
kkan pengaruh penyerapan protein yang dikonsumsi terhadap ilai PER kelompok tikus yang diinfeksi EPEC bukan diseba in pada ransum, tetapi lebih disebabkan oleh pemberia bkan infeksi pada saluran pencernaan tikus, sehingga penye menjadi terganggu.
PADA TIKUS TERINFEKSI EPEC
manfaat positif bagi kesehatan, khususnya menjaga kese ncernaan. Surono (2004) mengatakan bahwa Kementerian K mengidentifikasi 12 komponen bahan pangan yang dikategori tan, dan BAL termasuk salah satu dia ang berkaitan dengan BAL adalah mengendalikan bakter (Surono, 2004). EPEC merupakan salah satu bakteri pato EPEC melekat pada sel mukosa usus dan menyebabkan
udian melakukan invasi menembus sel mukosa.
ikus Percobaan (%bb)
uan Hari ke-14 Hari ke-21
51.84±0.43a 53.22±0.87bc 48.93±1.31a 46.02±1.63a 48.66±1.41a 48.30±1.13ab C 48.21±1.29a 57.25±1.98c C 46.93±2.69a 53.82±1.77c 64.49±2.70b 68.92±2.40d
i oleh huruf yang sama menunjukkan tidak berbeda nyata (p>0.05)
4 2.39 1.29 1.19 0.9 tarum 2 L. fermentum 2B4 L. plantarum 2C12 + EPEC
L. fermentum 2B4 + EPEC
Kontro Nilai PER ab a c dc d ) kuan ap kenaikan babkan oleh rian EPEC. yerapan
zat-seimbangan n Kesehatan orikan dapat diantaranya. teri patogen atogen yang n terjadinya
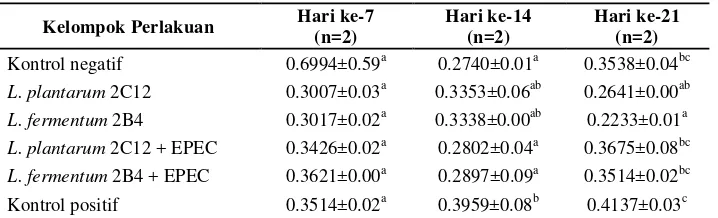
Feses masing-masing kelompok perlakuan diukur kadar airnya (basis basah) pada hari ke-14 dan ke-21 (Lampiran 4). Analisis sidik ragam menunjukkan bahwa perlakuan yang diberikan kepada tikus percobaan berpengaruh nyata (p<0.05) terhadap kadar air feses (%bb) tikus pada hari ke-14 dan ke-21 (Lampiran 5 dan 6). Rata-rata kadar air feses pada hari ke-14 dan ke-21 dapat dilihat pada Tabel 8. Uji lanjut Duncan pada hari ke-14 (Lampiran 5) menunjukkan bahwa kadar air feses kelompok kontrol positif (diberi EPEC saja) berbeda nyata dengan kadar air feses kelompok lainnya dan nilainya paling besar (64.49±2.70 %bb).
Kadar air feses kelompokL. plantarum2C12 + EPEC tidak berbeda nyata dengan kadar air feses kelompokL. fermentum2B4 + EPEC, dan keduanya juga tidak berbeda nyata dengan kadar air feses kelompok kontrol negatif, L. plantarum 2C12, dan L. fermentum2B4. Hal ini menunjukkan bahwa pemberianL. plantarum2C12 danL. fermentum2B4 sampai pada hari ke-14 dapat menekan kejadian diare pada kelompok yang juga diberi EPEC (kelompokL. plantarum
[image:37.612.163.515.302.452.2]2C12 + EPEC dan L. fermentum2B4 + EPEC). Feses tikus kelompok kontrol positif tampak berlendir sebagai tanda telah terjadi infeksi pada saluran pencernaannya, sedangkan feses pada kelompok tikus yang lain tidak berlendir (Gambar 9).
Gambar 9. Feses Tikus Percobaan pada Hari ke-14
Pada hari ke-21 ditemukan beberapa pola yang sama. Uji lanjut Duncan pada hari ke-21 (Lampiran 6) juga menunjukkan bahwa kadar air feses kelompok kontrol positif berbeda nyata dengan kadar air feses kelompok lainnya dan nilainya meningkat menjadi 68.92±2.40 %bb. Kadar air feses ini lebih besar dibandingkan dengan kelompok lainnya. Kadar air feses kelompok L. plantarum2C12 + EPEC danL. fermentum 2B4 + EPEC juga mengalami peningkatan namun tidak berbeda nyata satu sama lain dan juga tidak berbeda nyata dengan kelompok kontrol negatif. Pada tikus yang sehat (kelompok kontrol negatif,L. plantarum2C12, danL. fermentum2B4) kadar air feses berkisar pada 46.02±1.63 %bb sampai 53.22±0.87 %bb.
Dengan demikian, dapat dikatakan bahwa pemberian EPEC mengakibatkan terjadinya diare, ditandai oleh tingginya kadar air feses tikus kelompok kontrol positif (diberi EPEC saja) dibandingkan kelompok tikus lainnya. Selain itu, pemberianL. fermentum2B4 danL. plantarum
dapat menekan terjadinya diare pada tikus yang diberi EPEC.
Kegagalan sistem pertahanan mukosa intestinal melalui produksi musin (sebagai penghalang fisik, pelumas, menghasilkan senyawa bakteriostatik maupun bakteriosidal sel) oleh
Kontrol (-) L. plantarum2C12 L. fermentum2B4
L. plantarum2C12 + EPEC
L. fermentum2B4
IgA), serta mikrovili (yang mendorong musin dan bakteri keluar dari membran mukosa) dalam mencegah adesi EPEC akan mengawali infeksi EPEC (Salyer dan Whitt, 1994). Kegagalan mekanisme pertahanan tubuh tersebut menyebabkan terjadinya perlekatan bakteri pada permukaan sel intestinal inang, berupa lesi attaching dan effacing yang bersifat localized adherence. Perlekatan kuat antara sel bakteri dan sel epitel inang akan merusak aktin dan mikrovili sel-sel mukosa inang yang mengakibatkan hilangnya kemampuan mukosa untuk mengabsorbsi air sehingga terjadi diare akut berair yang persisten, selain kadang-kadang disertai demam ringan dan muntah (Knuttonet al., 1989).
Kompetisi BAL probiotik terhadap bakteri patogen dilakukan dengan cara persaingan dalam mendapatkan nutrisi dan membentuk biosurfaktan dan molekul koagregasi yang mencegah pelekatan dan penyebaran patogen pada sel epithelial, menghasilkan senyawa antibakteri seperti bakteriosin, menurunkan pH dengan dihasilkannya asam laktat yang menghambat pertumbuhan bakteri patogen, dan menekan aktivitas enzim penghasil amin yang toksik dan karsinogenik dari bakteri usus lainnya (Surono, 2004). Menurut Kaur et. al. (2002) efek antagonisme atau antibakteri BAL terdiri atas dua mekanisme, yaitu dengan menghasilkan senyawa metabolit primer seperti asam laktat, CO2, diasetil, asetaldehida, dan hidrogen peroksida (H2O2); dan dengan menghasilkan bakteriosin yang merupakan senyawa protein yang menunjukkan aktivitas antibakteri.
C. JUMLAH SEL LIMFOSIT
Limfosit adalah sel darah putih (leukosit) yang berukuran kecil, berbentuk bulat dengan diameter 7-15 µ m. Limfosit merupakan sel kunci dalam proses respon imun spesifik, untuk mengenali antigen yang beragam. Setiap limfosit hanya dapat mengenal satu antigen sehingga dalam proses respon imun, limfosit saling bekerja sama untuk mengeliminasi beragam antigen yang masuk ke dalam tubuh (Roitt, 1991).
Sel limfosit terdiri atas sel T dan sel B yang keduanya bertanggung jawab dalam respon imun spesifik untuk mengenali antigen melalui reseptor antigen. Sel limfosit juga mampu membedakan antigen dengan komponen tubuh sendiri atau berfungsi sebagai pengontrol sistem imun (Bellanti, 1993).
Proliferasi merupakan fungsi biologis mendasar limfosit, yaitu proses diferensiasi dan pembelahan (mitosis) sel. Limfosit merupakan sel tunggal yang bertahan baik pada saat dikultur dalam media sederhana. Respon proliferasi kultur limfosit digunakan untuk menggambarkan fungsi limfosit dan status imun individu (Tejasari, 2000). Jumlah rataan sel limfosit tikus percobaan selama penelitian dapat dilihat pada Tabel 9 dan Lampiran 7.
Tabel 9. Rataan Jumlah Sel Limfosit Tikus Percobaan (x106/ml) pada Hari ke-7, 14, dan 21
Kelompok Tikus Hari ke-7
(n=3)
Hari ke-14 (n=3)
Hari ke-21 (n=3)
Kontrol negatif 1.43±0.57a 45.84±4.73a 108.04±7.48bc
L. plantarum2C12 12.32±0.47b 38.54±6.72a 162.83±50.35c
L. fermentum2B4 12.96±0.13b 48.33±5.02a 162.55±14.93c
L. plantarum2C12 + EPEC 12.38±0.70b 94.66±3.29b 89.09±6.01ab
L. fermentum2B4 + EPEC 27.76±10.34c 150.76±27.88c 113.17±26.56bc Kontrol positif 3.11±1.30a 23.91±5.26a 38.32±11.66a
Keterangan: Nilai yang diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata (p>0.05)
Hal di atas menunjukkan bahwa dalam keadaan sehat (kelompok L. plantarum 2C12 + EPEC danL. fermentum2B4 + EPEC belum diberi EPEC), pemberianL. plantarum2C12 danL. fermentum2B4 dapat memicu proliferasi sel limfosit atau meningkatkan jumlah sel limfosit limpa hingga sembilan kali lipat jumlah sel limfosit kelompok yang tidak diberi BAL. Dengan demikian dapat dikatakan bahwa BAL yang digunakan pada penelitian ini, yaituL. plantarum2C12 danL. fermentum2B4, mempunyai sifat sebagai imunomodulator.
Pemberian EPEC pada kelompokL. plantarum2C12 + EPEC,L. fermentum2B4 + EPEC dan kontrol positif mulai dilakukan dari hari 8 hingga 14. Uji lanjut Duncan pada hari ke-14 (Lampiran 9) menunjukkan bahwa jumlah sel limfosit kelompok kontrol positif berbeda nyata dan lebih rendah dibandingkan dengan jumlah sel limfosit kelompokL. plantarum2C12 + EPEC danL. fermentum2B4 + EPEC. Jumlah sel limfosit kelompokL. fermentum2B4 + EPEC berbeda nyata dan lebih besar dibandingkan dengan jumlah sel limfosit kelompokL. plantarum 2C12 + EPEC. Hal ini menunjukkan bahwa pemberianL. plantarum2C12 danL. fermentum2B4 selama pemberian EPEC dapat memicu terjadinya proliferasi sel limfosit yang ditandai dengan meningkatnya jumlah sel limfosit pada limpa tikus. Dengan demikian, dapat dikatakan bahwaL. plantarum 2C12 danL. fermentum 2B4 dapat meningkatkan status imun atau bersifat sebagai imunomodulator, namun L. fermentum 2B4 memiliki sifat imunomodulator yang lebih baik dibandingkanL. plantarum2C12.
Pada hari ke-15 hingga ke-21, pemberian EPEC pada kelompok L. plantarum 2C12 + EPEC,L. fermentum2B4 + EPEC, dan kontrol positif dihentikan. Pada hari ke-21 kelompok tikus kontrol positif memiliki jumlah sel limfosit paling rendah. Uji lanjut Duncan pada hari ke-21 (Lampiran 10) menunjukkan bahwa jumlah sel limfosit tikus kelompok kontrol positif berbeda nyata dengan kelompok kontrol negatif,L. plantarum2C12,L. fermentum