1
(Rasyid et al., 1999). Namun makroalga jenis ini belum banyak dibudidayakan dan kebanyakan diambil secara langsung dari alam.
Makroalga mengonversi energi dari cahaya matahari melaui proses fotosintesis. Proses fotosintesis memerlukan molekul karbondioksida ( ) dari atmosfer dan hidrogen dipisahkan dari air untuk membangun karbohidrat. Makroalga dapat mereduksi yang menyebabkan peningkatan suhu bumi sehingga baik untuk dibudidayakan. Karbohidrat yang terkandung pada
makroalga memiliki kandungan lebih tinggi daripada lemaknya. Menurut Jeong dan Park (2009), kandungan gula lebih mudah untuk dikonversi ke dalam bentuk
biofuel dan kimia. Hal ini memungkinkan peluang untuk menjadikan makroalga sebagai bahan dari energi alternatif biofuel.
yang besarnya lima kali lebih banyak dari biomassa tumbuhan di darat. Menurut Aresta et al. (2005) biomassa yang dihasilkan dari fotosintesis tanaman akuatik lebih efisien dan tinggi dibandingkan dengan tanaman terestrial yaitu rata-rata sebesar 1,8-2,2%. Biomassa yang dihasilkan dari fotosintesis tanaman akuatik rata-rata sebesar 8%.
Penelitian ini melihat laju pertumbuhan biomassa dari Gelidiumlatifolium
pada sistem yang diinjeksikan dengan kadar yang berbeda-beda. Selain melihat laju pertumbuhan Gelidium latifolium, dilakukan perhitungan jumlah yang digunakan dalam proses kultivasi sehingga bisa diketahui jumlah gas
tersebut dalam proses kultivasi serta kandungan karbohidrat sebelum dan sesudah kultivasi.
1.2 Tujuan
Tujuan penelitian ini adalah :
1. Menguji kadar karbohidrat Gelidiumlatifolium sebelum dan sesudah kultivasi; 2. Menganalisis laju pertumbuhan biomassa Gelidiumlatifolium selama kultivasi
menggunakan sistem injeksi ;
3
sebagainya. Pigmen yang terdapat pada thallus juga bermacam-macam sehingga dapat digunakan dalam membedakan berbagai kelas makroalga, yaitu
Chloropyceae, Phaeophyceae, Rhodophyceae, dan Cyanophceae. Pigmen yang menentukan warna ini adalah klorofil, karoten, phycoerythin, dan phycocyanin
merupakan pigmen utama di samping pigmen lainnya (Aslan, 1998).
Alga merah atau Rhodophyceae merupakan alga yang memiliki pigmen fikobilin yang terdiri dari phycoerythin (berwarna merah) serta phycocyanin
(berwarna biru). Alga merah ini bersifat adaptasi kromatik yaitu memiliki penyesuaian antara proporsi pigmen dengan berbagai kualitas pencahayaan dan dapat menimbulkan berbagai warna pada thallus. Jenis ekonomis dari divisi ini adalah Gracilaria spp., Gelidium spp., Euchema spp., Hypnea spp., Gigartina
spp., dan Rhodymena spp. Alga cokelat dengan nama lain Phaeopyceae
merupakan alga yang memiliki pigmen klorofil a dan c, beta karoten, violasantin dan fikosantin. Jenis ekonomis pada divisi ini adalah Sargassum spp.,
Hormophysa spp., dan Turbinaria spp. Alga hijau atau Chlorophyceae
benilai ekonomis pada divisi ini adalah Ulva spp. dan Enteromorpha spp. (Aslan, 1998).
2.2 Klasifikasi dan Karakteristik Gelidiumlatifolium
Makroalga yang digunakan dalam penelitian adalah jenis Gelidium latifolium, tersaji pada Gambar 1.
Gambar 1. Makroalga Gelidium latifolium
Sumber: Dokumentasi pribadi
Dirujuk dari Hatta et al. (2001), taksonomi Gelidium latifolium adalah sebagai berikut:
Divisi : Rhodophyta Kelas : Rhodophyceae
Ordo : Gelidiales
Family : Gelidiaceae Genus : Gelidium
perairan Indonesia. Nama Gelidium berbeda-beda di setiap daerah misalnya kades dan intip kembang karang (Jawa Barat), bulung merak dan bulung ayam (Bali), serta sayur laut (Ambon). Gelidium sp. memiliki kandungan agar berkualitas baik dan potensial dijadikan sebagai bahan baku industri farmasi, kosmetik, dan makanan. Selain itu, diolah menjadi bioetanol dan bahan baku pulp
atau kertas karena kualitas seratnya yang sangat baik. Kandungan agar-agarnya berkisar antara 12-48% tergantung jenisnya (Aslan, 1988).
2.3 Laju Pertumbuhan Makroalga
Pertumbuhan adalah perubahan ukuran suatu organisme dapat berupa berat atau panjang dalam waktu tertentu. Pertumbuhan makroalga sangat dipengaruhi oleh dua faktor yaitu faktor internal dan faktor eksternal. Faktor internal yang berpengaruh antara lain jenis, galur, bagian thallus, dan umur. Faktor eksternal yang berpengaruh antara lain keadaan fisik dan kimiawi perairan. Selain itu, faktor lain yang sangat menentukan keberhasilan pertumbuhan makroalga yaitu pengelolaan yang dilakukan oleh manusia (Syahputra, 2005).
Pertumbuhan juga merupakan salah satu aspek biologi yang harus
laju pertumbuhan dan bibit thallus yang berasal dari bagian ujung akan
memberikan laju pertumbuhan lebih tinggi dibandingkan dengan bibit thallus dari bagian pangkal. Menurut Puslitbangkan (1991), laju pertumbuhan makroalga yang dianggap cukup menguntungkan adalah di atas 3% pertambahan berat per hari. Makroalga merupakan organisme laut yang memiliki syarat-syarat
lingkungan tertentu agar dapat hidup dan tumbuh dengan baik. Semakin sesuai kondisi lingkungan perairan dengan areal yang akan dibudidayakan akan semakin baik pertumbuhannya dan juga hasil yang diperoleh (Syahputra, 2005).
Soegiarto et al. (1978) menyatakan bahwa laju pertumbuhan makroalga berkisar antara 2-3% per hari. Percobaan yang dilakukannya menggunakan rak terapung pada tiga lapisan kedalaman berbeda menunjukkan bahwa posisi yang lebih dekat dengan permukaan (30 cm) tumbuh lebih baik daripada lapisan kedalaman di bawahnya karena cahaya matahari merupakan faktor penting untuk pertumbuhan makroalga. Pada kedalaman tidak terjangkau cahaya matahari, maka makroalga tidak dapat tumbuh. Demikian pula iklim, letak geografis dan faktor oseanografi menentukan pertumbuhannya. Pertumbuhan makroalga dikategorikan sebagai pertumbuhan somatik dan pertumbuhan fisiologis. Pertumbuhan somatik merupakan pertumbuhan yang diukur berdasarkan
yang telah dipotong pada karang atau balok semen kemudian disebar pada dasar perairan. Metode dasar merupakan metode pembudidayaan
makroalga dengan menggunakan bibit dengan berat tertentu. b. Metode lepas dasar (off-bottom method)
Metode ini dapat dilakukan pada dasar perairan yang terdiri dari pasir, sehingga mudah untuk menancapkan pancang. Metode ini sulit dilakukan pada dasar perairan yang berkarang. Bibit diikat dengan tali rafia yang kemudian diikatkan pada tali plastik yang direntangkan pada pokok kayu atau bambu. Jarak antara dasar perairan dengan bibit yang akan dilakukan berkisar antara 20-30 cm. Bibit yang akan ditanam berukuran 100-150 gram, dengan jarak tanam 20-25 cm. Penanaman dapat pula dilakukan dengan jaring yang berukuran 2,5x5 m² dengan lebar mata jaring 25-30 cm dan direntangkan pada patok kemudian bibit rumput laut diikatkan pada simpul-simpulnya.
c. Metode apung (floating method/longline)
ketersediaan material, umumnya 2,5x5 m² untuk memudahkan pemeliharaan.
Aslan (1998) menyatakan pemanenan makroalga dilakukan bila telah mencapai bobot empat kali dari bobot awalnya yaitu dalam lama pemeliharaan sekitar 1,5-4 bulan. Indriani dan Sumiarsih (1999) menyatakan makroalga bisa dipanen dalam waktu tanam 6-8 minggu. Menurut Kadi dan Atmadja (1988) pemanenan makroalga dapat dilakukan setelah 1-3 bulan.
2.5 Faktor yang Memengaruhi Pertumbuhan Makroalga
Beberapa faktor yang memengaruhi pertumbuhan dari makroalga diantaranya sebagai berikut:
2.4.1 Temperatur
Temperatur merupakan faktor yang amat penting bagi kehidupan organisme di lautan, karena temperatur memengaruhi aktivitas metabolisme ataupun perkembangbiakan dari organisme-organisme tersebut (Hutabarat dan Evans, 2008). Toleransi temperatur dianggap sebagai faktor penting dalam menjelaskan biogeografi makroalga. Kenaikan temperatur yang tinggi mengakibatkan thallus menjadi pucat kekuning-kuningan yang menjadikan makroalga tidak dapat tumbuh dengan baik. Oleh karena itu, temperatur perairan yang baik untuk budidaya makroalga adalah 20-28 °C dengan fluktuasi harian maksimum 4 °C (Puslitbangkan, 1991). Temperatur merupakan faktor sekunder bagi kehidupan makroalga dan fluktuasi yang tinggi akan menghindarkan proses
salinitas akibat air tawar yang masuk akan menyebabkan pertumbuhan makroalga menjadi tidak normal. Salinitas yang dianjurkan untuk budidaya makroalga adalah salinitas pada kisaran 28-34 ppt (Zatnika dan Angkasa, 1994). Menurut Dawes (1981) kisaran salinitas yang baik untuk budidaya makroalga berkisar 30-35 ppt. Soegiarto et al. (1978) pun menuturkan bahwa salinitas yang cocok untuk budidaya makroalga adalah 32-35 ppt.
2.4.3 Nutrien
Unsur hara atau nutrien berperan untuk pertumbuhan, terdiri dari mikro nutrien dan makro nutrien. Mikro nutrien merupakan unsur hara yang diperlukan dalam jumlah yang sedikit sedangkan makro nutrien merupakan unsur hara yang diperlukan dalam jumlah yang banyak. Unsur Nitrogen dan Fosfor merupakan makro nutrien yang menjadi pembatas pertumbuhan dan perkembangan
makroalga. Nitrogen diserap dalam bentuk Nitrat dan unsut Fosfor diserap dalam bentuk Fosfat (Nybakken, 1988).
2.4.4 Derajat keasaman (pH)
Makroalga cenderung membutuhkan pH yang basa untuk
pertumbuhannya. Derajat keasaman yang ideal untuk pertumbuhan makroalga yaitu 8-9. Apabila perairan terlalu asam maupun basa maka akan menghambat pertumbuhan makroalga (Puslitbangkan, 1991). Menurut Zatnika dan Angkasa (1994) derajat derajat keasaman yang baik untuk pertumbuhan makroalga adalah 7-9 dengan kisaran derajat derajat keasaman optimum sebesar 7,3-8,2.
2.4.5 Oksigen Terlarut (DO)
Oksigen terlarut (DO) umumnya banyak dijumpai di lapisanpermukaan
karena proses difusi dan fotosintesis yang dilakukan olehfitoplankton. Oksigen
terlarut penting dalam mempengaruhikesetimbangan kimia air laut dan
mempengaruhi kehidupan organisme laut. Baku mutu DO untuk makroalga adalah lebih dari 5 mg/L (Soegiarto et al., 1978).
2.4.6 Kecerahan dan Cahaya
Kecerahan perairan menunjukkan kemampuan cahaya untuk menembus lapisan air pada kedalaman tertentu. Pada perairan alami kecerahan penting karena erat kaitannya dengan proses fotosintesis. Kebutuhan cahaya yang tinggi bagi makroalga untuk kepentingan fotosintesis terlihat dari sebarannya yang terbatas pada daerah yang masih menerima cahaya matahari (Hutabarat dan Evans, 2008).
gejala ini dapat dilihat dengan adanya perubahan warna dan bentuk sehingga laju pertumbuhan makroalga menurun. Ciri-ciri makroalga yang terkena penyakit ais-ais ditandai dengan timbulnya bintik-bintik pada bagian thallus yang dapat
mengakibatkan thallus menjadi patah apabila dibiarkan dalam waktu relatif lama. Penyebab timbulnya penyakit ini adalah karena adanya mikroba yang menyerang makroalga yang lemah. Penyakit ais-ais biasanya menyerang 11 makroalga jenis
Eucheuma spp. Gejala yang dapat dilihat adalah perubahan warna menjadi pucat dan pada beberapa thallus menjadi putih dan akhirnya membusuk (Direktorat Jenderal Perikanan Budidaya, 2004).
Penyakit white spot merupakan penyakit yang menyerang makroalga jenis
Laminaria japonica di Cina. Penyakit ini menimbulkan gejala terjadinya perubahan warna thallus dari coklat kekuningan menjadi putih kemudian menyebar keseluruh thallus dan bagian makroalga membusuk dan rontok (Direktorat Jenderal Perikanan Budidaya, 2004).
2.5 Siklus Karbondioksida
Pembakaran bahan bakar fosil (batu bara dan minyak bumi) oleh
house effect) yaitu gas yang menyerap panas yang dilepaskan oleh cahaya matahari. Oleh karena itu, peningkatan kadar berkorelasi positif dengan peningkatan temperatur bumi yang biasa disebut dengan pemanasan global (Effendi, 2003).
Meskipun persentasi di atmosfer relatif kecil tetapi keberadaannya di perairan relatif tinggi karena memiliki kelarutan yang tinggi (Jeffries dan Mills,1996). Karbondioksida yang terdapat di atmosfer larut ke dalam badan air akan menghasilkan asam karbonat (Cole et al., 1988).
Cole et al. (1988) juga mengemukakan bahwa keberadaan di perairan terdapat dalam bentuk gas karbondioksida bebas ( ), ion bikarbonat ( ), ion karbonat ( ), dan asam karbonat ( ). Proporsi dari keempat bentuk karbon tersebut dapat dilihat pada Gambar 2.
Gambar 2. Hubungan antara dengan pH (Willoughby, 1978)
O + ……… (6) Kelarutan dalam air dipengaruhi oleh temperatur. Proses fotosintesis di perairan dapat memanfaatkan ataupun ion bikarbonat sebagai sumber karbon (Jeffries dan Mills,1996). Namun tumbuhan akuatik misalnya alga lebih menyukai sebagai sumber karbonnya dibandingkan ion bikarbonat dan karbonat. Bikarbonat sebenarnya dapat digunakan sebagai sumber karbon tetapi di dalam kloroplas bikarbonat harus dikonversi terlebih dahulu menjadi
dengan bantuan enzim karbonik anhidrase (Boney, 1989).
2.6 Kegunaan Makroalga
Makroalga dimanfaatkan secara luas baik dalam raw material maupun dalam bentuk hasil olahan. Di Indonesia makroalga digunakan sebagai lalapan, obat, manisan, dan sayuran. Sedangkan di Jepang digunakan sebagai sayuran, minuman teh, dan campuran pada nasi. Selain itu, pemanfaatan makroalga adalah sebagai pupuk, makanan ternak, dan sumber energi (Atmadja et al., 1996).
memiliki sifat-sifat koloid sehingga banyak dimanfaatkan untuk formulasi
berbagai produk. Polisakarida agar dapat diperoleh dari berbagai jenis alga merah diantaranya Gracilaria sp. dan Gelidium sp. (Rachmaniar, 1996b).
Menurut John (2010) beberapa spesies alga dengan kandungan pati yang tinggi dapat dijadikan etanol. Perusahaan penerbangan dan minyak telah mulai menginvestasikan modalnya untuk mengembangkan biofuel dari alga misalnya US Air Force dan Federal Aviation Administration.
2.7 Karbohidrat
Karbohidrat adalah biomolekul yang sangat melimpah di bumi. Fotosintesis mengonversi lebih dari 100 miliar metrik dan O menjadi selulosa dan produk tanaman lainnya. Karbohidrat (gula dan pati) adalah makanan pokok di sebagian besar dunia. Polimer karbohidrat tidak berfungsi sebagai struktural serta pelindung elemen dalam dinding sel bakteri, tanaman, dan dalam jaringan ikat hewan. Ada tiga kelas ukuran utama karbohidrat, yaitu monosakarida, oligosakarida, dan polisakarida. Kata "sakarida" berasal dari bahasa Yunani sakaron, yang berarti "gula" (Nelson dan Cox, 2004).
Monosakarida atau gula sederhana, terdiri dari aldehida polihidroksi tunggal atau keton unit. Monosakarida yang paling melimpah di alam adalah gula enam-karbon D-glukosa, kadang-kadang disebut sebagai dekstrosa. Monosakarida dengan rantai lebih dari empat karbon cenderung memiliki struktur siklik.
2.8 Produksi Bioetanol dan Hidrolisis
Proses produksi blue-etanol dari makroalga dilakukan melalui beberapa tahapan, yaitu hidrolisis, fermentasi, dan pemurnian. Hidrolisis dilakukan menggunakan asam kuat dengan pemanasan 100 ⁰C selama 3 jam atau
menggunakan enzim selulase. Tujuannya adalah untuk memisahkan polisakarida dari biomassa makroalga. Selanjutnya adalah fermentasi hasil hidrolisis
makroalga menjadi etanol menggunakan bantuan mikroorganisme.
Mikroorganisme yang biasa digunakan untuk fermentasi adalah Saccharomyces cerevisiae, Streptococcus cremoris, dan Lactobacillus pentoacetius pada kondisi anaerob, karena pada kondisi aerob akan menjadikan mikroorganisme
berkembang baik tetapi pembentukan etanolnya sedikit. Tahap terakhir adalah pemurnian etanol agar kandungan hasil fermentasi sesuai dengan yang diharapkan dan bisa digunakan sebagai pengganti bahan bakar fosil (Iryani et al., 2009).
biasa digunakan, yaitu hidrolisis asam encer (dilute acid hydrolysis), hidrolisis asam pekat (concentrated acid hydrolisis), dan hidrolisis enzim (enzyme hydrolysis). Hidrolisis selulosa menjadi gula sederhana dapat dilakukan
menggunakan tiga metode di atas. Beberapa penelitian melaporkan bahwa proses hidrolisis secara enzimatis lebih menguntungkan daripada menggunakan asam yaitu mencegah terjadinya korosi, proses dapat berlangsung pada kondisi mild
(pH 4,8 dan temperatur 500 °C) dan rendemen lebih tinggi (Duff dan Murray, 1996).
Menurut Speight (2002) hidrolisis merupakan reaksi pengikatan gugus hidroksil atau oleh suatu senyawa. Gugus dapat diperoleh dari senyawa air. Hidrolisis dapat digolongkan menjadi hidrolisis murni, hidrolisis asam, hidrolisis basa, dan hidrolisis enzim. Hidrolisis murni adalah hidrolisis yang menggunakan air saja sebagai penghidrolisis. Beberapa macam senyawa yang dapat dihidrolisis secara langsung dengan menggunakan air saja, antara lain halida asam dan asam anhidrid. Hidrolisis dengan asam ini mula-mula diamati oleh Kirchoff dengan mengamati hidrolisis pati dengan adanya asam-asam mineral dan terjadi suatu transformasi bahan pati menjadi glukosa. Jenis asam yang banyak digunakan antara lain asam klorida, asam sulfat, asam oksalat, dan asam benzena sulfonat. Asam berfungsi sebagai katalisator yaitu untuk
sehingga dalam reaksinya membutuhkan katalisator untuk mempercepat
18 3.1 Waktu dan Lokasi Penelitian
Penelitian ini dilakukan pada bulan Februari sampai Juli 2012. Waktu pemeliharaan Gelidium latifolium berlangsung dari bulan Juni sampai Juli 2012. Kegiatan penelitian meliputi tahap persiapan media kultivasi dan bibit makroalga, kultivasi menggunakan injeksi , pengukuran kualitas air, pengamatan
pertumbuhan makroalga, dan uji kadar karbohidrat sebelum serta setelah kultivasi. Rangkaian penelitian dilakukan di Laboratorium Mikroalga, Surfactant and Bioenergy Research Center (SBRC), Institut Pertanian Bogor, Bogor. Sampel Gelidium latifolium diperoleh dari perairan Ujung Kulon, Banten.
3.2 Alat dan Bahan
Alat yang digunakan dalam uji kadar karbohidrat Gelidiumlatifolium pada kultivasi menggunakan injeksi tersaji pada Tabel 1.
Tabel 1. Alat-alat uji kadar karbohidrat Gelidium latifolium
No. Nama Alat Keterangan 1. Alat hidrolisis Temperatur 300°C 2. Neraca analitik Kapasitas 2.000 gram
3. Selang aerasi Diameter 5 mm Warna bening
4. Tali nilon Panjang 25 cm 30 buah
5. Karet kaca 30 buah
6. Pompa aerator Resun LP-60 air pump
7. Batu aerasi 15 buah
8. Mixing chamber Diameter 20 cm, tinggi 38 cm Bentuk tabung 9. Tabung Regulator Morris 101-25 FL
10. Kompresor Viva air compressor E25 2248 US Model SP-204
11. Flow meter Dwayer RMA-12-SSV Satuan cc/menit
12. Batu aerasi 9 buah
13. Neraca digital ACIS-AD-2100H Kapasitas 2.000 gr 14. Refraktometer ATAGO S/Mill-E Salinitas 0-100‰
15. pH meter HANNA instrument
16. Termometer Satuan ⁰C
17. Gelas ukur Volume 250 mL 3 buah
18. Gelas erlemeyer Volume 1000 mL 1 buah
19. Sirink Volume 3 mL 1 buah
20. Orsat Apparatus Pelarut KOH
21. Kantong Dimensi 20x28 cm 6 buah
22. Alat pemotong Gunting dan cutter
Beberapa alat yang digunakan dalam penelitian tersaji pada Gambar 3.
(a) (b) (c)
(d) (e) (f)
(g) (h) (i)
4. Aquades 5. NaOH 30%
6. Luff school 25 mL
7. Larutan KI 20% 10 mL
8. Larutan 25% 25 mL
9. Larutan Na-tiosulfat 0.1 N
10. Indikator kanji 0,5% 5 tetes
Bahan yang digunakan dalam penelitian laju pertumbuhan biomassa
Gelidiumlatifolium pada kultivasi menggunakan injeksi tersaji pada Tabel 4. Tabel 4. Bahan-bahan penelitian laju pertumbuhan Gelidium latifolium
No. Nama Bahan Spesifikasi Keterangan
1. Gelidium latifolium ± 3 gram 30 ikat
2. Air laut 8 liter /akuarium 15 akuarium
3. 0,1262 gram Penentu normalitas NaOH
4. Nutrien TSP, ZA,Urea 15 ppm, 30 ppm, 30 ppm
5. Murni dan campuran 4 bar
6. NaOH 0,8 gram 0,02 N
Beberapa bahan yang digunakan dalam penelitian tersaji pada Gambar 4.
(a) (b) (c)
Gambar 4. Bahan penelitian; (a) Gelidium latifolium (b) NaOH dan PP (c) Nutrien
3.3 Metode Penelitian
Penelitian ini diawali dengan melakukan persiapan media kultivasi dan bibit makroalga. Tahapan kedua adalah pemeliharaan makroalga dalam akuarium kultivasi serta diberikan perlakuan injeksi dengan jumlah yang berbeda-beda. Tahapan ketiga adalah analisis konsentrasi terlarut dan sisa dari sampel air media kultivasi serta kualitas air, yaitu temperatur, salinitas, dan derajat derajat keasaman. Tahapan keempat adalah mengukur laju pertumbuhan biomassa
Gelidium latifolium diukur dari data pertumbuhan bobot. Tahapan terakhir adalah pengujian kadar karbohidrat biomassa sebelum dan sesudah kultivasi.
3.3.1 Persiapan media kultivasi dan bibit
akuarium diletakan di ruangan yang temperaturnya distabilkan , yaitu pada ruangan AC dengan temperatur 23 ⁰C.
Setelah media kultivasi disiapkan, selanjutnya menyiapkan bibit
makroalga Gelidium latifolium. Bibit tidak langsung diberikan perlakuan namun diaklimatisasi terlebih dahulu selama 1-3 hari. Aklimatisasi merupakan proses penyesuaian sampel sebelum diberikan perlakuan tertentu. Hal ini bertujuan agar sampel tidak stress dan bisa hidup di lingkungan ex-situ dengan baik. Sampel
Gelidium latifolium dicuci untuk menghilangkan substrat lumpur dan parasir. Selain itu, alga asosiasi yang menempel dibersihkan agar tidak menghambat pertumbuhan sampel.
makroalga masing-masing 3 gram, sehingga dibutuhkan 30 ikat makroalga. Media dan bibit makroalga Gelidium latifolium pada saat kultivasi disajikan pada Gambar 5.
Gambar 5. Akuarium dan bibit Gelidium latifolium
3.3.2 Kultivasi dengan injeksi
Kultivasi Gelidium latifolium dilakukan selama 6 minggu di lingkungan yang terkontrol yaitu pada akuarium berisi air laut yang diganti selama 2 minggu sekali. Penggantian air bertujuan untuk menjaga kualitas air karena akuarium tidak menggunakan sistem resirkulasi atau filter. Pertumbuhan makroalga memerlukan nutrien sehingga dilakukan pemberian nutrien selama kultivasi sebanyak 3 kali dalam 2 minggu. Setiap akuarium mendapatkan jumlah nutrien yang sama. Nutrien yang diberikan adalah TSP, urea dan ZA. Tabel 5.
berfotosintesis. Cahaya membantu makroalga menguraikan O menjadi dan dalam reaksi fotolisis yang terjadi di dalam grana. Ion ditangkap oleh
untuk menghasilkan biomassa tubuh makroalga berupa pertumbuhan
thallus. Karbondioksida digunakan sebagai bahan pokok dalam penelitian ini, dengan melihat pengaruh penambahan karbondioksida atau injeksi dengan volume yang berbeda-beda terhadap laju pertumbuhan Gelidium latifolium.
Penelitian ini dilakukan dengan menggunakan 1 kontrol serta 4 perlakuan dan 3 kali ulangan. Adapun kelima perlakuan tersebut adalah sebagai berikut:
1. Kontrol yaitu dengan hanya diberikan aerasi terus-menerus.
2. Perlakuan P1 dengan injeksi sebanyak 2.000 cc (200 cc x 10 menit per 3 hari) dan aerasi.
3. Perlakuan P2 dengan injeksi sebanyak 3.000 cc (200 cc x 15 menit per 3 hari) dan aerasi.
4. Perlakuan P3 dengan injeksi sebanyak2.000 cc (200 cc x 10 menit per 3 hari) tanpa aerasi.
Injeksi sebagai sumber karbon berasal dari murni dan gas kompresor dengan tekanan masing-masing sebesar 2 bar. Kedua sumber gas tersebut digabungkan pada sebuah tabung pencampur yaitu mixing chamber. Keluaran dari mixing chamber sebesar 2x100 cc/menit yang dialirkan ke dalam akuarium menggunakan selang aerasi berdiameter 5 mm. Akuarium ditutup dengan menggunakan styrofoam untuk mencegah terjadinya difusi gas yang tidak dikehendaki. Pengukuran sisa dilakukan pada perlakuan P3 dan P4. Karbondioksida pada kedua perlakuan tersebut ditampung menggunakan kantong yang dipasang bersamaan saat awal injeksi dan diukur
menjelang sore hari. Proses injeksi ke dalam akuarium kultivasi tersaji pada Gambar 6.
Gambar 7. Metode pengukuran terlarut
Keadaan asam akan ditunjukkan apabila air sampel tidak mengalami perubahan warna saat ditetesi indikator PP. Titrasi dilakukan sampai warna air sampel berubah menjadi merah muda selama 30 detik.
NaOH 0,8 gram
Dilarutkan dengan 1 Liter aquades
Standarisasi oleh larutan
Didapat normalitas NaOH (0,02 N)
Indikator pp 4 tetes Sampel air 25 mL
Perhitungan konsentrasi terlarut menggunakan rumus (Boyd, 1982) :
………. (7)
Keterangan :
= konsentrasi terlarut (mg/L) mL titran = volume NaOH (mL) N titran = normalitas NaOH (0,02 N)
Jumlah yang tersisa pada perlakuan P3 dan P4 dapat diketahui mengacu pada jumlah gas yang tertampung pada kantong , yang kemudian diukur menggunakan Orsat Apparatus. Gambar 8. menunjukkan bagian-bagian dari alat Orsat Apparatus yang berfungsi untuk mengukur sisa
Gambar 8. Bagian-bagian Orsat Apparatus
Orsat Apparatus memiliki tiga tabung dengan masing-masing fungsi berbeda. Perbedaan fungsi disebabkan oleh jenis larutan yang terdapat di
dengan cara membukakan keran H.
3. Ambil gas buangan ( ) dari saluran gas buangan untuk diukur, salurkan melalui selang yang dimasukan ke dalam pipa H.
4. Buka kran H sehingga gas buangan akan masuk dan mengakibatkan tinggi air yang ada di tabung ukur C akan berkurang.
5. Setelah tinggi air pada tabung ukur turun sebanyak 50 mL (mencapai angka 0) tutup kran H dan artinya sudah memasukan volume gas sebanyak 50 mL.
6. Untuk mengukur kandungan buka kran C supaya gas buangan bereaksi dengan larutan pada tabung III, yaitu KOH dengan menaik-turunkan gelas B sebanyak 5 - 7 kali.
7. Setelah 5 - 7 kali, kembalikan posisi larutan III ke posisi acuan pada set awal dan tutup kran C setelah didapatkan posisi yang diinginkan.
3.3.4 Pengukuran parameter kualitas air
Pengukuran parameter kualitas air dilakukan setiap 3 hari sekali bersamaan dengan pemberian . Parameter yang diukur adalah temperatur, salinitas, dan derajat keasaman (pH). Temperatur diukur menggunakan
termometer Celcius. Salinitas diukur menggunakan refraktometer dengan satuan permil (‰). Derajat derajat keasaman (pH) diukur menggunakan pH meter digital. Pengukuran kualitas air biasanya dilakukan setelah jam tiga sore dengan
memperhitungkan aktivitas fotosistesis yang dilakukan oleh makroalga.
3.3.5 Pengukuran laju pertumbuhan biomassa
Pengukuran laju pertumbuhan biomassa harian makroalga yang dikultivasi dihitung berdasarkan rumus (Dawes et al., 1993) :
………… (8)
Laju pertumbuhan relatif dihitung dengan rumus : ……….….. (9)
Keterangan :
DGR = laju pertumbuhan harian makroalga (%) per hari RGR = laju pertumbuhan relatif makroalga (%)
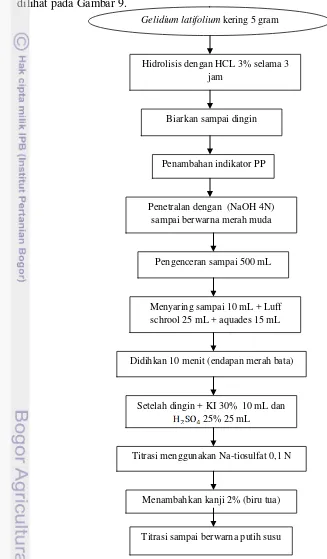
Gambar 9. Proses uji kadar karbohidrat Gelidium latifolium
Biarkan sampai dingin
Penetralan dengan (NaOH 4N) sampai berwarna merah muda
Didihkan 10 menit (endapan merah bata) Penambahan indikator PP
Menambahkan kanji 2% (biru tua) Setelah dingin + KI 30% 10 mL dan
25% 25 mL
Titrasi menggunakan Na-tiosulfat 0,1 N Pengenceran sampai 500 mL
Menyaring sampai 10 mL + Luff schrool 25 mL + aquades 15 mL
Uji karbohidrat di atas adalah metode yang resmi ditetapkan oleh BSN dalam SNI 01-2891-1992 yaitu analisis total karbohidrat dengan menggunakan metode Luff Schrool.
3.5 Analisis Data
Penelitian ini menggunakan model Rancangan Acak Lengkap dengan lima perlakuan dan enam kelompok. Data dianalisis secara statistik menggunakan Analisis Ragam (ANOVA) pada selang kepercayaan 95%. ANOVA adalah teknik analisis statistik yang dapat memberikan jawaban atas ada tidaknya skor pada masing-masing kelompok, dengan suatu resiko kesalahan sekecil mungkin (Irianto, 2004). Menurut Mattjik dan Sumertajaya (2002) persamaan Rancangan Acak Kelompok adalah sebagai berikut :
μ + + + ………. (10)
Keterangan:
= perlakuan injeksi (ke-i) dan kelompok minggu (ke-j) μ = nilai tengah umum
= pengaruh akibat perlakuan injeksi (ke-i) = pengaruh kelompok minggu (ke-j)
= kesalahan perlakuan percobaan pada perlakuan jenis bahan organik (ke-i) dan ulangan (ke-j)
Untuk melihat pengaruh perbedaan perlakuan terhadap laju pertumbuhan
34 4.1 Bobot Basah Gelidium latifolium
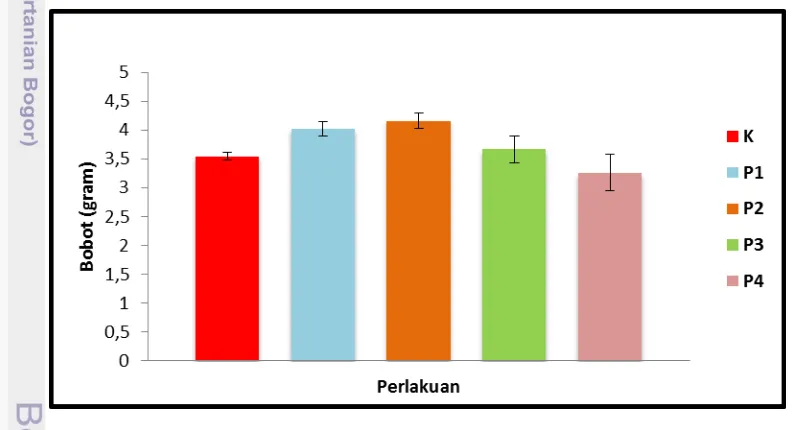
Penelitian menunjukkan bahwa pertambahan bobot basah rata-rata setiap ulangan pada kultivasi Gelidium latifolium dari perlakuan yang berbeda memiliki hasil beragam. Pertambahan bobot basah paling tinggi ditunjukkan oleh kultivasi P2 yaitu injeksi sebanyak 3.000 cc (200 cc x 15 menit per 3 hari) dan aerasi, sedangkan yang paling rendah adalah kultivasi P4 yaitu injeksi sebanyak 3.000 cc (200 cc x 15 menit per 3 hari) tanpa aerasi (Lampiran 1). Pertambahan bobot basah rata-rata memengaruhi bobot basah pada akhir periode kultivasi. Hasilnya dapat dilihat pada Gambar 10.
Gambar 10. Bobot basah rata-rata dan simpangan baku pada akhir kultivasi
Gelidium latifolium
Keterangan :
TSP, ZA, dan urea. Penyerapan zat hara dilakukan oleh seluruh bagian tubuh dibantu oleh sirkulasi yang baik yaitu gerakan air. Sistem sirkulasi perlakuan K, P1, dan P2 menjadikan pertumbuhan Gelidium latifolium lebih baik daripada P3 dan P4. Hal ini sesuai dengan pernyataan Indriani dan Sumiarsih (1991) bahwa gerakan air berfungsi untuk memudahkan penyerapan zat hara, membersihkan kotoran yang ada, dan melangsungkan pertukaran dan dalam air.
Injeksi ditambah aerasi lebih efektif meningkatkan pertambahan bobot basah Gelidium latifolium yang dikultivasi. Besar kecepatan yang diinjeksikan seragam sebesar 200 cc/menit didasarkan pada penelitian sebelumnya yang dilakukan oleh Barat (2011) dengan menggunakan kecepatan 500 cc/menit. Kecepatan yang digunakan pada penelitian ini diturunkan dari kecepatan
penelitian sebelumnya, hal ini bertujuan untuk tetap menjaga derajat keasaman dari media air laut, karena volume air yang digunakan lebih sedikit.
Aerasi menimbulkan gelembung-gelembung udara di dalam air dan menyebabkan pergerakan serta sistem sirkulasi di dalamnya. Penggunaan batu aerasi membantu memecah gelembung udara agar difusi di dalam air berlangsung lebih cepat dan terserap sempurna oleh makroalga. Lama injeksi pun
sebanyak 200 cc/menit selama 15 menit (P2) hari lebih efektif daripada injeksi sebanyak 200 cc/menit selama 10 menit (P1). Namun terjadi sebaliknya pada perlakuan yang tidak diaerasi, injeksi sebanyak 200 cc/menit selama 10 menit (P3) lebih efektif daripada injeksi sebanyak 200 cc/menit selama 15 menit (P4). Perlakuan K sebagai kontrol hanya mendapatkan aerasi saja, sehingga pertambahan bobotnya lebih lambat daripada perlakuan yang ditambahkan injeksi
(P1, P2 dan P3). Hal ini tidak berlaku untuk P4 karena mengalami
penurunan selisih bobot basah rata-rata pada awal kultivasi. Selisih pertambahan bobot basah rata-rata Gelidium latifolium tersaji pada Gambar 11.
Gambar 11. Selisih pertambahan bobot basah rata-rata dan simpangan baku
Gelidium latifolium
Keterangan :
2.000 cc (200 cc x 10 menit per 3 hari) tanpa aerasi mengalami penurunan yang signifikan di akhir pemeliharaan yaitu setelah minggu ke-4. Hal ini berbeda dengan perlakuan P4 yang mengalami penurunan sejak minggu ke-2. Penurunan ini diakibatkan oleh pelunakan bagian thallus sehingga mengurangi bobot basah
Gelidium latifolium yang dikultivasi. Bagian thallus yang melunak dipotong agar tidak memengaruhi pertumbuhan bagian yang lainnya.
Selisih tertinggi terjadi pada kultivasi P2 di minggu ke-4 sebesar
0,2383±0,11gram, sedangkan selisih pertumbuhan negatif terjadi pada kultivasi P4 di minggu ke-2 sebesar -0,0933±0,37 gram dan kultivasi P3 di minggu ke-6 sebesar 0,0017±0,08 gram (Lampiran 3).
4.2 Laju Pertumbuhan Gelidium latifolium
Laju pertumbuhan Gelidium latifolium untuk setiap perlakuan bervariasi baik laju pertumbuhan hariannya maupun laju pertumbuhan relatifnya, ekuivalen dengan pertambahan bobot rata-ratanya. Kultivasi berlangsung selama 42 hari dan pengukuran laju pertumbuhan dilakukan setiap satu minggu sekali.
Sumiarsih (1999) dan pemanenan dapat dilakukan setelah 6 minggu yaitu saat tanaman dianggap cukup matang dengan kandungan polisakarida maksimum Mukti (1987).
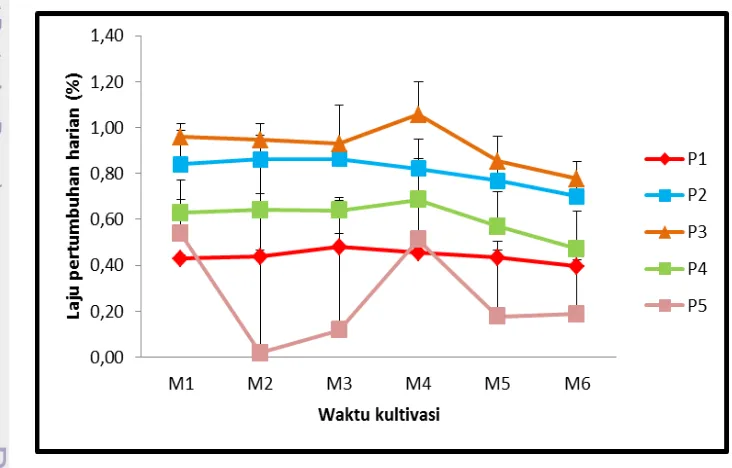
Besarnya nilai laju pertumbuhan harian Gelidium latifolium selama penelitian berkisar antara 0,02-1,06%. Perbedaan laju pertumbuhan harian ini disebabkan oleh perbedaan respon makroalga terhadap perlakuan yang diberikan. Pemberian karbondioksida atau injeksi pada jumlah yang berbeda
memberikan pengaruh yang berbeda pada lingkungan hidupnya. Berikut adalah grafik laju pertumbuhan harian Gelidium latifolium selama kultivasi 42 hari pada perlakuan yang berbeda hari tersaji pada Gambar 12.
Gambar 12. Laju pertumbuhan harian dan simpangan baku Gelidium latifolium Keterangan :
terjadi pada P3 dengan besarnya injeksi sebanyak 2.000 cc, namun tidak sebesar penurunan pH pada P4. Hal ini berbeda dengan P1 dan P2, penurunan pH dapat dinormalkan kembali oleh proses aerasi yang memicu terjadinya resirkulasi (Lampiran 10). Laju pertumbuhan harian selama kultivasi 42 hari dapat
diregresikan untuk mengetahui pertumbuhan pada hari-hari selanjutnya. Berikut adalah persamaaan regresi laju pertumbuhan harian control dan perlakuan yang berbeda Gelidium latifolium.
Tabel 6. Persamaan regresi linear laju pertumbuhan harian Gelidium latifoloum
Kontrol x = 0.463 - 0.000659 t
Perlakuan 1 x = 0.913 - 0.00401 t Perlakuan 2 x = 1.02 - 0.00486 t Perlakuan 3 x = 0.698 - 0.00404 t Perlakuan 4 x = 0.322 - 0.00502 t
juga mengalami penurunan karena pada minggu tersebut pertumbuhan telah mengalami fase stasioner (Lampiran 4). Laju pertumbuhan harian menunjukkan persentase perbandingan antara bobot saat akhir kultivasi dan bobot saat awal penanaman per satuan waktu.
Selain faktor derajat keasaman, salinitas pun memengaruhi laju
pertumbuhan Gelidium latifolium. Nilai salinitas tidak hanya berpengaruh pada pertumbuhan makroalga, tapi juga memicu organisme lain untuk tumbuh baik pada lingkungan tersebut. Salah satunya adalah fungi Rhizopus sp. yang
menempel pada thallusGelidium latifolium. Fungi ini menyebabkan penurunan laju pertumbuhan harian kulivasi P4 pada minggu ke-2 dan P3 pada minggu ke-6. Organisme mikro lainnya seperti mikroalga, tumbuh pada akuarium sehingga tampak seperti warna hijau di dinding-dinding akuarim.
Metode kultivasi monoline floating efektif untuk pemeliharaan Gelidium latifolium selama penelitian. Hal ini sesuai dengan pernyataan Aslan (1998) bahwa tingkat pertumbuhan makroalga dengan metode apung adalah sekitar 2,00-3,00%, metode lepas dasar sekitar 1,66-1,75%, dan metode dasar sekitar 0,30-0,53%. Menurut Soegiarto et al. (1978) kisaran laju pertumbuhan makroalga yang baik adalah antara 2-3%. Kultivasi pada setiap perlakuan dalam penelitian belum termasuk pada kategori baik karena laju pertumbuhannya kurang dari 2% sampai akhir pemeliharaannya.
Gambar 13. Laju pertumbuhan relatif Gelidium latifolium Keterangan :
K = kontrol yaitu dengan hanya diberikan aerasi terus-menerus. P1 = injeksi 2.000 cc (200 cc x 10 menit per 3 hari) dan aerasi. P2 = injeksi 3.000 cc (200 cc x 15 menit per 3 hari) dan diaerasi. P3 = injeksi 2.000 cc (200 cc x 10 menit per 3 hari) tanpa aerasi. P4 = injeksi 3.000 cc (200 cc x 15 menit per 3 hari) tanpa aerasi.
Besar laju pertumbuhan relatif Gelidium latifolium di akhir kultivasi pada setiap perlakuan yang berbeda dari yang paling tinggi sampai yang paling rendah adalah P2 sebesar 32,66%, P1 sebesar 29,43%, P3 sebesar 19,82%, K sebesar 16,64%, dan P4 sebesar 7,91% (Lampiran 5). Laju pertumbuhan relatif
menunjukkan hubungan presentase bobot saat akhir kultivasi dan bobot saat awal penanaman.
Hasil analisis secara statistik dengan selang kepercayaan 95%,
latifolium, ketiganya masing-masing memiliki variasi ragam d, e, dan c.
Perlakuan P4 yaitu injeksi sebanyak 3.000 cc (200 cc x 15 menit per 3 hari) tanpa aerasi memiliki nilai variasi ragam a (Lampiran 8).
Nilai variasi ragam c sampai e merupakam jarak peringkat antara satu nilai rata-rata dengan rata-rata lainnya setelah diurutkan. Nilai variasi ragam e
memiliki nilai rata-rata laju pertumbuhan bobot yang paling tinggi, sedangkan nilai variasi ragam a memiliki nilai rata-rata laju pertumbuhan bobot yang paling rendah. Perlakuan K sebagai kontrol berada pada peringkat b artinya perlakuan P1, P2, dan P3 memiliki besar nilai rata-rata laju pertumbuhan bobot lebih tinggi dari perlakuan kontrol sedangkan perlakuan P4 memiliki besar nilai rata-rata laju pertumbuhan bobot lebih rendah.
Selain pengujian berdasarkan perlakuan, dilakukan juga analisis statistik berdasarkan waktu kultivasi makroalga. Hasilnya menunjukkan bahwa pengaruh lamanya hari tidak berbeda nyata terhadap laju perlumbuhan Gelidium latifolium
sehingga tidak diperlukan uji lanjut untuk melihat variasi nilai ragamnya.
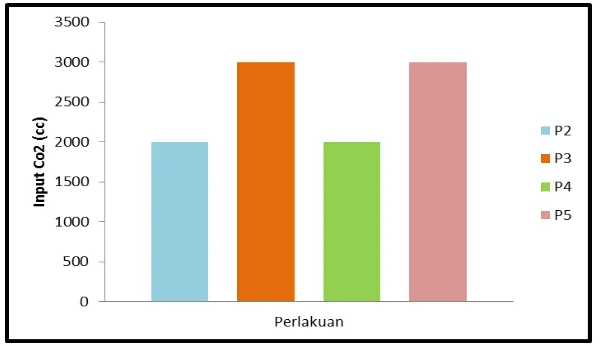
Gambar 14. Input pada kultivasi Gelidium latifolium Keterangan :
K = tidak mendapatkan injeksi
P1 = injeksi 2.000 cc (200 cc x 10 menit per 3 hari) dan aerasi. P2 = injeksi 3.000 cc (200 cc x 15 menit per 3 hari) dan diaerasi. P3 = injeksi 2.000 cc (200 cc x 10 menit per 3 hari) tanpa aerasi. P4 = injeksi 3.000 cc (200 cc x 15 menit per 3 hari) tanpa aerasi.
Karbondioksida ( ) merupakan molekul gas yang bisa larut dalam air laut. Karbondioksida berikatan dengan air membentuk senyawa anorganik yaitu asam karbonat yang akan terurai menjadi ion bikarbonat. Semakin banyak yang masuk ke dalam air, jumlah asam pun meningkat. Penelitian yang
dilakukan merupakan salah satu aplikasi dari pemanfaatan karbondioksida terlarut yakni memanfaatkan yang berasal dari injeksi untuk pertumbuhan biomassa Gelidium latifolium. Penelitian ini didukung oleh teori Aresta (2010) bahwa pemanfaatan gas karbondioksida dapat dijadikan sebagai teknologi
renewable yakni pengonversian karbon menjadi biomassa tumbuhan akuatik atau terestrial.
disebabkan oleh pemberian aerasi pada perlakuan P1 dan P2, sedangkan P3 dan P4 tidak dilakukan pemberian aerasi. Perbedaan perlakuan ini dimaksudkan untuk melihat pengaruh jumlah gas yang diinjeksi terhadap kualitas air dan respon pertumbuhan Gelidium latifolium.
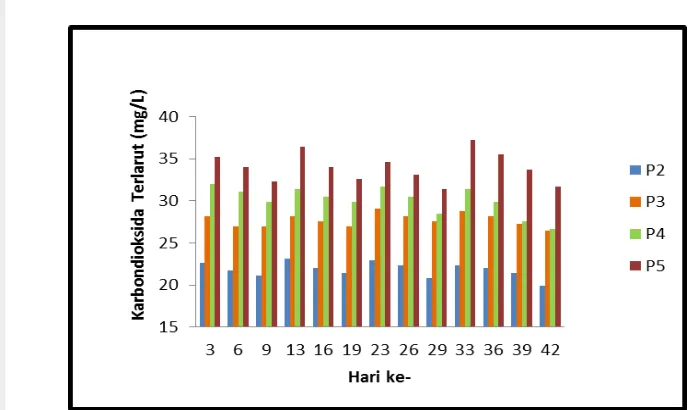
Aerator memberikan masukan gelembung-gelembung udara pada air laut sehingga terjadi sirkulasi dan pergerakan air pada akuarium. Sirkulasi dan pergerakan air memengaruhi jumlah kelarutan gas yang diinjeksikan ke dalam air laut. Diagram berikut menunjukkan bahwa terlarut harian pada setiap perlakuan nilainya berfluktuasi.
Gambar 15. Jumlah terlarut harian pada kultivasi Gelidium latifolium Keterangan:
K = tidak bisa diukur menggunakan titrasi NaOH karena keadaan basa. P1 = injeksi 2.000 cc (200 cc x 10 menit per 3 hari) dan aerasi. P2 = injeksi 3.000 cc (200 cc x 15 menit per 3 hari) dan diaerasi. P3 = injeksi 2.000 cc (200 cc x 10 menit per 3 hari) tanpa aerasi. P4 = injeksi 3.000 cc (200 cc x 15 menit per 3 hari) tanpa aerasi.
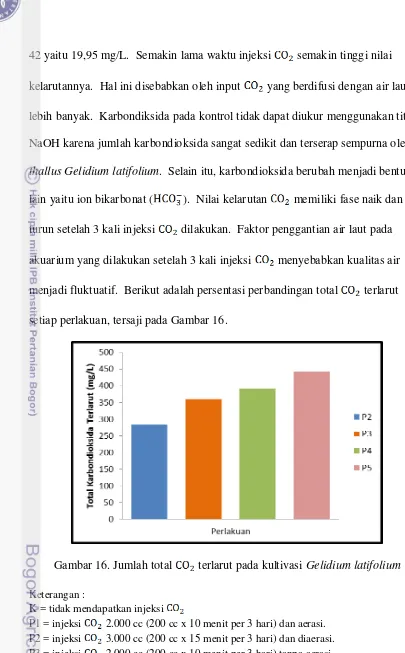
ke-turun setelah 3 kali injeksi dilakukan. Faktor penggantian air laut pada akuarium yang dilakukan setelah 3 kali injeksi menyebabkan kualitas air menjadi fluktuatif. Berikut adalah persentasi perbandingan total terlarut setiap perlakuan, tersaji pada Gambar 16.
Gambar 16. Jumlah total terlarut pada kultivasi Gelidium latifolium Keterangan :
K = tidak mendapatkan injeksi
Nilai tertinggi total terlarut dalam air laut adalah pada perlakuan P4 yaitu injeksi selama 15 menit tanpa aerasi dan paling rendah adalah pada perlakuan P1 yaitu injeksi selama 10 menit dan aerasi. Nilainya total terlarut secara berurutan setiap perlakuan dari yang tertinggi sampai terendah adalah P4 441,76 mg/L, P3 391,01 mg/L, P2 360,21 mg/L, dan P1 283,65 mg/L (Lampiran 6).
Menurut Effendi (2003) salah satu faktor yang memengaruhi kelarutan adalah tekanan parsial. Tekanan parsial akan berkurang akibat adanya kegiatan fotosintesis dan pemanasan. Kemampuan fotosintesis individu makroalga yang berbeda-beda serta pemanasan pada siang hari menjadi penyebab variasi nilai pada setiap perlakuan.
Pengukuran kelarutan dilakukan pada sore hari karena pada waktu tersebut cahaya mulai redup. Fotosintesis memerlukan cahaya matahari untuk mengeksitasi elektron yang terdapat pada klorofil sehingga keadaan elektron dalam klorofil menjadi tidak stabil dan mendesak molekul air terpecah menjadi
dan . Ion berperan dalam pembentukan menjadi glukosa melewati reaksi terang. Oleh karena itu, pada saat cahaya mulai meredup efektivitas fotosintesis menurun sehingga dilakukan pengukuran sisa.
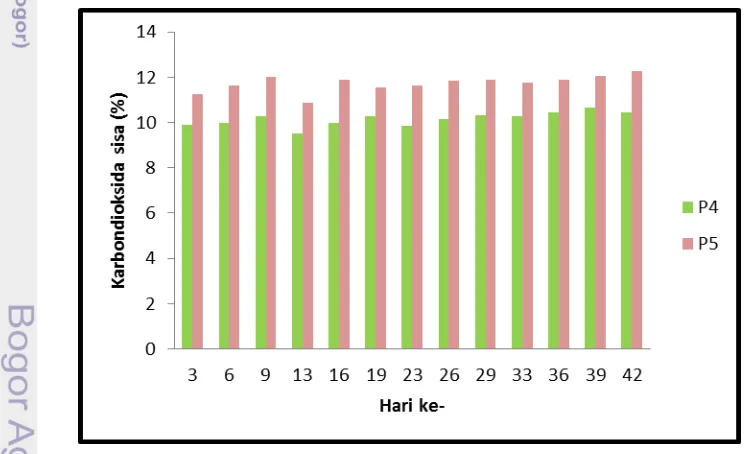
tidak terjadi pertukaran dengan gas lainnya yang berada di luar akuarium. Penampungan gas dilakukan setelah selesai injeksi yaitu pukul 10.00, kemudian pengukuran dilakukan pada sore hari bersamaan dengan pengukuran kualitas air. Jumlah sisa harian setiap pemberian injeksi berfluktuasi, namun perlakuan P4 selalu mendominasi P3. Berikut adalah nilai sisa harian yang terukur oleh
Orsat Apparatus tersaji pada Gambar 17.
Gambar 17. Sisa hasil pengukuran Orsat Apparatus
Keterangan :
Nilai sisa harian paling tinggi terjadi pada perlakuan P4 pada hari ke-42 yaitu 12,27%, sedangkan yang paling rendah pada perlakuan P3 hari ke-13 yaitu 9,53%. Rata-rata sisa tersisa dari perlakuan P3 sebesar 10,16% dan P4 sebesar 11,73%. Volume air laut sebanyak 8 liter dan injeksi sebanyak 2x100 cc/menit memengaruhi kesetimbangan karbondioksida dalam air laut. Hal ini sesuai dengan Teori Boyd (1988) yang mengategorikan kelarutan di perairan bahwa pada temperatur 25-27 °C berkisar antara 0,45-0,48 mg/L. Besarnya nilai temperatur berkebalikan dengan nilai kelarutan karbondioksida.
4.4 Kualitas Air
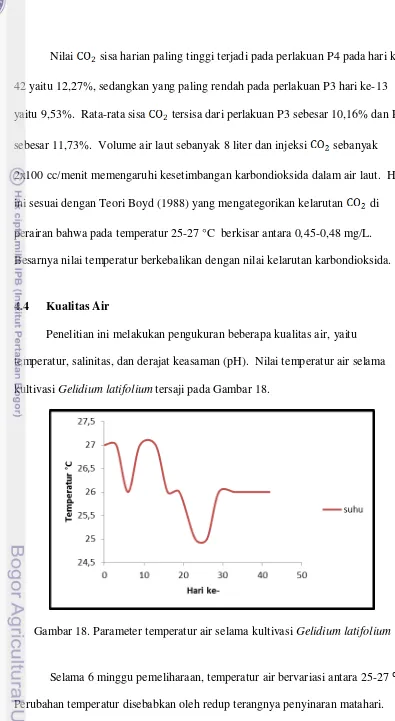
Penelitian ini melakukan pengukuran beberapa kualitas air, yaitu temperatur, salinitas, dan derajat keasaman (pH). Nilai temperatur air selama kultivasi Gelidium latifolium tersaji pada Gambar 18.
Gambar 18. Parameter temperatur air selama kultivasi Gelidium latifolium
tumbuh dengan baik jika rentang temperaturnya luas. Tunas thallus mengalami pemberhentian pertumbuhan dikarenakan perubahan temperatur yang fluktuatif. Temperatur juga memengaruhi kelembaban udara di sekitar lingkungan tempat kultivasi. Kelembaban yang tinggi juga tidak begitu bagus untuk pertumbuhan
Gelidium latifolium saat kultivasi.
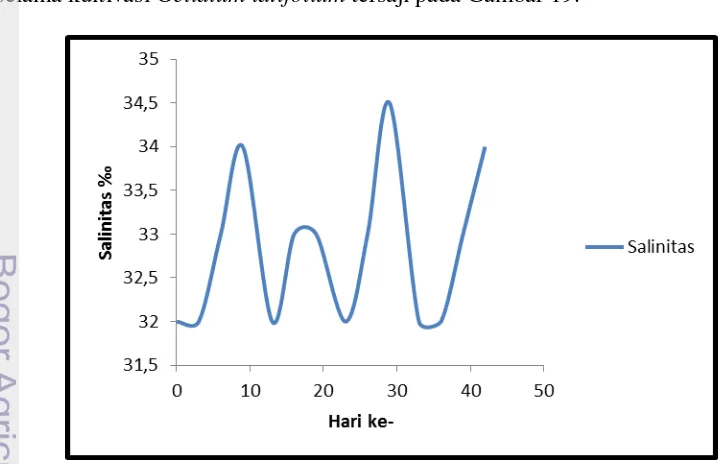
Parameter kualitas air yang diukur selanjutnya adalah salinitas. Nilai salinitas semua perlakuan besarnya sama di setiap pengukuran. Nilai salinitas air selama kultivasi Gelidium latifolium tersaji pada Gambar 19.
Salinitas yang dianjurkan untuk makroalga adalah salinitas pada kisaran 28-34 ppt (Zatnika dan Angkasa, 1994). Menurut Dawes (1981) kisaran salinitas yang baik untuk budidaya makroalga berkisar 30-35 ppt. Soegiarto et al. (1978) pun berpendapat bahwa salinitas yang cocok untuk budidaya makroalga adalah 32-35 ppt. Salinitas air pada penelitian yang dilakukan berkisar antara 32-34‰. Nilai ini masih berada dalam kisaran salinitas yang dianjurkan. Nilai salinitas tersebut relatif tinggi disebabkan oleh tingkat penguapan air dalam akuarium yang cukup tinggi, sehingga dilakukan penambahan air tawar. Penguapan ditandai adanya butiran garam pada dinding akuarium. Menurut Aslan (1998) Gelidium
yang hidup di perairan Indonesia adalah jenis yang yang menyukai salinitas tinggi yaitu 33‰.
Parameter kualitas air yang diukur adalah derajat keasaman (pH). Derajat keasaman yang ideal untuk pertumbuhan makroalga yaitu 8-9. Apabila perairan terlalu asam ataupun terlalu basa maka akan menghambat pertumbuhan
Gambar 20. Parameter derajat keasaman air selama kultivasi Gelidium latifolium
Perlakuan berpengaruh terhadap nilai pH, semakin lama injeksi
4.5 Isolasi Fungi Penghambat Pertumbuhan
Faktor biologi yang memengaruhi penurunan pertumbuhan Gelidium latifolium adalah fungi. Fungi menempel pada thallus menyebabkan bagian
thallus menjadi lunak dan berlendir. Berikut ini adalah gambar makroalga yang terserang oleh fungi pada saat kultivasi (Gambar 21).
Gambar 21. Makroalga yang terserang fungi
Fungi pada thallus diisolasi pada media PDA (Potato Dextrose Agar) berbahan dasar kentang untuk mengetahui jenis fungi yang menghambat pertumbuhan. Fungi disimpan pada media tersebut selama satu minggu di dry cabinet sampai terlihat jelas koloni dan hifanya. Berikut adalah gambar fungi hasil isolasi dari Gelidium latifolium (Gambar 22).
(a) (b)
Gambar 22. Rhizopus sp.; (a) Pengamatan K.Nishimura dan (b) Hasil isolasi pada media PDA
Sumber: K. Nishimura 1999 Sumber: Dokumentasi pribadi
Klasifikasi Rhizopus menurut Germain et al. (2006), yaitu
Koloni Rhizopus sp. berwarna putih berangsur-angsur menjadi abu-abu serta sporangia globus atau sub globus berwarna coklat gelap sampai hitam bila telah masak. Sporangiofor tumbuh dari stolon dan mengarah ke udara, tumbuh berlawanan dan terletak pada posisi yang sama dengan sporangiofora, Bentuk spora bulat, oval atau berbentuk elips atau silinder.
Menurut Sorenson dan Hesseltine (1986), Rhizopus sp. tumbuh baik pada kisaran pH 3,4-6 dan membutuhkan air untuk pertumbuhannya, tetapi kebutuhan air fungi lebih sedikit dibandingkan dengan bakteri. Hal ini selaras dengan hasil pengamatan yang dilakukan, Rhizopus sp. tumbuh pada thallus makroalga perlakuan P4. Pada perlakuan P4 kualitas airnya lebih asam dibandingkan perlakuan lainnya akibat lama injeksi dan tidak ditambahkannya aerasi.
thallus. Thallus mengalami perubahan fisik terutama tekstur yang semakin lunak karena terjadi degradasi kadar selulosa (Hidayat et al., 2006).
4.6 Kadar Karbohidrat Gelidium latifolium
Berbagai jenis Gelidium di Indonesia dan negara lain dimanfaatkan sebagai bahan baku pabrik agar-agar. Kandungan agarnya berkisar antara 12-48%
tergantung jenisnya, sedangkan kandungan agarnya di Indonesia (Sulawesi) mencapai 30% (Aslan, 1998). Menurut Rasyid et al. (1999) Gelidium sp. memiliki kandungan agar 26,5%. Hasil uji kadar karbohidrat yang dilakukan dalam penelitian berkisar antara 16,40-20,40%.
Kadar karbohidrat yang diuji adalah jenis monosakarida yaitu glukosa dan dihasilkan dari hidrolisis pati (amilum). Penentuan kadar karbohidrat kuantitatif dilakukan melaui metode Luff Schrool dengan prinsip dasarnya adalah hidrolisis karbohidrat dalam Gelidium latifolium kering menjadi monosakarida yang dapat mereduksi menjadi (SNI 01-2891-1992).
Tahapan reaksi yang terjadi adalah :
R-COH + CuO Cu + R-COOH
+ CuO Cu + O
Cu + 2KI Cu +
2Cu +
+ NaI
Kadar karbohidrat pada perlakuan P3 dan P4 merupakan kadar paling kecil dibandingkan yang lainnya. Nilai ini terjadi diperkirakan karena pada P3 dan P4 tumbuh fungi yang memfermentasi sakarida dari bagian thallus makroalga. Menurut Sudarmaji dan Markakis (1977), selama proses fermentasi akan terjadi perubahan pada kadar air setelah 24 jam fermentasi, kadar air akan mengalami penurunan menjadi sekitar 61% dan setelah 40 jam fermentasi akan meningkat lagi menjadi 64%. Perubahan-perubahan lain yang terjadi selama fermentasi adalah berkurangnya kandungan oligosakarida penyebab flatulence. Penurunan tersebut akan terus berlangsung sampai fermentasi 72 jam.
Kadar karbohidrat sebelum kultivasi lebih rendah dari K, P1, dan P2, setelah kultivasi dikarenakan sampel yang uji sebelum kultivasi adalah bibit yang memiliki karakteristik thallus lebih muda daripada sampel yang telah dikultivasi. Setelah dikultivasi Gelidium latifolium telah mengalami proses metabolisme dan
Sebelum kultivasi - 18.23%
Sesudah kultivasi K 19.40%
P1 20.40%
P2 19.40%
P3 16.87%
katabolisme sehingga biomassa thallus lebih banyak mengandung karbohidrat hasil pemanfaatan energi cahaya melalui fotosintesis menjadi biomassa.
Pengaruh penambahan injeksi pada kultivasi terhadap jumlah C (karbon) organik adalah kaitannya dengan biomassa thallus yang dihasilkan. Karbondioksida merupakan sumber karbon anorganik yang dikonversi ke dalam karbon organik berupa karbohidrat. Apabila bahan baku karbon tersedia di
lingkungan secara mudah makan kegiatan fotosintesis yang memanfaatkan karbon anorganik akan berjalan dengan mudah, namun harus didukung dengan
57
sebesar 16,40%. Laju pertumbuhan harian Gelidium latifolium selama penelitian ini berkisar antara 0,02-1,06%. Laju pertumbuhan harian tertinggi dari semua perlakuan ditemukan pada P3 yaitu 1,06±0,14% di minggu ke-4, sedangkan yang terendah ditemukan pada P5 yaitu 0,02±0,85% di minggu ke-2. Pemberian
berpengaruh nyata terhadap laju pertumbuhan Gelidium latifolium. Nilai kelarutan dan sisanya dipengaruhi oleh faktor aerasi dan konsentrasi injeksi.
5.2 Saran
MENGGUNAKAN SISTEM INJEKSI
DEA FAUZIA LESTARI
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
Bogor, 21 November 2012
Gelidium latifolium on ��� Injection of Cultivation System. Supervised by MUJIZAT KAWAROE and ADRIANI SUNUDDIN.
Macro algae is a potential feedstock for bioethanol energy development. The species of macro algae are very diverse in nature so that need to explore and research about biological characteristic, such as biomass growth rate. This research analyzed the levels of carbohydrate yield and measure the biomass growth rate of Gelidium latifolium on carbon dioxide (CO2) injection as source of photosynthesis
The research was conducted at Laboratory of Microbiology, Surfactant and Bioenergy Research Center (SBRC) of Bogor Agricultural University, Baranangsiang, on February until July 2012. Macro algae Gelidium latifolium is taken from Ujung Kulon, Banten. Experimental design used is Randomized Block Design (RBD) and Duncan Test with some treatments, namely control, P1
injection of 2.000 cc (200 cc x 10 minutes per 3 days) and aeration, P2 injection of 3.000 cc (200 cc x 15 minutes per 3 days) and aeration, P3 injection of 2.000 cc (200 cc x 10 minutes per 3 days) without aeration, and P4 injection of 3.000 cc (200 cc x 15 minutes per 3 days) without aeration. Initial weight of the Gelidium latifolium cultivation samples are similar, 3 grams and time of cultivation is 42 days.
The results showed that the highest average wet weight at the end of cultivation is P2 (4.16 ± 0.14 gram), P1 (4.03 ± 0.12 gram), P3 (0.23 ± 3.66 gram), control (3.54 ± 0.06 gram), and P4 (40.23 ± 3.26 gram). The daily growth rate value of Gelidium latifolium during study ranged from 0.02 to 1.06%. The highest daily growth rate of all treatments occurred in P2 is 1.06 ± 0.14% at 4th week, while the lowest daily growth rate of all treatments occurred in P4 is 0.02 ± 0.85% in the 2nd week . The weight of P4 treatment macro algae decreased
reduksi karbon di atmosfer.
Penelitian ini dilaksanakan di Laboratorium Mikroalga Surfactant and Bioenergy Research Center (SBRC) kampus Institut Pertanian Bogor, Baranang Siang, Bogor pada bulan Februari sampai dengan Juli 2012. Makroalga yang digunakan adalah Gelidium latifolium yang diambil dari perairan Ujung Kulon, Banten.
Rancangan percobaan yang digunakan adalah Rancangan Acak Kelompok (RAK) dan Uji Lanjut Duncan dengan beberapa perlakuan, yaitu kontrol, P1 injeksi sebanyak 2.000 cc (200 cc x 10 menit per 3 hari) dan aerasi, P2 injeksi sebanyak 3.000 cc (200 cc x 15 menit per 3 hari) dan aerasi, P3 injeksi sebanyak 2.000 cc (200 cc x 10 menit per 3 hari) tanpa aerasi, dan P4 injeksi sebanyak 3.000 cc (200 cc x 15 menit per 3 hari) tanpa aerasi. Bobot awal dari sampel Gelidium latifolium yang dikultivasi diseragamkan yaitu seberat 3 gram dan waktu kultivasi selama 42 hari.
Hasil penelitian menunjukkan bahwa bobot basah rata-rata di akhir kultivasi yang dari paling tinggi adalah pada P2 sebesar 4,16±0,14 gram, P1 sebesar 4,03±0,12 gram, P3 sebesar 3,66±0,23 gram, kontrol sebesar 3,54±0,06 gram, dan P4 sebesar 3,26±0,23 gram Besarnya nilai laju pertumbuhan harian
Gelidium latifolium selama penelitian berkisar antara 0,02-1,06%. Laju pertumbuhan harian tertinggi dari semua perlakuan terjadi pada P2 yaitu 1,06±0,14% di minggu ke-4, sedangkan laju pertumbuhan harian terendah dari semua perlakuan terjadi pada P4 yaitu 0,02±0,85% di minggu ke-2. Besarnya nilai bobot makroalga perlakuan P4 mengalami penurunan drastis pada miggu ke-2 yang disebabkan oleh fungi yang tumbuh di sekitar thallus. Pemberian
berpengaruh nyata terhadap laju pertumbuhan Gelidium latifolium, sehingga dilakukan uji lanjut untuk menentukan perlakuan berbeda nyata terhadap laju pertumbuhannya pada selang kepercayaan 95%. Besar kadar karbohidrat sebelum kultivasi adalah 18,23%, setelah kultivasi kadar karbohidrat kontrol sebesar 19,40%, P1 sebesar 20,40%, P2 sebesar 19,40%, P3 sebesar 16,87%, dan P4 sebesar 16,40%.
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan pada
Fakultas Perikanan dan Ilmu Kelautan
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
SKRIPSI
Judul Penelitian : LAJU PERTUMBUHAN BIOMASSA DAN UJI KADAR KARBOHIDRAT Gelidium latifolium PADA KULTIVASI MENGGUNAKAN SISTEM INJEKSI Nama Mahasiswa : Dea Fauzia Lestari
NIM : C54080013
Departemen : Ilmu dan Teknologi Kelautan
Menyetujui, .
Dosen Pembimbing I
Dr. Ir. Mujizat Kawaroe, M.Si. NIP. 19651213 199403 2 002
Dosen Pembimbing II
Adriani Sunuddin, S.Pi. M.Si. NIP. 19790206 200604 2 013
Mengetahui,
Ketua Departemen Ilmu dan Teknologi Kelautan
tugas akhir yang dibuat sebagai salah satu syarat untuk memperoleh gelar Sarjana di Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penulis mengucapkan banyak terima kepada seluruh pihak yang telah membantu dalam proses penyelesaian Skripsi ini, yaitu :
1. Ibunda dan ayahanda tercinta atas kasih sayang, doa, dukungan, nasihat, kesabaran, serta bantuannya baik moril maupun materil.
2. Dr. Ir. Mujizat Kawaroe, M.Si. dan Adriani Sunuddin, S.Pi. M.Si. selaku dosen pembimbing yang telah memberikan bimbingan, arahan, dan motivasi kepada Penulis.
3. Prof. Dr. Ir. Dietriech G. Bengen, DEA selaku dosen penguji yang telah memberikan saran dan masukan kepada Penulis.
4. Staff Surfactant and Bioenergy Research Center (SBRC), yaitu Mba Dahlia, Mba Dina, Bang Ito, Mba Tyas, Syarif, Mba Indah, dan Mba Neli yang memberikan arahan dan pendapat saat melakukan proses penelitian. 5. Rizky Rahadikha dan teman seperjuangan SBRC tim yang selalu
6. Teman-teman Perwira 42 serta teman-teman ITK 45 yang senantiasa membantu dan memberikan semangat dalam penelitian dan proses penulisan Skripsi ini.
Kesempurnaan Skripsi ini tidak terlepas dari saran dan kritik yang
membangun dari semua pihak. Penulis berharap semoga Skripsi ini dapat berguna untuk semua pihak.
Bogor, 21 November 2012
DAFTAR ISI ...iv 2.2 Klasifikasi dan Karakteristik Gelidiumlatifolium ...4 2.3 Laju Pertumbuhan Makroalga ...5 2.4 Metode Budidaya ...7 2.5 Faktor yang Memengaruhi Pertumbuhan Makroalga ...8 2.4.1 Suhu ...8 2.4.2 Salinitas ...9 2.4.3 Nutrien ...9 2.2.4 Keasaman (pH) ...10 2.2.5 Oksigen terlarut (DO) ...10 2.2.6 Kecerahan dan cahaya ...10 2.2.7 Hama dan penyakit ...11 2.5 Siklus Karbondioksida ...11 2.6 Kegunaan Makroalga ...13 2.7 Karbohidrat ...14 2.8 Produksi Bioetanol dan Hidrolisis ...15 3. BAHAN DAN METODE
3.3.3 Analisis kandungan ...27 3.3.4 Pengukuran parameter kualitas air ...30 3.3.5 Pengukuran laju pertumbuhan biomassa ...30 3.4 Uji Kadar Karbohidrat ...31 3.5 Analisis Data ...31 4. HASIL DAN PEMBAHASAN
4.1 Bobot Basah Gelidium latifolium ...34 4.2 Laju Pertumbuhan Gelidium latifolium ...37 4.3 Pemanfaatan Karbondioksida pada Kultivasi Gelidium latifolium ...42 4.4 Kualitas Air ...48 4.5 Isolasi Fungi Penghambat Pertumbuhan ...52 4.6 Kadar Karbohidrat Gelidium latifolium ...54 5. KESIMPULAN DAN SARAN
1 1.1 Latar Belakang
Indonesia memiliki sumber daya makroalga yang beragam dan wilayah pesisir yang luas. Luasnya lahan menjadi pendukung untuk dilakukannya
eksplorasi dan pemanfaatan makroalga sebagai bahan baku bioetanol. Salah satu makroalga yang potensial adalah Kelas Gelidian. Spesies Gelidium sp. memiliki kandungan agar 26,5%. Presentasi ini cukup tinggi bila dibandingkan dengan rata-rata kadar agarofit yang pernah dilaporkan sebelumnya yaitu 15-40% (Rasyid et al., 1999). Namun makroalga jenis ini belum banyak dibudidayakan dan kebanyakan diambil secara langsung dari alam.
Makroalga mengonversi energi dari cahaya matahari melaui proses fotosintesis. Proses fotosintesis memerlukan molekul karbondioksida ( ) dari atmosfer dan hidrogen dipisahkan dari air untuk membangun karbohidrat. Makroalga dapat mereduksi yang menyebabkan peningkatan suhu bumi sehingga baik untuk dibudidayakan. Karbohidrat yang terkandung pada
makroalga memiliki kandungan lebih tinggi daripada lemaknya. Menurut Jeong dan Park (2009), kandungan gula lebih mudah untuk dikonversi ke dalam bentuk
biofuel dan kimia. Hal ini memungkinkan peluang untuk menjadikan makroalga sebagai bahan dari energi alternatif biofuel.
pada sistem yang diinjeksikan dengan kadar yang berbeda-beda. Selain melihat laju pertumbuhan Gelidium latifolium, dilakukan perhitungan jumlah yang digunakan dalam proses kultivasi sehingga bisa diketahui jumlah gas
tersebut dalam proses kultivasi serta kandungan karbohidrat sebelum dan sesudah kultivasi.
1.2 Tujuan
Tujuan penelitian ini adalah :
1. Menguji kadar karbohidrat Gelidiumlatifolium sebelum dan sesudah kultivasi; 2. Menganalisis laju pertumbuhan biomassa Gelidiumlatifolium selama kultivasi
menggunakan sistem injeksi ;
3 2.1 Makroalga
Makroalga merupakan ganggang yang tidak mempunyai batang, daun, dan akar sejati. Tubuhnya menyerupai batang yang disebut dengan thallus dan
hidupnya menempel pada substrat, seperti karang, lumpur, pasir, batu, dan benda keras lainnya (Anggadiredja et al., 2006). Bentuk thallus pada makroalga bermacam-macam antara lain ada yang berbentuk pipih, tabung, bulat, dan sebagainya. Pigmen yang terdapat pada thallus juga bermacam-macam sehingga dapat digunakan dalam membedakan berbagai kelas makroalga, yaitu
Chloropyceae, Phaeophyceae, Rhodophyceae, dan Cyanophceae. Pigmen yang menentukan warna ini adalah klorofil, karoten, phycoerythin, dan phycocyanin
merupakan pigmen utama di samping pigmen lainnya (Aslan, 1998).
Alga merah atau Rhodophyceae merupakan alga yang memiliki pigmen fikobilin yang terdiri dari phycoerythin (berwarna merah) serta phycocyanin
(berwarna biru). Alga merah ini bersifat adaptasi kromatik yaitu memiliki penyesuaian antara proporsi pigmen dengan berbagai kualitas pencahayaan dan dapat menimbulkan berbagai warna pada thallus. Jenis ekonomis dari divisi ini adalah Gracilaria spp., Gelidium spp., Euchema spp., Hypnea spp., Gigartina
spp., dan Rhodymena spp. Alga cokelat dengan nama lain Phaeopyceae
merupakan alga yang memiliki pigmen klorofil a dan c, beta karoten, violasantin dan fikosantin. Jenis ekonomis pada divisi ini adalah Sargassum spp.,
Hormophysa spp., dan Turbinaria spp. Alga hijau atau Chlorophyceae
Gambar 1. Makroalga Gelidium latifolium
Sumber: Dokumentasi pribadi
Dirujuk dari Hatta et al. (2001), taksonomi Gelidium latifolium adalah sebagai berikut:
Divisi : Rhodophyta Kelas : Rhodophyceae
Ordo : Gelidiales
Family : Gelidiaceae Genus : Gelidium
Menurut Aslan (1998) ciri-ciri Gelidium sp. adalah memiliki ukuran kecil, panjang ± 20 cm, dan lebar 1,5 mm. Batang utama tegak dengan percabangan biasanya menyirip. Thallus berwarna kemerahan, coklat, dan hijau kecoklatan. Organ reproduksinya berukuran mikroskopis.
Lebih dari seratus jenis makroalga telah dimasukkan dalam Genus
Gelidium yang tersebar di seluruh dunia dan 11 jenis diantaranya terdistribusi di perairan Indonesia. Nama Gelidium berbeda-beda di setiap daerah misalnya kades dan intip kembang karang (Jawa Barat), bulung merak dan bulung ayam (Bali), serta sayur laut (Ambon). Gelidium sp. memiliki kandungan agar berkualitas baik dan potensial dijadikan sebagai bahan baku industri farmasi, kosmetik, dan makanan. Selain itu, diolah menjadi bioetanol dan bahan baku pulp
atau kertas karena kualitas seratnya yang sangat baik. Kandungan agar-agarnya berkisar antara 12-48% tergantung jenisnya (Aslan, 1988).
2.3 Laju Pertumbuhan Makroalga
Pertumbuhan adalah perubahan ukuran suatu organisme dapat berupa berat atau panjang dalam waktu tertentu. Pertumbuhan makroalga sangat dipengaruhi oleh dua faktor yaitu faktor internal dan faktor eksternal. Faktor internal yang berpengaruh antara lain jenis, galur, bagian thallus, dan umur. Faktor eksternal yang berpengaruh antara lain keadaan fisik dan kimiawi perairan. Selain itu, faktor lain yang sangat menentukan keberhasilan pertumbuhan makroalga yaitu pengelolaan yang dilakukan oleh manusia (Syahputra, 2005).
Pertumbuhan juga merupakan salah satu aspek biologi yang harus
kondisi lingkungan perairan dengan areal yang akan dibudidayakan akan semakin baik pertumbuhannya dan juga hasil yang diperoleh (Syahputra, 2005).
Soegiarto et al. (1978) menyatakan bahwa laju pertumbuhan makroalga berkisar antara 2-3% per hari. Percobaan yang dilakukannya menggunakan rak terapung pada tiga lapisan kedalaman berbeda menunjukkan bahwa posisi yang lebih dekat dengan permukaan (30 cm) tumbuh lebih baik daripada lapisan kedalaman di bawahnya karena cahaya matahari merupakan faktor penting untuk pertumbuhan makroalga. Pada kedalaman tidak terjangkau cahaya matahari, maka makroalga tidak dapat tumbuh. Demikian pula iklim, letak geografis dan faktor oseanografi menentukan pertumbuhannya. Pertumbuhan makroalga dikategorikan sebagai pertumbuhan somatik dan pertumbuhan fisiologis. Pertumbuhan somatik merupakan pertumbuhan yang diukur berdasarkan
2.4 Metode Budidaya
Menurut Aslan (1998), secara umum di Indonesia budidaya makroalga dilakukan dalam tiga metode penanaman berdasarkan posisi tanaman terhadap dasar perairan. Ketiga metode tersebut dijelaskan sebagai berikut:
a. Metode dasar (bottom method)
Penanaman dengan metode ini dilakukan dengan mengikat bibit tanaman yang telah dipotong pada karang atau balok semen kemudian disebar pada dasar perairan. Metode dasar merupakan metode pembudidayaan
makroalga dengan menggunakan bibit dengan berat tertentu. b. Metode lepas dasar (off-bottom method)
Metode ini dapat dilakukan pada dasar perairan yang terdiri dari pasir, sehingga mudah untuk menancapkan pancang. Metode ini sulit dilakukan pada dasar perairan yang berkarang. Bibit diikat dengan tali rafia yang kemudian diikatkan pada tali plastik yang direntangkan pada pokok kayu atau bambu. Jarak antara dasar perairan dengan bibit yang akan dilakukan berkisar antara 20-30 cm. Bibit yang akan ditanam berukuran 100-150 gram, dengan jarak tanam 20-25 cm. Penanaman dapat pula dilakukan dengan jaring yang berukuran 2,5x5 m² dengan lebar mata jaring 25-30 cm dan direntangkan pada patok kemudian bibit rumput laut diikatkan pada simpul-simpulnya.
c. Metode apung (floating method/longline)
pemanenan makroalga dapat dilakukan setelah 1-3 bulan.
2.5 Faktor yang Memengaruhi Pertumbuhan Makroalga
Beberapa faktor yang memengaruhi pertumbuhan dari makroalga diantaranya sebagai berikut:
2.4.1 Temperatur
Temperatur merupakan faktor yang amat penting bagi kehidupan organisme di lautan, karena temperatur memengaruhi aktivitas metabolisme ataupun perkembangbiakan dari organisme-organisme tersebut (Hutabarat dan Evans, 2008). Toleransi temperatur dianggap sebagai faktor penting dalam menjelaskan biogeografi makroalga. Kenaikan temperatur yang tinggi mengakibatkan thallus menjadi pucat kekuning-kuningan yang menjadikan makroalga tidak dapat tumbuh dengan baik. Oleh karena itu, temperatur perairan yang baik untuk budidaya makroalga adalah 20-28 °C dengan fluktuasi harian maksimum 4 °C (Puslitbangkan, 1991). Temperatur merupakan faktor sekunder bagi kehidupan makroalga dan fluktuasi yang tinggi akan menghindarkan proses
Menurut Luning (1990) makroalga mempunyai temperatur kisaran spesifik karena adanya enzim pada tubuhnya. Di daerah tropis makroalga masih dapat tumbuh pada kisaran temperatur 20-30 ⁰C dan hidup optimal pada 28 ⁰C.
2.4.2 Salinitas
Makroalga tumbuh dengan baik pada salinitas yang tinggi. Penurunan salinitas akibat air tawar yang masuk akan menyebabkan pertumbuhan makroalga menjadi tidak normal. Salinitas yang dianjurkan untuk budidaya makroalga adalah salinitas pada kisaran 28-34 ppt (Zatnika dan Angkasa, 1994). Menurut Dawes (1981) kisaran salinitas yang baik untuk budidaya makroalga berkisar 30-35 ppt. Soegiarto et al. (1978) pun menuturkan bahwa salinitas yang cocok untuk budidaya makroalga adalah 32-35 ppt.
2.4.3 Nutrien
Unsur hara atau nutrien berperan untuk pertumbuhan, terdiri dari mikro nutrien dan makro nutrien. Mikro nutrien merupakan unsur hara yang diperlukan dalam jumlah yang sedikit sedangkan makro nutrien merupakan unsur hara yang diperlukan dalam jumlah yang banyak. Unsur Nitrogen dan Fosfor merupakan makro nutrien yang menjadi pembatas pertumbuhan dan perkembangan
makroalga. Nitrogen diserap dalam bentuk Nitrat dan unsut Fosfor diserap dalam bentuk Fosfat (Nybakken, 1988).