AKTIVITAS FRAKSI POLIFENOL BUAH DELIMA (
Punica
granatum
L.) TERHADAP PEROKSIDASI LIPID DARAH
TIKUS YANG DIINDUKSI PARASETAMOL
HERYANI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
HERYANI. Aktivitas Fraksi Polifenol Buah Delima (Punica granatum
L.)
terhadap Peroksidasi Lipid Darah Tikus yang Diinduksi Parasetamol. Dibimbing
oleh ANNA P. ROSWIEM dan EDY DJAUHARI PK.
Buah delima (Punica granatum
L.) dilaporkan memiliki aktivitas
antioksidan tertinggi daripada tumbuhan obat lain. Penelitian ini bertujuan
menentukan aktivitas polifenol buah delima terhadap peroksidasi lipid darah tikus
yang diinduksi parasetamol. Sebanyak 22 tikus dibagi ke dalam 7 kelompok. Satu
kelompok normal diinduksi akuades dan enam kelompok perlakuan diinduksi
parasetamol (500 mg/KgBB) selama 34 hari. Kelompok kontrol positif pada
perlakuan diinduksi Cursil
®70 (13.3 mg/KgBB), dan kelompok lainnya
masing-masing diinduksi fraksi polifenol dosis 13.3 mg/KgBB, 100 mg/KgBB, 250
mg/KgBB, dan 500 mg/KgBB pada 17 hari terakhir. Polifenol diekstrak dengan
pelarut aseton:air:asam asetat (90:9.5:0.5). Lipid peroksida darah direaksikan
dengan asam tiobarbiturat (TBA) 1% dan dianalisis dengan spektrofotometer pada
ABSTRACT
HERYANI. Polyphenol Fraction Activities of Pomegranate (Punica granatum L.)
against Blood Lipid Peroxidation in Rats Induced by Paracetamol. Under the
direction of ANNA P. ROSWIEM and EDY DJAUHARI PK.
AKTIVITAS FRAKSI POLIFENOL BUAH DELIMA (
Punica
granatum
L.) TERHADAP PEROKSIDASI LIPID DARAH
TIKUS YANG DIINDUKSI PARASETAMOL
HERYANI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Aktivitas Fraksi Polifenol Buah Delima (Punica granatum L.)
terhadap Peroksidasi Lipid Darah Tikus yang Diinduksi
Parasetamol
Nama
: Heryani
NIM
: G84062248
Disetujui
Komisi Pembimbing
Dr. Anna P. Roswiem, MS
Ketua
Drs. Edy Djauhari PK, MS
Anggota
Diketahui
Dr. Ir. I Made Artika, M.App.Sc
Ketua Departemen Biokimia
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas limpahan
rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini
sebagai salah satu persyaratan untuk memperoleh gelar Sarjana Sains di
Departemen Biokimia. Karya ilmiah ini berjudul Aktivitas Fraksi Polifenol Buah
Delima (Punica granatum
L.) terhadap Peroksidasi Lipid Darah Tikus yang
Diinduksi Parasetamol. Penelitian ini dilaksanakan pada bulan Pebruari 2010
hingga Juni 2010 di Laboratorium dan Kandang Hewan Coba Biokimia,
Departemen Biokimia Institut Pertanian Bogor.
Ucapan terima kasih penulis sampaikan kepada Dr. Anna P. Roswiem, MS
dan Drs. Edy Djauhari PK., MS atas bimbingan, waktu, dan perhatiannya kepada
penulis selama penelitian dan penyusunan karya ilimiah. Ucapan terima kasih
juga penulis sampaikan kepada kedua orang tua dan seluruh keluarga tercinta atas
segala doa, dukungan, dan perhatiannya. Ucapan terimakasih juga disampaikan
kepada Dian Apriliana selaku rekan kerja, Sidik STK43, Renna Y. Vernanda,
Umul Karimah, Akmal, Marsudi Siburian, Feni T. Asmoro, Donna Fujie RU.,
Farah Meutia, Bakuh Darminto, S.Si, Sitha A. Ihsan, Reza B. Permana,
teman-teman Biokimia lain, serta teman-teman-teman-teman satu kontrakan, khususnya Chandra C.
Nugroho, Deden Miftahudin, dan Hizry Ramdani atas bantuannya selama
penelitian dan penyusunan skripsi. Semoga karya ilmiah ini dapat memberikan
informasi dan bermanfaat bagi semua.
Bogor, Agustus 2010
RIWAYAT HIDUP
Penulis dilahirkan di Subang pada tanggal 2 Juli 1988 dari ayah Jamarih
dan ibu Rumsinah sebagai anak ke-6 dari enam bersaudara. Tahun 2006 penulis
lulus dari SMA Negeri 1 Subang dan pada tahun yang sama penulis diterima di
IPB melalui jalur Undangan Seleksi Masuk IPB (USMI). Tahun 2007 penulis
diterima di Departemen Biokimia Fakultas Matematika dan Ilmu Pengetahuan
Alam (FMIPA) sebagai mayor.
Selama mengikuti perkuliahan, penulis pernah aktif di berbagai organisasi
kemahasiswaan. Tahun 2006-2007 penulis aktif di Ikatan Keluarga Muslim TPB
(IKMT) sebagai sekretaris umum. Tahun 2007-2008 penulis aktif di Badan
Eksekutif Mahasiswa (BEM) FMIPA sebagai staf Divisi Infokom. Di tahun yang
sama, penulis juga aktif sebagai ketua Organisasi Mahasiswa Daerah (OMDA)
Subang. Tahun 2008-2009 penulis aktif di Himpunan Profesi
Community of
Research and Education in Biochemistry
(CREBs) sebagai staf Divisi
Research
and Development
(RnD). Dilanjut pada tahun 2010 sebagai ketua Badan
Pengawas CREBs dan pengurus utama
Green Environment Biochemist
Community (GENESIST).
Selama perkuliahan, penulis pernah menjalani Praktik Lapangan (PL) di
Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya
Genetik Pertanian (BB-BIOGEN) dan menulis laporan ilmiah yang berjudul
Identifikasi Gen Ketahanan Penyakit Blas pada Populasi Haploid Ganda Padi
Gogo Hasil Persilangan Resiprokal Galur CT dan Bio46. Tahun 2009 penulis
mengikuti program kreativitas mahasiswa bidang penelitian (PKMP) dan
mendapatkan 5 besar PKMP terbaik tingkat IPB dengan judul Pemanfaatan
Limbah Cair Terasi sebagai Sumber Energi Listrik Alternatif di Kabupaten
Cirebon. Selain itu, penulis juga pernah menerima beasiswa
Goodwill
International tahun 2009-2010.
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Fisiologi Hati ... 2
Hepatitis Toksik ... 2
Parasetamol sebagai Stimulan Radikal Bebas ... 3
Oksidasi Lipid dan Analisisnya ... 4
Buah Delima (Punica granatum L.) ... 5
Polifenol ... 7
BAHAN DAN METODE
Bahan dan Alat... 8
Metode Penelitian ... 8
HASIL DAN PEMBAHASAN
Fraksi Polifenol Buah Delima ... 9
Kondisi Hewan Coba ... 10
Konsentrasi Lipid Peroksida Serum ... 11
SIMPULAN DAN SARAN
Simpulan ... 15
Saran ... 15
DAFTAR PUSTAKA ... 15
DAFTAR TABEL
Halaman
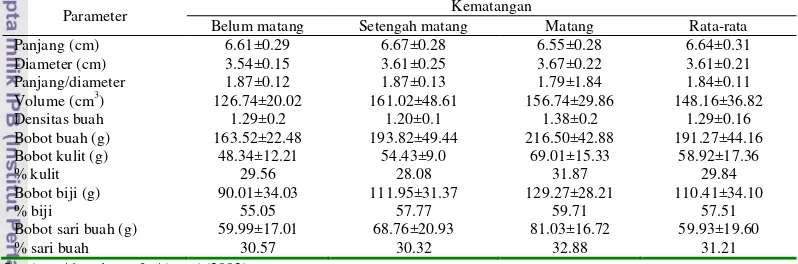
1 Kondisi fisik buah delima pada berbagai kematangan ... 6
2 Kadar abu (%) dan mineral (mg/100 g) pada sari buah dan biji delima ... 6
3 Komposisi kimia biji buah delima ... 6
4 Komposisi pakan standar tikus ... 11
DAFTAR GAMBAR
Halaman
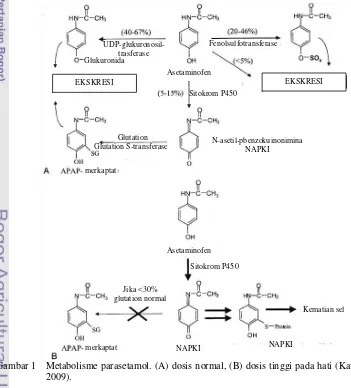
1 Metabolisme parasetamol dosis normal dan dosis tinggi pada hati ... 4
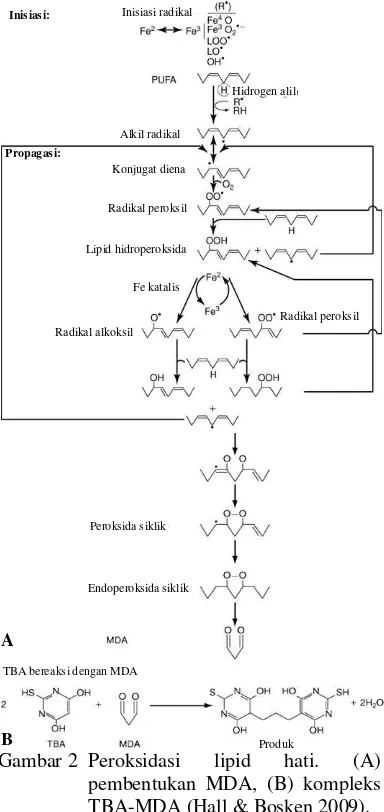
2 Peroksidasi lipid hati dan pembentukan kompleks TBA-MDA ... 5
3 Buah delima (Punica granatum L.) ... 7
4 Struktur kimia punikalin dan punikalagin ... 7
5 Pengambilan darah dari jantung pada tikus Sprague Dawley ... 9
6 Bobot badan tikus masa adaptasi ... 11
7 Bobot badan tikus hari ke-0 hingga ke-17 ... 11
8 Bobot badan tikus hari ke-18 hingga ke-34 ... 11
9 Konsentrasi lipid peroksida ... 15
DAFTAR LAMPIRAN
Halaman
1 Gambaran umum penelitian... 20
2 Prosedur ekstraksi polifenol ... 20
3 Rancangan perlakuan hewan coba ... 21
4 Pengukuran konsentrasi lipid peroksida ... 22
5 Bobot badan (BB) tikus masa adaptasi ... 23
6 Bobot badan (BB) tikus hari ke-0 hingga ke-17 ... 24
7 Bobot badan (BB) tikus hari ke-17 hingga ke-34 ... 25
8 Konsentrasi lipid peroksida serum tikus hari ke-0 ... 26
9 Konsentrasi lipid peroksida serum tikus hari ke-18 ... 27
10 Konsentrasi lipid peroksida serum tikus hari ke-35 ... 28
11 Rekapitulasi data statistik ... 29
1
PENDAHULUAN
Organ hati memiliki peranan yang sangat penting bagi manusia. Hati berfungsi dalam proses metabolisme zat-zat makanan, seperti karbohidrat, lipid, dan protein. Hati juga berfungsi dalam penyimpanan glikogen, trigliserida, Fe, dan Cu. Peranan hati lainnya adalah sebagai sistem mononuklear fagosit, detoksifikasi toksikan, serta fungsi sintesis dan ekskresi garam-garam empedu (Stockham & Scott 2008). Namun, berubahnya pola hidup yang tidak teratur dapat menyebabkan peningkatan perusakan hati, terutama oleh virus, bahan kimia alami atau sintetik yang merusak hati (hepatotoksik), alkohol, serta konsumsi obat-obatan dosis tinggi. Dalimartha (2005) menyebutkan bahwa hepatitis dapat terjadi akibat berbagai faktor tersebut.
Hepatitis akibat obat atau toksin dapat digolongkan menjadi hepatotoksin direct dan
indirect, reaksi hipersensitivitas terhadap obat, serta idiosinkrasi metabolik. Hal ini ditambah dengan pengetahuan masyarakat yang kurang akan konsumsi obat-obatan dapat meningkatkan resiko timbulnya penyakit hepatitis. Konsumsi obat-obatan seperti parasetamol dalam dosis berlebih pada hewan dan manusia dapat mengakibatkan kerusakan hati (Lee 2003). Obat-obat lain yang dapat menyebabkan kerusakan hati adalah obat anastetik, antibiotik, antiinflamasi, antimetabolik dan imunosupresif, antituberkulosa, hormon-hormon, serta obat psikotropik. Kerusakan hati dapat didiagnosa oleh beberapa parameter biokimia, yaitu adanya peningkatan aktivitas enzim alanin aminotransferase (ALT), aspartat aminotransferase (AST), alkalin fosfatase
(ALP), -glutamil transferase (GGT), glutation
peroksidase (GPx), superoksida dismutase (SOD), katalase, laktat dehidrogenase, 5-nukleotidase, bilirubin, dan TBA-reacting substance (TBARS) (Stockham & Scott 2008).
Hepatitis secara umum timbul akibat inflamasi hati. Salah satu kondisi yang terjadi adalah oksidasi membran sel oleh radikal bebas, baik dari luar tubuh (eksogen) maupun hasil metabolisme tubuh (endogen). Konsumsi parasetamol dosis tinggi dapat menyebabkan kerusakan hati secara akut atau nekrosis. Hal ini terjadi karena pengikatan kovalen pada N -asetil-p-benzokuinonimina (NAPKI), senyawa radikal hasil oksidasi parasetamol, dengan gugus –SH pada protein membran yang menghasilkan nekrosis sel dan peroksidasi lipid yang diinduksi oleh penurunan jumlah glutation (Murugesh et al. 2005).
Peroksidasi lipid membran sel sebenarnya dapat ditangkap oleh antioksidan. Tubuh manusia sendiri memiliki berbagai senyawa antioksidan, baik antioksidan enzimatik, seperti superoksida dismutase (SOD), katalase, dan peroksidase; maupun antioksidan non enzimatik seperti glutation tereduksi (GSH) (Stockham & Scott 2008). Namun, jika akumulasi radikal meningkat, tubuh membutuhkan asupan senyawa antioksidan dari luar yang mampu melindungi dan memperbaiki jaringan hati. Senyawa ini disebut sebagai hepatoprotektor (Dalimartha 2005).
Berbagai senyawa antioksidan yang berpotensi sebagai hepatoprotektor telah banyak diteliti. Batubara (2003) dan Adji (2004) menyebutkan bahwa saponin dari akar kuning (Archangelisia flava L. Merr) dan kurkumin dari Curcuma xanthorhiza Roxb. dapat menghambat peningkatan konsentrasi lipid peroksida, serta menurunkan aktivitas ALT dan AST pada tikus Sprague Dawley yang diinduksi parasetamol. Antioksidan lain diantaranya adalah Silimarin dari Silybum marinum dan ekstrak metanol Berberis tinctoria L. (Murugesh et al. 2005), antioksidan ekstrak air dan metanol 70% daun sangitan (Rustandi 2006), rebusan daun sirih merah (Windyagiri 2006), ekstrak air rosella (Aryadi 2009), serta alkaloid dan isoflavon bunga Sphaeranthus indicus (Tiwari & Khosa 2010).
Antioksidan memainkan peranan penting dalam mengikat radikal bebas dan mencegah amplifikasi senyawa radikal. Hingga saat ini aktivitas senyawa antioksidan tertinggi terdapat pada buah delima (Punica granatum L.), lebih tinggi daripada anggur merah dan teh hijau, dengan komponen tanin hydrolizable yang berperan dalam 92% aktivitas antioksidan dalam buah (Malik et al. 2005). Pengaruh pemberian ekstrak (antiokidan) buah delima terhadap kesehatan telah banyak diteliti, di antaranya adalah dapat memberikan efek antiarterosklerosis (Aviram et al. 2000), mereduksi stres oksidatif (Aviram et al. 2000; de Nigris et al. 2005), antihipertensi (Aviram & Dornfeld 2001), antidiabetes (Das et al.
2001; Huang et al. 2005), antimutagenik (Negi 2003), antikardiak fibrosis (Huang et al. 2005), anti-aging (Kumar et al. 2009), serta antikanker prostat (Malik et al. 2005; Seeram
2
hepatoprotektor pada tikus galur Wistar. Oleh karena itu, aktivitas hepatoproteksi fraksi polifenol buah delima terhadap peroksidasi lipid darah perlu diteliti.
Penelitian ini bertujuan menentukan aktivitas polifenol buah delima terhadap peroksidasi lipid darah tikus yang diinduksi parasetamol dosis 500 mg/KgBB, dengan hipotesis fraksi tersebut dapat menurunkan kadar lipid peroksida darah. Potensi yang diperoleh akan dibandingkan secara langsung dengan Cursil®70 (obat hepatitis) dosis 13.3 mg/KgBB. Metode yang digunakan untuk mengukur konsentrasi lipid peroksida serum tikus adalah metode asam tiobarbiturat (TBA)
dengan spektrofotometer pada λ=5γβ nm (Yagi
1994). Hasil penelitian ini diharapkan dapat menambah informasi potensi polifenol buah delima sebagai hepatoprotektor dan dapat dijadikan sebagai obat hepatitis alternatif.
TINJAUAN PUSTAKA
Fisiologi Hati
Hati merupakan organ tubuh yang besar, kompleks, dan terdapat di dalam rongga perut kanan atas, di bawah diafragma kanan, dan dilindungi tulang iga kanan bawah. Organ ini berwarna coklat tua dan berbobot antara 1200-1600 g atau sekitar 2.5% dari bobot total orang dewasa. Organ ini terbagi menjadi dua lobus, dengan lobus kanan yang besarnya enam kali dari bagian kirinya. Setiap lobus terdiri atas ribuan lobulus yang merupakan unit fungsional. Setiap lobulus terdiri atas sel-sel hepatosit yang berbentuk kubus dan tersusun melingkar mengelilingi vena sentralis. Di antara lobulus (interlobular) terdapat saluran empedu dan kapiler (sinusoid) yang merupakan cabang vena porta dan arteria hepatika (Dalimartha 2005). Sinusoid dibatasi oleh sel Kupffer yang merupakan sistem retikuloendotelial dan mempunyai fungsi serupa dengan sel makrofag (Kaplan & Pesce 2010).
Hati memiliki peran penting dalam metabolisme tubuh, yaitu metabolisme karbohidrat, protein, dan lipid yang dikirim oleh vena porta setelah diabsorbsi dari usus. Hati dapat menyintesis lebih dari 1000 protein plasma, seperti albumin dan globulin secara de novo dari asam amino esensial dan non esensial. Hati juga dapat menyintesis asam lemak, trigliserida, kolesterol, apolipoprotein, lipoprotein, dan kolesterol ester dalam fosfolipid. Beberapa bahan hasil metabolisme ini dapat tersimpan dalam hati, seperti
glikogen, trigliserida, Fe, dan Cu (Stockham & Scott 2008). Fungsi hati lainnya adalah detoksifikasi toksikan dan radikal bebas, yaitu melalui reaksi konjugasi dengan beberapa senyawa yang dihasilkan di dalam hati, seperti glutation, asam glukuronat, glisin, dan asetat. Hati mempunyai sistem ekskresi, dengan mengubah senyawa toksikan yang liposoluble
menjadi hydrosoluble yang diekskresikan melalui urin, cairan empedu, ataupun lewat usus. Hati juga berperan sebagai organ pertahanan tubuh, yaitu dengan adanya sel Kupffer yang mempunyai kemampuan memfagositosis sel-sel tua, partikel atau benda asing, sel tumor, bakteri, virus, dan parasit di dalam hati (Dalimartha 2005; Stockham & Scott 2008). Hati memiliki kapasitas cadangan yang besar, yaitu hanya dengan 10%-20% jaringan hati yang masih berfungsi ternyata sudah cukup untuk mempertahankan hidup pemiliknya. Kemampuan regenerasi jaringan yang mati cukup besar sehingga akan cepat digantikan dengan yang baru (Dalimartha 2005).
Sel hati mempunyai bentuk ultrastruktur yang mencerminkan bahwa sel terlibat dalam berbagai fungsi metabolik yang luas. Sel ini mengandung berbagai enzim, beberapa diantaranya penting untuk diagnostik karena dialirkan ke pembuluh darah vena dan aktivitasnya dapat diukur sehingga dapat menunjukkan adanya penyakit hati atau tingkat keparahannya (Ganong 2002). Enzim-enzim tersebut diantaranya adalah aspartat aminotransferase (AST), alanin aminotransferase (ALT), alkalin fosfatase
(ALP), -glutamintransferase (GGT), laktat
dehidrogenase, dan 5-nukleotidase. Konsentrasi keenam enzim ini meningkat dalam beberapa macam kerusakan hati, seperti hepatitis kronis, sirosis, alkoholik, dan tumor hati (Kaplan & Pesce 2010; Stockham & Scott 2008). Selain itu, produk peroksidasi lipid, TBA-reacting substance (TBARS), juga teralirkan ke pembuluh vena (Stockham & Scott 2008).
Hepatitis Toksik
3
disebabkan oleh bakteri, parasit, obat-obatan, alkohol, kegemukan, dan lainnya (Dalimartha 2005). Penderita hepatitis yang disebabkan oleh senyawa toksik dan obat-obatan ini memiliki tanda-tanda yang mirip dengan penyakit hepatitis lainnya (Anderson & Cockayne 1993).
Hepatitis berdasarkan tingkat keparahannya ada yang bersifat akut dan dapat meningkat menjadi kronis. Keduanya merupakan jenis penyakit dengan pasokan obat yang terbatas. Hal tersebut terjadi karena penyebab, mekanisme, dan perkembangan penyakit hati yang beragam, tingkat respon pasien rendah, efek samping cukup besar, serta biaya terapi yang mahal sehingga sulit mencari obat yang ideal (Anderson & Cockayne 1993).
Nabib (1987) menggolongkan penyebab timbulnya penyakit hepatitis toksik menjadi empat, yaitu (1) racun-racun kimia, seperti: tembaga, arsen, merkuri, kloroform, tetrakloroetanol, trinitrotoluena, tetrakloroetilena, dan karbon tetraklorida; (2) racun dari tanaman jenis Sereci, Aminskia, Phyllanthum, dan Leguminosa; (3) eksotoksin dan endotoksin mikroorganisme; serta (4) racun metabolik. Konsumsi obat-obatan seperti parasetamol dalam dosis berlebih pada hewan dan manusia juga dapat mengakibatkan kerusakan hati (Lee 2003).
Senyawa yang dapat menyebabkan gangguan pada jaringan hati akibat efek toksik pada hati dengan dosis berlebih dan/atau dalam jangka waktu yang lama disebut sebagai hepatotoksin. Hepatotoksin dapat menyebabkan hepatitis, tergantung pada dosis pemberian, interval waktu pemberian yang singkat antara pencernaan obat dan reaksi perlawanan, serta kemampuan untuk menimbulkan perubahan yang sama pada jaringan hati (Dalimartha 2005).
Berdasarkan mekanismenya terhadap perusakan hati, hepatotoksin dibagi menjadi dua macam, yaitu hepatotoksin intrinsik dan ekstrinsik. Hepatotoksin intrinsik merupakan hepatotoksin yang dapat diprediksi, tergantung pada dosis dan melibatkan mayoritas individu yang menggunakan obat dalam jumlah tertentu. Rentang waktu antara mulainya dan timbulnya kerusakan hati sangat bervariasi, dari beberapa jam sampai beberapa minggu. Salah satu contohnya adalah parasetamol (acetaminophen) yang menyebabkan nekrosis hati yang dapat diprediksi pada pemberian over dosis. Di sisi lain, hepatotoksin ekstrinsik atau idiosinkratik merupakan hepatotoksin yang tidak dapat diprediksi. Hepatotoksin ini terkait dengan hipersensitivitas atau kelainan
metabolisme. Respon dari hepatotoksin ini tidak dapat diprediksi dan tidak tergantung pada dosis pemberian. Tahap inkubasi toksin ini bervariasi, tetapi biasanya berminggu-minggu atau berbulan-bulan. Contohnya seperti sulfonamid, isoniazid, halotan, dan klorpromazin (Gibson 1991).
Parasetamol sebagai Stimulan Radikal Bebas
Parasetamol atau N-asetil-p-aminofenol merupakan obat yang berkhasiat analgetik anatipiretik non narkotik turunan para aminofenol. Parasetamol cepat diserap secara sempurna oleh saluran pencernaan dan tersebar ke seluruh cairan tubuh. Konsentrasi tertinggi berada pada plasma darah setelah 1-3 jam masuk ke dalam tubuh. Sebanyak 25% parasetamol berada terikat dengan protein (Lee 2003). Parasetamol dapat menyebabkan kerusakan hati apabila dikonsumsi 7.5 gram sekaligus. Pada pemakaian lebih dari 15 gram sekaligus akan menyebabkan nekrosis atau kematian sel hati (Dalimartha 2005). Dosis parasetamol yang diinduksikan berbeda-beda, tergantung pada spesiesnya. Dosis 500 mg/KgBB pada tikus Sprague Dawley mampu membuat kerusakan membran sel hepatosit selama 14 hari (Hastuti 2008), sedangkan dosis untuk tikus galur Wistar adalah 750 mg/KgBB (Murugesh et al. 2005). Secara keseluruhan, dosis parasetamol 2 g/KgBB 14 hari mampu merusak hati tikus putih Rattus norvegicus
(Balamurugan et al. 2008).
Pada dosis normal, parasetamol yang masuk ke dalam tubuh akan mengalami biotransformasi di dalam hati dengan mekanisme konjugasi (metabolisme fase II) dengan glukuronat sebanyak 40%-67%, sulfonat 20-46%, serta <5%-nya adalah sistein, beberapa metabolit terhidroksilasi dan terdeasetilasi. Hasil reaksi konjugasi ini menghasilkan senyawa yang larut air (hydrosoluble) dan tidak toksik sehingga dapat disekresikan melalui urin (Lee 2003).
Pada keadaan over dosis, sisa parasetamol akan dibiotransformasi oksidatif oleh sitokrom P-450 (metabolisme fase I) sehingga membentuk suatu metabolit elektrofil N
-asetil-p-benzoikuinonimina (NAPKI) yang bersifat hepatotoksik dan reaktif. NAPKI kemudian akan bereaksi dengan biomolekul penyusun membran sel hati, seperti fosfolipid dan protein bergugus –SH. Detoksifikasi NAPKI diawali oleh konjugasi dengan glutation tereduksi (GSH) menjadi asam merkapturat yang bersifat
4
Jika laju pembentukan NAPKI lebih besar dari laju detoksifikasi oleh GSH, maka akan terjadi oksidasi berbagai biomolekul penyusun membran seperti lipid atau gugus SH pada protein (Murugesh et al. 2005). Proses ini menyebabkan kandungan GSH hati <30% dari normalnya, sehingga NAPKI berikatan dengan makromolekul protein sel hati membentuk senyawa semikuinon. Senyawa ini akan mereduksi O2 menjadi O2•, kemudian membentuk senyawa radikal bebas lagi yang sejenis, yaitu radical oxygen species (ROS). ROS akan mengoksidasi fosfolipid secara berantai yang disebut oksidasi lipid. Hal ini mengakibatkan kerusakan sel hati sampai timbul nekrosis hati, yaitu terjadinya gangguan integritas membran plasma, keluarnya isi sel, dan timbulnya respon inflamasi (Gambar 1B). Respon ini menyebabkan banyak sel yang mati (Gibson & Sket 1991) yang ditandai dengan peningkatan ALT dan AST, bilirubin, alkalin fosfatase, gamma glutamil transferase, serta dehidrogenase laktat pada serum selama 24 jam setelah pemberian (Firmansyah 2006).
Oksidasi Lipid dan Analisisnya
Reaksi peroksidasi lipid terbagi atas reaksi inisiasi, propagasi, dan terminasi. Peroksidasi lipid dimulai dengan pemisahan sebuah atom hidrogen dari gugus metilena (-CH2-) pada
polyunsaturated fatty acids (PUFA) oleh
radical oxygen species (ROS). Reaksi ini menghasilkan radikal karbon pada PUFA. Radikal karbon distabilkan melalui suatu pengaturan ulang ikatan rangkap menghasilkan pembentukan diena terkonjugasi. Dalam keadaan aerobik, diena ini bereaksi dengan O2 membentuk radikal peroksi lipid (-CHOO•-). Radikal peroksi lipid ini dapat juga menghilangkan atom hidrogen dari gugus metilena (-CH2-) molekul lipid lain yang berdekatan, khususnya dengan adanya logam Cu atau Fe menyebabkan terjadinya reaksi autokatalitik. Radikal peroksi bergabung dengan atom H dari -CH2- lipid lain menghasilkan hidroperoksida lipid (-CHOOH-) dan radikal karbon lain (-CH•-). Tahap ini disebut propagasi. Selanjutnya radikal peroksi lipid akan membentuk lipid peroksida. Tahap
Gambar 1 Metabolisme parasetamol. (A) dosis normal, (B) dosis tinggi pada hati (Kavalci et al.
2009).
EKSKRESI EKSKRESI
UDP-glukuronosil-trasferase
Fenolsulfotransferase
Glukuronida
Glutation
Glutation S-transferase N-asetil-pbenzokuinonimina NAPKI Asetaminofen
merkaptat
Sitokrom P450
Sitokrom P450
merkaptat
Asetaminofen
Kematian sel
NAPKI Jika <30%
glutation normal
5
terminasi terjadi akibat reaksi peroksi radikal dengan α-tokoferol, senyawa lipofilik pada membran sel (Hall & Bosken 2009).
Sebelum tahap terminasi, radikal peroksi lipid (-CHOO•-) dapat mengalami proses transformasi menjadi peroksida siklik lalu siklik endoperoksida dari PUFA jenis arakidonat atau asam eikosapentanoat (Hall & Bosken 2009). Reaksi ini berlanjut hingga membentuk produk sekunder, yaitu malonaldehida (MDA). Oleh karena itu, lipid peroksida dapat dianalisis dengan adanya MDA yang direaksikan dengan asam tiobarbiturat (TBA) (Yagi 1994).
Metode asam tiobarbiturat digunakan untuk mengukur aktivitas antioksidasi suatu senyawa. Metode ini dilakukan secara langsung berdasarkan pengukuran produk utama atau sekunder dari reaksi oksidasi lipid. Prinsip metode TBA merupakan proses autooksidasi dari asam linoleat yang menghasilkan
TBA-reacting substances (TBARS), seperti malondialdehida (MDA). TBA bereaksi dengan gugus karboksilat dari MDA melalui penambahan nukleofilik membentuk kompleks MDA-TBA dalam suasana asam. Satu molekul MDA berikatan dengan dua molekul TBA menghasilkan produk yang berwarna sehingga dapat dikuantifikasi melalui spektrofotometri
pada λ=5γβ nm (Gambar β) (Yagi 1994).
Metode TBA mempunyai tingkat kepekaan yang tinggi pada radikal bebas dan mudah diaplikasikan untuk sampel dalam berbagai macam tahap oksidasi. Senyawa lain pun dapat bereaksi dengan TBA, seperti glukosa, sukrosa, asam amino, dan urea dalam konsentrasi yang sangat rendah. Metode TBA ini prinsip awalnya adalah pemurnian lipid peroksida dari senyawa-senyawa lain, kemudian diikat oleh TBA. Penambahan H2SO4 pada serum sampel berfungsi untuk memutuskan ikatan lipid dengan senyawa lain seperti protein. Penambahan fosfotungstat berfungsi mengendapkan protein serum. Proses sentrifugasi dilakukan untuk mengendapkan lipid bersama dengan protein. Pelet yang diperoleh merupakan kumpulan lipid peroksida.
Penambahan TBA 1% ke dalam pelet harus dalam kondisi asam, yaitu untuk merenggangkan padatan pelet sehingga TBA dapat bereaksi dengan lipid peroksida. Proses dilanjutkan dengan inkubasi pada suhu panas untuk mempercepat reaksi. Penambahan HCl hingga pH 1.7 dilakukan untuk menghilangkan sisa-sisa pengotor pada komponen lipid. Penambahan n-butanol : piridin (15:1) dilakukan untuk mengendapkan
pengotor-pengotor tersebut. Kemudian dilakukan sentrifugasi dan diperoleh supernatan berwarna merah keunguan yang merupakan kompleks lipid peroksida-TBA (Yagi 1994).
Gambar 2 Peroksidasi lipid hati. (A) pembentukan MDA, (B) kompleks TBA-MDA (Hall & Bosken 2009).
Buah Delima (Punica granatum L.)
Pohon delima (Punica granatum L.) adalah perdu atau pohon kecil yang banyak tumbuh dan dipelihara di pekarangan penduduk Indonesia sebagai tanaman hias. Pohon ini memiliki kingdom Plantae, filum Magnoliophyta, kelas Magnoliopsida, ordo Rosidae, famili Lythracae, genus Punica, dan spesies Punica granatum Linn (Wiryowidagdo 2008). Buah delima (pulp) memiliki presentase sebesar 57.51% dari berat buah total, meliputi 63.58% sari buah (juice) dan 36.21% biji (seed). Kulit buah (peel) delima memiliki ketebalan yang tinggi dengan berat 29.84% dari berat buah tota (Tabel 1). Sari buahsegar mengandung 84.57% air, 14.1% gula total, 1.05% protein, dan 0.33% kadar abu (Tabel 2).
TBA bereaksi dengan MDA
6
Total protein, asam askorbat, lemak, dan komponen fenolik pada biji delima adalah 4.06%, 0.32%, 0.15%, dan 2.92% (Tabel 3) (Al-Maiman & Ahmad 2002). Asam amino yang terkandung diantaranya asam glutamat dan asam aspartat (Aviram et al. 2000). Di sisi lain, Li Y et al. (2006) juga melaporkan bahwa kulit buah delima (peel) memiliki kadar air 8.0±0.8% dan menghasilkan rendemen fenolik yang lebih besar dari pulp, yaitu 31.5±3.0%.
Polifenol yang terlarut dalam sari buah sebanyak 0.2%-1.0% yang terdiri atas dua tipe, yaitu flavonoid jenis antosianin (8%-15%) dan
tanin jenis elagitanin (80%-90%). Antosianin (seperti delfinidin-3-glukosida, sianidin-3-glukosida, sianidin-3,5-diglukosida, dan pelargonidin) berfungsi dalam memberikan warna merah pada buah. Tanin hydrolizable
(seperti punikalin, pedunkulagin, punikalagin, galik, dan ester asam elagik pada glukosa) berperan dalam 92% aktivitas antioksidan dalam buah. Aktivitas antioksidan buah delima ini dilaporkan lebih tinggi daripada anggur merah dan teh hijau. Antioksidan ini juga berpotensi dalam mencegah peroksidasi lipid (Malik et al. 2005).
Tabel 1 Kondisi fisik buah delima pada berbagai kematangan
Sumber: Al-maiman & Ahmad (2002)
Tabel 2 Kadar abu (%) dan mineral (mg/100 g) pada sari buah dan biji delima
Sumber: Al-maiman & Ahmad (2002)
Tabel 3 Komposisi kimia biji buah delima
Sumber: Al-maiman & Ahmad (2002)
Parameter Kematangan
Belum matang Setengah matang Matang Rata-rata Panjang (cm) 6.61±0.29 6.67±0.28 6.55±0.28 6.64±0.31 Diameter (cm) 3.54±0.15 3.61±0.25 3.67±0.22 3.61±0.21 Panjang/diameter 1.87±0.12 1.87±0.13 1.79±1.84 1.84±0.11 Volume (cm3) 126.74±20.02 161.02±48.61 156.74±29.86 148.16±36.82
Densitas buah 1.29±0.2 1.20±0.1 1.38±0.2 1.29±0.16 Bobot buah (g) 163.52±22.48 193.82±49.44 216.50±42.88 191.27±44.16 Bobot kulit (g) 48.34±12.21 54.43±9.0 69.01±15.33 58.92±17.36
% kulit 29.56 28.08 31.87 29.84
Bobot biji (g) 90.01±34.03 111.95±31.37 129.27±28.21 110.41±34.10
% biji 55.05 57.77 59.71 57.51
Bobot sari buah (g) 59.99±17.01 68.76±20.93 81.03±16.72 59.93±19.60
% sari buah 30.57 30.32 32.88 31.21
Parameter Kematangan
Belum matang Setengah matang Matang Rata-rata Sari buah (juice)
Kadar abu 0.46±0.09 0.43±0.1 0.47±0.21 0.45±0.02
Cu 0.03±0.01 0.03±0.01 0.04±0.01 0.03±0.01
Fe 0.84±0.12 1.27±0.06 1.88±0.14 1.33±0.52
Zn 0.20±0.01 0.30±0.19 1.26±0.67 0.59±0.50
Mg 9.87±0.45 10.2±0.95 11.9±2.18 10.6±1.09
P 7.37±2.33 3.91±0.36 7.49±0.29 6.26±2.03
Na 37.8±10.3 44.5±5.95 95.7±2.17 59.3±31.6
Ca 38.2±9.27 31.4±10.2 59.3±8.88 43.0±14.5
K 309±9.27 209±14.5 243±21.7 253±51.1
Biji (seed)
Kadar abu 0.29±0.03 0.38±0.01 0.32±0.02 0.33±0.01
Cu 0.06±0.01 0.07±0.04 0.07±0.00 0.07±0.01
Fe 2.37±0.01 1.99±0.00 2.21±0.01 2.19±0.19
Zn 0.22±0.00 0.24±0.00 0.30±0.00 0.25±0.04
Mg 7.39±0.44 6.34±0.03 5.13±0.05 6.29±1.13
P 5.16±0.08 6.96±0.56 6.25±0.04 6.12±0.91
Na 79.2±2.2 76.9±0.144 72.1±0.12 76.1±3.59
Ca 26.9±0.44 23.3±0.27 24.5±0.23 24.8±18.5
K 285±7.53 302±5.44 333±15.8 307±24.4
Parameter Kematangan
Belum matang Setengah matang Matang Rata-rata Kadar air (%) 79.45±0.96 80.66±3.39 77.72±3.36 79.28±2.89 Protein (%) 3.99±0.4 3.74±0.89 4.45±0.68 4.06±0.26
Lemak (%) 0.2±0.0 0.01±0.0 0.25±0.3 0.15±0.10
Jenuh 18.6±3 17.9±3.6 16.4±2 17.5±1.02
7
Buah delima (Gambar 3) telah lama diformulasikan sebagai tanaman obat tradisional oleh masyarakat. Pada umumnya adalah sebagai obat antikanker. Semua khasiat sediaan delima ini disebabkan oleh kandungan berbagai senyawa antioksidan yang aktivitasnya sangat tinggi (Wiryowidagdo 2008). Pada akhir dekade ini, penelitian medis tentang komponen ekstrak buah delima seperti antioksidan, antikarsinogenik, dan antiinflamasi telah dipublikasikan dan difokuskan pada pengobatan dan pencegahan kanker, penyakit kardiovaskular, diabetes, infeksi bakteri, resistensi antibiotik, serta kerusakan kulit yang diinduksi radiasi UV. Beberapa potensi lain seperti pengobatan insomnia, infertilitas laki-laki, dan obesitas telah dikembangkan (Jurenka 2008). Namun, potensinya sebagai hepatoprotektor belum banyak diteliti.
Gambar 3 Buah delima (Punica granatum L.).
Polifenol
Polifenol merupakan senyawa metabolit sekunder dari tumbuhan yang banyak tersebar di alam. Polifenol disintesis di dalam tumbuhan melalui dua lintasan, yaitu lintasan shikimat dan asetat. Lebih dari 8.000 struktur fenolik telah diketahui (Lu & Gökmen 2002). Struktur utama polifenol adalah difenilpropana yang mengandung dua cincin aromatik yang dihubungkan dengan tiga atom karbon, biasanya membentuk oksigen heterosiklik. Jenis molekul senyawa ini beragam, mulai dari yang paling sederhana seperti asam fenolik hingga bentuk polimer tinggi seperti tanin. Polifenol umumnya berkonjugasi dengan satu atau lebih gula pada gugus hidroksil atau atom karbon aromatik (Reed et al. 2005).
Komponen fenolik bertindak sebagai antioksidan, yaitu terminator dari radikal bebas dan sebagai pengkelat ion logam redoks aktif. Ion logam ini memungkinkan peranannya untuk mengatalisis reaksi peroksidasi lipid. Antioksidan fenolik ini menghalangi oksidasi lipid dan molekul lain dengan cara
mendonasikan atom hidrogen ke senyawa radikal membentuk intermediet radikal fenoksil. Senyawa intermediet radikal fenoksil relatif stabil sehingga tidak mampu lagi menginisiasi reaksi radikal selanjutnya (Nzaramba 2008). Aktivitas biologis yang tinggi pada senyawa fenolik ini terletak pada posisi dan jumlah gugus hidroksil (-OH). Reed
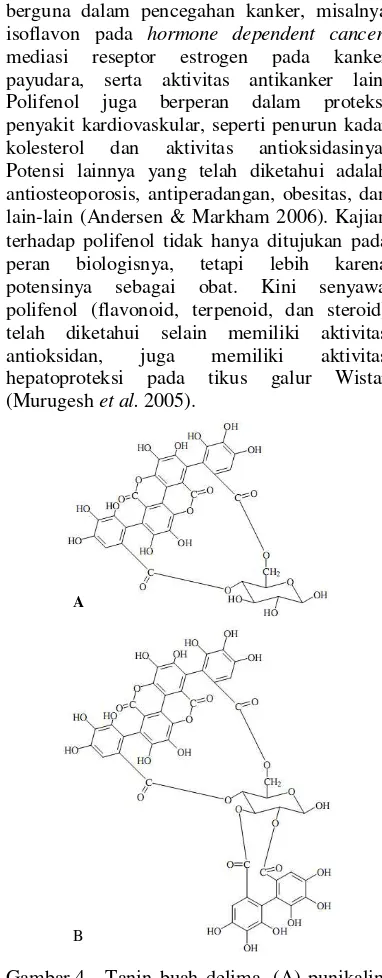
et al. (2005) menambahkkan bahwa ester asam galik seperti punikalin (Gambar 4A) dan punikalagin (Gambar 4B) memberi aktivitas antioksidan tertinggi pada polifenol buah delima.
Khasiat antioksidan polifenol umumnya berguna dalam pencegahan kanker, misalnya isoflavon pada hormone dependent cancer, mediasi reseptor estrogen pada kanker payudara, serta aktivitas antikanker lain. Polifenol juga berperan dalam proteksi penyakit kardiovaskular, seperti penurun kadar kolesterol dan aktivitas antioksidasinya. Potensi lainnya yang telah diketahui adalah antiosteoporosis, antiperadangan, obesitas, dan lain-lain (Andersen & Markham 2006). Kajian terhadap polifenol tidak hanya ditujukan pada peran biologisnya, tetapi lebih karena potensinya sebagai obat. Kini senyawa polifenol (flavonoid, terpenoid, dan steroid) telah diketahui selain memiliki aktivitas antioksidan, juga memiliki aktivitas hepatoproteksi pada tikus galur Wistar (Murugesh et al. 2005).
Gambar 4 Tanin buah delima. (A) punikalin, (B) punikalagin (Reed et al. 2005). A
8
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam peneletian ini adalah tikus putih galur Sprague Dawley jantan (Pusat Studi Biofarmaka-IPB) dengan kondisi sehat berumur 8 minggu dan berat 140-180 g, pakan standar (Indofeed, Indonesia), buah delima (Lampung, Indonesia), parasetamol (Sanmol, Indonesia), dan Cursil®70. Selain itu beberapa pereaksi yang digunakan adalah 1,1,3,3-tetrametoksipropana 6 M, H2SO4 N/12 (Merck, Indonesia), asam fosfotungstat 10% (v/v) (Merck, Indonesia), TBA 1% (b/v) (Merck, Indonesia), aseton (Merck, Indonesia), H2O, asam asetat (Merck, Indonesia), butanol (Merck, Indonesia), piridin (Merck, Indonesia), dan HCl.
Alat-alat yang akan digunakan dalam penelitian ini adalah oven, penggiling, shaker
orbital, uap putar, penangas air, desikator, neraca, spektrofotometer UV-Vis Genesys type, vortex, sentrifus klinis, mikrosentrifus, pH indikator, dan pH meter. Peralatan lainnya adalah labu ukur, Erlenmeyer, pipet tetes, pipet Mohr, pipet mikro, dan cawan porselin.
Metode Penelitian
Penelitian ini dilaksanakan dalam beberapa tahap kegiatan, yaitu penentuan kadar air, ekstraksi polifenol buah delima, adaptasi hewan coba, perlakuan hewan coba, pengukuran konsentrasi lipid peroksida sebagai parameter kerusakan hati, serta analisis statistika. Sebelumnya dilakukan preparasi sampel, yaitu buah delima (pulp) di oven pada suhu 50°C selama enam hari. Setelah kering, dilakukan penggilingan hingga terbentuk serbuk simplisia. Sampel segar (pulp) dan simplisia kemudian diukur kadar airnya.
Penentuan Kadar Air (AOAC 1995)
Cawan porselin dikeringkan pada suhu 105ºC selama 30 menit lalu didinginkan pada desikator dan ditimbang. Kadar air ditentukan dengan cara memasukkan 5 g sampel di dalam cawan porselin pada suhu 105ºC. Kemudian dilakukan pendinginan pada desikator sebelum ditimbang. Setelah 2 jam, bobot sampel dalam cawan porselin ditimbang, selanjutnya penimbangan dilakukan setiap 30 menit sekali hingga bobot konstan atau berbeda ≤ 0.000γ g. Penentuan kadar air dilakukan sebanyak 3 kali. Kadar air dapat dihitung menggunakan rumus:
W = Bobot sampel (g)
W1 = Bobot (cawan + sampel) setelah dioven W2 = Bobot cawan kosong
Ekstraksi Polifenol Buah Delima (Hayouni et al. 2007)
Metode ekstraksi yang akan dilakukan adalah modifikasi metode ekstraksi satu tahap (batch mode). Setiap 25 gram serbuk buah delima dimaserasi dengan 250 mL aseton:air:asam asetat (90:9.5:0.5) pada shaker orbital dengan suhu ruang selama 24 jam. Ekstrak tersebut kemudian disaring dengan kertas saring. Metode diulang hingga warna ekstrak sama dengan warna pelarut awal. Filtrat dikumpulkan dan dirotavapor pada suhu 45ºC kondisi vakum hingga kering.
Perlakuan Hewan Coba
Hewan coba yang digunakan adalah tikus dengan galur Sprague Dawley. Hewan percobaan berjumlah 22 ekor dikelompokkan menjadi 7 kelompok dan masing-masing kelompok terdiri atas 3 ekor, kecuali kelompok normal (4 ekor). Tikus dikandangkan secara individu beralaskan sekam kayu. Tikus diberi pakan standar 20 g/ekor/hari pada tahap adaptasi dan ditingkatkan mejadi 25 g/ekor/hari pada tahap perlakuan dengan air minum secara
ad libitum.Sebelum perlakuan, tikus diadaptasi selama 19 hari untuk menyeragamkan cara hidup dan pola makan dengan pakan standar, serta membiasakan diri dengan lingkungannya.
Tikus kelompok I merupakan kelompok normal (N) yang hanya diberi pakan standar selama penelitian dan dicekok akuades pada hari ke-0 hingga ke-34. Kelompok II atau kontrol positif (KP) yang menggunakan Cursil®70 (obat hepatitis) dengan dosis 13.3 mg/KgBB dari hari ke-18 hingga hari ke-34. Kelompok III adalah kelompok negatif (KN) yang dicekok parasetamol dosis 500 mg/KgBB pada hari ke-0 hingga ke-34. Kelompok IV (FD13.3), V (FD100), VI (FD250), dan VII (FD500) merupakan kelompok perlakuan yang dicekok dengan fraksi polifenol buah delima pada konsentrasi 13.3, 100, 250, dan 500 mg/KgBB dari hari ke-18 hingga hari ke-34. Kelompok II-VII secara bersamaan dicekok parasetamol 500 mg/KgBB dari hari ke-0 hingga hari ke-34.
Pengukuran Konsentrasi Lipid Peroksida Serum (Yagi 1994)
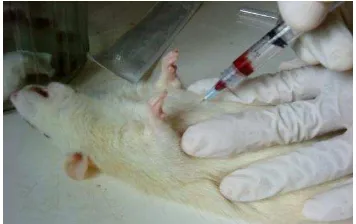
Pengambilan Serum Sampel. Darah tikus
9
alkohol 70%. Pemotongan dilakukan maksimal 5 mm dari ujung ekor dan ekor dibersihkan kembali dengan Betadine. Sampel darah yang diperoleh pada vial didiamkan pada kotak berisi es dan disimpan pada lemari pendingin selama semalam. Serum dipisahkan dengan sentrifugasi 3000 rpm pada suhu selama 15 menit. Pengambilan darah pada hari ke-35 dilakukan dari jantung (Gambar 5).
Persiapan Kurva Standar. Larutan stok
pereaksi 1,1,3,3-tetrametoksipropana (TMP) 6 M diencerkan menjadi 0.9, 1.8, 2.7, 3.6, 4.5, dan 6.0 µM. Tiap-tiap larutan dipipet sebanyak 4 mL ke dalam tabung reaksi dan ditambahkan 1.0 mL TBA 1% (b/v) dalam pelarut asam asetat 50% (v/v). Tahap selanjutnya tabung diinkubasi pada suhu 95°C selama 60 menit dan didinginkan dalam suhu kamar. Tabung yang telah dingin ditambah 1.0 mL air destilata serta 5 mL n-butanol:piridin 15:1 (v/v). Tabung ini selanjutnya dihomogenkan menggunakan vortex dan disentrifugasi pada kecepatan 3000 rpm selama 15 menit. Lapisan atas (fasa organik) diambil dan diukur absorbansinya dengan spektrofotometer pada λ=532 nm.
Pengukuran Sampel. Serum tikus diambil
sebanyak 0.3 mL kemudian ditambah 1.2 mL H2SO4 1/12 N. Campuran dibiarkan 10 menit, selanjutnya diberi asam fosfotungstat 10% (v/v) sebanyak 0.15 mL dan diinkubasi pada suhu ruang selama 5 menit. Selanjutnya disentrifugasi pada 3000 rpm selama 20 menit. Supernatan yang telah diperoleh dibuang, sedangkan peletnya ditambah 1.2 mL H2SO4 0.041 N dan 0.15 mL asam fosfotungstat 10% (v/v). Larutan ini disentrifugasi pada 3000 rpm selama 15 menit. Endapan yang diperoleh disuspensikan dalam 2.0 mL air destilata. Prosedur selanjutnya sama seperti yang dilakukan pada larutan standar (setengah resep). Sebelum penambahan 5 mL n-butanol : piridin pada sampel, dilakukan penambahan HCl sampai pH-nya berkisar 1.6-1.7.
Analisis Data (Myers & Milton 1991)
Data bobot badan diuji menggunakan uji-T menggunakan perangkat lunak SPSS Statistical Data Analysis seri 17. Data konsentrasi lipid peroksida yang diperoleh kemudian dimasukkan dalam uji analysis covarian
(ANCOVA) pada tingkat kepercayaan 95% dan taraf α = 0.05 menggunakan perangkat lunak statistical analysis system (SAS). Model rancangan tersebut adalah:
Yij= µ + τi+ xij+ εij Keterangan:
yij = Respon pada perlakuan ke-i dan ulangan ke-j
µ = Pengaruh rataan umum
τi = Pengaruh perlakuan ke-i, i = 1-7
xij = Pengaruh kovarian (x) terhadap perlakuan ke-i dan ulangan ke-j
εij = Pengaruh galat perlakuan ke-i dan ulangan ke-j, j = 1, 2, 3, 4
Uji lanjut yang digunakan adalah uji Duncan.
Gambar 5 Pengambilan darah dari jantung pada tikus Sprague Dawley.
HASIL DAN PEMBAHASAN
Fraksi Polifenol Buah Delima
10
dengan kematangan buah. Buah matang memiliki persentase gula lebih tinggi pada glukosa (53.4%) dan fruktosa (46.6%) (Al-Maiman & Ahmad 2002). Nilai kadar air simplisia juga berpengaruh pada kadar rendemen polifenol yang terbentuk. Nilai kadar air 12.02±0.37% menunjukkan bahwa jumlah komponen selain air yang terkandung pada sampel sekitar 87.98% yang diantaranya terkandung komponen fenolik. Nilai kadar air ini tidak berbeda jauh dengan yang dilaporkan oleh Li Y et al. (2006) untuk sampel kering buah delima (pulp) sebesar 10.9±1.1%.
Fraksi polifenol buah delima diperoleh dari modifikasi metode maserasi satu tahap (batch mode) dengan pelarut aseton:air:asam asetat (90:9.5:0.5) (Hayouni et al. 2007). Modifikasi yang digunakan adalah lama ekstraksi yang ditentukan oleh perubahan warna ekstrak hingga kembali ke warna awal pelarut (± 3 x 24 jam) yang dilakukan pada shaker orbital
dengan kecepatan putar 120 rpm. Hal ini dimaksudkan untuk memperluas titik singgung antara pelarut dan serbuk kering buah delima sehingga proses ekstraksi polifenol berlangsung optimal.
Rendemen atau fraksi polifenol diperoleh dari hasil pengonsentrasian semua fraksi organik pada rotary evaporator atau rotavapor pada suhu 45°C kondisi vakum. Dari kadar sampel kering ±87.98% diperoleh rendemen (fraksi) polifenol sebanyak 36.2%. Goli et al.
(2004) menyebutkan bahwa banyaknya jumlah rendemen ekstrak bergantung pada pelarut dan metode ekstraksi. Metode ekstraksi batch mode
dengan pelarut aseton:air:asam asetat (90:9.5:0.5) dilaporkan mampu menghasilkan total komponen fenolik tertinggi pada Quercus coccifera L. dan Juniperus phoenica L. dibandingkan dengan menggunakan pelarut lain, seperti etanol, metanol, atau etil asetat (Hayouni et al. 2007). Singh et al. (2002) telah mengekstraksi antioksidan buah delima dan kulit buah delima dari beberapa pelarut secara individu. Pelarut-pelarut tersebut meliputi metanol, aseton, atau air. Rendemen antioksidan maksimum diperoleh dari ekstrak metanol, 23.1±1.5%.
Rendemen komponen fenolik buah delima yang diperoleh pada penelitian ini tergolong tinggi. Hal ini diduga oleh kemampuan kombinasi berbagai pelarut yang berbeda memberikan solubilitas yang lebih tinggi daripada pelarut individu. Rendemen ini lebih tinggi daripada rendemen antioksidan yang dilaporkan oleh Li Y et al. (2006) yang menggunakan kombinasi pelarut metanol, etanol, aseton, dan lain-lain dengan metode
yang telah dipatenkan pada Chinese Patent. Li Y et al. (2006) menyebutkan bahwa kadar air simplisia buah delima (pulp) sebesar 10.9±1.1%. Dengan kata lain, kandungan komponen non airnya sekitar 89.1% dan menghasilkan rendemen komponen fenolik sebesar 14.5±1.7%. Oleh karena itu, hal ini dapat dijadikan sebagai faktor koreksi dalam perbedaan aktivitas fraksi polifenol yang akan ditunjukkan pada uji in vivo. Hasil rendemen yang lebih tinggi pada penelitian ini diduga memiliki aktivitas antioksidan yang tinggi pula dalam menurunkan peroksidasi lipid.
Kondisi Hewan Coba
Hewan coba sebelumnya dilakukan adaptasi selama 19 hari untuk menghindari resiko timbulnya stres selama proses transportasi serta menyeragamkan pola makan ataupun pola hidup dengan lingkungan baru. Selama tahap adaptasi, tikus hanya diberi pakan standar serta dilakukan penimbangan bobot badan secara berkala setiap hari. Pakan standar yang digunakan diperoleh dari PT. Indofeed dengan komposisi yang tidak berbeda jauh dengan normal laboratory diet (Tabel 4) (Anila & Vijayalakshmi 2003). Secara keseluruhan semua tikus mengalami peningkatan bobot badan sebesar 40.12%. Uji statistika menunjukkan peningkatan secara signifikan (p<0.05). Bobot badan tikus rata-rata pada awal adaptasi sebesar 161.88±8.77 g yang tidak berbeda nyata (Fhit<Fα), sedangkan pada akhir adaptasi sebesar 226.82±9.43 g yang beragam (Fhit>Fα) (Gambar 6). Kenaikan bobot badan ini dipengaruhi oleh tingkat konsumsi pakan dan umur tikus yang berada dalam masa pertumbuhan (mature point), yaitu kurang dari 6 bulan. Umur tikus yang digunakan pada awal adaptasi adalah ±2 bulan. Kondisi ini menunjukkan tikus dalam keadaan sehat, tidak ada gangguan pertumbuhan, kalorinya tercukupi, serta tidak adanya zat toksikan dalam pakan (Lu 2006). Kondisi ini menjadi faktor yang penting agar dapat memperkecil nilai galat percobaan.
11
Tabel 4 Komposisi pakan standar tikus
Komposisi PT. Indofeed (%)
Normal laboratory diet (%)*
Protein kasar 18 21
Lemak 6 5
Serat kasar 6 4
Kadar abu 8 8
Kalsium 0.8 1
Fosfor 1.05 0.6
Ekstrak
-nitrogen bebas 53 53 *Sumber: Anila & Vijayalakshmi (2003)
Gambar 6 Bobot badan tikus masa adaptasi.
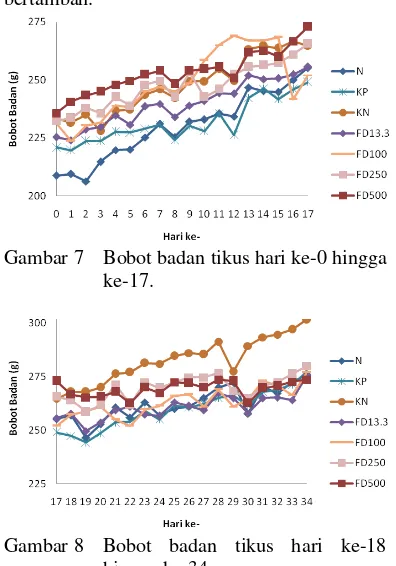
Perlakuan hewan coba dilanjutkan dengan induksi atau cekok parasetamol atau
para-asetilaminofenol dosis tinggi (500 mg/KgBB) selama 34 hari kecuali pada kelompok normal. Efek stres akibat pencekokan terlihat jelas dari peningkatan BB tikus yang fluktuatif (Gambar 7). Gan (1980) menyatakan bahwa pemberian parasetamol dalam dosis berlebih dapat menimbulkan gejala-gejala anoreksia, mual, muntah, serta sakit perut yang terjadi dalam 24 jam pertama, dan dapat berlangsung terus menerus selama seminggu atau lebih. Gejala-gejala inilah yang menyebabkan nafsu makan hewan coba menurun. Rata-rata BB tikus pada tahap ini meningkat 14.33 % secara nyata (p<0.05) dari 226.82±9.43 g menjadi 259.32±8.62 g dengan nilai BB tiap kelompok tidak berbeda nyata (Fhit<Fα). Peningkatan BB disebabkan oleh kondisi tikus yang masih dalam tahap pertumbuhan (<6 bulan). Peningkatan BB yang paling tinggi ditunjukkan oleh kelompok N, yaitu 22.28%. Kelompok lain yang diinduksi parasetamol menunjukkan peningkatan BB yang rendah, yaitu 12.67% (KP), 13.43% (KN), 13.46% (FD13.3), 8.93% (FD100), 14.35% (FD250), dan 15.84% (FD500).
Respon peningkatan BB yang rendah dan fluktuatif pun terlihat pada tahap perlakuan fraksi, yaitu dengan pencekokan parasetamol dan fraksi polifenol buah delima berbagai dosis ataupun Cursil®70. Peningkatan BB sebesar 8.05% teramati secara nyata (p<0.05) dari 259.32±8.62 g menjadi 280.19±9.66 g dengan nilai BB tiap kelompok tidak berbeda nyata
(Fhit<Fα) (Gambar 8). Peningkatan BB tikus terendah ditunjukkan oleh kelompok FD500 (0.24%). Peningkatan BB tikus yang lain adalah 8.13% (N), 11.38% (KP), 13.98% (KN), 7.82% (FD13.3), 9.92% (FD100), dan 5.4% (FD250). Kejadian ini diduga disebabkan oleh stres tikus akibat pencekokan ekstrak dan parasetamol secara bersamaan setiap hari (kecuali kelompok normal) yang mengakibatkan menurunnya nafsu makan. Selain itu, pertumbuhan bobot badan tikus yang semakin menurun juga dipengaruhi oleh bertambahnya umur. Gejala lain yang teramati adalah produksi urin dan waktu tidur yang bertambah.
Gambar 7 Bobot badan tikus hari ke-0 hingga ke-17.
Gambar 8 Bobot badan tikus hari ke-18 hingga ke-34.
Konsentrasi Lipid Peroksida Serum
Penelitian ini bertujuan menentukan aktivitas polifenol buah delima terhadap peroksidasi lipid darah tikus yang diinduksi parasetamol dosis 500 mg/KgBB. Kondisi fisik hewan coba yang teramati pada tiap kelompok belum bisa menggambarkan kondisi fisiologis yang terjadi. Stockham dan Scott (2008) menyebutkan bahwa profil konsentrasi lipid peroksida atau TBA-reacting substances
(TBARS) pada serum dapat menggambarkan kondisi hati akibat peroksidasi lipid oleh radikal yang teralirkan ke pembuluh vena.
Hari ke-0
12
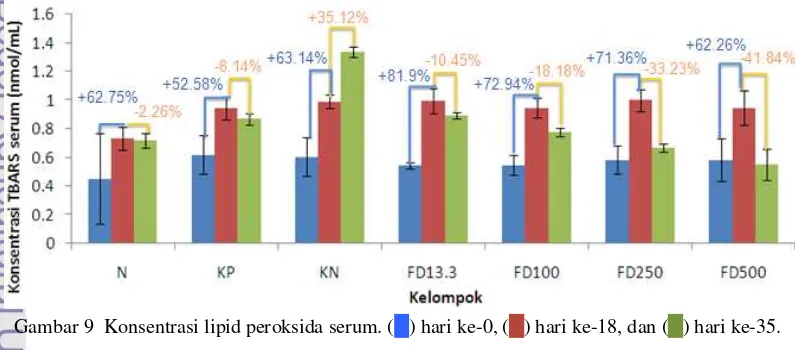
peroksida atau TBARS serum. Rataan konsentrasi TBARS pada hari ke-0 untuk semua tikus adalah 0.557±0.156 nmol/mL (p<0.05), dari rentang 0.023 nmol/mL hingga 0.76 nmol/mL dengan populasi 22 tikus. Hasil ini tidak berbeda dengan hasil penelitian Lavenia (2010) yang menunjukkan bahwa rata-rata konsentrasi lipid peroksida serum tikus pada hari ke-0 adalah 0.586±0.177 nmol/mL. Konsentrasi TBARS pada kelompok N, KP, KN, FD13.3, FD100, FD250, dan FD500 berturut-turut adalah 0.451±0.315 nmol/mL, 0.620±0.133 nmol/mL, 0.605±0.135 nmol/mL, 0.547±0.022 nmol/mL, 0.547±0.072 nmol/mL, 0.583±0.098 nmol/mL, dan 0.583±0.149 nmol/mL (Gambar 9). Secara statistik, konsentrasi TBARS tiap kelompok ini tidak berbeda nyata (Fhit<Fα), sehingga dapat disimpulkan bahwa keragaman bobot badan (Fhit>Fα) tidak selalu mempengaruhi konsentrasi TBARS serum. Myers dan Milton (1991) menyebutkan bahwa kondisi fisiologis awal yang bersifat kuantitatif (TBARS) disebut sebagai faktor kovarian yang dapat mempengaruhi keragaman nilai TBARS atau lipid peroksida selanjutnya. Konsentrasi lipid peroksida serum juga berbeda pada berbagai spesies. Misalnya lipid peroksida serum normal pada tikus jenis Rattus novergicus sebesar 2.99±0.11 nmol/mL (Mohamed et al. 2005), 3.41±0.57 nmol/mL pada jenis Wistar (Haidari
et al. 2009), sedangkan pada manusia (laki-laki) normal sebesar 3.42±0.94 nmol/mL (Yagi 1994).
Hari ke-18
Setelah tahap adaptasi, 17 hari selanjutnya tikus dicekok parasetamol dosis 500 mg/KgBB kecuali kelompok normal (N). Pemberian parasetamol ditujukan untuk meningkatkan radikal bebas yang dapat menginduksi aktivitas peroksidasi lipid (Muriel et al. 1992). Hasil penelitian menunjukkan konsentrasi TBARS
pada hari ke-18 mengalami peningkatan yang signifikan (p<0.05) dengan presentase yang berbeda pada tiap kelompok. Konsentrasi TBARS kelompok KP meningkat 52.58% menjadi 0.946±0.079 nmol/mL, sedangkan pada kelompok KN meningkat 63.14% menjadi 0.987±0.047 nmol/mL. Di sisi lain, konsentrasi TBARS kelompok FD13.3, FD100, FD250, dan FD500 berturut-turut mengalami peningkatan sebesar 81.9%, 72.94%, 71.36%, dan 62.26% dengan konsentrasi TBARS akhir masing-masing sebesar 0.995±0.088 nmol/mL, 0.946±0.068 nmol/mL, 0.999±0.075 nmol/mL, dan 0.946±0.118 nmol/mL.
Meningkatnya konsentrasi lipid peroksida (TBARS) yang terukur menggambarkan kondisi perusakan hati yang terus berlangsung dan gagalnya mekanisme pertahanan antioksidan endogen dalam kehadiran radikal bebas yang berlebih (Balamurugan et al. 2008). Murugesh et al. (2005) menjelaskan bahwa parasetamol dalam dosis terapetik dapat dimetabolisasi dan didetoksifikasi oleh hati dengan cara glukuronidisasi dan sulfasi sehingga dapat diekskresi melalui ginjal. Tetapi, ketika parasetamol sudah berada dalam dosis toksik, senyawa ini dikonversi ke dalam bentuk N-asetil-p-benzokuinonimina (NAPKI). NAPKI merupakan bentuk elektrofilik intermediet yang lebih toksik dan reaktif, hasil oksisdasi kompleks enzim sitokrom P450. NAPKI secara cepat bereaksi dengan glutation (GSH) dan mengawali penghabisan 90% total GSH pada sel dan mitokondria, sehingga mengakibatkan kematian hepatoseluler dan disfungsi mitokondria. Interaksi NAPKI dan GSH membetuk konjugat
GSH-acetaminophen, metabolit dengan kereaktifan yang lebih tinggi (Reszka et al. 2004). Selain itu, Nagy et al. (2007) menjelaskan induksi parasetamol dosis tinggi menyebabkan kematian sel hepatosit secara apoptosis maupun nekrosis.
13
Berbeda dengan kelompok lain, kelompok normal (N) tidak diberi perlakuan pencekokan parasetamol, tetapi dicekok akuades sebagai kontrol. Namun konsentrasi TBARS serum yang terukur mengalami peningkatan 62.75% pada hari ke-18 menjadi 0.734±0.079 nmol/mL. Peningkatan ini diduga disebabkan oleh kondisi stres oksidatif tikus akibat pencekokan akuades, yaitu stres elektron pada fosforilasi oksidatif membran dalam mitokondria menghasilkan jumlah anion peroksida (O2•-) yang tinggi sehingga meningkatkan peroksidasi lipid membran (Balamurugan et al. 2008). Namun jika konsentrasi TBARS keenam kelompok yang diinduksi parasetamol dibandingkan dengan kelompok normal, konsentrasi TBARS dianggap tidak berbeda nyata (Fhit<Fα). Artinya pada penelitian ini induksi parasetamol 500 mg/KgBB selama 17 hari belum mampu memberi pengaruh perusakan hati yang berarti. Hal ini diduga disebabkan oleh masih berperannya antioksidan endogen di dalam tubuh tikus terhadap NAPKI ataupun radikal bebas lainnya (Kaplan & Pesce 2010). Oleh karena itu, induksi parasetamol tetap diteruskan hingga hari ke-34 untuk mempertegas pengaruh parasetamol 500 mg/KgBB terhadap perusakan hati dan untuk meminimalisir pengaruh antioksidan endogen dalam menghambat peroksidasi lipid.
Hari ke-35
Percobaan dilanjutkan hingga hari ke-34 dengan perlakuan yang berbeda pada tiap kelompok. Kelompok normal (N) tetap dicekok akuades dan konsentrasi TBARS yang diperoleh menurun dari konsentrasi sebelumnya sebesar 2.26% menjadi 0.717±0.052 nmol/mL. Hasil uji statistik menunjukkan bahwa penurunan TBARS tidak berbeda secara signifikan (p=0.738). Penurunan ini diduga disebabkan oleh aktivitas pertahanan dari senyawa antioksidan endogen, seperti enzim katalase, superoksida dismutase (SOD), glutation peroksidase (GPx), dan protein glutation tereduksi (GSH) terhadap radikal (Stockham & Scott 2008). Profil kadar TBARS yang diperoleh pada penelitian ini merupakan acuan nilai konsentrasi TBARS bagi kelompok tikus lain sebagai kondisi normal.
Pada tahap akhir perlakuan, kelompok kontrol negatif (KN) tetap diinduksi parasetamol. Hasil penelitian menunjukkan bahwa konsentrasi TBARS tetap meningkat sebesar 35.12%, (p<0.0001) menjadi 1.335±0.035 nmol/mL seiring dengan
kontinuitas induksi parasetamol. Konsentrasi ini 86.19% lebih tinggi dari kondisi normal dan 120.66% meningkat selama 34 hari induksi. Konsentrasi TBARS yang terus meningkat ini didukung oleh teramatinya nekrosis sel atau kerusakan organ hepatosit akibat parasetamol secara anatomi dengan adanya bercak-bercak pada hati dan bilur steatosis yang tipis (Ariadini 2007). Hal ini diduga karena pada kelompok ini hanya diberi pakan standar, sehingga kurang cukup untuk mendapat antioksidan ataupun asupan nutrisi lain yang dapat menangkal radikal bebas ataupun regenerasi sel akibat induksi parasetamol.
Peningkatan konsentrasi lipid peroksida yang terjadi juga menggambarkan kondisi stres oksidatif pada sel hepatosit. Kondisi ini terjadi akibat aktivitas NAPKI dan konjugat
GSH-acetaminophen yang dapat meningkatkan pembentukan reactive oxygen species (ROS) seperti anion superoksida (O2•-), radikal
hidroksil (•OH), dan hidrogen peroksida (H2O2), serta reactive nitrogen species (RNS)
seperti nitrit oksida (•NO) dan peroksi nitrit. Jumlah ROS dan RNS yang meningkat dapat menyerang berbagai molekul biologis, seperti DNA, protein, dan fosfolipid yang mengawali proses peroksidasi lipid, nitrasi tirosin, dan pengurangan berbagai antioksidan enzim (Tiwari & Khosa 2010).
Kontradiksi dari kelompok KN adalah kelompok kontrol positif (KP) dan kelompok fraksi. Tikus kelompok KP diinduksi Cursil®70 dosis 13.3 mg/KgBB pada hari ke-18 hingga ke-34. Cursil®70 merupakan salah satu obat komersil yang mengandung ekstrak kurkumin dan silimarin yang berfungsi sebagai hepatoprotektor. Hasil penelitian menunjukkan bahwa konsentrasi TBARS serum menurun sebesar 8.14%, (p>0.05) yaitu 0.869±0.039 nmol/mL. Hasil ini juga dapat menjelaskan pendugaan kondisi hati tikus yang sedang mengalami perbaikan dan regenerasi sel walaupun belum optimal karena masih tinggi 21.03% dari konsentrasi normal.
14
Ekstrak silimarin mengandung campuran flavonolignan dan berbagai fraksi kimia yang belum diketahui dengan jelas. Silibin, komponen terbanyak pada silimarin dapat menstimulasi sintesis fosfatidilkolin dan meningkatkan aktifitas kolinfosfat sitidil transferase pada hati tikus kondisi normal dan kondisi setelah intoksikasi oleh galaktosamina. Fraksi polifenolik pada silimarin juga mampu memodifikasi profil lipoprotein plasma dan menghambat perkembangan perlemakan hati pada tikus. Silimarin dapat meningkatkan biosintesis protein hepatosit dan mempercepat regenerasi sel hati yang rusak. Silimarin juga
mampu menurunkan secara nyata aktivitas
-glutamil transpeptidase (GGT), alanin aminotransferase (ALT), dan aspartat aminotransferase (AST) serum pada hati yang rusak (Tedesco et al. 2004).
Profil konsentrasi TBARS serum kelompok fraksi polifenol menjadi parameter penting yang menjadi tujuan utama dalam penelitian ini. Vidal et al. (2003) menyebutkan bahwa LD50 pada ekstrak hidroalkoholik fenolik buah delima yang dicobakan pada mencit berkisar antara 565-945 mg/KgBB dengan nilai tengah 731 mg/KgBB. Jadi, nilai dosis terapetik yang boleh dipakai adalah <511.7 mg/KgBB pada tikus (Lampiran 12). Dosis yang digunakan per BB tikus adalah 13.3 mg/kg (FD13.3), 100 mg/kg (FD100), 250 mg/kg (FD250), dan 500 mg/kg (FD500).
Tikus kelompok fraksi diinduksi fraksi polifenol pada hari ke-18 hingga ke-34. Setelah pemberian fraksi, konsentrasi TBARS kelompok FD13.3, FD100, FD250, dan FD500 berturut-turut menurun sebesar 10.45%, 18.18%, 33.23%, dan 41.84%. Namun berdasarkan uji statistik, penurunan TBARS pada kelompok FD13.3 tidak berbeda nyata (p=0.5482) yang sebanding dengan penurunan yang ditunjukan oleh KP. Konsentrasi TBARS akhir pada FD13.3 adalah 0.54±0.022 nmol/mL. Hanya KP dan FD13.3 yang dikelompokan dalam satu kelompok yang sama pada uji lanjut Duncan. Hal ini menunjukkan bahwa dosis FD13.3 memberikan respon yang sama dengan KP (Cursil®70) yang menggambarkan belum adanya perbaikan kerusakan membran sel hepatosit secara nyata.
Hasil pengamatan juga menunjukan penurunan konsentrasi TBARS semakin besar seiring dengan peningkatan dosis. Uji statistik menunjukkan bahwa kelompok FD100, FD250, dan FD500 mampu menurunkan konsentrasi TBARS secara nyata (p<0.05). Respon penurunan TBARS terbaik ditunjukkan oleh dosis FD500 (500 mg/KgBB) (p<0.0001)
sebesar 41.84% dari 0.946±0.118 nmol/mL menjadi 0.55±0.457 nmol/mL. Konsentrasi akhir ini lebih rendah 23.4% dari konsentrasi TBARS kelompok normal. Aktivitas ini diduga disebabkan oleh kemampuan polifenol buah delima dalam menangkal radikal bebas (parasetamol) dalam dosis yang sama (500 mg/KgBB) dan kemampuannya untuk menginduksi regenerasi sel hepatosit (Nzaramba 2008). Jika fraksi polifenol dosis 500 mg/KgBB ini dikonsumsi oleh manusia (70 Kg), maka setiap harinya kira-kira manusia harus mengonsumsi 3.5 g fraksi polifenol buah delima atau 9.67 g simplisia buah delima. Dikarenakan 100 g simplisia pada penelitian ini diperoleh dari 5 buah delima, maka konsumsi setengah buah delima tiap hari untuk masyarakat diduga sebanding dengan dosis 500 mg/KgBB dalam menurunkan peroksidasi lipid hati.
Kemampuan fraksi polifenol buah delima dalam menurunkan konsentrasi lipid peroksida menunjukkan bahwa komponen-komponen polifenol buah delima berperan sebagai hepatoprotektor. Beberapa komponen fenolik buah delima seperti isomer punikalagin, turunan asam elagik, dan antosianin (delfinidin, sianidin, serta 3-glukosida dan 3,5-diglukosida pelargonidin) mampu menangkal radikal bebas dan menginhibisi peroksidasi lipid secara in vitro (Gil et al. 2000; Noda et al. 2002). Komponen polifenol terbanyak yang secara signifikan berkontribusi dalam aktivitas antioksidasi adalah α- dan - punikalagin. Beberapa komponen lain adalah elagitanin, asam elagik, antosianin, dan flavonoid. Reed et al. (2005) menambahkkan bahwa ester asam galik seperti punikalin dan punikalagin member aktivitas antioksidan tertinggi pada polifenol buah delima. Li Y et al. (2006) juga melaporkan bahwa ekstrak buah delima dan ekstrak kulit buah delima mengandung total fenolik, flavonoid, proantosianidin, dan asam askorbat yang teramati sebagai penangkap dan pencegah superoksida anion (O2•-), hidroksil
radikal (•OH), dan peroksil radikal.
Superoksida anion (O2•-) merupakan spesies radikal bebas yang digenerasikan secara berkala oleh beberapa proses seluler, meliputi sistem transport elektron pada membran dalam mitokondria dan mikrosom. Laju generasi O2• -ini diperparah oleh aktivitas NAPKI dan konjugat GSH-acetaminophen yang dapat meningkatkan pembentukan berbagai ROS yang dapat menimbulkan peroksidasi lipid.
15
(TBARS) sebesar 33.23% dari 0.999±0.075 nmol/mL menjadi 0.667±0.03 nmol/mL. Penurunan ini dianggap sangat berbeda nyata (p<0.01). Respon lain juga ditunjukkan oleh dosis FD100 (100 mg/KgBB), tetapi tidak lebih baik dari dosis FD250 dan FD500. Dosis FD100 dapat menurunkan konsentrasi lipid peroksida secara nyata (p=0.0250 atau 0.01<p<0.05) sebesar 18.18% dari 0.946±0.068 nmol/mL menjadi 0.774±0.028 nmol/mL. Li Y
et al. (2006) melaporkan bahwa ekstrak antioksidan buah delima memiliki aktivitas inhibisi sebesar 37.7% terhadap superoksida radikal. Namun, aktivitas antioksidan buah delima (pulp) lebih kecil daripada ekstrak kulit buah delima (peel) (Murthy et al. 2002; Li Y et al. 2006).
Hasil penelitian ini menggambarkan penurunan konsentrasi lipid peroksida yang diduga kuat disebabkan oleh aktivitas inhibisi dari fraksi polifenol buah delima (antioksidan eksogen) pada berbagai dosis. Pengerucutan pendugaan ini didasarkan pada semakin meningkatnya kadar TBARS pada kontrol negatif (KN) akibat penerusan cekok parasetamol selama 34 hari hingga akhir perlakuan. Kondisi ini menggambarkan gagalnya mekanisme pertahanan dari antioksidan endogen yang dimiliki oleh tikus tersebut.
SIMPULAN DAN SARAN
Simpulan
Induksi parasetamol meningkatkan konsentrasi lipid peroksida serum sebesar 35.12%. Fraksi polifenol buah delima dosis 13.3 mg/KgBB memiliki respon yang sama dengan Cursil®70 dalam menurunkan peroksidasi lipid sebesar 10.45% dan 8.14% (p>0.05). Fraksi dosis 100 mg/KgBB, dosis 250 mg/KgBB, dan 500 mg/KgBB mampu menurunkan konsentrasi lipid peroksida serum berturut-turut 10.45%, 18.18%, dan 33.23% (p<0.05) pada tikus yang diinduksi parasetamol.
Saran
Perlu dilakukan penelitian lanjutan untuk menguji parameter hepatoproteksi lain, seperti aktivitas enzim ALT, AST, ALP, GGT, SOD, katalase, GPx, GSH, dan bilirubin. Ulangan perlakuan perlu diperbanyak untuk memperkecil nilai keragaman. Dosis parasetamol perlu ditingkatkan agar memberi perbedaan yang nyata terhadap kelompok
normal. Lama perlakuan induksi fraksi juga perlu diperpanjang untuk mengetahui waktu optimal dalam memberikan efek hepatoproteksi. Desain percobaan untuk mengetahui potensi pencegahan dan uji aktivitas fraksi polifenol secara in vitro perlu dilakukan sebagai bahan perbandingan.
DAFTAR PUSTAKA
Ace Animal. 2006. Sprague Dawley. [terhubung berkala]. http://www. aceanimal.com/SpragueDawley.htm. [02 Mei 2010].
Adji P. 2004. Daya antioksidasi saponin akar kuning (archangelisia flava L. Merr.) sebagai mekanisme hepatoproteksi pada tikus yang diinduksi parasetamol [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Afaq F, Saleem M, Krueger CG, Reed JD, Mukhtar H. 2005. Anthocyanin and tanin-rich pomegranate fruit extract modulates MAPK and NfkappaB pathways and inhibits skin tumorigenesis in CD-1 mice.
Int J Cancer 113: 423-433.
Al-Maiman SA, Ahmad D. 2002. Changes in physical and chemical properties during pomegranate (Punica granatum L.) fruit maturation. Food Chem 76: 437-441.
Anila L, Vijayalakshmi NR. 2003. Antioxidant action of flavonoids from Mangifera indica and Emblica officinalis in hypercholesterolemic rats. Food Chem 83: 569-574.
Andersen M, Markham KR. 2006. Flavonoids: Chemistry, Biochemistry and Applications. Boca Raton: CRC Pr.
Anderson SC, Cockayne S. 2003. Clinical Chemistry Concepts and Aplication Revised Edition. New Castle: Saunders.
16
[AOAC Association Official Analytical Chemists]. 1995. Official Methods of Analysis. Ed ke-16. Washington DC: Association Official Analytical Chemists.
Aryadi Q. 2009. Potensi ekstrak air rosella sebagai hepatoprotektor pada tikus yang diinduksi parasetamol [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Aviram et al. 2000. Pomegranate juice consumption reduces oxidative stress, atherogenic modifications to LDL, and platelet aggregation: studies in human and in atherosclerotic apolipoprotein E-deficient mice. Am J Clin Nutr 71: 1064-1076.
Aviram M, Domfeld L. 2001. Pomegranate juice consumption inhibits serum angiotensin converting enzyme activity and reduces systolic blood pressure.
Atherosclerosis 158: 195-198.
Balamurugan M, Parthasarathi K, Ranganathan LS, Cooper EL. 2008. Hypothetical mode of action of earthworm extract with hepatoprotective and antioxidant properties. J Zhejiang Univ Sci B 9: 141-147.
Barnes J, Paget B. 1964. Evaluation of Drugs Activities: Pharmacometrics. New York: Mosby.
Batubara I. 2003. Saponin akar kuning (Archaengelisia flava (L.) Merr.) sebagai hepatoprotektor: ekstraksi, pemisahan, dan bioaktivitasnya [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Dalimartha S. 2005. Ramuan Tradisional untuk Pengobatan Hepatitis. Jakarta: Penebar Swadaya.
Das et al. 2001. Studies on the hypoglycaemic activity of Punica granatum seed in streptozotocin induced diabetic rats.
Phytother Res 15: 628-629.
De Nigris et al. 2005. Beneficial effects of pomegranate juice on oxidation-sensitive genes and endothelial nitric oxide synthase activity at sites of perturbed shear stress.
Proc Natl Acad Sci 102: 4896-4901.
Firmansyah M. 2006. Khasiat hepatoproteksi ekstrak daun sangitan (Sumbucus javanica Reinw.ex Blume.) pada tikus putih galur
Sprague Dawley yang diberi parasetamol [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Gan S et al. 1980. Farmakologi dan Terapi. Ed ke-2. Jakarta: UI Pr.
Ganong F. 2002. Buku Ajar Fisiologi Kedokteran. Ed ke-20. Djauhari HM, penerjemah. Jakarta: EGC. Terjemahan dari: Review of Medical Physiology.
Gibson GG, Sket P. 1991. Pengantar Metabolisme Obat. Aisyah BI, penerjemah. Jakarta: UI. Terjemahan dari:
Drugs Metabolism.
Gil MI, Tomas-Barberan FA, Hess-Pierce B, Holcroft DM, Kadeer AA. 2000. Antioxidant activity of pomegranate juice and its relationship with phhenolic composition and processing. J Agri and Food Chem 48: 4581-4589.
Goli AH, Baregar M, Sahari MA. 2004. Antioxidant activity and total phenolic compounds of pistachio (Pistachia vera) hull extract. Food Chem 92: 521-525.
Haidari F,