INDUKSI KERAGAMAN DUA VARIETAS KRISAN
(
Dendranthema grandiflora
Tzvelev) DENGAN ETIL METANA
SULFONAT (EMS) SECARA
IN VITRO
OLEH :
SYIFAUR RAHMAH (A24060719)
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
RINGKASAN
SYIFAUR RAHMAH. Induksi Keragaman Dua Varietas Krisan (Dendranthema grandiflora Tzvelev) dengan Etil Metana Sulfonat (EMS)
secaraIn vitro. Dibimbing oleh NURUL KHUMAIDA.
Krisan (Dendranthema grandiflora Tzvelev) merupakan salah satu komoditi tanaman hias yang paling banyak diproduksi dan diminati oleh pasar lokal maupun dunia. Namun terdapat kendala dalam pengembangannya diantaranya yaitu faktor lingkungan tumbuh, ketersediaan bibit unggul, dan varietas baru. Permasalahan tersebut dapat diatasi dengan pemuliaan krisan. Pemuliaan dapat dilakukan secara konvensional melalui persilangan maupun induksi mutasi secara in vitro. Mutasi dapat dilakukan dengan mutagen fisik, biologi, maupun kimia. Mutagen kimia yang sering digunakan adalah etil metana sulfonat (EMS).
Penelitian ini bertujuan untuk mempelajari pengaruh lama perendaman etil metana sulfonat (EMS) 0.77 % terhadap keragaman dua varietas krisan secara in vitro, meningkatkan keragaman genetik krisan (Dendranthema grandiflora
Tzvelev), dan mendapatkan mutan krisan yang potensial untuk dikembangkan sebagai bahan pemuliaan krisan lebih lanjut.
Lama perendaman EMS 0.77 % memberikan respon yang berbeda antara tanaman krisan varietas Chandra Kirana dan varietas Puspita Asri pada semua peubah kuantitatif, kecuali peubah tinggi tanaman. Pertumbuhan tinggi tanaman kedua varietas terhambat akibat lama perendaman EMS 0.77 %. Lama perendaman EMS 0.77 % umumnya menghambat pertumbuhan krisan varietas Puspita Asri, kecuali pada peubah jumlah stomata dan ukuran panjang stomata. Sebaliknya lama perendaman EMS 0.77 % umumnya meningkatkan pertumbuhan krisan varietas Chandra Kirana, kecuali pada jumlah stomata dan ukuran panjang stomata.
INDUKSI KERAGAMAN DUA VARIETAS KRISAN
(
Dendranthema grandiflora
Tzvelev) DENGAN ETIL METANA
SULFONAT (EMS) SECARA
IN VITRO
Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian Institut Pertanian Bogor
SYIFAUR RAHMAH
A24060719
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
Judul
:INDUKSI
KERAGAMAN
DUA
VARIETAS
KRISAN
(
Dendranthema
grandiflora
Tzvelev)
DENGAN ETIL METANA SULFONAT (EMS)
SECARA
IN VITRO
Nama
:
SYIFAUR RAHMAH
NIM
: A24060719
Menyetujui, Dosen pembimbing
Dr. Ir. Nurul Khumaida, MSi.
NIP. 19650719 199512 2 001
Mengetahui,
Ketua Departemen Agronomi dan Hortikultura Fakultas Pertanian IPB
Dr. Ir. Agus Purwito, MSc. Agr
NIP. 19611101 198703 1 003
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada 15 April 1989 sebagai anak pertama dari dua bersaudara dari pasangan Bapak Syamsuddin Yahya dan Ibu Junainah. Penulis memasuki pendidikan formal pertama pada tahun 1994 di MI. At-Taqwa Jakarta. Pada tahun 2003 penulis menyelesaikan studi di MTs. Al-Hikmah Jakarta. Penulis pernah menjadi bendahara OSIS (organisasi siswa) dan Majalah Sekolah sebagai peliput berita dan editor selama studi di sekolah tersebut. Pada tahun 2006 penulis lulus dari SMA Negeri 55 Jakarta.
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Allah SWT yang telah memberikan rahmat dan hidayah-Nya sehingga penelitian dan skripsi ini dapat diselesaikan dengan baik. Shalawat serta salam senantiasa penulis curahkan kepada Rasulullah Muhammad SAW.
Skripsi yang berjudul “Induksi Keragaman Dua Varietas Krisan (Dendranthema grandiflora Tzvelev) dengan Etil Metana Sulfonat (EMS) secara
In vitro” merupakan prasyarat untuk mendapat gelar Sarjana Pertanian.Penelitian ini menghasilkan beberapa mutan putatif yang dapat digunakan untuk penelitian selanjutnya.
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam penelitian dan penyusunan skripsi ini. Penulis juga berharap semoga skripsi ini dapat bermanfaat dan menambah wawasan bagi yang membacanya.
Bogor, Agustus 2011
UCAPAN TERIMA KASIH
Pada kesempatan ini, penulis menyampaikan terima kasih kepada :
1. Dr. Ir. Nurul Khumaida, MSi. selaku pembimbing yang telah memberikan bimbingan dan pengarahan selama penelitian dan proses penyusunan skripsi. 2. Dr. Desta Wirnas sebagai pembimbing akademik yang telah membimbing
penulis selama menjalani proses akademik.
3. Bapak Syamsuddin Yahya dan Ibu Junainah sebagai orangtua yang mendukung penuh penulis secara moril maupun finansial.
4. Muhammad Nofal sebagai adik penulis atas do’a dan dukungan serta kasih sayangnya
5. Balai Tanaman Hias (Balithi) Indonesia yang telah menyediakan mother plantuntuk bahan perbanyakan saat penelitian.
6. Ramdani, Raisa Baharuddin, Wening Prabawati, Leni Meliala, Limas Agung, yang telah membantu dan memberikan dorongan selama penelitian dan penyusunan skripsi.
7. Ka Asep, Mba’ Novi, Mba’ Prima, dan Teh Arrin yang banyak membantu
dalam pengumpulan literatur dan sekaligus teman diskusi selama penelitian dan penyusunan skripsi.
8. Ibu Juju, Teh Iif, dan Bapak Joko sebagai teknisi di Laboratorium Bioteknologi Tanaman I dan Laboratorium mikroteknik atas bantuan, bimbingan teknik dan kerjasamanya selama penelitian berlangsung.
9. Sadewi Maharani dan Chandra Catur Nugroho sebagai teman satu bimbingan dan seperjuangan dalam penelitian dan penyusunan skripsi.
DAFTAR ISI
Halaman
DAFTAR ISI... ix
DAFTAR TABEL... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN... xiv
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan... 4
Hipotesis... 4
TINJAUAN PUSTAKA ... 5
Biologi dan Syarat Tumbuh Krisan... 5
Krisan Varietas Chandra Kirana dan Puspita Asri ... 7
Kultur Jaringan ... 8
Induksi Mutasi... 10
Induksi Mutasi pada Krisan... 11
Etil Metana Sulfonat (EMS) sebagai Mutagen ... 12
Stomata dan Kloroplas dalam Sel Penjaga... 13
BAHAN DAN METODE ... 15
Tempat dan Waktu ... 15
Bahan dan Alat ... 15
Metode Penelitian... 16
Pelaksanaan Penelitian ... 17
Sterilisasi Alat, Media dan Lingkungan kerja... 17
Pembuatan Media... 18
Perbanyakan Planlet pada Media MS0 ... 18
Perendaman EMS dan Penanaman Ekplan ... 18
Analisis Stomata dan Jumlah Kloroplas pada Sel Penjaga ... 19
Pengamatan Penelitian ... 19
HASIL DAN PEMBAHASAN ... 22
Keadaan Umum Penelitian... 22
Persentase Eksplan Berkalus, Eksplan Bertunas, dan Eksplan Berakar ... 28
Tinggi Tanaman ... 30
Jumlah Daun... 32
Jumlah Tunas Tanaman... 34
Pertumbuhan Akar Tanaman... 37
Jumlah Stomata dan Kloroplas dalam Sel Penjaga ... 39
Ukuran Stomata... 43
Keragaman Warna Kalus ... 47
Keragaman pada Daun dan Batang ... 48
Analisis Keragaman Fenotipe pada Berbagai Peubah Pengamatan ... 50
KESIMPULAN DAN SARAN ... 51
Kesimpulan... 53
Saran... 53
DAFTAR PUSTAKA ... 54
DAFTAR TABEL
Nomor Halaman
1. Persentase Eksplan Mati dan Kontam pada Berbagai Perlakuan... 24 2. Rekapitulasi Hasil Sidik Ragam ... 27 3. Persentase Eksplan Berkalus, Eksplan Bertunas, dan Eksplan Berakar
pada 10 MST... 29 4. Pengaruh Faktor Lama Perendaman EMS terhadap Tinggi Tanaman... 31 5. Jumlah Daun per Planlet Hasil Interaksi Varietas dengan Lama
Perendaman EMS 0.77 % ... 33 6. Jumlah Tunas Tanaman Hasil Interaksi Varietas dengan Lama
Perendaman EMS 0.77 % ... 34 7. Pengaruh Faktor Tunggal Lama Perendaman EMS 0.77 % dan Varietas
terhadap Jumlah Akar pada 11 MST ... 38 8. Interaksi Varietas dengan Lama Perendaman EMS 0.77 % terhadap
Jumlah Stomata dan Kloroplas dalam Sel Penjaga... 40 9. Faktor Lama Perendaman EMS 0.77 % terhadap Ukuran Panjang
Stomata ... . 43 10. Interaksi Varietas dengan Lama Perendaman EMS 0.77 % terhadap
Ukuran Lebar Stomata ... 45 11. Frekuensi Keragaman Warna Kalus pada Berbagai Perlakuan Varietas
DAFTAR GAMBAR
Nomor Halaman
1. Beberapa Tipe Bunga Krisan. ... 7
2. Varietas Krisan ... 8
3. Alur Terjadinya Mutan Warna Bunga pada Krisan ... 12
4. Kultur In vitro yang Digunakan Sebagai Sumber Eksplan... 15
5. Perendaman Eksplan Krisan Var.Chandra Kirana dan Var.Puspita Asri dalam Larutan EMS 0.77 %... 19
6. Alur Pelaksanaan Penelitian ... 21
7. Kondisi Eksplan Varietas Puspita Asri Setelah Perendaman dalam EMS 0.77 % pada Lama Perendaman yang Berbeda... 22
8. Kondisi Planlet Krisan Varietas Puspita Asri saat 12 MST... 23
9. Ekplan Varietas Puspita Asri Perendaman EMS 0.77% Selama 90 menit yang Terkontaminasi oleh Cendawan... 25
10. Kalus Muncul pada Pangkal Batang Planlet Krisan var. Chandra Kirana Perendaman EMS 0.77 % Selama 90 menit saat 9 MST... 28
11. Rataan Tinggi Tanaman Pada Berbagai Perlakuan dan Umur Tanaman.... 30
12. Respon Tinggi Planlet Krisan Varietas Chandra Kirana Akibat Lama Perendaman EMS 0.77 % pada 10 MST. ... 31
13. Respon Tinggi Planlet Krisan Varietas Puspita Asri Akibat Lama Perendaman EMS 0.77 % pada 10 MST. ... 32
14. Respon Jumlah Daun Krisan Akibat Lama Perendaman EMS 0.77 % saat 10 MST. ... 34
15. Respon Jumlah Tunas Krisan Akibat Lama Perendaman EMS 0.77 % saat 10 MST ... 36
16. Keragaan Pertumbuhan Tunas In vitro Krisan Varietas Chandra Kirana saat 9 MST pada berbagai lama perendaman EMS 0.77 %. ... 37
17. Respon Jumlah Akar Krisan akibat Lama Perendaman EMS 0.77 % saat 10 MST. ... 39
19. Respon Jumlah Kloroplas Krisan Akibat Lama Perendaman EMS 0.77 % saat 10 MST... 42 20. Respon Ukuran Panjang Stomata Krisan Akibat Lama Perendaman EMS
0.77 % saat 10 MST... 44 21. Respon Ukuran Lebar Stomata Krisan Akibat Lama Perendaman EMS
0.77 % saat 10 MST... 46 22. Kalus pada varietas Chandra Kirana Saat 9 MST pada Perendaman EMS
DAFTAR LAMPIRAN
Nomor Halaman
1. Komposisi Media Murashige-Skoog (MS)... 59 2. Stomata pada Setiap Perlakuan Varietas dan Lama Perendaman EMS
PENDAHULUAN
Latar Belakang
Krisan (Dendranthema grandiflora Tzvelev) merupakan salah satu tanaman hias yang sangat populer di Indonesia. Bunga ini dibudidayakan oleh petani kecil hingga pengusaha besar pada lahan dengan ketinggian 600-1 200 m dpl. Petani kecil membudidayakan krisan dengan menerapkan teknologi sederhana, sedangkan pengusaha besar menggunakan teknologi modern berbasis agribisnis. Pengembangan krisan juga berdampak positif terhadap perekonomian di daerah pedesaan, khususnya terhadap peningkatan pendapatan petani dan masyarakat yang terlibat dalam pengembangannya.
Krisan merupakan tanaman hias terbanyak yang diproduksi oleh petani di Indonesia. Perkembangan produksi krisan terus mengalami kenaikan dari tahun 1998 sampai tahun 2008. Tahun 2008 jumlah produksi krisan mencapai 101 777 126 batang. Sentra produksi krisan di Indonesia yaitu Jawa Barat yang memproduksi sebanyak 51 451 094 tangkai. Produsen kedua yaitu Jawa Timur yang memproduksi sebanyak 29 962 606 tangkai krisan (www.bps.go.id).
Terdapat beberapa kendala dalam pengembangan krisan diantaranya yaitu faktor lingkungan tumbuh. Lingkungan yang mempengaruhi yaitu ketinggian tempat budidaya, suhu, dan lama penyinaran. Tanaman krisan memerlukan ketinggian 600-1 200 m dpl. Cassel (1998) menyatakan bahwa fase untuk pertumbuhan vegetatif membutuhkan suhu udara 20-26 oC, sedangkan pembungaan pada suhu 16-18 oC dengan kelembaban udara 70-80 %. Krisantini dalam Harjadi (1989) menyatakan untuk produksi bunga potong di daerah tropis, tanaman membutuhkan perlakuan hari panjang minimal 14.5 jam per hari dan suhu malam rendah (15.5 °C) untuk merangsang pertumbuhan dan mencapai panjang batang tertentu sebelum pembungaan.
Kendala lain adalah ketersediaan bibit krisan baru yang unggul. Krisan baru dengan berbagai keunikan bentuk petal, warna petal, banyaknya kuntum per tangkai perlu terus dirakit karena tanaman hias bersifat dinamis dan mengikuti
dari ketahanannya terhadap penyakit dan hama, serta ketahanannya terhadap waktu pajang (vaselife) jika sebagai bunga krisan potong.
Salah satu cara yang dapat dilakukan untuk mengatasi kendala tersebut adalah dengan pemuliaan melalui persilangan dan mutasi. Perbaikan tanaman krisan dengan persilangan sangat sulit dilakukan di Indonesia karena memerlukan suhu siang dan malam yang konstan, berkisar sekitar 17 oC dengan kelembaban relatif 70 %. Selain itu krisan mempunyai sifat self incompatibility
(Marwoto, 1999). Upaya perbaikan genetik tanaman krisan lebih menguntungkan dilakukan dengan pemuliaan mutasi. Mutasi pada tanaman yang diperbanyak secara vegetatif lebih efektif karena dapat mengubah satu atau beberapa karakter tanpa mengubah karakteristik kultivar asalnya (Datta and Gupta, 1981).
Berdasarkan data IAEA (International Atomik Energy Agency), saat ini terdapat sekitar 500 varietas tanaman hias di dunia yang dihasilkan melalui teknik mutasi, 211 di antaranya adalah varietas tanaman krisan (Dwimahyani, 2006). Mutasi pada tanaman krisan telah berkembang pesat dan banyak dilakukan oleh para pemulia tanaman di dunia. Menurut Soedjono (2003), telah dihasilkan 232 mutan krisan. Negara penghasil mutan krisan tersebut yaitu Belgia (3 mutan), Brazil (3 mutan), Belanda (80 mutan), Cina (21 mutan), Jerman (34 mutan), Hongaria (1 mutan), India (46 mutan), Jepang (14 mutan), Rusia (17 mutan), Polandia (6 mutan), Thailand (2 mutan), dan Amerika Serikat (1 mutan). Balai Tanaman Hias (Balithi) Indonesia telah merilis delapan varietas krisan baru hasil pemuliaan mutasi. Namun jika dibandingkan dengan kemajuan pemuliaan mutasi krisan di dunia, Indonesia masih tertinggal dari negara India, Cina, dan Jepang. Untuk itulah perlu dilakukan secara terus-menerus perakitan varietas krisan baru dengan teknik induksi mutasi.
Krisan varietas Puspita Asri dirilis oleh Balithi Indonesia pada tahun 2003. Tanaman ini adaptif untuk dataran sedang sampai tinggi. Morfologi tanaman yaitu tipe bunga spray, jenis bunga ganda, mahkota berwarna merah jambu dengan bunga tabung berwarna kuning. Mahkota krisan varieta Puspita Asri yang berwarna merah jambu memiliki peluang besar untuk menghasilkan keragaman jika dilakukan induksi mutasi. Warna mahkota merah jambu dapat berubah menjadi oranye, merah, putih, kuning, coklat, dan perunggu.
Pemuliaan dengan induksi mutasi dapat dilakukan dengan teknik kultur jaringan. Kultur jaringan merupakan suatu metode untuk mengisolasi bagian dari tanaman seperti protoplas, sel, sekelompok sel, jaringan, dan organ, serta menumbuhkannya dalam kondisi aseptik sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman utuh kembali (Gunawan, 1992). Induksi mutasi dengan kultur jaringan dapat dilakukan pada tingkat sel maupun jaringan, sehingga terdapat peluang yang tinggi untuk terjadinya keragaman yang diharapkan dan dapat diturunkan.
Keragaman pada kultur in vitro dapat ditingkatkan dengan pemberian mutagen baik secara fisik antara lain iradiasi sinar gamma maupun kimiawi yaitu menggunakan ethyl methane sulphonate (EMS) dan diethyl methane sulphonate
(DEMS). EMS umumnya menghasilkan mutasi titik atau mutasi gen, sedikit mutasi yang terpaut dan sedikit kerusakan pada kromosom sehingga sangat menguntungkan untuk kegiatan pemuliaan tanaman. Mutasi titik ini juga bersifat dapat diturunkan kepada generasi berikutnya.
Tujuan
Penelitian ini bertujuan untuk:
1. Mempelajari pengaruh lama perendaman etil metana sulfonat (EMS) 0.77 % terhadap keragaman dua varietas krisan secarain vitro.
2. Meningkatkan keragaman krisan (Dendranthema grandifloraTzvelev).
3. Mendapatkan mutan krisan yang potensial untuk dikembangkan sebagai bahan pemuliaan krisan lebih lanjut.
Hipotesis
1. Terdapat waktu perendaman etil metana sulfonat (EMS) 0.77 % yang terbaik yang menghasilkan keragaman varietas krisan.
2. Terdapat respon varietas krisan yang berbeda terhadap lama perendaman EMS 0.77 %.
TINJAUAN PUSTAKA
Biologi dan Syarat Tumbuh Krisan
Tanaman krisan termasuk famili Asteraceae. Secara taksonomi klasifikasi krisan yaitu sebagai berikut:
Kingdom : Plantae Divisi : Angiosperms Sub Divisi : Eudicots Kelas : Asterids
Ordo : Asterales
Famili : Asteraceae Genus : Dendranthema
Spesies :Dendranthema grandifloraTzvelev (www.wikipedia.or.id).
Tanaman krisan merupakan tanaman hari pendek (short day plant) yang secara alamiah di daerah sub tropis akan mengalami pertumbuhan vegetatif pada hari panjang (long day) pada musim panas dan akan mengalami perkembangan generatif pada hari pendek pada musim gugur. Menurut Gardner et al. (1991) tanaman hari pendek memerlukan panjang hari lebih pendek dari periode kritisnya untuk berbunga, sehingga akan segera berbunga apabila panjang hari atau jumlah jam terang kurang dari suatu batasan tertentu.
Tanaman krisan hibrida dan hasil mutasi banyak sekali dikembangkan untuk tujuan hortikultura, sehingga dihasilkan berbagai jenis keragaman bentuk dan warna bunganya. Menurut US National Chrysanthemum Society, Inc ., Krisan mekar dibagi 13 bentuk yang berbeda, sesuai dengan sistem klasifikasi internasional. Bentuk bunga dibagi berdasarkan bagaimana mahkota disusun:
1. Irregular Incurve (membengkok tidak rata): kelopak bunga tersembunyi, mahkota bunga yang menyembunyikan kelopak bunga juga ada yang bergantung membentuk “rok’(Gambar 1.a).
2. Reflex: kelopak bunga tersembunyi, dan mahkota bunga tersusun ke atas. 3. Regular Incurve (membengkok rata): hampir sama dengan irregular
sempurna. Kelopak bunga tersembunyi. Bentuk ini biasa disebut
“Chinese”(Gambar 1.b).
4. Decorative: Kelopak bunga tersembunyi dan mahkota bunga biasanya tidak tegak 90 derajat terhadap batang.
5. Intermediate Incurve: bentuk mekar antara Irregular dan Regular incurves baik ukuran dan bentuk. Biasanya memiliki kuntum yang longgar dan lebih luas. Kuntum bunga tersembunyi (Gambar 1.c).
6. Pompon: Bunga mekar berganda, ukuran kecil, dan bentuk nyaris bulat sempurna (Gambar 1.d).
7. Single/Semi-Double: bentuk mekar dengan menunjukkan kelopak bunga, memiliki 1 sampai 7 helai mahkota. Pada umumnya membentuk sudut kurang dari 90 derajat terhadap batang.
8. Anemone: Kelopak bunga tampak jelas, kadang-kadang terangkat dan dibayangi oleh mahkota.
9. Spoon: Kelopak bunga terlihat dan mahkota bunga berbentuk spatula panjang.
10.Quill: kelopak bunga tersembunyi dan mahkota bunga berbentuk seperti pipa.
11.Spider: Kelopak bunga tersembunyi dan mahkota bunga berbentuk seperti pipa dengan ujung berduri dan menggantung di sekitar batang.
12.Brush & Thistle: kelopak bunga terlihat. Mahkota bunga berbentuk seperti tabung dan menutupi seluruh kepala bunga atau sejajar dengan batang. 13.Exotic: Jenis mekar yang bertentangan dengan klasifikasi karena memiliki
atribut lebih dari satu dari semua tipe mekar yang ada. (www.asbindo.org)
mengakibatkan bunga yang dihasilkan cenderung berwarna kusam, pucat dan memudar.
Gambar 1. Beberapa Tipe Bunga Krisan : a)Irregular incurve, b)Regular incurve, c)Intermediate incurve, dan d) Pompon.
Krisantini dalam Harjadi (1989) menyatakan bahwa tanaman untuk produksi bunga potong di daerah tropis membutuhkan perlakuan hari panjang minimal 14.5 jam per hari dan suhu malam rendah (15.5 °C) untuk merangsang pertumbuhan dan mencapai panjang batang tertentu sebelum pembungaan. Cassel (1998) menambahkan pada budidaya krisan untuk pertumbuhan vegetatif membutuhkan suhu udara 20-26oC dan pembungaan pada suhu 16-18oC dengan kelembaban udara 70-80 % .
Krisan Varietas Chandra Kirana dan Puspita Asri
Krisan varietas Chandra Kirana (Gambar 2.a) dirilis pada tahun 1998 oleh Balai Penelitian Tanaman Hias (Balithi). Krisan ini adaptif pada dataran medium hingga tinggi. Umur tanaman dari krisan varietas Chandra Kirana yaitu 102-108 hari. Morfologi tinggi tanaman krisan var. Chandra Kirana yaitu 82.50 cm. Krisan varietas Chandra Kirana memiliki daun yang berbentuk bulat/lonjong menjari dengan tepi bergerigi sangat rapat. Krisan ini memiliki bunga pita yang berwarna ungu dan warna bunga tabung kuning. Tipe bunga yang
a b
dimiliki yaitu bunga ganda dengan jenis bunga Spray. Panjang tangkai bunga 83.1 cm. Inisiasi bunga terjadi 38.43 hari setelah perlakuan hari panjang dan memiliki waktu bunga mekar 84 hari.
Gambar 2. Varietas Krisan (a) Chandra Kirana dan (b) Puspita Asri (sumber : www.balithi.co.id)
Krisan varietas Puspita Asri (Gambar 2.b) dirilis pada tahun 2003 oleh Balai Penelitian Tanaman Hias (Balithi). Varietas krisan Puspita Asri ditawarkan oleh lembaga ini untuk komersialisasi dan dilepas melalui SK Mentan nomor: 508/Kpts/PD.210/10/2003, krisan varietas Puspita Asri memiliki umur tanaman 100-109 hari. Tanaman ini dapat mencapai tinggi 83 cm. Varietas krisan ini adaptif pada dataran medium dan tinggi. Bentuk bunga krisan var. Puspita Asri yaitu bunga ganda dan berjenis spray. Inisiasi bunga krisan varietas ini yaitu 37 hari setelah penyinaran buatan dihentikan. Selanjutnya varietas ini memiliki keunggulan yaitu ketahanannya dari terhadap penyakit karat.
Kultur Jaringan
Kultur jaringan merupakan suatu teknik untuk menumbuhkan sel, jaringan, dan organ tanaman dalam medium buatan secara aseptik dalam lingkungan terkendali agar beregenerasi membentuk tanaman sempurna (Wiendi, 1992). Wattimena et al. (1992) menambahkan teknik kultur jaringan ini disebut juga kulturin vitro(in vitro culture) yang berarti kultur di dalam gelas.
Tanaman memiliki kemampuan untuk mengontrol genetik dan potensial regenerasi yang disebut totipotensi. Kultur jaringan tanaman melibatkan ciri-ciri pada stimulan yang benar untuk menunjukkan totipotensi ini di bawah lingkungan aseptik dan terkontrol (in vitro). Bahan kimia dan fisik dibutuhkan untuk merawat
tanaman dalam kultur in vitro. Kebutuhan bahan kimia dipenuhi dengan memberikan nutrisi esensial dalam media pertumbuhan, sedangkan kebutuhan fisik dipenuhi dengan menciptakan sebuah lingkungan eksternal yang cocok (Adrian, 1979).
Umumnya media tumbuh menyediakan unsur penting untuk pertumbuhan dan perkembangan tanaman. Sumber karbon diperlukan untuk memenuhi energi tanaman untuk fotosintesis. Endress (1994) menyatakan terkadang dibutuhkan tambahan bahan organik seperti asam amino (arginin, asparagin, glutamin, glicin) dan vitamin (thiamin, piridoxin, asam pantotenik, myo-inositol) di dalam media. Asam amino ditambahkan untuk menambah suplai nitrogen dan vitamin diperlukan ketika vitamin di dalam tanaman itu sendiri tidak mencukupi. Media MS0 merupakan salah satu media yang sering digunakan dan mengandung unsur-unsur yang mencukupi untuk pertumbuhan tanaman (Lampiran 1).
Selain unsur esensial yang terkandung di dalam media terkadang terdapat zat pengatur tumbuh yang ditambahkan untuk memacu pertumbuhan tanaman. Sitokinin dan auksin merupakan dua kelas utama dalam pengatur tumbuh yang penting dalam kultur in vitro. Auksin merupakan kelas komponen yang menstimulasi pemanjangan sel akar dan perkembangan susunan akar dimana menghambat penyusunan tunas. Di sisi lain sitokinin menstimulasi proliferasi tunas, menginisiasi susunan kalus dan menghambat pengakaran (Dodds dan Roberts, 1995).
Selain faktor kimia, faktor fisik seperti suhu, cahaya, kelembaban relatif, dan pH merupakan syarat penting untuk pertumbuhan tanamanin vitro. Umumnya pH yang cocok untuk pertumbuhan eksplan in vitro yaitu 5.0-6.0. Media agar-agar tidak cukup kenyal jika pH di bawah 5.0, sedangkan pH yang lebih tinggi dari 6.0 menjadikan agar-agar terlalu keras (Chawla, 2000).
Profesor Murashige dari Universitas California membagi kultur in vitro
tanaman dengan merangsang pembentukan akar dan pertumbuhan (aklimatisasi) (Wetherell, 1982).
Induksi Mutasi
Mutasi adalah perubahan pada sekuen nukleotida dari molekul DNA. Mutasi dapat menyebabkan perubahan yang tampak pada organisme, yang disebut sebagai perubahan fenotipe (Brown, 1989). Organisme yang menunjukkan sifat fenotipe yang asli disebut tipe genotipe liar, sedangkan organisme yang telah mengalami mutasi disebut mutan.
Elisenstadt et al (1994) melaporkan mutasi dapat disebabkan antara lain oleh adanya mutagen. Aisyah (2006) menambahkan bahwa mutagen adalah wahana/agen yang dapat menyebabkan mutrasi. Mutagen dapat diklasifikasikan sebagai mutagen fisik, mutagen kimia, dan mutagen biologis. Mutagen fisik yaitu radiasi sinar x, sinar gamma, ultraviolet, dan neutron. Mutagen kimia diantaranya dari golongan alkylating agents seperti EMS (etil metana sulfonat), DES (Dietil sulfat), EL (etilenimin), dan juga kelompok analog-analog basanya.
Berdasarkan kerusakannya, mutasi dibedakan menjadi dua yaitu mutasi struktur basa dan mutasi sekuen basa (Tobin dan Morel, 1997). Mutasi juga dapat dikelompokkan berdasarkan besarnya sekuen DNA yang berubah, yaitu pada tingkat genom, kromosom, dan gen. Pada kegiatan pemuliaan mutasi yang diinginkan adalah mutasi pada tingkat gen atau mutasi titik atau perubahan pada sejumlah kecil segmen kromosom. Hal ini disebabkan perubahan pada sejumlah besar segmen kromosom sering menimbulkan pengaruh negatif seperti berkurangnya fertilitas pada tanaman (van Harten, 1998; Broetjes dan van Harten 1988).
Dilihat dari dunia pertanian, mutasi merupakan salah satu metode pemuliaan untuk meningkatkan keragaman genetik tanaman. Salah satu teknologi alternatif untuk mendapatkan genotipe-genotipe baru yaitu melalui kultur in vitro.
Aplikasi mutagen secara in vitro telah lazim digunakan dalam metode mutasi buatan seiring dengan keberhasilan aplikasi teknik perbanyakan in vitro
pada berbagai jenis tanaman. Prinsip dasar mutasi in vitro adalah meningkatkan frekuensi variasi somaklonal (Maluszynski, 1990) dan meningkatkan efektivitas variasi somaklonal (Ahloowalia, 1995) sehingga keragaman genetik tanaman diharapkan akan meningkat.
Teknik mutasi secara in vitro memiliki keunggulan antara lain mampu melibatkan sejumlah besar bahan tanam dan waktu yang dibutuhkan untuk mendapatkan mutan baru relatif lebih cepat dibandingkan teknik mutasi secaraex vitro (Ahloowalia, 1995). Kelebihan lainnya yaitu : 1) mutasi dapat dilakukan pada tingkat sel sehingga peluang untuk terjadinya khimera lebih kecil karena mutan yang dihasilkan berasal dari satu sel, 2) laju mutasi lebih tinggi karena masing-masing sel mengalami kontak langsung dengan mutagen, 3) dapat dilanjutkan dengan seleksi secara in vitro sehingga seleksi terhadap mutan menjadi lebih efisien (Chahal dan Gosal, 2006).
Induksi Mutasi pada Krisan
Berdasarkan data IAEA (International Atomik Energy Agency), saat ini terdapat sekitar 500 varietas tanaman hias di dunia yang dihasilkan melalui teknik mutasi, 211 di antaranya adalah varietas tanaman krisan (Dwimahyani, 2006). Mutasi pada tanaman krisan telah berkembang pesat dan banyak dilakukan oleh para pemulia tanaman di dunia. Menurut Soedjono (2003), telah dihasilkan 232 mutan krisan. Negara penghasil mutan krisan tersebut yaitu Belgia (3 mutan), Brazil (3 mutan), Belanda (80 mutan), Cina (21 mutan), Jerman (34 mutan), Hongaria (1 mutan), India (46 mutan), Jepang (14 mutan), Rusia (17 mutan), Polandia (6 mutan), Thailand (2 mutan), dan Amerika Serikat (1 mutan).
Perubahan alur warna mahkota bunga krisan dapat dilihat pada Gambar 3. Berdasarkan gambar tersebut dapat dilihat bahwa warna mahkota yang memiliki peluang lebih besar untuk mengalami perubahan warna setelah dimutasi yaitu warna merah jambu. Warna ini dapat berubah menjadi oranye, merah, putih, kuning, coklat dan perunggu. Warna kuning merupakan warna terakhir yang dapat dihasilkan dari mutasi krisan. Warna kuning memiliki peluang yang sangat kecil untuk berubah warna menjadi warna lain, perubahan mungkin terjadi dari intensitas warna kuning dari muda hingga pekat.
Gambar 3. Alur Terjadinya Mutan Warna Bunga pada Krisan (BroertjesdalamSchum dan Preil, 1998).
Etil Metana Sulfonat (EMS) sebagai Mutagen
Menurut Aisyah (2006) mutagen kimia lebih mudah tersedia dan kadang rasio mutan yang tidak diinginkan lebih baik dibandingkan hasil irradiasi fisik. Untuk pemuliaan tanaman, kelompok bahan kimia yang banyak digunakan adalah dari kelompok alkylating agents. Senyawa ini mengandung satu atau lebih kelompok alkil reaktif yang dapat ditransfer ke molekul lain pada posisi dimana kerapatan elektronnya tinggi.
Menurut Von Arnim (2005), EMS banyak digunakan sebab toksisitasnya tidak terlalu tinggi (moderate toxicity), memiliki efektifitas yang tinggi untuk menginduksi banyak mutasi (multiple mutation) per genom dan biasanya mutasinya berupa substitusi satu basa. Hasil penelitian Greene et al.(2003) pada tanaman arabidopsis menunjukkan 99 % mutasi yang terjadi akibat EMS (20-40 mM selama 10-20 jam) adalah perubahan dari GC menjadi AT dengan 53 % perubahan pada G dan 47 % perubahan pada C. Intensitas mutasi cukup tinggi yaitu terjadi pada 1/3 000 kilo basa atau 10 mutasi per genom.
Priyono dan Susilo (2002) menuliskan bahwa EMS mempunyai pengaruh negatif terhadap peubah-peubah pertumbuhan kulturin vitrosisik mikro kerk lily linier dengan meningkatnya aras konsentrasi EMS pada selang 0-0.25 %. Selain itu, EMS pada konsentrasi 0.05 % dapat berfungsi sebagai zat pengatur tumbuh. Ajijah (2009) menuliskan bahwa eksplan purwoceng yang diberi perlakuan EMS menunjukkan adanya peningkatan variasi fenotipe tunas. Variasi yang muncul yaitu tangkai daun besar, daun veriegata dan albino. Frekuensi variasi fenotipe tunas paling tinggi diperoleh pada perlakuan EMS 0.5 % selama 1 jam yaitu 12 % pada suhu kontrol dan 26.7 % pada suhu 23.3 ± 2.1oC.
Latadoet al.(2004) menuliskan bahwa tanaman krisan (Chrysanthemumcv. Inggrid) dengan bunga berwarna pink tua yang diberi perlakuan EMS 0.77 % (0.075 M) selama 1 jam dan 45 menit menghasilkan 5.2 % tanaman krisan mengalami perubahan warna mahkota bunga menjadi warna pink salmon, pink terang,bronze, kuning, dan salmon, sedangkan 89.6 % lainnya memiliki fenotipe yang seragam. Hal ini menunjukkan EMS merupakan mutagen yang efisien untuk menginduksi mutasiin vitropada krisan.
Keragaan Stomata dan Kloroplas dalam Sel Penjaga
mengkerut, sel-sel tersebut akan mengecil secara bersamaan kemudian menutup ruangan di antaranya (Campbell, 2004).
BAHAN DAN METODE
Tempat dan Waktu
Penelitian kultur in vitro dilaksanakan di Laboratorium Kultur Jaringan Tanaman, sedangkan pengujian stomata dilakukan di Laboratorium Mikro Teknik, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilakukan mulai bulan Januari sampai dengan Desember 2010.
Bahan dan Alat
Bahan tanaman yang digunakan adalah pucukin vitro(shoot tip) dari planlet krisan varietas Chandra Kirana (Gambar 4a) dan Puspita Asri (Gambar 4b), yang diperoleh dari Balai Penelitian Tanaman Hias, Cipanas.
Gambar 4. Kultur In vitro yang Digunakan Sebagai Sumber Eksplan. (a) Krisan var. Chandra Kirana dan (b) Krisan var. Puspita Asri.
Media perbanyakan yang digunakan yaitu MS0, sedangkan media kultur setelah perlakuan EMS adalah media MS dengan penambahan 1 ppm BAP. Bahan kimia lain yang dipakai yaitu etil metana sulfonat (EMS), komposisi media MS, BAP, aquades, spiritus, agar-agar, dan sukrosa.
Alat-alat yang digunakan meliputi Laminar Airflow Cabinet (LAC),
autoclave, stearer, shaker, neraca analitik, botol kultur, gelas piala, gelas ukur, cawan petri, pipet volumetrik, pinset, skalpel, pH meter, tissue, plastik, karet gelang, handsprayer, bunsen, korek api, rak kultur yang dilengkapi lampu fluorescence, alat tulis, kamera digital, dan mikroskop.
Metode Penelitian
Percobaan untuk peningkatan keragaman krisan ini dilakukan dengan menggunakan rancangan faktorial dua faktor yaitu varietas krisan dan lama perendaman EMS (etil metana sulfonat) yang disusun secara acak lengkap (RAL). Faktor pertama adalah varietas yang terdiri dari dua varietas yaitu Chandra Kirana dan Puspita Asri, sedangkan faktor kedua adalah lama perendaman EMS 0.77 % sebanyak empat taraf yaitu kontrol (0 menit), 90 menit, 105 menit, dan 120 menit. Kontrol dilakukan dengan perendaman eksplan dalam akuades steril.
Setiap kombinasi perlakuan diulang sebanyak 10 botol, sehingga keseluruhannya terdiri dari 80 botol satuan percobaan. Setiap satu botol satuan percobaan terdiri dari dua eksplan krisan, sehingga eksplan yang digunakan sejumlah 160 eksplan tunasin vitro.
Model rancangan yang digunakan adalah: Yijk= µ + αi+ βj+ (αβ)ij+ Єijk
Keterangan:
Yijk = nilai pengamatan dari satuan percobaan perlakuan varietas ke-i, karena
lama pertendaman EMS ke-j dan ulangan ke-k µ = nilai rataan umum
αi = pengaruh perlakuan varietas ke-i
βj = pengaruh perlakuan lama perendaman EMS ke-j
(αβ)j =pengaruh interaksi perlakuan varietas ke-i dan perlakuan lama
perendaman EMS ke-j
Єijk = galat percobaan
i = 1, 2
j = 1, 2, 3, 4
k = 1, 2, 3, 4, 5, 6, 7, 8, 9, 10
Analisis Keragaman Fenotipe dilakukan dengan perhitungan % KKF (Koefisien Keragaman Fenotipe). Rumus dan kriteria keragaman tersebut yaitu sebagai berikut :
% KKF = Standar deviasi populasi perlakuan x 100 % Rataan populasi perlakuan
Kategori keragaman berdasarkan % KKF yaitu : 0.00 < % KKF≤ 24.91 sempit 24.91 < % KKF≤ 49.71 agak sempit 49.71 < % KKF≤ 74.71 agak luas 74.71 < % KKF≤ 99.65 luas
≥ 99.65 sangat luas
(Murdaningsihet al.,1999)
Pelaksanaan Penelitian
Sterilisasi Alat, Media dan Lingkungan kerja
alat tanam dan botol kultur dicuci bersih kemudian dikeringkan. Alat-alat tanam danpetri dishdibungkus rapi terlebih dahulu dengan kertas. Media dan aquades juga disterilkan dalam autoklaf. Aquades dimasukkan dalam wadah kecil (erlenmeyer atau botol kultur) dengan isi maksimum 100 ml agar lebih efektif bila digunakan.
Semua alat dan bahan disterilkan dengan menggunakan autoklaf pada tekanan 0.12 Mpa dan suhu 121oC dengan waktu sterilisasi untuk botol kultur dan alat tanam selama 30 menit, dan untuk media 15 menit. Persiapan sebelum penanaman yaitu bagian dalam laminar air flow cabinet (LAC) sebelum digunakan disinari terlebih dahulu dengan sinar UV selama 1 jam. Setelah itu permukaan bagian dalam disemprot dengan alkohol 70 % dan dibersihkan dengan tisu. Hal ini dilakukan sebelum dan setelah penanaman.
Pembuatan Media
Media yang digunakan untuk perbanyakan dan pertumbuhan adalah media MS0. Media MS dibuat dengan mencampur larutan stok (A, B, C, D, E, F, Myo-inositol dan vitamin) yang ditambah 30g/l gula, dan 7 g/l agar-agar seperti pada Lampiran 1. Kemudian ditambahkan KOH/NaOH atau HCl pada media sehingga diperoleh pH 5.9, setelah itu dididihkan. Setelah mendidih, 25 ml larutan dituang ke dalam botol kultur yang telah disterilisasi, kemudian ditutup dengan plastik dan diikat dengan karet gelang. Botol-botol yang telah diisi media tersebut disterilisasi dalam autoklaf dengan tekanan 75.1 psi dan suhu 121oC selama 20 menit.
Perbanyakan Planlet pada Media MS0
Perbanyakan sumber eksplan krisan dilakukan sebelum perlakuan agar jumlah eksplan menjadi cukup. Perbanyakan menggunakan metode kultur mata tunas yang dilakukan di dalam LAC. Induk planlet yang telah ada dipotong-potong setiap satu mata tunas. Potongan eksplan direndam di dalam air yang telah diberi 2-3 tetes antiseptik. Selanjutnya eksplan ditanam di media MS0 dengan posisi tegak. Perbanyakan dilakukan dengan menanam lima eksplan dalam setiap botol kultur.
Perendaman EMS dan Penanaman Ekplan
Perendaman dan penanaman eksplan dilakukan di dalam LAC yang telah diberi perlakuan ultra violet (UV) selama satu jam dan disterilkan dengan alkohol 70 %. Eksplan direndam dan dikocok secara manual pada larutan EMS 0.77 % selama 90 menit, 105 menit, dan 120 menit (Gambar 5). Perlakuan kontrol dilakukan dengan perendaman eksplan di dalam air steril selama 120 menit. Perlakuan perendaman dilakukan di dalam laminar Eksplan yang digunakan adalah kultur tunas pucuk dari planlet krisan dengan panjang 0.5-1.0 cm. Eksplan yang telah direndam kemudian dicuci dengan air steril sebanyak tiga kali selama 15 menit.
Gambar 5. Perendaman Eksplan Krisan Var. Chandra Kirana (kiri) dan Var.Puspita Asri (kanan) dalam Larutan EMS 0.77 %.
Analisis Stomata dan Jumlah Kloroplas pada Sel Penjaga
Persiapan dilakukan di dalam laminar dengan menggunting dan mengeluarkan daun dari botol kultur. Masing-masing perlakuan diambil 10 daun sebagai sampelnya dan dimasukkan ke dalam kantung plastik kecil tiap perlakuan. Tahap berikutnya dilakukan di Laboratorium Mikro Teknik Departemen Agronomi dan Hortikultura, Institut Pertanian Bogor. Daun yang telah tersedia diletakkan di kaca preparat dan direkatkan solatip pada bagian bawah daun. Kemudian solatip dibuka sebagian agar bagian atas daun terlihat. Selanjutnya dilakukan pengerokan lapisan atas daun dengan bantuan pinset atau silet sampai hanya tersisa lapisan tipis bagian bawah daun. Tahap terakhir yaitu meletakkan kaca preparat di atas meja mikroskop dan dilakukan pengaturan pembesaran hingga stomata dan kloroplas terlihat jelas.
Pengamatan Penelitian
Pengamatan dilakukan mulai 1-12 minggu setelah tanam (MST) pada media kultur, pada peubah sebagai berikut:
1. Peubah Kuantitatif
a) Persentase kontaminasi
Pengamatan dilakukan setiap minggu dengan melihat keadaan tanaman maupun media yang terkontaminasi oleh cendawan atau bakteri.
b) Waktu munculnya tunas pertama
[image:33.612.264.401.79.184.2]c) Persentase eksplan bertunas
Pengamatan dilakukan setiap minggu dengan melihat eksplan yang bertunas dari eksplan yang hidup.
d) Jumlah tunas per eksplan
Pengamatan ini dilakukan setiap minggu dengan menghitung jumlah tunas yang muncul.
e) Persentase eksplan berkalus
Pengamatan dilakukan setiap minggu dengan melihat adanya kalus pada eksplan.
f) Tinggi tanaman
Pengamatan dilakukan setiap minggu, pengukuran dilakukan mulai dari atas media hingga tunas yang tertinggi. Pada proses pengukuran, tanaman tidak dikeluarkan dari botol kultur, sehingga digunakan penggaris yang ditempel pada botol kultur.
g) Jumlah daun total per eksplan
Pengamatan dilakukan setiap minggu pada daun yang telah membuka penuh.
h) Jumlah akar total
Pengamatan dilakukan setiap minggu, mulai 1-12 MST. Pengamatan dilakukan mulai dari akar yang muncul pertama kali.
i) Persentase eksplan berakar
Pengamatan dilakukan pada jumlah planlet yang berakar. Penghitungan dilakukan di akhir pengamatan tanaman dalam botol.
j) Jumlah stomata dan kloroplas
Jumlah stomata per bidang pandang dan jumlah kloroplas pada sel penjaga diamati dengan perbesaran 400 kali pada mikroskop pada 12 MST.
2. Peubah Kualitatif
Pengamatan umumnya dilakukan setiap dua minggu sekali sejak 1-12 MST saat eksplan di dalam botol.
a) Perubahan warna dan bentuk daun
b) Perubahan warna batang c) Perubahan warna kalus
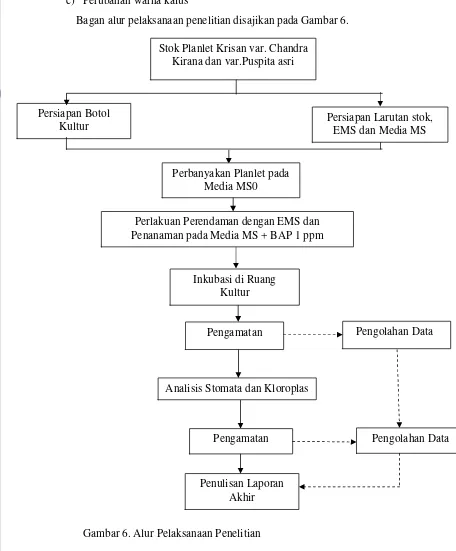
[image:35.612.84.540.106.657.2]Bagan alur pelaksanaan penelitian disajikan pada Gambar 6.
Gambar 6. Alur Pelaksanaan Penelitian
Stok Planlet Krisan var. Chandra Kirana dan var.Puspita asri
Persiapan Botol Kultur
Pengolahan Data Pengolahan Data
Penulisan Laporan Akhir Pengamatan Pengamatan
Persiapan Larutan stok, EMS dan Media MS
Perbanyakan Planlet pada Media MS0
Perlakuan Perendaman dengan EMS dan Penanaman pada Media MS + BAP 1 ppm
Inkubasi di Ruang Kultur
HASIL DAN PEMBAHASAN
Keadaan Umum Penelitian
Penelitian diawali dengan perbanyakan planlet krisan dari kedua varietas yang diuji, yaitu varietas Chandra Kirana dan Puspita Asri. Perbanyakan dilakukan dengan menggunakan stek satu mata tunas, dimana di dalam setiap botol kultur terdiri dari lima eksplan krisan. Media perbanyakan yang digunakan berupa MS0 (Lampiran 1). Penyimpanan eksplan hasil perbanyakan dilakukan di dalam ruang kultur yang bersuhu 18-22 oC dengan pencahayaan penuh selama 24 jam.
Eksplan yang digunakan untuk perlakuan lama perendaman etil metana sulfonat (EMS) berupa pucuk. Keragaan eksplan seragam dengan rataan tinggi 0.5 cm, berdaun dua helai, tanaman segar, daun dan batang berwarna hijau. Tunas yang telah direndam EMS 0.77 % dibilas dengan aquades steril sebanyak tiga kali selama 15 menit. Kemudian eksplan ditanam ke media MS yang ditambah 1 ppm BAP.
[image:36.612.250.416.524.647.2]Setelah perendaman EMS 0.77 % selama waktu perlakuan (0, 90, 105, dan 120 menit) dihasilkan kondisi eksplan yang beragam. Eksplan varietas Puspita Asri pada perlakuan kontrol terlihat lebih hijau dan segar jika dibandingkan dengan perlakuan perendaman EMS 0.77 %. Semakin lama perendaman eksplan dalam EMS 0.77 % akan semakin coklat warna eksplan yang dihasilkan (Gambar 7). Hal serupa juga terjadi pada eksplan varietas Candra Kirana.
Gambar 7. Kondisi Eksplan Varietas Puspita Asri Setelah Perendaman dalam EMS 0.77 % pada Lama Perendaman yang Berbeda.
kontrol 90 menit
Gambar 8. Kondisi Planlet Krisan Varietas Puspita Asri saat 12 MST a-d : Berturut-turut Perendaman EMS 0.77 % Selama 0, 90, 105, dan 120 menit.
Eksplan hasil perendaman EMS 0.77 % mengalami regenerasi yang baik setelah dikulturkan pada media MS + BAP 1 ppm. Pada varietas Puspita Asri, eksplan hasil perendaman yang terlihat coklat sebelum ditanam (Gambar 7) dapat tumbuh menjadi planlet yang hijau setelah dikulturkan pada media MS + BAP 1 ppm dan diinkubasi di dalam ruang kultur selama 12 MST (Gambar 8).
Regenerasi ini diduga terjadi karena sel dan jaringan eksplan masih hidup walaupun sudah berwarna coklat sehingga masih dapat menyerap nutrisi dari media. Media MS merupakan media dengan kandungan unsur makro dan mikro yang cukup lengkap bagi pertumbuhan dan perkembangan tanaman. Selain itu BAP 1 ppm yang ditambahkan juga mempengaruhi pertumbuhan sel tanaman. Gunawan (1992) menyatakan bahwa sitokinin adalah turunan dari adenin. Golongan ini sangat penting dalam pengaturan pembelahan sel dan morfogenesis. Menurut Siringo ringo (2009), BAP merupakan jenis sitokinin yang sangat efektif dalam menginduksi pertumbuhan tunas.
Tanaman yang telah diberi perlakuan perendaman EMS mengalami kontaminasi mulai 1 MST dan semakin meningkat setiap minggunya. Perlakuan yang menghasilkan kontaminasi terbanyak pada varietas Chandra Kirana yaitu perendaman EMS 0.77 % selama 105 menit (Chandra Kirana-150 menit) sebesar 65 %. Kontaminasi terbanyak pada varietas Puspita Asri dihasilkan oleh perlakuan EMS 0.77 % selama 120 menit (Puspita Asri-120 menit) sebesar 50 % (Tabel 1). Tanaman yang terkontaminasi dan tidak dapat diselamatkan dianggap sebagai data yang hilang.
[image:37.612.134.507.80.224.2]Tabel 1. Jumlah dan Persentase Eksplan Krisan yang Mati dan Terkontaminasi pada Berbagai Perlakuan dari Awal sampai Akhir Pengamatan .
Varietas
Lama Perendaman EMS
0.77 % (menit)
Total Eksplan Jumlah Eksplan Mati Jumlah Eksplan Terkontaminasi Sisa Eksplan Hidup Chandra Kirana
0 20 6 (30) 12 (60) 2 (10)
90 20 6 (30) 7 (35) 7 (35)
105 20 3 (15) 13 (65) 4 (20)
120 20 11 (55) 4 (20) 5 (25)
Puspita Asri
0 20 0 (0) 7 (35) 13 (65)
90 20 7 (35) 9 (45) 4 (20)
105 20 6 (30) 6 (30) 8 (40)
120 20 8 (40) 10 (50) 2 (10)
Keterangan : Angka dalam kurung menunjukkan persentase.
Jumlah eksplan mati secara umum semakin meningkat dengan semakin bertambahnya lama perendaman EMS 0.77 % (Tabel 1). Kematian eksplan ditandai dengan perubahan warna eksplan tunas dari hijau menjadi coklat kehitaman atau putih setelah diberi perlakuan perendaman EMS 0.77 %. Selain itu eksplan juga menjadi layu dan tidak vigor lagi, sehingga ada beberapa eksplan yang tidak dapat ditanam. Eksplan yang berwarna coklat kehitaman yang ditanam tetapi tidak tumbuh selama masa pengamatan juga dianggap sebagai eksplan mati.
Kematian ekplan yang semakin tinggi dengan semakin bertambahnya lama perendaman EMS 0.77 % diduga terjadi karena toksisitas yang semakin bertambah pada tanaman. Priyono dan Susilo (2002) menyatakan bahwa semakin lama waktu perendaman EMS menyebabkan semakin tinggi kadar EMS terserap ke dalam tanaman termasuk bertambahnya toksisitas EMS. Poerba et al. (2009) menyatakan semakin tinggi konsentrasi EMS, maka semakin rendah kemampuan eksplan petiola iles-iles (Amorphophallus muelleri) untuk bertahan hidup dan beregenerasi.
tinggi dibandingkan dengan jaringan yang diberi perlakuan konsentrasi EMS lebih rendah dan waktu perendaman lebih singkat.
Kontaminasi paling banyak disebabkan oleh cendawan (Gambar 9). Kontaminasi oleh cendawan yang terjadi saat penelitian diduga terjadi karena adanya peningkatan suhu dan kelembapan di ruang kultur pada saat inkubasi. Hal ini terjadi karena pendingin ruangan (AC) sempat rusak pada saat penelitian berlangsung. Gandjar, et al. (2006) menyatakan bahwa pertumbuhan cendawan (jamur) dipengaruhi oleh faktor substrat, cahaya, kelembaban, suhu, derajat keasaman substrat (pH) dan senyawa-senyawa kimia di lingkungannya. Carlile dan Watkinson (1995) menambahkan bahwa suhu maksimum kebanyakan fungi atau cendawan untuk tumbuh berkisar 30⁰C sampai 40 ⁰C dan optimalnya pada suhu 20⁰C sampai 30⁰C.
Gambar 9. Ekplan Varietas Puspita Asri Perendaman EMS 0.77% Selama 90 menit yang Terkontaminasi oleh Cendawan.
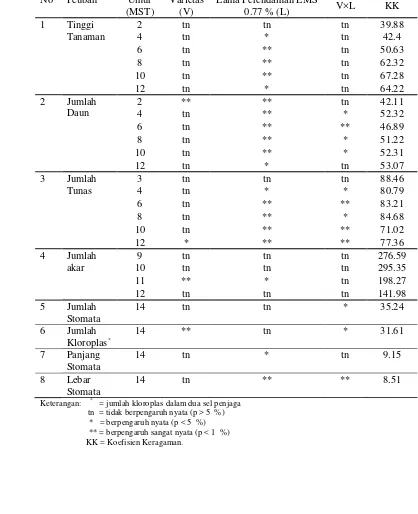
Data hasil rekapitulasi sidik ragam (Tabel 2) menggambarkan bahwa varietas tidak berpengaruh pada hampir semua peubah kecuali pada peubah jumlah daun saat 2 MST, jumlah tunas saat minggu akhir 12 MST, jumlah akar pada 11 MST, dan jumlah kloroplas pada sel penjaga stomata. Interaksi antara varietas dengan lama perendaman EMS 0.77 % berpengaruh nyata terhadap peubah jumlah daun, jumlah tunas, jumlah stomata, jumlah kloroplas dalam sel penjaga serta ukuran lebar stomata. Namun demikan, interaksi antara varietas dengan lama perendaman EMS 0.77 % tidak berpengaruh nyata terhadap tinggi tanaman dan jumlah akar (Tabel 2).
[image:39.612.240.400.315.436.2]berpengaruh sangat nyata pada 2-10 MST dan berpengaruh nyata saat 12 MST. Lama perendaman EMS 0.77 % juga berpengaruh nyata pada peubah jumlah tunas tanaman pada 4 MST dan berpengaruh sangat nyata saat 6-12 MST. Selanjutnya peubah jumlah akar tanaman juga dipengaruhi secara nyata oleh lama perendaman EMS 0.77 % saat 11 MST. Pengujian stomata menggambarkan bahwa lama perendaman EMS 0.77 % berpengaruh nyata pada ukuran panjang stomata dan berpengaruh sangat nyata pada lebar stomata (Tabel 2).
Tabel 2. Rekapitulasi Hasil Sidik Ragam Seluruh Peubah Kuantitatif
No Peubah Umur
(MST)
Varietas (V)
Lama Perendaman EMS
0.77 % (L) V×L KK
1 Tinggi
Tanaman
2 tn tn tn 39.88
4 tn * tn 42.4
6 tn ** tn 50.63
8 tn ** tn 62.32
10 tn ** tn 67.28
12 tn * tn 64.22
2 Jumlah
Daun
2 ** ** tn 42.11
4 tn ** * 52.32
6 tn ** ** 46.89
8 tn ** * 51.22
10 tn ** * 52.31
12 tn * tn 53.07
3 Jumlah
Tunas
3 tn tn tn 88.46
4 tn * * 80.79
6 tn ** ** 83.21
8 tn ** * 84.68
10 tn ** ** 71.02
12 * ** ** 77.36
4 Jumlah
akar
9 tn tn tn 276.59
10 tn tn tn 295.35
11 ** * tn 198.27
12 tn tn tn 141.98
5 Jumlah
Stomata
14 tn tn * 35.24
6 Jumlah
Kloroplas*
14 ** tn * 31.61
7 Panjang
Stomata
14 tn * tn 9.15
8 Lebar
Stomata
14 tn ** ** 8.51
Persentase Eksplan Berkalus, Eksplan Bertunas, dan Eksplan Berakar
Pertumbuhan eksplan tunas krisan varietas Chandra Kirana dan Puspita Asri setelah perlakuan lama perendaman EMS 0.77 % yang berbeda menghasilkan respon yang berbeda dalam kemampuan eksplan untuk beregenerasi. Hal ini merupakan suatu indikasi adanya pengaruh fisiologis dari mutagen pada mutagenesis di dalam sel dan jaringan eksplan.
Kalus mulai terbentuk saat 3 MST pada varietas Chandra Kirana perlakuan kontrol, perendaman EMS 0.77 % selama 90 dan 105 menit. Perendaman EMS 0.77 % selama 120 menit pada Chandra Kirana dan seluruh perlakuan perendaman pada varietas Puspita Asri menghasilkan kalus saat 4 MST. Lama perendaman EMS 0.77 % tidak menunjukkan adanya kecenderungan pola pada persentase tumbuh kalus eksplan krisan. Hal ini dapat dilihat dari fluktuasi persentase kalus terhadap lama perendaman EMS 0.77 % yang berbeda (Tabel 3).
[image:42.612.251.390.496.621.2]Kalus terbentuk pada pangkal batang tanaman (Gambar 10), tetapi terdapat sebagian kecil kalus yang tumbuh pada daun tanaman. Kalus tumbuh pada bagian pangkal batang tanaman diduga terjadi karena bagian pangkal batang merupakan bagian yang terluka akibat pemotongan sehingga kalus terbentuk. Tumbuhnya kalus pada pangkal tanaman diduga juga terjadi karena bagian tersebut langsung bersentuhan dengan media MS + BAP 1 ppm. Adanya penambahan BAP yang merupakan sitokinin pada media bereaksi dengan hormon auksin endogen yang terdapat pada pucuk tanaman sebagai eksplan.
dalam pembelahan sel dan morfogenesis, sedang auksin berperanan dalam mengatur pertumbuhan dan pemanjangan sel. Pemanjangan sel, pembelahan sel, morfogenesis dan pengaturan pertumbuhan merupakan proses yang sangat penting dalam pembetukan kalus dan selanjutnya diikuti pembentukan tunas.
[image:43.612.123.515.340.495.2]Eksplan mulai bertunas saat 2 MST pada varietas Chandra Kirana, sedangkan varietas Puspita Asri mulai bertunas saat 3 MST. Kemampuan eksplan membentuk tunas bervariasi pada varietas dan lama perendaman EMS 0.77 %. Persentase eksplan bertunas pada varietas Chandra Kirana dan Puspita Asri mengalami penurunan pada perendaman EMS 0.77 % selama 90 menit yang masing-masing besarnya 40 % dan 33.33 %. Namun, lama perendaman EMS 0.77 % selama 120 menit (100 %) lebih besar dibandingkan kontrol (76.92 %) pada varietas Chandra Kirana.
Tabel 3. Jumlah dan Persentase Eksplan Berkalus, Eksplan Bertunas, dan Eksplan Berakar pada Berbagai Perlakuan Saat 10 MST.
Varietas
Lama Perendaman EMS 0.77 %
(menit) Jumlah Eksplan Total Jumlah Eksplan Berkalus Jumlah Eksplan Bertunas Jumlah Eksplan Berakar Chandr a Kirana
0 13 13 (100) 9 (76.92) 2 (15.38)
90 10 8 (80) 4 (40) 1 (10)
105 15 15 (100) 11 (73.3) 2 (13.33)
120 6 4 (66.67) 6 (100) 1 (16.67)
Puspita Asri
0 15 15 (100) 14 (93.33) 4 (26.67)
90 6 3 (50) 2 (33.33) 2 (33.33)
105 8 7 (87.5) 4 (44.44) 1 (12.5)
120 2 2 (100) 1 (50) 0 (0)
Keterangan : Angka dalam kurung menunjukkan persentase.
Hasil penelitian menunjukkan respon yang berbeda terhadap persentase berakar tanaman. Persentase berakar eksplan varietas Chandra Kirana cenderung meningkat dengan perendaman EMS 0.77 % selama 120 menit (16.67 %). Hal sebaliknya terjadi pada varietas Puspita Asri yang menghasilkan persentase eksplan bertunas yang semakin menurun seiring bertambahnya lama waktu perendaman EMS 0.77 % hingga mencapai 0 % pada perendaman EMS 0.77 % selama 120 menit (Tabel 3).
Nasir (2002) faktor yang dapat mempengaruhi efektifitas mutagen kimia adalah spesies dan kekhususan mutagenik. Hasil penelitian Greene et al. (2003) pada tanaman arabidopsis menunjukkan 99% mutasi yang terjadi akibat EMS (20-40 mM selama 10-20 jam) adalah perubahan dari GC menjadi AT dengan 53 % perubahan pada G dan 47 % perubahan pada C.
Pada penelitian ini diduga terjadi perubahan susunan basa yang diakibatkan EMS. Perubahan susunan basa nitrogen tersebut diduga menyebabkan perubahan pada DNA yang mempengaruhi pembentukan enzim dan protein yang merespon hormon. Hal ini dapat menyebabkan proses reaksi selanjutnya terhadap pertumbuhan tanaman akan terhambat atau berkurang sehingga proses pembentukan kalus, akar, dan tunas berbeda-beda.
Tinggi Tanaman
Tinggi tanaman merupakan salah satu indikator pertumbuhan pada tanaman. Pengukuran tinggi tanaman dilakukan mulai dari permukaan media sampai titik tumbuh pada tunas yang tertinggi. Pertumbuhan tinggi yang tidak berbeda nyata pada semua perlakuan dihasilkan oleh interaksi varietas dengan lama perendaman EMS 0.77 %. Pertumbuhan tinggi tanaman semakin meningkat dengan bertambahnya umur tanaman, kecuali pada varietas Puspita Asri dengan perendaman EMS selama 90 menit (Puspita Asri-90 menit). Rata-rata pertumbuhan tinggi tanaman tertinggi pada perlakuan kontrol varietas Puspita Asri (Puspita Asri-0 menit) yaitu 3.8 cm saat 10 MST (Gambar 11).
0 0 .5 1 1 .5 2 2 .5 3 3 .5 4 4 .5 5
2 4 6 8 1 0 1 2
U m u r (M S T )
T in g g i T a n a m a n ( c
C K -0 C K -9 0 C K -1 0 5 C K -1 2 0 P A -0 P A -9 0 P A -1 0 5 P A -1 2 0
Keterangan : CK = Chandra Kirana PA = Puspita Asri
[image:44.612.183.457.513.678.2]0, 90, 105, 120 = berturut-turut lama perendaman EMS 0.77 % (menit).
Pertumbuhan tinggi tanaman tidak dipengaruhi oleh varietas, tetapi dipengaruhi oleh faktor lama perendaman EMS 0.77 %. Pengaruh yang nyata terjadi pada 2 MST dan 12 MST. Pengaruh yang sangat nyata terjadi pada periode pertengahan penelitian yaitu pada 6-10 MST. Tanaman tertinggi saat 10 MST diperoleh pada perlakuan kontrol yaitu 3.26 cm. Hasil ini tidak berbeda nyata dengan perlakuan perendaman EMS 0.77 % selama 120 menit (2.56 cm), namun berbeda nyata dengan perendaman selama 90 menit (1.19 cm) dan 105 menit sebesar 1.28 cm (Tabel 4).
Tabel 4. Pengaruh Lama Perendaman EMS terhadap Tinggi Tanaman KrisanIn vitro
Lama Perendaman Umur (MST)
EMS 0.77 % (menit) 4 6 8 10 12
---cm---0 1.01 a 1.69 a 2.80 a 3.26 a 4.22 a
90 0.66 b 0.89 b 1.19 b 1.35 b 1.29 b
105 0.71 b 0.92 b 1.28 b 1.49 b 2.5 ab
120 0.78 ab 1.37 ab 1.95 ab 2.56 ab 3.02 ab
Keterangan: Angka yang diikuti dengan huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata menurut uji DMRT 5 %.
[image:45.612.188.451.545.671.2]Hasil penelitian menggambarkan terjadinya respon linear tinggi planlet krisan varietas Chandra Kirana akibat lama perendaman EMS 0.77 % (Gambar 12.). Lama Perendaman EMS 0.77 % menyebabkan respon linear yang menurun terhadap pertumbuhan tinggi tanaman. Peningkatan satu menit lama perendaman EMS 0.77 % dapat menyebabkan tinggi tanaman varietas Chandra Kirana terhambat sebesar 0.0017 cm. Berdasarkan nilai koefisien determinasi (R2), maka respon perendaman EMS 0.77 % terhadap tinggi tanaman varietas Chandra Kirana dapat dijelaskan 1.5 % oleh persamaan linear pada Gambar 12.
Hasil penelitian menggambarkan terjadinya respon linear tinggi planlet krisan varietas Puspita Asri akibat lama perendaman EMS 0.77 % (Gambar 13.). Lama Perendaman EMS 0.77 % menyebabkan respon linear yang menurun terhadap pertumbuhan tinggi tanaman. Peningkatan satu menit lama perendaman EMS 0.77 % dapat menyebabkan tinggi tanaman varietas Puspita Asri terhambat sebesar 0.0192 cm. Berdasarkan nilai koefisien determinasi (R2), maka respon perendaman EMS 0.77 % terhadap tinggi tanaman varietas Puspita Asri dapat dijelaskan 93 % oleh persamaan linear pada Gambar 13. Tampak bahwa varietas Puspita Asri lebih berespon terhadap lama perendaman EMS 0.77 % dibandingkan dengan varietas Chandra Kirana.
Gambar 13. Respon Tinggi Planlet Krisan Varietas Puspita Asri Akibat Lama Perendaman EMS 0.77 % pada 10 MST.
Hal ini menunjukkan bahwa EMS 0.77 % mampu menghambat tinggi tanaman. Poerba et al. (2009) melaporkan bahwa induksi mutasi dengan EMS pada kultur in vitro iles-iles (A. Muelleri) menyebabkan pertumbuhan kultur terhambat. Jumlah tunas, jumlah akar, dan tinggi tunas tanaman iles-iles cenderung menurun sejalan dengan bertambahnya konsentrasi EMS.
Jumlah Daun
pada 10 MST dihasilkan oleh kombinasi perlakuan Chandra Kirana-120 menit (45.8) tidak berbeda nyata dengan kombinasi Puspita Asri-0 menit (43.1).
Tabel 5. Interaksi Varietas dengan Lama Perendaman EMS 0.77 % terhadap Jumlah Daun per Planlet
Varietas
Lama Perendaman EMS 0.77 %
(menit)
Umur (MST)
2 4 6 8 10 12
Chandra Kirana
0 3.56 8.57 ab 12.00 c 19.50 bc 23.71 bc 45.50
90 2.11 5.87 b 10.67 c 15.50 c 21.17 c 25.00
105 2.25 7.17 b 14.78 bc 21.69 bc 24.00 bc 26.50
120 2.80 9.70 ab 24.10 ab 40.10 a 45.80 a 52.75
Puspita Asri
0 7.00 13.30 ab 30.30 a 33.40 ab 43.10 ab 46.17
90 2.92 4.42 b 5.90 c 7.50 c 18.00 c 5.25
105 4.30 4.70 b 12.70 c 13.80 c 10.00 c 21.90
120 4.37 4.62 b 11.83 c 21.00 bc 24.50 bc 37.50
Interaksi VxL tn * ** * * tn
Keterangan : Angka yang diikuti dengan huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata
tn = tidak berpengaruh nyata (p > 5 %) * = berpengaruh nyata (p < 5 %) ** = berpengaruh sangat nyata (p < 1 %).
Hasil penelitian menggambarkan terjadinya respon linear jumlah daun krisan varietas Chandra Kirana akibat lama perendaman EMS 0.77 %. Lama Perendaman EMS 0.77 % menyebabkan respon linear yang meningkat terhadap jumlah daun tanaman. Peningkatan satu menit lama perendaman EMS 0.77 % dapat meningkatkan jumlah daun tanaman krisan varietas Chandra Kirana sebesar 0.1252. Berdasarkan nilai koefisien determinasi (R2), maka respon perendaman EMS 0.77 % terhadap jumlah daun varietas Chandra Kirana dapat dijelaskan 24.17 % oleh persamaan linear pada Gambar 14.a.
Gambar 14. Respon Jumlah Daun Krisan Akibat Lama Perendaman EMS 0.77 % saat 10 MST pada: (a) Var. Chandra Kirana dan (b) Var. Puspita Asri.
Hasil penelitian menggambarkan terjadinya respon linear jumlah daun krisan varietas Puspita Asri akibat lama perendaman EMS 0.77 % (Gambar 14.b). Lama Perendaman EMS 0.77 % menyebabkan respon linear yang menurun terhadap jumlah daun tanaman. Peningkatan satu menit lama perendaman EMS 0.77 % dapat menghambat jumlah daun tanaman krisan varietas Puspita Asri sebesar 0.1849. Berdasarkan nilai koefisien determinasi (R2), maka respon perendaman EMS 0.77 % terhadap jumlah daun varietas Puspita Asri dapat dijelaskan 67.38 % oleh persamaan linear pada Gambar 14.b.
Lama perendaman EMS 0.77 % memberikan hasil yang berbeda pada kedua varietas. Pada varietas Puspita Asri, lama perendaman EMS 0.77 % secara umum mengakibatkan terhambatnya pertumbuhan daun. Namun sebaliknya, semakin lama perendaman EMS 0.77 % secara umum menyebabkan pertumbuhan daun semakin banyak. Respon yang berbeda diduga muncul karena perbedaan genetik serta perbedaan ketahanan dan kepekaan terhadap lama perendaman EMS 0.77 % diantara krisan varietas Puspita Asri dan varietas Chandra Kirana.
Jumlah Tunas Tanaman
Pengamatan pertumbuhan tunas bertujuan untuk melihat sejauh mana pengaruh mutagen kimia terhadap keragaman yang terjadi pada tunas atau planlet. Pertumbuhan jumlah tunas cenderung semakin meningkat dengan bertambahnya umur tanaman, kecuali pada perlakuan kombinasi Chandra Kirana-0 menit, Chandra Kirana-90 menit, Puspita Asri-0 menit serta Puspita Asri-90 menit yang
mengalami penurunan sejak 10-12 MST (Tabel 6). Hal ini terjadi karena banyak planlet yang mengalami kontaminasi dan tidak bisa diselamatkan saat 11 MST sehingga banyak data yang hilang.
Tabel 6. Interaksi Varietas dengan Lama Perendaman EMS 0.77 % terhadap Jumlah Tunas Tanaman Krisan
Varietas Lama Perendaman EMS 0.77 %
Umur (MST)
4 6 8 10 12
Chandra Kirana
0 1.57 bc 1.64 B
c 2.36 b 2.43 bc 0.50 b
90 1.44 bc 1.42 bc 1.58 b 2.50 bc 1.75 b
105 1.50 bc 2.00 bc 2.50 b 2.87 bc 3.25 b
120 3.50 a 5.40 a 6.50 a 7.70 a 8.25 a
Puspita Asri
0 2.50 ab 3.70 ab 3.05 b 4.50 bc 4.00 ab
90 0.50 c 0.30 c 0.30 b 0.60 c 0.00 b
105 0.67 c 1.42 bc 1.50 ab 1.60 bc 1.60 b
120 1.30 bc 1.00 c 1.33 b 1.33 c 1.67 ab
Uji F * ** * ** *
Keterangan : Angka yang diikuti dengan huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata
* = berpengaruh nyata (p < 5 %) ** = berpengaruh sangat nyata (p < 1 %).
Hasil penelitian menggambarkan terjadinya respon linear jumlah tunas krisan varietas Chandra Kirana akibat lama perendaman EMS 0.77 % (Gambar 15.a). Lama Perendaman EMS 0.77 % menyebabkan respon linear yang meningkat terhadap jumlah tunas tanaman. Peningkatan satu menit lama perendaman EMS 0.77 % dapat meningkatkan jumlah tunas tanaman krisan varietas Chandra Kirana sebesar 0.0283. Berdasarkan nilai koefisien determinasi (R2), maka respon perendaman EMS 0.77 % terhadap jumlah tunas varietas Chandra Kirana dapat dijelaskan 28.89 % oleh persamaan linear pada Gambar 15.a.
y = 0.0283x + 1.5501 R² = 0.2889
0 1 2 3 4 5 6 7 8 9
0 50 100 150
J u m l a h T u n a s
Lama Perendaman EMS 0.77 % (menit)
y = -0.0092x + 3.9415 R² = 0.2065
0 0.5 1 1.5 2 2.5 3 3.5 4 4.5
0 50 100 150
J u m l a h T u n a s
[image:50.612.173.457.92.418.2]Lama Perendaman EMS 0.77 % (menit)
Gambar 15. Respon Jumlah Tunas Krisan Akibat Lama Perendaman EMS 0.77 % saat 10 MST pada: (a) Var. Chandra Kirana dan (b) Var. Puspita Asri.
Perendaman EMS 0.77 % dapat bersifat positif pada jumlah tunas varietas Chandra Kirana, tetapi juga dapat bersifat negatif atau menghambat terhadap varietas Puspita Asri. Sifat positif hasil perendaman EMS terhadap jumlah tunas pernah dilaporkan sebelumnya. Manzilla et al. (2010) menyatakan rata-rata jumlah tunas tanaman cabai (Capsicum annum L.) genotipe PBC495 dan Gelora yang diberi perlakuan EMS 0.5% selama 60 menit cenderung lebih tinggi dibandingkan dengan pada kondisi kontrol. Perendaman EMS yang bersifat negatif atau menghambat pertumbuhan jumlah tunas juga telah dilaporkan sebelumnya pada tanaman abaka (Purwatiet al.,2008), purwoceng (Ajijah, 2009), dan Iles-iles (Poerbaet al., 2009).
(a)
Gambar 16. Keragaan Pertumbuhan TunasIn vitroKrisan Varietas Chandra Kirana saat 9 MST pada berbagai lama perendaman EMS 0.77 %. a-d : berturut-turut perendaman EMS 0.77 % selama 0, 90, 105, 120 menit.
Perendaman EMS 0.77 % dapat menyebabkan terjadinya keragaman pertumbuhan tunas dengan lama perendaman yang berbeda (Gambar 16 a-d). Tanaman kontrol memiliki tunas yang sedikit, tetapi lebih tinggi (Gambar 16 a). Hal ini sangat berbeda dengan pertumbuhan tunas hasil perendaman EMS 0.77 % selama 120 menit yang memiliki banyak tunas, tetapi kerdil (Gambar 16 d).
Pertumbuhan Akar Tanaman
Interaksi antara varietas dengan lama perendaman EMS 0.77 % tidak berpengaruh nyata terhadap jumlah akar tanaman. Akar mulai tumbuh sejak 9 MST pada semua perlakuan dan varietas, kecuali pada varietas Puspita Asri dengan lama perendaman EMS 0.77 % selama 105 menit (10 MST) dan 120 menit (11 MST). Rata-rata jumlah akar yang terbanyak dihasilkan oleh perlakuan kontrol varietas Puspita Asri (5.39) saat 11 MST (Tabel 7).
Varietas berpengaruh sangat nyata terhadap jumlah akar tanaman, sedangkan lama perendaman EMS 0.77 % bepengaruh nyata. Varietas yang memiliki respon terbaik yaitu Puspita Asri (2.37) yang berbeda sangat nyata dengan varietas Chandra Kirana (0.19). Rata-rata jumlah akar terbanyak dihasilkan kontrol (2.59) yang tidak berbeda nyata dengan perendaman EMS 0.77 % selama 105 menit (0.68), tetapi berbeda nyata dengan perendaman selama 90 menit (0.10) dan 120 menit sebesar 0.28 (Tabel 7).
Tabel 7. Pengaruh Lama Perendaman EMS 0.77 % dan Varietas terhadap Jumlah Akar pada 11 MST
Perlakuan Jumlah Akar
Lama Perendaman EMS 0.77 % (menit)
0 2.59 a
90 0.10 b
105 0.68 ab
120 0.28 b
Uji F *
Varietas
Candra Kirana 0.19 k
Puspita Asri 2.37 j
Uji F **
Keterangan : Angka yang diikuti dengan huruf yang sama pada baris perlakuan yang sama menunjukkan tidak berbeda nyata
* = berpengaruh nyata (p < 5 %) ** = berpengaruh sangat nyata (p < 1 %).
Hasil penelitian menggambarkan terjadinya respon linear jumlah akar krisan varietas Chandra Kirana akibat lama perendaman EMS 0.77 % (Gambar 17.a). Lama Perendaman EMS 0.77 % menyebabkan respon linear yang meningkat terhadap jumlah akar tanaman. Peningkatan satu menit lama perendaman EMS 0.77 % dapat meningkatkan jumlah akar tanaman krisan varietas Chandra Kirana sebesar 0.0003. Berdasarkan nilai koefisien determinasi (R2), maka respon perendaman EMS 0.77 % terhadap jumlah akar varietas Chandra Kirana dapat dijelaskan 13.2 % oleh persamaan linear pada Gambar 17.a.
Hasil penelitian menggambarkan terjadinya respon linear jumlah akar krisan varietas Puspita Asri akibat lama perendaman EMS 0.77 % (Gambar 17.b). Lama Perendaman EMS 0.77 % menyebabkan respon linear yang menurun terhadap jumlah akar tanaman. Peningkatan satu menit lama perendaman EMS 0.77 % dapat menghambat jumlah akar tanaman krisan varietas Puspita Asri sebesar 0.0095. Berdasarkan nilai koefisien determinasi (R2), maka respon perendaman EMS 0.77 % terhadap jumlah akar varietas Puspita Asri dapat dijelaskan 70.76 % oleh persamaan linear pada Gambar 17.b.
tinggi kadar EMS terserap ke dalam tanaman termasuk bertambahnya toksisitas EMS terhadap pertumbuhan tunas, bulbet dan akar kultur sisik mikro kerk lily. Omar dan Novak (1990) menambahkan EMS juga menghambat pembentukan tanaman utuh (berdaun dan berakar) dari embrio somatik date palm (Phoenix dactyliferaL).
Gambar 17. Respon Jumlah Akar Krisan akibat Lama Perendaman EMS 0.77 % saat 10 MST pada: (a) Var. Chandra Kirana dan (b) Var. Puspita Asri.
Jumlah Stomata dan Kloroplas dalam Sel Penjaga
Stomata merupakan suatu celah pada jaringan epidermis yang berfungsi selama proses fotosintesis. Stomata dibatasi oleh dua sel penjaga yang di dalamnya mengandung kloroplas (Campbell, 2004). Pengamatan kuantitatif pada karakteristik sel seperti pengukuran ukuran sel sering diterapkan dalam menemukan poliploidi. Materi yang paling sering dilihat adalah sel penjaga pada stomata. Ukuran dan jumlah sel tersebut per area daun menjadi hal yang umum
(a)
untuk melacak perubahan ploidi (Sybenga, 1992). Pada penelitian ini stomata yang diamati adalah stomata pada bagian bawah daun. Stomata daun tanaman krisan hasil kombinasi perlakuan varietas dengan lama perendaman EMS 0.77 % dapat dilihat pada Lampiran 2.
Lama perendaman EMS 0.77 % berpengaruh nyata terhadap peubah jumlah stomata daun dan jumlah kloroplas dalam sel penjaga. Jumlah stomata terbanyak dihasilkan pada kombinasi Puspita Asri-0 menit (16) yang berbeda nyata dengan kombinasi Chandra Kirana-90 menit (9.67) dan Chandra Kirana-120 menit (9.6), sedangkan pada perlakuan lainnya dihasilkan jumlah stomata yang tidak berbeda nyata (Tabel 8). Secara umum lama perendaman EMS 0.77 % tidak berbeda nyata pada jumlah stomata daun varietas Puspita Asri. Lama perendaman EMS 0.77 % selama 90 menit dan 120 menit pada varietas Chandra Kirana berbeda nyata terhadap jumlah stomata daun.
[image:54.612.125.512.467.629.2]Hasil interaksi yang menghasilkan jumlah kloroplas dalam sel penjaga terbanyak yaitu perlakuan Puspita Asri-0 (19.4) yang berbeda nyata dengan perlakuan Chandra Kirana-90 (12.67), Chandra Kirana-120 (11.77), dan perlakuan Puspita Asri-90 sebesar 10.78 (Tabel 8). Jumlah kloroplas pada perlakuan Puspita Asri-90 menit berbeda nyata lebih sedikit jika dibandingkan kontrolnya.
Tabel 8. Interaksi Varietas dengan Lama Perendaman EMS 0.77 % terhadap Jumlah Stomata dan Kloroplas dalam Sel Penjaga Bawah Daun Krisan
Varietas Lama Perendaman EMS 0.77 % (menit)
Jumlah Stomata Jumlah Kloroplas dalam Sel Penjaga Chandra
Kirana
0 15.70 a 13.30 abcd
90 9.67 b 12.67 bcd