DEP
VARIETA
PARTEME
INS
AS PITAL
KRISTIA
A
EN AGRO
FAKULT
STITUT P
LOKA SE
ANTO NUG
A24070017
ONOMI DA
TAS PERT
PERTANIA
2012
CARA
IN
GROHO
7
AN HORT
TANIAN
AN BOGO
N VITRO
TIKULTU
OR
RINGKASAN
KRISTIANTO NUGROHO. Pengaruh Penambahan IAA dan Kinetin terhadap Pertumbuhan Krisan (Dendranthema grandiflora Tzvelev) Varietas Pitaloka secara in vitro. (Dibimbing oleh NURHAYATI A. MATTJIK).
Tujuan dari penelitian ini yaitu untuk mempelajari pengaruh konsentrasi IAA dan kinetin terhadap pertumbuhan krisan varietas Pitalokasecara in vitro dan mempelajari bagaimana interaksi antara kedua zat pengatur tumbuh tersebut. Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan Tanaman 3 Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor pada bulan Februari hingga Mei 2012.
Penelitian dilakukan menggunakan rancangan perlakuan faktorial yang disusun dalam Rancangan lingkungan Acak Lengkap (RAL) dengan dua faktor yaitu konsentrasi IAA dan konsentrasi kinetin. Perlakuan konsentrasi IAA terdiri atas tiga taraf yaitu 0 mg/l, 0.5 mg/l, dan 1.0 mg/l sedangkan konsentrasi kinetin terdiri atas empat taraf yaitu 0 mg/l, 0.5 mg/l, 1.0 mg/l, dan 1.5 mg/l sehingga terdapat 12 kombinasi perlakuan. Tiap perlakuan diulang sebanyak 10 kali sehingga terdapat 120 satuan percobaan.
Hasil percobaan selama tahap kultur in vitro menunjukkan bahwa penambahan auksin tidak berpengaruh nyata terhadap peubah jumlah tunas, jumlah buku, jumlah daun, jumlah akar, panjang akar, dan tinggi planlet. Penambahan kinetin menunjukkan pengaruh nyata terhadap jumlah akar, panjang akar, dan tinggi planlet, serta berpengaruh sangat nyata terhadap jumlah tunas, jumlah daun, dan jumlah buku. Interaksi antara IAA dan kinetin berpengaruh nyata terhadap jumlah buku dan berpengaruh sangat nyata terhadap jumlah akar, panjang akar, dan tinggi planlet.
PENGARUH PENAMBAHAN IAA DAN KINETIN TERHADAP
PERTUMBUHAN KRISAN (
Dendranthema grandiflora
Tzvelev)
VARIETAS PITALOKA SECARA
IN VITRO
Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian Institut Pertanian Bogor
KRISTIANTO NUGROHO
A24070017
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
Judul :
PENGARUH PENAMBAHAN IAA DAN
KINETIN TERHADAP PERTUMBUHAN
KRISAN (
Dendranthema grandiflora
Tzvelev)
VARIETAS PITALOKA SECARA
IN VITRO
Nama
:
KRISTIANTO NUGROHO
NIM
:
A24070017
Menyetujui, Pembimbing
Prof. Dr. Ir. Nurhayati Ansori Mattjik, MS. NIP. 19460807 197301 2 001
Mengetahui,
Ketua Departemen Agronomi dan Hortikultura Fakultas Pertanian IPB
Dr. Ir. Agus Purwito, MSc. Agr NIP. 19611101 198703 1 003
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 24 Desember 1989. Penulis merupakan anak ketiga dari tiga bersaudara dari pasangan Bapak Sarwono dan Ibu Nur Siti.
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Allah SWT yang telah memberi kekuatan dan kemudahan sehingga penulis dapat menyelesaikan skripsi yang berjudul Pengaruh Penambahan IAA dan Kinetin terhadap Pertumbuhan Krisan (Dendranthema grandiflora Tzvelev) varietas Pitaloka secara in vitro
dengan sebaik mungkin. Penyusunan skripsi ini merupakan salah satu syarat kelulusan bagi mahasiswa Mayor Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor.
Tiada gading yang tak retak. Penulis menyadari bahwa skripsi ini mungkin masih memiliki banyak kesalahan dan kekurangan. Oleh karena itu penulis menyampaikan permohonan maaf atas segala kekurangan yang ada. Semoga skripsi ini dapat bermanfaat bagi siapapun yang membutuhkan.
Bogor, Agustus 2012
UCAPAN TERIMA KASIH
Dalam menyelesaikan skripsi ini, penulis memperoleh bantuan dari berbagai pihak. Oleh karena itu, pada kesempatan ini penulis menyampaikan ucapan terima kasih kepada:
1. Prof. Dr. Ir. Nurhayati A. Mattjik, MS. sebagai dosen pembimbing skripsi, atas bimbingan dan arahan selama kegiatan penelitian ini berlangsung. 2. Prof. Dr. Ir. Bambang S. Purwoko, M.Sc. selaku pembimbing akademik
yang telah memberi arahan dan bimbingan akademik selama masa kuliah, juga atas bantuan ZPT kinetin untuk penelitian ini.
3. Dr. Dewi Sukma, SP, M.Si dan Dr. Ir. Syarifah Iis Aisyah, MSc.Agr. sebagai dosen penguji yang telah memberikan kritik dan saran untuk
perbaikan skripsi ini.
4. Yayasan Bogor International Club, melalui wakilnya Ibu Ratna Rosiana Budiman, atas bantuan dana beasiswa untuk kegiatan penelitian ini
5. Bapak, Ibu, serta kakak-kakak yang selalu memberikan dukungan baik moril maupun materil kepada penulis.
6. Rekan kerja di Laboratorium Kultur Jaringan 3, antara lain Teh Iif, Mas Deni, Bi Acih, Pak Nur Arifin, Neneng, Rara Puspita, Mbak Sandra, serta Mbak Iin, atas bantuan dan kerjasamanya.
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 3
Hipotesis ... 4
TINJAUAN PUSTAKA ... 5
Botani Tanaman Krisan ... 5
Syarat Tumbuh Tanaman Krisan………7
Varietas Tanaman Krisan Indonesia ... 10
Kultur Jaringan Tanaman ... 11
Kultur Jaringan Krisan……….12
Media Kultur Jaringan………..14
Zat Pengatur Tumbuh ... 15
Auksin ... 16
Sitokinin ... 19
BAHAN DAN METODE ... 22
Tempat dan Waktu ... 22
Bahan dan Alat ... 22
Metode Penelitian ... 22
Pelaksanaan ... 23
HASIL DAN PEMBAHASAN ... 26
Kondisi Umum ... 26
Pembahasan Umum ... 27
Jumlah Tunas ... 28
Jumlah Buku ... 30
Jumlah Daun ... 32
Jumlah Akar ... 35
Panjang Akar ... 37
Pembentukan Kalus ... 39
Tinggi Planlet ... 41
KESIMPULAN DAN SARAN ... 44
Kesimpulan ... 44
Saran ... 44
DAFTAR TABEL
Nomor Halaman
1.
Hasil uji F Pengaruh Konsentrasi IAA dan Kinetin terhadapJumlah Tunas pada Kultur in vitro Krisan Varietas Pitaloka... 29
2.
Pengaruh Konsentrasi Kinetin terhadap Jumlah Tunas padaKultur in vitro Krisan Varietas Pitaloka... 29
3.
Hasil uji F Pengaruh Konsentrasi IAA dan Kinetin terhadapJumlah Buku pada Kultur in vitro Krisan Varietas Pitaloka... 31
4.
Pengaruh Konsentrasi Kinetin terhadap Jumlah Buku padaKultur in vitro Krisan Varietas Pitaloka... 31
5.
Pengaruh Interaksi IAA dan Kinetin terhadap Jumlah Buku pada Kultur in vitro Krisan Varietas Pitaloka... 326.
Hasil uji F Pengaruh Konsentrasi IAA dan Kinetin terhadapJumlah Daun pada Kultur in vitro Krisan Varietas Pitaloka... 33
7.
Pengaruh Konsentrasi Kinetin terhadap Jumlah Daun padaKultur in vitro Krisan Varietas Pitaloka... 33
8.
Hasil uji F Pengaruh Konsentrasi IAA dan Kinetin terhadapJumlah Akar pada Kultur in vitro Krisan Varietas Pitaloka... 36
9.
Pengaruh Konsentrasi Kinetin terhadap Jumlah Akar padaKultur in vitro Krisan Varietas Pitaloka... 36
10.
Pengaruh Interaksi IAA dan Kinetin terhadap Jumlah Akar pada Kultur in vitro Krisan Varietas Pitaloka... 3611.
Hasil uji F Pengaruh Konsentrasi IAA dan Kinetin terhadapPanjang Akar pada Kultur in vitro Krisan Varietas Pitaloka... 37
12.
Pengaruh Konsentrasi Kinetin terhadap Panjang Akar padaKultur in vitro Krisan Varietas Pitaloka... 38
14.Persentase Eksplan Membentuk Kalus dari Tiap Perlakuan
pada Kultur in vitro Krisan Varietas Pitaloka... 40
15.
Hasil uji F Pengaruh Konsentrasi IAA dan Kinetin terhadapTinggi Planlet pada Kultur in vitro Krisan Varietas Pitaloka... 41
16.
Pengaruh Konsentrasi Kinetin terhadap Tinggi Planlet padaKultur in vitro Krisan Varietas Pitaloka... 42
DAFTAR GAMBAR
Nomor Halaman
1. Bentuk bunga krisan : (A). Tipe Pompon, (B). Tipe Button,
(C). Tipe Decorative, (D) Tipe Single... 7
2. Bentuk bunga krisan : (A). Tipe Spoon, (B). Tipe Quill,
(C). Tipe Anemone, (D). Tipe Spider... 8
3. Krisan Varietas Pitaloka... 11
4. Skema Biosintesis IAA... 17
5. Skema Pembentukan Sitokinin Melalui
Lintasan Asam Mevalonat………. 20
6. Gejala Kontaminasi Selama Masa Kultur... 26
7. Tunas yang terbentuk pada kultur in vitro krisan
varietas Pitaloka perlakuan kinetin 0.5 mg/l pada 1 MSK…………. 28
8. Analisis Regresi Pengaruh Konsentrasi Kinetin terhadap Jumlah Tunas Kultur in vitro Krisan Varietas Pitaloka
pada 9 MSK……….. 30
9. Analisis Regresi Pengaruh Konsentrasi Kinetin terhadap Jumlah Tunas Kultur in vitro Krisan Varietas Pitaloka
pada 9 MSK……….. 34
10.Akar yang terbentuk pada kultur in vitro krisan varietas Pitaloka perlakuan IAA 1 mg/l pada 1 MSK……….. 35
11.(A). Kalus Berakar yang Terbentuk pada Perlakuan IAA 0.5 mg/l
dan (B). Kalus Bertunas yang Terbentuk pada Perlakuan
Kinetin 1.5 mg/l………. 41
DAFTAR LAMPIRAN
Nomor Halaman
1. Deskripsi Krisan Varietas Pitaloka... 49
2. Komposisi Media Murashige dan Skoog……….. 50
3. Rumus Konversi dari ppm ke μM………. 51
4. Sidik Ragam Pengaruh IAA, Kinetin, dan Interaksinya terhadap Jumlah Tunas pada Kultur in vitro Krisan
varietas Pitaloka………. 52
5. Sidik Ragam Pengaruh IAA, Kinetin, dan Interaksinya terhadap Jumlah Daun pada Kultur in vitro Krisan
varietas Pitaloka………. 52
6. Sidik Ragam Pengaruh IAA, Kinetin, dan Interaksinya terhadap Jumlah Buku pada Kultur in vitro Krisan
varietas Pitaloka………. 53
7. Sidik Ragam Pengaruh IAA, Kinetin, dan Interaksinya terhadap Jumlah Akar pada Kultur in vitro Krisan
varietas Pitaloka………. 53
8. Sidik Ragam Pengaruh IAA, Kinetin, dan Interaksinya terhadap Tinggi Planlet pada Kultur in vitro Krisan
varietas Pitaloka………..54
9. Sidik Ragam Pengaruh IAA, Kinetin, dan Interaksinya terhadap Panjang Akar pada Kultur in vitro Krisan
PENDAHULUAN
Latar Belakang
Tanaman hias merupakan salah satu komoditas hortikultura yang memiliki prospek ekonomi yang menguntungkan. Pemanfaatan tanaman hias dapat berupa tanaman hias dalam pot yang digunakan untuk memperindah halaman rumah atau mempercantik dekorasi ruangan. Cara lain pemanfaatan tanaman hias ialah dalam bentuk bunga potong segar yang permintaannya saat ini kian bertambah seiring dengan perkembangan pola pikir masyarakat akan nilai-nilai keindahan dan estetika. Hal ini terlihat dari tingginya permintaan akan bunga potong segar, baik digunakan sebagai hiasan di rumah, di kantor, di hotel maupun dalam acara-acara tertentu seperti pernikahan, wisuda, upacara keagamaan, hingga kematian. Kondisi geografis Indonesia yang memiliki dataran tinggi dengan kondisi udara yang sejuk membuat agribisnis tanaman hias berkembang semakin pesat.
Krisan (Dendranthema grandiflora Tzvelev) merupakan salah satu jenis tanaman hias yang memiliki angka permintaan cukup tinggi di masyarakat. Sentra produksi krisan kini mulai tersebar di beberapa daerah di Indonesia antara lain di kawasan Cipanas-Cianjur, Lembang (Jawa Barat); Bandungan (Jawa Tengah); Batu (Jawa Timur); Brastagi (Sumatera Utara); Bukit Tinggi (Sumatera Barat); Pagar Alam (Sumatera Selatan); Bali; hingga Tomohon (Sulawesi Utara) (Hadi, 2008). Badan Pusat Statistik (2009) mencatat bahwa produksi bunga potong krisan pada tahun 2009 mencapai 107 847 072 tangkai, meningkat 8 688 130 tangkai dari tahun sebelumnya. Produksi bunga potong krisan bahkan jauh lebih tinggi dibanding bunga potong tanaman lain seperti anggrek, gladiol, mawar, sedap malam, dan gerbera (BPS, 2009). Tingginya angka produksi bunga potong krisan menunjukkan besarnya tingkat permintaan masyarakat akan bunga potong tersebut.
Meskipun agribisnis tanaman krisan nampak begitu menjanjikan, namun
kenyataannya upaya produksi tanaman krisan di Indonesia dihadapkan pada
beberapa permasalahan. Hingga akhir periode 1990an Indonesia belum mampu
dari luar negeri. Selama ini bibit krisan diimpor dari negara seperti Belanda,
Jerman, Amerika Serikat, dan Jepang yang selain harganya mahal juga
memerlukan kompensasi pembayaran royalti 10% untuk tiap harga jual
per tangkainya bila tanaman tersebut diperbanyak secara komersial (Syaifan,
2010). Pembiakan tanaman krisan dapat berlangsung secara generatif maupun
vegetatif. Menurut Kofranek (1992), bila tanaman krisan dibiakkan secara
generatif dari benih, maka akan terjadi segregasi yang menghasilkan keturunan
dengan beragam bentuk bunga, padahal keseragaman bentuk dan warna bunga
menjadi salah satu kriteria penting dalam pemasaran tanaman krisan. Hingga kini
pembiakan secara vegetatif melalui stek pucuk menjadi pilihan utama yang
digunakan oleh para produsen krisan di Indonesia.
Seiring berjalannya waktu semakin tingginya permintaan konsumen akan
bunga potong krisan membuat para produsen harus mampu menyediakan bibit
tanaman krisan yang seragam serta bebas penyakit dalam jumlah yang besar dan
dalam waktu yang relatif singkat. Oleh karena itu upaya pembiakan secara in vitro
melalui teknik kultur jaringan dapat menjadi salah satu alternatif. Menurut
Gunawan (1992), kelebihan teknik kultur jaringan yaitu mampu memproduksi
tanaman dalam jumlah besar dengan waktu yang relatif singkat, tanaman yang
diperoleh juga terbebas dari patogen, dan teknik kultur jaringan dapat pula
diterapkan dalam pemuliaan tanaman terutama bila cara konvensional dihadapkan
diferensiasi jaringan, pembesaran dan pemanjangan sel, perkembangan tunas dan pucuk, pemeliharaan sintesis asam nukleat dan protein, ikut mengendalikan perkecambahan pada benih, menyokong translokasi nutrisi dan substansi organik, serta menghambat terjadinya senescence dengan mencegah terjadinya degradasi klorofil (Weaver, 1972; Arteca, 1996).
Menurut Windasari (2004), pemberian NAA pada konsentrasi 0.1 mg/l memberikan hasil yang optimum untuk jumlah daun dan tinggi planlet krisan varietas Delano Red, sedangkan pemberian kinetin hingga 2.5 mg/l menunjukkan pengaruh yang baik bagi jumlah daun, namun pertumbuhan akar planlet menjadi terhambat. Maryani dan Zamroni (2005) memperoleh hasil bahwa kombinasi IAA 1 mg/l dengan BAP 1 mg/l menghasilkan jumlah tunas terbanyak pada perbanyakan krisan secara in vitro. Penelitian yang dilakukan oleh Syaifan (2010) terhadap dua varietas krisan yaitu Puspita Nusantara dan Puspita Asri menunjukkan bahwa pemberian BA 4.44 μM mendorong terbentuknya jumlah daun per eksplan yang terbanyak, sedangkan pemberian BA 6.66 μM menghasilkan jumlah tunas terbanyak.
Oleh karena itu, dalam penelitian ini digunakan dua jenis zat pengatur tumbuh yaitu IAA dan kinetin untuk melihat bagaimana pengaruh penambahan kedua zat pengatur tumbuh tersebut dalam memacu pertumbuhan krisan varietas Pitaloka secara in vitro. Konsentrasi IAA yang digunakan ialah 0 mg/l, 0.5 mg/l, dan 1.0 mg/l, sedangkan konsentrasi kinetin yang digunakan ialah 0 mg/l, 0.5 mg/l, 1.0 mg/l, dan 1.5 mg/l.
Tujuan
Hipotesis
1. Akan diperoleh konsentrasi IAA yang baik untuk pertumbuhan krisan varietas Pitaloka secara in vitro.
2. Akan diperoleh konsentrasi kinetin yang baik untuk pertumbuhan krisan varietas Pitaloka secara in vitro.
TINJAUAN PUSTAKA
Botani Tanaman Krisan
Krisan (Dendranthema grandiflora Tzvelev. sinonim Chrysanthemum morifolium Ramat.) merupakan tanaman hias berbentuk perdu yang telah dibudidayakan di Cina sejak 2000 tahun lalu (Boodley, 1998). Pada tahun 797 M bunga krisan dijadikan simbol kekaisaran Jepang dengan julukan Queen of the East (National Chrysanthemum Society, 2003). Selain sebagai tanaman hias, krisan juga dikenal sebagai salah satu tanaman obat dalam literatur pengobatan tradisional Cina. Akarnya dapat digunakan sebagai penghilang sakit kepala, tunas muda dan mahkota bunganya dapat dimakan sebagai salad, dan daunnya digunakan sebagai minuman untuk kesehatan (National Chrysanthemum Society, 2003). Penelitian yang dilakukan oleh Pin et al. (1999) pada Chrysanthemum morifolium, menunjukkan bahwa ekstrak bunga krisan jenis tersebut memiliki kandungan antioksidan yang cukup tinggi. Penelitian Zhu et al. (2005) menunjukkan bahwa minyak esensial yang terdapat pada bunga Chrysanthemum indicum memiliki kemampuan menghambat pertumbuhan 15 macam mikroorganisme.
Pada tahun 1795 tanaman krisan dibawa ke daratan Eropa (Hadi, 2008). Ahli botani Swedia yang dikenal pula sebagai Bapak Taksonomi, Carolus Linnaeus, memberikan nama Chrysanthemum sebagai genus tanaman ini yang merupakan perpaduan dari kata Yunani chrysos yang berarti emas dan anthemon
yang bermakna bunga (National Chrysanthemum Society, 2003). Sejak saat itulah nama Chrysanthemum digunakan secara luas untuk menyebut genus tanaman ini. Selanjutnya pada tahun 1843 Robert Fortune membawa ke Inggris salah satu jenis krisan yang menjadi tetua krisan jenis spray dan pompon; dan pada tahun 1889 Elmer D. Smith di Amerika Serikat mulai melakukan persilangan untuk menghasilkan varietas baru krisan untuk diperjualbelikan (Kofranek, 1992).
Di Amerika Serikat sendiri, tanaman krisan menjadi sedemikian terkenal, bahkan menurut Boodley (1998) krisan merupakan tanaman pot penghasil dollar
popularitas krisan terutama karena tanaman ini memiliki bentuk dan warna petal bunga yang beraneka ragam mulai dari kuning keemasan, merah, merah muda, ungu, dan putih. Dalam sistem klasifikasi terbaru, beberapa anggota genus Chrysanthemum berganti nama menjadi Dendranthema. Berikut merupakan klasifikasi krisan:
Kingdom : Plantae Divisi : Spermatophyta Subdivisi : Angiospermae Kelas : Dicotyledoneae Ordo : Asterales Famili : Asteraceae Genus : Dendranthema
Spesies : Dendranthema grandiflora Tzvelev.
Krisan memiliki bentuk bunga yang beragam. Oleh karena itu pengelompokkan krisan seringkali dilakukan berdasarkan bentuk bunganya. National Chrysanthemum Society dalam Crockett (1972) membuat klasifikasi sebagai berikut :
1. Tipe Pompon, memiliki diameter bunga antara 3-5 cm. Berbunga sepanjang musim gugur. Bunga berbentuk seperti bola, bagian piringan bunganya ada yang berwarna kuning, berupa cincin petal tunggal maupun ganda.
2. Tipe Button, memiliki diameter bunga kurang dari 3 cm, memiliki petal yang memeluk piringan bunga begitu erat sehingga nampak seperti pernah dipangkas. Berbunga pada musim gugur.
3. Tipe Decorative, memiliki diameter bunga antara 5-10 cm. Berbunga pada akhir musim panas hingga akhir musim gugur. Bentuknya menyerupai tipe pompon namun bagian tepi bunga lebih panjang.
Gambar 1. Bentuk bunga krisan : (A). Tipe Pompon, (B). Tipe Button, (C). Tipe Decorative, (D) Tipe Single (Sumber : Gambar A, B, C berasal dari www. mums.org, Gambar D berasal dari www.cyrosellaflower.wordpress.com
Selain keempat tipe tersebut, masih terdapat tipe lain menurut Crockett (1972) yang kurang umum direkomendasikan karena waktu mekarnya yang terlambat yaitu pada akhir musim gugur atau awal musim dingin sehingga memerlukan perlindungan di rumah kaca, antara lain :
1. Tipe Spoon, memiliki diameter bunga antara 7-12 cm, memiliki tabung petal dengan ujung tiap petal mengembang mejadi bagian yang berbentuk seperti sendok. Warna pada bagian ujung petalnya lebih cerah dibanding bagian petal lainnya.
2. Tipe Quill, mirip dengan tipe spoon namun bagian ujung petalnya tertutup. 3. Tipe Anemone, memiliki bagian dasar piringan bunga yang berbentuk
seperti bantalan.
4. Tipe Spider, memiliki petal yang unik dan panjang serta melengkung ke atas.
B A
Gambar 2. Bentuk bunga krisan : (A). Tipe Spoon, (B). Tipe Quill, (C). Tipe Anemone, (D). Tipe Spider. (Sumber :www.mums.org )
Syarat Tumbuh Tanaman Krisan
Krisan merupakan tanaman yang berasal dari daerah subtropis sehingga memerlukan lingkungan yang cukup sejuk untuk dapat tumbuh dengan baik.Di daerah subtropis menurut Crockett (1977), krisan dapat tumbuh dengan baik pada suhu siang di bawah 200C sedangkan pada malam hari antara 4-100C. Menurut BBPP Lembang (1999), suhu untuk pertumbuhan krisan pada siang hari di daerah tropis adalah 20-280 C dan pada malam hari sekitar 15-200C, dengan kelembapan udara 90-95% pada awal pertumbuhan dan kelembapan udara 70-80% setelah tanaman cukup dewasa. Di Indonesia krisan dapat tumbuh dengan baik pada daerah dengan ketinggian 600-1200 mdpl.
Menurut Boodley (1998), media untuk penanaman krisan dapat berupa campuran tanah lempung, Sphagnum peat moss, dan perlite dengan perbandingan 1:1:1. Campuran media tersebut memiliki drainase dan aerasi yang baik sehingga
C
B A
tidak terlalu berat dan dapat disterilisasi dengan mudah (Boodley, 1998). Penanaman dilakukan dengan kerapatan 64 tanaman/m2 pada musim hujan dan 72-80 tanaman/m2 pada musim kemarau (BBPP Lembang, 1999). Tanaman krisan membutuhkan air dalam jumlah yang memadai, namun tanaman krisan tidak tahan terhadap terpaan air hujan. Oleh karena itu menurut BBPP Lembang (1999), untuk budidaya krisan di daerah dengan curah hujan tinggi dibutuhkan bangunan rumah plastik
Tanaman krisan merupakan tanaman hari pendek dengan batas kritis panjang hari (critical daylength) sekitar 14.5 jam (Boodley, 1998). Tanaman krisan akan berbunga bila panjang hari yang diterima kurang dari batas kritisnya dan akan tetap berada dalam fase vegetatif selama panjang hari yang diterima melebihi batas kritisnya. Indonesia merupakan negara tropis dengan panjang siang dan malam yang relatif sama yaitu 12 jam. Oleh karena itu tanaman krisan perlu mendapat perlakuan khusus selama masa pertumbuhannya. Untuk memacu pertumbuhan selama fase vegetatif, biasanya dilakukan pemberian cahaya buatan 3-4 jam setiap malam selama 4-5 minggu (tergantung varietas) dengan menggunakan lampu TL atau lampu pijar (BBPP Lembang, 1999). Menjelang fase generatif, pemberian cahaya buatan dihentikan karena untuk merangsang pembungaan pada krisan dibutuhkan lama penyinaran yang kurang dari titik kritisnya.
Selain dipengaruhi oleh lama penyinaran, pembungaan pada krisan juga dipengaruhi oleh suhu lingkungan. Menurut Boodley (1998), untuk pembungaan pada krisan dibutuhkan suhu malam pada kisaran 15.5-16.50C dan suhu siang antara 18.5-210C. Pembungaan krisan akan terhambat pada suhu siang di atas 27.50C. Untuk memperbaiki kualitas warna bunga, biasanya suhu pada malam hari diturunkan hingga 130C pada sepuluh hari menjelang tanaman siap dipanen (Boodley, 1998).
- Bercak daun akibat cendawan Septoria chrysanthemella, yang dapat menyebabkan bercak-bercak hitam pada daun dan menghambat proses fotosintesis.
- Bakteri Erwinia chrysanthemi dan cendawan Verticillium alboatrum yang menyebabkan layu pada tanaman. Pencegahannya dapat dilakukan melalui sterilisasi media tumbuh, penggunaan kultivar yang resisten, dan aplikasi kultur meristem.
- Bercak pada petal bunga yang menyebabkan hilangnya nilai keindahan bunga akibat serangan Botrytis cinerea. Pencegahan dilakukan dengan memperbaiki ventilasi dan pergerakan udara di dalam rumah kaca/plastik serta membuang kuncup bunga yang telah terserang bercak.
Varietas Tanaman Krisan Indonesia
Tanaman krisan diintroduksikan ke Indonesia pada tahun 1800 dan mulai dikembangkan secara komersial pada tahun 1940 (Hadi, 2008). Menurut Hadi (2008), jenis dan varietas tanaman krisan di Indonesia umumnya merupakan hibrida yang berasal dari Belanda, Amerika Serikat dan Jepang. Jenis krisan yang ditanam di Indonesia antara lain berupa:
a) Krisan lokal (krisan kuno) yang berasal dari luar negeri, tetapi telah lama beradaptasi di Indonesia dan telah dianggap sebagai krisan lokal. Ciri-cirinya ialah mampu berbunga pada hari netral dengan siklus hidup antara 7-12 bulan dalam satu kali penanaman. Contohnya Chrysanthemum maximum berbunga kuning yang banyak ditanam di Lembang.
b) Krisan introduksi (krisan modern atau krisan hibrida). Krisan ini bersifat hari
pendek dan memiliki siklus hidup semusim. Contoh krisan ini adalah
Chrysanthemum indicum var. Dark Flamingo, C. indicum var. Dolaroid, C. indicum var. Indianapolis, dan sebagainya.
dihasilkan oleh Balithi di antaranya varietas Puspita Nusantara, Dewi Ratih, Candra Kirana, Puspita Asri, Cut Nyak Dien, Nyi Ageng Serang, Dewi Sartika, Sakuntala, Purbasari, dan Pitaloka.
Varietas Pitaloka merupakan varietas keluaran Balithi dengan nomor klon Balithi 13.14. Varietas ini merupakan hasil persilangan tetua 880077 dengan Klondike. Varietas ini dirilis pada tahun 2000 berdasarkan S.K. Menteri Pertanian No. 73 tahun 2000, dengan tim pemulia Budi Marwoto, dkk. Varietas Pitaloka memiliki bunga tipe anemone dan jenis bunga spray dengan warna bunga pita ungu dan diameter bunga pita 4.6 cm. Umur tanaman antara 80-100 hari, adaptif pada dataran sedang hingga tinggi, dan bunganya memiliki masa kesegaran hingga 14 hari (deskripsi varietas pada Lampiran 1).
Kultur Jaringan Tanaman
Kultur Jaringan Tanaman
Kultur jaringan tanaman merupakan suatu metode untuk mengisolasi bagian dari tanaman seperti protoplasma, sel, sekelompok sel, jaringan, dan organ, serta menumbuhkannya dalam kondisi aseptik, sehingga bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman utuh kembali (Gunawan, 1992). Caponetti et al. (2005) menyatakan bahwa prinsip dasar kultur jaringan ialah kemampuan komponen tubuh tanaman (organ, jaringan, atau sel) untuk ditumbuhkan secara terpisah dalam suatu media in vitro menjadi tanaman yang utuh kembali. Menurut Zulkarnain (2009), teknik kultur jaringan memiliki beberapa keuntungan yaitu dapat menghasilkan jutaan klon dalam waktu setahun
hanya dari sejumlah kecil material awal, menawarkan suatu alternatif bagi spesies-spesies yang resisten terhadap sistem perbanyakan vegetatif konvensional, adanya suatu kemungkinan untuk mempercepat pertukaran bahan tanaman di tingkat internasional, dan perbanyakan dengan teknik kultur jaringan tidak bergantung pada musim.
Kultur Jaringan Krisan
Krisan merupakan salah satu jenis tanaman yang telah banyak diteliti perbanyakannya secara kultur jaringan. Kemampuan krisan untuk dapat tumbuh dengan mudah pada media tanam in vitro membuat tanaman ini menjadi topik populer yang diteliti banyak orang selama lima tahun belakangan ini. Selain itu, produk bunga potongnya yang masih mendominasi pasar di Indonesia membuat penelitian kultur jaringan krisan masih terus dikembangkan.
Penelitian kultur jaringan krisan sebagian besar berkisar tentang konsentrasi zat pengatur tumbuh yang efektif terhadap pertumbuhan krisan secara
in vitro. Penelitian lain ialah seputar penggunaan iradiasi sinar radioaktif untuk menghasilkan tanaman krisan yang mengalami variasi somaklonal sehingga diperoleh tanaman krisan dengan warna bunga yang baru. Penelitian ke arah embriogenesis somatik pada krisan sangat jarang dilakukan terutama karena proses embriogenesis membutuhkan waktu yang lebih lama sehingga dirasakan kurang ekonomis.
Pada tahun 2004, Windasari meneliti tentang pemberian NAA dan kinetin terhadap pertumbuhan krisan varietas Delano Red secara in vitro. Windasari (2004) memperoleh hasil bahwa pemberian NAA pada konsentrasi 0.1 mg/l memberikan hasil yang optimum untuk jumlah daun dan tinggi planlet krisan varietas Delano Red, sedangkan pemberian kinetin hingga 2.5 mg/l menunjukkan pengaruh yang baik bagi jumlah daun, namun pertumbuhan akar planlet menjadi terhambat. Kombinasi NAA 0.1 mg/l dengan kinetin 2.5 mg/l memberikan hasil tertinggi untuk jumlah tunas dan jumlah buku, namun eksplan hanya membentuk kalus pada bagian bawahnya dan tidak mampu berakar.
Maryani dan Zamroni (2005), memperoleh hasil bahwa kombinasi IAA 1 mg/l dengan BAP 1 mg/l menghasilkan jumlah tunas terbanyak pada perbanyakan krisan secara in vitro, namun pemberian IAA dan BAP tidak berpengaruh nyata terhadap tinggi tunas. Penelitian yang dilakukan oleh Syaifan (2010) terhadap dua varietas krisan yaitu Puspita Nusantara dan Puspita Asri menunjukkan bahwa pemberian BA 4.44 μM mendorong terbentuknya jumlah daun per eksplan yang terbanyak, sedangkan pemberian BA 6.66 μM menghasilkan jumlah tunas terbanyak. Pada penelitian yang dilakukan Syaifan (2010), perlakuan kontrol (tanpa ZPT) mampu menghasilkan tunas tertinggi dan panjang ruas terpanjang.
Penelitian mengenai penggunaan iradiasi sinar gamma secara in vitro
dilakukan oleh Sari (2011) terhadap krisan varietas Puspita Nusantara, Puspita Asri, Cut Nyak Dien, dan Dewi Ratih. Hasilnya menunjukkan bahwa dosis radiasi sinar gamma 0.5 krad atau lebih ternyata mampu menginduksi keragaman somaklonal pada keempat varietas tersebut. Maharani (2011) juga melakukan penelitian iradiasi sinar gamma secara in vitro pada krisan varietas Puspita Nusantara dan Dewi Ratih. Hasilnya menunjukkan bahwa dosis iradiasi sinar gamma 20 Gy mampu meningkatkan keragaman (bentuk, ukuran, dan warna daun) krisan kedua varietas tersebut. Mutan yang dihasilkan memiliki bentuk daun yang kecil, tepi daun tak bergerigi, serta warna daun menjadi variegata.
Media Kultur Jaringan
Media merupakan salah satu komponen penting dalam kultur jaringan tanaman. Keberhasilan kultur jaringan tanaman sebagian besar bergantung pada ketepatan komposisi media yang digunakan (Evans et al., 2003). Media tersebut akan berperan dalam menyediakan lingkungan fisik bagi pertumbuhan sel dan jaringan atau dengan kata lain, media memiliki fungsi seperti tanah yang menyokong pertumbuhan suatu tanaman. Selain itu, media juga berperan menyediakan nutrisi bagi sel atau jaringan sehingga mampu mengalami pembelahan dan membentuk organ tanaman secara lengkap.
Menurut Chawla (2002), sangatlah penting untuk mengetahui jenis tanaman apa yang digunakan serta tujuan akhir apa yang diharapkan dari eksplan yang ditumbuhkan secara in vitro tersebut, karena dari pengetahuan akan kedua faktor itulah maka kita bisa menentukan jenis media apa yang dapat digunakan dengan tepat. Selanjutnya, nutrisi dalam media kultur jaringan meliputi komposisi dari garam-garam mineral yang ditambahkan, sumber karbon, vitamin, fitohormon, dan suplemen organik lainnya (Chawla, 2002).
Sel, jaringan dan organ hanya akan tumbuh pada kultur yang disuplai nutrisi yang sesuai (Thomas dan Davey, 1975). Oleh karena itu, kultur jaringan tanaman membutuhkan suplai dari beberapa komponen anorganik secara berkelanjutan (Dodds dan Roberts, 1995). Sumber hara makro dan mikro bagi tanaman diperoleh dari garam-garam anorganik yang ditambahkan ke dalam media. Menurut Zulkarnain (2009) unsur hara nitrogen dapat diberikan dalam bentuk garam KNO3 atau NH4NO3; sedangkan fosfor dapat diperoleh dalam
bentuk NaH2PO4.H2O atau KH2PO4; untuk unsur kalium diberikan melalui garam
KCl, KNO3, atau KH2PO4. Kebutuhan akan magnesium dan belerang dapat
diperoleh melalui MgSO4.7H2O, kebutuhan akan seng diperoleh dari
ZnSO4.7H2O, kebutuhan tembaga berasal dari CuSO4.5H20, kebutuhan mangan
didapat dari MnSO4.H2O, unsur boron dapat terpenuhi melalui penambahan
H3BO3, serta molibdenum diperoleh dari Na2MoO4.2H20 atau dari Molibdenum
Sebagai sumber karbon biasa digunakan sukrosa atau glukosa (Chawla, 2002). Konsentrasi sukrosa yang biasa digunakan berkisar antara 2-5%. Menurut Gunawan (1992), fruktosa dan galaktosa kurang efektif digunakan sebagai sumber karbon sedangkan manosa dan laktosa merupakan jenis karbohidrat yang paling tidak efektif. Vitamin ditambahkan sebagai penyusun kofaktor bagi enzim yang berperan dalam berbagai prosesmetabolisme (Zulkarnain, 2009). Menurut Evans et al. (2003), peranan vitamin bagi sel tanaman dan kultur jaringan tidaklah terlalu esensial, kecuali vitamin B1 (thiamine), namun sejumlah vitamin seperti
nicotinic acid (niasin), pyridoxine HCl (B6), asam folat (B11), asam panthotenat, biotin, vitamin C, dan vitamin E sering ditambahkan ke dalam media. Senyawa gula alkohol seperti myo-inositol terkadang ditambahkan ke dalam media kultur tanaman monokotil, Gymnospermae, dan beberapa tanaman dikotil (Evans et al., 2003). Penambahan myo-inositol ke dalam media berperan dalam memperbaiki pertumbuhan dan morfogenesis jaringan yang dikulturkan (Gunawan, 1992).
Selain senyawa organik yang konstitusinya jelas, terkadang ke dalam media kultur jaringan juga ditambahkan persenyawaan yang kompleks yang komposisinya berbeda dari sumber yang satu dengan yang lainnya seperti air
kelapa, casein hydrolisate, ekstrak ragi, jus tomat, dan ekstrak pisang (Gunawan, 1992). Bila ditinjau dari sudut ilmiah, Zulkarnain (2009) menyatakan
bahwa penggunaan ekstrak alami masih dapat dianjurkan dan kehadiran senyawa tersebut tak dapat diabaikan begitu saja apabila ternyata senyawa-senyawa murni tidak dapat memenuhi apa yang diharapkan.
Zat Pengatur Tumbuh
pada mulanya hanya dapat diisolasi dari jaringan tumbuhan namun seiring berkembangnya ilmu pengetahuan, beberapa jenis senyawa sintetik yang memiliki aktivitas menyerupai hormon tumbuhan dapat diproduksi di laboratorium. Kondisi inilah yang kemudian mengaburkan definisi mengenai hormon tumbuhan, bahwa senyawa sintetik tersebut juga seringkali disebut sebagai hormon.
Arteca (1996) kemudian membuat batasan mengenai konsep hormon tumbuhan dengan memberikan tiga syarat suatu senyawa dapat digolongkan sebagai fitohormon yaitu :
1. Senyawa tersebut disintesis oleh bagian tubuh tumbuhan dan tersebar secara meluas pada semua anggota kerajaan tumbuhan.
2. Senyawa tersebut menunjukkan aktivitas biologis yang spesifik pada konsentrasi sangat rendah.
3. Senyawa tersebut mampu menimbulkan respon fisiologis selama masa pertumbuhan.
Mengenai senyawa sintetik yang memiliki kemampuan serupa dengan hormon tumbuhan tertentu, Arteca (1996) kemudian menggunakan istilah zat pengatur tumbuh (plant growth regulator) untuk menyebut senyawa-senyawa tersebut berdasarkan definisi dari Johannes van Overbeek bahwa zat pengatur tumbuh merupakan komponen organik selain nutrisi yang pada konsentrasi rendah mampu memacu, menghambat, atau bahkan mengubah proses fisiologis pada tumbuhan.
Auksin
Auksin berasal dari bahasa Yunani auxein yang berarti meningkatkan dan istilah ini pertama kali digunakan oleh Frits Went yang menemukan bahwa suatu senyawa yang belum dapat dicirikan mampu menyebabkan pembengkokan koleoptil oat ke arah cahaya (Salisbury dan Ross, 1995).Senyawa yang ditemukan oleh Went tersebut kemudian dikenal sebagai indole-3-acetic acid (IAA). Pada tahun 1934, KÖgl dan Kostermans mengisolasi IAA dari khamir dan pada tahun
berikutnya Thimann berhasil mengisolasi IAA dari kultur cendawan
p t k m m m h t o u t b Saat pembentuka terbentuknya keduanya da (a) Gamb Menu mengubah t meristem ta mengapa jar hasil pengu tersebut.Auk oleh enzim umumnya di tinggi antara Tran bawah sepan
Trypto
Indol
pyruvic
Indol
acetald
Indol
acetic
ini asam an IAA (Arta IAA dar apat berfung
bar 4. Skema
urut Salisbu triptofan me ajuk serta ringan terseb ukuran, kand ksin mudah IAA oksid itambahkan a 1-30 mg/l ( nspor IAA u
njang berka
ophan
le
‐
3
‐
c
acid
le
‐
3
‐
dehyde
le
‐
3
‐
c
acid
amino tri teca, 1996) ri asam am
si pada tanam
a biosintesis
ury dan Ro enjadi IAA
daun dan b but diduga dungan auk terdegradasi dase (Salibu dalam medi (Dodds dan R umumnya be s pembuluh Tryptopha transamina Indole pyruvate decarboxyl Indole acetaldehy dehydrogen iptofan dite . Menurut A mino triptofa
man (Gamba
IAA : (a). Ja
oss (1995), banyak terd buah yang sebagai sum ksin paling i oleh cahay ury dan Ro ia kultur jari Roberts, 199 erasal dari d h, bahkan au
T
T
ac
a
an ase e lase yde nase erima seba Arteca (199 fan, baik saar 4).
(b)
alur pertama
enzim yan dapat pada j
sedang tum mber dari IA
tinggi dite ya (Dodds da
ss, 1995). ingan pada k 95). daun muda y uksin sintetik
Tryptophan
Tryptamine
Indole
‐
3
‐
ethanol
Indole
‐
3
‐
cetaldehyd
Indole
‐
3
‐
acetic
acid
gai prekurs 96) terdapat
alah satuny
a (b). Jalur ke
ng paling ak jaringan mu mbuh.Itulah AA karena b mukan pad an Roberts, 1
Oleh karen konsentrasi y
yang berger k yang dibe
n
e
de
d
Try deca Ami Indo o ace dehy sor dalam t dua jalur ya ataupun edua ktif dalam uda seperti sebabnya berdasarkan da jaringan 1995) serta na itu IAAyang cukup
tanaman juga bergerak serupa dengan IAA (Salisbury dan Ross, 1995). Cara pengangkutan auksin tersebut menurut Salisbury dan Ross (1995) memiliki keistimewaan sebagai berikut :
1. Pergerakan auksin berlangsung secara lambat dengan kecepatan 1 cm/jam di akar dan batang.
2. Pengangkutan auksin berlangsung secara polar pada batang, dengan arah basipetal (dari pucuk menuju ke dasar), bahkan sekalipun dasar tersebut berada pada posisi terbalik sedangkan pada akar pengangkutan juga berlangsung secara polar dengan arah akropetal (mencari pucuk).
3. Pengangkutan auksin membutuhkan adanya energi dalam bentuk ATP, sehingga keberadaan senyawa apapun yang mampu menghambat respirasi tanaman ataupun ketidakhadiran oksigen secara otomatis akan menghambat pergerakan auksin.
Menurut Armini et al. (1992) auksin terutama berperan dalam pertumbuhan kalus, suspensi sel, dan pertumbuhan akar. Efek fisiologi dari auksin antara lain terlihat ada proses pemanjangan sel, fototropisme, dominansi apikal, inisiasi dan pemanjangan akar, produksi etilen, dan pertumbuhan buah (Arteca, 1996).
Menurut Arteca (1996), auksin sintetik telah banyak dijual secara komersial. Aktivitas auksin sintetik menyerupai IAA namun struktur kimianya berbeda. Terdapat enam kelas auksin sintetik saat ini yaitu :
1. Turunan indole seperti indole-3-acetic acid (IAA) dan indole-3-butyric acid (IBA).
2. Turunan asam benzoat seperti dicamba dan 2,3,6-trichlorobenzoic acid. 3. Turunan naftalena seperti α dan β-naphtalene-acetic acid (NAA)
4. Turunan fenoksi seperti 2,4-dichlorophenoxy acetic acid (2,4-D) dan 2,4,5-trichlorophenoxy acetic acid (2,4,5-T).
5. Turunan naphtoxyacetic acid seperti α dan - naphtoxyacetic acid (NOA) 6. Turunan asam pikolinat seperti picloram
diambil, kemampuan ekpslan untuk mensintesis auksin secara alami, dan interaksi antara auksin yang diberikan secara eksogen dengan auksin endogen (Armini et al., 1992). Misalnya saja auksin jenis IAA begitu mudah teroksidasi, sehingga penggunaannya dalam media kultur jaringan kurang efektif. NAA dapat menjadi pilihan alternatif, karena NAA cenderung lebih stabil dan sulit terdegradasi sehingga penggunaan pada konsentrasi rendah antara 0.1-2.0 mg/l sudah cukup (Dodds dan Roberts, 1995). Pada proses pembentukan kalus, umumnya 2,4-D menjadi pilihan utama karena kemampuannya merangsang pembentukan kalus meskipun tanpa kehadiran sitokinin (Dodds dan Roberts, 1995).
Sitokinin
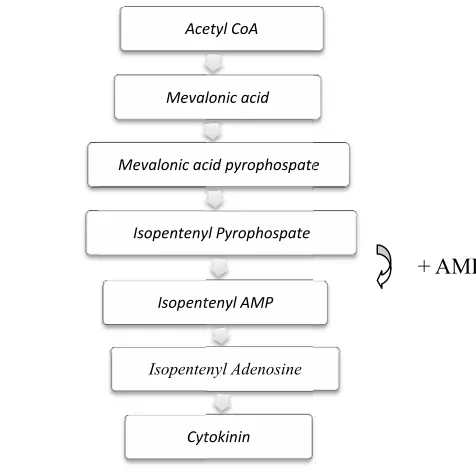
Menurut Srivastava (2001), sitokinin merupakan senyawa yang secara alami ditemukan secara bebas di sitoplasma dan juga menjadi komponen terintegrasi dari beberapa RNAt, di mana senyawa ini mampu meningkatkan pembelahan sel pada tanaman. Chesworth et al. (1998) menyatakan bahwa sitokinin menjadi penyusun 10% dari molekul RNAt. Sejarah penemuan sitokinin bermula pada tahun 1913 saat Gottlieb Haberlandt di Austria menemukan senyawa tak dikenal yang mampu merangsang pembelahan sel pada kambium gabus dan membantu pemulihan luka pada umbi kentang yang terpotong. Pada tahun 1940an Johannes van Overbeek juga menemukan adanya senyawa yang mampu merangsang pembelahan sel pada endosperma cair buah kelapa (Salibury dan Ross, 1995). Baru pada tahun 1955, Carlos Miller beserta koleganya yang bekerja di Laboratorium Skoog dan Strong di Universitas Wisconsin, berhasil mengisolasi suatu senyawa yang berasal dari sampel DNA ikan herring yang telah diautoklaf, yang kemudian diberi nama kinetin karena kemampuan senyawa tersebut dalam menginduksi pembelahan sel (Moore, 1979). Pada tahun 1964 secara hampir bersamaan D.S Letham dan Carlos Miller berhasil mengekstrak jenis sitokinin lain yaitu zeatin yang bersumber dari endosperma cair jagung (Salisbury dan Ross, 1995).
p y t S d K m G m ( d y t m p Saat pembentuka yang diperol tersebut mem Selain berpe dalam pemb KoA harus membentuk Gambar 5. Pada masih aktif 1972).Selain (1995), sitok disintesis di yang men tanaman.Sal mengandung pada kutu em
ini asetil K an sitokinin
leh dari pros masuki siklu eran dalam p bentukan gib
memasuki sitokinin (G
Skema pe (Arteca, 19
a dasarnya s membelah n terdapat pa
kinin juga t akar dan di unjukkan lisbury dan g sitokinin mbun madu. KoA merupa (Arteca, 19 ses dekarbok us Krebs dala
pembentuka berelin, karot rangkaian Gambar 5). embentukan 996). sitokinin ba seperti keca ada organ ya terdapat di translokasik bahwa sit Ross (1995 seperti yang Ace Meval Mevalonic ac Isopenteny Isopent Isopente Cyt akan senyaw 996). Asetil ksilasi oksida am rantai res an sitokinin, tenoid, dan a panjang lin
sitokinin m
anyak ditem ambah dan ang masih m
ujung akar. kan ke pucuk
tokinin dit 5) menyatak g dibuktikan etyl CoA lonic acid cid pyrophospate yl Pyrophospate tenyl AMP enyl Adenosine tokinin
wa yang me KoA sendir atif asam pir spirasi (Salis asetil KoA asam absisat ntasan asam
melalui lint
mukan di jar buah yang muda, menur
Menurut A k karena beg temukan d kan bahwa n dengan d
e
+
njadi prekur ri merupaka ruvat sebelum
sbury dan R juga berper t (Arteca, 19 m mevalona tasan asam ringan yang masih muda rut Salisbury Arteca (1996 gitu banyakn di pembulu
pembuluh f ditemukanny + AMP rsor dalam an senyawa m senyawa Ross, 1995). ran penting 996). Asetil at sebelum mevalonat sel-selnya a (Weaver, y dan Ross 6) sitokinin nya laporan
uh xilem floem juga
Terdapat beberapa respon biologis yang menyebabkan konsentrasi sitokinin dapat meningkat antara lain saat pembelahan sel, pembentukan organ, pembesaran sel dan organ, penghambatan degradasi klorofil, perkembangan kloroplas, penundaan senescens, pembukaan dan penutupan stomata, serta perkembangan kuncup dan tunas (Arteca, 1996). Selain ditemukan pada tanaman, sitokinin juga ditemukan pada lumut, beberapa jenis bakteri seperti
Agrobacterium sp. dan Pseudomonas sp., beberapa cendawan patogen seperti
Helminthosporium sp. dan Ustilago sp., serta ganggang cokelat dan ganggang merah (Salisbury dan Ross, 1995; Srivastava, 2001).
BAHAN DAN METODE
Tempat dan Waktu
Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan Tanaman 3 Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor pada bulan Februari hingga Mei 2012.
Bahan dan Alat
Bahan tanaman (eksplan) yang digunakan adalah stek buku tunggal dari planlet krisan varietas Pitaloka koleksi Laboratorium Kultur Jaringan 3 hasil subkultur kedua berumur dua bulan. Media kultur yang digunakan ialah media padat Murashige dan Skoog (MS) yang mengandung hara makro dan mikro (Lampiran 2). Bahan pemadat yang digunakan adalah agar komersial sebanyak 7 g/l dan sebagai pengatur keasaman media digunakan KOH 1 N. Zat pengatur tumbuh yang digunakan ialah IAA dan kinetin. Bahan lain yang digunakan meliputi akuades, alkohol 70%, povidone iodine 10%, dan bahan pemutih komersial yang mengandung natrium hipoklorit. Peralatan yang digunakan berupa
laminar airflow cabinet, autoklaf listrik, kertas lakmus, botol kultur, timbangan analitik, dan peralatan tanam standar laboratorium.
Metode Penelitian
Model linier rancangan yang digunakan adalah : Yij =
µ
+α
i +β
j + (αβ
)ij +ε
ijkKeterangan :
Yij = nilai pengamatan karena ada pengaruh dari konsentrasi IAA ke-i dan
konsentrasi kinetin ke-j
i = 1,2,3, j = 1,2,3,4 µ = nilai rataan umum
αi = nilai tambahan karena pengaruh perlakuanIAA dengan konsentrasi ke-i
βj = nilai tambahan karena pengaruh perlakuan kinetin dengan konsentrasi
ke-j
(αβ)ij = pengaruh interaksi perlakuan konsentrasi IAA ke-i dan konsentrasi
kinetin ke-j
ε
ijk = galat pada perlakuan konsentrasi IAAke-i, konsentrasi kinetin ke-jData pengamatan dianalisis dengan uji F pada taraf 5%, jika terdapat hasil yang berpengaruh nyata maka dilakukan uji lanjut dengan DMRT (Duncan Multiple Range Test) pada taraf 5%. Perangkat lunak yang digunakan untuk pengolahan data adalah SAS versi 9.1 dengan program GLM (General Linear Manager) dan Minitab.
Pelaksanaan a. Sterilisasi alat-alat tanam
Alat-alat yang akan digunakan untuk penanaman secara in vitro
b. Pembuatan media tanam in vitro
Media tanam in vitro yang digunakan berupa media padat MS dengan penambahan ZPT IAA dan kinetin. Pembuatan media dilakukan dengan pembuatan larutan stok hara MS yang terdiri atas stok A, B, C, D, E, F, myo-inositol, dan vitamin (lampiran 2). Selanjutnya dilakukan pengambilan larutan stok dengan menggunakan pipet sesuai kebutuhan serta dilakukan penambahan IAA dan kinetin sesuai perlakuan. Selanjutnya larutan media tersebut dimasukkan dalam labu takar dan ditambahkan larutan gula sebanyak 30 g/l kemudian dilakukan tera dengan akuades hingga volume 1 liter. Proses pengaturan pH hingga mencapai derajat kemasaman media sekitar 5.6-5.8 dilakukan melalui penambahan KOH 1N. Larutan kemudian dituang dalam panci untuk dimasak bersama dengan agar sebanyak 7 g/l. Media yang sudah jadi dituang ke dalam botol-botol kultur yang telah disterilisasi terlebih dahulu sebanyak 20 ml/botol. Botol-botol kultur tersebut kemudian ditutup plastik dan disterilisasi dengan autoklaf pada suhu 121o C tekanan 17.5 psi selama 20 menit.
c. Persiapan Eksplan
Eksplan yang digunakan berupa stek buku tunggal yang dibuang terlebih dahulu daunnya. Selanjutnya di dalam laminar airflow, eksplan tersebut direndam dalam larutan akuades steril yang ditetesi 8-10 tetes povidone iodine 10% selama 5 menit. Eksplan lalu ditanam dalam media sesuai dengan jenis perlakuan masing-masing.
Botol-botol kultur yang berisi eksplan lalu disimpan dalam ruang kultur yang diberi penyinaran lampu TL 36 watt selama 24 jam per hari pada suhu 200C sejak awal penanaman hingga 9 MSK.
d. Pengamatan
Pengamatan dilakukan seminggu sekali dimulai sejak satu minggu setelah kultur (MSK) hingga 9 MSK. Peubah yang diamati antara lain :
2. Jumlah daun per eksplan, yang meliputi jumlah seluruh daun dari tiap eksplan.
3. Jumlah akar per eksplan, yang meliputi jumlah seluruh akar yang dimiliki setiap eksplan.
4. Jumlah buku per eksplan, yang meliputi jumlah buku total yang dimiliki setiap eksplan.
5. Jumlah tunas, meliputi jumlah tunas yang terbentuk pada tiap eksplan 6. Tinggi planlet, diukur dari permukaan media hingga titik tumbuh tanaman.
Pengukuran dilakukan tanpa mengeluarkan eksplan dari botol.
7. Panjang akar, diamati pada 9 MSK dengan mengeluarkan planlet dari botol kultur. Panjang akar diukur dari pangkal akar sampai ujung akar terpanjang.
HASIL DAN PEMBAHASAN
Kondisi Umum
Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan 3, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, IPB selama sembilan minggu sejak Februari hingga Mei 2012. Kondisi laboratorium tempat dilakukan penelitian memiliki kisaran suhu antara 18-200C dan kelembaban udara mencapai 90%. Selama masa kultur, eksplan diletakkan pada rak dengan penyinaran selama 24 jam. Kondisi ini bertujuan agar eksplan dapat tumbuh secara optimal dengan tingkat kontaminasi yang minimum.
[image:40.612.124.505.381.526.2]Pada pengamatan minggu pertama setelah kultur (1 MSK), persentase eksplan yang hidup adalah 100%. Saat kultur memasuki minggu kedua, gejala kontaminasi mulai terlihat pada beberapa botol. Kontaminasi yang terjadi disebabkan oleh cendawan dan bakteri.
Gambar 6. Gejala Kontaminasi Selama Masa Kultur : (A). Kontaminasi Cendawan, (B). Kontaminasi Bakteri
Eksplan yang terkontaminasi selanjutnya diselamatkan dengan cara disterilisasi pada larutan natrium hipoklorit 5% dan povidone iodine 10%, baru kemudian eksplan dipindahkan pada media lain yang komposisinya sama. Proses sterilisasi yang dilakukan seringkali menyebabkan kerusakan pada sel-sel eksplan sehingga kebanyakan eksplan yang telah terkontaminasi kemudian dicoba untuk diselamatkan memiliki daya hidup yang rendah, bahkan menjadi mati. Tingginya tingkat kontaminasi inilah yang menyebabkan proses pengolahan data dilakukan
dengan menggunakan program GLM (General Linear Manager). Hingga akhir masa pengamatan (9 MSK), persentase planlet yang hidup adalah 67.5%.
Pembahasan Umum
Krisan varietas Pitaloka merupakan salah satu varietas produksi Balithi yang memiliki potensi untuk dikembangkan di masyarakat. Petal bunganya yang berwarna ungu memiliki keindahan tersendiri dan jarang ditemukan di pasaran. Selama ini para petani krisan masih jarang menggunakan varietas keluaran Balithi dengan alasan masa vase life bunga potongnya yang relatif singkat. Pemilihan krisan varietas Pitaloka dalam penelitian ini diharapkan dapat memacu masyarakat untuk mulai mau menggunakan varietas yang dihasilkan oleh para pemulia dalam negeri.
Selama tahap kultur in vitro, penambahan ZPT IAA tidak memberikan pengaruh yang nyata terhadap pertumbuhan planlet krisan varietas Pitaloka. Hal tersebut terlihat dari hasil pengamatan di mana hampir sebagian besar eksplan pada perlakuan kontrol (tanpa ZPT) menunjukkan respon pertumbuhan lebih baik dibanding eksplan yang diberi perlakuan IAA. Kandungan auksin endogen yang dimiliki tanaman krisan diduga sudah cukup tinggi sehingga penambahan auksin dari luar justru menghambat pertumbuhan tanaman. Hasil serupa juga diperoleh pada penelitian Syaifan (2010) di mana perlakuan kontrol (tanpa ZPT) mampu menghasilkan tunas tertinggi dan panjang ruas terpanjang.
Kemampuan tumbuh tanaman krisan pada media MS tanpa tambahan auksin dari luar dapat memberikan keuntungan tersendiri bagi para produsen bibit krisan hasil kultur jaringan, di mana alokasi biaya untuk ZPT auksin dapat dikurangi sehingga biaya produksi bibit kultur jaringan krisan dapat ditekan sedemikian rupa. Dampaknya tentu saja akan terlihat pada harga jual bibit krisan kultur jaringan yang bisa dijual lebih murah sehingga bisa bersaing dengan bibit krisan yang diperbanyak secara vegetatif konvensional.
efek dominansi apikal (Arteca, 1996). Oleh karena itu penambahan sitokinin pada media perbanyakan krisan varietas Pitaloka secara in vitro masih diperlukan untuk merangsang produksi tunas dan daun yang lebih banyak.
Jumlah Tunas
[image:42.612.238.402.377.501.2]Pada minggu pertama setelah kultur (1 MSK), persentase eksplan yang telah membentuk tunas sebanyak 32.08%. Satu eksplan rata-rata hanya menghasilkan satu tunas saja. Pada umur 2 MSK tunas yang terbentuk mulai membuka daunnya dan mulai memperlihatkan pertumbuhan yang cukup jelas. Pada akhir pengamatan (9 MSK) persentase eksplan yang membentuk tunas mencapai 89.58%. Eksplan yang tidak membentuk tunas umumnya berupa eksplan yang hanya mendapat perlakuan tunggal IAA tanpa kinetin, di mana eksplan tersebut membentuk kalus dan hanya mampu berakar saja.
Gambar 7. Tunas yang terbentuk pada kultur in vitro krisan varietas Pitaloka perlakuan kinetin 0.5 mg/l pada 1 MSK
Tabel 1. Hasil uji F Pengaruh Konsentrasi IAA dan Kinetin terhadap Jumlah Tunas pada Kultur in vitro Krisan Varietas Pitaloka
Umur (MSK) Konsentrasi IAA (mg/l)
Konsentrasi Kinetin (mg/l)
Interaksi IAA dan Kinetin
KK (%)
7 tn ** tn 8.56
8 tn ** tn 9.10
9 tn ** tn 9.96
Keterangan : tn : Tidak nyata pada uji F 5% * : Nyata pada uji F 5%
** : Sangat nyata pada uji F 1% MSK : Minggu Setelah Kultur KK : Koefisien Keragaman
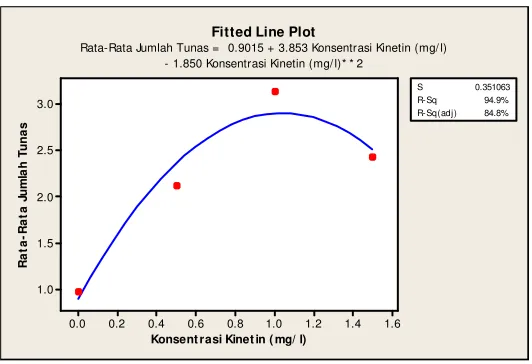
Data yang terbentuk merupakan hasil transformasi √ 5
Rata-rata jumlah tunas terbanyak diperoleh pada perlakuan kinetin 1 mg/l yaitu sebanyak 3.18 tunas. Rata-rata jumlah tunas terendah diperoleh pada perlakuan tanpa ZPT (kontrol). Terlihat bahwa pemberian kinetin mampu menstimulasi pembentukan tunas. Menurut Armini et al. (1992), pemberian sitokinin akan merangsang proliferasi tunas, di mana melalui pemberian sitokinin, bagian ketiak stek yang dorman atau hanya mampu menghasilkan satu tunas akan mampu menghasilkan lebih dari satu tunas.
Tabel 2. Pengaruh Konsentrasi Kinetin terhadap Jumlah Tunas pada Kultur
in vitro Krisan Varietas Pitaloka
Konsentrasi Kinetin
(mg/l)
Umur (MSK)
7 8 9
0 0.91c 0.95c 0.98c
0.5 1.61bc 1.78b 2.13b
1.0 2.86a 3.05a 3.18a
1.5 1.78b 2.16b 2.44ab
Keterangan: Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji lanjut DMRT taraf 5%.
Konsent rasi Kinet in ( mg/ l) R a ta -R a ta J u m la h T u n a s 1.6 1.4 1.2 1.0 0.8 0.6 0.4 0.2 0.0 3.0 2.5 2.0 1.5 1.0 S 0.351063 R-Sq 94.9% R-Sq(adj) 84.8% Fitted Line Plot
Rata-Rata Jumlah Tunas = 0.9015 + 3.853 Konsentrasi Kinetin (mg/ l) - 1.850 Konsentrasi Kinetin (mg/ l)* * 2
Gambar 8. Analisis Regresi Pengaruh Konsentrasi Kinetin terhadap Jumlah Tunas Kultur in vitro Krisan Varietas Pitaloka pada 9 MSK
Berdasarkan hasil uji lanjut terlihat bahwa pemberian kinetin hingga konsentrasi 1 mg/l (4.64 μM) memberikan respon yang maksimum terhadap jumlah tunas, sebaliknya penambahan konsentrasi kinetin hingga 1.5 mg/l (6.96 μM) menunjukkan penurunan jumlah tunas (lampiran 3). Hasil serupa juga terlihat pada penelitian Syaifan (2010) pada krisan varietas Puspita Asri dan Puspita Nusantara di mana pemberian BA hingga konsentrasi 6.73 μM mampu menghasilkan rata-rata jumlah tunas terbanyak, namun penambahan konsentrasi BA melebihi 6.73 μM justru menurunkan rata-rata jumlah tunas. Hal ini menunjukkan bahwa pemberian sitokinin pada konsentrasi optimum akan mampu memberikan respon yang maksimal terhadap pertumbuhan tanaman, namun peningkatan konsentrasi sitokinin melewati titik optimumnya justru akan menghambat pertumbuhan tanaman.
Jumlah Buku
[image:44.612.187.453.77.259.2]Tabel 3. Hasil uji F Pengaruh Konsentrasi IAA dan Kinetin terhadap Jumlah Buku pada Kultur in vitro Krisan Varietas Pitaloka
Umur (MSK) Konsentrasi IAA (mg/l)
Konsentrasi Kinetin (mg/l)
Interaksi IAA dan Kinetin
KK (%)
7 tn ** * 17.63
8 tn ** * 18.84
9 tn ** * 20.01
Keterangan : tn : Tidak nyata pada uji F 5% * : Nyata pada uji F 5% ** : Sangat nyata pada uji F 1% MSK : Minggu Setelah Kultur KK : Koefisien Keragaman
Data yang terbentuk merupakan hasil transformasi √ 5
Tabel 4. Pengaruh Konsentrasi Kinetin terhadap Jumlah Buku pada Kultur
in vitro Krisan Varietas Pitaloka
Konsentrasi Kinetin
(mg/l)
Umur (MSK)
7 8 9
0 4.32b 5.36b 5.75b
0.5 4.00b 5.04b 6.15b
1.0 6.98a 8.27a 10.59a
1.5 3.25b 4.22b 5.13b
Keterangan: Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji lanjut DMRT taraf 5%.
Buku (node) merupakan titik tempat tumbuhnya daun dan tunas lateral. Kinetin memiliki peran dalam proses pembentukan tunas samping dan jaringan mesofil daun (Wareing dan Philips, 1970). Oleh karena itu penambahan kinetin hingga konsentrasi 1 mg/l meningkatkan rata-rata jumlah buku, namun penambahan kinetin hingga konsentrasi 1.5 mg/l justru menunjukkan respon penurunan rata-rata jumlah buku.
daun yang berhubungan dengan bagian buku tempat melekatnya daun tersebut. Lapisan tersebutlah yang mencegah agar daun tanaman tidak gugur sebelum waktunya.
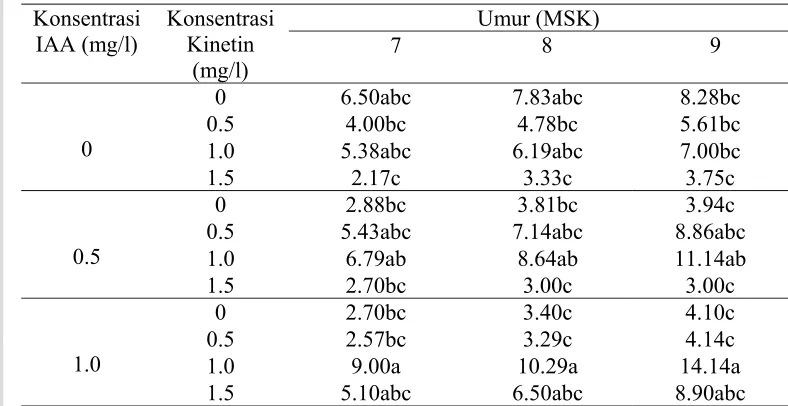
Tabel 5. Pengaruh Interaksi IAA dan Kinetin terhadap Jumlah Buku pada Kultur
in vitro Krisan Varietas Pitaloka
Konsentrasi IAA (mg/l)
Konsentrasi Kinetin
(mg/l)
Umur (MSK)
7 8 9
0
0 6.50abc 7.83abc 8.28bc 0.5 4.00bc 4.78bc 5.61bc 1.0 5.38abc 6.19abc 7.00bc 1.5 2.17c 3.33c 3.75c
0.5
0 2.88bc 3.81bc 3.94c 0.5 5.43abc 7.14abc 8.86abc 1.0 6.79ab 8.64ab 11.14ab 1.5 2.70bc 3.00c 3.00c
1.0
0 2.70bc 3.40c 4.10c 0.5 2.57bc 3.29c 4.14c 1.0 9.00a 10.29a 14.14a 1.5 5.10abc 6.50abc 8.90abc
Keterangan: Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji lanjut DMRT taraf 5%.
Jumlah Daun
Tabel 6. Hasil uji F Pengaruh Konsentrasi IAA dan Kinetin terhadap Jumlah Daun pada Kultur in vitro Krisan Varietas Pitaloka
Umur (MSK) Konsentrasi IAA (mg/l)
Konsentrasi Kinetin (mg/l)
Interaksi IAA dan Kinetin
KK (%)
7 tn ** ** 21.78
8 tn ** * 22.15
9 tn ** tn 23.29
Keterangan : tn : Tidak nyata pada uji F 5% * : Nyata pada uji F 5%
** : Sangat nyata pada uji F 1% MSK : Minggu Setelah Kultur KK : Koefisien Keragaman
Data yang terbentuk merupakan hasil transformasi √ 5
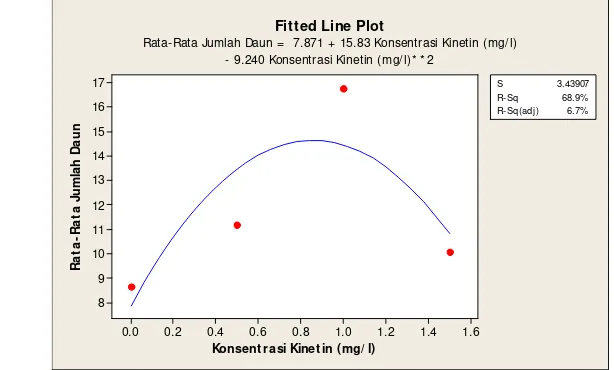
Tabel 7. Pengaruh Konsentrasi Kinetin terhadap Jumlah Daun pada Kultur
in vitro Krisan Varietas Pitaloka
Konsentrasi Kinetin
(mg/l)
Umur (MSK)
7 8 9
0 6.39b 7.23b 8.63b
0.5 6.85b 8.59b 11.17b 1.0 11.86a 13.98a 16.77a 1.5 5.44b 7.94b 10.06b
Keterangan: Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji lanjut DMRT taraf 5%.
maksimal terhadap pertumbuhan tanaman, namun peningkatan konsentrasi sitokinin melewati titik optimumnya justru akan menghambat pertumbuhan tanaman.
Analisis regresi pengaruh kinetin terhadap jumlah daun pada 9 MSK menghasilkan persamaan y = -9.240 x2 + 15.83 x + 7.871 (R2 = 0.689), seperti yang tersaji pada Gambar 9. Koefisien determinasi yang dihasilkan sebesar (0.689), artinya sebesar 68.9 % keragaman Y yang dapat dijelaskan oleh model regresi polinomial.
Konsent rasi Kinet in ( mg/ l)
R a ta -R a ta J u m la h D a u n 1.6 1.4 1.2 1.0 0.8 0.6 0.4 0.2 0.0 17 16 15 14 13 12 11 10 9 8 S 3.43907 R-Sq 68.9% R-Sq(adj) 6.7% Fitted Line Plot
Rata-Rata Jumlah Daun = 7.871 + 15.83 Konsentrasi Kinetin (mg/ l) - 9.240 Konsentrasi Kinetin (mg/ l)* * 2
Gambar 9. Analisis Regresi Pengaruh Konsentrasi Kinetin terhadap Jumlah Daun Kultur in vitro Krisan Varietas Pitaloka pada 9 MSK
Pembentukan daun diawali dengan inisiasi primordia daun yang diikuti dengan proses pembelahan sel, pembesaran sel, dan diferensiasi (Wareing dan Philips, 1970). Menurut Arteca (1996), kehadiran sitokinin akan berperan dalam proses pembelahan dan pembesaran sel, yang pada akhirnya akan mengarah pada pembentukan organ. Wareing dan Philips (1970) menyatakan bahwa tanaman
horseradish (Amoracea lapathifolia) yang dipotong akarnya mengalami kegagalan dalam pembentukan jaringan mesofil daun, karena akar yang menjadi tempat sintesis sitokinin tidak lagi ada. Hal tersebut mengindikasikan bahwa kehadiran sitokinin dalam petumbuhan daun terutama berperan dalam proses pembentukan jaringan mesofil.
[image:48.612.154.461.236.421.2]peran dalam pertumbuhan daun terutama dalam hal pembentukan tulang daun dan pembuluh angkut daun. Pada kasus tanaman horseradish yang dibuang akarnya, meskipun tanaman gagal membentuk jaringan mesofil daun, namun tanaman tetap mampu membentuk pembuluh angkut pada daun karena pucuk sebagai sumber auksin masih ada. Menurut Salisbury dan Ross (1995), secara terpisah auksin dan sitokinin memang memiliki fungsi yang antagonis, namun dalam kenyataannya untuk menghasilkan suatu respon fisiologis tertentu diperlukan interaksi kerja di antara keduanya. Daun yang terbentuk berwarna hijau, menandakan bahwa pemberian kinetin mampu merangsang perkembangan kloroplas, yang akan berperan dalam pembentukan klorofil (Arteca, 1996).
Jumlah Akar
Pembentukan akar pada eksplan juga telah terjadi pada 1 MSK dengan persentase eksplan yang berakar sebanyak 26.25%. Akar yang terbentuk merupakan jenis akar adventif karena berasal dari jaringan yang tidak memiliki
[image:49.612.224.413.533.671.2]proexisting meristem akar (Salisbury dan Ross, 1995). Pada akhir pengamatan terdapat 89.58% eksplan yang mampu membentuk akar. Hasil sidik ragam menunjukkan bahwa pemberian IAA secara tunggal tidak berpengaruh nyata terhadap jumlah akar yang terbentuk. Konsentrasi tunggal kinetin memperlihatkan pengaruh nyata pada 7 dan 9 MSK serta pengaruh sangat nyata pada 8 MSK. Interaksi IAA dan kinetin memberikan pengaruh nyata pada 7 dan 8 MSK serta pengaruh sangat nyata pada 9 MSK.
Tabel 8. Hasil uji F Pengaruh Konsentrasi IAA dan Kinetin terhadap Jumlah Akar pada Kultur in vitro Krisan Varietas Pitaloka
Umur (MSK) Konsentrasi IAA (mg/l) Konsentrasi Kinetin (mg/l) Interaksi IAA dan Kinetin KK (%)
7 tn * * 15.63
8 tn ** * 15.95
9 tn * ** 16.83
Keterangan : tn : Tidak nyata pada uji F 5% * : Nyata pada uji F 5%
** : Sangat nyata pada uji F 1% MSK : Minggu Setelah Kultur KK : Koefisien Keragaman
[image:50.612.98.510.97.694.2]Data yang terbentuk merupakan hasil transformasi √ 5
Tabel 10. Pengaruh Konsentrasi Kinetin terhadap Jumlah Akar pada Kultur
in vitro Krisan Varietas Pitaloka
Konsentrasi Kinetin
(mg/l)
Umur (MSK)
7 8 9
0 6.50a 7.46a 7.94a
0.5 4.35b 4.96bc 5.72ab 1.0 4.82ab 5.66ab 6.93a
1.5 2.97b 3.36c 4.06b
Keterangan: Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji lanjut DMRT taraf 5%.
Tabel 9. Pengaruh Interaksi IAA dan Kinetin terhadap Jumlah Akar pada Kultur in vitro Krisan Varietas Pitaloka
Konsentrasi IAA (mg/l) Konsentrasi Kinetin (mg/l) Umur (MSK)
7 8 9
0
0 9.40a 10.5a 11.5a
0.5 4.44bc 5.11b 5.72bcd 1.0 3.69bc 4.50b 5.50bcd 1.5 2.00c 2.67b 3.08cd
0.5
0 3.94bc 4.68b 4.69bcd 0.5 5.29bc 5.64b 6.93bcd 1.0 5.07bc 6.00b 7.43bc 1.5 2.50bc 2.70b 2.70d
1
0 4.80bc 5.80b 6.00bcd 0.5 3.29bc 4.07b 4.50bcd 1.0 5.86b 6.64b 8.07ab 1.5 4.14bc 4.43b 5.86bcd
[image:50.612.101.514.467.671.2]Rata-rata jumlah akar terbanyak pada penelitian ini diperoleh pada perlakuan media MS tanpa ZPT (kontrol) yaitu sebanyak 11.5 akar. Hal tersebut diduga karena tanaman krisan telah memiliki kandungan auksin endogen yang cukup tinggi. Tingginya kandungan auksin endogen terlihat pada kemampuan stek buku tunggal krisan yang mampu tumbuh dengan baik di media MS tanpa tambahan zat pengatur tumbuh. Menurut Armini et al. (1992), seringkali sekelompok sel dalam suatu eksplan mampu memproduksi auksin endogen yang cukup untuk aktivitas sel itu sendiri. Hasil serupa terlihat pada penelitian yang dilakukan oleh Hoesen (2007) pada kultur in vitro keladi tikus (Tymphonium trilobatum). Hasil penelitian menunjukkan bahwa eksplan yang diberikan perlakuan tunggal NAA 0.5 mg/l tidak menunjukkan respon yang optimal dalam pembentukan akar, karena menurut Hoesen (2007) auksin endogen telah memberikan peran dalam proses fisiologis eksplan tersebut sehingga penambahan auksin dari luar tidaklah lagi diperlukan.
Panjang Akar
Peubah panjang akar hanya diamati pada 9 MSK, karena untuk pengamatan panjang akar, eksplan perlu dikeluarkan dari dalam botol. Bila pengamatan ini dilakukan selama masa kultur, dikhawatirkan tingkat kontaminasi akan sangat tinggi. Hasil sidik ragam menunjukkan bahwa konsentrasi tunggal IAA tidak berpengaruh nyata terhadap panjang akar, konsentrasi tunggal kinetin berpengaruh nyata terhadap panjang akar, dan interaksi IAA dengan kinetin berpengaruh sangat nyata terhadap panjang akar pada 9 MSK.
Tabel 11. Hasil uji F Pengaruh Konsentrasi IAA dan Kinetin terhadap Panjang Akar pada Kultur in vitro Krisan Varietas Pitaloka
Umur (MSK) Konsentrasi IAA (mg/l)
Konsentrasi Kinetin (mg/l)
Interaksi IAA dan Kinetin
KK (%)
9 tn * ** 12.99%
Keterangan : tn : Tidak nyata pada uji F 5% * : Nyata pada uji F 5%
** : Sangat nyata pada uji F 1% MSK : Minggu Setelah Kultur KK : Koefisien Keragaman
Tabel 12. Pengaruh Konsentrasi IAA dan Konsentrasi Kinetin terhadap Panjang Akar
Perlakuan Umur (MSK) 9
Kinetin (mg/l) ...cm...
0 7.63a 0.5 6.24a 1.0 6.18a 1.5 4.36b
Keterangan: Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji lanjut DMRT taraf 5%.
Tabel 13. Pengaruh Interaksi IAA dan Kinetin terhadap Panjang Akar pada Kultur in vitro Krisan Varietas Pitaloka
Konsentrasi IAA (mg/l)
Konsentrasi Kinetin (mg/l)
Umur (MSK) 9
...cm...
0 9.73a 0 0.5 4.40bcd
1 5.91bc 1.5 2.53d 0 5.28bcd 0.5 0.5 7.49ab
1 5.78bcd 1.5 2.69cd 0 7.58ab 1.0 0.5 7.23ab
1 7.01ab 1.5 7.59ab
Keterangan: Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji lanjut DMRT taraf 5%.
Pembentukan Kalus
Tabel 14. Persentase Eksplan Membentuk Kalus dari Tiap Perlakuan pada Kultur
in vitro Krisan Varietas Pitaloka
Konsentrasi IAA (mg/l)
Konsentrasi Kinetin (mg/l)
Persentase Eksplan Berkalus (%)
0 0 0
0.5 40
1.0 10
1.5 40
0.5 0 25
0.5 35
1.0 45
1.5 65
1.0 0 35
0.5 65
1.0 35
1.5 55
Berdasarkan Tabel 14. terlihat bahwa persentase eksplan membentuk kalus paling banyak terdapat pada perlakuan IAA 0.5 mg/l + kinetin 1.5 mg/l dan IAA 1.0 mg/l + kinetin 0.5 mg/l. Diduga pada konsentrasi tersebut, kedua ZPT berada dalam perimbangan untuk membentuk kalus. Penelitian yang dilakukan Khairunisa (2009) terhadap kultur in vitro binahong (Anredera cordifolia), memperoleh hasil bahwa perlakuan tunggal BAP, kinetin, dan Thidiazuron pada selang antara 0.50 - 2.0 mg/l mampu menginduksi kalus pada eksplan yang berasal dari ruas batang. Menurut Sitorus et al. (2011) pemberian IBA 0.5 mg/l dan BAP 0.4 mg/l mampu merangsang pembentukan kalus pada tanaman binahong.
Gambar 11. (A). Kalus Berakar yang Terbentuk pada Perlakuan IAA 0.5 mg/l dan (B). Kalus Bertunas yang Terbentuk pada Perlakuan Kinetin 1.5 mg/l
Tinggi Planlet
Hasil sidik ragam menunjukkan bahwa perlakuan konsentrasi tunggal IAA tidak memberikan pengaruh nyata terhadap tinggi planlet pada 7-9 MSK. Perlakuan konsentrasi tunggal kinetin berpengaruh nyata terhadap tinggi planlet pada 7-9 MSK, sedangkan interaksi IAA dengan kinetin memberikan pengaruh sangat nyata terhadap tinggi planlet pada 7-9 MSK.
Tabel 15. Hasil uji F Pengaruh Konsentrasi IAA dan Kinetin terhadap Tinggi Planlet pada Kultur in vitro Krisan Varietas Pitaloka
Umur (MSK) Konsentrasi IAA (mg/l)
Konsentrasi Kinetin (mg/l)
Interaksi IAA dan Kinetin
KK (%)
7 tn * ** 8.14
8 tn * ** 9.36
9 tn * ** 10.66
Keterangan : tn : Tidak nyata pada uji F 5% * : Nyata pada uji F 5% ** : Sangat nyata pada uji F 1% MSK : Minggu Setelah Kultur KK : Koefisien Keragaman
Data yang terbentuk merupakan hasil transformasi √ 5
Tabel 16. Pengaruh Konsentrasi Kinetin terhadap Tinggi Planlet pada Kultur in vitro Krisan Varietas Pitaloka
Konsentrasi Kinetin
(mg/l)
Umur (MSK)
7 8 9
0 3.83a 4.54a 5.32a
0.5 2.52b 3.16bc 4.15ab 1.0 3.04ab 3.87ab 4.92a
1.5 2.19b 2.61c 3.19b
Keterangan: Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji lanjut DMRT taraf 5%.
Data dalam satuan cm
Tabel 17. Pengaruh Interaksi IAA dan Kinetin terhadap Tinggi Planlet pada Kultur in vitro Krisan Varietas Pitaloka
Konsentrasi IAA (mg/l)
Konsentrasi Kinetin
(mg/l)
Umur (MSK)
7 8 9
………cm……….
0
0 5.92a 6.95a 8.12a 0.5 2.69b 3.41b 4.36bc 1.0 2.90b 3.56b 4.38bc 1.5 1.69b 2.13b 2.42c
0.5