THE EFFECTS OF TEMPERATURE AND PACKAGING TRANSPERANCY ON THE STABILITY OF ANTIOXIDANT CAPACITY AS STORAGE TIME PARAMETER OF
“BIR PLETOK” Daniel Wiguna and Yadi Haryadi
Department of Food Science and Technology, Faculty of Agricultural Technology, Bogor Agricultural University, IPB Darmaga Campus, PO BOX 220, Bogor, West Java, Indonesia
Phone: +62 818 06211800, E-mail: daniel_wiguna@yahoo.com
ABSTRACT
Bir Pletok is a Betawi traditional beverage product made from spices and herbs. Bir Pletok has many advantages, such as to keep body warm and to prevent cold . Bir pletok’s key benefit is related to its antioxidant capacity. The packaging and the storage environment are two important factors in the beverage industry include bir pletok. These factors could affect the antioxidant capacity. The antioxidant capacity in food could decrease due to high temperature and other specific conditions. In the present study the change of antioxidant capacity during the storage and the storage time of bir pletok in the bottle glass packaging with different transperancy and different storage temperature were evaluated. ASS method was used to find the storage time of bir pletok with temperature parameter and ESS method was used to find the storage time of bir pletok with packaging transperancy parameter , whereas the reduction of DPPH method was used to determine the antioxidant capacity of bir pletok during 8 weeks of storage. The storage time of bir pletok that had been storage in 300, 370C, and 500C were 29,45 days, 22,55 days, and 10,67 days respectively. Among the three levels of storage temperatures evaluated in this research, the best temperature for bir pletok storage is 300C. The storage time of bir pletok that had been storage in transparent, brown, and dark bottle glass were 19,28 days, 25,05 days, and 29,91 days respectively. The result of the study showed that the non-transparent packaging was the best condition for bir pletok storage.
1
I. PENDAHULUAN
1.1.LATAR BELAKANG
Penggunaan produk-produk alami semakin meningkat seiring dengan meningkatnya perhatian masyarakat terhadap kesehatan. Salah satu akibatnya adalah peningkatan permintaan konsumen akan pangan fungsional. Salah satu produk pangan fungsional adalah minuman kesehatan. Minuman kesehatan dapat diartikan sebagai minuman yang dapat meningkatkan fungsi fisiologis, seperti menurunkan kolesterol, meningkatkan sistem imun, mencegah kanker, dan sebagainya di samping mempunyai rasa dan aroma yang enak serta kandungan gizi yang sesuai dengan fungsinya. Rempah-rempah memiliki aktivitas antioksidan yang cukup tinggi sehingga banyak dikembangkan menjadi minuman fungsional. Antioksidan bermanfaat bagi kesehatan dan berperan penting dalam mempertahankan mutu produk pangan. Berbagai kerusakan seperti ketengikan, perubahan nilai gizi, perubahan warna dan rasa, serta kerusakan fisik lain pada produk pangan yang disebabkan reaksi oksidasi dapat dihambat oleh antioksidan.
Salah satu minuman rempah yang sudah dikenal masyarakat Betawi adalah bir pletok. Sebutan bir bukan berarti minuman ini mengandung alkohol. Sebutan “bir” berawal dari penampakannya yang menyerupai anggur merah. Proses pengocokan sebelum penyajian minuman mengakibatkan minuman ini berbusa seperti bir pada umumnya. Bahan-bahan yang digunakan pada pembuatan bir pletok adalah macam-macam rempah yang diracik sehingga menghasilkan minuman yang khas. Macam rempah yang digunakan tergantung selera pembuatnya. Karakteristik minuman bir pletok antara lain berwarna merah, beraroma jahe dan kayu manis, berasa hangat di badan dan cukup pedas. Minuman ini secara aspek psikologis aman bagi semua golongan konsumen termasuk golongan muslim. Bir pletok dapat disajikan dalam keadaan dingin maupun hangat. Bir pletok yang disajikan dingin pun memberikan efek hangat setelah dikonsumsi. Bir pletok sendiri sudah dapat dinikmati dalam berbagai bentuk produk. Bentuk bir pletok yang beredar pada masyarakat antara lain adalah sirup, bir pletok instan, dan bir pletok siap minum dalam kemasan botol.
2
Sebagian besar produsen bir pletok hanya mendasarkan umur simpan produknya dalam hal organoleptik tanpa memperhitungan penurunan aktivitas antioksidan produk tersebut. Kapasitas antioksidan berkaitan erat dengan sisi fungsionalitas yang dimiliki oleh bir pletok. Faktor yang diduga berpengaruh terhadap perubahan kapasitas antioksidan dalam produk pangan adalah suhu dan transparansi kemasan. Penentuan kecepatan reaksi kimia bahan pangan yang berhubungan dengan suhu dapat dilakukan dengan metode Arrhenius. Penentuan umur simpan untuk parameter cahaya yang dilakukan adalah metode Accelerated Storage Studies (ASS) dan model yang dipakai adalah model Arrhenius dengan faktor kritis adalah aktivitas antioksidan. Penentuan umur simpan untuk parameter transparansi kemasan yang dilakukan adalah metode Extended Storage Studies (ESS).1.2.TUJUAN PENELITIAN
3
II. TINJAUAN PUSTAKA
2.1. MINUMAN TRADISIONAL FUNGSIONAL
Makanan dan minuman tradisional merupakan makanan dan minuman yang terbuat dari bahan lokal dan memiliki cita rasa yang relatif sesuai dengan selera masyarakat setempat. Menurut Ichikawa (1994), suatu pangan dapat dikatakan sebagai pangan fungsional bila memenuhi syarat-syarat berikut :
1. Dapat digunakan sebagai makanan dan memiliki fungsi untuk kesehatan 2. Manfaatnya bagi kesehatan dan pemenuhan gizi harus berdasarkan data ilmiah.
3. Jumlah yang dikonsumsi setiap hari harus ditentukan dan diizinkan oleh ahli kesehatan dan gizi.
4. Aman dalam diet yang seimbang.
5. Memiliki karakteristik sifat fisik dan kimia disertai metode analisis yang jelas, serta sifat kuantitatif dan sifat kualitatif bahan pangan dapat ditentukan.
6. Tidak mengurangi nilai gizi pangan. 7. Dikonsumsi dengan cara yang wajar.
8. Tidak dikonsumsi dalam bentuk tablet, kapsul ataupun serbuk. 9. Berasal dari bahan-bahan alami.
2.2. BIR PLETOK
Bir pletok merupakan minuman tradisional fungsional khas Betawi yang diracik dari bermacam-macam rempah. Minuman ini berkhasiat menurunkan gejala masuk angin, mengatasi sariawan, kelelahan, dan reumatik. (Harmanto, 2000). Rempah-rempah yang digunakan berbeda-beda bergantung pada pembuatnya. Formula untuk membuat bir pletok pada penelitian ini diambil dari penelitian sebelumnya tentang pengembangan formula bir pletok (Dulimarta, 2000). Resep bir pletok yang digunakan dapat dilihat pada Tabel 1 dan rempah-rempah yang digunakan dapat dilihat pada Gambar 1.
Gambar 1. Aneka rempah yang digunakan dalam formulasi bir pletok
Secang Cabe Jawa Kayu Manis Serai Lada Putih Jintan Hitam
Lada Hitam Cengkeh Biji Pala Pekak Jahe Kapulaga
4
Tabel 1. Komposisi bir pletokSumber : Dulimarta, 2000
2.3. REMPAH-REMPAH
Rempah-rempah dapat dikategorikan sebagai tanaman obat. Menurut Dennin (2000), dari 75.000 jenis tanaman di dunia terdapat 20.000 jenis tanaman obat dan 4.000 jenis tanaman yang sudah digunakan sebagai obat. Bagian tanaman yang digunakan sebagai rempah-rempah umumnya berasal dari bunga, umbi, daun, dan rimpang. Pemanfaatan rempah-rempah biasanya diolah dalam bentuk tersendiri atau sebagai zat tambahan pada makanan yang berfungsi untuk flavor, peningkat citarasa, serta dapat berfungsi sebagai sumber mineral pelengkap kesehatan (Ridwan et al.,1997).
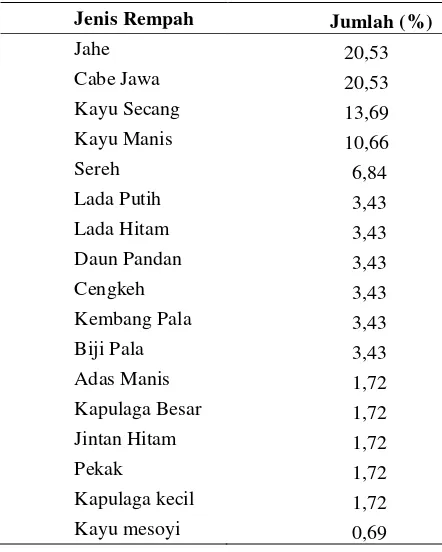
Rempah-rempah yang banyak digunakan pada pembuatan bir pletok ini adalah jahe, kayu secang, cabe jawa, kayu manis, daun sereh, lada putih, lada hitam, daun pandan, cengkeh, kembang dan biji pala, adas manis, kapulaga besar, kapulaga kecil, jintan hitam, pekak, dan kayu mesoyi. Tabulasi jenis rempah, komponen mayor yang terkandung dan khasiat beberapa rempah yang digunakan dalam pembuatan bir pletok terdapat dalam Lampiran 2.
2.3.1. Jahe- Ginger (Zingiber officionale Roscoe)
Jahe adalah umbi dari tanaman Zingiber officinale Roscoe yang termasuk dalam famili Zingiberaceae. Tanaman jahe membentuk rimpang yang berbentuk umbi. Batang pokok mencapai ketinggian satu meter. Cabang rimpang dapat membentuk malai bunga yang tegak lurus mencapai 25cm. (Rismunandar, 1992).
Rimpang jahe umumnya mengandung minyak atsiri sebanyak 0,25-3,3 persen yang terdiri atas antara lain minyak terpentin, zingiberen, kurkumin, dan pheladren. Jahe juga mengandung camphen, bisabolen, farnesen, sesquiphellandren, zingibren, linalool, nerolidol, geranial, neral, dan 1,8-sineol. Penghasil rasa pedas jahe adalah gingerol dan shogaol yang banyak terdapat pada oleoresin jahe (Agusta, 2000). Komposisi kimia jahe dapat dilihat pada Lampiran 1.
Jenis Rempah Jumlah (%)
Jahe 20,53
Cabe Jawa 20,53
Kayu Secang 13,69
Kayu Manis 10,66
Sereh 6,84
Lada Putih 3,43
Lada Hitam 3,43
Daun Pandan 3,43
Cengkeh 3,43
Kembang Pala 3,43
Biji Pala 3,43
Adas Manis 1,72
Kapulaga Besar 1,72
Jintan Hitam 1,72
Pekak 1,72
Kapulaga kecil 1,72
5
Berdasarkan hasil percobaan dengan hewan percobaan, terbukti bahwa ekstrak jahe merupakan stimulant bagi pernafasan dan jantung. Ekstrak jahe juga dapat menyembuhkan reumatik, penyakit malaria, radang, influenza, batuk, dan pendarahan. Ekstrak jahe juga digunakan untuk merangsang nafsu makan, meperlancar pencernaan dan mengurangi asam perut karena adanya zat antioksidan yang merangsang selaput lendir dan usus (Rismunandar, 1992). Herlina et al. (2002) membuktikan bahwa ekstrak jahe dapat menghambat waktu terjadinya oksidasi lipida dari 20 detik menjadi 10 menit. Muchtadi dan Sugiono (1992) menyatakan bahwa ekstrak jahe mempunyai daya antioksidan yang dapat dimanfaatkan untuk mengawetkan minyak dan lemak.2.3.2. Kayu Secang – Sepang (Caesalpinia sappan Linn)
Secang (Caesalpinia sappan Linn) termasuk famili Leguminoseae. Tanaman ini merupakan tanaman perdu yang memanjat, berduri banyak, akarnya berserabut dan berwarna gelap. Bagian batang berwarna coklat keabuan (Heyne, 1987). Secang tumbuh pada ketinggian antara 1-700m di atas permukaan laut di daerah Jawa (Sastrapraja dan Bimantoro, 1980). Secang banyak dimanfaatkan sebagai tanaman pagar.
Kandungan kimia dari kayu secang adalah tannin (asam tannat), asam galat, resin, resorsin, brazilin, brazielin, dan pigmen sappanin (Maharani, 2003). Secang dapat digunakan sebagai pewarna alami karena mengandung brazilin yang berwarna merah dan bersifat mudah larut dalam air panas. Kayu secang juga mempunyai aktivitas sebagai antibakteri dan bakteriostatik (Winarti dan Sembiring, 1998). Brazilin yang merupakan komponen terbesar dari kayu secang merupakan senyawa oksidatif yang memiliki gugus katekol pada struktur kimianya. Berdasarkan sifat antioksidannya, brazilin merupakan pelindung terhadap bahaya radikal bebas pada sel (Sanusi, 1999). Kayu secang mempunyai daya antibakteri terhadap bakteri gram positif, seperti Bacillus pumilus, Bacillus subtilis, dan Staphylococcus aureus, serta daya antibakteri terhadap bakteri gram negatif, seperti Escherichia coli, Klebsiella pnemoniae, dan kapang Penicillium aeruginosa ( Sundari et al., 1998).
2.3.3. Cabe Jawa – Long Pepper (Piper retrofactum Vahl.)
Lada panjang (Piper retrofactum Vahl.) atau yang dikenal sebagai cabe jawa merupakan tanaman asli Indonesia. Tanaman ini termasuk dalam famili Piperaceaea. Cabe jawa tergolong tanaman yang merambat dan melilit. Buah mudanya berwarna hijau dank eras serta beraroma tajam dan pedas. Warna buah berubah menjadi kuning gading dan akhirnya berwarna merah jika sudah matang (Emmyzar, 1992).
Tingkat kepedasan cabe jawa lebih tinggi dibandingkan dengan tingkat kepedasan jenis lada panjang lainnya. Menurut Winarto (2008), rasa pedas ini disebabkan oleh senyawa piperin dan piperanin. Cabe jawa juga mengandung minyak atsiri yang terdiri atas linalool, terpentil asetat, sitronelil asetat, dan sitral (Sait et al., 1992). Menurut Mardisiswojo dan Rajakmangunsudarso (1985), cabe jawa dapat digunakan untuk mengobati demam, tekanan darah rendah, sukar bersalin, perut mulas, beri-beri, influenza, lambung lemah, dan masuk angin.
2.3.4. Kayu Manis – Cinnamon (Cinnamomum burmanii Blume)
6
umumnya mengandung minyak atsiri, pati, getah, resin, fixed oil, tannin, selulosa, pigmen, kalium oksalat, dan mineral (Rismunandar dan Paimin, 2001). Eugenil asetat, sinnamaldehida, sineol, sinnamil asetat, kariopillen, L-phellandren, p-simen, dan α-pinen adalah komponen-komponen minyak atsiri kayu manis. Komposisi kayu manis ditunjukkan pada Lampiran 1.Komponen utama flavor pada kayu manis adalah sinamaldehid berkisar 70-75%, yang bukan termasuk ke dalam golongan fenol. Komponen minor flavor yaitu eugenol, safrol, aceteugenol, dan kumarin mengandung gugus fenol dan penting untuk memberi cita rasa khas flavor alami kayu manis (Edria, 2010). Menurut King (2000), kayu manis mampu berperan sebagai antioksidan karena mengandung senyawa tannin dan eugenol. Kayu manis dapat dimanfaatkan sebagai obat sariawan, encok, tekanan darah tinggi, asma, masuk angin, antidiare, dan memiliki sifat germisidal (Mardisiswojo dan Rajakmangunsudarso, 1985). Daya germisidal kayu manis dan cengkeh paling efektif jika dibandingkan dengan rempah-rempah lainnya (Farrel, 1990).
2.3.5. Sereh – Lemongrass (Andropogon citratus)
Sereh merupakan tumbuhan sejenis rumput yang berumpun besar, termasuk famili Gramineae. Daunnya berwarna hijau dengan panjang mencapai 1 m dan lebar 15 mm serta berbentuk pita. Bunganya berbulir majemuk dan berwarna putih (Wijayakusuma et al., 1996). Sereh mengandung minyak atsiri dengan komponen seperti citranelal, citral, genariol, metal hepton, eugenol, kardinen, dan limonene. Kandungan utama minyak sereh adalah sitral dengan jumlah 66-85%. Sereh dapat dimanfaatkan untuk mengobati sakit kepala, otot, sendi, ngilu, batuk, nyeri lambung, diare, dan memperlancar sirkulasi darah (Wijayakusuma et al., 1996). Selain itu, sereh juga dapat digunakan untuk membantu pencernaan, mengurangi tekanan darah dan mencegah flatulensi (Santoso, 2008).
2.3.6. Lada Hitam – Black Pepper dan Lada Putih – White Pepper (Piper nigrum L.)
Lada Hitam adalah buah lada yang masih mempunyai kulit dan berwarna hitam hasil fermentasi dan penjemuran. Lada adalah buah dari tanaman Piper nigrum L., yang berasal dari famili Piperaceae. Karen, simen, limonene, phellandren, pinen, sabinen, bisabolen, kariopillen, kopaen, elemen, humulen, dan terpinen-4-ol adalah minyak atsiri pada lada hitam. Lada putih adalah buah lada yang tidak mempunyai kulit lagi dan telah dikeringkan. Lada putih juga berasal dari tanaman Piper nigrum L. yang berasal dari famili Piperaceae.
Rasa pedas lada diakibatkan oleh adanya piperin, piperanin, dan chavicin yang merupakan persenyawaan dari piperin dengan semacam alkaloida. (Rismunandar dan Riski, 2003). Lada secara umum dapat digunakan untuk masuk angin, influenza, demam, dan tekanan darah rendah (Mardisiswojo dan Rajakmangunsudarso, 1985). Komposisi lada hitam dan lada putih dapat dilihat pada Lampiran 1.
2.3.7. Pandan – Pandanus (Pandanus amaryllifolius Roxe)
7
2.3.8. Cengkeh – Clove (Syzygium aromaticum)Cengkeh tergolong ke dalam family Myrtaceae. Tumbuhan ini berbatang sedang dengan tinggi mencapai 18 m. Daunnya berbentuk bulat telur atau lonjong, tebal, dan agak mengkilat (Mardisiswojo dan Rajakmangunsudarso, 1985). Cengkeh yang digunakan sebagai rempah-rempah merupakan kuncup bunga yang dipetik pada saat dasar kuncup berubah warna menjadi merah (Farrell, 1990).
Komponen utama minyak essensial cengkeh adalah fenol eugenol. Menurut Ningsih (2001), sekitar 99% minyak yang terdapat pada cengkeh terdiri atas 70-90% eugenol, lebih dari 17% eugenol asetat, dan caryophyllene sesquiterpenes (terutama beta-caryophkyllene, 5-12%). Warna dan kelarutan minyak cengkeh sama dengan eugenol. Eugenol berwarna kuning pucat, bening, berbau aromatik dan pedas. Cairan ini menjadi lebih hitam dan kental jika kontak dengan udara. Eugenol sedikit larut dalam air dan larut dalam alkohol, kloroform, dan eter. Komposisi organik lainnya adalah eugenol asetat, carryophilen, metal-n-amil karbinol, metal-n-heptil karbinol, mtil-n-heptil keton, metal benzoate, benzil alkohol, furfural alkohol, dan vanillin. Komposisi kimia cengkeh dapat dilihat pada Lampiran 1.
Bunga cengkeh dapat digunakan untuk mengobati masuk angin, batuk, dan mata yang terasa sakit (Mardisiswojo dan Rajakmangunsudarso, 1985). Selain itu, dapat mengatasi sakit gigi, mulas-mulas, dan terkadang baik juga untuk mengatasi sakit batuk. Dosis yang diperlukan adalah sekitar 0,1 ml sampai 0,36 ml (Sutedjo, 1990). Minyak cengkeh sebanyak 0,1 persen sudah dapat menghambat pertumbuhan mikroba.
2.3.9. Kembang Pala – Mace dan Biji Pala – Nutmeg (Myristica fragans Houtt)
Buah pala berbentuk lonjong seperti lemon, berwarna kuning, berdaging dan beraroma khas karena mengandung safrole dan myristisin pada daging buahnya. (Santoso, 2008). Buah pala terdiri atas daging buah (84,33%), biji (13,85%), dan fuli (1,85%) dari berat total buah pala (Farrell, 1990). Biji pala berwarna keabu-abuan, berbentuk oval, beberapa berbentuk bulat dengan ukuran yang bervariasi. Komposisi kimia kembang pala hampir sama dengan biji pala yang terdiri atas pati, minyak lemak dan ekstrak alkohol, mineral, protein, serta minyak atsiri. Minyak atsisri biji pala terdapat pada perisperma. Komponen utama yang menyusun minyak atsiri biji pala adalah pinen, sabinen, mirsen, terpinen, limonene, terpinolen, sineol, 1-terpeinen-4-ol, safrol, miristisin dan elemisin. Terdapat juga dalam jumlah kecil golongan oxygenated hydrocarbon, misalnya asam organik, ester, keton, dan alkohol (Farrell, 1990). Komposisi kimia biji pala dapat dilihat pada Lampiran 1. Biji pala dalam pengobatan tradisional berguna dalam menghentikan muntah-muntah dan menghilangkan rasa sakit pada waktu haid. (Rismunandar, 1992). Biji pala juga berkhasiat untuk mengatasi kejang lambung dan encok (Sugiyono, 2001).
2.3.10. Adas Manis – Anise (Pimpinella anisum L.)
8
2.3.11. Kapulaga Besar – Cardamom (Amomum cardamomum Willd)Tanaman ini merupakan tanaman yang dapat hidup lama dan mempunyai umbi batang dalam tanah yang tebalnya sebesar jari. Batang berdaun agak banyak dan tingginya mencapai 1-1,5cm. Bentuk daunnya seperti pisau bedah dengan bunganya yang tegak lurus ke atas dan tingginya mencapai 8 cm (Indo, 1993). Bentuk buahnya bulat pipih bersegi tiga terdiri atas 3 ruang, panjangnya 1-1,2 cm dan lebarnya 1-1,5 cm. Bagian atas kelopak bunga warnanya coklat, melekat, dan bentuknya panjang dan berbulu-bulu. Buahnya seolah-olah tidak mudah pecah, tetapi jika di tekan kulitnya yang tipis akan pecah menjadi tiga bagian. Bijinya berukuran 4 mm. Bentuknya pipih berwarna coklat dan di ujungnya terdapat aril (arilus) berwarna putih dan rasanya manis.
Bagian biji jika dikunyah memiliki rasa seperti merica atau jahe (Indo, 1993). Senyawa utama yang terdapat dalam kapulaga adalah sineol, metal hepton, β-terpeniol, sabinen, linalool,
geraniol, α-pinen, sabinen, limonene, dan terpenil asetat. Kapulaga dapat digunakan sebagai obat
penyakit radang amandel, tenggorokan, gatal-gatal, perut mulas, sesak napas, keletihan, dan demam. Selain itu, dapat juga digunakan untuk penyakit muntah-muntah, sakit dalam tulang, influenza, reumatik, dan batuk (Indo, 1993).
2.3.12. Kapulaga Kecil – Cardamom (Elettaria cardamomum L. Maton)
Kardamom termasuk golongan Scitamineae dan family Zingiberaceae. Tanaman ini mempunyai umbi batang yang agak besar. Daunnya berbentuk tombak, berujung runcing, berwarna hijau tua, agak licin, dan sedikit berbulu (Indo, 1993). Buahnya bulat telur, agak memanjang, bersegi tiga, berkambium, dan berwarna kuning muda jika telah masak. Buahnya terdiri dari tiga ruang yang dipisahkan oleh selaput tipis setebal kertas. Setiap ruang berisi 5-7 buah biji yang berwarna coklat dan beraroma harum (Indo, 1993). Komposisi kimia biji kapulaga dapat dilihat pada Lampiran 1.
Biji kapulaga yang berkualitas tinggi dapat menghasilkan minyak atsiri sebanyak 10 persen. Senyawa utama yang terdapat dalam kapulaga kecil adalah sineol, metal hepton, β-terpineol, borneol, neril asetat, genariol, nerol, nerolidol, α-pinen, sabinen, mirsen, limonene, dan α-simen. Kardamom memiliki khasiat daya karminatif atau laksatif (untuk mencuci perut), sebagai stimulant dan juga sebagai penyembuh gangguan lambung dan antikejang perut (Rismunandar, 1992).
2.3.13. Jintan Hitam – Caraway Seed (Carum carvi L.)
9
2.3.14. Pekak – Anise China Star (Illicium verum Hooker F.)Pekak di Indonesia dikenal juga dengan nama adas bintang karena bentuknya seperti bintang. Pekak termasuk ke dalam family Magnoliaceae. Buah pekak berbentuk bintang yang terdiri dari delapan karpel yang berbentuk seperti kano. Setiap karpel berukuran 20 mm yang berisi biji yang berwarna coklat kering (Farrell, 1990).
Aroma dan flavor ekstrak pekak sangat mirip dengan aroma dan flavor adas manis. Kandungan minyak volatile pekak berkisar anatara 8-9%, sedangkan fixed oil kurang lebih 2%. Pekak mengandung dua macam komponen utama yaitu trans-anetole 88-90% dan limonene 5% (Farrell, 1990). Pekak dapat dimanfaatkan untuk menghindari masuk angin dan perut kembung (Ketaren, 1986).
2.3.15. Kayu Mesoyi – Mesoi (Crypearya messoy)
Mesoyi merupakan tanaman tegak, berkayu, dan tingginya mencapai 5 m. Kayu dan kulitnya mengeluarkan bau aromatis yang khas. Kulit kayu berwarna kelabu di sebelah luar dan kemerah-merahan di dalam. Tanaman ini banyak ditemukan di daerah Irian Jaya dan Maluku. Bau aromatis yang dihasilkan menyebabkan bahan tanaman ini sering digunakan untuk bedak bersama-sama dengan cengkeh. Menurut Mardisiswojo dan Rajakmangunsudarso (1985), kayu mesoyi mengandung sinamal aldehid, asam sinamat, dan eugenol. Mesoyi lakton merupakan senyawa yang terkandung secara dominan di dalam minyak atsiri mesoyi. Selain itu, kayu mesoyi bersifat irritant (membebaskan pembuluh darah kapiler) dan dapat digunakan sebagai bahan pewangi (Delimarta, 1998). Kayu mesoyi ini berkhasiat juga untuk batuk yang tidak berdahak, mencret, mulas, dan encok. (Iskandar dan Ismanto, 2001). Hasil penelitian Reapina (2007) menunjukkan mesoyi bersifat antibakteri terhadap Salmonella thypimurium dan Bacillus cereus.
2.4. PEMBOTOLAN DAN STERILISASI
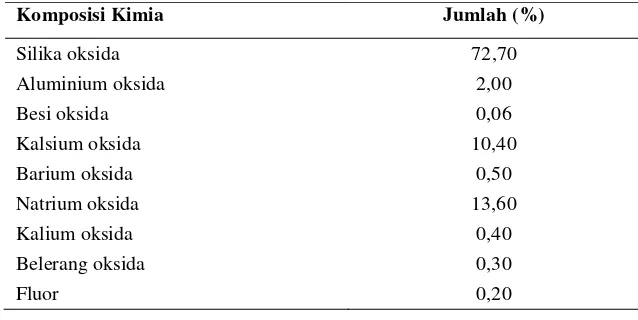
Wadah gelas untuk mengemas makanan semakin digunakan karena memiliki keuntungan dibandingkan dengan bahan pengemas lain. Komposisi kimia wadah gelas komersial ditunjukkan pada Tabel 2. Keuntungan penggunaan wadah gelas untuk mengemas bahan pangan menurut Muchtadi (1995) adalah sebagai berikut :
1. Wadah gelas bersifat inert sehingga tidak akan bereaksi dengan bahan pangan. 2. Gelas bersifat kedap dan tidak berpori-pori.
3. Tidak berbau dan bersih.
4. Bersifat transparan sehingga memungkinkan produk di dalamnya diperiksa oleh produsen maupun konsumen
5. Wadah gelas mempunyai kekuatan tinggi dan kemajuan teknologi telah menghasilkan gelas yang lebih kuat tetapi lebih tipis dan ringan.
6. Wadah gelas mudah dibuka dan ditutup kembali, serta wadas bekas dapat digunakan kembali. 7. Wadah gelas dapat dibuat dalam berbagai bentuk, ukuran, dan warna.
8. Wadah gelas dapat diisi atau ditutup secara vakum
9. Umur simpan bahan pangan dalam wadah gelas lebih lama dibandingkan dalam kaleng. Kelemahan wadah gelas untuk bahan pengemas adalah sebagai berikut:
1. Berat sehingga biaya distribusi mahal 2. Mudah pecah
10
Tabel 2. Komposisi kimia wadah gelas komersial (Muchtadi, 1995)Komposisi Kimia Jumlah (%)
Silika oksida 72,70
Aluminium oksida 2,00
Besi oksida 0,06
Kalsium oksida 10,40
Barium oksida 0,50
Natrium oksida 13,60
Kalium oksida 0,40
Belerang oksida 0,30
Fluor 0,20
Industri pengalengan dan pembotolan umumnya mengaplikasikan proses sterilisasi pada produk akhir yang telah diisikan dan ditutup dalam suatu wadah. Sterilisasi merupakan suatu proses pemanasan pada periode waktu dan suhu tertentu. Umumnya berada dalam kondisi tekanan uap jenuh dan suhu 1150C atau lebih. Proses ini bertujuan membunuh mikroorganisme perusak yang mungkin berada dalam produk pangan dan membunuh semua mikroorganisme pathogen yang mungkin ada. Sterilisasi komersial bertujuan untuk menginaktifkan spora mikroba pembusuk khususnya anaerobik (Muchtadi, 1997).
2.5. ANTIOKSIDAN
Antioksidan merupakan suatu senyawa yang dapat menghambat atau mencegah proses oksidasi dari bahan secara signifikan meskipun terdapat dalam konsesntrasi kecil dibandingkan dengan bahan yang dapat teroksidasi. (Halliwell dan Gutteridge, 1999). Terdapat dua macam antioksidan, yaitu antioksidan primer dan antioksidan sekunder. Antioksidan primer dapat diproduksi oleh tubuh manusia, misalnya enzim intraseluler SOD (superoksidadismutase) sebagai pelindung sel dan mencegah peradangan akibat radikal bebas. Antioksidan sekunder tidak dapat dihasilkan oleh tubuh manusia sehingga diperlukan asupan dari luar. Antioksidan sekunder dapat berupa zat gizi (vitamin A, vitamin C, dan vitamin E) atau zat nongizi (flavonoid dan polifenol) (Winarti, 2010).
11
SOD2.5.1. Mekanisme Antioksidasi
Berdasarkan mekanisme kerjanya, antioksidan memiliki dua fungsi. Fungsi pertama merupakan fungsi utama dari antioksidan yaitu sebagai pemberi atom hydrogen. Antioksidan (AH) yang mempunyai fungsi utama tersebut sering disebut sebagai antioksidan primer. Senyawa ini dapat memberikan atom hydrogen secara cepat ke radikal lipida (R*, ROO*) atau mengubahnya ke bentuk lebih stabil, sementara turunan radikal antioksidan (A*) tersebut memiliki keadaan lebih stabil dibanding dengan radikal lipida. Fungsi kedua merupakan fungsi sekunder antioksidan, yaitu memperlambat laju autoksidasi dengan berbagai mekanisme pemutusan rantai autoksidasi. Mekanisme yang berlansung adalah pengubahan radikal lipida ke bentuk lebih stabil (Gordon, 1990).
Penambahan antioksidan (AH) primer dengan konsentrasi rendah pada lipida dapat menghambat reaksi autoksidasi lemak dan minyak. Penambahan tersebut dapat menghalangi reaksi oksidasi pada tahap inisiasi maupun propagasi. Radikal antioksidan (A*) yang terbentuk pada reaksi tersebut relatif stabil dan tidak mempunyai banyak energi untuk bereaksi dengan molekul lipida lain membentuk radikal lipida baru (Gordon, 1990). Tahap inisiasi dan propagasi adalah sebagai berikut:
Inisiasi : R* + AH → R + A*
Propagasi : ROO* + AH → ROOH + A*
Besar konsentrasi antioksidan yang ditambahkan dapat berpengaruh pada laju oksidasi. Konsentrasi tinggi mengakibatkan aktivitas antioksidan grup fenolik sering lenyap bahkan antioksidan tersebut menjadi prooksidan. Pengaruh jumlah konsentrasi pada laju oksidasi bergantung pada struktur antioksidan dan kondisi sampel yang akan diuji (Edria, 2010). Reaksi perubahan antioksidan menjadi prooksidan adalah sebagai berikut :
AH + O2 → A* + HOO
AH + ROOH → RO*
+ H2O - A*
2.5.2. Jenis Antioksidan
Menurut Halliwell dan Gutteridge (1999), pertahanan antioksidan antara lain :
a. Zat yang secara katalitik menghilangkan radikal bebas dan senyawa reaktif lainnya. Contohnya adalah ezim superoksida dismutase (SOD), enzim katalase, enzim peroksidase, dan antioksidan spesifik dari thiol.
b. Protein yang meminimalkan kemampuan prooksidan seperti ion besi dan tembaga dalam heme. Contohnya adalah transferin, haptoglobin, haemopexin, dan etallothionein.
c. Protein yang dapat mencegah kerusakan biomolekul (termasuk kerusakan oksidatif) dengan mekanisme lain seperti Heat Shock Protein
d. Zat atau senyawa bermassa rendah yang dapat menangkap ROS (Reactive Oxygen Species) dan RNS (Reactive Nitrogen Species). Contohnya adalah α-tokoferol dan gluthatione. Beberapa antioksidan berasal dari diet terutama asam askorbat dan α-tokoferol.
Menurut Halliwell dan Gutteridge (1999), dalam cairan intraseluler enzim yang berpartisipasi dalam proses degradasi senyawa ROS antara lain :
a. Enzim Superdioksida Dismutase (SOD)
Semua CuZnSODs mengkatalisis reaksi yang sama yaitu mempercepat dismutase O2
-menurut reaksi :
12
Spesitifitas SOD terhadap reaksinya dengan O2
sering digunakan untuk menduga keterlibatan radikal ini dalam sistem biologis. Senyawa SODs dapat bereaksi dengan OH, RO*, ROH*, dan singlet oksigen, karena SODs mengandung histidin dan rantai lain yang dapat bereaksi dengan molekul tersebut. CuZnSOD bereaksi dengan peroksinitril menjadi nitrat.
b. Enzim Katalase
H2O2 yang dihasilkan dari proses dismutase O2- diurai dalam keadaan aerob oleh
dua tipe enzim. Katalase mengkatalisis langsung dekomposisi H2O2 menjadi O2 menurut
reaksi :
2H2O2 → 2 H2O + 2O2
Enzim peroksidase mengurai H2O2 dengan cara menggunakan H2O2 itu untuk
mengoksidasi substrat lain (SH2) menurut reaksi :
SH2 + H2O2 → S + 2 H2O
Kebanyakan sel aerob mempunyai aktivitas katalase. Katalase dalam sel darah merah dapat melindungi sel dari terbentuknya H2O2 karena Penghilangan O2- oleh
autooksidasi dari hemogoblin.
c. Enzim Glutation Peroksidase (G-SH Px)
Glutation peroksidase menguraikan H2O2 menjadi H2O dengan mengoksidasi
G-SH (Glutation tereduksi) menurut reaksi :
H2O2 + 2G-SH → GSSG + 2 H2O
Degradasi H2O2 menggunakan enzim GPx terjadi pada jaringan hewan dengan
GSH sebagai hidrogen donor. Beberapa kasus grup peroksida dapat diurai menjadi alkohol menurut reaksi :
LOOH + 2GSH → GSSG + H2O + LOH
Pengurangan jumlah glutation tereduksi (GSSG atau GSH) dalam sel normal sangat tinggi, sehingga harus ada mekanisme yang mengubah GSSG kembal menjadi GSH. Reaksi ini dapat dilakukan oleh enzim glutation reduktase yang mengkatalisis reaksi :
GSSG + NADPH + H+ → 2GSH + NADP*
Antioksidan berberat molekul rendah yang didapat dari diet antara lain (Halliwell dan Gutteridge, 1999) :
a. Vitamin C
L-asam askorbat (vitamin C) merupakan antioksidan larut air yang paling penting. Senyawa ini secara efektif menangkap O2, OH
*
, peroksil radikal, singlet oksigen, dan dapat berperan dalam regenerasi vitamin E. Keefektifan senyawa ini dalam menangkap peroksil radikal dalam cairan dan plasma atau sitosol menjadikan senyawa ini dapat melindungi biomembran dari kerusakan peroksida.
Vitamin C juga mampu menangkap HO2*, thiol oksisulfur radikal, turunan
ergothionine radikal, asam hipoklorit, asam proksinitrit dan zat nitrat, nitrosida radikal, O3,
NO2, dan radikal yang disebabkan oleh beberapa obat-obatan. Selain itu, merupakan substrat
untuk askorbat peroksidase yang merupakan enzim penting dalam penghilangan H2O2 pada
kloroplas. b. Vitamin E
13
peroksil (LO2) radikal lebih cepat daripada reaksi radikal tersebut dengan rantai asam lemakatau dengan protein membrane menurut reaksi :
α TocH + LO2 → Toc
*
+ LO2H
Tokoferol juga dapat bereaksi dengan singlet oksigen dan dapat melindungi
melindungi membrane dari senyawa ini, senyawa α Toc bereaksi pelan dengan O2* atau HO2*
dan dapat bereaksi pula dengan peroksil radikal lain untuk menghasilkan produk non radikal. Struktur molekulnya mempunyai efek antioksidan yang efektif karena dapat mendonorkan atom H dari gugus OH pada struktur cincinnya untuk membentuk radikal bebas. Meskipun berbentuk radikal bebas, tetapi tidak reaktif karena electron yang tidak berpasangan dalam atom oksigen dilokalisasi pada cincin aromatik sehingga meningkatkan stabilitas.
c. Karotenoid
Meskipun beberapa karotenoid memiliki efek antioksidan, tetapi perhatian terpusat pada β-karoten yang mempunyai kemampuan penangkapan efektif terhadap peroksil radikal dalam kondisi fisiologi dan dapat menangkap singlet oksigen. Studi terbaru menyatakan β-karoten mengindikasikan kemungkinan efek yang sinergis dengan vitamin E.
d. Flavonoid
Beberapa flavonoid yang mempunyai struktur fenolik yang hampir sama dengan vitamin E, berperan sebagai antioksidan dalam sistem lemak, bereaksi dengan O2*, lipid
peroksil radikal dan membentuk kompleks besi yang mencegah kereaktifan radikal O2*. Zat
ini juga menjaga vitamin C, terutama dengan adanya ion logam yang secara normal mempercepat oksidasi asam askorbat, contohnya quercetin, morin, myricetin, kaempferol, dan asam tanat yang diketahui mempunyai aktivitas antioksidan (Kochar dan Rossell, 1995).
Fenol juga dilaporkan mempunyai efek kardioprotektif dengan meminimalkan terjadinya oksidasi LDL secara in vivo. Derajat hidroksilasi dan posisi relatif dari grup OH adalah faktor penting untuk mengetahui kemampuan antioksidan. Komponen flavonoid ini banyak terkandung pada rempah-rempah.
2.5.3. Kapasitas Antioksidan
Kemampuan senyawa antioksidan dalam menetralisasi radikal bebas disebut kapasitas antioksidan. Kapasitas antioksidan suatu bahan pangan umum dapat dinyatakan sebagai aktivitas antioksidan setara asam askorbat (Ascorbic Acid Equivalent Antioxidant Capacity - AEAC) dengan menggunakan asam askorbat sebagai standar atau dapat dinyatakan dalam Trolox Equivalent Antioxidan Capacity (TEAC). Kapasitas antioksidan dalam AEAC dinyatakan dalam satuan mgAEq/ml (Leong dan Shui, 2002). Satuan ini menunjukkan jumlah asam askorbat (mg) yang memiliki kapasitas antioksidan setara (ekivalen) dengan 1 ml sampel. Analisis kapasitas antioksidan bahan pangan dapat dilakukan dengan metode spektrofotometri menggunakan DPPH (2,2-difenil-1-pikrilhidrazil) pada panjang gelombang 517 nm, suatu radikal bebas stabil yang dapat bereaksi dengan antioksidan.
Kapasitas antioksidan dalam TEAC dinyatakan dalam satuan Trolox Equivalent Antioxidan Capacity (TEAC). Analisis kapasitas antioksidan bahan pangan dapat dilakukan dengan metode spektrofotometri menggunakan ABTS ( 2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonic acid) pada panjang gelombang 415 nm dan 734 nm. Metode ini menghitung absorbansi pereduksian ABTS*+ . Kapasitas antioksidan dihitung setara trolox. (Prior et al., 2005)
14
a. Metode Sistem Model β-karoten/linoleat
Pengukuran berdasarkan pada minimisasi kehilangan warna pada β-karoten pada oksidasi ganda asam linoleat dan β-karoten dalam sistem aqueous. Kerusakan oksidatif ini diukur secara kolorimetri pada panjang gelombang 470 nm.
b. Metode Diene Terkonjugasi
Metode diene terkonjugasi digunakan sebagai indeks kestabilan lipid. Metode ini tidak dapat diaplikasikan pada semua jenis minyak karena nilai diene terkonjugasi tergantung pada komposisi asam lemak minyak tersebut. Metode ini sering diaplikasikan pada minyak yang mengandung asam linoleat atau asam lemak tak jenuh lainnya seperti minyak kedelai dan minyak jagung. Pengukuran dilakukan pada panjang gelombang 234 nm dan dinyatakan dalam satuan mmol/kg minyak.
c. Metode Rancimat
Prinsip metode ini adalah oksidasi dipercepat dengan cara induksi aliran udara melewati minyak yang dipanaskan. Priode induksi pada suhu ruang dihasilkan pada hitungan minggu atau bulan. Oleh karena itu, uji dipercepat dengan penaikan suhu. Besarnya aktivitas antioksidan dapat diketahui dari besarnya penghambatan terhadap pembentukan senyawa oksidan yang disebabkan oleh pemanasan minyak.
d. Metode Tiosianat
Prinsip metode ini adalah mengukur aktivitas antioksidan dalam menghambat terbentuknya senyawa-senyawa radikal yang bersifat reaktif. Uji ini mengukur jumlah peroksida secara kualitatif. Pengukuran dapat dinyatakan dalam periode induksi dan faktor protektif. Periode induksi adalah waktu yang dibutuhkan untuk mencapai nilai absorbansi 0,3 pada panjang gelombang 500nm. Faktor protektif didapat dari perbandingan periode induksi sampel (hari) dengan periode induksi kontrol (hari). Semakin tinggi faktor protektif maka aktivitas antioksidannya semakin meningkat.
e. Metode Scavenging Effect on DPPH Radical
Prinsip metode ini adalah mengukur daya peredaman sampel (ekstrak) terhadap radikal bebas DPPH. Senyawa peredam radikal bebas akan menjadi radikal baru yang stabil atau senyawa bukan radikal.
Metode Scavenging Effect on DPPH Radical dipakai pada penelitian ini karena lebih efisien baik dari segi waktu, alat, maupun bahan.
2.6.PENDUGAAN UMUR SIMPAN 2.6.1. Pengertian Umur Simpan
Umur simpan adalah selang waktu antara saat produksi hingga saat konsumsi dimana produk masih berada dalam kondisi yang memuaskan pada sifat-sifat penampakan, rasa, aroma, tekstur dan nilai gizi. (Hine, 1997) Suatu produk dikatakan berada pada kisaran umur simpannya bila kualitas produk secara umum dapat diterima untuk tujuan seperti yang diinginkan oleh konsumen dan selama bahan pengemas masih memiliki integritas serta memproteksi isi kemasan. (Arpah, 2001). Oleh karena itu, dalam menentukan daya simpan suatu produk perlu dilakukan pengukuran terhadap atribut mutu produk tersebut.
15
menggunakan metode-metode tertentu. Menurut Ellis (1994) diacu dalam Man dan Jones (1999), penentuan umur simpan produk dilakukan dengan mengamati produk selama penyimpanan sampai terjadi perubahan yang tidak dapat diterima lagi oleh konsumen. Faktor yang mempengaruhi umur simpan dapat dikategorikan menjadi faktor internal dan eksternal (Kilcast dan Subramanian ,1993). Faktor internal merupakan karakteristik produk akhir, misalnya aktivitas air (aw), pH, nilaigizi, penggunaan bahan pengawet dan biokimia alami produk (enzim dan komponen kimia). Faktor eksternal adalah faktor yang mempengaruhi produk selama pengiriman hingga diterima konsumen. Faktor eksternal diantaranya adalah suhu penyimpanan, RH penyimpanan, RH proses, RH pengiriman, komposisi udara dalam kemasan dan penanganan selama di konsumen (Astawan, 2007). Penentuan umur simpan penting dalam proses penyimpanan suatu produk. Pengetahuan mengenai umur simpan produk akan dapat mempermudah perancangan sistem pengemasan dan penyimpanan yang sesuai (Syarief dan Halid, 1993).
2.6.2. Dasar Penurunan Mutu
Analisis penurunan mutu memerlukan beberapa pengamatan, yaitu parameter yang dapat diukur secara kuantitatif dan parameter tersebut harus mencerminkan keadaan mutu produk yang diperiksa. Faktor lingkungan seperti suhu, kelembaban, kandungan oksigen, dan cahaya dapat menyebabkan penurunan mutu produk sehingga produk dapat ditolak oleh konsumen. Faktor lingkungan pun dapat membahayakan orang yang mengkonsumsinya karena dapat membuat seseorang keracunan (Edria, 2010). Oleh karena itu, pemahaman yang baik terhadap reaksi-reaksi yang dapat menyebabkan penurunan mutu produk pangan menempati prioritas untuk pengembangan prosedur spesifik guna mengevaluasi umur simpan produk pangan (Singh, 1994).
Penyimpangan mutu produk dari mutu awalnya disebut sebagai deteriorasi (Labuza,1982). Reaksi deteriorasi dimulai dari persinggungan produk dengan udara, oksigen, uap air, cahaya, atau akibat perubahan suhu. Reaksi ini dapat juga diawali oleh hentakan mekanis seperti vibrasi, kompresi, dan abrasi. Deteriorasi pada produk pangan dapat juga disebabkan oleh faktor intrinsik maupun ekstrinsik yang selanjutnya memicu reaksi dalam produk. Reaksi tersebut dapat berupa reaksi kimia, reaksi enzimatis,dan proses lainnya. Contoh proses lainnya adalah proses fisik dalam bentuk penyerapan uap air atau gas dari lingkungan. Analisis kuantitatif reaksi deteriorasi yang berlangsung pada produk selama proses pengemasan dan penyimpanan dapat dilakukan dengan cara pengukuran tingkat deteriorasi yang berlangsung. Analisis-analisis yang dilakukan meliputi analisis fisik, analisis kimia, dan uji organoleptik.
16
2.6.3. Perumusan Model Umur SimpanUmur simpan produk pangan dapat diduga dan kemudian ditetapkan waktu kadaluarsanya dengan menggunakan dua konsep studi penyimpanan produk pangan yaitu Extended Storage Studies (ESS) dan Accelerated Storage Studies (ASS). (Floros dan Granasekharan, 1993). ESS sering juga disebut sebagai metode konvensional yaitu penentuan tanggal kadaluarsa dengan menyimpan suatu seri produk pada kondisi normal sehari-hari dan dilakukan pengamatan terhadap penurunan mutunya sehingga mencapai tingkat kadaluarsa. Metode ini akurat dan tepat, namun memerlukan waktu yang panjang dan analisis parameter mutu yang relatif banyak. Metode ESS sering digunakan untuk produk yang mempunyai kadaluarsa kurang dari 3 bulan. (Floros dan Granasekharan, 1993).
Metode Accelerated Storage Studies (ASS) digunakan untuk mempercepat pendugaan waktu umur simpan. Kondisi penyimpanan pada metode ini diatur di luar kondisi normal sehingga produk dapat lebih cepat rusak dan penentuan umur simpan dapat ditentukan (Arpah, 2001). Penggunaan metode akselerasi harus disesuaikan dengan keadaan dan faktor yang mempercepat kerusakan produk yang bersangkutan. Model yang diterapkan pada penelitian akselerasi ini menggunakan pendekatan semi empiris dengan bantuan persamaan Arrhenius, yaitu suatu cara pendekatan yang menggunakan teori kinetika yang pada umumnya mempunyai Ordo Nol atau Ordo Satu untuk bahan pangan. Menurut Syarief dan Halid (1993), untuk menganalisis penurunan mutu dengan metode akselerasi diperlukan beberapa pengamatan yaitu harus ada parameter yang diukur secara kuantitatif.
Menurut Syarief dan Halid (1993), suhu merupakan faktor yang berpengaruh terhadap perubahan mutu pangan. Pendugaan umur simpan seharusnya dilakukan di ruangan dengan suhu tetap. Metode Arrhenius baik untuk diterapkan dalam penyimpanan produk pada suhu penyimpanan yang relatif stabil. Menurut Labuza (1982), persamaan Arrhenius menunjukkan ketergantungan laju reaksi deteriorasi terhadap suhu yang dirumuskan sebagai berikut :
= −��/��
keterangan :
k = konstanta penurunan suhu
ko = konstanta (tidak bergantung pada suhu)
Ea = energi aktivasi (Kal/mol)
T = suhu mutlak (K)
R = konstanta gas (1.986 Kal/mol K)
Persamaan di atas diubah menjadi :
�� = − ��
��
Berdasarkan persamaan di atas, diperoleh kurva berupa garis linier pada plot ln k terhadap (1/T) dengan slope –Ea/R seperti Gambar 2.
17
-Ea/R1/T ln K
Gambar 2. Kurva hubungan nilai ln k dengan slope (-Ea/RT) pada persamaan Arrhenius
Labuza (1982) menyatakan penilaian tentang umur simpan dapat dilakukan dengan kondisi dipercepat (accelerated shelf life test) yang selanjutnya dapat memprediksi umur simpan yang sebenarnya. Metode ini dapat dilakukan dengan mengkondisikan bahan pangan pada suhu dan kelembaban relatif yang tinggi sehingga kadar air kritis lebih cepat tercapai. Penentuan umur simpan dengan metode Arrhenius termasuk ke dalam metode akselerasi.
Semakin sederhana model yang digunakan untuk menduga umur simpan, maka semakin sedikit asumsi yang dipakai. Asumsi-asumsi yang digunakan dalam pendugaan umur simpan metode Arrhenius ini adalah :
a. Perubahan faktor mutu hanya ditentukan oleh satu macam reaksi saja. b. Tidak terjadi faktor lain yang mengakibatkan perubahan mutu.
c. Proses perubahan mutu dianggap bukan merupakan akibat proses-proses yang terjadi sebelumnya.
d. Suhu selama penyimpanan tetap atau dianggap tetap.
Menurut Labuza (1982), reaksi kehilangan mutu pada makanan banyak dijelaskan oleh Ordo Nol dan Ordo Satu, dan sedikit pada ordo reaksi lain.
2.6.3.1. Ordo Nol
Penurunan mutu reaksi nol dalah penurunan mutu yang konstan. Reaksi yang termasuk pada Ordo Nol, laju reaksinya tidak tergantung pada konsentrasi pereaksinya, dengan kata lain reaksi berlangsung dengan laju yang tetap. Jenis Ordo Nol tidak terlalu umum terjadi. Tipe kerusakan yang mengikuti kinetika Ordo Nol meliputi reaksi kerusakan enzimatis, pencoklatan enzimatis, dan oksidasi. Adapun contoh Ordo Nol lainnya adalah reaksi gas pada permukaan logam, reaksi dengan katalis enzim pada konsentrasi substrat tinggi, reaksi fotosintesis pada hijau daun di siang hari, dan reaksi glukosa dengan hemoglobin pada darah.
Implikasi dari Ordo Nol adalah kecepatan penurunan mutu berlangsung secara tetap pada suhu konstan dan digambarkan dengan persamaan berikut :
− � � =
Untuk menentukan jumlah kehilangan mutu maka dilakukan integrasi terhadap persamaan :
� �
�
��
= � . � �
Sehingga menjadi :
18
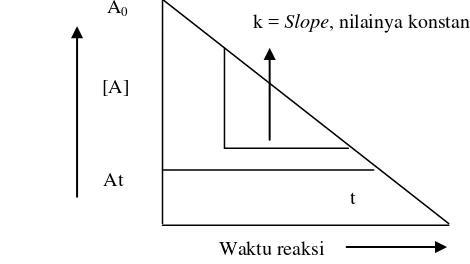
di mana : At adalah jumlah pada waktu t dan Ao adalah jumlah awal AGrafik hubungan waktu penyimpanan dengan perubahan mutu pada Ordo Nol adalah berupa garis lurus, dengan slope kemiringan k yang nilainya konstan. Bentuk umum grafik tersebut terdapat pada Gambar 3.
Gambar 3. Grafik hubungan waktu penyimpanan dengan perubahan mutu produk pada Ordo Nol (Labuza, 1982)
2.6.3.2. Ordo Satu
Tipe kerusakan yang mengikuti Ordo Satu adalah ketengikan, pertumbuhan mikroba, produksi off flavor (penyimpangan flavor) oleh mikroba pada daging, ikan, dan unggas, kerusakan vitamin, penurunan mutu protein, dan lain sebagainya.
Persamaan reaksinya adalah
− � � = .�
Untuk menentukan jumlah kehilangan mutu maka dilakukan integrasi terhadap persamaan :
� � �⁄
��
= − � . � �
Sehingga menjadi :
�� �� − �� � = − .�
Grafik Ordo Satu berupa kurva (bukan garis lurus), namun akan membentuk garis lurus dalam persamaan logaritmanya, dengan slope kemiringan k yang nilainya tidak konstan seperti yang terlihat pada Gambar 4.
Faktor-faktor yang mempengaruhi laju reaksi kimia terdapat tujuh faktor, anatara lain jenis zat yang bereaksi, konsentrasi zat yang bereaksi, suhu, katalis dan otokatalis, tekanan, luas permukaan, sinar, dan cahaya. Jenis zat yang beraksi merupakan faktor terpenting dalam suatu reaksi. Suatu zat A dapat dengan mudah bereaksi dengan zat B, tetapi belum mudah bereaksi bila dengan zat C. Selain itu, laju rekasi akan semakin naik jika konsentrasi pereaksi makin tinggi. Makin tinggi suhu campuran zat yang bereaksi, makin cepat reaksi berlangsung. Hal ini berdasar
A0
[A]
At
t
k = Slope, nilainya konstan
19
teori kinetik molekul, yang menyatakan bahwa semakin tinggi suhu suatu zat, semakin kuat gerakan-gerakan molekulnya (Irawadi, 2005).Gambar 4. Grafik hubungan waktu penyimpanan dengan perubahan mutu produk pada Ordo Satu (Labuza, 1982)
(a) Grafik hubungan waktu dan perubahan mutu Ordo Satu (b) Grafik hubungan waktu dan logaritma perubahan mutu Ordo Satu
(a) (b)
Slope = k
Waktu Waktu
Slope = �� ��
20
III.
METODOLOGI PENELITIAN
3.1. BAHAN DAN ALAT
Bahan yang digunakan dalam penelitian ini terdiri atas bahan-bahan untuk membuat bir pletok, penyimpanan dan bahan-bahan untuk analisis. Bahan yang digunakan untuk pembuatan bir pletok terdiri dari jahe, kayu secang, cabe jawa, kayu manis, sereh, lada putih, lada hitam, daun pandan, cengkeh, kembang pala, biji pala, adas manis, kapulaga besar, kapulaga kecil, jintan, kayu mesoyi, pekak, air, dan gula yang diperoleh dari Pasar Anyar, Bogor. Bahan untuk analisis terdiri dari bir pletok larutan DPPH dan metanol.
Alat yang digunakan dalam penelitian ini terdiri dari alat-alat untuk pembuatan bir pletok, penyimpanan, dan alat-alat untuk analisis. Alat-alat yang digunakan untuk pembuatan dan penyimpanan bir pletok, yaitu oven pengering, blender kering, neraca analitik, steam jacket, centong, kulkas, saringan, dan botol kaca. Alat-alat yang digunakan untuk analisis, yaitu gelas piala, tabung reaksi bertutup, pipet Mohr 1 ml, pipet Mohr 5 ml, pipet Mohr 10 ml, kuvet, spektrofotometer, dan vortex.
3.2. METODE PENELITIAN
Penelitian yang dilakukan terdiri dari empat tahap, yaitu: (1) Pembuatan bir pletok dalam botol, (2) Penelitian Utama, (3) Pendugaan umur simpan dengan metode Arrhenius, dan (4) Transformasi nilai umur simpan menjadi waktu kadaluarsa. Penelitian utama terdiri atas Penelitian Seri I dan Penelitian Seri II. Pengamatan setiap seri penelitian utama terdiri atas analisis antioksidan dengan metode DPPH dan uji organoleptik pada akhir masa penyimpanan. Garis besar penelitian dapat dilihat pada Gambar 5.
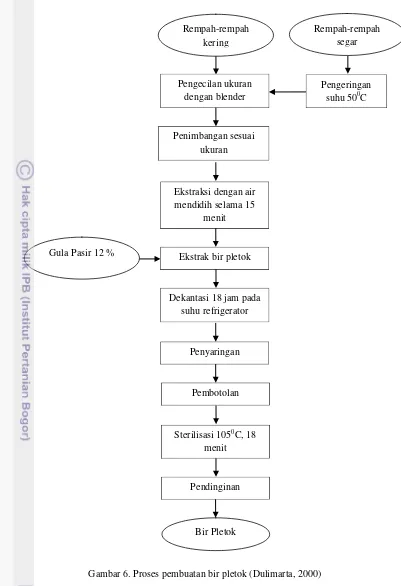
3.2.1. Pembuatan Bir Pletok
21
Gambar 5. Diagram alir penelitianTabel 3. Komposisi bir pletok (Dulimarta, 2000)
Jenis Rempah Jumlah (%)
Jahe 20,53
Cabe Jawa 20,53
Kayu Secang 13,69
Kayu Manis 10,66
Sereh 6,84
Lada Putih 3,43
Lada Hitam 3,43
Daun Pandan 3,43
Cengkeh 3,43
Kembang Pala 3,43
Biji Pala 3.43
Adas Manis 1,72
Kapulaga Besar 1,72
Jintan Hitam 1,72
Pekak 1,72
Kapulaga kecil 1,72
Kayu mesoyi 0,69
Pendugaan Umur Simpan
Penelitian Seri I Penelitian Seri II Rempah-rempah
Pembuatan bir pletok
bir pletok dalam botol
Penyimpanan dengan suhu yang berbeda
Penyimpanan dengan warna botol yang berbeda
Analisis kapasitas antioksidan Analisis kapasitas antioksidan
Uji rating hedonik Uji rating hedonik
Pendugaan Umur Simpan
22
Gambar 6. Proses pembuatan bir pletok (Dulimarta, 2000)3.2.2. Penelitian Utama
Penelitian utama pada dasarnya adalah penyimpanan bir pletok selama 8 minggu dan pendugaan umur simpan dengan model Arrhenius berdasarkan perubahan kadar antioksidan selama umur simpan tersebut. Penelitian utama terdiri atas Penelitian Seri I dan Penelitian Seri II. Uji yang dilakukan baik untuk Penelitian Seri I maupun Penelitian Seri II adalah uji kapasitas
Pengecilan ukuran dengan blender
Penimbangan sesuai ukuran
Ekstraksi dengan air mendidih selama 15
menit
Ekstrak bir pletok
Dekantasi 18 jam pada suhu refrigerator
Bir Pletok Rempah-rempah
kering
Rempah-rempah segar
Pengeringan suhu 500C
Penyaringan
Pembotolan
Sterilisasi 1050C, 18 menit
23
antioksidan serta uji organoleptik akhir. Perbedaan Penelitian Seri I dan Penelitian Seri II terdapat dalam penyimpanan bir pletok. Faktor yang dipakai pada Penelitian Seri I adalah suhu, sedangkan warna botol yang dipakai adalah gelap dan disimpan dalam inkubator. Faktor yang dipakai pada Penelitian Seri II adalah transparansi kemasan yang diwakilkan oleh pembedaan warna botol, sedangkan suhu yang dipakai adalah 300C dan disimpan pada ruang terbuka. Suhu yang digunakan untuk penyimpanan Penelitian Seri I adalah 300C, 370C, dan 500C. Warna botol kaca yang digunakan untuk Penelitian Seri II adalah tidak berwarna, coklat, dan gelap. Pendugaan umur simpan dihitung dengan metode Accelerated Storage Studies (ASS) dan model Arrhenius berdasarkan perubahan kadar antioksidan selama umur simpan tersebut.Penataan penelitian yang digunakan menggunakan univariated factor pada masing-masing seri penelitian dan dilakukan dengan tiga kali ulangan. Faktor yang akan dipelajari pada Penelitian Seri I adalah suhu penyimpanan dan faktor yang akan dipelajari pada Penelitian Seri II adalah transparansi kemasan yang diwakilkan oleh pembedaan warna botol kaca. Pendugaan umur simpan dihitung dengan metode Extended Storage Studies (ESS) berdasarkan perubahan kadar antioksidan selama umur simpan tersebut.
3.2.3. Pendugaan Umur Simpan dengan Metode Arrhenius
Model Arrhenius merupakan jenis pendekatan yang mengkuantifikasikan pengaruh suhu terhadap reaksi deteriorasi. Persamaan Arrhenius menunjukkan kebergantungan konstanta laju reaksi terhadap suhu dalam kisaran suhu yang luas.
Persamaan model Arrhenius :
= . −��/�� Dengan mengubah persamaan di atas maka menjadi :
�� = − ��
��
Hasil yang diperoleh selanjutnya diplotkan pada grafik hubungan antara lama penyimpanan (hari) dan rata-rata penurunan mutu/hari (k). Jika reaksi kerusakan pangan yang disimpan belum diketahui model orde reaksinya, maka plot nilai diatas dapat dilakukan baik pada Ordo Nol maupun Ordo Satu. Pada Ordo Nol, plot dilakukan antara rataan skor pengamatan dengan waktu penyimpanan, sedangkan Ordo Satu, nilai rataan skor terlebih dahulu diubah dalam bentuk lon (ln) lalu diplotkan dengan waktu penyimpanan. Langkah berikutnya adalah menentukan regresi linearnya.
Hasil plot di atas akan memberikan nilai k, intersep dan koefisien korelasi masing-masing suhu penyimpanan. Untuk melihat dan menentukan orde reaksi kerusakan bahan pangan yang disimpan dapat ditentukan dari nilai koefisien korelasi yang lebih besar (R2). Setelah jenis orde reaksi kerusakan pangan diketahui, maka langkah selanjutnya adalah memplotkan nilai k terhadap suhu penyimpanan dalam bentuk Kelvin (K, 1/T). Nilai k terlebih dahulu diubah dalam bentuk ln jika orde reaksi kerusakan pangan mengikuti Ordo Satu. Hasil plot tersebut akan memberikan nilai k, intersep dan koefisien korelasi. Nilai k hasil plot ini merupakan nilai dari energi aktivasi dibagi dengan konstanta gas (Ea/R), karena persamaan garis linear hasil pemplotan akan mengikuti persamaan Arrhenius. Selanjutnya umur produk bir pletok dalam botol dapat dihitung dengan persamaan :
�= � − �� Keterangan :
24
At = nilai mutu produk yang tersisa setelah waktu tk = konstanta penurunan mutu pada suhu normal
3.2.4. Transformasi Nilai Umur Simpan Menjadi Waktu Kadaluarsa
Transformasi nilai umur simpan menjadi waktu kadaluarsa dilakukan dengan menghitung umur simpan produk pada berbagai suhu penyimpanan. Dalam penelitian ini waktu kadaluarsa dihitung pada estimasi suhu penyimpanan konvensional dengan suhu siang hari (350C) dan malam hari (250C)
3.3. PROSEDUR ANALISIS
3.3.1. Pengukuran Kapasitas Antioksidan Menggunakan DPPH (Leong dan Shui, 2002) Sebelum dilakukan pengukuran kapasitas antioksidan, dilakukan pembuatan kurva standar dengan menggunakan larutan asam askorbat dengan konsentrasi 0 sampai 110 ppm. Prosedur pembuatan larutan untuk standar sama dengan prosedur pengujian sampel. Selanjutnya dibuat kurva standar asam askorbat dengan memplotkan hubungan antara konsentrasi asam askorbat dan (A blanko – A sampel).
Prosedur pengujian sampel diawali dengan memasukkan 1 ml sampel bir pletok ke dalam tabung reaksi, kemudian ditambahkan 7 ml metanol. Larutan DPPH sebanyak 2 ml ditambahkan ke dalam tabung reaksi sehingga konsentrasi akhir larutan DPPH menjadi 0.02 mM, lalu dikocok dengan alat vortex. Campuran larutan didiamkan selama 30 menit dalam suhu ruang dan diukur absorbansinya (A sampel) pada panjang gelombang 517 nm. A blanko diperoleh dengan prosedur yang sama kecuali tidak ada penambahan sampel sehingga metanol yang digunakan menjadi 8 ml. Selanjutnya selisih A blanko dikurangi nilai A sampel yang disubstitusikan pada persamaan kurva standar asam askorbat untuk menentukan AEAC(Ascorbic Acid Equivalent Antioxidant Capacity).
3.3.2. Uji Organoleptik dengan Uji Rating Hedonik (Adawiyah dan Waysima, 2009)
Uji rating hedonik dilakukan terhadap kedua seri penelitian secara terpisah baik Seri I maupun Seri II pada akhir masa penyimpanan. Panelis diminta untuk menilai atribut-atribut sensori sampel yang disajikan, yakni dalam hal warna, aroma, rasa, dan keseluruhan. Dalam uji ini, digunakan panelis tidak terlatih sebanyak 70 orang. Taraf signifikansi yang digunakan adalah 5%. Analisis data dilakukan menggunakan ANOVA (Analysis of Variance) dengan uji lanjut Duncan. Skala yang digunakan dalam uji ini adalah skala kategori 7 poin dengan deskripsi sebagai berikut:
1 = sangat tidak suka 2 = tidak suka 3 = agak tidak suka 4 = netral
25
3.4. PERLAKUAN3.4.1. Penelitian Seri I
Pada Penelitian Seri I perlakukan yang diterapkan adalah suhu dengan tiga taraf sebagai berikut:
A1 = Suhu 300C A2 = Suhu 370C A3 = Suhu 500C 3.4.2. Penelitian Seri II
Pada Penelitian Seri II, perlakukan yang diterapkan adalah warna botol (yang merepresentasikan transmisi cahaya) dengan tiga taraf sebagai berikut:
B1 = Bening / Tidak berwarna B2 = Coklat
B3 = Gelap (dilapisi alufo)
3.5. RANCANGAN PERCOBAAN
Rancangan percobaan yang digunakan dalam Penelitian Seri I dan Penelitian Seri II adalah Rancangan Acak Lengkap (RAL) dengan masing-masing tiga ulangan. Model matematik RAL tersebut adalah sebagai berikut:
Yij = µ + Ai + Σ ij Di mana:
Yij = Nilai pengamatan µ = Nilai rata-rata umum
Ai = Pengaruh taraf perlakuan ke-i Σ ij = Galat percobaan
26
y = 0.0182x - 0.4897 R² = 0.995
0 0.5 1 1.5 2
0 20 40 60 80 100 120
A
b
so
rb
a
n
si
Konsentrasi (ppm)
IV.
HASIL DAN PEMBAHASAN
4.1. PENELITIAN SERI I
4.1.1.Perubahan Kapasitas Antioksidan Bir Pletok Selama Penyimpanan
Penentuan kapasitas antioksidan diawali dengan menentukan persamaan kurva standar asam askorbat. Penentuan persamaan kurva standar asam askorbat dilakukan dengan kurva yang menghubungkan absorbansi larutan asam askorbat terukur (Ablanko-Asampel) sebagai y dan konsentrasi asam askorbat (ppm) sebagai x seperti Gambar 7. Persamaan kurva standar asam askorbat yang didapat adalah y= 0,018x – 0,4897.
Gambar 7. Kurva standar asam askorbat
Kapasitas antioksidan bir pletok ditentukan dengan mengukur absorbansi sampel dan memasukkannya dalam persamaan kurva standar asam askorbat. Kapasitas antioksidan awal dari bir pletok pada penelitian adalah sebesar 101,5769 ppm AEAC. Contoh perhitungan kapasitas antioksidan adalah sebagai berikut :
Absorbansi sampel H0 U1= 0,282
Absorbansi sampel H0 U2= 0,280
Absorbansi blanko = 1,640
Absorbansi blanko – Absorbansi sampel H0 U1 = 1,358
Absorbansi blanko – Absorbansi sampel H0 U2 = 1,360
Y = 0,018x – 0,4897 1,358 = 0,018 x – 0,4897
�1= 101.521978 ppm AEAC
Y = 0,018x – 0,4897 1,360 = 0,018 x – 0,4897
�2 = 101.6318681 ppm AEAC
Kapasitas antioksidan H0 = (�1 +�2) 2⁄ = 101.5769 ppm AEAC
27
0.0000 20.0000 40.0000 60.0000 80.0000 100.0000 120.00000 10 20 30 40 50 60
K a p a si ta s a n ti o k si d a n ( p p m A E A C )
Lama Penyimpanan (hari)
Series1
Series2
Series3
Gambar 8. Perubahan kapasitas antioksidan bir pletok pada Penelitian Seri I selama penyimpanan
Tabel 4. Kadar antioksidan bir pletok Penelitian Seri I selama penyimpanan
Hari ke- Suhu
300C 370C 500C 0 101,5769 101,5769 101,5769
7 101,0549 100,2582 97,8681
14 99,9011 98,6648 84,8187
21 97,8681 93,3352 80,4238
28 94,4890 86,7967 68,8297
35 82,5659 75,4231 63,9945
42 81,4670 75,0385 60,5330
49 79,3242 73,5549 56,0000
56 76,6044 67,8407 43,3077
Secara umum, kapasitas antioksidan bir pletok selama penyimpanan menurun seiring dengan lamanya waktu simpan. Kapasitas antioksidan bir pletok pada penyimpanan suhu 500C mengalami penurunan yang paling drastis karena antioksidan mudah teroksidasi oleh panas. Kapasitas antioksidan bir pletok pada suhu penyimpanan 300C dan 370C juga mengalami penurunan tetapi tidak drastis. Penurunan kapasitas antioksidan berbanding lurus dengan penambahan suhu penyimpanan yang dilakukan. Penurunan kapasitas antioksidan akan lebih cepat seiring dengan suhu penyimpanan yang lebih tinggi.
4.1.2. Penentuan Umur Simpan dan Waktu Kadaluarsa Bir Pletok 4.1.2.1. Penentuan Ordo Reaksi
Berdasarkan data perubahan kapasitas antioksidan bir pletok selama penyimpanan, dapat diplotkan dalam bentuk kurva yang disajikan dalam bentuk kurva linier dan kurva eksponensial. Kurva berbentuk linier menunjukkan Ordo Nol dan kurva eksponensial menunjukkan data Ordo Satu. Penetapan ordo reaksi berkaitan dengan laju perubahan mutu. Ordo Nol menunjukkan laju kerusakan konstan, sedangkan Ordo Satu menunjukkan laju kerusakan yang bersifat logaritmik.
28
Pemilihan ordo reaksi dilakukan dengan memplotkan data penurunan kapasitas antioksidan mengikuti Ordo Nol dan Ordo Satu. Masing-masing ordo dibuat persamaan regresinya. Ordo reaksi yang terpilih adalah ordo reaksi dengan nilai R2 terbesar dan mendekati 1. Hasil perhitungan R2 pada penelitian kali ini tidak berbeda terlalu jauh oleh karena itu dilakukan penghitungan umur simpan pada kedua ordo reaksi. Kurva ordo reaksi masing-masing perlakuan terdapat pada Lampiran 3. Nilai persamaan grafik dan nilai R2 masing-masing perlakuan terdapat pada Tabel 5.Tabel 5. Persamaan reaksi hubungan antara perubahan kapasitas antioksidan dan perlakuan Penelitian Seri I pada Ordo Nol dan Ordo Satu
Suhu Ordo Nol Ordo Satu
Persamaan reaksi R2 Persamaan reaksi R2 300C y= -0,5173x + 105,020 0,9198 y = -0,0058x + 4,6621 0,9167 370C y= -0,6672x + 104,510 0,9503 y = -0,0079x + 4,6621 0,9478 500C y = -1,0056x + 101,150 0,9804 y = -0,0142x + 4,6555 0,9702 4.1.2.2. Penghitungan Umur Simpan dengan Metode Arrhenius
Penentuan umur simpan bir pletok dilakukan dengan model Arrhenius. Berdasarkan data yang diperoleh, dilakukan perhitungan lanjut terhadap nilai k dari setiap perlakuan berdasarkan kedua ordo reaksi. Nilai k pada Ordo Nol dapat ditentukan dari nilai slope grafik. Nilai k Ordo Satu diperoleh dengan cara menghitung dengan rumus :
�� ��= �� � − .� Keterangan :
At =Absorbansi sampel pada akhir penyimpanan A0= Absorbansi awal sampel
t = waktu akhir penyimpanan
Nilai k merupakan konstanta penurunan mutu. Nilai k berkaitan dengan waktu umur simpan bir pletok. Semakin tinggi nikai k, semakin besar penurunan mutu yang terjadi sehingga akan mempersingkat umur simpan bir pletok. Perhitungan umur simpan dapat diperluas pada berbagai suhu yang lain dengan menggunakan hubungan nilai k dan suhu penghitungan sebelumnya. Nilai k yang diperoleh dalam perhitungan dihubungkan dengan suhu menggunakan persamaan Arrhenius :
�=���(�� ��)⁄ Atau dalam bentuk logaritmanya
ln�= ln�� − ����
� �.�
1
���
29
y = -3242.4x + 10.047 R² = 0.9996
-0.8000 -0.6000 -0.4000 -0.2000 0.0000 0.2000
0.0031 0.0031 0.0032 0.0032 0.0033 0.0033 0.0034
Ln
k
1/T (K)
y = -5476x + 12.757 R² = 0.9983
-6.0000 -5.0000 -4.0000 -3.0000 -2.0000 -1.0000 0.0000
0.0031 0.0031 0.0032 0.0032 0.0033 0.0033 0.0034
Ln
k
[image:30.595.115.495.87.797.2]1/T (K)
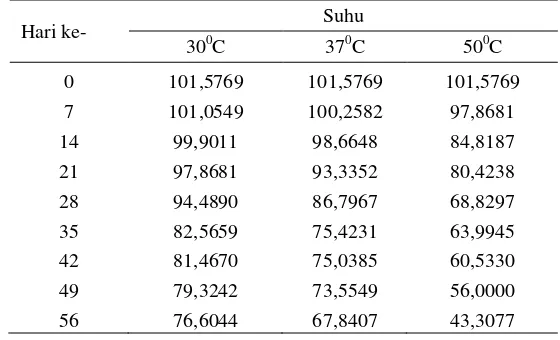
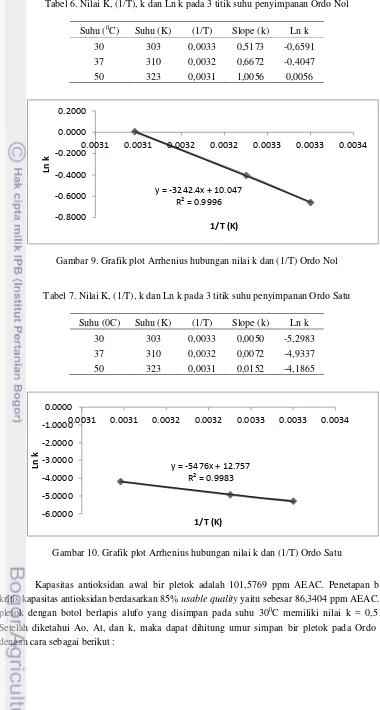
Tabel 6. Nilai K, (1/T), k dan Ln k pada 3 titik suhu penyimpanan Ordo Nol
Suhu (0C) Suhu (K) (1/T) Slope (k) Ln k 30 303 0,0033 0,5173 -0,6591 37 310 0,0032 0,6672 -0,4047 50 323 0,0031 1,0056 0,0056
Gambar 9. Grafik plot Arrhenius hubungan nilai k dan (1/T) Ordo Nol
Tabel 7. Nilai K, (1/T), k dan Ln k pada 3 titik suhu penyimpanan Ordo Satu
Suhu (0C) Suhu (K) (1/T) Slope (k) Ln k 30 303 0,0033 0,0050 -5,2983 37 310 0,0032 0,0072 -4,9337 50 323 0,0031 0,0152 -4,1865
Gambar 10. Grafik plot Arrhenius hubungan nilai k dan (1/T) Ordo Satu
[image:30.595.125.495.107.339.2]30
=� −�� = , − ,, = , ��
Dengan cara yang sama diperoleh nilai k dan umur simpan pada suhu penyimpanan dan umur simpan seperti pada Tabel 8. Nilai k yang lebih besar didapatkan dari penyimpanan dengan suhu lebih tinggi.
Tabel 8. Nilai konstanta perubahan kapasitas antioksidan dan umur simpan bir pletok Penelitian Seri I terhadap pengaruh suhu penyimpanan pada Ordo Nol
Suhu nilai k Umur simpan (hari) 300C 0,5173 29,45
370C 0,6672 22,84
500C 1,0056 15,15
Umur simpan bir pletok yang disimpan dalam suhu 300C pada Ordo Satu memiliki nilai k dan umur simpan :
Ao = 101,5769 ppm AEAC A = 86,3404 ppm AEAC
=�� � − �� � = �� , − �� ,
, = , ��
Dengan cara yang sama diperoleh nilai k dan umur simpan pada suhu penyimpanan dan umur simpan seperti pada Tabel 9. Nilai k yang lebih besar didapatkan dari penyimpanan dengan suhu lebih tinggi.
Tabel 9. Nilai konstanta perubahan kapasitas antioksidan dan umur simpan bir pletok Penelitian Seri I terhadap pengaruh suhu penyimpanan pada Ordo Satu
Suhu nilai k Umur simpan (hari) 300C 0,5173 32,25
370C 0,6672 22,55
500C 1,0056 10,67
Nilai k yang lebih tinggi menghasilkan umur simpan bir pletok yang lebih rendah. Data perhitungan nilai k dan umur simpan juga menunjukkan bahwa suhu penyimpanan sangat berpengaruh terhadap umur simpan bir pletok. Semakin tinggi suhu penyimpanan menyebabkan nilai k semakin meningkat dan umur simpan bir pletok semakin menurun.
4.1.2.3. Transformasi umur Simpan menjadi Waktu Kadaluarsa
31
karena diasumsikan mempengaruh suhu penyimpanan bir pletok dalam distribusi dan penyimpanan yang dilakukan oleh pengrajin bir pletok konvensional, yaitu 250C pada malam hari dan 350C pada siang hari. Perhitungan nilai k dan lama simpan (t) pada kedua suhu sehingga diperoleh nilai k dan t terdapat pada Tabel 10 untuk Ordo Nol dan Tabel 11 untuk Ordo Satu.Tabel 10. Nilai k, ln k, umur simpan, dan waktu kadaluarsa pada suhu 250C dan 350C berdasarkan persamaan Arrhenius untuk Ordo Nol
Suhu (0C) Suhu (K) (1/T) Ln k k Umur Simpan Kadaluarsa 35 308 0,0032 -0,4803 0,6186 24,63
29,85 25 298 0,0033 -0,8335 0,4345 35,07
Tabel 11. Nilai k, ln k, umur simpan, dan waktu kadaluarsa pada suhu 250C dan 350C berdasarkan persamaan Arrhenius untuk Ordo Satu
Suhu (0C) Suhu (K) (1/T) Ln k k Umur Simpan Kadaluarsa
35 308 0,0032 -5,0222 0,0066 24,66
34,72
25 298 0,0034 -5,6188 0,0036
44,78
Waktu kadaluarsa bir pletok yang disimpan dan dijual oleh produsen bir pletok konvensional dengan mengasumsikan suhu penyimpanan seperti di atas pada Ordo Nol dan pada Ordo Satu berturut-turut adalah sebesar 29,5 hari (29 hari) dan 34,72 hari (34 hari).
4.1.3. Penerimaan Konsumen terhadap Bir Pletok Setelah Penyimpanan
Penerimaan konsumen terhadap bir pletok setelah penyimpanan dilakukan berdasarkan hasil uji rating hedonik. Respon panelis pada uji rating hedonik dapat dilihat pada Tabel 12. Rekapitulasi data uji rating hedonik dan pengolahan datanya dapat dilihat pada Lampiran 4a-Lampiran 4e.
Tabel 12 Respon panelis pada uji rating hedonik Penelitian Seri I
Suhu Parameter uji
Rasa Aroma Warna Overall 300C 4,93 4,74 5,13 4,66 370C 4,09 4,50 4,61 4,47 500C 3,81 4,07 4,43 4,03
32
pletok pada suhu penyimpanan 370C tetapi dari rata-rata nilai rating hedonik tertinggi, penyimpanan bir pletok dengan suhu 300C sangat dianjurkan dibandingkan dengan suhu penyimpanan yang lain.Umur simpan bir pletok pada Penelitian Seri I cukup singkat karena penghitungan umur simpan hanya berdasarkan parameter kapasitas antioksidan sebesar 85% dari kapasitas antioksidan awal bir pletok. Bir pletok yang telah disimpan dalam waktu dua bulan masih dapat diterima konsumen dalam segi sensori yang dibuktikan dengan nilai rata-rata rating hedonik yang cukup tinggi.
4.1.4.Korelasi Data Organoleptik dan Data Kuantitatif
Data organoleptik diambil dengan uji rating hedonik dengan skala parameter 1-7 dengan taraf signifikansi 5%, dianalisis dengan ANOVA dan uji lanjut Duncan. Data kuantitatif pada penelitian ini adalah kadar antioksidan dan umur simpan. Berdasarkan hasil organoleptik, bir pletok yang paling disukai oleh konsumen adalah bir pletok yang disimpan pada suhu 300C. Berdasarkan hasil data analisis, penurunan mutu kapasitas antioksidan yang terendah ditunjukkan oleh bir pletok yang disimpan pada suhu 300C.
Hasil organoleptik pada penelitian ini sebanding dengan hasil analisis kadar antioksidan. Kapasitas antioksidan yang lebih tinggi menghasilkan penerimaan konsumen yang lebih tinggi dan menghasilkan umur simpan yang lebih tinggi.
4.2. PENELITIAN SERI II
4.2.1. Perubahan Kapasitas Antioksidan Bir Pletok Selama Penyimpanan
Dengan cara yang sama dengan Penelitian Seri I maka dapat dihitung kapasitas antioksidan selama penyimpanan bir pletok pada masing-masing waktu dan perlakuan. Perubahan kadar antioksidan bir pletok selama penyimpanan ditunjukkan oleh Tabel 13 dan Gambar 11.
33
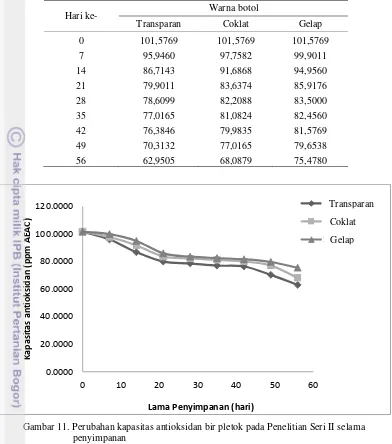
Tabel 13. Kadar antioksidan bir pletok Penelitian Seri II selama penyimpananHari ke- Warna botol
Transparan Coklat Gelap
0 101,5769 101,5769 101,5769
7 95,9460 97,7582 99,9011
14 86,7143 91,6868 94,9560
21 79,9011 83,6374 85,9176
28 78,6099 82,2088 83,5000
35 77,0165 81,0824 82,4560
42 76,3846 79,9835 81,5769
49 70,3132 77,0165 79,6538
56 62,9505 68,0879 75,4780
Gambar 11. Perubahan kapasitas antioksidan bir pletok pada Penelitian Seri II selama penyimpanan
4.2.2. Penentuan Umur Simpan Bir Pletok
4.2.2.1. Penghitungan Umur Simpan dengan Metode ESS
Penentuan umur simpan bir pletok dilakukan dengan model ESS. Berdasarkan data perubahan kapasitas antioksidan bir pletok selama penyimpanan, dapat diplotkan dalam bentuk kurva yang disajikan dalam bentuk linear. Kurva dari masing-masing warna botol memiliki persamaan garis linear yang berbeda-beda. Umur simpan metode ESS dapat ditentukan dengan memasukkan 85% usable quality nilai kapasitas antioksidan awal bir pletok menggantikan nilai y pada masing-masing persamaan garis linear. Nilai persamaan garisdan nilai R2 masing-masing perlakuan terdapat pada Tabel 14 dan Kurva dapat dilihat pada Lampiran 3.
0.0000 20.0000 40.0000 60.0000 80.0000 100.0000 120.0000
0 10 20 30 40 50 60
K a p a si ta s a n ti o k si d a n ( p p m A E A C )
Lama Penyimpanan (hari)
34
Tabel 14. Persamaan garis linear antara perubahan kapasitas antioksidan dan perlakuanPenelitian Seri II
Warna Botol Persamaan reaksi R2
Transparan y = -0,607x + 98,042 0,9311 Coklat y = -0,5289x + 99,592 0,9327 Gelap y = -0,4651x + 100,25 0,9192
Kapasitas antioksidan awal bir pletok adalah 101,5769 ppm AEAC. Penetapan batas kritis kapasitas antioksidan berdasarkan 85% usable quality yaitu sebesar 86,3404 ppm AEAC.
Bir pletok dengan botol tansparan yang disimpan pada ruang terbuka memiliki nilai k dan umur simpan :
y = 86,3404 = − ,
− , =
, − ,
= , ��
Dengan cara yang sama diperoleh umur simpan pada botol coklat dan pada botol yang dilapisi alufo seperti pada Tabel 15. Nilai k yang lebih besar didapatkan dari botol yang transparan. Bir pletok yang dikemas dalam botol yang lebih terlindung dari banyak transmisi cahaya memiliki nilai k yang lebih kecil dan memiliki umur simpan yang lebih besar. Data perhitungan nilai k dan umur simpan juga menunjukkan bahwa transmisi cahaya sangat berpengaruh terhadap umur simpan bir pletok. Semakin banyak transmisi cahaya yang masuk ke dalam bir pletok menyebabkan nilai k semakin meningkat dan umur simpan bir pletok semakin menurun. Hal ini dapat terjadi karena produk yang tidak memiliki penghalang transmisi cahaya dalam penelitian ini adalah warna botol yang semakin gelap akan mengalami kontak langsung dengan faktor deteriorasi yaitu transmisi cahaya itu sendiri.
Umur simpan bir pletok pada Penelitian Seri II cukup singkat karena penghitungan umur simpan hanya berdasarkan parameter kapasitas antioksidan sebesar 85% dari kapasitas antioksidan awal bir pletok. Bir pletok yang telah disimpan dalam waktu dua bulan masih dapat diterima konsumen dalam segi sensori yang dibuktikan dengan nilai rata-rata rating hedonik yang cukup tinggi.
Tabel 15. Umur simpan bir pletok pada masing-masing perl