UJI KECERNAAN
IN VITRO
SILASE CAMPURAN RUMPUT
GAJAH (
Pennisetum purpureum
)
DAN LAMTORO MERAH
(
Acacia villosa
)
FAOLINE JUNITA PUTRI
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Uji Kecernaan In vitro Silase Campuran Rumput Gajah (Pennisetum purpureum) dan Lamtoro Merah (Acacia villosa) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
FAOLINE JUNITA PUTRI. Uji Kecernaan In vitro Silase Campuran Rumput Gajah (Pennisetum purpureum) dan Lamtoro Merah (Acacia villosa). Dibimbing oleh ASEP SUDARMAN dan YANTYATI WIDYASTUTI.
Uji Kecernaan In vitro Silase Campuran Rumput Gajah (P. purpureum) dan Lamtoro Merah (A. villosa) bertujuan untuk mengkaji kualitas kecernaan silase pada proporsi yang berbeda secara in vitro. Rancangan yang digunakan adalah RAK faktorial 3x6 dengan 3 ulangan. Faktor A adalah perbedaan proporsi dari rumput gajah dan A. villosa yaitu A1 = 60% rumput gajah : 40% A. villosa, A2 = 50% rumput gajah : 50% A. villosa, A3 = 40% rumput gajah : 60% A. villosa, sedangkan faktor B adalah perbedaan waktu inkubasi (4, 8, 12, 24, 48, 72 jam). Uji ANOVA digunakan untuk mengetahui perbedaan antar perlakuan. Perbedaan antar perlakuan kemudian diuji menggunakan uji polynomial dan Duncan. Hasil menunjukkan bahwa bakteri total meningkat (P<0.05) sedangkan jumlah protozoa total menurun dengan pertambahan taraf A. villosa (P<0.05). Konsentrasi ammonia dan nilai KCBK dipengaruhi oleh perbedaan waktu inkubasi (P<0.05). Terdapat interaksi (P<0.05) antara perbedaan proporsi dengan waktu inkubasi pada konsentrasi VFA total. Peningkatan taraf A. villosa dapat mengurangi produksi metan. Disimpulkan bahwa penambahan 40% A. villosa dalam silase campuran menghasilkan nilai kecernaan dan VFA total terbaik tetapi menghasilkan gas metan tertinggi.
Kata kunci: A. villosa, kecernaan, metan, rumput gajah
ABSTRACT
FAOLINE JUNITA PUTRI. In vitro Digestibility Testing of Mixed Pennisetum purpureum and Acacia villosa Silage. Supervised by ASEP SUDARMAN and YANTYATI WIDYASTUTI
The aim of this experiment was to study in vitro digestibility of mixed Pennisetum purpureum and Acacia villosa silage in different proportion. The experiment used factorial block randomized design 3x6 with three replicates. Factor A was the ratio between P. purpureum and A. villosa i.e. A1 = 60% P. purpureum : 40% A. villosa, A2 = 50% P. purpureum : 50% A. villosa, and A3 = 40% P. purpureum and60% A. villosa. Factor B was incubation times i.e. B1-B6 for 4, 8, 12, 24, 48, and 72 hours. Data were analyzed using analysis of variance (ANOVA), the difference between treatments were tested with polynomial and Duncan test. The result showed that bacterial population, and organic digestibility were influenced by treatments (P<0.05). Ammonia concentrations, and dry matter digestibility were influenced by incubation time (P<0.05). Protozoa populations was influenced by treatments and incubation time (P<0.05). Interaction between two factors was detected (P<0.05) on total VFA concentrations. Methane was reduced by the increased of A. villosa. It is concluded that the addition of 40% of A. villosa cause the highest digestibility and total VFA production but produce the highest methane.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Peternakan
pada
Departemen Ilmu Nutrisi dan Teknologi Pakan
UJI KECERNAAN
IN VITRO
SILASE CAMPURAN RUMPUT
GAJAH (
Pennisetum purpureum
)
DAN LAMTORO MERAH
(
Acacia villosa
)
FAOLINE JUNITA PUTRI
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Uji Kecernaan In vitro Silase Campuran Rumput Gajah (Pennisetum purpureum) dan Lamtoro Merah (Acacia villosa) Nama : Faoline Junita Putri
NIM : D24090101
Disetujui oleh
Dr Ir Asep Sudarman, MRurSc Pembimbing I
Dr Ir Yantyati Widyastuti Pembimbing II
Diketahui oleh
Prof Dr Ir Panca Dewi MHK, MSi Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Mei 2013 ini ialah Silase, dengan judul Uji Kecernaan In vitro Silase Campuran Rumput Gajah (Pennisetum purpureum) dan Lamtoro Merah (Acacia villosa).
Silase campuran rumput dan legum diharapkan dapat menjadi hijauan sumber protein yang dapat memenuhi kebutuhan ternak ruminansia. Penggunaan A. villosa dalam silase campuran diharapkan selain dapat menambah protein juga dapat digunakan sebagai upaya dalam menekan produksi gas metan. Oleh karena itu dilakukan pengujian secara in vitro untuk mengukur nilai kecernaan silase campuran rumput dan legum.
Skripsi ini merupakan salah satu syarat untuk kelulusan dan memperoleh gelar Sarjana Peternakan di Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
METODE 2
Waktu dan Tempat 2
Bahan 2
HASIL DAN PEMBAHASAN 6
Kecernaan 6
Total Protozoa 8
Total Bakteri 9
Konsentrasi NH3 10
Konsentrasi VFA dan Estimasi Produksi Metan 12
SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR PUSTAKA 15
RIWAYAT HIDUP 23
DAFTAR TABEL
1 Komposisi kimia silase campuran P. purpureum dan A. villosa 2 2 Pengaruh perlakuan perbedaan proporsi P. purpureum dan A. villosa
dalam silase campuran terhadap rataan nilai KCBK pada waktu
inkubasi yang berbeda 7
3 Pengaruh perlakuan perbedaan proporsi P. purpureum dan A. villosa dalam silase campuran terhadap rataan nilai KCBO pada waktu
inkubasi yang berbeda 7
4 Pengaruh perlakuan perbedaan proporsi P. purpureum dan A. villosa dalam silase campuran terhadap rataan total protozoa pada waktu
inkubasi yang berbeda 9
5 Pengaruh perlakuan perbedaan proporsi P. purpureum dan A. villosa dalam silase campuran terhadap rataan populasi bakteri total pada
waktu inkubasi yang berbeda 10
6 Pengaruh perlakuan perbedaan proporsi P. purpureum dan A. villosa dalam silase campuran terhadap rataan konsentrasi NH3 pada waktu
inkubasi yang berbeda 11
7 Pengaruh perlakuan perbedaan proporsi P. purpureum dan A. villosa dalam silase campuran terhadap rataan konsentrasi total VFA pada
waktu inkubasi yang berbeda 13
8 Pengaruh perlakuan perbedaan proporsi P. purpureum dan A. villosa dalam silase campuran terhadap konsentrasi VFA parsial 14
DAFTAR GAMBAR
1 Kurva koefisien cerna bahan kering terhadap waktu inkubasi dari perlakuan pemberian silase campuran P. purpureum dan A. villosa
pada proporsi yang berbeda secara in vitro. 6
2 Kurva hasil perhitungan total protozoa terhadap waktu inkubasi dari perlakuan pemberian silase campuran P. purpureum dan A. villosa
pada proporsi yang berbeda secara in vitro. 8
3 Kurva rataan NH3 terhadap waktu inkubasi dari perlakuan pemberian
silase campuran P. purpureum dan A. villosa pada proporsi yang
berbeda secara in vitro. 11
4 Produksi metan hasil perhitungan dari perlakuan pemberian silase campuran antara P. purpureum dan A. villosa pada proporsi yang
DAFTAR LAMPIRAN
1 Hasil sidik ragam (ANOVA) nilai KCBK 18
2 Hasil uji lanjut kontras polinomial parameter KCBK 18
3 Hasil sidik ragam (ANOVA) nilai KCBO 18
4 Hasil uji jarak berganda Duncan parameter KCBO 18
5 Hasil sidik ragam (ANOVA) protozoa total 19
6 Hasil uji jarak berganda Duncan parameter protozoa 19 7 Hasil uji lanjut kontras polinomial parameter protozoa 19
8 Hasil sidik ragam (ANOVA) bakteri total 20
9 Hasil uji jarak berganda Duncan parameter bakteri total 20 10 Hasil sidik ragam (ANOVA) konsentrasi amonia 20 11 Hasil uji lanjut kontras polinomial parameter konsentrasi NH3 21
12 Hasil sidik ragam (ANOVA) konsentrasi VFA total 21 13 Hasil uji jarak berganda Duncan interaksi parameter VFA total 22
PENDAHULUAN
Kualitas dan kuantitas pakan seringkali menjadi permasalahan dalam penyediaan pakan hijauan untuk ternak ruminansia. Produksi dan kualitas nutrisi hijauan cenderung menurun tajam selama musim kemarau (Salem et al. 2006). Pengawetan merupakan salah satu usaha agar hijauan dapat tersedia sepanjang tahun. Pembuatan silase merupakan salah satu jenis usaha pengawetan yang dapat dilakukan. Silase merupakan pakan ternak yang diawetkan melalui proses fermentasi. Tujuan fermentasi adalah untuk menyimpan dan mempertahankan kualitas pakan agar dapat diberikan pada ternak pada musim kekurangan.
Rumput gajah atau P. purpureum merupakan jenis hijauan yang biasa diberikan pada ternak ruminansia. Pemberian pupuk kandang meningkatkan produksi rumput gajah menjadi 184 ton ha-1 tahun-1 atau dua kali lebih besar dibandingkan dengan penanaman tanpa pemupukan (Balitnak 2006). Surplus produksi rumput gajah dapat dimanfaatkan untuk pembuatan silase. Namun kandungan proteinnya hanya sebesar 10.39% (Sidiq 2013), sehingga perlu adanya penambahan sumber protein lainnya.
Legum merupakan hijauan dengan kandungan protein yang tinggi. Penambahan legum dapat meningkatkan kualitas nutrisi silase rumput gajah. Salah satu jenis legum yang dapat dimanfaatkan adalah A. villosa. Menurut Sidiq (2013) kandungan protein kasar A. villosa sebesar 25.28%. Namun penggunaannya perlu diperhatikan karena adanya kandungan senyawa sekunder, diantaranya tanin. Wina et al. (2005) menyatakan A. villosa merupakan salah satu jenis legum yang dapat dimanfaatkan apabila kandungan nutrisi taninnya dapat diatasi. Sidiq (2013) melaporkan kandungan tanin dalam A. villosa sebesar 28.22%BK. Kandungan tanin dalam A. villosa dapat menurunkan angka kecernaan karena tanin dapat mengikat protein dan karbohidrat. Wulandari (2008) melaporkan kandungan senyawa sekunder dalam A. villosa diantaranya tanin yang dapat menghambat proses degradasi protein pakan sehingga menurunkan kecernaan pakan, dan asam amino non-protein yang diduga bersifat toksik. Bansi (2001) melaporkan penambahan ekstrak A. villosa ke dalam fermentasi in vitro menunjukan terjadinya penghambatan kecernaan bahan kering rumput gajah. Proses ensilase dalam pembuatan silase campuran rumput gajah dan A. villosa diharapkan dapat mengurangi tanin sehingga dapat dimanfaatkan oleh ternak. Kandungan senyawa sekunder dalam silase campuran diharapkan dapat dimanfaatkan untuk mengurangi populasi protozoa dan produksi gas metan. Berdasarkan Hess et al. (2004) peningkatan legum menyebabkan penurunan populasi protozoa ciliata sebesar 50%.
Metode in vitro sebaiknya dilakukan terlebih dahulu sebelum memberikan pakan pada ternak. Hungate (1966) menyatakan terdapat hubungan positif antara kecernaan pakan in vitro dan in vivo sehingga sebelum melakukan uji langsung kepada ternak, uji in vitro dapat dilakukan terlebih dahulu untuk melihat kualitas kecernaan pakan dan pengaruh pakan pada kondisi rumen
2
METODE
Waktu dan Tempat
Penelitian dimulai dari bulan Mei 2013 hingga September 2013. Penelitian dilaksanakan di Laboratorium Mikrobiologi Terapan Pusat Penelitian Bioteknologi LIPI, dan Laboratorium Nutrisi Ternak Perah Fakultas Peternakan Institut Pertanian Bogor.
Bahan
Bahan yang digunakan dalam penelitian ini adalah cairan rumen segar sapi potong yang berasal dari sapi berfistula, plastik kemasan, label, larutan McDougall dengan pH 6.5-6.9, larutan pepsin HCl 0.2%, aquadest, larutan HgCl2
jenuh, larutan Na2CO3 jenuh, larutan H2SO4 0.005 N, asam borat berindikator,
larutan HCl 0.5 N, larutan H2SO4 15%, larutan NaOH 0.5 N, larutan indikator PP
(Phenol Phtalein 0.1%), larutan garam formalin, media 98-5, gas CO2, dan tiga
jenis silase campuran dengan komposisi kimia sebagai berikut : Tabel 1 Komposisi kimia silase campuran P. purpureum dan A. villosa
Silase BK(%) BO PK SK Total tanin Total fenol
%BK
A1 51.22 92.33 17.31 29.63 4.47 7.12
A2 46.08 93.80 20.40 28.34 5.14 8.07
A3 42.43 92.49 21.19 22.41 6.49 9.24
Keterangan : A1 (silase campuran 60% P. purpureum : 40% A. villosa); A2 (silase campuran 50%
P. purpureum: 50% A. villosa); A3 (silase campuran 40% P. purpureum : 60% A. villosa) (Sidiq 2013).
Alat
Peralatan yang digunakan dalam penelitian ini adalah seperangkat alat-alat percobaan fermentasi kecernaan in vitro seperti timbangan digital, erlenmeyer bersumbat karet, shaker incubator, tabung gas CO2, cawan porselen, oven 105 ºC,
tanur listrik 600 ºC, kertas saring Whatman No.41, cawan Conway, labu erlenmeyer, alat-alat destilasi, alat-alat titrasi, counting chamber, tabung Hungate, autoclave, sentrifuse.
Prosedur Penelitian
Pengambilan Cairan Rumen
3 Pembuatan Larutan McDougall sebagai Larutan Buffer
Sebanyak 5 liter air destilasi dimasukkan ke dalam labu takar yang bervolume 6 liter dengan ditambahkan bahan-bahan berikut : 9.8 g NaHCO3,
3.708 g Na2HPO4.7H2O, 0.97 g KCl, 0.47 g NaCl, 0.12 g MgSO4.7H2O, 0.053 g
CaCl2.2H2O, CaCl2.2H2O ditambahkan paling akhir setelah bahan lainnya larut
sempurna. Selanjutnya larutan dialiri dengan gas CO2 perlahan-lahan untuk
menurunkan pH hingga mencapai pH 6.8.
Pencernaan Fermentatif
Percobaan fermentasi in vitro menggunakan metode Tilley dan Terry (1963) dengan menggunakan 0.5 gram sampel, 40 ml larutan buffer, dan 10 ml cairan rumen. Metode dimodifikasi dengan penggunaan erlenmeyer bersumbat karet, serta shaker incubator sebagai pengganti waterbath. Shaker incubator diaturpada suhu 39 ºC kemudian sampel diinkubasi selama 4; 8; 12; 24; 48; 72 jam. Proses fermentasi dihentikan dengan meneteskan larutan HgCl2 jenuh sebanyak 0.01 ml.
Hasil fermentasi dipindahkan dalam tabung corning kemudian disentrifuse pada kecepatan 3000 rpm selama 15 menit. Supernatan diambil untuk analisis konsentrasi NH3 dan VFA, sedangkan residu diambil untuk analisis KCBK dan
KCBO.
Pengukuran Koefisien Cerna Bahan Kering dan Bahan Organik
Koefisien Cerna Bahan Kering (KCBK) dan Bahan Organik (KCBO) diukur dengan metode Tilley dan Terry (1963). Sampel yang telah diinkubasi ditetesi HgCl2 kemudian disentrifuse dengan kecepatan 3500 rpm selama 15 menit.
Supernatan dan endapan dipisahkan, endapan yang terbentuk ditambahkan 50 ml larutan pepsin-HCl. Campuran tersebut diinkubasi selama 48 jam tanpa tutup karet. Setelah 48 jam endapan disaring menggunakan kertas saring nomor 41. Residu dimasukan dalam cawan porselen yang diketahui bobot kosongnya. Bahan kering diperoleh dengan cara mengeringkan sampel pada suhu 105 ºC selama 24 jam. Bahan organik diperoleh dengan cara mengabukan sampel pada suhu 600 ºC selama 2 jam. Blanko merupakan medium tanpa sampel. Larutan pepsin-HCl terdiri dari 2.8 gram pepsin yang dilarutkan dalam 850 ml air suling, kemudian ditambahkan 17.8 HCl pekat, campuran dimasukan dalam labu ukur 1000 ml setelah ditera kemudian larutan dihomogenkan Untuk menentukan KCBK dan KCBO dapat dihitung dengan rumus :
Perhitungan Populasi Bakteri Total
Perhitungan populasi bakteri total menggunakan metode Ogimoto dan Imai (1981). Media tumbuh 98-5 digunakan untuk menghitung populasi bakteri total. Media 98-5 tersebut dipanaskan perlahan-lahan sambil dialiri gas CO2 sampai
4
15 menit, tekanan 1 Atm). Supernatan hasil inkubasi yang telah diencerkan ditambahkan sebanyak 0.1 ml ke dalam tabung hungate, kemudian diratakan menggunakan roller tube. Populasi bakteri dapat dihitung dengan rumus :
Populasi bakteri = n x 10x/0.05 x 0.1 CFU/ml
Keterangan : n = jumlah koloni yang terdapat pada tabung seri pengenceran ke-x ; x = tingkat pengenceran.
Perhitungan Populasi Protozoa
Perhitungan populasi protozoa menggunakan metode Ogimoto dan Imai (1981). Supernatan hasil inkubasi dicampur dengan larutan garam formalin (MFS) dengan rasio 1:1. Sebanyak 0.025 ml sampel diteteskan pada counting chamber (haemacytometer). Protozoa yang dihitung adalah total dari protozoa yang terdapat dalam counting chamber dengan ketebalan 0.1 mm, luas kotak terkecil 0.0625 mm2 yang terdapat 16 kotak dan jumlah kotak yang dibaca sebanyak 5 kotak. Perhitungan populasi protozoa dilakukan dengan menggunakan mikroskop pada pembesaran 40 kali. Larutan MFS terdiri dari 0.6 gram indikator methyl green, 100 ml larutan formalin 35%, dan 0.8 gram NaCl dalam 1000 ml larutan. Populasi protozoa dapat dihitung dengan rumus:
Protozoa ml-1 cairan rumen = 1000 x FP x C 0.1 x 0.0625 x 16 x 5 Keterangan : FP = faktor pengenceran ; C = jumlah protozoa Pengukuran NH3
Konsentrasi NH3 diukur dengan menggunakan metode mikrodifusi conway
(Conway dan O’malley 1942). Bibir dan tutup cawan Conway diolesi dengan vaselin. Sebanyak 1 ml supernatan diambil, dan ditempatkan di salah satu ujung alur cawan Conway. Kemudian 1 ml larutan Na2CO3 jenuh ditempatkan pada
ujung lain cawan Conway yang bersebelahan dengan supernatan (tidak boleh bercampur). Larutan asam borat berindikator warna merah sebanyak 1 ml ditempatkan dalam cawan kecil yang terletak di tengah cawan Conway. Cawan Conway lalu ditutup rapat hingga kedap udara, larutan Na2CO3 dicampur dengan
supernatan hingga merata dengan cara menggoyang-goyangkan cawan. Setelah itu cawan dibiarkan dalam suhu kamar selama 24 jam. Tutup cawan dibuka, asam borat berindikator dititrasi dengan larutan H2SO4 0.005 N sampai terjadi
perubahan warna dari biru menjadi merah. Konsentrasi NH3 dihitung berdasarkan
rumus berikut :
Pengukuran Konsentrasi VFA dan Estimasi Produksi Metan
Pengukuran kosentrasi VFA total Konsentrasi VFA diukur dengan menggunakan teknik destilasi uap (General Laboratory Procedure … 1966). Supernatan yang sama dengan analisa NH3 diambil sebanyak 5 ml, dan
dimasukkan ke dalam tabung destilasi. Larutan H2SO4 15% ditambahkan
5 labu penyulingan yang berisi air mendidih (dipanaskan terus selama destilasi). Uap air panas akan mendesak VFA yang akan terkondensasi dalam pendingin. Cairan yang terbentuk ditampung dalam labu Erlenmeyer yang berisi 5 ml NaOH 0.5 N sampai mencapai 250 ml. Indikator PP ditambahkan sebanyak 2 tetes dan dititrasi dengan HCl 0.5 N sampai warna titrat berubah dari merah jambu menjadi merah muda seulas. Rumus berikut digunakan untuk menghitung konsentrasi VFA :
Keterangan : a=volume titran blangko; b = volume titran contoh
Pengukuran VFA parsial Analisa konsentrasi VFA parsial dilakukan dengan teknik kromatografi gas. Cairan rumen yang diambil disentrifus dengan kecepatan 10.000 rpm selama 15 menit untuk diambil supernatannya. Sebanyak 2 ml supernatan dipipet ke dalam tabung plastik kecil yang bertutup lalu ditambahkan 30 mg asam sulfosalisilat (C6H3(OH)SO3H.2H2O) lalu dikocok kemudian
disentrifus dengan kecepatan 3.000 rpm selama 10 menit dalam suhu 4 ºC lalu disaring dengan millipore. Sebanyak 1 ml hasil saringan diinjeksikan ke kromatografi gas. Sebelum itu larutan VFA standar diinjeksi terlebih dahulu. Konsentrasi VFA parsial diukur dengan menggunakan sampel yang telah dikomposit. Perhitungan konsentrasi dalam sampel dilakukan dengan rumus :
B
Perhitungan produksi metan Produksi gas metan dapat dihitung dengan pendekatan stoikiometri proporsi VFA parsial. Menurut Moss et al. (2000) produksi metan dapat dihitung melalui persamaan:
CH4 = 0.45C2– 0.275C3 + 0.40C4
6
berfistula digunakan sebagai ulangan atau kelompok. Model matematika yang digunakan adalah sebagai berikut :
Yijk= μ + τi+ αj + ßk+ αjßk+ εijk
Keterangan :
Yijk = nilai pengamatan kelompok ke-i, perlakuan ke-j dan waktu inkubasi ke-k
μ = nilai rataan umum
τi = pengaruh kelompok (cairan rumen) ke-i
αj = pengaruh perlakuan perbedaan proporsi silase campuran ke-j
ßk = pengaruh perlakuan waktu inkubasi ke-k
αjßk = pengaruh interaksi
εijk = galat percobaan untuk kelompok ke-i, perbedaan proporsi silase campuran
ke-j dan pengaruh perlakuan waktu inkubasi ke-k Analisis Data
Data yang diperoleh dianalisis dengan menggunakan sidik ragam (ANOVA) dan untuk mengetahui perbedaan antara perlakuan diuji dengan uji jarak berganda Duncan (Steel dan Torrie 1993). Instrumen pengolahan data penelitian yang digunakan adalah Microsoft Excel dan SPSS
HASIL DAN PEMBAHASAN
Kecernaan
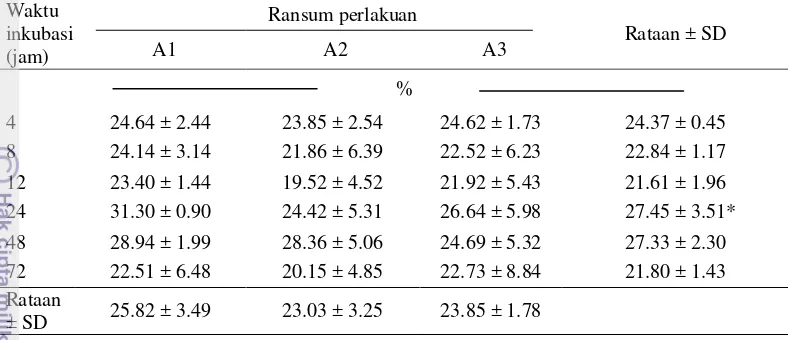
Tidak terdapat interaksi antara perlakuan perbedaan proporsi rumput dan legum dengan perbedaan waktu inkubasi (Tabel 2). Rataan KCBK tidak dipengaruhi oleh perbedaan proporsi antara P. purpureum dan A. villosa, namun perbedaan waktu inkubasi memiliki pengaruh signifikan terhadap rataan KCBK (P<0.05) pada kurva berbentuk kubik (Gambar 1).
7 Tabel 2 Pengaruh perlakuan perbedaan proporsi P. purpureum dan A. villosa
dalam silase campuran terhadap rataan nilai KCBK pada waktu inkubasi yang berbeda
Keterangan : A1 (silase campuran 60% P. purpureum : 40% A. villosa); A2 (silase campuran 50%
P. purpureum: 50% A. villosa); A3(silase campuran 40% P. purpureum : 60% A. villosa). *P value
menunjukkan pengaruh perlakuan waktu (P<0.05).
Tabel 3 Pengaruh perlakuan perbedaan proporsi P. purpureum dan A. villosa dalam silase campuran terhadap rataan nilai KCBO pada waktu inkubasi yang berbeda
Keterangan : A1 (silase campuran 60% P. purpureum : 40% A. villosa); A2 (silase campuran 50%
P. purpureum: 50% A. villosa); A3 (silase campuran 40% P. purpureum : 60% A. villosa). Angka-angka pada baris yang sama yang diikuti oleh huruf kecil yang berbeda menunjukkan berbeda nyata pada taraf uji 5% (uji selang berganda duncan).
8
Wiryawan et al. (2001) melaporkan bahwa kecernaan bahan kering secara in vitro dari domba yang tidak diadaptasi dan diberi A. villosa berkisar antara 19.48% sedangkan kecernaan bahan organiknya 19.18%, rendahnya kecernaan secara in vitro diakibatkan tingkat resistensi mikroba rumen terhadap toksik senyawa kimia sekunder berupa fenol. Hasil dalam penelitian ini menunjukan nilai KCBK dan KCBO yang lebih tinggi, hal ini mungkin karena adanya proses ensilase. Hal ini sesuai dengan hasil yang dilaporkan oleh Wina et al. (2005) proses pengasaman menurunkan konsentrasi fenol dan tanin A. villosa.
Surono et al. (2003) melaporkan nilai KCBK dan KCBO silase rumput gajah sebesar 48.55% dan 47.45%. Peningkatan level A. villosa memiliki kecenderungan menurunkan nilai rataan kecernaan, rataan total VFA (Tabel 7), dan rataan NH3 (Tabel 6), hal ini disebabkan oleh adanya peningkatan kadar tanin
dalam silase campuran. Tanin akan membentuk kompleks dengan protein maupun karbohidrat sehingga menurunkan degradasi bahan kering. Tingginya konsentrasi tanin dalam A. villosa dibandingkan dengan Calliandra caloythyrsus dan Leucaena leucocephala menghambat fermentasi protein dan karbohidrat oleh mikroba rumen, hal ini terlihat pada rendahnya nilai KCBK dan KCBO (Wiryawan et al. 2001). Sutardi (1979) menyatakan setiap sumber protein pakan memiliki kelarutan dan ketahanan terhadap degradasi mikroba yang berbeda – beda sehingga mengakibatkan perbedaan kecernaan dalam rumen.
Total Protozoa
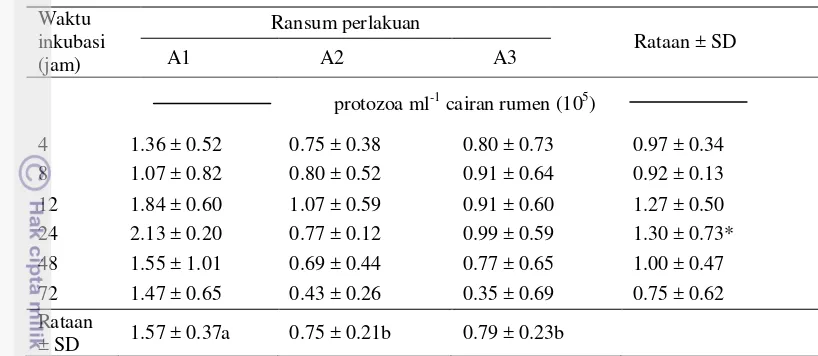
Hasil penelitian menunjukkan total protozoa berada pada kisaran 105 ml-1 cairan rumen, menurut Theodorou dan France (2005) populasi protozoa dalam rumen antara 105-106 ml-1 cairan rumen. Rataan protozoa total dipengaruhi oleh perlakuan perbedaan proporsi antara P. purpureum dan A. villosa (P<0.05) (Tabel 4). Waktu fermentasi memiliki pengaruh signifikan terhadap populasi total protozoa (P<0.05) pada kurva berbentuk kuadratik (Gambar 2).
9 Tabel 4 Pengaruh perlakuan perbedaan proporsi P. purpureum dan A. villosa
dalam silase campuran terhadap rataan total protozoa pada waktu inkubasi yang berbeda
Keterangan : A1 (silase campuran 60% P. purpureum : 40% A. villosa); A2 (silase campuran 50%
P. purpureum: 50% A. villosa); A3(silase campuran 40% P. purpureum : 60% A. villosa). Angka-angka pada baris yang sama yang diikuti oleh huruf kecil yang berbeda menunjukkan berbeda nyata pada taraf uji 5% (uji selang berganda duncan). *P value menunjukkan pengaruh perbedaan waktu inkubasi (P<0.005).
Hasil menunjukkan peningkatan level A. villosa lebih dari 40% dalam silase campuran dapat menurunkan jumlah total protozoa. Kandungan saponin dalam akasia berfungsi sebagai agen defaunasi karena dapat mempengaruhi aktivitas protozoa dalam rumen (Wina dan Tangendjaja 2000). Protozoa dalam rumen memiliki peranan dalam pembentukan metan serta penurunan jumlah total bakteri dalam rumen, oleh karena itu jumlah protozoa dalam rumen perlu ditekan. Terlihat pada hasil perhitungan total bakteri (Tabel 5) pada perlakuan A3 jumlah bakteri lebih tinggi dibandingkan perlakuan A1, berbanding terbalik dengan jumlah total protozoa pada perlakuan yang sama. Kamra (2005) menyatakan akan terjadi peningkatan yang signifikan pada jumlah bakteri dalam cairan rumen ketika protozoa didefaunasi. Sajati et al. (2012) mengurangi populasi protozoa berarti memberikan kesempatan bakteri untuk berkembang lebih baik. Keberadaan protozoa dalam rumen tidak selalu diartikan buruk, Kamra (2005) melaporkan apabila protozoa dalam rumen ditekan akan memberikan efek baik berupa berkurangnya metanogenesis dan juga memberikan efek buruk yaitu terganggunya pH rumen.
Total Bakteri
10
dengan sel bakteri atau secara tidak langsung dengan menurunkan ketersediaan protein dan sulfur untuk mikroba.
Tabel 5 Pengaruh perlakuan perbedaan proporsi P. purpureum dan A. villosa dalam silase campuran terhadap rataan populasi bakteri total pada waktu inkubasi yang berbeda
Keterangan : A1 (silase campuran 60% P. purpureum : 40% A. villosa); A2 (silase campuran 50%
P. purpureum: 50% A. villosa); A3(silase campuran 40% P. purpureum : 60% A. villosa). Angka-angka pada baris yang sama yang diikuti oleh huruf kecil yang berbeda menunjukkan berbeda nyata pada taraf uji 5% (uji selang berganda duncan).
Rataan bakteri total dipengaruhi oleh perlakuan perbedaan proporsi antara P. purpureum dan A. villosa (P<0.05), sedangkan waktu inkubasi tidak memiliki pengaruh signifikan terhadap populasi total bakteri (Tabel 5). Waktu inkubasi tidak memberikan pengaruh signifikan terhadap jumlah bakteri total namun memiliki kecenderungan meningkat pada waktu inkubasi ke-12 jam kemudian menurun kembali. Penurunan antara lain diakibatkan oleh penurunan ketersediaan nutrisi untuk pembentukan tubuh mikroba. Terjadi penekanan populasi protozoa dengan adanya peningkatan proporsi A. villosa dalam silase campuran (Tabel 4), hal ini mungkin menyebabkan populasi bakteri total dalam penelitian ini meningkat sejalan dengan meningkatnya proporsi A. villosa dalam silase campuran.
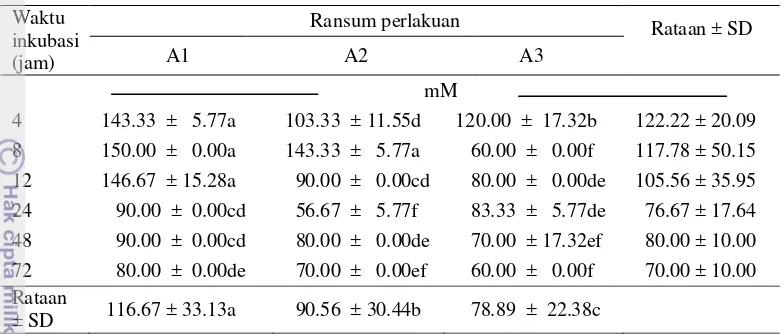
Konsentrasi NH3
Rataan NH3 tidak dipengaruhi oleh perlakuan perbedaan proporsi antara P.
purpureum dan A. villosa (Tabel 6), namun perlakuan waktu fermentasi memiliki pengaruh signifikan terhadap rataan NH3 (P<0.05) pada kurva berbentuk
kuadratik (Gambar 3). Konsentrasi NH3 tertinggi berada pada waktu inkubasi ke-
24 jam, pada waktu yang sama konsentrasi VFA total berada pada konsentrasi yang rendah (Tabel 7). Populasi bakteri mencapai puncak pada waktu inkubasi ke- 12 jam (Tabel 5). Hasil penelitian ini mungkin menunjukkan sintesis protein mikroba berjalan dengan baik pada waktu inkubasi kurang dari 24 jam. Ammonia (NH3) merupakan hasil degradasi protein kasar dan deaminasi asam amino oleh
11 untuk sintesis mikroba rumen adalah 6–21 mM. Konsentrasi NH3 yang terbentuk
dalam rumen dapat terpengaruh oleh kandungan metabolit sekunder seperti tanin. Kandungan tanin dalam bahan pakan akan membentuk suatu komplek yang stabil dengan protein sehingga sulit untuk didegradasi, hal ini dapat menyebabkan berkurangnya konsentrasi NH3 yang terbentuk.
Tabel 6 Pengaruh perlakuan perbedaan proporsi P. purpureum dan A. villosa dalam silase campuran terhadap rataan konsentrasi NH3 pada waktu
inkubasi yang berbeda
Waktu inkubasi (jam)
Ransum perlakuan Rataan ± SD
A1 A2 A3
Keterangan : A1 (silase campuran 60% P. purpureum : 40% A. villosa); A2 (silase campuran 50%
P. purpureum: 50% A. villosa); A3(silase campuran 40% P. purpureum : 60% A. villosa). Tanda bintang menunjukan signifikasi pada taraf 5% (Uji polinomial). *P value menunjukkan pengaruh perbedaan waktu inkubasi (P<0.005).
Kecenderungan dari hasil menunjukkan konsentrasi NH3 yang rendah.
Syahrir et al. (2009) menyatakan konsentrasi NH3 yang rendah dalam cairan
rumen dapat mencerminkan proses fermentasi yang berjalan baik sehingga ammonia dimanfaatkan dengan baik, protein ransum sulit terdegradasi atau
12
protein ransum rendah. Kandungan protein dalam silase campuran berkisar antara 17 – 21%BK rendahnya konsentrasi NH3 dalam penelitian ini mencerminkan
proses fermentasi berjalan baik atau protein ransum sulit dicerna dalam rumen. Rendahnya nilai NH3 dapat disebabkan oleh kandungan tanin dalam A.
villosa, hal ini sesuai dengan penelitian Jayanegara dan Palupi (2010) bahwa peningkatan level tanin terkondensasi menurunkan produksi NH3. Menurut Frutos
et al. (2004) tanin akan mempengaruhi degradasi protein dalam rumen. Tanin dalam A. villosa mengikat protein sehingga dapat meningkatkan protein by pass, penurunan degradasi protein dalam rumen akan menurunkan produksi NH3 namun
meningkatkan protein non ammonia ke duodenum (Frutos et al. 2004). Wiryawan et al. (2001)melaporkan dari perlakuan A. villosa yang memiliki kandungan tanin lebih tinggi dibandingkan dengan perlakuan C. caloythyrsus dan L. leucocephala menghasilkan rataan konsentrasi NH3 yang lebih rendah.
Rataan NH3 berada pada rentang 0.86–3.28 mM, nilai ini lebih rendah bila
dibandingkan dengan penelitian Triyani (2002) sebesar 6.43 mM. Perbedaan hasil dapat disebabkan oleh berbedanya cairan rumen yang dipakai, pada penelitian tersebut digunakan cairan rumen domba yang telah diadaptasi. Perbedaan ini sesuai dengan pernyataan Ismartoyo (2011) bahwa spesies yang yang berbeda akan menghasilkan degradasi pakan yang berbeda. Hakim (2002) menyatakan perbedaan konsentrasi NH3 pada cairan rumen sapi, kerbau, kambing, dan domba
yang mungkin disebabkan karena adanya perbedaan pakan sebelum perlakuan. Hartati (2002) menyatakan ternak domba yang terbiasa memakan berbagai jenis legum lebih toleran terhadap zat antinutrisi seperti tanin dalam A. villosa. Hal ini mengindikasikan bahwa proses adaptasi pada ternak akan mempengaruhi kemampuan rumen untuk mendegradasi pakan.
Konsentrasi VFA dan Estimasi Produksi Metan
13 Tabel 7 Pengaruh perlakuan perbedaan proporsi P. purpureum dan A. villosa
dalam silase campuran terhadap rataan konsentrasi total VFA pada waktu inkubasi yang berbeda
Waktu inkubasi (jam)
Ransum perlakuan Rataan ± SD
A1 A2 A3
Keterangan : A1 (silase campuran 60% P. purpureum : 40% A. villosa); A2 (silase campuran 50%
P. purpureum: 50% A. villosa); A3(silase campuran 40% P. purpureum : 60% A. villosa). Angka-angka pada baris yang sama yang diikuti oleh huruf kecil yang berbeda menunjukkan berbeda nyata pada taraf uji 5% (uji selang berganda duncan).
Efisiensi penggunaan ammonia tercermin pada perlakuan A1, hal ini ditunjukkan dengan lebih rendahnya konsentrasi ammonia yang dihasilkan dan lebih tingginya konsentrasi VFA total. Hasil ini memiliki kecenderungan yang sama dengan hasil penelitian Syahrir et al. (2009) tingginya VFA dan rendahnya konsentrasi ammonia pada penambahan murbei 37.5% menunjukkan efisiensi penggunaan ammonia untuk sintesis mikroba. Tingginya konsentrasi VFA bersamaan dengan rendahnya konsentrasi NH3 dan tingginya populasi bakteri
menunjukkan efisiensi penggunaan pakan untuk sintesis mikroba.
Perlakuan waktu menunjukkan nilai rataan total VFA yang berbeda pada perlakuan A3 rataan total VFA tertinggi terdapat pada waktu fermentasi ke- 4 jam, perlakuan A2 terjadi kenaikan rataan total VFA pada waktu fermentasi ke- 4 dan ke– 8 jam kemudian menurun kembali, sedangkan pada perlakuan A1 terdapat kenaikan nilai rataan total VFA pada waktu fermentasi ke- 4, ke- 8, dan ke- 12 jam kemudian menurun kembali. Menurut Hungate (1966) VFA naik pada jam ke- 4 sampai ke- 5, sedangkan berdasarkan Askar dan Abdurachman (2002) nilai VFA dari jam ke- 4 sampai dengan ke- 8 kemudian turun kembali. Perbedaan rataan konsentrasi VFA mungkin disebabkan oleh perbedaan perlakuan pakan yang diberikan. Tingginya konsentrasi VFA menunjukkan degradasi pakan oleh bakteri, dan sintesis protein mikroba berjalan dengan baik. Hasil ini ditandai dengan rendahnya NH3 yang terukur saat konsentrasi VFA mencapai puncak
produksi.
Hasil analisis VFA parsial menunjukkan terdapat kecenderungan perbedaan antara perlakuan dengan bertambahnya level A. villosa. Jumlah asetat (C2) dan
butirat (C4) yang diproduksi berkurang, produksi propionat (C3) meningkat (Tabel
8), dan metan (CH4) yang terbentuk berkurang (Gambar 4). Ratio asetat :
14
memiliki efek positif dalam meningkatkan propionat. Kim et al. (2012) menyatakan penambahan legum yang mengandung antibakterial mengubah pola fermentasi rumen ke arah pembentukan propionat.
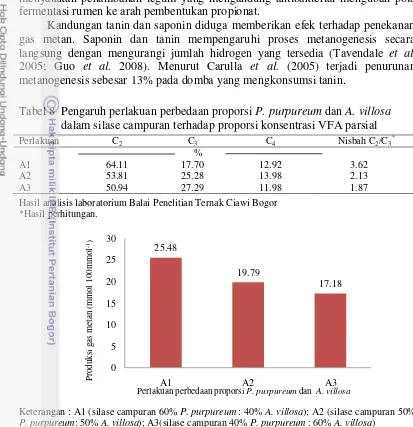
Kandungan tanin dan saponin diduga memberikan efek terhadap penekanan gas metan. Saponin dan tanin mempengaruhi proses metanogenesis secara langsung dengan mengurangi jumlah hidrogen yang tersedia (Tavendale et al. 2005; Guo et al. 2008). Menurut Carulla et al. (2005) terjadi penurunan metanogenesis sebesar 13% pada domba yang mengkonsumsi tanin.
Tabel 8 Pengaruh perlakuan perbedaan proporsi P. purpureum dan A. villosa dalam silase campuran terhadap proporsi konsentrasi VFA parsial
Perlakuan C2 C3 C4 Nisbah C2/C3*
%
A1 64.11 17.70 12.92 3.62
A2 53.81 25.28 13.98 2.13
A3 50.94 27.29 11.98 1.87
Hasil analisis laboratorium Balai Penelitian Ternak Ciawi Bogor *Hasil perhitungan.
Keterangan : A1 (silase campuran 60% P. purpureum : 40% A. villosa); A2 (silase campuran 50%
P. purpureum: 50% A. villosa); A3(silase campuran 40% P. purpureum : 60% A. villosa)
Gambar 4 Produksi metan hasil perhitungan dari perlakuan pemberian silase campuran antara P. purpureum dan A. villosa pada proporsi yang berbeda secara in vitro.
Hungate (1966) menyatakan terbentuknya asetat dan butirat pada proses fermentasi akan disertai terbentuknya metan yang relatif tinggi, tetapi terbentuknya propionat akan menurunkan produksi metan. Hasil penelitian menunjukkan hasil yang sama dengan pernyataan tersebut, peningkatan level A. villosa menurunkan produksi asetat, dan butirat, meningkatkan produksi propionat serta menekan produksi metan. Penurunan produksi metan karena perlakuan level A. villosa juga dapat diamati melalui menurunnya jumlah total protozoa (Tabel 4). Sajati et al. (2012) menyatakan penurunan produksi gas metan juga disebabkan oleh penurunan jumlah protozoa. Metanogen dalam rumen bersimbiosis dengan protozoa, menurut Newbold et al. (1995) simbiosis protozoa dengan metanogen
15 menghasilkan 9-25% metanogenesis dalam rumen. Proses defaunasi mengurangi jumlah hidrogen yang merupakan prekursor pembentukan CH4 (Hook et al. 2010).
SIMPULAN DAN SARAN
Simpulan
Perlakuan A1 yaitu penambahan A. villosa sebesar 40% dalam silase campuran menghasilkan nilai kecernaan dan VFA total terbaik tetapi menghasilkan gas metan yang lebih tinggi.
Saran
Perlu dilakukannya penelitian lanjutan untuk menguji kecernaan silase campuran P. purpureum dan A. villosa dengan level penambahan A. villosa lebih rendah untuk mengkaji nilai kecernaannya.
DAFTAR PUSTAKA
Askar S, Abdurachman. 2002. Pengaruh zink methionina ke dalam simulasi rumen secara in vitro terhadap produksi asam lemak atsiri. Bul Tek Pertan. 7(2):69-72.
[Balitnak] Balai Penelitian Ternak. 2006. Kotoran Kambing dan Domba pun Bernilai Ekonomis [Internet]. Bogor (ID): Puslitbang Deptan. [2013 Mei 05]. Tersedia pada : http://pustaka.litbang.deptan.go.id.
Bansi H. 2001. Potensi lamtoro merah (Acacia villosa) dan kaliandara putih (Calliandra tetragona) sebagai pakan sumber protein baru bagi ternak ruminansia [Skripsi]. Bogor (ID): Institut Pertanian Bogor.
Carulla JE, Kreuzer M, Machmuller A, Hess HD. 2005. Supplementation of Acacia mearnsii tannis decrease methanogenesis and urinary nitrogen in forage-fed sheep. Aus J Agric Res. 56:961-970
Conway EJ, O'Malley E. 1942. Microdiffusion methods: Ammonia and Urea Using Buffered Absorbents (revised methods for ranges than 10 μg N), Biochem J. 36:655-661.
Durmic Z, Blache D. 2012. Bioactive plant and plant products: Effects on animal function, health, welfare. J Anim Sci. 176:150-162
France J, Dijkstra J. 2005. Volatille Fatty Acid Production. In: J Dijkstra, JM Forbes and J France (Eds). Quantitative Aspect for Ruminant Digestion and Metabolism. Ed ke-2. London (GB): CABI Publishing.
Frutos P, Hervas G, Giraldez FJ, Mantecon AR. 2004. Review tannins and ruminant nutrition. Span J Agric Res. 2(2):191-202.
16
Guo YQ, Liu JX, Lu Y, Zhu WY, Denman SE, McSweeney CS. 2008. Effect of tea saponin on methanogenesis, microbial community structure and expression of mcrA gene, in cultures of rumen micro-organism. Lett App Microbiol. 47:421-426
Hakim RS. 2002. Evaluasi in vitro respons mikroba rumen ruminansia terhadap penambahan DABA (2,4-diaminobutyricacid) dan lamtoro merah (Acacia villosa) [Skripsi]. Bogor (ID): Institut Pertanian Bogor
Hartati E. 2002. Evaluasi in vitro ketahanan mikroba rumen domba yang berbeda masa adaptasinya pada Acacia villosa terhadap penambahan DABA (2,4-diaminobutyric acid) [Skripsi]. Bogor (ID): Institut Pertanian Bogor.
Hess HD, Beuret RA, Lotsscher M, Hindrichsen K, Machmuller A, Carulla JE, Lascano CE, Kreuzer M. 2004. Ruminal fermentation, methanogenesis and nitrogen utilization of sheep receiving tropical grass hay-concentrate diets offered with Sapindus saponaria fruits and Cratylia argentea foliage. J Anim Sci. 79:177-189.
Hook SE, Wright AG, Mcbridge AW. 2010. Methanogens: Methane producers of the rumen and mitigation strategies. Hind Pub Corp. 2010:1-11. doi: 10.1155/2010/945785
Hungate RE. 1966. The Ruminant and Its Microbes. New York (USA): Academic Pr.
Ismartoyo. 2011. Ilmu Nutrisi. Makassar (ID): Universitas Hasanuddin.
Jayanegara A, Palupi E. 2010. Condensed tannin effects on nitrogen digestion in ruminants: A meta-analysis from in vitro and in vivo studies. Med Pet. 33(3):176-181.
Kamra DN. 2005. Rumen microbial ecosystem. Ind Vet Res Ins. 89(1):124–135. Kim ET, Kim CH, Min KS, Lee SS. 2012. Effects of plant extract on microbial
population, methane emission and ruminal fermentation characteristic in in vitro. J Anim Sci. 25(6):806-811
Kumar K. 2011. Role of tannins on animal performance : An overview. J Natur Remed. 11(2):82-89.
McDonald P, Edwards RA, Greenhalgh JFD, Morgan CA. 2002. Animal Nutrition. Ed ke-6. New York (USA): Ashford Colour Pr.
Moss AR, Jouany JP, Newbold J. 2000. Methane production by ruminants: its contribution to global warming. Ann Zoo Tech. 49:231-253.
Newbold CJ, Lassalas B, Jouany JP. 1995. The importance of methanogens associated with ciliate protozoa in ruminal methane production in vitro. Lett App Microbiol. 21:230-234.
Ogimoto K, Imai S. 1981. Atlas of Rumen Microbiology. Tokyo (JP): Scientific Societies Pr.
Sajati G, Prasetyo BWHE, Surono. 2012. Pengaruh ekstruksi dan proteksi dengan tanin pada tepung kedelai terhadap gas total dan metan secara in vitro. Anim Agric J. 1(1):241 – 256.
17 Syahrir S, Wiryawan KG, Parakkasi A, Winugroho M, Sari ONP. 2009.
Efektivitas daun murbei sebagai pengganti konsentrat dalam sistem rumen in vitro. Med Pet. 32(2):112-119.
Schofield P, Mbugua DM, Pell AN. 2001. Analysis of condensed tannins: a review. Anim Feed Sci Technol. 91:21-40.
Sidiq F. 2013. Pengaruh taraf inklusi legume Acacia villosa terhadap kualitas silase gabungan rumput legume yang diberi aditif berupa Lactobacillus plantarum dan dedak padi [Skripsi]. Bogor (ID): Institut Pertanian Bogor. Steel RGD, Torrie JH. 1993. Prinsip dan Prosedur Statistika: Suatu Pendekatan
Biometrik. Sumantri B, penerjemah. Jakarta (ID): Gramedia. Terjemahan dari: Principles and Procedures of Statistics.
Surono, Soejono M, Budhi SPS. 2003. Kecernaan bahan kering dan bahan organik in vitro silase rumput gajah pada umur potong dan level aditif uang berbeda. J Indon Trop Anim Agric. 28(4):204-210.
Sutardi T. 1979. Ketahanan protein bahan makanan terhadap degradasi oleh mikroba rumen dan manfaatnya bagi produktivitas ternak. Proceeding Seminar dan Penunjang Peternakan. Bogor (ID): Lembaga Penelitian Peternakan. Tavendale MH, Meagher LP, Pacheco D, Walker N, Attwood GT, Sivakumaran
S. 2005. Methane production from in vitro rumen incubations with Lotus pedunculatus and Medicago sativa and effects of extractable condensed tannin fractions on methanogenesis. J Anim Sci Feed Technol. 123:403-419.
Theodorou MK, France J. 2005. Rumen Microorganism and their Interactions. In : Dijkstra J, Forbes JM, France F (Eds). Quantitative Aspect for Ruminant Digestion and Metabolism. Ed ke-2. London (GB): CABI Publishing.
Tilley JMA, Terry RA. 1963. A two stage technique for in vitro digestion of forage crops. J Br Grassl Soc. 18:104-111
Tillman AD, Hartadi H, Reksohadiprodjo S, Prawirokusumo S, Lebdosoekojo S. 1991. Ilmu Makanan Ternak Dasar. Jogjakarta (ID): Gadjah Mada Univ Pr Triyani Y. 2002. Isolasi bakteri rumen domba pencerna legum akasia (Acacia
villosa dan Acacia angustissima) [Skripsi]. Bogor (ID): Institut Pertanian Bogor.
Waldron MR, Schrick FN, Quigley JD, Klotz AM, Saxton, Heitmann RN. 2002. Volatile fatty acid metabolism by epithelial cells isolated from different areas of the ewe rumen. J Anim Sci. 80:270-278.
Wina E, Tangendjaja B. 2000. Kemungkinan adanya senyawa racun dalam Acacia villosa. Bul Pet Univ Gadjah Mada. 24(1):34-42.
Wina E, Tangendjaja B, Susana IWR. 2005. Effect of chopping, and soaking in water, hydrochloric acidic and calcium hydroxide solutions on the nutritional value of Acacia villosa for goats. Anim Feed Sci Technol. 122:79-92.
Wiryawan KG, Suryahadi, Anita ST. 2001. In vitro degradation of Acacia villosa by ruminal microbes of adapted and non-adapted sheep to Acacia Feeding. J Pet Ling. 9(2):40-45.
18
Lampiran 1 Hasil sidik ragam (ANOVA) nilai KCBK
Sumber Jumlah kuadrat tipe
III Db Rataan kuadrat F hitung Signifikansi
Model Terkoreksi 488.518a 19 25.711 1.065 0.424
Total terkoreksi 1309.515 53
Keterangan : hasil sidik ragam (ANOVA) dianalisis menggunakan software SPSS 16; Db : derajat bebas, a : R square = 0.373.
Lampiran 2 Hasil uji lanjut kontras polinomial parameter KCBK
Kontras polinomial Signifikansi
Keterangan : hasil uji lanjut kontras polinomial menggunakan software SPSS 16
Lampiran 3 Hasil sidik ragam (ANOVA) nilai KCBO
Sumber Jumlah kuadrat tipe
III Db Rataan kuadrat F hitung Signifikansi
Model Terkoreksi 776.655a 19 40.877 1.382 0.200
Total terkoreksi 1782.100 53
Keterangan : hasil sidik ragam (ANOVA) dianalisis menggunakan software SPSS 16; Db : derajat bebas, a : R square = 0.436.
Lampiran 4 Hasil uji jarak berganda Duncan parameter KCBO
A Jumlah Subset
1 2
2 18 23.0167
3 18 25.3700 25.3700
1 18 28.4067
19 Lampiran 5 Hasil sidik ragam (ANOVA) protozoa total
Sumber Jumlah kuadrat tipe
III Db
Rataan
kuadrat F hitung Signifikansi
Model Terkoreksi 18.771a 19 0.988 7.858 0.000
Intersep 57.908 1 57.908 460.612 0.000
Taraf leguminosa (A) 7.691 2 3.846 30.589 0.000
Waktu Inkubasi (B) 2.029 5 0.406 3.228 0.017
Ulangan 7.561 2 3.781 30.072 0.000
A * B 1.489 10 0.149 1.184 0.335
Galat 4.274 34 0.126
Total 80.954 54
Total terkoreksi 23.045 53
Keterangan : hasil sidik ragam (ANOVA) dianalisis menggunakan software SPSS 16; Db : derajat bebas, a : R square = 0.815.
Lampiran 6 Hasil uji jarak berganda Duncan parameter protozoa
A Jumlah Subset
1 2
2 18 0.7511
3 18 0.7867
1 18 1.5689
Keterangan : hasil uji jarak berganda Duncan menggunakan software SPSS 16
Lampiran 7 Hasil uji lanjut kontras polinomial parameter protozoa
Kontras polinomial Signifikansi
Linear 0.118
Kuadratik 0.002
Kubik 0.270
Order 4 0.097
Order 5 0.851
20
Lampiran 8 Hasil sidik ragam (ANOVA) bakteri total
Sumber Jumlah kuadrat tipe
III Db
Rataan
kuadrat F hitung Signifikansi
Model Terkoreksi 83.616a 19 4.401 1.604 0.112
Intersep 1977.019 1 1977.019 720.592 0.000
Taraf leguminosa (A) 23.951 2 11.976 4.365 0.021
Waktu Inkubasi (B) 25.152 5 5.030 1.834 0.133
Ulangan 21.979 2 10.989 4.005 0.027
A * B 12.534 10 1.253 0.457 0.906
Galat 93.283 34 2.744
Total 2153.918 54
Total terkoreksi 176.899 53
Keterangan : hasil sidik ragam (ANOVA) dianalisis menggunakan software SPSS 16; Db : derajat bebas; a : R square = 0.473
Lampiran 9 Hasil uji jarak berganda Duncan parameter bakteri total
A Jumlah Subset
1 2
1 18 5.4956
2 18 5.6694
3 18 6.9872
Keterangan : hasil uji jarak berganda Duncan menggunakan software SPSS 16
Lampiran 10 Hasil sidik ragam (ANOVA) konsentrasi amonia
Sumber Jumlah kuadrat tipe III Db Rataan
kuadrat F hitung Signifikansi
Model Terkoreksi 26.779a 19 1.0409 2.796 0.004
Intersep 230.847 1 230.847 457.974 0.000
Taraf leguminosa (A) 2.339 2 1.170 2.321 0.114
Waktu Inkubasi (B) 18.581 5 3.716 7.372 0.000
Ulangan 2.085 2 1.042 2.068 0.142
A * B 3.774 10 0.377 0.749 0.675
Galat 17.138 34 0.504
Total 274.764 54
Total terkoreksi 43.917 53
21 Lampiran 11 Hasil uji lanjut kontras polinomial parameter konsentrasi NH3
Kontras polinomial Signifikansi
Linear 0.160
Kuadratik 0.000
Kubik 0.916
Order 4 0.016
Order 5 0.331
Keterangan : hasil uji lanjut kontras polinomial menggunakan software SPSS 16
Lampiran 12 Hasil sidik ragam (ANOVA) konsentrasi VFA total
Sumber Jumlah kuadrat tipe
III Db Rataan kuadrat F hitung Signifikansi
Model Terkoreksi 51635.185a 19 2717.641 48.443 0.000
Intersep 491157.407 1 491157.407 8.755E3 0.000
Taraf leguminosa (A) 13470.370 2 6735.185 120.056 0.000
Waktu Inkubasi (B) 23009.259 5 4601.852 82.029 0.000
Ulangan 292.593 2 146.296 2.608 0.088
A * B 14862.963 10 1486.296 26.494 0.000
Galat 1907.407 34 56.100
Total 544700.000 54
Total terkoreksi 53542.593 53
22
Lampiran 13 Hasil uji jarak berganda Duncan interaksi parameter VFA total
Perlakuan Jumlah
Subset
1 2 3 4 5 6
10 3 56.6667
14 3 60.0000
18 3 60.0000
12 3 70.0000 70.0000
17 3 70.0000 70.0000
6 3 80.0000 80.0000
11 3 80.0000 80.0000
15 3 80.0000 80.0000
16 3 83.3333 83.3333
4 3 90.0000 90.0000
5 3 90.0000 90.0000
9 3 90.0000 90.0000
7 3 103.3300
13 3 120.0000
1 3 143.3300
8 3 143.3300
3 3 146.6700
2 3 150.0000
Keterangan : hasil uji lanjut kontras polinomial menggunakan software SPSS 16
Lampiran 14 Hasil analisis VFA parsial
Sampel*
C2 C3 i-C4 C4 i-C5 C5 Total
M
A1 1.34 0.37 0.02 0.27 0.04 0.05 2.09
A2 3.81 1.79 0.1 0.99 0.17 0.22 7.08
A3 13.27 7.11 0.48 3.12 0.84 1.23 26.05
23
RIWAYAT HIDUP
Penulis dilahirkan di Bandung, Jawa Barat pada tanggal 29 Juni 1990. Penulis merupakan anak kedua dari tiga bersaudara dari pasangan Bapak Agus Palilu dan Ibu Rosmeini. Penulis menempuh pendidikan dasar di SD Negeri Sukadamai 3 Bogor pada tahun 1996-2002. Pendidikan dilanjutkan di SMP Negeri 4 Bogor hingga tahun 2005 dan tingkat menengah atas dilanjutkan di Sekolah Menengah Analis Kimia Bogor.
Penulis diterima di IPB pada tahun 2009 melalui jalur Ujian Talenta Mandiri IPB (UTMI). Menempuh program tingkat
persiapan bersama (TPB) pada tahun 2009. Selama kuliah penulis aktif dalam kepanitiaan Dekan Cup 2011, FST 2011, dan FGW 2013 dalam divisi Sponsorship. Anggota divisi Eksternal Bem D D’Oreamnos 2011-2012, asisten praktikum Mikrobiologi Nutrisi tahun 2013, dan sebagai ketua kelompok pada program penelitian yang didanai oleh Dikti dalam program kreativitas mahasiswa (PKM) pada tahun 2011.
UCAPAN TERIMAKASIH
Penelitian ini didukung oleh Pusat Penelitian Bioteknologi Lembaga Ilmu Pengetahuan Indonesia (LIPI). Terimakasih untuk Dr Ir Asep Sudarman, MRurSc dan Dr Ir Yantyati Widyastuti sebagai kepala laboratorium sekaligus pembimbing skripsi atas bimbingan dan ide yang diberikan. Roni Ridwan, SPt MSi dan ibu Dian Anggraeni atas bantuannya terkait prosedur dan pelaksanaan teknis laboratorium, Fajrin Sidiq, SPt yang turut membantu seluruh rangkaian penelitian, dan M. Asrianto Malik, SPt yang membantu proses pengolahan data statistik. Dilla Mariestia Fassah, SPt MSc selaku dosen pembahas dalam seminar hasil penelitian pada tanggal 05 Desember 2013. Dr Epi Taufik, SPt MVPH MSi dan Dr Sri Suharti, SPt MSi selaku dosen penguji sidang pada tanggal 10 Februari 2014.