DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
2015
PENGUJIAN BIOINTENSIF PENYAKIT BUSUK DAUN
(
Fusarium fujikuroi
Nirenberg) PADA TANAMAN
SANSEVIERIA (
Sansevieria trifasciata
)
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Pengujian Biointensif Penyakit Busuk Daun (Fusarium fujikuroi Nirenberg) pada Tanaman Sansevieria (Sansevieria trifasciata) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
Urwatil Wutsqo. Pengujian Biointensif Penyakit Busuk Daun (Fusarium fujikuroi Nirenberg) pada Tanaman Sansevieria (Sansevieria trifasciata). Dibimbing oleh TITIEK SITI YULIANI.
ABSTRACT
URWATIL WUTSQO. Biontensive Test of Leaf Rot Disease (Fusarium fujikuroi Nirenberg) on Sansevieria Plant (Sansevieria trifasciata). Supervised by TITIEK SITI YULIANI.
Sansevieria (Sansevieria trifasciata) or lidahmertua is one of the plants that have prospect to be developed in Indonesia. Some factor which cause problem for farmers are pests and diseases. F. fujikuroi is a fungal leaf rot disease-causing pathogen in sansevieria. This research aim to know effectiveness of antagonist agents Trichoderma harzianum and plant growth promoting rhizobacteria (PGPR) in suppressing growth of leaf rot disease. This research activity consists of isolation leaf plant that show symptom of leaf rot, exploration of T. harzianum from soil, in vitro antagonism test using T. harzianum, PGPR, combination between PGPR with T. harzianum and fungicide active ingredient benomil. In vivo test is done by soaking the sansevieria plant in each antagonist agents for 24 hours, sansevieria is planted in a medium containing compost, sand, and husk with 1:1:1 ratio. A week after the plantation, pathogen inoculation is done. The experiments were conducted using complete randomized design. The observed variables is percentage of inhibition, disease incidence and severity disease of leaf rot. The results of in vitro tests showed that T. harzianum most effective in suppressing growth of F. fujikuroi, while in vivo tests showed that F. fujikuroi less well developed in the greenhouse so that the level of incidence disease and severity disease is low. Combination of T. harzianum and PGPR less effective in suppressing development of leaf rot disease.
© Hak Cipta Milik IPB, tahun 2015 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
PENGUJIAN BIOINTENSIF PENYAKIT BUSUK DAUN
(
Fusarium
fujikuroi
Nirenberg) PADA TANAMAN
SANSEVIERIA (
Sansevieria trifasciata
)
URWATIL WUTSQO
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
PRAKATA
Puji dan syukur penulis panjatkan ke khadirat Allah SWT yang telah memberikan segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan usulan tugas akhir yang berjudul “Pengujian Biointensif Penyakit Busuk Daun (Fusarium fujikuroi Nirenberg) pada Tanaman Sansevieria (Sansevieria trifasciata) dilaksanakan di Laboratorium Mikologi, Departemen Proteksi Tanaman, Fakultas Pertanian, dan Kebun Percobaan Cikabayan University Farm, Institut Pertanian Bogor. Penelitian dilaksanakan pada bulan Maret hingga Oktober 2014. Pada kesempatan kali ini penulis mengucapkan terima kasih kepada keluarga yang telah mendoakan dan mendukung sepenuh hati kepada penulis, Dr. Ir. Titiek Siti Yuliani, SU selaku dosen pembimbing skripsi yang telah membimbing atau memberikan masukan serta motivasi. Peulis mengucapakan terima kasih kepada dosen penguji skripsi Dr. Ir. Teguh Santoso, DEA yang telah memberikan saran dan masukan kepada penulis dalam melakukan penulisan skripsi. Teman-teman Proteksi Tanaman 47 dan rekan kerja di Laboratorium Mikologi yang telah turut membantu serta memberikan dukungan dan semangat kepada penulis.
Semoga penelitian ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN ix
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 4
Manfaat Penelitian 4
METODE 5
Waktu dan Tempat Penelitian 5
Alat dan Bahan 5
Prosedur Penelitian 5
Isolasi dan Identifikasi Fusarium fujikuroi 5 Isolasi dan Identifikasi Trichoderma harzianum 5
Peremajaan Trichoderma harzianum 6
Peremajaan PGPR 6
Uji Antagonisme secara in vitro 6
Pengujian in vivo 7
Skoring Penyakit Busuk Daun 7
Rancangan Percobaan dan Analisis Data 8
HASIL DAN PEMBAHASAN 9
Isolasi dan Identifikasi Fusarium fujikuroi 9
Isolasi dan Identifikasi Trichoderma harzianum 10
Peremajaan PGPR 11
Uji Antagonisme in vitro 11
Metode Inokulasi 13
Pengujian in vivo 14
KESIMPULAN DAN SARAN 17
DAFTAR PUSTAKA 18
DAFTAR TABEL
1 Skoring penyakit busuk daun (F. fujikuroi) 7
2 Identifikasi koloni dan morfologi F. fujikuroi 10 3 Persentase daya hambat F. fujikuroi oleh agens antagonis dan
fungisida benomil 12
4 Kejadian penyakit busuk daun (F. fujikuroi) pada tanaman sansevieria 15 5 Keparahan penyakit busuk daun (F. fujikuroi) pada tanaman sansevieria 15
DAFTAR GAMBAR
1 Gejala dan tanda penyakit busuk pada daun sansevieria 9 2 Koloni F. fujikuroi pada media PDA dalam cawan petri 9 3 Morfologi cendawan F. fujikuroi pada umur 7 hsi 9 4 Hasil peremajaan T. harzianum pada 7 hsi (makroskopis dan
mikroskopis) 11
5 Hasil peremajaan PGPR pada 7 hsi 11
6 Hasil uji antagonisme in vitro 12
7 Metode inokulasi 14
8 Hasil pengujian in vivo 14
DAFTAR LAMPIRAN
1 Jari-jari pertumbuhan koloni F. fujikuroi dengan metode uji ganda 23 2 Kejadian penyakit busuk daun pada 3 sampai 7 MSI 24 3 Keparahan penyakit busuk daun pada 3 sampai 7 MSI 25
PENDAHULUAN
Latar Belakang
Sansevieria (Sansevieria trifasciata) merupakan salah satu tanaman hias yang mempunyai prospek untuk dikembangkan di Indonesia. Sansevieria adalah tanaman hias yang berasal dari Afrika. Tanaman ini mulai dikenal di Indonesia pada tahun 2004. Di Indonesia, nama sansevieria lebih dikenal dengan sebutan lidahmertua. Bermacam variasi daun, mulai dari motif, warna, bentuk, serta ukurannya menyebabkan tanaman ini banyak digemari orang. Kadang-kadang harganya sampai ratusan ribu rupiah hingga mencapai jutaan ribu rupiah/lahan tanaman (Purwanto 2006). Sansevieria tergolong ke dalam tanaman yang tahan cekaman, baik di tempat dengan banyak polusi udara yang membuat tanaman lain mati sampai tempat yang miskin cahaya. Tanaman ini membutuhkan air untuk tumbuh berkisar 26 ml/tanaman/minggu. Sebagai penghias ruangan, tanaman ini dapat tidak disiram selama setengah bulan. Syarat tumbuh sansevieria pada ketinggian tempat 0-1 800 m dpl, dengan suhu malam berkisar 15 ºC -21 ºC, dan suhu siang berkisar 21 ºC-27 ºC (Saraswati 2006). Suhu yang terlalu rendah justru akan menghambat pertumbuhan. Daerah pegunungan yang bersuhu dingin tidak cocok untuk sansevieria.
Kandungan saponin di dalam lidahmertua dan mahoni diduga dapat digunakan sebagai insektisida nabati dalam pengendalian hama Thrips pada tanaman semangka (Ayuningtyas 2012). Sansevieria memiliki nilai ekonomi yang cukup tinggi dan mempunyai prospek yang cukup bagus, karena telah menjadi komoditas eksport. Berdasarkan hasil wawancara dengan petani sansevieria di desa Cipanas bahwa harga satu tanaman sansevieria adalah Rp 3 000,-. Petani menjual tanaman sansevieria dengan mengambil anakan dan ditanam kembali untuk diperbanyak. Jika tanaman sansevieria terserang penyakit petani bisa mengalami kerugian sampai ratusan ribu hingga jutaan rupiah (Ujang 2014 Juli 7, Komunikasi Pribadi).
Penyakit busuk daun merupakan permasalahan utama pada sansevieria yang disebabkan oleh Colletotrichum sp. dan Fusarium fujikuroi (Purwanto 2006). Fusarium merupakan patogen tular tanah yang merupakan kelompok mikroba pengganggu tanaman yang keberadaan dan hidupnya di dalam tanah. Kelompok patogen ini sering menimbulkan kerugian berupa penurunan hasil panen, mengingat sering terlambatnya penanganan penyakit yang ditimbulkannya karena gejala penyakit yang terlambat diketahui. Hal ini terjadi karena patogen menyerang perakaran tanaman dan membutuhkan waktu untuk menimbulkan gejala pada bagian tanaman di atas permukaan tanah (Soesanto 2008).
Menurut Leslie & Summerell (2006) Fusarium tergolong ke dalam: Kingdom : Fungi
2
Menurut Semangun (1994) bahwa Fusarium membentuk miselium bersekat dan dapat tumbuh baik pada berbagai media agar yang mengandung ekstrak sayuran. Awalnya tidak berwarna (hialin), miselium tua berwarna ungu. Penyakit yang disebabkan oleh Fusarium diinformasikan dapat menurunkan kualitas dan hasil panen. Petani sering mengalami kegagalan panen akibat gangguan penyakit yang belum dapat diatasi dengan efektif. Gejala yang muncul berupa busuk jorong atau tidak teratur berwarna cokelat kelabu pada daun, daun menjadi busuk basah, mengerut kadang-kadang dijumpai tidak berwarna, gejala lebih sering ditemukan disekitar dileher akar. Gejala lanjut berupa tanaman rubuh dan mati (Djafaruddin 2000).
Berdasarkan hasil penelitian Huda (2010), kejadian penyakit di lapangan diamati melalui kenampakan gejala pada fenotip tanaman berupa daun tua berwarna kuning cerah dimulai dari bagian tepinya kemudian berkembang menjadi daun menguning dan layu keseluruhan, rebah pada pangkal tangkai daun, pecah pada batang tanaman yang berada di atas permukaan tanah, serta kelayuan tanaman dan kematian tanaman. Gejala internal menunjukkan adanya bercak hitam hingga kemerahan atau busuknya batang jika dibelah secara melintang maupun membujur dan busuknya bagian bonggol tanaman.
Fusarium sangat sesuai pada tanah dengan kisaran pH 4.5 sampai 6.0. Suhu optimum untuk pertumbuhan adalah 20 ºC dan 30 ºC, dengan suhu maksimum pada 37 ºC atau dibawahnya dan minimum sekitar 5 ºC, sedangkan optimum untuk pembentukan spora berkisar 20 ºC-25 ºC. Cendawan dapat bertahan lama di dalam tanah selama beberapa tahun (Djaenudin 2010). Penyakit akan lebih berat bila tanah mengandung banyak unsur nitrogen tetapi miskin akan kalium (Semangun 2000).
Tindakan pengendalian penyebab penyakit busuk daun yang dilakukan petani masih dianggap belum intensif. Pengendalian yang umumnya dilakukan oleh petani berupa membuang dan mengubur tanaman yang menunjukkan gejala busuk daun. Tindakan pengendalian ini tidak efektif karena dapat menjadikan sumber inokulum Fusarium. Pengendalian biointesif merupakan suatu sistem pendekatan untuk pengelolaan penyakit tanaman yang didasarkan pada pemahaman ekologi patogen. Sistem ini menggabungkan beberapa teknik pengendalian yang efektif, eisien, dan ramah lingkungan dengan mengoptimalkan sumber daya hayati yang bermanfaat bagi agens hayati dan merugikan bagi patogen (ATTRA 2001). Menurut Djafarudin (2000), pengendalian Fusarium dapat dilakukan dengan menggunakan fungisida berbahan aktif benomil. Adapun pengendalian yang dapat dilakukan selain penggunaan fungisida, dapat dilakukan dengan menggunakan agens hayati yang aman dan ramah lingkungan, seperti Trichoderma sp. dan Pseudomonas fluorescens (Agrios 2005).
Trichoderma spp. merupakan salah satu cendawan tular tanah yang banyak ditemukan di seluruh dunia dan berperan penting dalam proses pengendalian hayati. Hal ini dikarenakan Trichoderma mudah diisolasi dengan berbagai teknik, khususnya menggunakan tabung reaksi dan cawan petri. Tidak ada persyaratan khusus untuk pertumbuhan cendawan antagonis ini, kecuali lingkungan tertentu dengan kandungan nitrat yang tinggi (Soesanto 2008).
3 organisme pengganggu tumbuhan (OPT). Mekanisme pengendalian Trichoderma spp. bersifat spesifik target, mampu mengoloni rhizosfer dengan cepat, dan melindungi akar dari serangan cendawan patogen, mampu mempercepat pertumbuhan dan meningkatkan hasil produksi tanaman yang menjadikan Trichoderma unggul sebagai salah satu agens pengendali hayati (Purwantisari dan Hastuti 2009).
Sifat dan mekanisme kerja antagonisme Trichoderma spp. antara lain lisis, kompetisi, dan mikoparasit. Sifat baik dan efisiennya Trichoderma sp. untuk pengendali secara hayati diantaranya dapat ditemukan pada berbagai tempat, cepat dan dapat tumbuh pada berbagai tempat, kisaran parasitismenya terhadap patogen tumbuhan sangat luas, berkemampuan tinggi dalam berkompetisi makanan, ruangan (tempat) dan menghasilkan antibiotik (Djafarudin 2000). Trichoderma viridae berhasil menekan pertumbuhan beberapa cendawan, antara lain Pythium spp., Verticillium sp., F. solani, F. oxysporum, Colletotrichum lini, Alternaria sp. dan Rhizoctonia solani dengan pH tanah rendah (Soesanto 2008).
PGPR singkatan dari plant growth promoting rhizobacteria atau rhizobakteri pendukung pertumbuhan tanaman. PGPR telah mendapatkan perhatian khusus karena berperan pertama kali di dalam pengendalain hayati, yang kemudian diikuti dengan peran lain, seperti antibioisis. PGPR yang diterapkan di lapangan tidak selalu menunjukkan keaktifan senyawa seperti hormon. Mekanisme kerja PGPR di alam umumnya selalu berkaitan dengan mekanisme lain dari agens pengendali hayati, seperti antibiotik, siderofor, dan persaingan. Siderofor adalah senyawa yang diproduksi agens biokontrol pada lingkungan yang stress besi dan berperan sebagai agen pengkhelat ion besi yang spesifik dari lingkungan (Wardani 2012). Siderofor dapat menghindarkan ion besi dari patogen sehingga pertumbuhan patogen terhambat. Penghambatan pengolonian akar oleh cendawan patogen dapat disebabkan oleh adanya PGPR dalam populasi yang tinggi pada akar yang menghasilkan antibiotik, memanfaatkan nutrisi, dan mengubah lingkungan kimia sekitar akar (Soesanto 2008).
Rizosfer tanaman merupakan habitat bagi berbagai spesies bakteri yang secara umum dikenal sebagai rizobakteria. Isolat rizobakteria dapat berfungsi sebagai pemacu pertumbuhan tanaman dan sebagai agens antagonis terhadap patogen tanaman (Anisa 2011). Menurut Glick dan Pasternak (1998) keuntungan dari mekanisme PGPR dibedakan menjadi dua yaitu secara langsung dan tidak langsung. Keuntungan secara langsung pada tanaman mampu memfiksasi nitrogen dan memberikannya pada tanaman, meningkatkan ketersediaan atau menyimpan besi dan fosor dari tanah, menyediakan mineral-mineral tersebut dalam bentuk yang dapat digunakan oleh tanaman, mensintesis fitohormon seperti auksin, sitokoin, atau giberelin yang memicu perkembangan sel tanaman. Keuntungan PGPR secara tidak langsung terjadi ketika PGPR dapat mencegah pertumbuhan patogen dalam tanah yang dapat mengganggu pertumbuhan dan perkembangan normal tanaman.
4
misalnya lendir tanaman untuk cendawan dan eksudat akar untuk bakteri kelompok Pseudomonas, 3) kompatibel dengan lingkungan tanah serta perubahan yang terjadi karena peningkatan cara bercocok tanam (Mishra et al. 2001).
Berdasarkan hasil penelitian Mishra et al. (2011) bahwa kombinasi P. fluorescens dengan T. harzianum diaplikasikan dalam mengendalikan penyakit busuk batang pada kacang polong. Kombinasi agens biokontrol tersebut menunjukkan bahwa aplikasi kombinasi memberikan penekanan yang lebih tinggi bila dibandingkan dengan aplikasi secara tunggal. Hal ini berbeda dengan hasil penelitian Felde et al. (2009) bahwa kombinasi Trichoderma dan Fusarium non patogenik tidak memberikan penekanan yang baik terhadap layu Fusarium pada pisang.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui keefektifan agens antagonis T. harzianum dan PGPR dalam menekan pertumbuhan penyakit bercak daun.
Manfaat Penelitian
5 METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai bulan Maret 2014 hingga Oktober 2014 di Laboratorium Mikologi, Departemen Proteksi Tanaman, Fakultas Pertanian dan Kebun Percobaan Cikabayan University Farm, Institut Pertanian Bogor.
Alat dan Bahan
Bahan-bahan yang digunakan pada penelitian ini adalah tanaman sansevieria yang digunakan dalam penelitian berasal dari petani sansevieria di Desa Cipanas, PGPR dengan merek dagang BenPrimA berasal dari koleksi Klinik Tanaman Deapartemen Proteksi Tanaman, IPB dan fungisida dengan bahan aktif benomil (Masalgin 50 WP).
Prosedur Penelitian
Isolasi dan Identifikasi F. fujikuroi
Daun dicuci dengan air mengalir. Daun dipotong sebesar 0.5 cm x 0.5 cm dibagian sehat dan yang sakit. Sterilisasi permukaan daun dengan menggunakan larutan NaOCl 3% selama 3 menit, setelah itu direndam pada alkohol 70% selama 1 menit dan dibilas menggunakan air steril, lalu dikeringanginkan. Potongan daun ditanam pada media PDA dan diinkubasi pada suhu ruang. Patogen yang berumur 7 hari disimpan untuk digunakan pada uji antagonisme in vitro dan uji virulensi dengan metode Postulat Koch, yaitu:
Isolasi. Pencucian permukaan daun dengan air mengalir. Daun dipotong sebesar 0.5 cm x 0.5 cm dibagian sehat dan yang sakit. Sterilisasi permukaan daun dengan menggunakan larutan NaOCl 3% selama 3 menit, setelah itu direndam pada alkohol 70% selama 1 menit dan dibilas menggunakan air steril, lalu dikeringanginkan. Potongan daun ditanam pada media PDA dan diinkubasi pada suhu ruang.
Inokulasi. Untuk metode inokulasi dengan mengencerkan biakan Fusarium yang telah diremajakan dalam media beras dengan air steril, kemudian menghitung kerapatan konidia dengan menggunakan hemositometer sampai diperoleh kerapatan 107 sel konidia/ml. Inokulasi pada daun dilakukan dengan metode penyuntikan dan penempelan pada daun, sedangkan pada tanah dengan penyiraman di sekitar tanah. Setelah beberapa hari masa inkubasi, daun diamati yang menunjukkan gejala identik dengan gejala awal di lapangan.
Reisolasi. Tanaman yang menunjukkan gejala sakit diisolasi kembali pada media PDA dan diidentifikasi secara makroskopis dan mikroskopis dengan mengamati warna koloni, pertumbuhan miselium, dan bentuk konidia.
Isolasi dan Identifikasi Trichoderma harzianum
6
makroskopis dan mikroskopis dengan mengamati warna koloni, pertumbuhan miselium,dan bentuk konidia.
Peremajaan Trichoderma harzianum
Peremajaan ini dilakukan dengan menumbuhkan isolat T. harzianum yang sudah murni pada media PDA dan diinkubasi pada suhu ruang selama 5 sampai 7 hari. Pembiakan massal dilakukan pada 300 g jagung pipil steril yang sebelumnya disterilisasi terlebih dahulu dengan mengunakan autoklaf pada suhu 121 ºC. Inkubasi dilakukan selama 14 hari untuk mendapatkan massa Trichoderma yang telah menutupi seluruh permukaan jagung.
Peremajaan PGPR
Peremajaan PGPR dilakukan pada media NB sebanyak 9 ml dicampur dengan 1 gram PGPR, dan dihomogenkan dengan menggunakan shaker dengan kecepatan 100 rpm selama 2 hari, kemudian dilakukan pengenceran berseri hingga 10-7 cfu/ml.Inokulum hasil pengenceran digores pada media NA sebanyak satu
lup, kemudian diinkubasi pada suhu ruang selama 3 hari untuk menghitung jumlah konidia.
Uji Antagonisme secara in vitro
Uji antagonisme secara in vitro antara agens antagonis dengan patogen
dilakukan dengan menggunakan metode uji ganda pada media PDA. Agens antagonis T. harzianum (T), PGPR (P), kombinasi antara PGPR (P) dengan
T. harzianum (T) dan fungisida benomil (F) diinokulasikan pada media PDA dengan jarak 3 cm dari F. fujikuroi. Diameter masing-masing agens antagonis dan patogen sebesar 0.5 cm. Pengamatan dilakukan dengan mengukur jari-jari koloni cendawan patogen yang menjauhi koloni agens antagonis (R1) dan jari-jari koloni cendawan patogen yang mendekati agens antagonis (R2), serta menghitung penghambatan agens antagonis (ppH).
Pengaruh penghambatan agens antagonis terhadap pertumbuhan patogen menggunakan rumus presentasi Skidmore and Dickinson (1976):
PPh : R −R
R
X
%
dengan,
R1 : Jari-jari koloni patogen yang menjauhi koloni agens antagois R2 : Jari-jari koloni patogen yang mendekati koloni agesns antagonis PPh : Presentase penghambatan pertumbuhan
P A R1 R2
P : Koloni cendawan patogen A : Koloni cendawan antagonis
R1 : Jari-jari koloni patogen yang menjauhi koloni cendawan antagonis (mm)
7 Pengujian in vivo
Uji antagonisme ini dilakukan pada tanaman sansevieria. Uji antagonisme in vivo terdiri dari :
T : Pengendalian dengan T. harzianum P : Pengendalian dengan PGPR
F : Pengendalian dengan fungisida benomil
P+T : Kombinasi pengendalian antara PGPR dengan T. harzianum K : Kontrol
Pengujian in vivo terdiri dari 5 ulangan, 5 perlakuan dengan masing-masing perlakuan terdiri dari 7 tanaman dan jumlah total tanaman sebanyak 175 tanaman. Sansevieria direndam di dalam suspensi agens antagonis selama 24 jam, kemudian pada pagi hari ditanam di dalam polybag. Satu polybag ditanam satu tanaman sansevieria. Inokulasi patogen dilakukan pada pagi hari dengan penyiraman suspensi F. fujikuroi sebanyak 10 ml/tanaman dengan kepadatan 107 sel konidia/ml larutan ke tanah pada 7 hari setelah tanam (hst).
Skoring Penyakit Busuk Daun
Pengamatan gejala busuk daun dengan menghitung skoring dan dilakukan setiap minggu sejak munculnya gejala sampai akhir percobaan. Pengukuran kejadian penyakit dan keparahan penyakit dihitung menggunakan rumus menurut Zadoks and Schein (1979):
Kejadian penyakit = �
� x100% dengan,
n : Jumlah tanaman contoh yang terserang N: Jumlah tanaman contoh yang diamati
Keparahan penyakit =
∑
���� � � x 100% n : jumlah tanaman yang terserang
v : skor pada setiap kategori serangan N: jumlah tanaman yang diamati V: skor untuk kategori serangan
Metode skoring penyakit busuk daun berdasarkan Holliday and Mowat (1963) yang dimodifikasi sebagai berikut:
Tabel 1 Skoring penyakit busuk daun (F. fujikuroi) Nilai skoring Kategori serangan
0 Tidak ada serangan
1 busuk daun berkisar antara 1-5% 2 busuk daun berkisar antara 5-10% 3 busuk daun berkisar antara 10-25% 4
5
8
Rancangan Percobaan dan Analisis Data
9
HASIL DAN PEMBAHASAN
Isolasi dan Identifikasi F. fujikuroi
Cendawan F. fujikuroi diisolasi dari sampel daun yang menunjukkan gejala busuk daun. Gejala pada daun berupa busuk berwarna coklat kemerahan, daun menjadi busuk basah, mengerut, tidak beraturan.
Gambar 1 Gejala dan tanda penyakit busuk pada daun sansevieria
Pengamatan morfologi F. fujikuroi dengan menggunakan mikroskop program pemotretan digitan NIS element perbesaran 100x.
Gambar 2 Koloni F. fujikuroi pada media PDA dalam cawan petri
Gambar 3 Morfologi cendawan F. fujikuroi pada umur 7 hsi : konidiofor (a), makrokonidia (b), dan mikrokonidia (c)
1 1 10 µm
a b c
10
Tabel 2 Identifikasi koloni dan morfologi F. fujikuroi Bagian Leslie & Summerell
(2006) Watanabe (2002) Karakter temuan Koloni Miselium berwana Klamidospora Tidak terbentuk Tidak terbentuk Tidak terbentuk
Isolasi dan Identifikasi Trichoderma harzianum
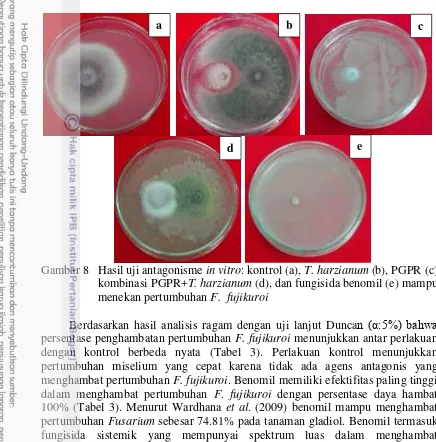
Hasil isolasi pada medium PDA membentuk miselium berwarna hijau. Pada 7 hari setelah inokulasi (hsi) miselium tumbuh menutupi seluruh permukaaan media (Gambar 6a). Pengamatan cendawan T. harzianum secara mikroskopis mempunyai konidiofor hialin, tegak, bercabang banyak, konidia terdiri atas satu sel berbentuk oval, berkumpul pada bagian ujung fialid (Gambar 6b). Hal ini sesuai dengan hasil identifikasi menurut Watanabe (2002).
11
Gambar 6 Hasil peremajaan T. harzianum pada 7 hsi: koloni pada media PDA dalam cawan petri (a), konidia T. harzianum (b)
Peremajaan PGPR
Hasil peremajaan pada media NA membentuk koloni berwarna putih, mempunyai bentuk berbenang-benang, tepian bercabang dan elevasi berbukit-bukit (Gambar 7).
Gambar 7 Hasil peremajaan PGPR pada 7 hsi: koloni pada media NA dalam cawan petri
Uji Antagonisme secara In vitro
Uji antagonisme in vitro antara F. fujikuroi dengan T. harzianum, PGPR, PGPR + T. harzianum dan fungisida dilakukan selama 7 hari dengan mengukur jari-jari pertumbuhan patogen. Hasil uji antagonisme menunjukkan agens antagonis dan fungisida mampu menghambat pertumbuhan patogen (Gambar 8).
12
Gambar 8 Hasil uji antagonisme in vitro: kontrol (a), T. harzianum (b), PGPR (c), kombinasi PGPR+T. harzianum (d), dan fungisida benomil (e) mampu menekan pertumbuhan F. fujikuroi
Berdasarkan hasil analisis ragam dengan uji lanjut Duncan (α:5%) bahwa persentase penghambatan pertumbuhan F. fujikuroi menunjukkan antar perlakuan dengan kontrol berbeda nyata (Tabel 3). Perlakuan kontrol menunjukkan pertumbuhan miselium yang cepat karena tidak ada agens antagonis yang menghambat pertumbuhan F. fujikuroi. Benomil memiliki efektifitas paling tinggi dalam menghambat pertumbuhan F. fujikuroi dengan persentase daya hambat 100% (Tabel 3). Menurut Wardhana et al. (2009) benomil mampu menghambat pertumbuhan Fusarium sebesar 74.81% pada tanaman gladiol. Benomil termasuk fungisida sistemik yang mempunyai spektrum luas dalam menghambat partumbuhan patogen.
Tabel 3 Persentase daya hambat F. fujikuroi oleh agens antagonis dan fungisida benomil
Perlakuanb Daya hambat (%)a Mekanisme penghambatan Kompetisi Antibiosis
berdasarkan selang berganda pada taraf nyata 5%. b K= kontrol F. fujikuroi. c T=Trichoderma.d
P= PGPR. e F=Fungisida. F P+T= PGPR+Trichoderma
d
b
e
13 T. harzianum mampu menghambat pertumbuhan F. fujikuroi sebesar 41.86% (Tabel 3). Mekanisme penghambatan T.harzianum berupa kompetisi ruang. Menurut Djafarudin (2000) bahwa sifat dan mekanisme kerja antagonisme Trichoderma antara lain lisis, kompetisi, dan mikoparasitisme. Trichoderma mempunyai kemampuan mikoparasitme yaitu hifa Trichoderma tumbuh melilit pada hifa patogen dan menghasilkan enzim lisis yang dapat menembus dinding sel dan menghasilkan senyawa antibiotik yaitu viridin dan gliotoksin (Sastrahidayat 1992). Penambahan antagonis T. harzianum dapat menghambat pertumbuhan Fusarium pada semua isolat, yang berkisar antara 7.89-56.25% (Prabowo et al. 2006).
Isolat bakteri PGPR mampu menghambat pertumbuhan F. fujikuroi sebesar 16.28% (Tabel 3). Mekanisme antagonis yang dihasilkan yaitu antibiosis dengan adanya zona bening di antara pertemuan cendawan antagonis dengan patogen yang menghasilkan senyawa antibiotik. Perlakuan kombinasi antara isolat bakteri PGPR dengan T. harzianum mampu menghambat pertumbuhan F. fujikuroi sebesar 25.29% (Tabel 3). Menurut Soesanto et al. (2008), perlakuan gabungan antara T. harzianum, Gliocladium sp., dan P. fluorescens P60 memberikan pengaruh positif dalam menekan pernyakit layu Fusarium pada tanaman gladiol hingga 53.98%. Persentase daya hambat pada perlakuan tunggal T. harzianum lebih besar dibandingkan perlakuan kombinasi dengan PGPR. Hal ini diduga karena pada perlakuan kombinasi adanya persaingan dalam memperebutkan ruang tumbuh dan nutrisi di dalam media.
Menurut Barus (2014), persentase penghambatan oleh agens biokontrol dipengaruhi oleh banyak faktor seperti kemampuan tumbuh, kecepatan tumbuh, umur agens biokontrol, kemampuan bertahan dari patogen dan mekanisme penghambatan yang berbeda untuk setiap agens biokontrolnya serta seberapa besar kemampuan agens biokontrol dalam menghasilkan senyawa antibiotik.
Metode Inokulasi
Hasil inokulasi patogen pada metode penempelan gejala muncul satu minggu setelah inokulasi (msi), sedangkan metode penyuntikan dan penyiraman gejala muncul 3 msi. Gejala pada metode inokulasi lebih cepat muncul dibandingkan gejala penyuntikan dan penyiraman. Hal ini diduga karena pada metode penempelan konidia dalam satu bulatan biakan Fusarium jumlah kerapatan konidia yang dihasilkan tidak diketahui diduga lebih banyak dari pada metode penyiraman, sedangkan pada metode penyiraman jumlah kerapatan konidia 107 sel konidia/ml. Untuk metode penyiraman Fusarium menyerang perakaran tanaman dan membutuhkan waktu untuk menimbulkan gejala pada bagian tanaman di atas permukaan tanah. Menurut Mc Carter (2006) bahwa patogen masuk ke dalam tanaman melalui luka pada akar, luka pada batang maupun melalui stomata yang menjadi lubang masuk. Patogen kemudian menuju sistem pembuluh tanaman. Proses pencapaian sistem pembuluh akan menjadi lebih cepat bila suhu pada saat infeksi tinggi. Setelah mencapai sistem pembuluh kemudian patogen mengkolonisasi xylem. Pada xylem, patogen bereproduksi dengan sangat cepat sehingga memblok saluran xylem. Xylem yang terblok akan menyebabkan tanaman sulit menyalurkan air dan nutrisi sehingga tanaman menjadi busuk dan layu.
14
Gambar 9 Metode inokulasi F. fujikuroi: penempelan (a), penyuntikan (b), dan penyiraman (c)
Gejala yang muncul untuk metode penempelan dan penyuntikan sama berupa busuk berwarna coklat kemerahan menyerupai bercak daun (Gambar 9a dan 9b), sedangkan metode penyiraman gejala berupa busuk berwarna coklat kemerahan pada keseluruhan daun, daun menjadi busuk basah mengerut yang pinggirnya tidak beraturan, tanaman rubuh dan mudah dicabut (Gambar 9c).
Pengujian in vivo
Uji antagonisme in vivo mampu menghambat pertumbuhan F. fujikuroi (Gambar 10), meskipun tingkat kejadian dan keparahan penyakit di lapangan cukup rendah. Gejala yang muncul di lapangan berupa busuk kemerahan dan cokelat kelabu pada daun, daun menjadi busuk basah, mengerut, gejala sering ditemukan di sekitar leher akar.
Gambar 10 Hasil pengujian in vivo: T. harzianum (a), PGPR (b), PGPR+T.harzianum (c), fungisida benomil (d), dan kontrol (e) Kejadian Penyakit
Kejadian penyakit adalah persentase jumlah tanaman sakit dibandingkan dengan jumlah tanaman yang diamati. Pengamatan tingkat kejadian penyakit dan keparahan penyakit busuk daun di rumah kaca dilakukan selama 5 minggu dengan 1 kali pengamatan untuk setiap minggunya.
a b c
a b c
15 Pada Tabel 4 dapat dilihat bahwa T. harzianum, PGPR, PGPR+T. harzianum, dan fungisida benomil mampu menghambat pertumbuhan F. fujikuroi. Berdasarkan hasil analisis ragam dengan uji lanjut Duncan (α:5%) perlakuan kontrol tidak berbeda nyata dengan perlakuan T. harzianum dan PGPR, sedangkan dengan perlakuan kombinasi PGPR+T. harzianum dan fungisida berbeda nyata (Tabel 4).
Tabel 4 Kejadian penyakit busuk daun (F. fujikuroi) pada tanaman sansevieria
Perlakuanb Kejadian penyakita
berdasarkan selang berganda pada taraf nyata 5%. b K= kontrol F. fujikuroi. c T=Trichoderma.d
P= PGPR. e F=Fungisida. F P+T= PGPR+Trichoderma
Keparahan Penyakit
Hasil analisis ragam dengan uji lanjut Duncan (α:5%) bahwa perlakuan kontrol tidak berpengaruh nyata dengan fungisida, namun dengan perlakuan PGPR, T. harzianum dan PGPR+T. harzianum berpengaruh nyata dalam menghambat pertumbuhan F. fujikuroi (Tabel 5).
Tabel 5 Keparahan penyakit F. fujikuroi pada tanaman sansevieria
Perlakuanb Keparahan penyakita
berdasarkan selang berganda pada taraf nyata 5%. b K= kontrol F. fujikuroi. c T=Trichoderma.d
P= PGPR. e F=Fungisida. f P+T= PGPR+Trichoderma
16
digunakan adalah pasir yang memiliki kelembaban tanah rendah dan diduga bahan organik yang diaplikasikan sedikit. Menurut Soesanto (2008) bahwa agens antagonis membutuhkan kelembaban tanah yang tinggi dan bahan organik yang tinggi untuk mempercepat pertumbuhan dan pemantapan daya antagonis dalam tanah. Menurut Felde et al. (2006) aplikasi kombinasi juga dapat memberikan efek yang negatif terhadap pengendalian penyakit. Hal ini dapat terjadi karena mekanisme dari masing-masing agens antagonis tidak secara langsung mempengaruhi metabolisme patogen tetapi juga mempengaruhi mekanisme sesama agens antagonis.
17
SIMPULAN DAN SARAN
Kesimpulan
Hasil uji antagonisme pada perlakuan biointensif secara in vitro yang paling efektif dalam menghambat pertumbuhan F. fujikuroi adalah T. harzianum yaitu sebesar 41.86%. Hasil uji antagonisme secara in vivo yang paling aktif dalam menghambat kejadian dan keparahan penyakit adalah perlakuan PGPR dan T. harzianum dengan masing-masing persentase kejadian penyakit sebesar 1.71% dan 2.28%, sedangkan persentase keparahan penyakit secara berturut-turut sebesar 0.96% dan 1.16%.
Saran
18
DAFTAR PUSTAKA
[ATTRA] Appropiate Technology Transfer for Rural Areas. 2001. Biointensive Integrated Pest Management (IPM) fundamentals of sustainable agriculture. NCAT Agr Specialist [internet]. [diunduh 26 Desember 2013]. Tersedia pada: http://attra.ncat.org/attra-pub/ipm.
Agrios GN. 2005. Plant Pathology. 5th ed. London (GB): Elsevier Academic Press.
Anisa Y. 2011. Pengaruh mulsa dan PGPR terhadap insidensi penyakit busuk pangkal batang (Sclerotium rolfsii Sacc.) pada tanaman kedelai (Glycine max (L.)Merill) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Ayuningtyas A. 2012. Pemanfaatan mahoni (Swietena mahagoni L Jacq.) dan lidah mertua (Sansevieria trifasciata Prain.) untuk mengendalikan hama Thrips sp. pada tanaman semangka (Citrullus lanatus Thunb.) [abstrak] [Internet] [diunduh 2014 Juli 2]. Tersedia pada: http://www.peipfi-komdasulsel.org /wp- content/ up loads/2012/03/9-Nurasiah-Dj-Bioekologi-penyakit-layu-fusarium.pdf.
Barus DA. Pencegahan rebah kecambah dan busuk kecambah (Colletotrichum gloeosporioides (Penz.)Sacc.) pada papaya calina oleh beberapa agens biokontrol [skripsi]. Bogor (ID): Institiut Pertanian Bogor.
Djaenuddin N. 2010. Bioekologi penyakit Fusarium oxysporum [Internet]. Maros (ID): Balai Penelitian Tanaman Serealia; [diunduh 2014 Januari 1]. Tersedia pada: http://www.peipfi-komdasulsel.org /wp- content/ up loads/2012/03/9-Nurasiah-Dj-Bioekologi-penyakit-layu-fusarium.pdf.
Djafaruddin. 2000. Dasar-Dasar Pengendalian Penyakit Tanaman. Jakarta (ID): PT Bumi Aksara.
Felde AZ, Poscasangre LE, Monteros CAC, Sikora RA, Rosales FE, Riveros AS. 2006. Effect of combined inoculations of endophytic fungi on biocontrol of Radhopholus similis. InfoMusa. 15(1-2): 12-18.
Glick BR, Paternak JJ. 1998. Molecular Biotechnology Principles and Appliations of Recombination DNA. 3rd ed. Washington DC (US): American Society for Microbiology Press.
Holliday P, Mowat WP. 1963. Foot rot of Piper nigrum L. (Phytophthora
palmivora). London (UK): Commonwealth Mycological Institute.
Huda M. 2010. Pengendalian layu Fusarium pada tanaman pisang (Musa paradisiaca L.) secara kultur teknis dan hayati [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Khalimi K, Wirya GNAS. 2010. Pemanfaatan plant growth promoting rhizobacteria untuk biostimulants dan bioprotectans. Ecotrophic 4(2):131-135.
Leslie JF, Summerell BA. 2006. The Fusarium Laboratory Manual. Lowa (US): Blackwell Publishing.
McCarter SM. 2006. Bacterial wilt. Di dalam: Jones JB, Jones JP, Stall RE,Zitter TA, editors. Compendium of Tomato Disease. Minnesota (US): The American Phytophatological Society. Hlm 28-29.
19 soybean. Pakistan Journal of Botani. 43(5): 2569-2574. Tersedia pada: http://www.pakbs.org/pjbot/PDFs/43(5)/PJB43(5)2569.pdf
Nawangsih AA. 2006. Seleksi dan karakterisasi bakteri biokontrol untuk mengendalikan penyakit layu bakteri ( Ralstonia solanacearum) pada tomat [disertasi]. Bogor [ID]: Institut Pertanian Bogo.
Prabowo AK, Prihatiningsih N, Soesanto L. 2006. Potensi Trichoderma harzianum dalam mengendalikan sembilan isolat Fusarium oxyspoprum Schlecht Ifsp. zingiberi Trujill pada kencur. Jurnal Ilmu-Ilmu Pertanian Indonesia [Internet]. [diunduh 2014 Januari 1]; 8: 76-84. Tersedia pada: http://repository.unib.ac.id/47/1/76JIPI-2006.pdf.
Purwantisari S, Hastuti RB. 2009. Uji antagonisme jamur patogen Phytophthora infestans penyebab penyakit busuk daun dan umbi tanaman kentang dengan menggunakan Trichoderma spp. isolat lokal. Bioma [Internet] [diunduh 2014 Januari 1];11(1):24-32. Tersedia pada: http:// eprints.undip.ac.id/2000/1/Bioma_Susiana_Juni_2009_.pdf.
Purwanto A. 2006. Sansevieria Flora Cantik Penyerap Racun. Yogyakarta (ID): Kanisius.
Saraswati D. 2006. Merawat Sansevieria. Jakarta (ID): Penebar Swadaya.
Sastrahidayat IR. 1992. Ilmu Penyakit Tumbuhan. Surabaya (ID): Usaha Nasional. Semangun H. 1994. Pengantar Ilmu Penyakit Tumbuhan. Yogyakarta (ID):
Gadjah Mada University Press.
Semangun 2000. Penyakit-Penyakit Tanaman Hortikultura Di Indonesia. Yogyakarta (ID): Gajah Mada University Press.
Skidmore AM, Dickinson CH. 1976. Microbiology of Serial Plant Surfacae. New York (US) : Academic Press.
Soesanto L. 2008. Pengantar Pengendalian Hayati Penyakit Tanaman . Jakarta (ID): PT Raja Grafindo Persada.
Wardhana DW, Soesanto L, Utami DS. 2009. Penekanan hayati penyakit layu Fusarium pada subang gladiol. J Hort. 19(2):199-206.
Wardani FF. 2012. Efikasi bakteri endofit dan plant growth promoting rhizobacteriai (PGPR) dalam menekan perkembangan penyakit layu bakteri (Ralstonia solanacearum) pada tomat [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Watanabe T. 2002. Pictorial Atlas of Soil and Seed Fungi : Morphologies of Cultured Fungi and Key to Species. 2nd ed. Boca Raton (US): CRC Press.
21
23 Lampiran 1 Jari-jari pertumbuhan koloni F. fujikuroi dengan metode uji ganda
Keterangan: R1 (jari-jari koloni F. fujikuroi yang menjauhi agens antagonis), R2 (jari-jari koloni F. fujikuroi yang mendekati gens antagonis)
Perla- kuan
Ula-ngan
Jari-jari koloni F. fujikuroi (cm)
1 2 3 4 5 6 7
24
Lampiran 2 Kejadian penyakit busuk daun pada 3 sampai 7 MSI Perlakuan Ulangan Persentase penghambatan pada tanaman ke- (%)
25 Lampiran 3 Keparahan penyakit busuk daun pada 3 sampai 7 MSI
Perlakuan Ulangan Persentase peenghambatan pada tanaman ke- (%100)
26
RIWAYAT HIDUP
Penulis dilahirkan di Pekalongan pada tanggal 9 Maret 1993. Penulis merupakan anak ke lima dari tujuh bersaudara dari ayah Zaedun dan ibu Sufaeroh. Penulis menyelesaikan pendidikan di TK Muslimat Pekalongan, MI Walisongo pada tahun 2004, MTs S Simbang Kulon pada tahun 2007, dan SMA Futuhiyyah pada tahun 2010. Penulis diterima di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB) pada tahun 2010 melalui jalur Undangan Seleksi Masuk IPB (USMI).