RESPON ERITROSIT DAN LEUKOSIT MENCIT (Mus musculus) YANG DIINDUKSI BENZO(α)PIREN TERHADAP PEMBERIAN TAURIN DAN
EKSTRAK DAUN DEWA Gynura segetum (Lour) Merr
Oleh :
HENNY MARLINDA
Tesis
Sebagai Salah Satu Syarat untuk Mencapai Gelar MAGISTER SAINS
Pada
Program Studi Magister Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung
PROGRAM PASCASARJANA MAGISTER BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
ABSTRAK
RESPON ERITROSIT DAN LEUKOSIT MENCIT (Mus musculus) YANG DIINDUKSI BENZO(α)PIREN TERHADAP PEMBERIAN TAURIN DAN
EKSTRAK DAUN DEWA (Gynura segetum (Lour) Merr
Oleh
Henny Marlinda
Kanker darah (leukemia) merupakan salah satu penyakit kanker yang terjadi karena keganasan sel-sel darah. Pengobatan leukemia umumnya menyebabkan kerusakan pada sel-sel normal. Oleh karena itu dibutuhkan obat yang mempunyai efek memperbaiki kerusakan sel dan meningkatkan imunitas sel-sel normal seperti taurin dan daun dewa yang diduga mempunyai sifat antikanker dan antioksidan. Tujuan dari penelitian ini adalah untuk mengetahui pengaruh taurin dan ekstrak daun dewa terhadap jaringan darah yang diinduksi benzo(α)piren secara in vivo, dengan melihat perubahan berat badan, jumlah sel darah merah (eritrosit), jumlah total dan jenis sel darah putih (leukosit) pada mencit (Mus musculus). Data dianalisis dengan one way Anova dilanjutkan uji BNT taraf nyata 5%. Kelompok perlakuan yaitu kelompok I diberi 0,2 ml minyak jagung (sebagai kontrol negatif), II (diberi benzo (α)piren sebagai kontrol positif), kelompok III (diberi taurin 7,8 mg/BB/hari dimulai sejak hari ke 1 sampai ke 15 sebelum induksi benzo(α)piren sampai akhir penelitian). Kelompok perlakuan yaitu kelompok IV diberi benzo(α)piren, selanjutnya diberi taurin 7,8 mg/BB/hari yang diberi 2 kali sehari, serta kelompok V diberi benzo(a)piren, kemudian diberi ekstrak daun dewa dosis 277,8 mg/BB/hari. Hasil penelitian menunjukkan taurin dan daun dewa mampu mencegah pembentukan sel – sel leukemia dengan meningkatkan kondisi berat badan, jumlah eritrosit, jumlah leukosit, dan jumlah macam leukosit menjadi normal kembali. Kesimpulan penelitian ini taurin mempunyai kemampuan terapoitik dan preventif, terhadap kerusakan sel-sel darah yang diinduksi benzo(α)piren serta taurin mempunyai kemampuan lebih baik dari ekstrak daun dewa .
ERYTHROCYTE AND LEUKOCYTE RESPONSES OF MICE (Mus musculus) INDUCED BY BENZO(α)PIREN TO THE ADMINISTRATION OF TAURINE AND DEWA LEAF EXTRACT Gynura segetum (Lour) Merr
ABSTRACT By
Henny Marlinda
RESPON ERITROSIT DAN LEUKOSIT MENCIT (Mus musculus) YANG DIINDUKSI BENZO(α)PIREN TERHADAP PEMBERIAN TAURIN DAN
EKSTRAK DAUN DEWA Gynura segetum (Lour) Merr (Tesis)
Oleh : Henny Marlinda
PROGRAM PASCASARJANA MAGISTER BIOLOGI UNIVERSITAS LAMPUNG
DAFTAR GAMBAR
Halaman
Gambar 1. Skema Hematopoiesis……….. ... 14
Gambar 2. Diferensiasi Sel Darah Putih Mencit (Mus musculus)……….15
Gambar 3. Sel darah merah normal secara mikroskopis... 16
Gambar 4. Gejala Kanker Darah ..…………... 22
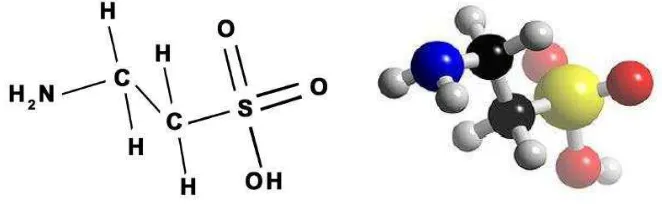
Gambar 5. Struktur diagram bola dan stik taurin...……...…... 24
Gambar 6. Biosintetis Taurin..………... 25
Gambar 7. Daun Dewa (Gynura segetum (Lour) Merr)... 26
Gambar 8. Kerangka dasar flavonoid……….…...27 Gambar 9. Struktur Benzo (α) piren……….…... 28
Gambar 10. Proses metabolime benzo(α)pren dalam tubuh……...………....…..28
Gambar 11. Mencit (Mus musculus)……....………... 31
Gambar 12. Skema penelitian………. ... 35
Gambar 13. Bagan alur pembuatan ekstrak daun dewa (Gynura segetum (Lour) Merr)...………. ... 36
Gambar 14.Selisih Berat Badan Mencit Pada Tiap Kelompok Perlakuan pada hari ke 1 terhadap hari ke 10, 20, 25……….…...42
Gambar 15. Limfosit Darah Pheriperal...……...………....….57
Gambar 16. Monosit Darah Pheriperal...58
Gambar 17. Neutrofil Darah Pheriperal...……...………...61
Gambar 19. Rak dan kandang mencit ...………….. ... 89
Gambar 20. Sedian taurin dan sonde ...……….…… 89
Gambar 21. Pemberian taurin dan ekstrak dewa secara oral penyuntikan benzo(a)piren...……….…….. 90
Gambar 22. Serasah dan Pakan Mencit ...………. ... 90
Gambar 23. Mencit yang menderita kanker dibagian tengkuk dan kaki setelah diinduksi benzo(α)piren pada kelompok taurin dosis15,6 mg/BB/hari...………....…. 91
Gambar 24. Mencit yang menderita kanker dibagian tengkuk dan kaki setelah diinduksi benzo(α)piren pada kelompok kontrol positif…….….. 91
Gambar 25. Mencit yang menderita kanker dibagian tengkuk dan kaki setelah diinduksi benzo(α)piren pada kelompok dewa 277,8 mg/BB/hari...….. 92
Gambar 26. Pengukuran berat tubuh mencit……… 92
Gambar 27. Pengambilan darah pada aorta mencit... 93
Gambar 28. Sampel darah pada tabung EDTA... 93
Gambar 29. Penghitungan RBC dan WBC... 94
Penulis dilahirkan di Kotabumi Lampung Utara pada tanggal 2 Maret 1976, anak kedua dari enam bersaudara, dari pasangan bahagia Bapak U.Solichin dan Ibu Siti Amah.
Penulis mengawali pendidikan formal di TK Pertiwi Kotabumi Lampung Utara tahun 1982. Tahun 1982 diterima di SD Xaverius Kotabumi Lampung Utara yang diselesaikan pada tahun 1988. Tahun 1988 diterima di SMP Negeri 1 Kotabumi yang diselesaikan pada tahun 1991. Tahun 1991 diterima di SMA Negeri 1 Kotabumi yang diselesaikan tahun 1994 dan pada tahun yang sama penulis diterima di Universitas Lampung FMIPA Jurusan Biologi Program Studi Biologi.
SANWACANA
Alhamdulillah puji syukur kehadirat Allah SWT karena berkat rahmat dan ridho-Nya penulis dapat menyelesaikan karya kecil yang berjudul
“Respon Eritrosit dan Leukosit Mencit (Mus musculus) Yang Diinduksi
Benzo(α)piren Terhadap Pemberian Taurin Dan Ekstrak Daun Dewa (Gynura
segetum (Lour) Merr)”
Dalam pembuatan dan penyusunan karya ini, tidak sedikit halangan dan rintangan yang penulis hadapi, akan tetapi berkat bantuan serta dukungan dari berbagai pihak maka akhirnya penulis dapat menyelesaikan karya kecil ini. Dalam kesempatan ini penulis ingin menyampaikan ucapan terimakasih yang sebesar-besarnya kepada :
1. Ibu Endang Linirin Widiastuti, Ph.D., selaku pembimbing I dan pembimbing akademik yang telah banyak meluangkan waktu untuk memberikan bimbingan, arahan, ide, saran, dan kritik dengan penuh kesabaran selama penulisan tesis ini.
3. Bapak Dr. Sutyarso, M.Biomed., selaku pembahas, atas saran, kritik, ilmu serta dukungan yang telah diberikan sehingga tugas akhir ini terselesaikan. 4. Bapak Dr. Sumardi, M.Si., selaku Ketua Program Studi Magister Biologi
FMIPA Unila, atas dukungan, saran, kritik serta masukan yang telah diberikan sehingga saya dapat menyelesaikan pendidikan di Magister Biologi FMIPA Unila.
5. Bapak Prof. Suharso, Ph.D., selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
6. Ibu Dra. Nuning Nurcahyani, M.Sc. selaku Ketua Jurusan Biologi FMIPA Universitas Lampung.
7. Ibu Dr. Rochmah Agustrina, S.U. selaku Sekretaris Program Pascasarjana Magister Biologi.
8. Bapak dan Ibu dosen, staf beserta laboran Jurusan Biologi FMIPA Unila atas ilmu dan pengalaman yang telah banyak diberikan kepada penulis. 9. Suamiku (Eka Yantami Aquan) dan Anak-anakku (Salsabilla Suci Aquan,
Fajar Syuhada Aquan, dan Furqon Siddiq Aquan) yang sangat aku sayangi dan cintai, telah bersedia memberikan bantuan materi dan moril, semangat, motivasi dan menjadi tempat curahan hatiku.
10.Keluarga besar yang telah banyak memberikan dukungan kepada penulis, baik berupa materi, dukungan moril dan semangat. Orang tua ku (U. Solichin dan Siti Amah), Umiku (Sri Purnama), Mertua ku
11.Keluarga besar SMA Negeri 2 Kotabumi Lampung Utara.
12.Teman-teman saya tersayang Anata Mashyi Harun, M.Si., Agra Masya, Annisa Agata, M.Si., Arini Pradita.R. M.Si., Elfa V.P. M.Si., Rudi M.Si., Mellinasari, SE., Susila Darmawati, M.Pd., terima kasih atas bantuan moril, kebersamaan, perhatian, dan dukungan kepada penulis.
13.Teman-teman angkatan 2013, Alia Larasati D., M.Si., Annisa Agata, M.Si, Arini Pradita.R., M.Si., Elva Verda P., M.Si., Erika, M.Si., A R.R. Etty, M.Si., Salman Al Farisi, M.Si, terimakasih atas dukungan, kritikan, canda tawa, dan kebersamannya kepada penulis.
14.Semua pihak yang telah banyak membantu dalam proses perkuliahan, penelitian hingga akhir, yang tidak dapat dituliskan satu persatu di tesis ini.
Penulis berharap semoga Allah SWT membalas kebaikan yang telah mereka berikan. Dan semoga tesis ini bermanfaat bagi kita semua.Amin.
Bandar Lampung, Juli 2015 Penulis
DAFTAR TABEL
Halaman
Tabel 1. Klasifikasi dan Data Biologis Mencit (Mus Musculus) ………. . 30
Tabel 2. Bahan dan komposisi pakan mencit ... 36
Tabel 3. Dosis pada tiap kelompok perlakuan ... 37
Tabel 4. Pengaruh berbagai Perlakuan terhadap Jumlah Total Sel Darah Merah(Eritrosit)………45
Tabel 5. Pengaruh berbagai Perlakuan terhadap Jumlah Total Sel Darah Putih (leukosit)……….………49
Tabel 6. Rerata Persentase Diferensiasi Leukosit dari Tiap Perlakuan………...………55
Tabel 7. Jumlah sel Eritrosit Mencit (106sel/μL)………74
Tabel 8. Jumlah sel leukosit Mencit (103sel/μL) ... 74
Tabel 9. Jumlah neutrofil mencit ... 74
Tabel 10. Jumlah limfosit mencit ... 75
Tabel 11. Jumlah eosinofil mencit ... 75
Tabel 12. Jumlah monosit mencit ... 75
Tabel 13. Jumlah basofil mencit ... 75
Tabel 14. Selisih berat tubuh mencit hari ke-1 dengan hari 10 perlakuan ... 76
Tabel 15. Selisih berat tubuh mencit hari ke-1 dengan hari 20 perlakuan ... 76
DAFTAR ISI A.Latar Belakang dan Masalah ... 1
B. Rumusan Masalah ... 7
C.Tujuan Penelitian ... 7
D.Manfaat Penelitian ... 8
E. Kerangka Pikir ... 8
F. Hipotesis ... 12
II. TINJAUAN PUSTAKA A.Darah ... 13
B. Leukosit (Sel Darah Putih) ... 15
C.Sel darah merah (Eritrosit) ... 16
D.Kanker ... 17
E. Leukemia ... 19
F. Kasifikasi leukemia ... 20
1. Perjalanan alamiah penyakit akut dan kronis ... 20
2. Tipe sel dominan yang terlibat limfoid dan myeloid ... 20
3. Jumlah leukosit dalam darah ... 20
G. Pemeriksaan penunjang ... 21
III. METODE PENELITIAN
A.Tempat dan Waktu Penelitian ... 33
B. Alat dan Bahan ... 33
C.Rancangan Percobaan ... 34
D.Parameter ... 34
E. Alur Penelitian ... 35
F. Pelaksanaan ... 35
1. Pembuatan sediaan uji ... 35
2. Pe meliharaan mencit ... 37
3. Makanan dan minuman mencit (Mus musculus) ... 37
4. Induksi karsinogenik terhadap hewan uji dengan benzo(α)piren ... 38
5. Pemberian senyawa uji taurin ... 38
6. Penghitungan sel darah putih (leukosit) ... 37
7. Penghitungan diferensial leukosit ... 37
8. Penghitungan sel darah merah (eritrosit) ... 38
9. Pengamatan berat badan mencit (Mus musculus) ... 38
G.Analisis Data ... 39
IV. HASIL DAN PEMBAHASAN A.Perubahan Berat Tubuh Mencit (Mus musculus) ... 41
B. Pengaruh berbagai perlakuan terhadap jumlah total sel darah merah (eritrosit) ... 45
C.Pengaruh berbagai perlakuan terhadap jumlah total sel darah putih (leukosit) ... 49
D.Analisis persentase diferensiasi leukosit ... 52
V. SIMPULAN DAN SARAN A.Simpulan ... 60
B. Saran ... 61
I. PENDAHULUAN
A.Latar Belakang dan Masalah
Kanker adalah pembentukan jaringan baru yang abnormal dan bersifat ganas (maligne), suatu kelompok sel yang tiba- tiba menjadi liar dan memperbanyak diri secara pesat dan terus menerus (proliferasi) (Huspa, 2009). Kanker dapat disebabkan oleh faktor endogen maupun eksogen. Faktor endogen dapat berupa faktor genetik, penyakit, dan hormon, sedangkan faktor eksogen dapat berasal dari makanan, virus, senyawa-senyawa karsinogenik seperti polusi udara, zat warna, logam-logam karsinogen, dan banyak penyebab lainnya seperti siklofosfamida (Hanahan and Weinberg, 2000).
Menurut Sundaryono (2011), kanker terjadi pada pertumbuhan sel-sel normal melalui proses kesalahan yang berubah menjadi sel-sel ganas yang
2
Perubahan yang umum terutama menurunnya sel eritrosit dan meningkatnya jumlah sel darah putih leukosit secara ganas.
Pertumbuhan dan perkembangan yang tidak normal pada sel-sel darah dapat berubah menjadi sel- sel ganas. Keganasan dari sel-sel darah yang merupakan salah satu jenis penyakit serius adalah leukemia (Lisdawati et al, 2002). Leukemia memiliki sifat ganas pada jaringan darah yang akhirnya dapat menyebabkan kematian. Kekurangan jumlah sel-sel darah merah merupakan kelainan hematologi yang biasa dan sering ditemukan pada pasien kanker. Banyak pasien telah didiagnosis menderita anemia akibat berbagai penyakit kronik, seperti kanker (Syafei, 2009).
Benzo(α)piren adalah salah satu hidrokarbon aromatik polisiklik (PAH) dan ditemukan dimana saja (ubiquitously) yang terdapat di lingkungan (Xue and Warshawsky, 2005). Benzo(α)piren juga ada di dalam beberapa makanan dalam jumlah yang cukup besar seperti daging merah yang dimasak, ayam goreng dengan kulit dan telur goreng (Ronco et al, 2011). Benzo(α)piren bisa mewakili untuk semua PAH dan diurutkan pada Kelas-I oleh Badan
Internasional untuk Penelitian Kanker (IARC, 2010). Benzo(α)piren sama seperti golongan PAH lainnya, merupakan zat yang bersifat tidak mudah bereaksi. Tingkat toksisitas benzo(α)piren tergantung pada bentuk
karbon. Anyakora et al (2008), menjelaskan bahwa di lingkungan,
benzo(α)piren akan berubah menjadi lemak (fat) yang bersifat mudah larut (soluble), masuk dalam tubuh organisme dan terakumulasi.
Secara in vivo, benzo(α)piren telah terbukti dapat menyebabkan tumor pada
setiap model hewan percobaan, baik melalui jalur makanan, pernapasan, maupun kontak pada permukaan kulit. Inisiasi proses karsinogenik dari benzo(α)piren bahkan dapat terjadi pada bagian jaringan yang jauh dari titik
asal paparannya. Penelitian terbaru oleh Gangar et al (2010), induksi zat karsinogen benzo(α)piren pada tikus memperlihatkan efek berat badan dan
hematologi yang signifikan pada jumlah eritrosit, jumlah leukosit, dan
diferensiasi leukosit secara menyeluruh, dan merupakan indikator penting pada
proses karsinogenesis atau tumorigenesis pada tikus. Efek mutagenik dari
benzo(α)piren telah diteliti menggunakan uji mikronukleus (MN) pada sel
eritrosit polikromatik (PCE) dari sumsum tulang femur mencit albino. Mencit
albino diinjeksi dengan larutan benzo(α)piren 0,3% (b/v) sebanyak 0,1 ml pada
daerah tengkuk secara subkutan, sebanyak sepuluh kali dalam interval waktu
satu hari. Ternyata terdapat kenaikan frekuensi mikronukleus eritrosit
polikromatik (MNPCE) yang cukup besar yang menunjukkan bahwa
benzo(α)piren memiliki efek mutagenik dengan tingkat mutagenisitas yang
cukup tinggi (Sumpena, 2009).
Pengobatan kanker secara medis dilakukan dengan terapi penyinaran,
4
yang ideal seharusnya dapat menghabiskan sel kanker tanpa membahayakan jaringan sehat. Namun sampai sekarang belum ditemukan obat yang
memenuhi kriteria demikian (Fahmi dkk,1993). Berbagai macam senyawa telah dikembangkan melawan kanker yang meliputi senyawa-senyawa pengalkalasi, antimetabolit, obat-obat radiomimetik, hormon dan senyawa antagonis. Obat antikanker yang ideal seharusnya cepat membunuh sel kanker tanpa membahayakan jaringan normal. Sampai sekarang belum ditemukan obat yang memenuhi kriteria sehingga perlu dikembangkan obat baru yang mempunyai efek terapi yang baik (Nurrochmad, 2004).
Menurut Marley et al (2013), asam amino (AA) adalah salah satu kelas penting dari molekul sinyal sel, terlibat dalam regulasi ekspresi gen dan kaskade fosforilasi protein. Beberapa asam amino juga sebagian berfungsi
sebagai prekursor hormon sintesis dan sebagai zat nitrogen molekul rendah. Taurin (asam 2-aminoethanesulfonic) adalah β-AA dan asam amino yang paling banyak pada mamalia, yang didistribusikan secara luas di dalam sistem saraf pusat (SSP) dan menempati tempat kedua setelah glutamat dalam
et al., 1998). Penelitian ini membuktikan kandungan taurin pada tubuh
manusia bisa bersifat terapoitik dan protektif terhadap beberapa penyakit.
Menurut Stapleton et al (1998), pada kucing yang yang diberikan taurin
menunjukkan peningkatan jumlah sel mononuclear mutlak, peningkatan respon chemiluminescen, dan fagositosis staphylococcus dibanding dengan kucing
yang tidak diberi taurin. Taurin juga diketahui sebagai zat antioksidan baik secara tidak langsung yaitu dengan menstabilkan membran dan secara langsung yaitu dengan melalui penyerapan HOC1 (Stapleton et al., 1998).
Sebuah penelitian di Irlandia yang dilakukan oleh Bouchier-Hayes et al (1998), telah berhasil menemukan fungsi taurin sebagai antioksidan dari oksidan rokok, dimana taurin dapat mengembalikan atau melindungi keadaan normal pembuluh darah para perokok. Ketika oksidan rokok yang merupakan molekul oksigen dengan elektron tidak berpasangan (Reactive Oxygen Species atau ROS) banyak terdapat dalam pembuluh darah, maka molekul tersebut menjadi
tidak stabil, liar dan radikal. Akibatnya, ROS akan berusaha mencari
pasangannya dengan merebut pasangan elektron molekul lainnya, yang tanpa disadari secara perlahan-lahan akan menimbulkan “plaque” akibat aktivitas makrofag dan terakumulasi menutupi saluran pembuluh darah (foam cell). Apabila sifat oksidan itu semakin reaktif dan sulit untuk dikendalikan, maka untuk menyeimbangkan “keliaran” radikal bebas diperlukan sejumlah
6
Selain itu, taurin dilaporkan dapat menginduksi produksi reduced glutathione (GSH) pada organ yang berbeda (Anand et al., 2011). Induksi ini terhubung
dengan efek perlindungan dari taurin pada glutathione dan tergantung enzim glutathione (Pushpakiran et al., 2004). Di sisi lain, glutathione dan derivatif glutathione yang dipengaruhi oleh taurin, yang berarti bahwa semua senyawa ini memiliki efek protektif dan modulatory di beberapa jaringan (Janaky et al., 2008). Hal ini menunjukkan akumulasi GSH dalam plasma darah di bawah pengaruh kadar taurin. Kehadiran dalam darah sebagai konsekuensi dari akumulasi GSH dalam organ dan diikuti kebocoran pada plasma. Selain itu sumber glutathione dapat dipertahankan karena sifat antioksidan dari taurin dan kemampuannya untuk xenobiotik konjugat (Emudianughe et al., 1983).
Bahkan terdapat penelitian pendukung yang menyatakan taurin yang telah dimodifikasi dengan tembaga (Cu), memiliki kemampuan untuk menghambat kerja proteosme dan menginduksi aktivitas apoptosis pada sel-sel kanker leukemia dan payudara. Taurin sebagai antikanker dimungkinkan melalui antioksidasi, immunomodulasi, peningkatan perbaikan pada DNA dan penghambatan proliferasi sel (Xia Zhang et al., 2008).
kanker dan seluruh bagian tanaman berkhasiat untuk menyembuhkan berbagai macam penyakit (Rivai, 2012). Tanaman ini tergabung dalam kuartet zat anti kanker, yaitu daun dewa yang mengandung alkaloid, flavonoid, saponin, dan tannin (Sundaryono, 2011).
B. Rumusan Masalah
Berdasarkan uraian latar belakang diatas dirumuskan masalah penelitian yaitu apakah pemberian taurin dan daun dewa (Gynura segetum (Lour) Merr) dapat melindungi dan memperbaiki kerusakan sel-sel darah mencit (Mus musculus) yang diinduksi benzo(α)piren?
C. Tujuan Penelitian
8
D. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan manfaat bagi masyarakat sebagai sumber informasi tentang kemampuan taurin yang berpotensi sebagai
antikanker, terutama terhadap kanker darah (leukemia).
E. Kerangka Pemikiran
Kanker adalah penyakit yang menimbulkan kematian kedua setelah jantung. Kanker tumbuh dan berkembang melalui pertumbuhan sel-sel normal yang menyimpang akibat faktor luar dan dalam sehingga sel-sel normal berubah menjadi sel-sel ganas yang berproliferasi cepat dan biasanya terjadi pada semua jaringan, misalnya darah, hati, paru-paru dan organ lain. Sel-sel jaringan darah akan mengalami pembelahan secara terus menerus hingga akhirnya jaringan darah mengalami pertumbuhan yang meningkat. Sel-sel darah yang sering membelah berpotensi terhadap semakin besar terjadinya suatu kesalahan. Perubahan ini awalnya tidak terdeteksi dan akhirnya dapat menyebabkan pertumbuhan abnormal hingga adanya perubahan sel-sel
jaringan darah, yaitu perubahan pada jumlah hingga bentuk sel-sel eritrosit dan leukosit. Demikian juga dengan jaringan organ tubuh lainnya. Abnormalitas pada sel disebabkan oleh pengaruh pemaparan bahan yang bersifat
karsinogenik seperti xenobiotik atau senyawa yang bersifat racun. Salah satu xenobiotik yang cukup akrab dengan kehidupan manusia sehari-hari adalah
aromatik yang digolongkan sebagai senyawa pro karsinogen kuat. Senyawa ini
dijumpai di lingkungan sebagai hasil pirolisis lemak atau sebagai hasil proses
pembakaran yang tidak sempurna, seperti pada daging panggang, sate,
makanan yang diasap, asap rokok dan asap kendaraan bermotor.
Benzo(α)piren terakumulasi dalam darah sehingga menyebabkan terbentuk
reactive oxygen species (ROS) tinggiyang akan mengikis zat antioksidan endogen terjadi stres oksidatif yang memicu kerusakan DNA atau RNA sel normal menjadi sel kanker. Pada fase promosi senyawa benzo(α)piren akan mengakibatkan terjadinya inflamasi sehingga meningkatkan resiko terjadinya kanker dan mendorong yang pertumbuhan kanker memasuki fase progresi. Benzo(α)piren akan menginduksi pertumbuhan kanker pada fase progresi
dengan mendorong terjadinya proliferasi yang tidak terkontrol, invasi, dan metastasis dari sel kanker, yang memicu terbentuknya kanker adalah dengan jalan mengaktifkan sel kanker, mengaktifkan gen tumor penekan p53 yang menyediakan dan memfasilitasi sel tersebut untuk berkembang seperti hiperaktif pertumbuhan dan pembelahan sel, mencegah terjadinya program kematian sel (apoptosis), kehilangan sifat normal dari sel dan mampu bertahan dan berkembang dalam jaringan lingkungannya.
Pada jaringan darah, perubahan yang umum terutama meningkatnya jumlah sel darah putih leukosit secara ganas. Keganasan sel-sel darah leukosit ini
10
selanjutnya memiliki sifat ganas pada jaringan darah dengan mempengaruhi jumlah sel darah merah yang akhirnya dapat menyebabkan kematian.
Kekurangan jumlah darah merah adalah kelainan hematologi yang biasa dan sangat sering ditemui pada pasien kanker. Banyak pasien awalnya telah didiagnosis anemia akibat penyakit kronik, seperti kanker. Obat anti kanker sendiri yang digunakan dalam pengobatan, idealnya seharusnya dapat
menghabiskan sel kanker tanpa membahayakan jaringan sehat, namun hingga saat ini belum ditemukan obat yang memenuhi kriteria demikian.
Pengobatan kanker dengan tanaman obat yang terkandung senyawa flavonoid mempunyai kemampuan menangkap radikal bebas (antioksidasi) yang dapat menyebabkan kanker. Tanaman daun dewa (Gynura segetum (Lour) Merr) adalah tanaman yang mengandung flavonoid.
Taurin dan ekstrak daun dewa diujikan pada penderita leukemia untuk mengetahui efek anti kanker yang terdapat pada keduanya. Dengan menggunakan mencit (Mus musculus) yang telah diinduksi zat karsinogen benzo(α)piren, sampai terjadi nodul pada tengkuk jaringan sub kutan mencit. Selanjutnya pemberian taurin dan ekstrak daun dewa dengan dosis yang telah ditentukan secara oral pada waktu pagi dan sore hari selama 15 hari setelah terdapat nodul pada sub kutan mencit.
12
F. Hipotesis
II. TINJAUAN PUSTAKA
A. Darah
Darah adalah suatu suspensi partikel dalam suatu larutan koloid cair yang mengandung elektrolit (Baldy, 2006). Darah mempunyai fungsi penting dalam sirkulasi. Secara umum fungsi darah adalah sebagai alat transportasi oksigen, karbondioksida, zat gizi, dan sisa metabolisme, mempertahankan
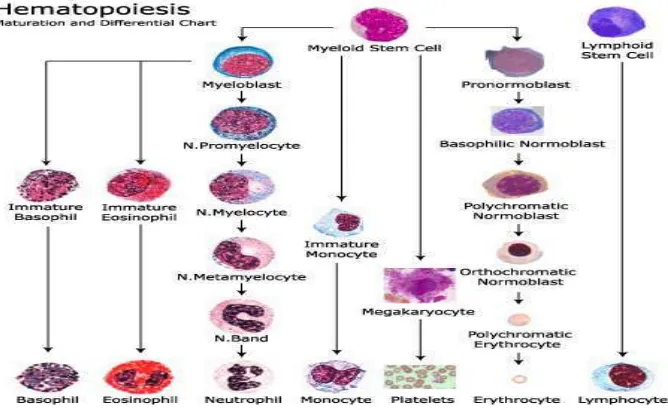
keseimbangan asam basa, mengatur cairan jaringan dan cairan ekstra sel, mengatur suhu tubuh, dan sebagai pertahanan tubuh dengan mengedarkan antibodi dan sel darah putih (Goorha et al, 2003). Sel-sel darah tersebut mempunyai umur tertentu, sehingga dibutuhkan pembentukan sel-sel darah baru yang disebut hematopoesis. Proses hematopoesis dapat dilihat pada Gambar 1.
14
Proses ini berlangsung apabila terjadi pendarahan atau penghancuran sel, yang terjadi pada sumsum tulang, kemudian setelah dewasa bermigrasi ke darah perifer. Terdapat 2 stem sel yang berperan dalam pembentukan sel darah yaitu stem sel mieloid dan stem sel limfoid. Stem sel limfoid terkait dengan thymus dimana sel limfosit dihasilkan. Stem sel mieloid jauh lebih kompleks dari stem sel limfoid. Stem sel mieloid sedikitnya memiliki enam garis keturunan yang berbeda yaitu garis keturunan eritrosit, trombosit, neutrofil, eosonofil, basofil, dan monosit/makrofag. Sel-sel ini terbentuk sebelum menjadi matang
(dewasa) terjadi di sumsum tulang. Tahap akhir garis keturunan mieloid ini terdapat dalam sel darah perifer normal (Wellman, 2010).
Stem sel mieloid jauh lebih kompleks dari stem sel limfoid. Stem sel mieloid sedikitnya memiliki enam garis keturunan yang berbeda, yaitu garis keturunan (sel darah merah) eritrosit, trombosit, monosit, eosinofil, basofil, dan
neutrofil/makrofag. Proses terbentuknya eritrosit, trombosit, monosit, neutrofil, eosinofil, dan basofil sebelum menjadi matur (dewasa) terjadi di dalam sumsum tulang seperti pada (Gambar 1). Tahap akhir dari garis
B. Sel Darah Putih (Leukosit)
Leukosit tidak berwarna, memiliki inti, dapat bergerak secara amoeboid dan dapat menembus dinding kapiler /diapedesis. Jumlah normal 4 × 109 hingga 11 × 109 sel leukosit dalam satu liter darah manusia dewasa yang sehat atau sekitar 7000 - 25000 sel per tetes (Harahap, 2008). Leukosit adalah sel darah yang mengandung inti, disebut juga sel darah putih. Dilihat dibawah
mikroskop sitoplasmanya sel darah putih mempunyai granula spesifik (granulosit), yang dalam keadaan hidup berupa tetesan setengah cair, dalam sitoplasmanya dan mempunyai bentuk inti yang bervariasi. Sedangkan yang tidak mempunyai granula sitoplasmanya homogen dengan inti bentuk bulat atau bentuk ginjal. Granula dianggap spesifik bila secara tetap terdapat dalam jenis leukosit tertentu dan pada sebagian besar precursor (prazatnya) (Effendi, 2003).
Leukosit mempunyai peranan dalam pertahanan seluler dan humoral organisme terhadap zat-zat asing. Leukosit dapat meninggalkan kapiler dengan
menerobos antara sel-sel endotelium dan menembus ke dalam jaringan
16
gambaran granular sehingga disebut granulosit. Granulosit dan monosit melindungi tubuh terhadap organisme penyerang terutama dengan cara
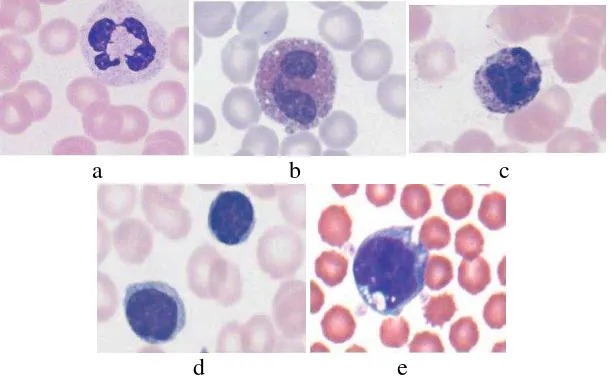
mencernanya yaitu melalui fagositosis. Fungsi pertama sel limfosit dan sel-sel plasma berhubungan dengan sistem imun. Struktur macam leukosit pada darah pheriperal terlihat pada Gambar 2.
a b c
d e
Gambar 2. Diferensiasi Sel Darah Putih (Leukosit) Mencit (Mus musculus) a. Neutrofil b. Eosinofil c. Basofil d. Limfosit mencit (Perbesaran 100x) (Sumber: Themi et al, 2004) e. Monosit mencit (Perbesaran 100x) (Sumber: Weiss and Wardrop, 2010)
C. Sel Darah Merah (Eritrosit)
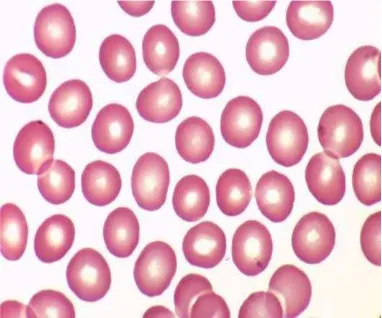
Fungsi utama dari sel darah merah adalah untuk mengangkut HbO2 yang membawa oksigen ke jaringan. Membran permeabel yang menutupi komponen sel darah merah terbuat dari lipid, protein, dan karbohidrat. Perubahan komposisi lipid membran dapat menghasilkan bentuk sel darah merah yang abnormal. Ketidaknormalan membran protein juga mungkin menghasilkan bentuk tidak normal dari sel darah merah. Jumlah eritrosit (RBC) sering digunakan untuk menegakkan diagnosa mengenai penyebab anemia (Thrall, 2004). Struktur sel darah merah dapat dilihat pada Gambar 3.
Gambar 3. Sel-sel darah merah normal secara mikroskopis (Vidinsky, 2011).
D. Kanker
18
sebesar 80-85 %. Radikal bebas dan reaksi oksidasi berantai yang dihasilkan jelas berperan pada proses mutasi ini. Di dalam tubuh pembentukan radikal bebas terjadi pada membran plasma yang banyak mengandung asam lemak mudah sekali teroksidasi menghasilkan berbagai senyawa radikal bebas
(Sundaryono, 2011). Proses oksidasi tersebut menyebabkan kadar asam lemak esensial pada membran plasma menjadi berkurang dan permeabilitas membran terganggu sehingga radikal bebas menjadi makin mudah menerobos masuk ke dalam sel dan mengakibatkan berbagai kerusakan, seperti merusak lisosom, Inti sel dan DNA yang dapat memicu timbulnya kanker (Sundaryono, 2011).
Serangkaian proses berkembangnya kanker disebut karsinogenesis. Karsinogenesis adalah suatu proses terjadinya kanker melalui mekanisme multitahap yang menunjukkan perubahan genetik dan menyebabkan
E. Leukemia
Saat ini, penyakit leukemia menduduki peringkat ketiga di dunia sebagai penyebab kematian akibat kanker yang terutama menyerang anak-anak dan remaja berusia antara 3 – 14 tahun (Lorenzo, 2000). Leukemia umumnya muncul pada diri seseorang sejak dimasa kecilnya, pada sumsum tulang tanpa diketahui dengan jelas penyebabnya telah memproduksi sel darah putih yang berkembang tidak normal atau abnormal. Normalnya, sel darah putih me-reproduksi ulang bila tubuh memerlukannya atau ada tempat bagi sel darah itu sendiri. Tubuh manusia akan memberikan tanda/signal secara teratur kapankah sel darah diharapkan be-reproduksi kembali.
Pada kasus kanker darah (leukemia), sel darah putih tidak merespon kepada tanda/signal yang diberikan. Akhirnya produksi yang berlebihan tidak
terkontrol (abnormal) akan keluar dari sumsum tulang dan dapat ditemukan di dalam darah perifer atau darah tepi (Yuliangga, 2008). Jumlah sel darah putih yang abnormal ini bila berlebihan dapat mengganggu fungsi normal sel lainnya, seseorang dengan kondisi seperti ini (leukemia) akan menunjukkan beberapa gejala seperti; mudah terkena penyakit infeksi, anemia dan
20
F. Klasifikasi Leukemia
1. Perjalanan alamiah penyakit akut dan kronis
Leukemia akut ditandai dengan suatu perjalanan penyakit yang sangat cepat, mematikan dan memburuk. Apabila tidak diobati segera, maka penderita dapat meninggal dalam hitungan minggu hingga hari. Sedangkan leukemia kronis memiliki perjalanan penyakit yang tidak begitu cepat sehingga memiliki harapan hidup yang lebih lama, hingga lebih dari 1 tahun bahkan ada yang mencapai 5 tahun (Yuliangga, 2008).
2.Tipe sel predominan yang terlibat limfoid dan mieloid
Kemudian, penyakit diklasifikasikan dengan jenis sel yang ditemukan pada sediaan darah tepi.
Ketika leukemia memengaruhi limfosit atau sel limfoid, maka disebut
leukemia limfositik.
Ketika leukemia memengaruhi sel mieloid seperti neutrofil, basofil dan
eosinofil, maka disebut leukemia mielositik (Yuliangga, 2008).
3.Jumlah leukosit dalam darah
Leukemia leukemik, bila jumlah leukosit di dalam darah lebih dari normal,
terdapat sel-sel abnormal.
Leukemia subleukemik, bila jumlah leukosit di dalam darah kurang dari
Leukemia aleukemik, bila jumlah leukosit di dalam darah kurang dari
normal, tidak terdapat sel-sel abnormal (Yuliangga, 2008).
G. Pemeriksaan Penunjang
Pemeriksaan darah tepi
Pada LLA ditemukan leukositosis (60%) dan kadang-kadang leukopenia (25%). Pada LMA ditemukan penurunan eritrosit dan trombosit (Yuliangga, 2008).
H. Diagnosis Leukemia
1. Kenaikan jumlah sel Leukosit yang sangat tinggi (3-4 kali nilai normal) harus diwaspadai sebagai tanda adanya pertumbuhan ke arah keganasan. Hal tersebut bisa memicu terjadinya kanker darah atau leukemia (Aryanto, 2014).
2. Dikatakan bahwa apabila di dalam darah jumlah leukosit pada lebih dari 11.000 sel/mm3 disebut leukositosis (menderita penyakit leukemia) dan bila kurang dari 4.000 sel/mm3 disebut leukopenia (Playfair and Chain, 2001). 3. Pada awalnya, pasien sering mengeluh pembesaran limpa, atau keluhan lain
yang tidak spesifik, seperti rasa cepat lelah, badan lemah, demam yang tidak terlalu tinggi, keringat malam, dan penurunan berat badan yang berlangsung lama. Semua keluhan tersebut merupakan gambaran
22
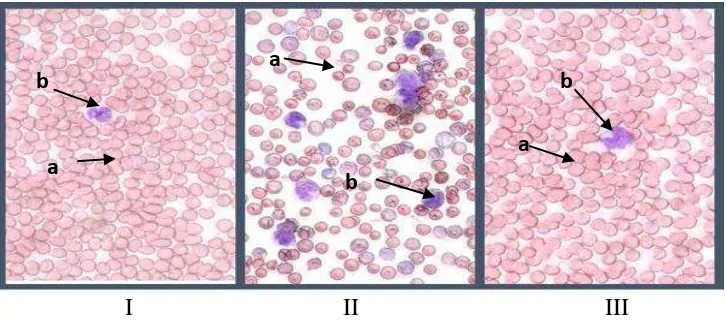
I II III Gambar 4. Gejala Kanker (Vidinsky, 2011)
Keterangan
I. struktur sel darah yang normal
II. struktur sel darah yang terkena kanker
III. struktur sel darah yang telah diterapi obat antikanker a : Eritrosit b : Leukosit
I. Taurin
Taurin juga dikenal sebagai 2-aminoethanesulfonic acid, adalah senyawa yang diproduksi secara alami dalam tubuh manusia. Taurin ditemukan dalam kadar tinggi di otot rangka, jantung, serta dalam sel darah putih dan sistem saraf pusat. Menurut Stapleton et al (1998), taurin adalah setua manusia itu sendiri, yang pada akhirnya ditemukan pada tahun 1827 oleh Tiedemann dan Gmelin pada empedu sapi. Menurut Stapleton et al (1998), taurin merupakan asam amino bebas berkonsentrasi tertinggi dan banyak ditemui dalam berbagai jenis sel pada manusia.
1. Fungsi Taurin
Penelitian taurin mulai digalakkan pada tahun 1975 dengan penjelasan peranan taurin sebagai asam amino esensial terdapat pada kucing, di mana
a
a
a b
kekurangannya menyebabkan degradasi retina dan akhirnya menimbulkan kebutaan. Sejak saat itu mulai banyak peneliti yang menggunakan taurin sebagai objeknya, sehingga didapatkan banyak sekali manfaat taurin. Menurut Stapleton et al (1998), penelitian biologis dengan mengkaitkan taurin hasilnya sangat mengagumkan, termasuk taurin sebagai antioksidan, membran stabilisasi, detoksifikasi, neuromodulation dan regulasi kalsium homeostasis, kekurangan pada awal kehidupan yang akan merugikan integritas fungsional normal retina. Menurut Stapleton et al (1998), banyak sekali bukti yang melibatkan taurin dalam regulasi homeostasis kalsium. Taurin adalah salah satu asam amino bebas yang paling banyak terdapat pada sel leukosit. Taurin telah terbukti menjadi pengobatan yang efektif untuk jantung kongestif dan untuk melindungi terhadap efek buruk dari spesies oksigen reaktif (ROS) (Stapleton et al, 1998).
Beberapa peran taurin berhubungan dengan osmoregulasi, antioksidan, detoksifikasi, dan stimulasi glikolisis dan glikogenesis. Penelitian terbaru menyatakan bahwa kadar taurin diukur dalam darah pada 50 pasien wanita. Kesimpulannya, pengukuran taurin pada serum wanita dengan perdarahan uterus yang tidak teratur bisa membantu deteksi dini transformasi maligna dari dinding endometrium (Agouza dan Nashar, 2011). Penelitian lainnya taurin sebagai antioksidan kuat dan asam amino semi esensial anti inflamasi ekstensif terlibat dalam kegiatan neurologis, bertindak sebagai faktor
neurotropik, sehingga diprediksi taurin dapat sebagai zat antikanker
24
memblokir excitotoxicity glutamat-induced jalur mengarah menjadi efek saraf dan neuromodulation. Seperti pernyataan Stapleton et al (1998) meskipun taurin berhubungan dengan banyak fungsi fisiologis, kondisi patologis, dan tindakan farmakologis, masih relatif sedikit diketahui tentang taurin dari sudut pandang fisiologis, dan biokimia dalam kaitannya dengan mekanisme di mana asam amino yang bisa diambil manfaatnya.
2. Struktur Kimia Taurin dan Biosintesis Taurin
Prospek masa depan untuk penggunaan taurin dalam bidang klinis memang menarik, dikatakan Menzie et al (2013), bahwa defisit taurin telah
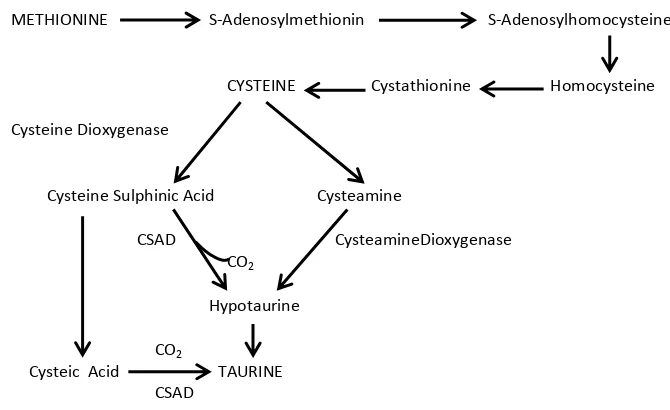
menyebabkan beberapa penyakit SSP, seperti Alzheimer, Parkinson, epilepsi, dan kerusakan neuron retina. 70% jumlah dari asam amino pada sel leukosit pada sistem imun adalah asam amino bebas taurin, apabila jumlah taurin berkurang akan menurunkan fungsional dan jumlah persentase dari sel-sel Polimorfonuklear (PMN) dan mononuclear leukosit (Stapleton et al, 1998). Struktur diagram taurin dapat dilihat pada Gambar 5 dan
biosintesis taurin dapat dilihat pada Gambar 6.
METHIONINE S-Adenosylmethionin S-Adenosylhomocysteine
CYSTEINE Cystathionine Homocysteine
Cysteine Dioxygenase
Cysteine Sulphinic Acid Cysteamine
CSAD CysteamineDioxygenase
CO2
Hypotaurine
CO2
Cysteic Acid TAURINE
CSAD
Gambar 6. Biosintetis Taurin (Menzie et al, 2013).
Gambar 6 menunjukkan jalur biokimia utama dari biosintesis taurin. Metionin diubah menjadi sistein melalui transulfuration. Enzim sistein dioksigenase mengoksida sistein untuk sistein asam sulphinic yang
kemudian decarboxylized untuk membentuk hypotaurine oleh enzim, sistein sulphinic asam dekarboksilase (Csad) Cysteine juga dapat dikonversi.
Untuk panteetheine via koenzim A dan kemudian cysteamine, yang teroksidasi untuk membentuk hypotaurine. Oksidasi hasil hypotaurine ditaurin sebagai asam sulphinic akhir produk. Cysteine juga dapat diubah menjadi asam cysteic yang kemudian dekarboksilasi untuk membentuk taurin (Menzie et al, 2013).
J. Daun Dewa (Gynura segetum (Lour) Merr)
26
antiradang, antipiretik, analgesik dan pembersih darah (Rivai, 2012). Dari beberapa hasil penelitian diketahui bahwa tanaman ini memiliki efek sebagai antikanker, analgesik, dan penurun kadar kolesterol (Putri, 2007). Tanaman daun dewa mempunyai kandungan kimia yang bermanfaat bagi manusia. Daun dewa mengandung alkaloid, saponin, flavonoid, minyak atsiri dan tanin (Rivai, 2012). Berdasarkan telaah data spektrum ultraviolet-sinar, diketahui flavonoid yang berikatan dengan gula pada 3-O dan 7-O serta memiliki gugus hidroksi pada posisi C-5, C-3’dan C-4’, flavonoid tersebut merupakan kuersetin 3,7-O-diglikosida (Rivai, 2012). Struktur daun dewa terlihat pada Gambar 7.
Gambar 7. Daun Dewa (Gynura segetum (Lour) Merr) (Tracker, 2013)
Kandungan flavonoid pada daun dewa juga merupakan antioksidan sehingga mampu menangkal radikal bebas. Dalam penelitian Sofia (2005),
(Sujatmoko, 2002). Antioksidan merupakan inhibitor yang bekerja menghambat oksidasi dengan cara bereaksi dengan radikal bebas reaktif membentuk radikal bebas yang tidak reaktif dan relatif stabil (Sofia, 2005). Kerangka flavonoid dapat dilihat pada Gambar 8.
Gambar 8. Kerangka dasar flavonoid (Sundaryono, 2011)
Kandungan kimia dari tumbuhan daun dewa pada spesies Gynura segetum (Lour) Merr mengandung saponin, minyak atsiri, flavonoid, etanol, alkohol, tanin, senesfilin dan alkaloid (Priadi, 2004).
K. Benzo (α) piren
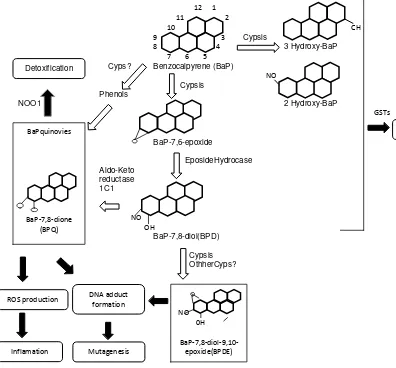
28
Gambar 9. Struktur Benzo(α)piren (Brown et al, 2009).
12 1
Gambar 10. Proses metabolime benzo(α)piren dalam tubuh (Uno dan Makishima, 2009)
Pada tubuh yang memiliki cyctochrome P450 1A1, adanya benzo(α)piren 7,8-trans-diol ini ternyata mengakibatkan terjadinya reaksi lain. Benzo(α)piren
7,8-trans-diol merupakan substrat bagi cyctochrome P450 1A1, sehingga
terjadi oksidasi yang menghasilkan benzo(α)piren 7,8-trans-diol, 9,10-oxide,
Detoxification
BaPquinovies
BaP-7,8-dione (BPQ)
ROS production DNA adduct
yang memiliki sifat mutagenik tinggi. Pada metabolisme dalam sel,
benzo(α)piren 7,8-trans-diol, 9,10-oxide berinteraksi dengan guanine residue
DNA. Mutagenic diol epoxide ini masuk ke dalam retikulum endoplasma atau ke nukleus dan berinteraksi dengan DNA, sehingga menyebabkan struktur kimia DNA berubah (DNA adducts) (Walker, 2009). Penelitian Qian et al (2014), menyatakan benzo(α)piren membahayakan dengan menginduksi kerusakan DNA dan stres oksidatif .
Dalam studi sebelumnya, penemuan Arylhydrocarbon receptor (AHR)
mengikat benzo(α)piren ke dalam tubuh dan permukaan sel, aktivasi transkripsi sitokrom P450, dalam pembentukan metabolit utama benzo(α)
piren-diol-epoxidedeoxyribonucleic acid (BPDE) dan spesies oksigen reaktif (ROS)
(Wang et al, 2013) dan kedua zat yang benzo(α)piren memiliki mediator utama toksisitas. ROS-dimediasi stres oksidatif in vivo, menyebabkan peradangan, apoptosis melemahkan resistensi kekebalan tubuh dan ketidakstabilan genomik dan reaksi yang merugikan lainnya (Hananan and Weinberg, 2011). BPDE dibentuk dengan mengikat DNA adduct, BPDE-DNA memblokir
penggabungan DNA polymerase dan RNA polymerase sehingga memicu pembentukan sel-sel kanker (John et al, 2012).
Menurut Akram (2012), adanya akumulasi benzo(α)piren (PAH) membentuk spesies oksigen reaktif (ROS) melalui pembentukan kuinon oleh dihydrodiol
dehydrogeneses, menuju kearah pembentukan sel-sel kanker. Pemaparan zat
30
disamping itu menimbulkan komplikasi patologi sekunder selain proses karsinogenesis yaitu adanya toksisitas hematologi (Gangar et al, 2010). Pada penelitian Gangar et al (2010), tikus yang diinduksi benzo(α)piren mengalami penurunan berat badan dibanding kelompok perlakuan yang diberi zat
kemopreventif ekstrak daun Azadirachta indica disebabkan efek negatif benzo(α)piren dalam proses karsinogenesis atau tumorigenesis, sehingga
menurut Gangar et al (2010), pengukuran berat badan, penghitungan sel darah merah (RBC), penghitungan sel darah putih (WBC), dan jumlah persentase diferensial leukosit merupakan parameter penting untuk mengetahui sejauh mana proses perkembangan sel-sel kanker akibat induksi zat karsinogen benzo(α)piren dan keberhasilan pengobatan zat antikanker.
L. Mencit (Mus musculus)
Hewan coba yang digunakan pada penelitian ini yaitu mencit. Mencit (Mus musculus) telah digunakan sebagai subyek penelitian sejak abad ke-19. Alasan
penggunaan mencit sebagai hewan coba yaitu memiliki potensial reproduksi yang tinggi, masa kebuntingan yang singkat, jangka hidup yang pendek, berukuran kecil, harga relatif murah, dan mudah dipelihara (Sirois, 2005). Berat badan mencit berbeda-beda untuk tiap individu. Mencit laboratorium biasanya mengkonsumsi pakan yang disediakan dalam bentuk pelet dan
yang ada pada waktu ini merupakan turunan mencit liar sesudah melalui peternakan selektif (Yuwono, 2009). Mencit merupakan hewan yang jinak, lemah, mudah ditangani, takut cahaya, dan aktif pada malam hari. Mencit yang dipelihara sendiri makannya lebih sedikit dan bobot lebih ringan dibanding mencit yang dipelihara bersama-sama dalam satu kandang, kadang-kadang mempunyai sifat kanibal. Temperatur ruangan untuk pemeliharaan mencit berkisar antara 20-25° C. Reproduksi mencit yang cepat membuat hewan ini menjadi mudah ditemukan dan dikembang biakan. Oleh karena itulah mencit sering sekali menjadi hewan percobaan oleh para peneliti atau ahli biologi. Mencit juga memiliki julukan lain yaitu hewan eksperimen (Soegijanto dkk, 2003). Mencit (Mus musculus) terlihat pada Gambar 11.
32
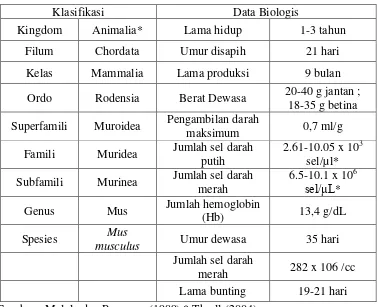
Tabel 1. Klasifikasi dan Data Biologis Mencit (Mus Musculus)
Klasifikasi Data Biologis
Kingdom Animalia* Lama hidup 1-3 tahun
Filum Chordata Umur disapih 21 hari
Kelas Mammalia Lama produksi 9 bulan
Ordo Rodensia Berat Dewasa 20-40 g jantan ; 18-35 g betina Superfamili Muroidea Pengambilan darah
maksimum 0,7 ml/g
Famili Muridea Jumlah sel darah putih
2.61-10.05 x 103 sel/µl* Subfamili Murinea Jumlah sel darah
merah
6.5-10.1 x 106 sel/μL*
Genus Mus Jumlah hemoglobin
(Hb) 13,4 g/dL
Spesies Mus
musculus Umur dewasa 35 hari
Jumlah sel darah
BAB III. METODE PENELITIAN
A. Tempat dan Waktu
Penelitian ini dilakukan di Laboratorium Biologi Molekuler Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung untuk pemeliharaan mencit, pengukuran berat badan dan pembuatan sediaan uji. Sedangkan pembedahan mencit, proses pembuatan dan penghitungan diferensiasi leukosit, penghitungan jumlah eritrosit dan jumlah leukosit dilakukan di Balai Penyidikan dan Pengujian Veteriner (BPPV) Regional III, Bandar Lampung. Penelitian dilaksanakan pada bulan Desember 2014 sampai dengan bulan Februari 2015.
B. Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah pipet Thoma leukosit, kamar hitung, mikroskop, gelas objek, spatula, blood counter tabulator, bak pemeliharaan mencit, tempat minum mencit, neraca analitik, sentrifugator, dan syiringe. gelas kimia (2 L), corong pisah, gunting, pipet tetes, plat tetes,
erlenmeyer 100 ml, gelas ukur 25 mL, kertas saring, blender, corong kecil, rotary evaporator, neraca analitik, hot plete, kandang mencit, tabung EDTA,
34
Bahan yang digunakan adalah mencit DDY jantan yang berumur 5-7 minggu dengan berat tubuh ± 30 g, mencit diperoleh dari bagian Non Ruminansia dan Satwa Harapan, Institut Pertanian Bogor (IPB), Jawa Barat, air untuk
minuman mencit dan pelarut taurin, senyawa taurin, BaP, minyak jagung sebagai pelarut BaP, daun dewa, etanol teknis larutan Hayem (Na Cl 1 g + Na2SO4 5 g + HgCl20,5 g + aquadest 200 mL), larutan truk (asam asetat 13 mL + gentiana violet 21 mL + akuades100 mL), taurin, Giemsa, garam fisiologis (Na Cl 0,9%).
C. Rancangan Percobaan
Penelitian dilaksanakan dalam rancangan acak lengkap. Pengujian pada mencit dilakukan secara in vivo. Mencit dibagi menjadi 5 kelompok perlakuan,
masing-masing perlakuan terdiri dari 5 ekor sebagai ulangan. Kelompok I (diberi 0,2 ml minyak jagung dan diberi akuades sampai akhir masa
penelitian), II (diinduksi dengan BaP tanpa pemberian bahan uji), III (sebelum diinduksi BaP, diberi dosis taurin 7,8 mg/BB/hari selama dua minggu), IV (Setelah diinduksi BaP, diberi taurin dosis 15,6 mg/BB/hari), V (Setelah diinduksi BaP, diberi antikanker ekstrak daun dewa 277,8 mg/BB/hari).
D. Parameter
E. Alur Penelitian
Mencit umur 5 – 7 minggu, berat badan ± 20 gram
Adaptasi pakan standar ( ad libitum ) sampai akhir penelitian
Induksi dengan BaP dengan dosis 0,3 mg/BB/hari setiap hari selama 10 hari secara subkutan kemudian dilanjutkan dengan
pemberian zat uji selama 15 hari
Penentuan dosis dan pemberian senyawa taurin serta seduhan daun dewa dengan dosis 277,8 mg/BB/hari.
Pemberian zat uji taurin dengan dosis 7,8 mg/BB/hari (setiap hari, pagi dan sore menjadi 15,6 mg/BB/hari selama 15 hari)
Penghitung berat badan dilakukan dikandang.
Pengambilan sampel jumlah eritrosit, jumlah leukosit dan jumlah macam leukosit mencit di laboratorium.
Gambar 12. Skema penelitian
F. Pelaksanaan
1. Pembuatan Sediaan Uji
36
Penentuan dosis ekstrak daun dewa dalam penelitian ini mengacu dosis ekstrak daun sirsak yang diberikan pada tikus, yaitu 106,84615 g/BB/hari (Dewi, 2007). Dosis ekstrak daun dewa pada mencit dihitung dengan menggunakan tabel konversi manusia ke mencit adalah 0,0026, sehingga diperoleh dosis seduhan daun dewa untuk mencit, yaitu 106,84615 x 0,0026 = 0,27779 g/BB/hari sehingga diperoleh 277,8 mg/BB/hari (Ngatidjan, 1991).
Gambar 13. Bagan alur pembuatan ekstrak daun dewa.
Daun dewa yang telah halus dimaserasi selama 24 jam dengan pelarut etanol 96%.
Ekstrak yang dihasilkan disaring dengan corong buncher
Ekstrak yang diperoleh dipekatkan dengan menggunakan rotary evaporator pada suhu 90oC sampai diperoleh ekstrak kental.
Menyiapkan daun dewa
Dilakukan penyortiran dengan mengambil daun terbaik
Daun dewa yang telah disortir kemudian dicuci dengan air mengalir
Daun dewa yang sudah dicuci kemudian dikeringkan pada open dengan dengan suhu 30-50oC. Dalam pengeringan ini hendaknya
dihindarkan dari panas matahari langsung.
2. Pemeliharaan Mencit
Mencit diaklimasi selama 15 hari diberi makanan dan minuman yang sama secara teratur. Pada tahap ini dilakukan pengamatan terhadap keadaan umum dan berat tubuh mencit. Mencit yang sakit tidak diikutsertakan dalam percobaan. Mencit ditempatkan pada lingkungan kandang dengan ventilasi yang cukup serta penyinaran yang cukup dimana lamanya terang 14 jam dan lama gelap 10 jam.
3. Makanan dan Minuman Mencit
Makanan mencit berupa pakan pelet yaitu comfeed BR II . yang ditunjukkan pada Tabel 2.
Tabel 2. Bahan dan komposisi pakan mencit
38
Minuman mencit berupa air mineral yang diberikan melalui botol gelas minuman. Makanan dan minuman mencit diberikan secara ad libitum (sampai kenyang).
4. Induksi Karsinogenik terhadap Hewan Uji dengan BaP
Induksi karsinogenik dilakukan dengan cara menyuntikkan larutan BaP pada jaringan subkutan mencit di bagian tengkuk. BaP 0,3 mg dilarutkan dalam 0,2 ml minyak jagung. Semua kelompok diinduksi dengan BaP selama 10 hari kemudian dilanjutkan dengan pemberian zat uji selama 15 hari (Sugitha dan Djalil, 1989). Kemudian ditunggu sampai adanya kanker, yaitu munculnya benjolan (nodul) di bagian tengkuk. BaP diberikan selama 10 hari karena sel kanker akan tumbuh setelah terinduksi antara 9-13 hari. Pada periode ini terlihat dan terasa perubahan pada tengkuk dan kaki mencit (Juliyarsi dan Melia, 2007). Untuk kontrol, mencit tidak diinjeksi BaP namun injeksi dengan pelarut BaP, yaitu 0,2 ml minyak jagung.
5. Pemberian Senyawa Uji Taurin
Tabel 3. Dosis pada tiap kelompok perlakuan
Kelompok Perlakuan Jumlah
mencit
I (kontrol positif)
Diberi 0,2 ml corn oil dan selanjutnya hanya diberi akuadest sampai akhir masa penelitian.
5
II (kontrol negatif) Diinduksi dengan BaP tanpa pemberian bahan uji.
5
III (preventif)
Diberi taurin dengan 7.8 mg/BB/hari dimulai sejak dua minggu sebelum
induksi BaP sampai akhir masa penelitian.
5
IV (Kuratif)
Setelah diinduksi BaP, dilanjutkan pemberian taurin dengan dosis 7.8
g/BB/hari (2 x pagi dan sore)sampai akhir masa penelitian
5
V (Kuratif)
Setelah diinduksi BaP, dilanjutkan diterapi dengan obat antikanker ekstrak daun dewa (Gynura segetum (Lour)Merr) dosis 277,8 mg/BB /hari.
5
6. Analisis Penghitungan Jumlah Total Sel Darah Putih (Leukosit)
Penghitungan jumlah leukosit dilakukan dengan menggunakan pipet Thoma leukosit. Sampel darah yang diberi anti koagulan EDTA dihisap dengan pipet sampai tanda “0,5”. Pipet kemudian dicelupkan ke dalam larutan Turk dihisap sampai tanda “11” sehingga diperoleh pengenceran 1 : 20. Pipet
40
7. Analisis Macam Sel Darah Putih (Leukosit)
Sampel darah segar diteteskan pada gelas obyek dan dibuat preparat apus. Selanjutnya, setelah kering preparat apus tersebut difiksasi dengan metanol selama 3-5 menit kemudian dikering anginkan. Preparat kemudian diwarnai dengan larutan giemza dengan pengenceran 1 : 9 selama 30 menit (pada pH bufer fosfat 6, 8-7, 2). Selanjutnya preparat dicuci dengan aquades dan dibiarkan mengering di atas rak. Setelah kering preparat diperiksa di bawah mikroskop dengan perbesaran 100x dihitung setiap jenis leukosit
menggunakan blood counter tabulator. Sel yang dihitung paling sedikit 100 sel dan dilakukan perhitungan persentase jenis leukosit. Angka yang
diperoleh merupakan jumlah relatif masing-masing jenis leukosit dari seluruh jenis leukosit (Tambur, 2006).
8. Analisis Penghitungan Jumlah Total Sel Darah Merah (Eritrosit) Pengamatan eritrosit menggunakan haemositometer yang terdiri dari dua komponen yaitu kamar hitung (counting chamber) dan pipet pengencer. Kamar hitung yang dipakai merupakan tipe “imporeved chamber” dan pipet
sampai batas 0,5 atau 1. Hisap larutan pengencer sampai angka 101, suspensi dikocok sampai benar-benar homogen (larutan menjadi berwarna merah di dalam tabung). Kamar hitung dan gelas penutup dibersihkan, kemudian gelas penutup dipasangkan di atas kamar hitung sedemikian rupa sehingga apabila dibalik gelas penutup tidak terjatuh. Tetes pertama suspensi darah dibuang terlebih dahulu, setelah itu tetes darah berikutnya diteteskan pada bagian pinggir gelas penutup. Dihitung jumlah eritrosit 5 kotak kecil pada kotak besar di tengah, dihitung dengan rumus :
Jumlah sel darah merah (DM) =Ne x p x 50
Keterangan : Ne : Jumlah eritrosit dalam satu kotak menegah p : Pengenceran
9. Pemeriksaan Berat Badan Mencit pada Tiap Perlakuan
Penghitungan berat badan mencit dimulai dari hari pertama, hari ke 10, hari ke 20 dan hari ke 25. Hasil selisih berat badan yang dihitung dibuat grafik dengan menggunakan histogram batang.
G. Analasis Data
64
KESIMPULAN DAN SARAN
A.KESIMPULAN
Berdasarkan hasil penelitian, dapat disimpulkan :
1. Taurin mampu berfungsi sebagai preventif dan terapoitik terhadap sel-sel darah yang diinduksi BaP.
2. Dosis taurin yang cukup efektif dalam mengurangi kelainan hematologi mencit yaitu dosis 7,8 mg/BB/hari.
3. Ekstrak daun dewa dengan dosis 277,8 mg/BB/hari terbukti cukup efektif mengurangi kelainan pada sel-sel darah mencit.
4. Kemampuan taurin sebagai preventif dan terapoitik lebih baik dibanding ekstrak daun dewa.
B.SARAN
DAFTAR PUSTAKA
Akram. 2012. Mekanisme Kemopreventif Ekstrak Heksan Biji Jinten Hitam (Nigella sativa Lor) Pada Tikus Sprague Dawley Diinduksi 7,12
DimethylBenz(a)antracene : Kajian Antioksidan dan Immunomodulator. Disertasi. Universitas Gadjah Mada.
Agouza, EL dan EL.Nashar, 2011. Serum Taurine as a Marker of Endometrial Cancer. The Open Women’s Health Journal, 2011, 5, 1-6.
Alim, 2013. Mencit (Mus Musculus) dan Klasifikasinya,
http://www.biologi-sel.com/2013/10/mencit-mus-musculus-dan-klasifikasinya.html. 23 Februari 2015.
AML (American Medical Laboratory), 2013. Mouse Hematology [Internet]. [diunduh 4 Maret 2013]. Tersedia pada: http://en.aml-vet.com/animal-species/mouse/hematology.
Anand, P, D.Rajakumar, M.Jeraud, AJ.Felix, T. Balasubramanian. 2011. Effects of taurine on glutathione peroxidase, glutathione reductase and reduced glutathione levels in rats. Pak. J. Biol. Sci. 14: 219-225.
Anyakora, C, M. Arbabi, dan H. Coker. 2008. A screen for benzo(a)pyrene in fish samples from crude oil polluted environments. American Journal of
Environmental Sciences, (2): 145-150.
Aryanto. 2014. Gambar sel leukosit abnormal http://www.obatkankerdarah.info/ Penyakit kanker darah dan obatnya. 12 Desember 2014.
Asha, K.K. 2009. Biochemical Studies on the Protective Effect of Taurine on Experymentally Induced Fulminat Hepatic Failure in Rats. Tesis.Cochin University. India.
Aspinall V and M.O‟Reilly. 2004. Introduction to Veterinary Anatomy and Physiologi. London (UK): Elsevier. 86-87.
66
Baldy CM. 2006. Gangguan Sistem Hematologi di dalam: Patofisiologi, Konsep Klinis Proses Proses Penyakit: Alih Bahasa. Brahm U; Editor Edisi Bahasa Indonesia. Huriawati, Hartanto et al. ed-6. Jakarta: EGC. Hlm 247. Bouchier-Hayes D., H.P. Redmond,P.P. Stapleton, P. Neary,. 1998.
Immunonutrition: The Role of Taurine.Nutrition 14:599-604.
Brown, W. H., C. S. Foote, B. L. Iverson, dan E. V. Anslyn. 2009. Organic Chemistry. USA, Brooks/Cole Cengage Learning.
Calabresi, P. and B. A.Chabner,2001 “Chemotherapy of Neoplastic Diseases” in Goodman, L. S. and A. Gilman, The Pharmacological Basic of
Therapeutics, 10th Edition, The Mc Graw-Hill Companies Inc., New York.
Craig, W.J. 2002. Vegetarian Phytochemicals: Guardians of Our Health, a Continuing Education Article. Available from:
http://www.Andrews.edu/NUFS/phyto.htlm Accessed at 03/16 2009.
Dalimartha, S. 1999. Atlas Tumbuhan Obat Indonesia. Jilid I. Jakarta: Trubus Agriwidya.
Dewi, S.P. 2007. Anatomi Ocimum sanctum.Tanaman Obat Indonesia. http://toiusd.multiply.com/journal/item/110/ Ocimum_sanctum-068114098. 25 Februari.2009.
Effendi, Z. (2003). Peran Leukosit Sebagai Anti Inflamasi Alergik DalamTubuh. Bagian Histologi Fakultas Kedokteran Universitas Sumatra Erlinger Thomas P. 2004. WBC Count.
Emudianughe, TS, J.Caldwell, RL.Smith. 1983. The utilization of exogenous taurine for the conjugation of xenobiotic acids in the ferret. Xenobiotica. 13: 133-138.
Evans, W. J. (2000) Vitamin E, vitamin C, and exercise. Am J Clin Nutr, 72,52S - 647S.
Fahmi, U., S. Syamsudin dan N. Akbar, 1993. ” Perilaku Hidup Sehat
Mengurangi Resiko Kanker”, Proceeding : 16 thn Yayasan Kanker
Indonesia, Jakarta.
Fajrunni‟mah, R. 2011.Pengaruh Pemberian Jus Noni terhadap Selisih Jumlah. Leukosit, Jumlah Neutrofil, dan Kadar Alkalifosfatase pada Tikus Wistar. Tesis. UNAIR.Surabaya.
Faust, R. A., dan P. Reno. 1994. Toxicity Summary for Benzo[a]pyren. Health Sciences Research Division Oak Ridge National Laboratory Department of Energy, Oak Ridge, Tennessee.
Gangar,S. C.Sandhir,R.Koul,A .2010. Effects of Azadiracha indica on certain hematological parameters during benzo(a)pyrene induced murine forestomach tumorigenesis. European Journal of Medical and
Pharmacological Sciences. Punjab University. Chandigarh (India).
Ganong WF. 1983. Review of Physiology. 11th Ed. California. Lange Medical Publication. pp 414-443.
Gershwin ME, German JB, Keen CL. 2000. Nutrition and Immunology Principles and Practice. Human Press.
GoorhaYK, MP.Deb, LCT. Chatterjee, CPS.Dhot, BRS.Prasad. 2003. Artifical blood. Medical Journal Armed Forces India 59 : 45-50.
Halliwell, B and Gutteridge, J.M.C., 2000, Free Radical in Biology and Medicine, Oxford University Press, NewYork.
Hanafiah, A.K. 2011. Rancangan Percobaan : Teori dan Aplikasi. PT. Raja Grafindo Persada. Jakarta.
Hanahan, D. and R.A.Weinberg. 2000. The Hallmark of Cancer. Cell. Vol 100:57-70.
Hanahan D,and R.A. Weinberg.2011.Hallmarks of cancer: the next generation[J]. Cell, 144(5):646-674.
Harahap N. S. (2008). “Pengaruh Aktivitas Fisik Maksimal Terhadap Jumlah Hitung dan Jenis Leukosit pada Mencit jantan (Mus musculus L ) “. USU e-ropository. Medan.
Hartono A, dan Budiwiyono, (2006). Pengaruh Stres Akibat Cemas Ujian Semester Terhadap Jumlah Lekosit Mahasiswa Fakultas Kedokteran Universitas Diponegoro Angkatan 2001, Media Medika Muda. Hembing. 2005. Sehat Dengan Daun Dewa.
http://www.kompas.co.id/kesehatan/news/0207/08/011205.htm. 20
September 2011.
Herwindriandita, Siti Kusmardiyani, As‟ari Nawawi., 2006. Telaah Fitokimia Daun Dewa. Bandung : ITB.
68
Hutomo, Rahadi, Sutarno, Winarno, Kusmardi. 2005. Uji Antimalaria Ekstrak Buah Morinda citrifolia dan AktivitasMakrofag pada Mencit (Mus musculus) setelah Diinfeksi Plasmodium berghei. Surakarta: Biofarmasi Jurusan Biologi FMIPA UNS.
IARC. 2010. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Some Non-heterocyclic Polycyclic Aromatic Hydrocarbons and Some Related Exposures. Lyon, France.
Islambulchilar M, I. Asvadiz , Sanaat Z, Esfahaniz A, Sattari MR. 2011. Effect of Taurine on Febrile Episodes in Acute Lymphoblastic Leukemia. Adv Pharm Bull, 2015, 5(1), 103-108.
Jain NC. 1993. Essentials of Veterinary Hematology. 1st ed. Philadelphia, USA: Lea & Febiger; 1993. pp. 295–306. 21. Stockham SL, Scott MA.
Janaky, R, CA Shaw, SS Oja, P. Saransaari. 2008. Taurine release in developing mouse hippocampus is modulated by glutathione and glutathione
derivatives. Amino Acids. 34:75-80.
John K, MM. Pratt, FA Beland.2012. Benzo[a]pyrene (BP) DNA adduct
formation in DNA repair-deficient p53 haploinsufficient [Xpa(-/-)p53(+/-)] and wild-type mice fed BP and BP plus chlorophyllin for 28 days[J]. Carcinogenesis, 2012, 33(11): 2236-2241.
Juliyarsi, I. dan S, Melia. 2007. Dadih Susu Sapi Mutan Lactococcus lactis Sebagai Food Healhty Dalam Menghambat Kanker. Artikel Penelitian
dosen muda.Universitas Andalas.Padang.
Levy J. 1998.Immunonutrition: the pediatric experience. Nutrition. ;14(7):641-7. Lisdawati, V.2002. Brine Shrimp Lethality Test (BSLT), Bioasai Antikanker
invitro dengan Sel Leukemia L1210, dan Isolasi serta Penentuan Struktur Molekul Senyawa Kimia dari Buah Mahkota Dewa [Phaleria macrocar (Scheff) Boerl.], Jakarta, Tesis Program Pascasarjana Program Studi Ilmu Kefarmasian, Departemen Farmasi – FMIPA UI.
Lorenzo, J., 2000. Interaction Between Immune and Bone Cells: New Insights with Many Remaining Questions, The Journal of Clinical
Lodish H., A. Berk,P. Matsudaira,C.A. Kaiser,M. Krieger, M.P.Scott, S.L. Zipursky,J. Darnell. 2000. Molecular Cell Biology, 5th ed. WH Freeman: New York.
Malole MBM, dan CSU Pramono. 1989. Penggunaan hewan-hewan percobaan di laboratorium. Pusat Antar Universitas Bioteknologi Institut Pertanian Bogor.
Mangan, Y. 2003. Cara Bijak Menaklukan Kanker. Jakarta: Agromedia. Marley, Helfand, dan Edris, 2013. The effects of taurolidine alone and in combination with doxorubicin or carboplatin in canine osteosarcoma in
vitro. BMC Veterinary Research 2013, 9:15.
Menzie, Prentice and Wu. 2013.Neuroprotective Mechanisms of Taurine againstIschemic Stroke. Brain Sci. 2013, 3, 877-907;
doi:10.3390/brainsci3020877.
Nebert, DW, Z Shi, M Gálvez-Peralta,S Uno, and N Dragin.2013. Oral Benzo[a]pyrene: Understanding Pharmacokinetics, Detoxication and Consequences––Cyp1 Knockout Mouse Lines as a Paradigm. Molecular Pharmacology Fast Forward.DOI: 10.1124/mol.113.086637.
NIOSH (National Institute for Occupational Health and Safety).2005.
Pocket Guide to Chemical Hazards. Department of Health and Human Services. Centers for Disease Control and Prevention. National Institute For Occupational Health and Safety. Cincinnati, USA, September 2005. Ngatidjan. 1991. Petunjuk Laboratorium: Metode laboratorium Dalam
Toksikologi. Pusat Antar Universitas Bioteknologi Universitas Gajah Mada. Yogyakarta.
Nugraha, L.S.A. 2011. Cara dan Rute Pemberian Obat Pada Hewan Percobaan Mencit. Akademi Farmasi Theresiana. Semarang.
Nurrochmad, 2004. Pandangan Baru Kurkumin dan Aktivitasnya sebagai Antikanker. Biofarmasi 2 (2): 75-80, Agustus 2004, ISSN: 1693-2242. Playfair, J.H.L. and B.M. Chain. 2001. Immunology at a Glance Seventh edition.
Blackwell Publishing Company. London: 8-63.
70
Pushpakiran, G, Mahalakshmi, K, Anuradha, CV. 2004. Protective effects of taurine on glutathione and glutathione-dependent enzymes in ethanol-fed rats. Pharmazie. 59: 869-872.
Putri, C.A.R. 2007. Efek Infutum Daun Dewa (Gynura segetum [Lour.] Merr) Terhadap Hambatan Respon Rasa Nyeri..Thesis. Universitas Airlangga.
Surabaya.
Qian Ba, Junyang Li, Chao Huang, Hongling Qiu, Jingquan Li, Ruiai Chu, Wei Zhang, Dong Xie, Yongning Wu, and Hui WangHui W., 2014. Bahaya kesehatan Mekanisme Pembangunan dan benzo (a) pyrene. Shanghai Institutes untuk Biological Sciences, Akademi Ilmu Pengetahuan Cina Institut Nutrisi Pusat Penelitian Keamanan Pangan
Raskin RE, and KJ Wardrop. 2010. Species Specific Hematology. di dalam: Schlams Veterinary Hematology. Sixth Edition. editor Douglas J weiss, K Jane Wardrop. USA: Blackwell Publishing Ltd. hal: 85.
Riyani, E. 2011. Benzo(α)piren vs DNA/RNA.
http://unpredictable-science.blogspot.com/2011/11/benzoapyrene-vs- dnarna.html. 23 Maret 2015.
Rivai, H.2012. Identifikasi Senyawa Antioksidan Dari Daun Dewa (Gynura pseudochina (Lour.) DC). Jurnal Sains dan Teknologi Farmasi, Vol. 17, No. 1, 2012, hal 84-91.
Ronco, A. L., De Stefani, E., Correa, P., Deneo-Pellegrini, H., Boffetta, P., acosta, G. & Mendiaharu, M. 2011. Dietary benzo[a]pyrene, alcohol drinking, and risk of breast cancer: a case-control study in Uruguay. Asian Pac. J.
Cancer Prev, 12, 1463-7.
Saleh AM, C.Vijayasarathy, L. Masoud, L.Kumar, A.Shahin, A.Kambal, 2003. Paraoxon induces apoptosis in EL4 cells via activation of mitochondrial pathways. Toxicol. Appl. Pharmacol. 190(1): 47-57.
Saputra, K. Maat, S., Soedoko, R, 2002. Terapi Biologi Untuk Kanker. Airlangga University Press : Surabaya.
Shao, A., and J.N. Hathcock. 2008. Risk assessment for the amino acids taurine, l-glutamine and l-arginine. Regul Toxicol Pharmacol 50(3) : 376-399. Sinha M, P. Manna and P.Sil, 2007. Amelioration of galactosamine-induced
nephrotoxicity by a protein isolated from the leaves of the herb, Cajanus indicus Complementary and Alternative Medicine; 7: 11-14.
Soegijanto, S, F.A. Ratam,Soetjipto, K Sudiyana, Y Priyatna,2003.Uji Coba Vaksin Dengue Rekombinan pada Hewan Coba Mencit,Tikus, Kelinci dan Monyet. Sari Pediatri, Vol. 5, No. 2, September 2003: 64 – 71.
Sofia.D. 2005. Antioksidan dan radikal bebas. http://www.chem-istry.org/artikel kimia/berita/antioksidan_dan_radikal_bebas/. 5 Maret 2015.
Stapleton, P.Philip, O'Flaherty, Lean, Redmond, Paul, Boucher Hayes,
David J. 1998. Neuroprotective Mechanisms of Taurine against Ischemic Stroke. brain sciences ISSN 2076-3425.
Sujatmoko, 2002. Peranan Antioksidan Terhadap Kesehatan.
http://www.mailarchive.com/[email protected]/ms g010617.html. 20 September 2011.
Sumpena, Y. 2009. Uji Mutagenisitas Benzo (α) piren dengan Metode Mikronukleus pada Sumsum Tulang Mencit Albino (Mus musculus). Cermin Dunia Kedokteran Vol 36 no. 1/167.
Sundaryono, 2011. Uji Aktivitas Senyawa Flavonoid Total dari Gynura segetum
(Lour) Terhadap Peningkatan Eritrosit Dan Penurunan Leukosit Pada Mencit (Mus musculus).Jurnal Exacta, Vol. IX No.2. Hal 8-16.
Sugitha, I.M dan M. Djalil. 1989. Susu, Penanganan dan Teknologinya. Fakultas Peternakan. Universitas Andalas. Padang.
Suryani, E. 2014. Identifikasi Penyakit Acute Myeloid Leukemia (AML)
Menggunakan „ Rule Based System’ Berdasarkan Morfologi Sel Darah Putih Studi Kasus : AML2 dan AML4. ISBN: 979-26-0276-3. Semantik. hal 194. Swenson, Melvin J, RO William. 1993. Duke’s Physiology of Domestic Animal
11th Edition. London: Cornell University Press. hal 219-235.
Syafei, Syafrizal. 2009. Eritropoetin Rekombinan pada Penderita Kanker. Cermin Dunia Kedokteran Vol 36 no. 1/167.
Tambur Z, 2006. White Blood Cell Differential Count in Rabbits Artificially Infected with Intestinal Coccidia. J. Protozool. Res 16, 42-50.
Themi H, H.Diem, Haferlach T. 2004. Color Atlas of Hematology. Edisi ke-2. Stuttgart, New York: Thieme. hal 45.
72
Teske E. 2010. Leucocytes. Di dalam: Douglas J Weiss, K Jane Wardrop, editor.
Schalm‟s Veterinary Hematology Sixth Edition. United States of America: Wiley-Blackwell. hal: 263-298.
Tracker. 2013. Cara Meramu Daun Dewa untuk Obat.
http://danahauses.blogspot.com/2013/02/cara-meramu-daun-dewa-untuk-obat.html. 28 Mei 2015.
Uno, S., dan M. Makishima. 2009. Benzo[a]pyrene toxicity and inflammatory disease. Current Rheumatology Reviews, (5) : 266-271.
Vidinsky K. 2011. UCSF Researchers Identify Promising New Treatment for Childhood Leukemia. [terhubung berkala] http: //www.ucsf.edu/news /2011/03/9631/ucsf-researchers-identify-promising-new-
treatmentchildhood- leukemia. [23 Desember 2011].
Walker, C. H. 2009. Organic pollutants : an ecotoxicological perspective. London, CRC Press.
Wang Q, Chen W, Xu X. 2013.RIP1 potentiates BPDE-induced transformation in human bronchial epithelial cells through catalase-mediated suppression of excessive reactive oxygen species[J]. Carcinogenesis, 2013, 34(9): 2119-2228.
Wellman ML. 2010. Hematopoiesis. Di dalam: Douglas J weiss, K Jane Wardrop, editor. Schalm‟s Veterinary Hematology Sixth Edition. United States of America: Wiley-Blackwell. hal: 27-35.
Weiss DJ, and KJ Wardrop. 2010. Schalm‟s Veterinary Hematology, 6nd edition. United State of America: Blackwell Publishing Ltd. hal 263-305.
Xia Zhang, Caifeng Bi, Yuhua Fan, Cindy Cui, Di Chen and Q. Pingdou.2008. Induction of tumor cell apoptosis by taurine Schiff base copper complex is associated the with inhibition of proteasomal activity
Int J Mol Med. Nov 2008; 22(5): 677–682.
Xue, W.and Warshawsky, D. 2005. Metabolic activation of polycyclic and heterocyclic aromatic hydrocarbons and DNA damage: A review. Toxicology and Applied Pharmacology, 206, 73-93.
Yuwono. 2009. Mencit strain CBR Swiss Derived. Pusat Penelitian Penyakit Menular Badan Penelitian dan Pengembangan Kesehatan, Departemen Kesehatan RI. Jakarta.
Yuliangga. S . 2008. Penyakit Leukemia Kanker Darah.
Zakaria, Fransiska R. 2001. Pangan dan Pencegahan Kanker. Jurnal Teknologi dan Industri Pangan, Vol. XII, No. 2 Th. hal 171-175.