ANALISIS NUMERIK UNTUK PERLAKUAN VIROTHERAPY
PADA TUMOR PARU-PARU DENGAN MENGGUNAKAN
VIRUS CAMPAK
SUNJONO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa tesis Analisis Numerik untuk Perlakuan
Virotherapy pada Tumor Paru-paru dengan Menggunakan Virus Campak adalah benar-benar karya saya sendiri dengan arahan komisi pembimbing dan belum
diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber
informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak
diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam
Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2010
SUNJONO NRP G751080041
ABSTRACT
SUNJONO. Numerical Analysis of Lungs Tumor Virotherapy Treatment with Measles Viruses. Under direction of AGUS KARTONO, and IRZAMAN
Virotherapy tumors is a dynamic system that requires a mathematical model to complement the understanding of the results. The interaction between tumor cells are not infected cells, infected cells and virus populations gives an overview of the dynamic system virotherapy. We use a model of tumor and virus interactions based on the phenomenon of interaction between the three populations, that are not infected cells, infected cells and virus. Model parameters are obtained according to the model to experimental data. We discuss and seek balance the nature of the effects of disturbances and initial conditions of the dynamic system in an attempt to reach the tumor. We show that the total doses of virus play an important role in determining the outcome of therapy. If tumor growth can be slowed, at a minimum dose of virus required for therapy can be reduced substantially, then the prediction is interesting and more effective virotherapy of this model in the event of slowing tumor growth.
Keywords: lungs tumor, bertalanffy-richards model, virotherapy, prediction of therapy.
RINGKASAN
SUNJONO. Analisis Numerik untuk Perlakuan Virotherapy pada Tumor Paru-paru dengan Menggunakan Virus Campak. Dibimbing oleh AGUS KARTONO dan IRZAMAN
Tumor Paru-paru dalam arti luas adalah semua penyakit ganas yang terjadi di paru-paru, mencakup keganasan yang berasal dari paru-paru sendiri (primer) atau penyebaran (metastasis) tumor dari organ lain. Definisi khusus untuk tumor paru-paru primer yakni tumor ganas yang berasal dari jaringan sel (epitel) saluran napas (bronkus). Tumor paru-paru termasuk tumor penyebab kematian tertinggi. Hampir 90% pengidap tumor paru-paru tidak bisa diselamatkan apabila sudah akut, karena tumor akan mudah menyebar ke jaringan tubuh sekelilingnya seperti hati, tulang belakang, dan otak melalui pembuluh darah. Tumor paru-paru paling banyak ditemukan pada laki-laki dewasa dan perokok. Lebih dari 80% tumor paru-paru berhubungan dengan perokok. Ada beberapa pilihan untuk pengobatan tumor paru-paru pada masing-masing tingkatan yang dapat ditawarkan apabila telah didiagnosis pasti, yaitu jenis histologis dan staging penyakit yang dapat ditentukan yaitu dengan: bedah, radiotherapy, chemotherapy, targeted therapy, dan terapi lain(Elisna Syahruddin, 2006).
Perlakuan virotherapy yang diberikan ke pasien merupakan bentuk pengobatan tumor dengan menggunakan metode bioteknologi. Pada teknologi ini, virus dibentuk (dikonversi) untuk menyerang sel tumor, sedangkan sel-sel sehat relatif masih utuh dan dalam kondisi yang baik. Virus yang digunakan dalam virotherapy ini adalah virus campak. Pada saat ini, virus digunakan sebagai pengobatan terhadap berbagai penyakit tumor. Pada teknologi pengobatan ini, virus diperlakukan sebagai vektor khusus untuk dapat menargetkan sel dan DNA tertentu. Infeksi oleh virus campak dimulai ketika protein hemaglutinin (H) virus berinteraksi dengan receptor (CD46) pada sel target. Interaksi ini memicu perubahan pada protein fusion (F) virus yang mengarah ke perpaduan dari virus dan plasma membran sel untuk masuk ke dalam sel. Apabila protein H dan F dari virus meningkat, maka ini sel tumor yang terinfeksi juga akan meningkat (Dingli,2006a)
.
Selama beberapa tahun terakhir ini, virus (baik berbasis DNA dan RNA) dikembangkan terus sebagai terapi pengobatan tumor, atau biasa dikenalkan sebagai potensi pengobatan tumor. Interaksi antara tumor dengan populasi virus yang kompleks dan dinamik dapat dipahami dengan menggunakan pemodelan matematika.Tujuan penelitian ini adalah untuk mengetahui kondisi populasi awal tumor yang tidak terinfeksi, kondisi populasi tumor yang terinfeksi, berapa dosis virus yang diberikan pada pasien untuk mencapai penyembuhan dan berapa dosis virus yang optimal untuk dapat membunuh tumor, tanpa membunuh sel yang sehat. Selain itu, untuk mengetahui apakah penjadwalan pemberian dosis memainkan peran penting pada hasil terapi ini.
dapat diaplikasikan pada pengobatan tumor.
Peralatan yang digunakan dalam penelitian ini berupa komputer Intel Celeron(A4315), 2.5 GB of RAM. Software yang digunakan untuk proses komputasi adalah bahasa pemrograman Matlab R2008b dari Mathwork, Inc. Untuk mendukung penelitian ini sumber referensi yang digunakan selain buku (literature) juga informasi yang di peroleh dari internet yang dapat diakses dari laboratorium. Pembuatan program dengan bahasa pemrograman Matlab R2008b diperlukan untuk memudahkan perhitungan secara numerik, juga memudahkan dalam pembuatan grafik solusi persamaan, baik ruang fasanya maupun laju perubahan populasi pada model tumor yang dibuat.
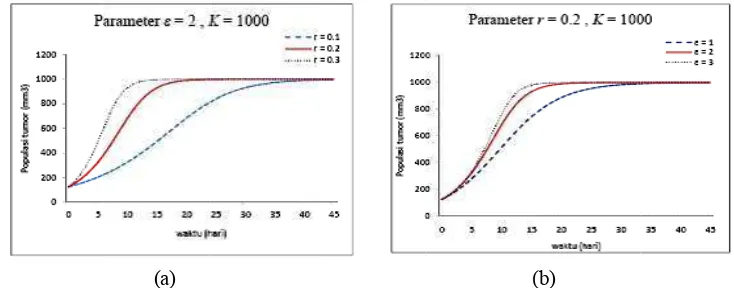
Dari perhitungan numerik dengan model Bertalanffy-Richards diketahui bahwa ketika kontrol r pada 0.1, 0.2, 0.3 dengan parameter = 2, K = 1000, maka diperoleh grafik yang menunjukkan bahwa pada nilai r yang semakin besar maka pertumbuhan populasi tumor akan semakin cepat pada beberapa waktu tertentu. Pada parameter kontrol dengan parameter r = 0.2, K = 1000 menunjukkan hasil yang sama dengan parameter kontrol r. Hal ini menunjukkan bahwa parameter r dan pada pertumbuhan populasi tumor mempunyai nilai yang konstan. Berdasarkan hasil plot parameter kontrol dan r, maka dapat dijadikan sebagai tolak ukur untuk virotherapy tumor paru-paru dengan data eksperimen. Dalam penelitian ini, kami menggunakan persamaan pertumbuhan dengan standar error 12.51.
Pada dosis virus awal rendah dengan α dan ω adalah 0, maka sistem mendekati pada keseimbangan 2 (K, 0, 0) yang terkait dengan kegagalan terapi. Dengan dosis virus awal v(0) = 5 terjadi kenaikan yang tajam jumlah sel tumor yang terinfeksi x(t) = 0.68 mm3 yang diikuti oleh penurunan ukuran total tumor u(t) = y(t) + x(t) = 88 mm3. Namun, karena pengaruh penurunan jumlah virus, maka jumlah sel-sel tumor yang terinfeksi menurun, sehingga jumlah populasi tumor meningkat pada saat t = 50 hari, yaitu 677.758 mm3 dan mencapai ukuran maksimal(K) pada saat t = 100 hari. Jika dosis virus awal v(0) = 22 dengan α dan ω adalah 0, maka terjadi kenaikan yang tajam jumlah sel tumor yang terinfeksi x(2) = 2.125 mm3 yang diikuti oleh penurunan ukuran total tumor u(t) = y(t)+x(t) mencapai 15 mm3. Namun, karena pengaruh penurunan jumlah virus yang sangat tajam, jumlah sel-sel tumor yang terinfeksi menurun, sehingga jumlah populasi tumor meningkat pada saat t = 50 hari mencapai ukuran 25.392 mm3 dan mencapai ukuran maksimal(K) pada saat t = 165 hari. Sedangkan pada dosis virus awal v(0) = 85, populasi sel tumor yang terinfeksi meningkat cepat, pada t = 1 mencapai 5.117 mm3 dan menurun pada t = 2 hari yang diikuti penurunan populasi tumor, dan jumlah populasi virus mencapai 70 mm3 pada saat t = 50 hari.
Terapi tumor secara modern dapat dilakukan dengan virotherapy yang dikombinasikan dengan terapi lain untuk mengendalikan tingkat pertumbuhan tumor
.
Jika dosis virus awal v(0) = 22 dengan α = 0.3, ω = 0.9, = 0.02 danterdeteksi. Dalam hal ini, sistem mencapai keseimbangan 3 dimana α > δ dan x(t) +y(t)≤K dengan nilai keseimbangan pada y3 = 67.034 mm3, x3 = 0.698 mm3,
v3 = 0.217 mm3. Dalam hal ini menunjukkan terapi sukses.
Berdasarkan model virotherapy yang kami sajikan dan pemahaman berbagai aspek efek terapi, maka dapat diambil suatu kesimpulan bahwa untuk dapat melakukan virotherapy maka perlu mengetahui kondisi awal tumor. Jumlah populasi tumor yang terinfeksi dapat diketahui dari hasil virotherapy berdasarkan dosis yang diberikan. Pada virotherapy ini, jumlah dosis virus 22 dengan kondisi keseimbangan 3, maka diketahui sel tumor terinfeksi 2.09 mm3, tidak mungkin dosis virus yang diberikan dalam eksperimen dapat mencapai penyembuhan, tetapi hanya dapat memperlambat pertumbuhan. Dosis virus optimal didefinisikan sebagai dosis terkecil virus yang efektif secara operasional dapat mengontrol pertumbuhan tumor secara signifikan, kemudian menggabungkan virotherapy dengan terapi lain untuk penyembuhan. Penjadwalan pemberian dosis tampaknya tidak memainkan peran penting pada hasil terapi. Hal utama yang menentukan hasil terapi adalah total dosis virus.
© Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruhnya karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
ANALISIS NUMERIK UNTUK PERLAKUAN VIROTHERAPY
PADA TUMOR PARU-PARU DENGAN MENGGUNAKAN
VIRUS CAMPAK
SUNJONO
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biofisika
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
HALAMAN PENGESAHAN
Judul Tesis : Analisis Numerik untuk Perlakuan Virotherapy pada Tumor Paru-paru dengan Menggunakan Virus Campak.
Nama : SUNJONO
N R P : G751080041
Program Studi : BIOFISIKA
Disetujui Komisi Pembimbing
Dr. Agus Kartono, M.Si Dr. Ir. Irzaman , M.Si
Ketua Anggota
Diketahui,
Ketua Program Studi Dekan Sekolah Pascasarjana Biofisika
Dr. Agus Kartono, M.Si. Prof. Dr. Ir.Khairil A. Notodiputro, M.S
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah
melimpahkan rahmat, taufik dan hidayah-Nya, sehingga penulis dapat
menyelesaikan laporan penelitian yang berjudul “ Analisis numerik untuk
perlakuan virotherapy pada tumor paru-paru dengan menggunakan virus
campak “, yang dilakukan dalam rangka tugas akhir untuk menyelesaikan program pendidikan S2 Biofisika pada Sekolah Pasca Sarjana, Institut Pertanian
Bogor.
Pada kesempatan ini, penulis mengucapkan banyak terima kasih dan
memberikan penghargaan yang sebesar-besarnya kepada Bapak Drs. Syafrudin
AK yang telah memberikan arahan dan motivasi kepada penulis untuk belajar di
IPB, kepada Bapak Dr.Agus Kartono, M.Si dan Bapak Dr. Ir. Irzaman, M.Si atas
segala bimbingan dan motivasinya yang diberikan kepada penulis untuk dapat
menyelesaikan laporan penelitian ini. Kepada istri, orangtua dan anak yang selalu
memberikan dorongan semangat dan motivasi, serta seluruh pihak yang telah
membantu penulis, juga kepada semua teman-teman seperjuangan Biofisika.
Semoga karya ilmiah ini akan bermanfaat bagi ilmu pengetahuan.
Bogor, Januari 2010
RIWAYAT HIDUP
Penulis dilahirkan di Bojonegoro pada tanggal 12 Juli 1971 dari seorang
ayah bernama Sudarno dan ibu Bandji. Penulis merupakan putra kedua dari dua
bersaudara.
Setelah menamatkan pendidikan Diploma III Institut Teknologi Sepuluh
Nopember (ITS) Surabaya Jurusan Kimia tahun 1993, penulis diangkat sebagai
guru di SMA Negeri 1 Tanjung Selor Kabupaten Bulungan Propinsi Kalimantan
Timur. Pada tahun 1997 melanjutkan pendidikan Sarjana Universitas Terbuka
Jurusan Pendidikan Kimia dan lulus tahun 1999. Pada tahun 2008 mendapat
kesempatan untuk melanjutkan ke program Magister Sains program studi
Biofisika di Institut Pertanian Bogor melalui Beasiswa Unggulan Daerah
Kabupaten Bulungan Propinsi Kalimantan Timur.
Selama menjadi guru, penulis pernah menjadi guru teladan tingkat SMA se
Kabupaten Bulungan berdasarkan SK Bupati Bulungan tahun 2008, serta menjadi
DAFTAR ISI
Halaman
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
PENDAHULUAN Latar Belakang ... 1
Perumusan Masalah ... 3
Tujuan Penelitian ... 3
Manfaat Penelitian ... 3
Ruang Lingkup Penelitian ... 4
TINJAUAN PUSTAKA Model Matematika ... 4
Model Pertumbuhan Tumor Tanpa Perlakuan ... 4
Model Interaksi Populasi Tumor dengan Virus ... 5
Analisa Keseimbangan ... 11
Stabilitas Keseimbangan ... 11
Validasi Model dan Estimasi Parameter ... 12
METODOLOGI PENELITIAN Waktu dan Tempat Penelitian ... 14
Peralatan ... 14
Studi Pustaka ... 14
Pembuatan Program ... 14
Analisa Output ... 14
HASIL DAN PEMBAHASAN Pertumbuhan Populasi Tumor Bertalanffy-Richards ... 15
Parameter Kontrol r dan ... 15
Solusi Numerik ... 17
Prediksi Virotherapy dosis rendah ... 17
Prediksi Virotherapy dosis sedang ... 18
Prediksi Virotherapy dosis tinggi ... 20
Prediksi model untuk sukses terapi ... 21
SIMPULAN ... 24
DAFTAR PUSTAKA ... 25
DAFTAR TABE
LHalaman
1 Parameter dan satuan bentuk persamaan virotherapy ... 9
DAFTAR GAMBAR
Halaman
1 Pertumbuhan tumor dalam waktu 3, 6, 9, 12 hari ... 2
2 Diagram skematis dari model virotherapy ... 9
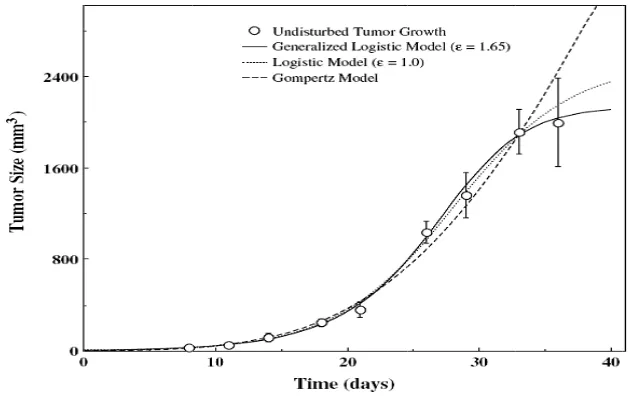
3 Perbandingan Pertumbuhan tumor dari data eksperiment dengan model
Gompertz (G), Logistic (L), Bertalanffy-Richards atau Generalized
Logistic (GL). ... 13
4 Pertumbuhan tumor model Bertalanffy-richards dengan (a). Parameter
kontrol r pada 0.1, 0.2, 0.3 dan (b).Parameter kontrol pada 1, 2, 3 r =
0.2, K = 1000. ... 15 5 Pertumbuhan tumor paru-paru berdasarkan data eksperimen dan model
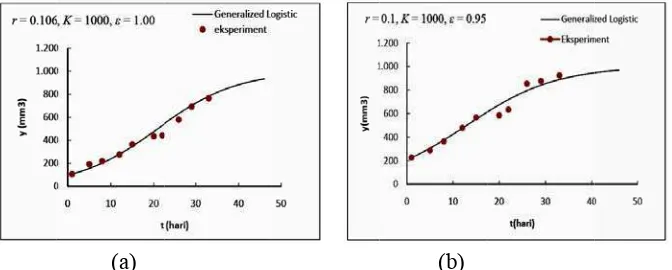
Bertalanffy-Richards (Generalized Logistic) ... 16
6 Pertumbuhan tumor tanpa perlakuan dan perlakuan virotherapy
menggunakan model Bertalanffy-Richard pada α = ω = 0 dengan r =
0.106, K = 1000, = 1.00 ... 16
7 Prediksi dari model persamaan (11) - (13) dengan dosis virus v(0) = 5.
Nilai parameter untuk r, K, dan sama dengan parameter Gambar 6
dan (y(0), x(0)) = (107.900, 0) ... 18
8 Prediksi dari model persamaan (11) - (13) dengan dosis virus v(0) = 22.
Nilai parameter untuk r, K, dan sama dengan parameter Gambar 6
dan (y(0), x(0)) = (107.900, 0). ... 19
9 Hubungan populasi sel tumor, sel terinfeksi dan populasi virus pada
dosis virus v(0) = 22, α = 1.3, ω = 0.3 dengan nilai parameter r,K,
sama pada Gambar 6 ... 19
10 Prediksi dari model persamaan (11) - (13) pada dosis virus v(0) = 85, α
= ω = 0 dengan nilai parameter r,K, sama pada Gambar 6. ... 21
11 Hubungan populasi sel tumor, sel terinfeksi dan populasi virus pada
dosis virus v(0) = 22, α = 0.3, ω = 0.9 dengan nilai parameter r,K,
sama pada Gambar 6. ... 22
12 Gambaran hasil virotherapy, pada dosis virus v(0) = 5, = 0.02,
α = 0.5, ω = 0.2, ρ= 0.141, dengan nilai parameter r, K, sama pada
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 27
2 Sintaks Plot Grafik Dengan software MatlabR2008b ... 28
3 Data Eksperimen Pertumbuhan Tumor Paru-paru ... 31
4 Data virotherapy dosis rendah ... 32
5 Data virotherapy dosis sedang ... 34
6 Data virotherapy dosis tinggi ... 36
1
PENDAHULUAN
LATAR BELAKANG
Tumor muncul ditandai oleh perubahan yang sangat mendasar di dalam sel
biologi, khususnya nukleus, dan sifat tumor ditransmisikan dari sel ke sel melalui
generasi-generasi lanjutannya secara tak terbatas. Sel tumor memiliki
pertumbuhan mandiri yang lebih cepat daripada yang dimiliki oleh sel inang. Sel
tumor dapat dikenal dari perubahan-perubahan dalam struktur, metabolisme, sifat,
pola pertumbuhan, dan juga dari perubahan dalam fungsi atau dalam hubungan
imunologik dengan bagian-bagian tubuh yang lain. Tumor merupakan salah satu
penyebab utama kematian di seluruh dunia. Badan Kesehatan Dunia (WHO)
mengestimasikan bahwa 84 juta orang meninggal akibat tumor dalam rentang
waktu 2005 dan 2015. Sedangkan hasil Riset Kesehatan Dasar 2007 menyebutkan
bahwa prevalensi penyakit tumor di Indonesia adalah 4,3
Tumor Paru-paru dalam arti luas adalah semua penyakit ganas yang terjadi
di paru-paru, mencakup keganasan yang berasal dari paru-paru sendiri (primer) atau penyebaran (metastasis) tumor dari organ lain. Definisi khusus untuk tumor paru-paru primer yakni tumor ganas yang berasal dari jaringan sel (epitel) saluran napas (bronkus). Tumor paru-paru termasuk tumor penyebab kematian tertinggi. Hampir 90% pengidap tumor paru-paru tidak bisa diselamatkan apabila sudah
akut, karena tumor akan mudah menyebar ke jaringan tubuh sekelilingnya seperti
hati, tulang belakang, dan otak melalui pembuluh darah. Tumor paru-paru paling
banyak ditemukan pada laki-laki dewasa dan perokok. Lebih dari 80% tumor
paru-paru berhubungan dengan perokok. Ada beberapa pilihan untuk pengobatan
tumor paru-paru pada masing-masing tingkatan yang dapat ditawarkan apabila
telah didiagnosis pasti, yaitu jenis histologis dan staging penyakit yang dapat ditentukan yaitu dengan: bedah, radiotherapy, chemotherapy, targeted therapy, dan terapi lain (Elisna Syahruddin, 2006).
2
virus dibentuk (dikonversi) untuk menyerang sel tumor, sedangkan sel-sel sehat
relatif masih utuh dan dalam kondisi yang baik. Virus yang digunakan dalam
virotherapy ini adalah virus campak. Pada saat ini, virus digunakan sebagai pengobatan terhadap berbagai penyakit tumor. Pada teknologi pengobatan ini,
virus diperlakukan sebagai vektor khusus untuk dapat menargetkan sel dan DNA
tertentu. Infeksi oleh virus campak dimulai ketika protein hemaglutinin (H) virus berinteraksi dengan receptor (CD46) pada sel target. Interaksi ini memicu perubahan pada protein fusion (F) virus yang mengarah ke perpaduan dari virus dan plasma membran sel untuk masuk ke dalam sel. Apabila protein H dan F dari virus meningkat, maka ini sel tumor yang terinfeksi juga akan meningkat
(Dingli,2006a)
.
Selama beberapa tahun terakhir ini, virus (baik berbasis DNA dan RNA) dikembangkan terus sebagai terapi pengobatan tumor, atau biasadikenalkan sebagai potensi pengobatan tumor.
Gambar 1. Pertumbuhan tumor dalam waktu 3, 6, 9, 12 hari
Oleh karena, pertumbuhan tumor sangat cepat dibandingkan dengan sel
normal yang sehat, maka virus diperlukan untuk dapat mengendalikan
pertumbuhan tumor, atau bahkan diharapkan dapat membunuhnya. Keberhasilan
virotherapy pada tumor paru-paru tergantung pada infeksi sel tumor yang menjadi tempat untuk amplifikasi virus tersebut. Setelah virus dilepaskan dari sel-sel yang
terinfeksi oleh tumor, maka muncul partikel baru yang dapat menulari sel tumor.
Dengan demikian, penyebaran virus melalui tumor merupakan satu kesatuan
rangkaian. Interaksi antara tumor dengan populasi virus yang kompleks dan
3
PERUMUSAN MASALAH
1. Bagaimanakah membangun model dan persamaan matematika yang dapat
menjelaskan fenomena virotherapy pada tumor
2. Menganalisa model yang digunakan pada sistem dinamika virotherapy pada tumor tersebut dan apakah hasil simulasi model itu memberikan hasil
prediksi yang sesuai kenyataan (experiment)
3. Bagaimana bentuk persamaan matematika yang lebih umum yang dapat
menjelaskan fenomena virotherapy pada tumor yang secara kualitatif mempunyai kemiripan dengan kenyataan.
4. Jika telah dibangun persamaan matematika umum untuk suatu virotherapy pada tumor, bagaimana bentuk persamaan matematika yang dapat
menjelaskan interaksi antara virus dengan tumor.
TUJUAN PENELITIAN
Penelitian ini bertujuan untuk mengetahui:
1. Kondisi populasi awal tumor yang tidak terinfeksi.
2. Kondisi populasi tumor yang terinfeksi.
3. Berapa dosis virus yang diberikan pada pasien untuk mencapai
penyembuhan?
4. Berapa dosis virus yang optimal untuk dapat membunuh tumor, tanpa
membunuh sel yang sehat?
5. Apakah penjadwalan pemberian dosis memainkan peran penting pada
hasil terapi?
MANFAAT PENELITIAN
Penelitian ini menjadi acuan dasar tentang mekanisme kerja virotherapy pada tumor paru-paru, mulai dari keadaan kondisi populasi sel tumor sebelum diberi
4
mengurangi atau membunuh seluruh populasi sel tumor. Penelitian ini diharapkan
dapat diaplikasikan pada pengobatan tumor paru-paru.
RUANG LINGKUP
Ruang lingkup dalam penelitian ini meliputi persamaan diferensial biasa
(ODE), persamaan Bertalanffy-Richards, persamaan Wodarz dan Komarova,
persamaan Dingli serta pemahaman virotherapy.
TINJAUAN PUSTAKA
MODEL MATEMATIKA.
Model Pertumbuhan Tumor Tanpa Perlakuan
Setiap akan melakukan terapi pada pertumbuhan tumor diperlukan suatu
model pertumbuhan tumor tanpa perlakuan terapi. Pada umumnya, pertumbuhan
tumor tanpa perlakuan terapi dijelaskan oleh fungsi Gompertz, namun untuk
beberapa tumor yang lebih umum model Bertalanffy-Richards (atau generalized logistic) digunakan juga untuk menjelaskan pertumbuhan tumor. Pada penelitian ini, kami menggunakan model Bertalanffy-Richards yang diberikan dalam bentuk
persamaan:
y ' = (g/ ) y[1− y /K], > 0. (1)
5
Gompertz adalah sama. Solusi dari persamaan (1) dapat ditulis dalam bentuk
analitik (Zeljko Bajzer, 1996) sebagai berikut:
y (t) = yo [ f + (1 – fε) e-gt] -1/ ,dimana f = yo/K. (2)
Pada model virotherapy, kita akan mempertimbangkan dinamika tiga interaksi populasi (Dingli,2006a), yaitu:
1. y (t) - Sel tumor yang tidak terinfeksi, 2. x (t) - Sel tumor yang terinfeksi virus, 3. v (t) - Partikel virus bebas yang menginfeksi
.
Representasi gambar dari model diatas diberikan pada Gambar 2.
Model Interaksi Populasi Tumor dengan Virus
Pemodelan interaksi antara populasi sel tumor dan virus dengan sistem ODE
(Ordinary Differential Equations) diusulkan pertama kali oleh Wodarz (2001) dan
Wodarz dan Komarova (2005) dalam bentuk sebagai berikut:
y' = ry[1− (x +y ) / C] – dy – βxy , (3) x' = βxy + sx[1 –(x + y)/C] – ax, (4)
6
berinteraksi dengan sel tidak terinfeksi, maka keduanya menjadi terinfeksi.
Bentuk dy merupakan laju kematian sel yang terinfeksi dan ax merupakan angka kematian sel yang terinfeksi sebagai akibat infeksi virus.
Model di persamaan (3) dan (4) tidak termasuk populasi partikel virus yang
bebas, infeksi sel tumor dengan virus bebas dan berbagai macam sel terinfeksi
secara tidak langsung dimodelkan hanya dengan laju konstanta β pada saat menangkap produksi virus. Beberapa eksperimen oleh Peng dkk (2002a, 2006)
menunjukkan bahwa partikel virus campak bebas tidak terdeteksi, namun hal ini
penting dalam pemodelan efek sementara dari infeksi oleh virus. Karya ilmiah
terbaru Wodarz (2003) memperkenalkan populasi virus bebas, dan
memperlihatkan penghentian pertumbuhan dari sel-sel yang terinfeksi. Bahkan,
ada eksperimen yang menyatakan bahwa beberapa virus yang berbeda
menghambat replikasi sel setelah terinfeksi (Heaney dkk., 2002). Model yang
diusulkan Wodarz (2003) dinyatakan dalam bentuk persamaan matematika:
y' = ry[1 −(x +y ) / C] – dy – βxy , (5) x' = кyv – ( d + a)x, (6) v' = αx – ωv. (7)
Dalam model baru ini, bentuk кyv menyatakan penyebaran infeksi di sel-sel tumor yang produktif. Model ini mengasumsikan bahwa satu partikel virus bebas akan
menginfeksi satu sel tumor yang tidak terinfeksi. Dengan demikian, bentuk кyv merupakan laju infeksi dari sel-sel yang tidak terinfeksi oleh virus bebas v(t), dengan к > 0 yang merupakan konstanta laju infeksi sel-sel tumor. Dalam model ini, konstanta laju kematian d + a dari sel yang terinfeksi terdiri dari tingkat kematian sel tumor yang tidak terinfeksi (d) dan tingkat kematian yang disebabkan oleh virus (a). Bentuk model αx merupakan sel-sel yang terinfeksi dengan konstanta laju α, dan ων merupakan laju pembersihan partikel virus bebas dengan berbagai penyebab non-spesifik, termasuk mengikat dan mengangkat
partikel yang tidak sempurna. Dalam karya Wodarz (2003) sebelumnya,
pertumbuhan sel tumor telah dimodifikasi dengan model yang dikenalkan lebih
7
Dingli dkk (2006a). Model yang diusulkan untuk virotherapy (Dingli dkk., 2006a) adalah:
y' = ry[1− (y +x)ε/K] – кyv, (8) x' = кyv – x, (9) v' = αx – ωv. (10)
Dibandingkan dengan persamaan (5), persamaan (8) telah mengabaikan istilah
dy, karena bentuk itu terlalu berlebihan dengan kondisi kenyataannya (Dingli dkk., 2006a). Persamaan y' = ry[1 − (y+x ) / C] – dy – кyv setara dengan
persamaan (8), apabila kita menentukan parameter sebagai r = r – d, K = (1-d/r)1/C. Demikian pula angka kematian ( d + a)x dalam persamaan (6)
dapat diwakili oleh x. Harga konstanta dapat juga merupakan efek dari beberapa model sistem kekebalan tubuh yang menyatakan juga bahwa
pembunuhan dari sel yang terinfeksi oleh respon kekebalan tubuh adalah
berbanding lurus dengan ukuran dari populasi sel yang terinfeksi. Selain itu, jika
tingkat perkembangbiakan sel tumor yang terinfeksi rendah, maka
perkembangbiakan sel tumor menjadi lebih efektif akibat nilai > 0. Nilai
terdiri dari empat hal, yaitu = d + a + di- rx ,dimana diadalah model efek respon
dari immune dan rx adalah model nilai konstanta perkembangbiakan yang kecil.
Persamaan (8)-(10) merupakan model virotherapy yang masih harus disempurnakan dengan dua hal sebagai berikut :
1. Tidak ada istilah yang menjelaskan infeksi dari pertemuan antara sel yang
terinfeksi (x) (menyatakan protein F dan H yang disebabkan oleh virus) dan sel yang tidak terinfeksi, sehingga perpaduan sel menghasilkan syncytium. Syncytium yang dihasilkan dapat bergabung dengan sel lain yang tidak terinfeksi. Eksperimen menunjukkan bahwa penyebaran infeksi intratumoral terjadi oleh perpaduan antara sel yang terinfeksi dan tidak terinfeksi, tetapi
bukan terjadi oleh infeksi virus bebas (Peng dkk., 2002b; Dingli dkk., 2004).
2. Persamaan (10) tidak ada bentuk кyv yang mewakili pembersihan partikel virus bebas . Model ini berasumsi bahwa satu partikel virus menginfeksi satu
8
berhenti di bagian populasi virus bebas. Syncytia tidak mungkin melepaskan partikel virus bebas ketika mereka mati, karena syncytia mati terjadi apoptosis yang merusak sel tumor dari dalam. Ini sangat menarik untuk dicatat bahwa
untuk hal yang lebih kompleks dan lebih realistis, model yang diusulkan oleh
Wu dkk. (2001, 2004), Wein dkk. (2003), dan Guo Tao (2005) dan Friedman
dkk.(2006) juga tidak menyertakan istilah yang analog dengan кyv di persamaan untuk nilai perubahan populasi virus.
Ketika dua bentuk persamaan diatas kehilangan bentuk кyv diperkenalkan kembali, maka model virotherapy dapat dinyatakan kembali dalam suatu bentuk persamaan matematika yang baru (Zeljko Bajzer, 2008),
y' = ry[1− (y +x)ε/K] – кyv – ρxy, (11)
x' = кyv – x, (12) v' = αx – ωv –кyv, (13)
Mekanisme persamaan (11) - (13) dinyatakan dalam diagram Gambar 2.
Parameter ρ > 0 adalah nilai konstanta yang menjelaskan perpaduan fusi sel ke sel dalam proses pembentukan syncytia. Dalam model ini, x(t) merupakan populasi dari sel yang keduanya terinfeksi dan sel syncytia. Kedua sel mati dinyatakan dengan nilai konstanta efektif > 0. Bentuk ρxy tidak muncul dalam persamaan (12), karena tidak ada muncul sel atau virus baru.
9
Gambar 2. Diagram skematis dari model virotherapy. Variabel y menunjukkan populasi dari sel tumor yang tidak terinfeksi. Perkembangbiakan sel-sel ini dijelaskan dengan laju pertumbuhan efektif (r), ukuran maksimal tumor (K)dan parameter merupakan bentuk karakteristik pertumbuhan tumor. Populasi dari sel yang terinfeksi virus dan populasi virus ditunjukkan dengan x dan v. Nilai parameter yang ditunjukkan pada tingkat pertama dan kedua secara berurutan dijelaskan pada Tabel 1. Garis panah tebal menandakan populasi bertambah atau berkurang, sedangkan garis putus-putus menunjukkan bahwa nilai yang tergantung dengan populasi x.
Proses penambahan populasi x(t) terjadi apabila sel yang tidak terinfeksi dimasukkan ke dalam syncytium oleh penggabungan sel ke sel. Bentuk ini secara konseptual berbeda dengan bentuk βxy dalam persamaan (3) dan (4). Model ini merangkum parameter pada Tabel 1 untuk kemudahan referensi. Seperti dalam
model yang diberikan oleh persamaan (8) - (10), jumlah populasi sel tumor
u(t) = x(t) + y(t) tidak dapat melebihi populasi sel K.
Tabel 1. Parameter dan satuan bentuk persamaan (11) – (13) yang digunakan.
r K к ρ ω α
Laju pertumbuhan efektif sel yang tidak terinfeksi (per hari)
Ukuran maksimal tumor (dalam sel 106)
Konstanta laju infeksi (per hari per 106 sel)
Konstanta laju sel yang bergabung (per hari per 106 sel)
Konstanta laju kematian efektif sel yang terinfeksi (per hari)
Konstanta laju virus yang mati (per hari)
10
Model ini menunjukkan jumlah populasi sel tumor mula-mula(awal) dengan
y(0) = yo, dan menganggap bahwa pada saat t = 0 populasi partikel virus v(0) = vo. Populasi awal sel tumor yang terinfeksi x(0) = 0. Parameter model yang sesuai dengan model di persamaan (11) - (13) telah tersedia data untuk ukuran
tumor sebagai fungsi dari waktu (lihat Gambar 6). Ukuran tumor diukur sebagai
volume (dalam mm3), sedangkan dalam model ini menganggap jumlah populasi
sel. Volume tumor dikonversi ke populasi sel dengan asumsi bahwa 1mm3 sama
dengan 106 sel tumor. Model ini menyatakan jumlah populasi sel tumor dan virus
y, x, v dalam satuan 106, sedangkan model ini menganggap bahwa semua unit waktu dinyatakan dalam satuan hari.
Tujuan virotherapy pada tumor adalah untuk mengurangi dan membunuh sel tumor. Bentuk persamaan matematika yang digunakan dalam analisisis numerik
virotherapy adalah persamaan (11) - (13). Dalam model ini, kita dapat menganggap bahwa tumor yang benar-benar dibunuh ketika populasi sel tumor
berkurang satu sel, ini berarti kita mengadopsi bahwa u(t) = x(t) + y(t) = 10-6. Secara umum, model dinamika populasi persamaan (11) - (13) dianggap sebagai
perpaduan model Wodarz (2001,2003), Wu dkk. (2001, 2004), Dingli dkk.
(2006a), dan Tao Guo (2005), dan Wein dkk. (2003). Mungkin tidak realistis
apabila ukuran interaksi populasi sangat kecil, juga dalam beberapa batas yang
terendah dari 1 sel adalah berbeda. Namun dapat dianggap sebagai perkiraan
relatif konservatif pada pemberantasan penyakit tumor. Tentunya, u(t) = 10-6 dicapai pada beberapa batas waktu t = t ≤ T, dimana T diperkirakan massa maksimal populasi inang. Kita menganggap T = 1000 hari untuk seekor tikus. Jika rata-rata populasi tumor berkurang pada waktu T dan berkurang ke ukuran minimal yang dideteksi, maka kita mempertimbangkan bahwa terapi itu telah
berhasil. Secara umum populasi sel 106 tumbuh di bawah kulit tidak terdeteksi
11
ANALISA KESEIMBANGAN.
Hasil virotherapy dapat dicirikan oleh sifat yang stabil sistem persamaan (11) - (13), kecuali beban tumor u(t) telah berkurang ke tingkat di bawah 1 sel (u(t) < 10-6) terbatas pada beberapa waktu. Oleh karena itu kami mulai membahas stabilitas keseimbangan dari tiga model keseimbangan.
Stabilitas Keseimbangan
Sifat stabil dari sistem persamaan (11) - (13) mendekati selama t→∞ yang merupakan hasil terapi, apabila beban tumor x(t) + y(t) belum dikurangi ke tingkat di bawah satu sel di beberapa waktu tertentu. Simulasi menunjukkan bahwa untuk
parameter yang relevan fisiologisnya, seperti semua sifat keseimbangan. Oleh
karena itu, kami mulai mengkarakterisasi parameter yang ditetapkan dari model
dan menganalisa stabilitasnya.
Pada kebanyakan parameter, ada tiga keseimbangan yang ditunjukkan
sistem persamaan (11) - (13). Hasil terapi yang pada saat ini terkait dengan titik
keseimbangan pada keadaan awal adalah:
y1 = 0, x1 = 0, v1 = 0, (14)
hal ini tidak stabil untuk parameter biologi yang relevan, sistem selama ini
memiliki nilai eigen
λ1 = r > 0, λ2 = - < 0, λ3 = -ω
Keseimbangan yang tidak stabil bergantung pada sumbu y. Ketidakstabilan ini merupakan konsekuensi asumsi yang dibuat dalam model, yaitu dalam kondisi
tidak ada virus, jumlah sel terinfeksi akan tetap di x(0), solusi akan tetap berada pada sumbu y dan berkembang sesuai dengan model Bertalanffy-Richards.
Apabila tidak ada terapi, atau terapi gagal, maka akan tumbuh tumor yang
ukurannya maksimal. Hal ini diwakili oleh titik keseimbangan:
12
Jacobian dari sistem untuk hal ini mempunyai nilai eigen
λ1 = -r /K < 0, λ23 = -p ± (16)
dimana
P = + kK + ω1, q = (α – )kK – ω.
Semua nilai eigen nyata untuk parameter biologi yang relevan. Dalam kasus q < 0 semua nilai eigen adalah negatif dan keseimbangan stabil. Ketika q > 0 dari persamaan (16) dan λ2 > 0, maka keseimbangannya adalah tidak stabil.
Keberhasilan terapi diwakili oleh titik keseimbangan:
, 1 , , (17)
Dimana
Apabila y3 = K terkait dengan titik keseimbangan dari kegagalan terapi, maka
parameter biologi yang relevan untuk nilai-nilai yang bukan negatif dari y3 dan v3
yang diperoleh hanya untuk α > . Dalam hal ini c > 0, dan mudah untuk menunjukkan bahwa persamaan (17) memiliki solusi unik untuk x3.
VALIDASI MODEL DAN ESTIMASI PARAMETER.
Model virotherapy telah divalidasi dengan data percobaan yang telah diperoleh dari literature. Data ini meliputi kurva pertumbuhan tumor tanpa
pengobatan dan kurva pertumbuhan ketika virotherapy dilakukan pada hari pertama. Ukuran tumor diukur dalam satuan volume (dalam mm3), sedangkan
dalam model ini menganggap jumlah populasi sel. Oleh karena itu, volume tumor
14
METODOLOGI PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dilaksanakan di Laboratorium Fisika Teori, Departemen Fisika,
Institut Pertanian Bogor di mulai pada bulan Juli 2009 sampai dengan bulan
Januari 2010. Kegiatannya meliputi penelitian pendahuluan, pembuatan program,
analisis output, pengolahan data dan penyusunan laporan.
Peralatan
Peralatan yang digunakan dalam penelitian ini berupa komputer intel Pentium
(A4315), 2.5 GB of RAM. Software yang digunakan untuk proses komputasi adalah bahasa pemrograman Matlab R2008b dari Mathwork, Inc. Untuk mendukung penelitian ini sumber referensi yang digunakan selain buku
(literature) juga informasi yang di peroleh dari internet yang dapat diakses dari Laboratorium.
Studi Pustaka
Studi pustaka diperlukan untuk mengetahui sejauh mana perkembangan yang
telah dicapai dalam bidang yang diteliti.
Pembuatan Program
Pembuatan program dengan bahasa pemrograman Matlab R2008b diperlukan untuk memudahkan perhitungan secara numerik dan juga memudahkan dalam
pembuatan grafik solusi persamaan baik ruang fasanya maupun laju perubahan
populasi pada model tumor yang dibuat.
Analisis Output
Analisis output diperlukan untuk menguji apakah output yang didapat sesuai
dengan teori yang ada dalam literatur. Sistematika penelitian yang lebih lengkap
17
parameter α dan ω ditetapkan nol, sehingga hasil ini sesuai dengan pertumbuhan tumor tanpa perlakuan.
Tabel 2. Nilai laju konstan (dalam satuan per hari) model untuk prediksi
virotherapy.
Seperti telah dibahas dalam bagian analisa keseimbangan persamaan
(11) - (13), keseimbangan sangat penting untuk hasil virotherapy. Akan tetapi, ketika efek terapi yang signifikan harus dicapai dalam jangka waktu terbatas
(1000 hari), perlu mempelajari prediksi dari model (11) - (13) dengan solusi
numerik. Oleh karena itu, kami membahas hasil solusi numerik yang dipilih untuk
menunjukkan implikasi dari efek virotherapy yang signifikan.
Prediksi Virotherapy Dosis Rendah (v(0) = 5)
Solusi numerik diselesaikan dengan menggunakan software MatlabR2008b dan mensubstitusikan nilai parameter ke persamaan (11) - (13), sehingga
18
Gambar 7. Prediksi dari model persamaan (11) - (13) dengan dosis virus v(0) = 5. Nilai parameter untuk r, K, dan sama dengan parameter di Gambar 6 dan (y(0),
x(0)) = (107.900, 0).
Gambar 7 menunjukkan perubahan waktu untuk ukuran total tumor u, serta populasi virus v dan sel yang terinveksi x. Jika dosis virus awal terlalu rendah dengan αdan ω adalah 0, maka sistem mendekati pada keseimbangan 2 (K, 0, 0) yang terkait dengan kegagalan terapi. Dengan dosis virus awal v(0) = 5 terjadi kenaikan yang tajam jumlah sel tumor yang terinfeksi x(t) = 0.67 mm3 yang diikuti oleh penurunan ukuran total tumor u(t) = y(t) + x(t) = 88 mm3. Namun, karena pengaruh penurunan jumlah virus, maka jumlah sel-sel yang terinfeksi
menurun, sehingga jumlah populasi tumor meningkat pada saat t = 50 hari adalah 677.758 mm3 dan mencapai ukuran maksimal (K) pada saat t = 100 hari.
Prediksi Virotherapy Dosis Sedang (v(0) = 22)
Untuk dosis virus sedang, solusi numerik diselesaikan dengan menggunakan
software Matlab R2008b, dan mensubstitusikan nilai parameter ke persamaan (11) - (13), sehingga diperoleh grafik hubungan antara populasi sel tumor y, populasi virus v serta sel yang terinfeksi x terhadap waktu t
19
(b) (d)
Gambar 8. Prediksi dari model persamaan (11)-(13) dengan dosis virus v(0) = 22. (a, b,c) pada saat t = 50. (d) pada saat t = 165. Nilai parameter untuk r, K, dan sama dengan parameter Gambar 6 dan (y(0), x(0)) = (107.900, 0).
Gambar 8 menunjukkan perubahan waktu untuk ukuran total tumor u, serta populasi virus v dan sel tumor yang terinfeksi x. Jika dosis virus awal v(0) = 22 dengan α dan ω adalah 0, maka terjadi kenaikan yang tajam jumlah sel tumor yang terinfeksi x(2) = 2.125 mm3 yang diikuti oleh penurunan ukuran total tumor u(t) = y(t) + x(t) mencapai 15 mm3. Namun, karena pengaruh penurunan jumlah virus yang sangat tajam, jumlah sel-sel yang terinfeksi menurun, sehingga jumlah
populasi tumor meningkat pada saat t = 50 hari mencapai ukuran 25.392 mm3 dan mencapai ukuran maksimal (K) pada saat t = 165 hari.
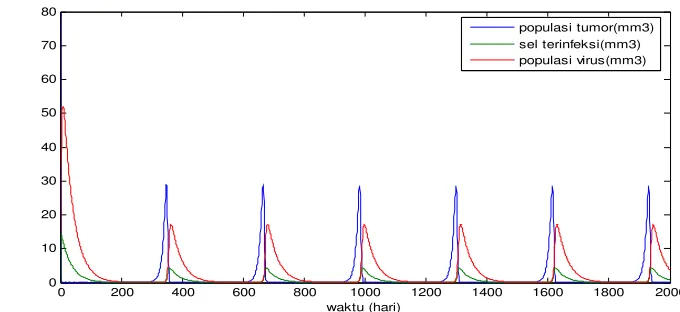
Dengan menggunakan dosis virus v(0) = 22 dalam persamaan Bertalanffy-Richards dengan parameter α = 1.3, ω = 0.3, dan laju virus yang menginfeksi 0.01 , diperoleh grafik hubungan populasi tumor, sel tumor terinfeksi dan populasi
virus sebagai berikut:
Gambar 9. Hubungan populasi sel tumor, sel terinfeksi dan populasi virus pada dosis virus v(0) = 22, α = 1.3, ω = 0.3 dengan nilai parameter r,K, sama pada Gambar 6.
0 200 400 600 800 1000 1200 1400 1600 1800 2000
20
Gambar 9. menunjukkan pertumbuhan yang berosilasi secara periodik populasi sel
tumor, hal ini disebabkan karena setiap pertumbuhan populasi tumor sebesar 10-4
mm3 diikuti oleh adanya populasi virus sebesar 0.1 mm3 , ini berarti bahwa
terdapat populasi virus yang dapat menginfeksi populasi tumor secara kontinyu,
sampai t = 2000 hari terdapat populasi sel yang terinfeksi sebesar 0.76 mm3.
Prediksi Virotherapy Dosis Tinggi(v(0) = 85)
Pada dosis virus tinggi, solusi numerik diselesaikan dengan menggunakan
software Matlab R2008b, dan mensubstitusikan nilai parameter ke persamaan (11) - (13), sehingga diperoleh grafik hubungan antara populasi sel tumor y, populasi virus v serta sel yang terinfeksi x terhadap waktu t.
21
Gambar 10. . Prediksi dari model persamaan (11) - (13) pada dosis virus v(0) = 85, α = ω = 0 dengan nilai parameter r,K, sama pada Gambar 6.
Dengan dosis virus awal v (0) = 85, populasi sel tumor yang terinfeksi meningkat cepat, pada t = 1 hari mencapai 5.117 mm3 dan menurun pada t = 2 hari yang diikuti penurunan populasi tumor, dan jumlah populasi virus mencapai 70 mm3
pada saat t = 50 hari. Hal ini tidak baik bagi pasien, karena jumlah virus masih banyak dapat menimbulkan penyakit.
Prediksi model untuk terapi sukses
Terapi tumor secara modern dapat dilakukan dengan virotherapy yang dikombinasikan dengan terapi lain untuk mengendalikan tingkat pertumbuhan
tumor paru-paru
.
Dengan menggunakan persamaan (11) - (13) dari model Bertalanffy-Richards dan penyelesaian solusi numerik dengan menggunakan22
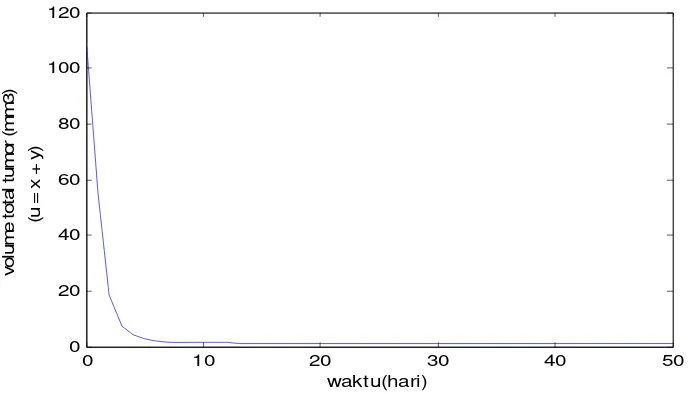
Gambar 11. Hubungan populasi sel tumor, sel terinfeksi dan populasi virus pada dosis virus v(0) = 22, α = 0.3, ω = 0.9 dengan nilai parameter r,K, sama pada Gambar 6. Gambar ini berhubungan dengan terapi sukses.
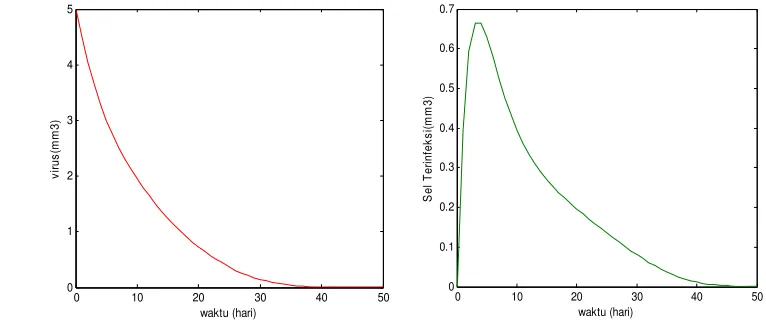
Apabila dosis virus awal v(0) = 22 dengan α = 0.3, ω = 0.9, = 0.02 dan ρ = 0.141, maka terjadi kenaikan sel tumor yang terinfeksi pada ukuran maksimal
x(5) = 2.097 mm3, dan pada saat x(60) = 0.769 mm3 . Gambar 11 menunjukkan penurunan yang tajam ukuran total tumor u, serta populasi virus v. Populasi tumor total u(t) = 1 mm3 pada saat t = 33 hari, dan pada saat t = 60 hari mencapai ukuran 0,37 mm3. Pada kondisi ukuran total tumor u(t) < 1 ini, peranan terapi yang lain mulai dilakukan, karena pada kondisi yang demikian populasi sel tumor tidak
23
Dalam Gambar 12, kami menggambarkan beberapa pola virotherapy yang mungkin muncul untuk kombinasi parameter model yang berbeda. Perlu diingat
bahwa beberapa kombinasi dari parameter mengakibatkan berosilasi secara
24
KESIMPULAN
Berdasarkan model virotherapy yang kami sajikan dan dengan pemahaman berbagai aspek efek terapi, maka dapat diambil suatu kesimpulan bahwa:
1. Untuk dapat melakukan virotherapy maka perlu mengetahui kondisi awal tumor.
2. Jumlah populasi tumor yang terinfeksi dapat diketahui dari hasil
virotherapy berdasarkan dosis yang diberikan. Sebagai contoh, pada dosis virus 22 dengan kondisi keseimbangan 3 maka diketahui sel tumor
terinfeksi 2.09 mm3
3. Tidak mungkin dosis virus yang diberikan dalam eksperimen dapat
mencapai penyembuhan atau sel tumor seluruhnya mati, tetapi hanya dapat
memperlambat pertumbuhan sel tumor.
4. Dosis virus optimal didefinisikan sebagai dosis terkecil virus yang efektif
dapat secara operasional mengontrol pertumbuhan tumor secara signifikan.
Kemudian virotherapy digabung dengan strategi terapi lain untuk penyembuhan secara total.
5. Penjadwalan pemberian dosis tampaknya tidak memainkan peran penting
pada hasil terapi. Hal utama yang menentukan hasil terapi adalah jumlah
25
DAFTAR PUSTAKA
Dingli D., Peng K.W, Harvey M.E, Greipp P.R, O’Connor M.K., Cattaneo R.,Morris J.C.,Russell S.J., 2004. Image-guided radiovirotherapy for multiple myeloma using a recombinant measles virus expressing the thyroidal sodium iodide symporter. Blood 103 (5),1641–1646.
Dingli D, Cascino M.D, Josic K, Russell S.J, Bajzer Z ., 2006a. Mathematical modeling of cancer radiovirotherapy. Math. Biosci. 199 (1), 55 –78.
Elisna Syahruddin, 2006, Lung cancer 101, Division of thoracic oncology.faculty of medicine, University of Indonesia
Friedman A., Tian J., Fulci G., Chiocca E., Wang J., 2006. Glioma virotherapy: effects of innate immune suppression and increased viral replication capacity. Cancer Res. 66, 2314–2319.
Peter L. Bonate PhD FCP, 2006. Pharmacokinetic-Pharmacodynamic Modeling and Simulation, Springer Science+Business Media, Inc., 233 Spring Street, New York, NY 10013, USA.
Peng K.W., Hadac E.M., Anderson B.D., Myers R., Harvey M., Reiner S.M., Soeffker D., Federspiel M.J., Russell S.J., 2006. Pharmacokinetics of oncolytic measles virotherapy: eventual equilibrium between virus and tumor in an ovarian cancer xenograft model. Cancer Gene Ther. 13 (8), 732–738.
Wodarz D., Komarova N., 2005. Computational Biology of Cancer: Lecture Notes and Mathematical Modeling. World Scientific Publishing Company, Hackensack, NJ.
Zeljko Bajzer, et al.2007. Optimization of tumor virotherapy with recombinant measles viruses. Biomathematics Resource,USA.
Zeljko Bajzer, et al.2008. Modeling of cancer virotherapy with recombinant measles viruses.Theoretical biology252:109–122.
26
27
Lampiran 1. Diagram Alir Penelitian.
Belum
Ya
Tidak
Ya
Penelusuran Literatur
Sudah siap?
Penggunaan Software
Pembuatan dan pengujian program
Sesuai dengan literatur
28
Lampiran 2. Sintaks Plot Grafik Dengan software MatlabR2008b.
1. Dengan persamaan Bertalanffy-Richard berikut akan dibuat solusi grafik
menggunakan softwareMatlab R2008b.
y ' =(r y)[1− y /K],
dengan nilai parameter r,K, sama dengan Gambar 6.
% GRAFIK PERSAMAAN BERTALANFFY-RICHARDS
% SUNJONO
% BIOFISIKA IPB 2010
% Pertumbuhan Populasi Tumor Tanpa Perlakuan.
function dzdt = TumorBR(t,z)
% Colve the populasi tumor example
dzdt = zeros(size(z));
% Parameters - TumorBR - rate constants
r =0.106 ; K =1000 ; eps =1.00; k =0.000959 ;
rho =0.215 ; tho =0.512 ; alpha =0 ; omega = 0 ;
y = z(1);
% Evaluate the RHS expression
dzdt(1)= r*y*(1-y^eps/K^eps);
%eof-TumorBR.m
2. Persamaan Virotherapy berikut akan dibuat solusi grafik menggunakan softwareMatlab R2008b.
y' = ry[1− (y +x)ε/K] – кyv – ρxy,
x' = кyv – x, v' = αx – ωv –кyv,
dengan nilai parameter sama dengan Tabel 2.
29
% GRAFIK PERSAMAAN VIROTHERAPY % SUNJONO
% BIOFISIKA IPB 2010
% Interaksi Populasi Tumor dengan Virus.
function dzdt = TumorTerapiSukses(t,z)
% Colve the virotherapy example
dzdt = zeros(size(z));
% Parameters - TumorTerapiSukses - rate constants
r =0.106 ; K =1000 ; eps =1.00 ; k =0.0009575;
rho =0.141 ; tho =0.02 ; alpha =0.3 ; omega =0.9 ;
y = z(1);
x = z(2);
v = z(3);
% Evaluate the RHS expression
dzdt(1)= r*y*(1-(y+x)^eps/K^eps)-k*y*v-rho*x*y;
dzdt(2)= k*y*v - tho*x;
dzdt(3)= alpha*x - omega*v - k*y*v;
30
Grafik yang di hasilkan :
31
Lampiran 3. Data Eksperimen Pertumbuhan Tumor Paru-paru yang Diimplankan ke Tikus
Hari Ke-
Eksperimen 1
( mm3 )
Eksperimen 2
( mm3 )
1 107.9 226.5
5 193.6 287.6
8 220.3 364.1
12 277.2 479.2
15 366.5 566.8
20 435.2 585.8
22 442.8 635.1
26 579.5 855.4
29 691.6 878.4
33 765.1 925.9
33
39 400.8518 0.0155 0.0104
40 425.3295 0.0119 0.0070
41 450.4338 0.0090 0.0046
42 476.0090 0.0067 0.0029
43 501.8890 0.0048 0.0018
44 527.9041 0.0035 0.0011
45 553.8819 0.0024 0.0007
46 579.6566 0.0017 0.0004
47 605.0699 0.0011 0.0002
48 629.9759 0.0008 0.0001
49 654.2434 0.0005 0.0001
50 677.7578 0.0003 0.0000
35
39 20.5343 0.3591 9.2841
40 20.9034 0.3584 9.1015
41 21.2866 0.3578 8.9192
42 21.6820 0.3571 8.7374
43 22.0897 0.3562 8.5559
44 22.5114 0.3553 8.3748
45 22.9503 0.3545 8.1943
46 23.4059 0.3538 8.0142
47 23.8765 0.3529 7.8345
48 24.3628 0.3519 7.6554
49 24.8672 0.3508 7.4768
50 25.3923 0.3498 7.2988
37
39 1.2834 0.1713 71.0299
40 1.2846 0.1712 70.9425
41 1.2859 0.1711 70.8551
42 1.2874 0.1711 70.7677
43 1.2890 0.1710 70.6803
44 1.2908 0.1710 70.5929
45 1.2926 0.1710 70.5056
46 1.2945 0.1710 70.4181
47 1.2966 0.1711 70.3307
48 1.2987 0.1711 70.2432
49 1.3010 0.1712 70.1557
50 1.3033 0.1712 70.0682
38
Lampiran 7. Data Prediksi Model untuk Terapi Sukses.
Waktu(t)
11 16.4219 1.9714 0.6533
39
39 0.6875 1.1667 0.3972
40 0.6491 1.1439 0.3897
41 0.6148 1.1215 0.3818
42 0.5842 1.0995 0.3744
43 0.5568 1.0779 0.3672
44 0.5323 1.0568 0.3599
45 0.5104 1.0360 0.3529
46 0.4908 1.0157 0.3460
47 0.4733 0.9957 0.3392
48 0.4577 0.9761 0.3325
49 0.4439 0.9569 0.3261
50 0.4316 0.9381 0.3197
51 0.4208 0.9197 0.3134
52 0.4113 0.9016 0.3070
53 0.4030 0.8839 0.3012
54 0.3959 0.8665 0.2955
55 0.3898 0.8494 0.2895
56 0.3848 0.8327 0.2835
57 0.3807 0.8163 0.2780
58 0.3776 0.8003 0.2728
59 0.3753 0.7845 0.2673
60 0.3738 0.7691 0.2618