1
BAB I
LARUTAN DAN KONSENTRASI LARUTAN
Tujuan PembelajaranSetelah mempelajarari pada bagian bab ini, diharapkan mahasiswa 1. Dapat menjelaskan Satuan konsentrasi larutan yang biasa
digunakan di laboratorium
2. dapat mempersiapkan larutan dalam berbagai satuan konsentrasi 3. dapat mengubah satuan konsentrasi tertentu ke satuan
konsentrasi lain
1.1 Definisi Larutan
Campuran zat-zat terlarut dan pelarut yang komposisinya merata atau serba sama (homogen) disebut dengan Larutan. Suatu larutan dapat terdiri dari satu zat terlarut atau lebih dan satu macam pelarut, tetapi umumnya terdiri dari satu jenis zat terlarut dan satu pelarut. Berbicara tentang larutan, kata-kata solven (pelarut) dan Solut (zat yang terlarut) sudah umum disebutkan, Solven sebagai komponen yang secara fisik tidak berubah jika larutan terbentuk, sedangkan solut sebagai semua komponen yang larut dalam pelarut.
Ditinjau dari ukuran partikel yang terlarut, Larutan homogen dibedakan menjadi 2 yaitu larutan sejati dan koloid.
2 Tabel 1.1 Tabel perbedaan larutan sejati dengan koloid
Jenis Larutan Ukuran Contoh Sifat Larutan Sejati < 1 nm Larutan Garam
dapur, larutan gula, larutan cuka
Larutan Koloid 1 – 1000 nm koloid susu, Memiliki Efek Tyndal, Gerak Brown dan dapat dipisahkan
dengan kertas semipermeabel
1.2 Proses Pelarutan dari sudut Pandang Molekul
Pada cairan dan padatan, molekul-molekul saling terikat dengan adanya tarik-menarik antar molekul. Gaya ini akan memainkan peran penting dalam pembentukan larutan. Air sebagai pelarut dalam fasa cair memiliki ikatan hydrogen antara molekul H2O yang satu dengan yang lainnya. Bila suatu zat melarut dalam pelarut seperti air, proses pelarutan dapat dibayangkan melalui tiga tahap. Tahap pertama adalah pemisahan molekul pelarut, tahap ke dua pemisahan molekul zat terlarut, dan tahap ke tiga molekul pelarut dengan zat terlarut bercampur.
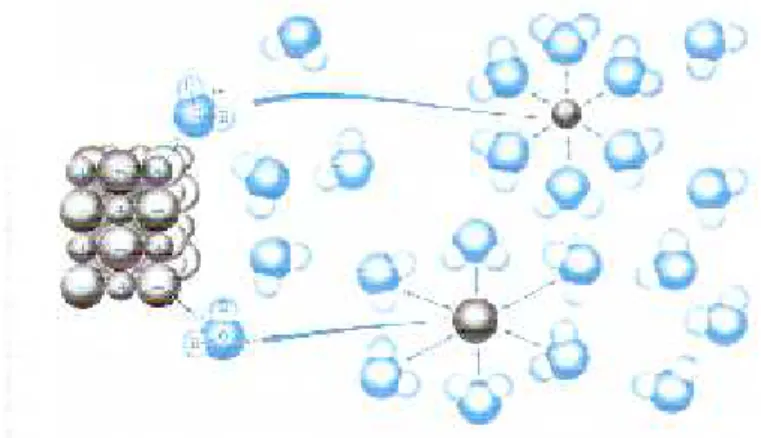
Proses pembentukan larutan dari padatan ion dalam air seperti larutan NaCl dalam air, molekul air yang memiliki dwikutub yang terdiri dari sisi negatif dan sisi positif. Sisi negative dari dwikutub ini
3 mengelilingi ion positif dari ion Na+ sedangkan sisi positif dwikutub mengelilingi ion negative dari ion Cl-. Seperti terlihat pada Gambar 1.1
SumberPetrucci 1985.
Gambar 1.1 Pelarutan Kristal ion dalam air.
Kemudahan partikel zat terlarut menggantikan molekul pelarut bergantung pada kekuatan relative dari tiga jenis interaksi
a. interaksi pelarut-pelarut
b. interaksi zat terlarut-zat terlarut c. interaksi pelarut-zat terlarut Kalor pelarutan mengikuti rumus :
Hpelarutan
Dimana :kalor pemutusan ikatan pelarut-pelarut
kalor pemutusan ikatan zat terlarut- zat terlarut
kalor pembentukan ikatan pelarut – zat terlarut
4 Kalau interaksi pelarut-zat terlarut lebih kuat dibandingkan interaksi pelarut-pelarut dan inetraksi zat terlarut-zat terlarut, maka proses pelarutannya disebut eksoterm ( Hpelarutan < 0), sebaliknya Kalau interaksi pelarut-zat terlarut lebih lemah dibandingkan interaksi pelarut-pelarut dan inetraksi zat terlarut-zat terlarut, maka proses pelarutannya disebut endoterm (Hpelarutan> 0)
1.3 Konsentrasi Larutan
Larutan yang merupakan campuran homogen, komposisinya dapat berbeda. Misalnya dua buah larutan garam yang pelarutnya sama-sama satu liter, sedangkan jumlah garam terlarut berbeda. Dari dua larutan tersebut orang lain tidak bisa mengetahui secara langsung berapa garam yang tekandung di dalamnya. Sebagai informasi mengenai jumlah realtif solut dan sovent dalam larutan digunakan istilah konsentrasi larutan Konsentrasi Larutan adalah Jumlah zat terlarut dalam setiap satuan larutan atau pelarut. Konsentrasi larutan merupakan suatu label larutan, agar larutan tersebut bisa memberikan gambaran atau informasi tentang perbandingan jumlah zat terlarut dan jumlah pelarutnya. Konsentrasi larutan yang sering dipergunakan dilaboratorium diantaranya adalah molaritas (M), Normalitas (N), Fraksi Mol ( X), molalitas (m) dan ppm. Berikut ini akan dibahas bagaimana mengungkapkan konsentrasi larutan beberapa satuan.
5
Molaritas
Ada beberapa cara untuk memperoleh konsentrasi larutan secara kuantitatif. Suatu istilah yang sangat berguna yang berkaitan dengan stoikiometri suatu reaksi dalam larutan disebut konsentrasi molar atau molaritas, dengan simbol M. Dinyatakan sebagai jumlah mol suatu solut dalam larutan dibagi dengan volume larutan yang ditentukan dalam liter.
larutan liter solut mol M) Molaritas(
Larutan yang mengandung 1 mol NaCl dalam 1 L larutan mempunyai molaritas 1 M. Jika larutan ada larutan tertulis HCl 0,1 M berarti dalam satu liter larutan terdapat 0,1 mol HCl. Sekarang cobalah diperhatikan suatu contoh yang memperlihatkan bagaimana menghitung suatu larutan.
Contoh Soal 1.
2,00 gram natrium hidroksida, NaOH (senyawa yang banyak ditemukan dalam pembersih Drano), dilarutkan dalam air dan membentuk larutan dengan volume 200 mL. Berapa molaritas NaOH dalam larutan?
6
Penyelesaian:
Untuk menghitung molaritas, kita ambil perbandingan antara jumlah mol solut dengan jumlah liter larutan. Ini berarti kita mengetahui jumlah NaOH dalam mol dan volume larutan dalam liter.
Massa rumus NaOH 40,0 g/mol, dengan demikian:
2,00 g NaOH × gNaOH molNaOH 0 , 40 1 = 0,0500 mol NaOH
Jika dinyatakan dalam liter, 200 mL menjadi 0,200 L. dengan demikian molaritasnya adalah:
Molaritas = larutan L 0,2 NaOH mol 0,05 = 0,250 mol NaOH/liter = 0,250 M NaOH
Alasan molaritas merupakan konsentrasi yang sangat berguna adalah karena jika kita mengetahui molaritas suatu larutan, kita dapat menentukan jumlah mol solut yang diinginkan dengan cara mengukur volumenya yang tepat. Sebagai contoh, misalnya kita mempunyai suatu wadah yang besar dan berisi 0,250 M larutan NaOH dan misalnya kita membutuhkan suatu reaksi jumlah NaOH tepat 0,250 mol. Label yang ada pada wadah itu tertulis setiap liter larutan mengandung 0,250 mol NaOH, dengan demikian apa yang akan kita kerjakan adalah mengambil sejumlah 1 L larutan dan kita akan memperoleh 0,25 mol NaOH. Demikian juga, jika kita ingin membutuhkan 0,5 mol NaOH
7 untuk suatu percobaan, kita dapat mengambil larutan itu sejumlah 2 L larutan dan jika membutuhkan hanya 0,125 mol NaOH, kita dapat mengambil sejumlah 0,5 L (500 mL) larutan. Oleh sebab itu untuk penggunaan molaritas secara tepat, kita harus mempelajari hubungan mol suatu solut dengan volume larutan dan contoh-contoh berikut ini memperlihatkan bagaimana hubungan ini dilaksanakan.
Contoh Soal 2
Berapa mililiter dari larutan 0,25 M NaOH yang dibutuhkan untuk mendapatkan 0,02 mol NaOH?
Analisa:
Untuk perhitungan, molaritas merupakan jembatan antara mol zat terlarut dan volume larutan. Pada label tertulis 0,25 M NaOH, dalam 1 liter larutan mengandung 0,25 mol NaOH. Angka ini dapat digunakan sebagai faktor konversi yang langsung dapat digunakan atau diubah lebih dahulu:
larutan L 1 NaOH mol 0,25 atau NaOH mol 0,25 larutan L 1
Kita dapat juga mengubah volume menjadi milliliter dan ditulis sebagai berikut: larutan mL 1000 NaOH mol 0,25 NaOH mol 0,250 larutan mL 1000 8 Kemudian untuk menjawab soal ini kita mulai dengan mengubah arti molaritas yang tertulis menjadi faktor konversi, dengan demikian soal ini dapat dijawab secara tepat.
Penyelesaian:
Kita dapat mengubah bentuk soal ini menjadi:
Untuk 0,02 mol NaOH setara mL larutan NaOH 0,25 M Untuk mengubah mol NaOH menjadi milliliter larutan, kita
butuhkan faktor konversi “mol NaOH” dalam denominator. Karena kita
membutuhkan jawaban dalam milliliter, maka:
0,02 mol NaOH × NaOH mol 0,25 larutan mL 1000 = 80 mL larutan
Dengan demikian kita ambil 80 mL larutan 0,25 M NaOH, yang berarti mengandung 0,02 mol NaOH.
Contoh Soal 3.
Berapa gram NaOH yang ada dalam 50 mL larutan 0,4 M NaOH?
Analisa: Kita dapat menulis soal ini menjadi:
50 mL larutan setara dengan berapa g NaOH
Molaritas dapat digunakan sebagai faktor konversi suntuk
mengubah “mL larutan” menjadi mol NaOH dan kemdian kita gunakan
9
Penyelesaian:
Mula-mula, 0,4 M diubah menjadi perbandingan mol dengan volume.
0,400 M berarti larutan mL 1000 NaOH mol 0,4
Kemudian perbandingan ini digunakan sebagai faktor konversi
untuk menghitung “mL larutan”.
50 mL larutan × larutan mL 1000 NaOH mol 0,4 = 0,02 mol NaOH
Massa formula NaOH adalah 40,0 g/mol. Maka:
0,02 mol NaOH × NaOH mol 1 NaOH g 40 = 0,8 g NaOH
Dengan demikian 50 mL NaOH 0,4 M mengandung 0,8 g NaOH. Kadang-kadang jika anda sedang bekerja di Laboratorium, membutuhkan larutan dengan konsentrasi tertentu. Untuk membuat larutan ini tidak begitu sukar, seperti dapat dilihat pada contoh berikut:
Contoh Soal 4
Berapa gram perak nitrat, AgNO3 dibutuhkan untuk membuat 500 mL larutan AgNO30,300 M?
Analisa:
Apa yang sebetulnya kita butuhkan disini adalah berapa gram AgNO3 yang harus ada dalam larutan akhir. Jika kita dapat membayangkannya, kita dapat menimbang solut yang dibutuhkan, kemudian dilarutkan
10 dalam pelarut secukupnya sesuai dengan larutan yang diinginkan. Dengan demikian soal ini dapat dijawab seperti yang disajikan ini.
Penyelesaian:
Mula-mula, molaritas diubah menjadi
0,300 M AgNO3berarti larutan mL 1000 AgNO mol 0,3 3
Dalam larutan akhir, jumlah AgNO3yang harus ada adalah:
500 mL larutan × larutan mL 1000 AgNO mol 0,3 3 = 0,15 mol AgNO3
Massa molar AgNO3adalah 170 g/mol. Dengan demikian
0,15 mol AgNO3× 3 3 AgNO mol 1 AgNO g 170 = 25,5 g AgNO3
Untuk mempersiapkan larutan yang diminta pada contoh di atas, kita harus melarutkan 25,5 g AgNO3dalam sejumlah air sehingga volume akhir menjadi tepat 500 mL. Untuk mengukur volume dengan tepat digunakan labu takar (Gambar 3.4). Labu ini berisi volume tertentu jika diisi sampai tanda garis yang melingkar pada leher labu tersebut. Gambar 3.5 memperlihatkan langkah-langkah yang dilaksanakan untuk membuat larutan tersebut.
Sebagai langkah akhir untuk pembuatan larutan dalam contoh ini adalah volume larutan diisi sampai volume akhir tepat 500 mL. Kita tidak boleh menambah air 500 mL ke perak nitrat, karena hal ini menyebabkan volume akhir menjadi sedikit lebih besar dari 500 mL
11 (baik solut maupun pelarut mengambil ruang yang ada dalam labu takar). Jika benar dilaksanakan penambahan air 500 mL, maka konsentrasi akan menjadi sedikit lebih kecil dari 0,3 M (sesuai dengan konsentrasi yang kita inginkan), karena solut lebih terpencar dalam volume yang sedikit lebih besar dari yang diharapkan
Menentukan Molaritas Larutan Pekat
Bahan atau zat berupa larutan yang tersedia dilaboratorium, seperti HNO3, H2SO4, NH3, HCl dan lain-lain umumnya berupa larutan pekat yang dikemas dalam suatu botol. Masing-masing larutan pekat tersebut diberi label perihal keterangan mengenai larutan.
Konsentrasi larutan pekat yang tersedia di laboratorium umumnya diberikan dalam bentuk persen (%). Larutan H2SO4/p biasanya mempunyai persentase 95 - 97 %, HCl/p antara 31 - 33 %. Bila kita menginginkan konsentrasi larutan dalam bentuk molaritas atau yang lainnya, maka perlu diperhatikan keterangan lain yang terdapat pada label dari larutan tersebut, seperti berat jenis, Molekul relatif (Mr), dan yang lainnya.
Sebelumnya Telah dibicarakan bahwa konsentrasi larutan dalam molaritas menyatakan banyaknya mol suatu senyawa setiap liter larutan. Yang perlu diperhatikan dalam mengubah konsentrasi dari % ke konsentrasi lainnya adalah masalah satuan. Kalau kita akan merubah konsentrasi menjadi molaritas. Maka kita harus tahu terlebih
12 dahulu satuan dari molaritas molaritas yaitu mol suatu zat per liter larutan. Untuk mengubahnya dapat dilakukan sebagai berukut :
massa zat per liter larutan = ( / )kg L xpersen(/100)x g kg 1000
1 , sehingga konsentrasi molaritas dapat ditulis :
Molaritas (zat X) = Mr(X) 1kg 1000g . % . ρ(kg/L)
Sedangkan untuk zat berupa padatan molaritan larutan dapat dihitung dengan persamaan
Molaritas = V(liter) 1 x Mr(X) m(X) Contoh Soal 5.
Asam sulfat pekat yang diproduksi dari pabrik dan disering digunakan dilaboratorium mempunyai konsetrasi antara 95 % - 97%. Berat jenis larutan asam tersebut adalah 1,84 kg/L (Mr = 98,08). Kalau larutan tersebut diubah konsentrasinya menjadi molaritas, berapa M konsentrasinya.
13 Penyelesaian : Dik : = 1,8 kg/L % = 96 % = 96/100 Mr(H2SO4= 98,08 Dit. Molaritas = ? Penyelesaian : Molaritas H2SO4= ) SO Mr(H 1kg 1000g x 100 96 x kg/L 1,84 4 2 = 18,01 mol/L = 18 M Molalitas (m)
Molalitas merupakan suatu konsentrasi larutan yang menyatakan banyaknya mol senyawa atau zat setiap kilogram pelarut (solvent).
Jika Mm adalah massa molar (g mol-1), maka :
pelarut kg M terlarut zat gram (m) Kemolalan m 14 Contoh Soal 6
1. Hitung kemolalan larutan metil alkohol (Mr = 32), dengan melarutkan 37 g metil alkohol (CH3OH) dalam 1750 g air.
Penyelesaian : m 0,680 kg 1,1750 mol 1,156 Kemolalan mol 1,156 32,0 g 37 terlarut zat mol mol g
2. Suatu larutan asam sulfat sebanyak 200 mL mempunyai konsentrasi 20% berat, dan kerapatannya 1,200 g/mL. Hitung kemolalan larutan, MrH2SO4= 98. Jawab :
m 2,55 0,192 mol 0,490 Kemolalan g 192 g 48,0 240 (pelarut) Berat SO H mol 0,490 mol g 98 g 48,0 SO H mol Jumlah SO H g 48,0 240 0,20 terlarut) (zat SO H Berat g 240 mL g 1,200 mL 200 larutan Berat 4 2 1 4 2 4 2 4 2 15
Menentukan Molalitas Larutan Pekat
Menentukan molalitas larutan dari larutan pekat, terlebih dahulu dihitung massa dari zat terlarut dan massa pelarutnya. Kalau larutan yang konsentrasinya dinyatakan dalam % dan berat jenisnya diketahui, maka massa zat dapat dihitung :
Massa zat = 1Kg 1000g x rsen(/100) ρ(Kg/L)xpe
Kemudian jika dalam larutan tersebut hanya terdiri dari satu macam zat terlarut dan pelarut saja, maka massa pelarutnya adala sebagai berukut :
Massa pelarut = ( / ) (kg L x 100%%) molalitas = mol/Kg pelarut
molalitas = %). ).(100% (X).ρX).ρ( M ) (1000g/1kg . % . ρ(kg/L) m
Untuk zat padat yang dilarutkan dalam air molalitas (m) larutan dihitung dengan persamaan
Molalitas = m(pelarut) 1 x (X) M m(X) m
Dimana m(X) = massa zat X dalam gram m(pelarut) = massa pelarut dalam kg
16
Contoh Soal 7.
Ubahlah konsentrasi larutan H2SO4pekat 96 % dan berat jenisnya = 1,84 mejadi molalitas Penyelesaian Molalitas H2SO4 = )). SO %(H ).(100% SO ).ρ.ρ SO (H M kg) ).(1000g/1 SO ).%(H SO ρ(H 4 2 4 2 4 2 m 4 2 4 2 = 1 84 96 100 1000 1 98 1 84 1 0 96 , ( / ). / . ( / ) ( / ). , ( / )( , ) kg L g kg g mol kg L = 244,9 mol/kg pelarut = 244,9 m Normalitas (N)
Normalitas disefinisikan sebagai jumlah mol ekivalen dari suatu zat per liter larutan.
Normalitas = V(Liter) n molekivale Atau larutan liter ekivalen massa terlarut zat gram Normalitas x
17
Contoh Soal 8
1. Hitung kenormalan larutan yang mengandung 36,75 g H2SO4 dalam 1,5 liter larutan. MrH2SO4= 98.
Jawab : N 0,50 1,50 49 36,75 Kenormalan 49 ekivalen Massa
Untuk padatan yang dilarutkan dalam air, normalitas larutan dapat ditentukan denga rumusan berikut:
= xn V(ml) 1000 x (X) M m(X) m
dimana n adalah banyaknya ekivalen setiap mol zat X.,
Menentukan Normalitas Larutan Pekat
Cara menentukan normalitas larutan pekat dapat ditentukan dengan persamaan Normalitas = ) SO (H M 1kg 1000g x 100 96 x 1,84kg/L 4 2 m x n Catatan 18 Harga n suatu zat dapat dihitung dari bobot ekivalennya. Bobot ekuivalen suatu zat yng terlibat dalam suatu reaksi, yang digunakan sebagai dasar untuk suatu titrasi, didefinisikan sebagai
1. Asam basa Bobot ekuivalen adalah bobot dalam gram (dari) suatu
zat yang diperlukan untuk memberikan atau bereaksi dengan i mol (1,008 g) H+
2. Redoks. Bobot ekuivalen adalah botot dalam gram (dari suatu zat
yang diperlukan untuk memberikan atau bereaksi dengan i mol elektro.
3. Pengendapan atau pembentukan kompleks bobot gram ekuivalen
adalah bobot dalam gram (dari) zat itu yang diperlukan untuk memberikan atau bereaksi dengan i mol kation univalen, ½ mol kation divalen, 1/3 mol kation trivalen dan seterusnya
Hubungan bobot ekuivalen dan bobot molekul dapat dirumuskan sebagai berukut :
gram ekuivalen = n Mr
dimana untuk asam basa n = jumlah mol ion H+, untuk Redoks n = banyaknya elektron, dan untuk kompleks n = jumlah muatan kation.
19 Yaitu menyatakan banyaknya gram suatu zat dalam 106 gram larutan. ppm = m zat m sampel x ( ) ( ) 10 6ppm Fraksi mol
menyatakan mol suatu zat per jumlah mol keseluruhan;
X1 = mol zat
mol total
( )
( )
1
Konsentrasi dalam Persen
Dalam bidang kimia sering digunakan persen untuk menyatakan konsentrasi larutan. Persen konsentrasi dapat dinyatakan dengan persen berat (% W/W), persen volume (% V/V) dan persen berat/volume (% W/V). a. Persen berat (% W/W) 00 1 larutan gram terlarut zat gram W/W) (% berat Persen 20 Contoh Soal 9
1. Hitung berapa % berat NaCl yang dibuat dengan melarutkan 20 g NaCl dalam 55 g air.
Penyelesaian : % berat NaCl = 100 55 20 20 = 26,67 % berat Contoh Soal 10 :
. Hitung % W/W, CH3COOH dalam 5 mL cuka dengan kerapatan 1,008 g/mL, yang mengandung 0,2589 g CH3COOH.
Penyelesaian % CH3COOH = 100 1,008 mL 5 COOH CH g 0,2589 mL g 3 = 5,14% b. Persen volume (% V/V) Persen volume (% V/V) = 100 larutan mL terlarut zat mL
21
Contoh Soal 11 :
50 ml alkohol dicampur dengan 50 ml air menghasilkan 96,54 ml larutan. Hitung persen volume masing-masing komponen.
Penyelesaian
persen volume alkohol = 100 54 , 9650 = 51,79%
persen volume air = 100
54 , 9650 = 51,79%
Contoh Soal 12 :
Suatu larutan diperoleh dengan melarutkan 33 g alkohol, (C2H5OH) dalam air sehingga diperoleh 100 ml larutan.
Jika kerapatan C2H5OH murni 0,785 g/ml, hitung konsentrasi C2H5OH dinyatakan dalam persen volume.
Penyelesaian
Volume alkohol semula 42,04mL 0,78533 Volume 100 42,04% 100 04 , 42 c. Persen berat/volume (% W/V) 22 Persen berat-volume (% W/V) = 100 larutan mL terlarut zat gram
Persen berat sering digunakan karena tidak bergantung pada temperatur.
Parts Per Million dan Parts Per Billion
Jika larutan sangat encer digunakan satuan konsentrasi parts per million, ppm (bagian per sejuta), dan parts per billion, ppb (bagian per milliard). Satuan ini banyak digunakan dalam analisis unsur dalam jumlah trace (kelumit) dengan SSA (Spektrometri Serapan Atom)
larutan L 1 terlarut zat g μ 1 ppb 1 larutan L 1 terlarut zat mg 1 ppm 1 Contoh 13
1. Suatu larutan aseton dalam air mengandung 8,60 mg aseton dalam 21,4 L larutan. Jika kerapatan larutan 0,997 g/cm3, hitung konsentrasi aseton dalam (a) ppm dan (b) ppb.
Penyelesaian : (a) ppm aseton = 6 10 larutan berat terlarut zat berat ppm Berat aseton 8,60 mg = 8,60 x 10-3g
23 Berat air = 21,4 L x 1000 mL/L x 0,997 g/mL = 21,4 x 104g ppm aseton = 4 106 air g 10 21,4 aseton g 8,60 = 0,402 ppm (b) ppb aseton = 109 air berat aseton berat = 4 109 air g 10 21,4 aseton g 8,60 = 402ppb Fraksi Mol (x) A mol fraksi
Total
n A n A X pelarut mol jumlah terlarut zat mol jumlah pelarut mol jumlah pelarut mol fraksi pelarut mol jumlah terlarut zat mol jumlah terlarut zat mol jumlah terlarut zat mol fraksi Contoh Soal 14Hitung berapa fraksi mol NaCl dan fraksi mol H2O dalam larutan 117 g NaCl dalam 3 kg H2O.
24 Penyelesaian : 0,988 168,6 166,6 air mol fraksi 0,012 168,6 2 NaCl mol fraksi mol 166,6 18 3000 air kg 3 mol 2 58,5 117 NaCl g 117 Contoh Soal 15
Hitung fraksi mol H2SO4 dalam larutan yang mengandung 0,56 mol dalam 1 kg H2O jika diketahui Mr . H2O = 18 g/mol.
Penyelesaian : mol 55,56 18 1000 air l mo Jumlah
25 010 , 0 12 , 56 56 , 0 56 , 55 56 , 0 56 , 0 4 2 SO H mol fraksi Keformalan (F) larutan liter terlarut zat rumus massa jumlah Keformalan Contoh Soal 16
Hitung keformalan suatu larutan diperoleh dengan melarutkan 1,90 g Na2SO4dalam 0,085 liter larutan..
Penyelesaian :
Massa Molar, Na2SO4: 142
F 0,16 0,185 0,0134 keformalan rumus berat 0,0134 142 1,90 SO Na g 1,90 2 4
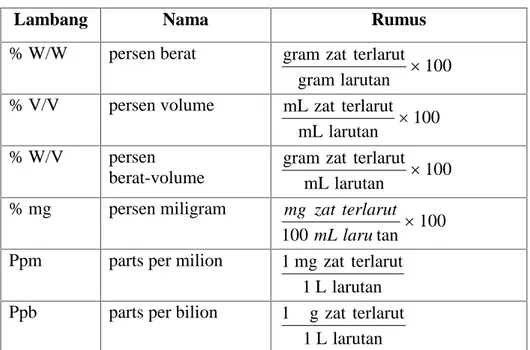
Konsentrasi larutan di atas dikelompokkan dalam satuan fisik atau satuan kimia. Konsentrasi yang termasuk dalam satuan Fisika dan Kimia dapat di lihat pada tabel berikut
26 Tabel 1.1 Konsentasi Larutan dalam Satuan Kimia
Lambang Nama Rumus
% W/W persen berat 100 larutan gram terlarut zat gram % V/V persen volume 100 larutan mL terlarut zat mL % W/V persen berat-volume mLlarutan 100 terlarut zat gram % mg persen miligram 100 tan 100 mLlaru terlarut zat mg Ppm parts per milion
larutan L 1 terlarut zat mg 1 Ppb parts per bilion
larutan L 1 terlarut zat g μ 1
Tabel 1.2 Konsentrasi Larutan dalam satuan Kimia
Lambang Nama Rumus
1 2 3 X fraksi mol pelarut mol terlarut zat mol terlarut zat mol F Formal larutan liter terlarut zat rumus massa M Molar larutan liter terlarut zat mol
27 1 2 3 M Molal pelarut kg terlarut zat mol N normal larutan liter terlarut zat ekivalen
m Eq miliekivalen seperseribu mol muatan
Osm osmolar larutan liter osmols Soal Latihan Konsentrasi Larutan
1. 0,395 g KMnO4 dimasukkan ke dalam labu ukur 250 ml, kemudian ditambah dengan air hingga volume larutan mencapai tanda batas pada labu. Tentukan konsentrasi dari larutan KMnO4tersebut dalam molaritas
2. Hitung konsentrasi larutan dalam molaritas dari :
a. 4 gram NaOH dalam 750 ml larutan b. 0,25 mol HCl dalam 2 liter larutan
c. 56,5 g NaCl yang larut dalam 2 liter larutan d. 0,1 mol H2SO4dalam 1 liter larutan
3. Hitung konsentrasi larutan dalam molaritas dari :
a. HCl pekat 32 % yang mempunyai berat jenis 1,16 kg/L b. HNO3pekat 69 % dengan berat jenis 1,40 kg/L
c. KClO3pekat 60 % yang berat jenisnya 1,530
28
4. Hitung normalitas dari masing-masing larutan soal no 2.dan 3 5. Berapa gram Na2CO3yang diperlukan untuk membuat 2 liter larutan
Na2CO31,5 M.
6. Bila 0,585 g padatan NaCl dilarutkan dalam 500 ml air (berat jenis
air = 1 kg/L). hitung konsentrasi larutan ini dalam molalitas (m).
7. Berapa gram K2Cr2O7 yang diperlukan untuk membuat laruran : 2 liter larutan K2Cr2O7 0,2 M
Suatu larutan dibuat dengan cara melakukan H2SO4100% sebanyak 80 gram dalam 120 gram air mempunyai berat jenis 1,303 g/mL. Hitung :
a). Persen berat b). Kemolalan c). Kemolaran d). Fraksi mol
8. Suatu larutan 45% berat dari NaNO3 mempunyai kerapatan 1,368 g/mL. Hitung a. fraksi mol,
b. kemolaran dari NaNO3.
9. Kerapatan dan persen berat suatu larutan asam sulfat 1,28 g mL-1dan 37% W/W.Hitung :
a). Keformalan larutan b). Kemolaran
c). Kemolalan
d). Fraksi mol H2SO4
29 a. Larutan KCl 0,2 M sebanyak 2 liter
b. Larutan KMnO41 M sebanyak 250 ml
c. Larutan KMnO4yang mengandung 2 mol Mn sebanyak 500 ml d. Larutan Fe2(SO4)3yang mengandung 5 ppm besi
11. Berapa mL larutan pekat yang diperlukan untuk membuat larutan berikut :
a. Laruran H2SO4 0,1 N sebanyak 2 liter dari asam sulfat pekat ( 97 %, berat jenisnya 1.84 kg/L)
b. Laruran HCl 1 M sebanyak 750 mL dari HCl pekat 32 % yang mempunyai berat jenis 1,16 kg/L
c. Larutan HNO3 10 % sebanyak 2 liter dari HNO3 pekat 69 % dengan berat jenis 1,40 kg/L
Konsentrasi Pengenceran 30 BAB II
KONSENTRASI PENGENCERAN
Tujuan Pembelajaran
Setelah mempelajarari pada bagian bab ini, diharapkan mahasiswa :
1. Menjelaskan prinsip-prinsip dalam pengenceran
2. dapat mlakukan pengenceran latutan dan perhitungannya
3. mengggunakan konsep pengenceran dalam mempersiapkan
larutan di laboratorium
2.1 Pengertian Pengenceran
Dalam pekerjaan sehari-hari di Laboratorium, biasanya kita menggunakan larutan yang lebih rendah konsentrasinya dengan cara menambah pelarutnya. Di laboratorium kimia membeli larutan senyawa kimia dalam air yang konsentrasinya pekat, sebab cara ini adalah cara yang sangat ekonomis. Biasanya senyawa kimia yang dibeli ini demikian pekatnya, untuk keperluan sehari-hari larutan ini harus diencerkan. Proses pengenceran adalah mancampurkan larutan pekat (konsentrasi tinggi) dengan cara menambahkan pelarut agar diperoleh volume akhir yang lebih besar atau konsentrasi yang lebih kecil.
Konsentrasi Pengenceran 31
Gambar 2.1 Pelarutan dan Pengenceran
2.2 Menentukan konsentrasi larutan hasil pengenceran
Pengenceran yang dimaksudkan dalam larutan kimia, yaitu memperbesar jumlah pelarut pada suatu larutan yang mempunyai jumlah mol zat tertentu. Pengenceran yang biasa dilakukan adalah dengan mengambil larutan yang mempunyai konsentrasi volume tertentu kemudian ditambah dengan pelarut (aquades untuk pelarut air) sampai volumenya sesuai dengan yang diharapkan. Hasil pengenceran jumlah mol zat terlarut yang ada dalam larutan tidak berubah, akan konsentrasi larutan berubah, hal ini disebabkan oleh perubahan volume pelarut.
Konsentrasi Pengenceran 32
a b
Gambar 2.2. a) 250 ml larutan CuSO4 2 M, b) larutan a yang sudah ditembah dengan 750 ml pelarut
Hubungan antara konsentrasi M (molaritas), Volume V dan mol n, adalah :
M n V
, maka n = M x V
Pada pengenceran jumlah zat terlarut tidak berubah, yang berubah adalah jumlah pelarut, sehingga jumlah mol zat terlarut sebelum dan sesudah diencerkan tetap.
Konsentrasi Pengenceran 33
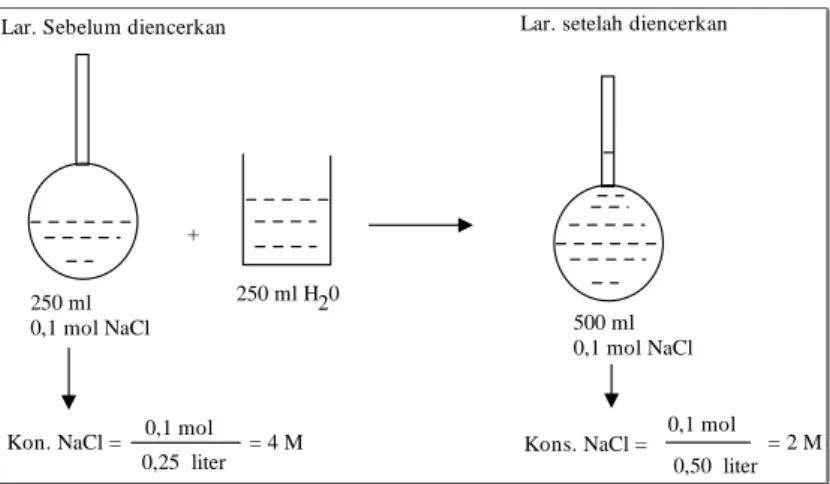
mol zat sebelum diencerkan = mol zat setelah diencerkan n1 = n2 250 ml 0,1 mol NaCl 250 ml H20 500 ml 0,1 mol NaCl +
Lar. Sebelum diencerkan Lar. setelah diencerkan
Kon. NaCl = 0,1 mol
0,25 liter = 4 M Kons. NaCl = 0,1 mol
0,50 liter = 2 M
Gambar 2.3 Perubahan konsentrsasi yang terjadi dalm pengenceran
Kalau kita memisalkan : volume dan konsentrasi larutan sebelum diencerkan masing-masing adalah V1 dan M1 (M untuk
molaritas) sedangkan volume dan konsentrasi larutan sesudah diencerkan masing-masing adalah V2 dan M2 , maka berlaku
hubungan :
n1 = n2
Konsentrasi Pengenceran 34
Demikian juga untuk konsentrasi yang lainnya seperti : N (normalitas), mol ekivalen zat terlarut sebelum dan sesudah dilakukan pengenceran tidak berubah.
grek. sebelum diencerkan = grek setelah diencerkan molek1 = molek2
N1 x V1 = N2 x V2 Dimana :
N1 = konsentrasi (normalitas ) larutan sebelum diencerkan V1 = volume larutas sebelum diencerkan
N2 = konsentrasi (normalitas) larutan setelah diencerkan V2 = volume larutan setelah diencerkan
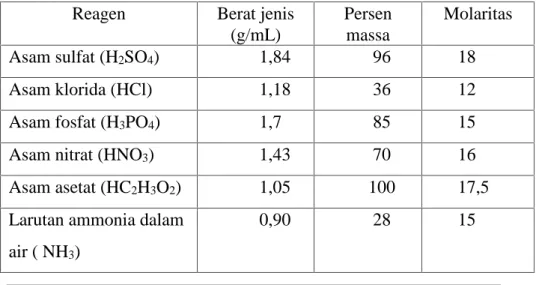
Tabel 2.1 Larutan Pekat yang konsentrasinya tinggi di Laboratorium
Reagen Berat jenis (g/mL)
Persen massa
Molaritas
Asam sulfat (H2SO4) 1,84 96 18
Asam klorida (HCl) 1,18 36 12
Asam fosfat (H3PO4) 1,7 85 15
Asam nitrat (HNO3) 1,43 70 16
Asam asetat (HC2H3O2) 1,05 100 17,5
Larutan ammonia dalam air ( NH3)
0,90 28 15
Konsentrasi Pengenceran 35
Contoh Soal 1
Seorang asisten mahasiswa memelukan larutan HCl 1 M sebanyak 1000 ml untuk kegiatan praktikum mahasiswa bimbingannya. Larutan yang ada di laboratorium adalah HCl pekat 32 % yang berat jenisnya 1,16 kg/L. (Mr(HCl) = 36,5 g/mol)
a. Berapa ml larutan HCl pekat yang diperlukan.
b. berapa meliliter aquades yang diperlukan untuk pengenceran. c. bagaimana cara membuatnya.
Contoh Soal 2
Contoh Soal 2.
Berapa mL H2SO4pekat (18,0 M) yang dibutuhkan untuk membuat 750 mL larutan H2SO43,00 M? Penyelesaian: Gunakan rumus 3.1 M1V1= M2V2 M1= 18,0 M M2= 3,00 M V1= ? V2= 750 mL Jawab Viadalah:
Konsentrasi Pengenceran 36 1 2 2 1 M V M V V1= M mL M 0 , 18 ) 750 )( 00 , 3 ( V1= 125 mL
Untuk membuat larutan ini, diencerkan 125 mL H2SO4 pekat menjadi volume akhir 750 mL.
Ada hal penting untuk pengamanan yang perlu diperhatikan pada contoh di atas. Jika suatu larutan senyawa kimia yang pekat diencerkan, kadang-kadang sejumlah panas dilepaskan. Hal ini terutama dapat terjadi pada pengenceran asam sulfat pekat. Agar panas ini dapat dihilangkan dengan aman, asam sulfat pekat yang harus ditambahkan ke dalam air, tidak boleh sebaliknya. Jika air ditambahkan ke dalam asam sulfat pekat, panas yang dilepaskan sedemikian besar yang dapat menyebabkan air mendadak mendidih dan menyebabkan asam sulfat memercik. Jika kita berada didekatnya, percikan asam sulfat ini merusak kulit.
Contoh Soal 3
Berapa banyak air yang harus ditambahkan ke dalam 25,0 mL KOH 0,500 M agar diperoleh konsentrasi 0,350 M?
Konsentrasi Pengenceran 37
Penyelesaian:
Persamaan untuk pengenceran adalah: M1V1= M2V2
M1= 0,500 M M2= 0,350 M V1= 25,0 mL V2= ?
Dengan cara substitusi kita peroleh:
M 0,350 25,0mL) (0,500M)x( V2 V2 = 35,7 mL
Larutan mula-mula adalah 25,0 mL, harus ditambah 10,7 mL. (Dapat dianggap bahwa penambahan volume bersifat aditif. Bekerja dengan larutan encer biasanya anggapan ini masih cukup valid).
Contoh Soal 4
Misalnya 200 mL air ditambahkan ke dalam 300 mL larutan yang pada labelnya tertulis HNO30,600 M. Berapa konsentrasi solutdalam larutan akhir?
Penyelesaian
Konsentrasi Pengenceran 38 M1V1= M2V2 M1= 0,600 M M2= ? V1= 300 mL V2= 200 mL + 300 mL = 500 mL Jawab M2menjadi: 2 1 1 2 V V M M ) 500 ( ) 300 )( 600 , 0 ( mL mL M = 0,360 M
Konsentrasi HNO3dalam larutan akhir adalah 0,360 M.
Dalam contoh ini, kita menganggap penambahan volume dapat diabaikan. Pada contoh di atas kiat anggap 200 mL H2O ditambah 300 mL larutan pekat menghasilkan volume total akhir 500 mL. hal ini sebetulnya kurang benar. Untuk kebanyakan larutan yang biasa digunakan cara ini cukup memadai, tetapi untuk analisa yang harus tepat sekali, harus menggunakan labu takar. Pelarut harus ditambahkan sedikit-sedikit sampai volume larutan mencapai tanda garis yang mengelilingi leher labu takar. Untuk memperoleh larutan dengan molaritas yang diinginkan, kita ambil sejumlah tertentu larutan yang pekat dimasukkan dalam labu takar. Kemudian pelarut ditambahkan sedikit-sedikit sampai volume larutan mencapai tanda garis yang ada
Konsentrasi Pengenceran 39
dileher labu. Dengan cara ini solute larutan awal yang pekat (konsentrasinya tinggi) didistribusi tepat sekali dalam volume akhir.
Contoh Soal 5
Bagaimana cara membuat 1 L larutan HCl 1 M dari larutan pekat 30 %, yang berat jenisnya 1,16 kg/L
Penyelesain:
Konsentrasi larutan HCl pekat (M1) sebagai larutan sebelum diencerkan adalah : M1 = ) 36,5(g/mol ) (1000g/1Kg x(32/100)x 1,16(kg/L) = 10,17 mol/L
Konsentrasi larutan yang akan dibuat (konsentrasi larutan setelah diencerkan) adalah 1 M yang volumenya 1000 ml (M2 = 1 mol/L; V2= 1000 ml ), sehingga :
a. Volume larutan HCl pekat yang diperlukan adalah :
Konsentrasi Pengenceran 40 V1 = 1 2 2 M V . M = (mol/l) 10,17 ml 000 1(mol/l)x1 = 98,33 ml
b. Volume aquades yang diperlukan untuk pengenceran adalah
V2- V1 = 1000 ml - 98,33 ml = 901,67 ml
c. Cara membuatnya adalah sebagai berukut :
diambil sebanyak 98,33 ml larutan HCl pekat dengan pipet
volum.
kemudian dimasukkan ke dalam labu ukur berukuran 1000 ml. larutan tambah dengan aquadet sampai tanda batas.
larutan diaduk dan disimpan pada botol penyimpan larutan.
Soal Latihan:
1. Larutan NaCl 2 N diencerkan sampai konsentrasinya menjadi 0,5 N.
berapa kali lipat volume akhir pengenceran dibanding dengan volume sebelum diencerkan
2. 4 gram padatan NaOH dilarutkan dalam air sampai volumenya
menjadi 100 ml.
a. berapa molar konsentrasi larutan tersebut
b. bila larutan tersebut ditabah dengan 400 ml air, berapa
konsentrasinya.
3. Untuk membuat larutan H2SO4 0,1 N sebanyak 500 ml, berapa ml asam sulfat pekat yang diperlukan untuk membuat larutan, bila asam
Konsentrasi Pengenceran 41
sulfat pekat mempunyai konsentrasi 96 %, berat jenisnya 1,84 kg/l . (Ar : H = 1; S = 32 dan O = 16)
4. 150 ml Larutan HCl 0,1 M dicampur dengan 250 ml larutan HCl
0,5 M . Hitung berapa konsentrasi campuran HCl tersebut
5. Bila 25 ml etanol 99,8 % yang berat jenisnya 0,79 kg/l diencerkan
sehingga konsentrasinya menjadi 25 %. Berapa volume larutan sesudah diencerkan.
6. Berapa volume larutan AgNO30,1 M harus bereaksi dengan 10 ml larutan K2CrO7 0.0872 M untuk mengendapkan semua kromat sebagai Ag2CrO4.
7. Berapa volume larutan KNO3 1,0 M harus diencerkan dengan air untuk membuat 250 ml larutan KNO30,2 M.
8. Satu liter larutan sampel yang mengandung KOH yang belum diketahui konsentrasi, dilakukan analisis dengan cara mengambil 25 mL kemudian diencerkan dengan aquades sampai volumenya 100 ml selanjutnya dititrasi dengan menggunakan asam. Hasil titrasi ditemukan konsentrasinya 0,1 M. Berapakah konsentrasi pada larutan sampel tersebut.