LAPORAN PRAKTIKUM PTK 3
“ PEMBUATAN NITROBENZENE “
Disusun Oleh :
Ariesta Dwi Utami
(2015430005)
FAKULTAS TEKNIK
UNIVERSITAS MUHAMMADIYAH JAKARTA
I. PRINSIP PERCOBAAN
Prinsip nya berdasarkan Metode nitrasi yaitu dimana reaksi subtitusi gugus Nitro (NO2) ke dalam senyawa benzene.
II. MAKSUD DAN TUJUAN
Untuk mengetahui cara pembuatan Nitrobenzene dari benzen dan asam nitrat dengan katalis H2SO4
Untuk memurnikan nitrobenzen dengan destilasi
Untuk mengetahui sifat fisika dan sifat kimia dari Nitrobenzen
Untuk mengetahui refraksi dari nitrobenzen
III. REAKSI
C6H6 + HNO3 C6H5NO2 + H2O
IV. DASAR TEORI
Nitrasi adalah salah satu contoh dari reaksi subtitusi elektrofilik aromatic. Dalam reaksi ini suatu gugus fungsi terikat secara langsung pada cincin aromatic yakni gugus nitro (NO2). Nitrasi dapat dilakukan dengan menggunakan HNO3 pekat dan H2SO4 pekat. Atau larutan HNO3 dalam suasana asam asetat glacial. Pemilihn suatu nitrasi bergantung pada reaktifan senyawa yang akan dinitrasi dan kelarutannya dalam mediun penitrasi.
Reaksi nitrasi ini menggunakan ion nitril (NO2+) yang biasanya terbentuk dari campuran asam nitrat dan asam sulfat pekat dengan faktor van’t Hoff i=4 (jumlah molekul yang dihasilkan dari satu molekul sumbernya). Sedangkan bila berasal dari etil nitrat, nitrogen pentoksida dan nitrogen titroksida, mempunyai faktor i yang lebih tinggi.
Ikatan gugus NO2 pada senyawa nitro dapat berupa : 1. -C-NO2 : disebut senyawa nitro
contoh : parafin + HNO3 → Nitroparafin + H20 2. -O-NO2 : disebut senyawa nitrat
3. -N-NO2 : disebut senyawa nitriamin
contoh : guanidine + HNO3 → nitroguanidine + H2O Reaksi pembentukan senyawa nitro dapat berupa:
1. Reaksi substitusi terhadap:
2. Reaksi adisi ikatan rangkap
Kegunaan proses nitrasi antara lain pada bidang industri:
1. Bahan peledak yang berupa senyawa nitrat misalnya : gliseril trinitrat dan selulosa nitrat
2. Sebagai senyawa antara untuk pembuatan amina yang disentesa dengan proses reduksi senyawa nitro. Misalnya Nitrobenzena direduksi menjadi anilin yang merupakan bahan baku zat warna.
3. Bahan pengoksidasi misalnya : Nitrobenzena 4. Sebagai zat pelarut
Reaksi Nitrasi
1) Reaksi Umum Nitrasi
a) C-nitration, dimana gugus nitro melekat pada atom karbon
b) O-nitration (an esterification reaction), dimana gugus nitro melekat pada atom oksigen, terbentuk ikatan O-N menghasilkan nitrat ester
a) N-nitration, dimana gugus nitro melekat pada atom nitrogen, terbentuk ikatan N-N menghasilkan senyawa nitramin
2) Reaksi Nitrasi a) Ionik reaction
Aromatik, alcohols, glycols, dan amines umumnya di nitrasi dengan mixed acids via ionic reactions menjadi electrophilic reaction
b) Free-radical reaction
Propane dinitrasi secara komersial dalam jumlah yang besar dengan menggunakan nitric acid pada fase gas dalam free-radical reaction pada T 380–420°C.
3) Faktor Faktor yang Mempengaruhi Nitrasi a) Ratio Asam Nitrat ( R)
Ratio asam nitrat adalah perbandingan asam nitrat 100% dengan zat yang dinitrasi
R = HNO3 . 100%
R harus memenuhi harga tertentu untuk suatu reaksi tertentu. Misalnya: untuk gliceril trinitrat→R = 2,3
b) Nilai Dehidrasi Asam (NDA)
Nilai dehidrasi asammerupakan kemantapan H2SO4 dalam proses nitrasi. NDA = berat asam sulfat 100%, berat air sesudah reaksi
dengan: S =% H2SO4 dalam asam N =% HNO3 dalam asam W =% H2O dalam asam
E =jumlah air sesudah reaksi (air dari H carbon + air dari reaksi) H2N – C – NH + HONO2 H2N – C – N – NO2 + H2O
NH NH
H H
guanidine nitroguanidine
NDA
=
E
.
N
S
Makin besar NDA proses nitrasi makin bagus, makin kecil NDA akan menyebabkan terjadinya akumulasi zat-zat dan mengakibatkan terjadinya oksidasi.
A. ASAM SULFAT
Asam sulfat, H2SO4, merupakan asam mineral (anorganik) yang kuat. Zat ini larut dalam air pada semua perbandingan. Asam sulfat mempunyai banyak kegunaan dan merupakan salah satu produk utama industri kimia. Kegunaan utamanya termasuk pemrosesan bijih mineral, sintesis kimia, pemrosesan air limbah dan pengilangan minyak. Reaksi hidrasi dari asam sulfat adalah reaksi eksoterm yang kuat. Karena asam sulfat bersifat mengeringkan dalam pengolahan kebanyakan buah buahan kering. Diatmosfer, zat ini termasuk salah satu bahan kimia yang menyebabkan hujan asam. a. Sifat Fisis H2SO4
o Memilki aroma khas yaitu belerang
o Berat Molekulnya : 98 gr/mol
o Cairan kental berwarna bening kekuningan
o Kandungan airnya kecil
o Tahan pengoksidasi dan pendehidrasi
o Bersifat korosif dan bersifat hidrokofis
o Berbentuk cair dan berat jenis 1,84 25/ ML ,
o titik didih 240℃ titik leleh 10 ℃
b. Sifat Kimia H2SO4
o Merupakan asam kuat
o Jika di campur dengan air akan menimbulkan reaksi eksoterm.
o H2SO4 bersifat encer tidak bereaksi dengan Bi, Hg, Cu, dan logam mulia
H2SO4 (encer) + Fe FeSO4 + H2
o H2SO4 pekat dalam keadaan panas akan mengoksidasi logam-logam
o Merupakan oksidator dengan reduksi terkuat c. Kegunaan H2SO4
o Bahan pembuatan pupuk amonium sulfat
o Industri obat
o Untuk pembuatan zat warna
o Untuk memurnikan minyak tanah B. BENZENE
Senyawa benzena mempunyai rumus molekul C6H6, dan term asuk dalam golongan senyawa hidrokarbon. Benzena merupakan senyawa aromatis yang paling sederhana. Rumus umun benzene adalah C6H6.
Pada cincin benzene ,istilah orto,para dan meta dapat digunakan jika terdapat dua substituen pada cincin benzene. Orto menunjukkan kedua substituen terletak pada atom karbon yang bersebelahan, meta menunjukkan adanya satu atom karbon di antara keduanya, sedangkan para untuk substituen yang terletak bersebrangan pada benzene. Benzene dan homolognya tidak larut dalam air tetapi dalam pelarut organic. Hidrokarbon aromatic mudah terbakar dan harus ditangani dengan hati-hati. Terlalu lama menghirup uap benzene mengakibatkan penurunan produksi butir darah merah dan putih dan dapat berakibat fatal. Benzene juga merupakan karsinogen. Benzene sebaiknya digunakan dalam ruangan yang berventilasi baik. Salah satu bahayanya dalam penanganan hidrokarbon aromatic ialah karena sifat karsinogennya adalah penyebab kanker ( Ralph H. Petrucci,1985 : 265-266).
a. Sifat Fisik Benzena
o Zat cair tidak berwarna
o Memiliki bau yang khas
o Mudah menguap
o Tidak larut dalam pelarut polar seperti air air, tetapi larut dalam pelarut organikseperti eter dan tetraklorometana
o Titik Leleh : 5,5 derajat Celsius
o Titik didih : 80,1derajat Celsius
o Densitas : 0,837 b. Sifat Kimia Benzena
o Bersifat kasinogenik (racun)
o Merupakan senyawa nonpolar
o Lebih mudah mengalami reaksi substitusi dari pada adisi. (untuk mengetahui beberapa reaksi subtitusi pada benzene)
o Sukar Mengalami Adisi, Benzena bila direaksikan dengan gas hidrogen akan mengalami reaksi adisi tetapi reaksi akan berjalan lambat walaupun dilakukan pada suhu tinggi dan katalis Ni.
H2
C
+ 3 H2 Ni H2 – C C – H2
H2 - C C – H2
C
H2
o Mudah Tersubtitusi a) Halogenasi :
C6H6 + Cl2 C6H5C l + HCl b) Akilasi dengan katalis
FeCl3 : C6H6 + R-Cl C6H5R + HCl c) Nitrasi :
C6H6 + HNO3 H2SO4 C6H5NO2 + H2O d) Asilasi:
C6H6 + CH3 C Cl AlCl3 C6H5COCH3 + HCl
Kegunaan Benzena
o Benzena digunakan sebagai pelarut.
o Benzena juga digunakan sebagai prekursor dalam pembuatan obat, plastik, karet buatan dan pewarna.
o Benzena digunakan untuk menaikkan angka oktana bensin.
o Benzena digunakan sebagai pelarut untuk berbagai jenis zat. Selain itu benzena juga digunakan sebagai bahan dasar membuat stirena (bahan membuat sejenis karet sintetis) dan nilon–66.
C. NITROBENZEN
digunakan sebagai bahan dasar anilin dan sebagai pelarut. Aplikasi yang lebih khusus, nitrobenzen digunakan sebagai bahan kimia karet, peptisida dan segala macam hal yang berkenaan dengan farmasi. Nitrobenzen juga digunakan sebagai bahan sepatu, semir lantai, pakaian kulit, mengecat bahan pelarut dan material lain yang berfungsi menyembunyikan bau yang tak sedap.
Nitrobenzene merupakan salah satu senyawa organik yang biasanya terkandung dalam limbah industry kimia dimana Nitrobenzene cukup sulit diolah sebelum akhirnya dibuang karena sifatnya yang sangat kompleks. Limbah yang mengandung nitrobenzene ini dapat ditemukan pada industry pestisida dan sabun. Nitrobenzene disebut juga sebagai nitrobenzol yang merupakan senyawa organik yang beracun dan dapat digunakan sebagai pelarut atau agent pengoksida (Wijayadkk. 2008).
Nitrobenzen dapat dibuat dengan beberapa proses sebagai berikut:
a. Nitrasi benzen dengan asam campuran, dengan proses batch
Dalam proses ini asam campuran yang digunakan 56-60% H2SO4, 27-32% HNO3, 8-17% H2O . Temperatur reaksi adalah 50- 55 C, produk keluar nitrator dipisahkan dalam separator. Produk nitrobenzen dinetralisasai dengan NaOH. Untuk pemurnian dilakukan dengan proses distilasi. Yield 95-98% dan waktu reaksi secara batch berkisar 2-4 jam (Kirk - Othmer, 1996).
b. Nitrasi benzen dengan asam campuran dengan proses kontinyu. Proses kontinyu adalah proses Beazzi yang pada prinsipnya sama dengan proses batch, sedangkan letak perbedaannya adalah:
1. Versi untuk reaktor yang digunakan untuk proses kontinyu lebih kecil, 30 gallon nitrator kontinyu setara 1500 gallon nitrator batch (Faith et al., 1975).
2. Konsentrasi HNO3 untuk penetrasi lebih rendah. Pada
batch berkonsentrasi HNO3 27-32% sedangkan pada kontinyu konsentrasi HNO3 20-26%.
3. Kecepatan reaksi lebih tinggi, hal ini karena dengan ukuran reaktor lebih kecil, sehingga pengadukan lebih efisien.
4. Waktu reaksi lebih cepat, pada proses batch 2-4 jam, sedangkan pada proses kontinyu 10-30 menit. Selain mempunyai banyak kelebihan,
1. Penggunaan nitrating agent, dengan salah satu komponen dari penitrasi tersebut adalah H2SO4 yang merupakan asam yang sangat korosif.
2. Perlu untuk rekonsentrasi H2SO4 sehingga dapat diperkirakan, biayanya cukup tinggi (Kirk - Othmer, 1996).
Sifat – sifat fisika dari nitrobenzene :
o Titik didih 209,20o C atau 211o C
o Indeks bias 1,3530
o Titik leleh 5,7o C
o Berat jenis 1,203 g/mL
o Massa molar 123,06 g/mol
o Berwarna kuning muda
o Berbentuk cairan minyak, berbau dan beracun
o Nitrobenzene tidak boleh mengenai kulit, mata, atau pakaian Jika terkena haruslah diberi air atau alcohol
o Angka pH dari nitrobenzen adalah 8,1 ( 1 g/L, H2O, 20o C)
o Batasan ledakan 1,8 – 40 % ( V)
o Mudah meledak dalam keadaan uap.
Sifat kimia dari Nitrobenzen adalah :
o Dapat dihidroksi dengan hydrogen
o Dengan fenil hidroksi amin
o Jika direduksi membentuk anilin.
o Tidak dapat dioksidasi dalam larutan KMn seperti alkena.
o Tidak dapat diadisi oleh Br2, H2O dan KMnO4, bisa terjadi bila ada UV.
o Mengalami reasi alkilasi dengan katalisator AlCl3
Kegunaan dari Nitrobenzen adalah :
o Untuk membuat aniline
o Untuk membuat parfum dalam sabun
o Untuk membuat semir sepatu
4. Es
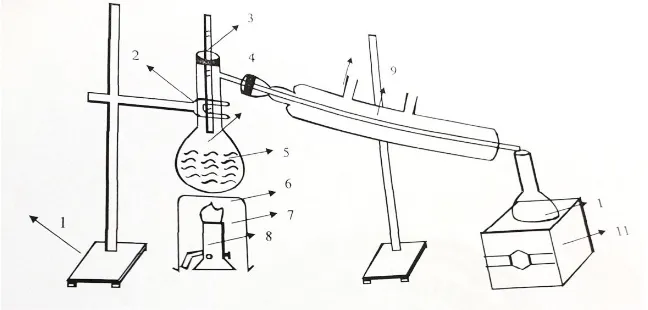
Gambar : distilasi akhir
Keterangan gambar : 1. Statip
2. Klem 3. Tutup karet 4. Labu didih
5. Asam Sulfat (H2SO4) + HNO3 + C6H6 6. Kaki tiga
7. Bunsen 8. Bunsen 9. Condensor 10. Erlen mayer 11. Lab jack VII. ALAT DAN BAHAN
Alat – alat yang digunakan :
Labu alas bulat + penutup karet
Waterbath
Thermometer
Labu corong pemisah
Labu destilasi
Erlenmayer
Kertas saring
Pipet volume
Spatula
Batang pengaduk
Kondensor
Corong
Thermometer
a) Bahan yang digunakan
Benzene (C6H6)
Asam Sulfat (H2SO4)
Asam Nitrat(HNO3)
Aquadest
CaCl2 exicatus
VIII. CARA KERJA
1. Dalam sebuah labu volume 500cc dituangkan 42cc Asam sulfat pekat dan perlahan-lahan sambil diaduk, dialirkan Asam nitrat sebanyak 37cc (campuran ini menjadi panas dan didinginkan dalam air dingin).
2. Setelah campuran dingin dialirkan 30cc Benzene sedikit demi sedikit sambil terus diaduk
3. Pada waktu diteteskan Benzene akan terlihat timbulnya warna coklat yang tak lama lagi akan hilang.
4. Temperatur harus selalu dilihat jika lebih tinggi dari 60°C maka harus didinginkan terus dengan air dingin sebelum ditambahkan Benzene. 5. Untuk menyempurnakan jalannya reaksi, labu dipanaskan di atas water
bath kira-kira 30 menit dan labu harus ditutup dengan gabus yang ditusuk dengan sebuah pipa kaca vertical (styg buis) sebagai penghubung dengan udara luar.
6. Selama pemanasan ini harus sering dikocok agar bercampur dengan baik. 7. Setelah itu labu dibiarkan dingin dan tuangkan ke dalam air dingin sebanyak 1500cc, dikocok baik-baik dan akan terjadi cairan seperti minyak dalam air.
9. Cairan yang seperti minyak tersebut adalah Nitrobenzene dan kemudian dituangkan ke dalam labu yang kering.
10. Nitrobenzene tersebut masih keruh karena mengandung air, untuk itu ditambahkan CaCl2 exicatus sambil dikocok-kocok.
11. Kemudian pisahkan Nitrobenzene tersebut dari CaCl2 exicatus dan di destilasi.
12. Mula-mula akan keluar sebagai Benzene, air, dan Nitrobenzene pada suhu 205 - 207°C.
13. Destilasi dihentikan bila cairan yang di destilasi telah berwarna coklat tua, sebab mungkin ada senyawa-senyawa dinitro yang pada pemanasan kuat dapat menimbulkan ledakan (juga dijaga selama destilasi agar jangan sampai isi labu kering).
14. Hitung rendemen teoritis dari hasil yang didapat
IX. DATA PENGAMATAN DAN PERHITUNGAN a) Asam Nitrat (HNO3)
MR = 63 gr/mol Bj = 1,4 gr/ml
Bobot asam nitrat = ρ x V
= 1,4 gr/ml x 37 ml = 51,8 gr
Mol asam nitrat = Massa : MR
= 51,8 gr : 63 gr/mol = 0,822 mol
b) Benzene (C6H6) MR = 78 gr/mol Bj = 0,894 gr/ml
Bobot asam nitrat = ρ x V
= 0,894 gr/ml x 30 ml = 26,82 gr
Mol asam nitrat = Massa : MR
= 0,343 mol
1. Reaksi Bahan
C6H6 + HNO3 C6H5NO2 + H2O Mula-mula : 0,34 0,82
Bereaksi : 0,34 0,34 0,34 0,34 Sisa : 0 0,48 0,34 0,34
Bobot teoritis nitrobenzene = MR x Mol
= 123 gr/mol x 0,34 mol = 41,82 gr
Bobot praktikum
Bobot erlen mayer + nitrobenzene = 112,35 gr Bobot kosong erlen mayer = 94,85 gr -Bobot nitrobenzene yang didapatkan = 17,5 gr
2. Rendemen yang didapatkan
% rendemen = Bobot nitrobenzene prakrikumBobot teoritis nitrobenzene x100 %
= 41,8217,5 x 100 %
= 41,8 %
X.
PEMBAHASAN
Pada praktikum ini bahan yang di gunakan adalah Benzene (C6H6), Asam Sulfat (H2SO4), Asam Nitrat(HNO3), Aquadest dan CaCl2 exicatus. Pada tahap pertama HNO3 37 ml di masukan terlebih dahulu ke labu lalu di tambahkan H2SO4 sebanyak 42 ml. Hal ini dikarenakan BJ asam sulfat lebih besar dari asam nitrat. Ini untuk menghindari cipratan asam. Fungsi asam sulfat disini untuk mengubah HNO3 yang elektrofit lemah menjadi elektrofit kuat.
Selanjutnya di tambahkan benzen sebanyak 30 ml. Fungsi benzen untuk pencampuran rata. Selanjutnya dipanaskan di waterbath dengan suhu di bawah 600C selama 30 menit. Suhu dijaga jika lebih dari 600C kemungkinan adanya dinitro dan trinitro. Sedangkan jika kurang dari 600C kemungkinan reaksi tidak akan berlangsung sempurna. Saat di panaskan sambil di kocok selama terus menerus. Pengocokan berfungsi untuk agar HNO3 dan H2SO4 dapat terurai membentuk ion nitronium.
Masukan ke dalam corong pemisah dengan penambahan air. Fungsinya untuk memisahkan kotoran yang ada. Akan terbentuk 2 lapisan. Lapisan nitrobenzen yang terbentuk ada di lapisan bawah. Lalu larutan di pisahkan. Larutan nitrobenzen ditambahkan CaCl2 exicatus untuk menghilangkan air yang masih ada. Tahap terakhir dilakukan destilasi. Pada destilasi suhu 800C akan keluar larutan benzen. Pada suhu 1000C akan keluar pelarut air. Ganti erlenmeyer pada proses destilasi. Pada suhu 205 – 2100C akan keluar Nitrobenzen. Destilasi akan dihentikan ketika cairan yang ada di dalam labu berwarna coklat. Hal ini menandakan adanya dinitro dan trinitro yang dapat mengakibatkan ledakan.
Pada praktikum ini di dapatkan hasil nitrobenzen sebanyak 17,5 gram dan rendemen yang di dapat 41,8 %
XI.
KESIMPULAN
Dari praktikum ini dapat di simpulkan :
Pembuatan nitrobenzen menggunakan metode nitrasi.
Rendemen yang di dapat 41,8 %
XII. DAFTAR PUSTAKA
Berghuis, N. T. (2015). Modul Praktikum Kimia Organik I. Bandung: UIN Sunan Gunung Djati.
Daud Zakaria. Laporan praktikum pembuatan nitrobenzen. Jakarta : FT-UMJ Gustriyanidevita (2012, April 08). Sintesis Nitrobenzen. Diambil kembali dari https://gustriyanidevita.wordpress.com/2012/04/08/sintesis-nitrobenzen/
Kirk R.E., and Othmer, D.F., 1996, “ Encyclopedia of Chemical Technology ”,vol.17, 4nd edition, John Wiley & Sons Inc.,New York
https://www.academia.edu/8893701/