PRAKTIKUM I
ANALISIS KUALITATIF
1.
Tujuan Praktikum
Tujuan praktikum ini adalah sebagai sebagai berikut:
1.1 Dapat menentukan sifat dan karakteristik dari satu sampel 1.2 Dapat menentukan golongan kation dari sampel
1.3 Dapat menentuan spesifik kation dari sampel 1.4 Dapat menentukan golongan anion dari sampel 1.5 Dapat menentukan spesifik anion dari sampel
2.
Rumusan Masalah
Rumusan masalah pada praktikum ini adalah sebagai berikut:
2.1 Bagaimana menentuan sifat dan karakteristik dari satu sampel?
2.2 Bagaimana menentuan golongan kation dari sampel?
2.3 Bagaimana menentuan spesifik kation dari sampel?
2.4 Bagaimana menentuan golongan anion dari sampel?
2.5 Bagaiamana menentuan spesifik anion dari sampel?
3.
Kajian Pustaka
Kimia analisis dapat dibagi dalam dua bidang yang disebut dengan analisis kualitatif dan analisa kuantitatif. Analisa kualitatif membahas identifikasi zat-zat. Urusannya adalah unsur unsur atau senyawa apa yang terdapat dalam suatu sampel (contoh). Analisis kuantitatif berurusan dengan penetapan banyaknya suatu zat tertentu yang ada dalam sampel. Zat yang ditetapkan, yang sering dirujuk sebagai sebagai konstituen yang diinginkan atau analit, dapt merupakan sebagian kecil atau sebagian besar dari contoh yang dianalisis (Day dan Underwood, 1986).
Analisis kualitatif adalah pemeriksaan ion atau unsur yang terdapat dalam suatu unsur tunggal atau campuran senyawa. Dalam analisis kualitatif, suatu zat atau unsur dalam sampel dapat ditentukan melalui tahap-tahap:
(Tim Analitik, 2012)
Analisis pendahuluan merupakan pengamatan terhadap bentuk dan warna zat, reaksi nyala, mengamati reaksi zat terhadap senyawa tertentu, dan lain-lain. Sedangkan analisis secara sistematis adalah menganalisis zat berdasarkan golongan yang paling sering digunakan
adalah analisis golongan sistem H2S. Syarat utamanya sampel harus dalam bentuk larutan
(Tim Analitik, 2012).
Cara pelarutan adalah sedikit sampel padat dicoba dilarutkan dalam pelarut: 1) air, 2) HCl encer, 3) HCl pekat, 4) HNO3encer, 5)HNO3pekat, dan 6) Aquaregia (air raja).
Percobaan pelarutan diurutkan dari yang pertama dulu baru dilarutkan pada pelarut yang berikutnya (Tim Analitik, 2012) .
Prinsip pemeriksaan kation menurut sistem H2S adalah:
1. penambahan reagen selektif untuk mengendapkan ion ion dalam golongan,
2. pembagian dalam golongan dan sub golongan, serta pemisahan ion-ion, dan
3. reaksi identifikasi dengan menggunakan reagen spesifik.
(Tim Analitik, 2012)
Untuk tujuan analisis kualitatif, sistematik kation-kation diklasifikasikan dalam lima golongan berdasarkan sifaat-sifat kation itu terhadap beberapa reagensia. Dengan memakai apa yang disebut reagensia, golongan secara sistematik dapat kita tetapkan ada atau tidaknya golongan-golongan kation dan dapat juga memisahkan golongan-golongan ini untuk pemeriksaan lebih lanjut (Svehla, 1990).
Uji pendahuluan yang dilakukan terhadap sampel yang dianalisis dapat memberikan petunjuk yang sangat penting dan akan memudahkan analisis lebih lanjut. Untuk beberapa ion tertentu uji pendahuluan sudah memberikan kepastian. Beberapa uji pendahuluan yang akan kita kerjakan dalam praktikum kali ini adalah:
1. Uji pendahuluan secara organoleptis 2. Uji pendahuluan untuk kation 3. Uji pendahuluan untuk anion
Bentuk : Perhatikan bentuk dari sampel apakah berupa padatan atau larutan. Bila sampel berupa padatan atau kristal perhatikan bentuknya secara mikroskopis.
Warna : perhatikan warna padatan atau larutan Padatan:
Merah :Pb3O4, HgO, HgI2, HgS, Sb2S3, CrO3, K3(Fe(CN)6)
Merah jingga : K2Cr2O7
Merah keunguan : CdS, As2S3, PbI2, K4(Fe(CN)6), K2CrO4, FeCl3, Fe(NO3)3
Hijau : Cr2O3, Hg2I2, Cr(OH)3, garam-garam fero (Fe2+), garam-garam nikel (Ni2+),
CuCO3, CrCl3.6H2O, CuCl2.6H2O
Biru : Garam-garam kobalt (CO2+) anhidrat, garam-garam tembaga (Cu2+) terhidrat.
Coklat : PbO2, CdO, Fe3O4, Fe2O3, Fe(OH)3
Hitam : PbS, CuS, CuO, HgS, FeS, MnO2, CoS, NiS dan C (karbon)
Larutan
Merah muda : CO2+, Mn2+
Merah jingga : Cr2O7
2-Kuning : CrO42-, Fe(CN)63-, Fe3+
Hijau : Ni2+, Fe2+, Cr3+
Biru : Cu2+ (dari garam-garam terhidrat)
Ungu : MnO4
-Sifat : Perhatikan apakah sampel itu bersifat higroskopis atau tidak. Zat-zat yang bersifat
higroskopis antara lain CaCl2, MgCl2, NaOH. Periksa reaksinya terhadap lakmus merah atau
lakmus biru, apakah bersifat netral atau basa.
Bau : cium baunya (hati-hati bau menusuk). Zat-zat yang berbau khas, misalnya H2S,
CH3COOH, NH4OH, dan Cl2.
Rasa : sebaiknya cara ini tidak dilakukan karena pada umumnya zat-zat kimia berbahaya.
2. Uji pendahuluan untuk kation A. Uji nyala
(syarif hamdani, dkk, 2012:8-9)
Untuk tujuan analisis kualitatif, sistematik kation-kation diklasifikasikan dalam lima golongan berdasarkan sifaat-sifat kation itu terhadap beberapa reagensia. Dengan memakai apa yang disebut reagensia, golongan secara sistematik dapat kita tetapkan ada atau tidaknya golongan-golongan kation dan dapat juga memisahkan golongan-golongan ini untuk pemeriksaan lebih lanjut (Svehla, 1990).
Penggolongan kation-kation adalah sebagai berikut:
4.1 Golongan I : Ag, Hg(I), dan Pb
4.2 Golongan II A : Cu, Cd, Hg(II), Bi, dan Pb
4..3 Golongan II B : AS, Sb, dan Sn
4.4 Golongan III : Al, Cr, Fe, dan Mn
4.5 Golongan IV : Mn, Zn, Ni, dan Co
4.6 Golongan V : Ca, Sr, dan Ba
4.7 Golongan VI : Na, K, Mg,
Dalam analisis anion (ion negatif), kebanyakan ion-ion logam akan mengganggu. Oleh sebab itu, ion-ion logam dipisahkan terlebih dahulu dengan cara mengendapkannya sebagai garam karbonat (Tim Analitik, 2012).
Analisis kualitatif menggunakan dua macam uji, yaitu uji reaaksi kering dan reaksi basah. Reaksi kering dapat diterapkan untuk zat-zat padat dan reaksi basah untuk zat dalam larutan. Sejumlah uji yang dapat dilakukan dalam keadaan kering, yakni tanpa melarutkan, contoh misalnyadengan pemanasan, uji pipa-tiup, uji nyala, uji spektroskopi, uji maniks boraks, uji manik fosfat, dan uji manik natrium karbonat. Reaksi basah dibuat dengan melarutkan zat-zat dalam larutan (Vogel, 1985).
Reagensia golongan yang dipakai untuk klasifikasi kation yang paling umum adalah asam klorida, hidrogen sulfida, dan amonium karbonat. Klasifikasi ini didasarkan atas apakah suatu kation bereaksi dengan reagensia-reagensia ini membentuk endapan atau tidak. Jadi, boleh kita katakan bahwa klasifikasi kation didasarkan atas perbedaan kelarutan dari klorida, sulfida, dan karbonat dari golongan tersebut (Vogel, 1985).
4.
Alat dan Bahan
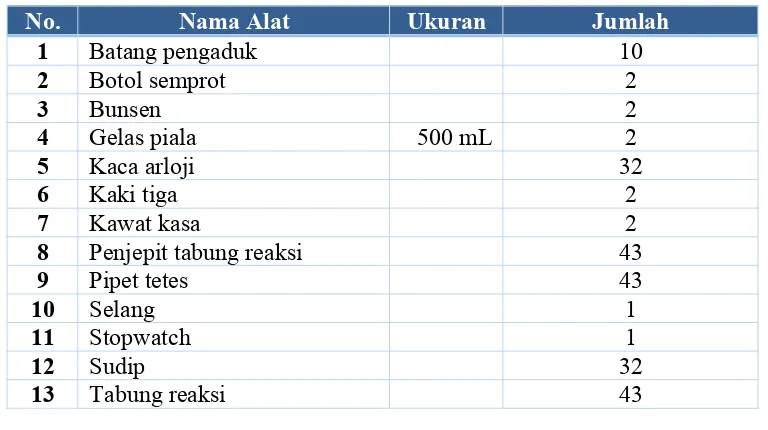
4.1 AlatAlat yang digunakan dalam praktikum analisis kualitatif ini adalah sebagai berikut:
Tabel 4.1 Alat Praktikum Analisis Kualitatif
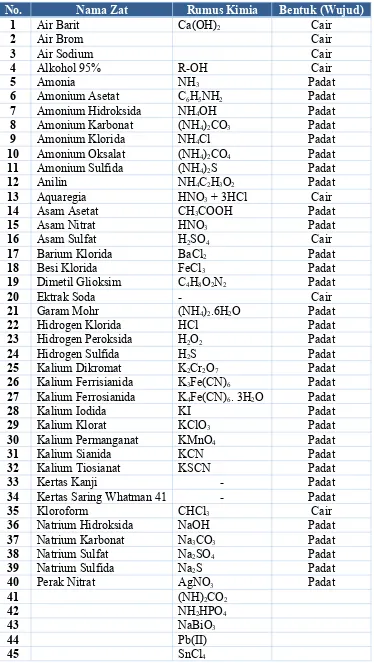
Tabel 4.2 Bahan Praktikum Analisis Kualitatif
No. Nama Zat Rumus Kimia Bentuk (Wujud)
1 Air Barit Ca(OH)2 Cair
7 Amonium Hidroksida NH4OH Padat
8 Amonium Karbonat (NH4)2CO3 Padat
9 Amonium Klorida NH4Cl Padat
10 Amonium Oksalat (NH4)2CO4 Padat
11 Amonium Sulfida (NH4)2S Padat
12 Anilin NH4C2H3O2 Padat
13 Aquaregia HNO3 + 3HCl Cair
14 Asam Asetat CH3COOH Padat
15 Asam Nitrat HNO3 Padat
23 Hidrogen Peroksida H2O2 Padat
24 Hidrogen Sulfida H2S Padat
25 Kalium Dikromat K2Cr2O7 Padat
26 Kalium Ferrisianida K3Fe(CN)6 Padat
27 Kalium Ferrosianida K4Fe(CN)6. 3H2O Padat
28 Kalium Iodida KI Padat
34 Kertas Saring Whatman 41 - Padat
35 Kloroform CHCl3 Cair
36 Natrium Hidroksida NaOH Padat
37 Natrium Karbonat Na3CO3 Padat
38 Natrium Sulfat Na2SO4 Padat
39 Natrium Sulfida Na2S Padat
5.
Prosedur Kerja
5.1 Pemisahan Kation-kation Berdasarkan Golongan 5.1.1 Golongan I
5.1.1.1 Larutan sampel ditambah HCl 6 M, maka kation golongan I
akan mengendap sebagai garam klorida warna putih, lalu disaring (filtratnya disimpan untuk analisis golongan selanjutnya).
5.1.1.2 Endapan ditambah air panas, sebagian larut, dan disaring
5.1.1.3 Filtratnya diidentifikasikan dengan menambahkan larutan
K2Cr2O7 akan terbentuk endapan berwarna kuning. Endapan dari
kation apa?
5.1.1.4 Endapan ditambah dengan larutan NH4OH 2 M. Sebagian
endapan akan larut, pisahkan dari endapan, dan identifikasi larutan dengan penambahan asam nitrat, sehingga akan timbul kembali endapan. Selidiki endapan dari kation apa?
5.1.1.5 Endapan sisa dapat diidentifikasi dengan melarutkan dalam
aquaregia, lalu diteteskan pada kertas saring dan ditetesi dengan
2 tetes SnCl2 dan 1 tetes anilin. Akan terbentuk noda berwarna
hitam. Noda dari kation apa?
5.1.2 Golongan II
5.1.2.1 Filtrat dari pengendapan kation golongan I diasamkan dengan
HCl, lalu ditambahkan H2O2 10% dan dididihkan sampai H2O2
habis terurai. Tambahkan air sodium, lalu dialirkan gas H2S
sampai terjadi endapan sulfida golongan II, kemudian saring (filtratnya disimpan untuk analisis golongan selanjutnya)
5.1.2.2 Endapan di atas terdiri dari endapan golongan II A dan II B.
Endapan golongan II A dipisahkan dan golongan II B dengan penambahan larutan amonium sulfida 2 M kedalam endapan. Golongan II B akan larut. Pisahkan!
5.1.2.3 Endapan golongan II A dipanaskan dengan HNO3 1:1, maka
CuS, CdS, Bi2S3, dan PbS akan larut, sedangkan HgS tidak.
5.1.2.4 Kation golongan II yang telah dilarutkan dalam larutan amonium sulfida di atas akan mengendap kembali jika di asamkan dengan HCl. Bila kedalam campuran endapan ditambahkan HCl 6 M, maka Sb2S3 dan Sn S2 akan larut,
sedangkan As2S3 tidak larut. Endapan As2S3 larut dalam larutan
natrium hidroksida.
5.1.3 Golongan III
5.1.3.1 Filtrat pada pengendapan golongan II dididihkan untuk
menghilangkan H2S, lalu ditambahkan air brom, kemudian
tambahkan NH4Cl dan NH4OH berlebih, maka akan terbentuk
endapan golongan III: Fe(OH)3, Al(OH)3, Cr(OH)3, dan MnO2. x H2O. Saring dan filtrat disimpan untuk untuk
pemeriksaan golongan berikutnya.
5.1.3.2 Endapan dipanaskan dengan larutan NaOH dan H2O2, maka
Al(OH)3dan Cr(OH)3 akan larut. Jika ditambahkan dengan
amonium hidroksida akan terbentuk endapan Al(OH)3 yang
memberikan warna putih. Sedangkan Cr+3 akan tetap larut,
selanjutkan akan dilakukan identifikasi.
5.1.3.3 Endapan Fe(OH)3 dan MnO2. x H2O ditambahkan HNO3 dan
H2O2 akan terbentuk larutan Fe+3 dan Mn+2, lalu tambahkan
larutan kalium klorat, sehingga Mn akan mengendap sebagai
MnO2 dan Fe tetap larut. Pisahkan dengan penyaring dan
lakukan identifikasi.
5.1.4 Golongan IV
5.1.4.1 Filtrat dari golongan III ditambahkan NH4Cl, NH4OH, dan ¿ ¿
akan terbentuk endapan golongan IV: MnS, ZnS, NiS, dan CoS, kemudian disaring (filtrat disimpan untuk analisis golongan selanjutnya).
5.1.4.2 Ke dalam endapan kation golongan IV ditambah larutan HCl 2
5.1.5 Golongan V
5.1.5.1 Filtrat dari golongan IV dinetralkan dengan NH4OH, lalu
ditambahkan NH4Cl 2 M dan (NH)2CO2 2 M, kemudian
panaskan sampai terjadi endapan CaCO3, SrCo3, BaCo3. Saring
dan filtrat mengandung kation golongan VI.
5.1.5.2 Ke dalam endapan golongan V ditambahkan asam asetat panas
dan amonium asetat, lalu tambahkan larutan K2Cr2O7, didihkan,
maka akan terjadi endapan BaCr O4 yang berwarna kuning, sedangkan CaCO3 dan SrCo3 larut. Saring!
5.1.5.3 Ke dalam filtrat ditambahkan NH4OHdan alkohol 95%, maka
akan terbentuk endapan berwarna kuning dari Sr. Sedangkan
Ca+2 diidentifikasi dengan penambahan amonium oksalat yang
menghasilkan endapan putih CaC2O4.
5.1.6 Golongan VI
dianalisis dengan menambahkan larutan NH4Cl , NH4OH,
dan NH2HPO4 yang akan menghasilkan endapan putih dari
senyawa MgNH4HPO4.
5.1.6.3 Untuk mengetahui ion NH4+¿¿
dalam sampel, seharusnya dilakukan analisis pendahuluan dengan penambahan NaOH
kedalam larutan sampel, jika ada ion NH4+¿¿ akan tercium bau
amonia dari gas yang dihasilkan.
5.2 Reaksi Identifikasi Beberapa Kation 5.2.2 Reaksi identifikasi terhadap Cu+2
Cu+2 dengan larutan kalium ferrosianida akan membentuk endapan merah coklat yang
5.2.3 Reaksi identifikasi terhadap Cd2+¿¿
Ke dalam larutan kompleks yang mengandung Cd2+¿¿ ditambahkan KCN dan setelah
itu ditetesi dengan Na2S terbentuk endapan kuning menandakan adanya Cd2+¿¿.
5.2.4Reaksi identifikasi terhadap Fe+3
Pada larutan ini diteteskan 2 tetes KSCN 0,2 M, terbentuknya warna merah dari
larutan menunjukkan adanya Fe+3
.
5.2.5 Reaksi identifikasi terhadapMn2+¿¿
Pada larutan ditambahkan beberapa mL larutan HNO3 pekat dan NaBiO3 padat, lalu
panaskan. Terbentuknya warna ungu menandakan adanya MnO4.
5.2.6Reaksi identifikasi terhadap ¿2+¿¿
Endapan Ni-sulfida larut dalam aquaregia, lalu ditambahkan dimetil glioksim.
Terbentuknya endapan merah menunjukkan adanya ion ¿2+¿¿ dalam sampel.
5.2.7 Reaksi identifikasi terhadap Zn2+¿¿
Larutan Zn2+¿¿ jika dibasakan dengan amonia akan terbentuk endapan putih yang segera
larut kembali. Tambahkan beberapa tetes pereaksi kalium ferrisianida. Terbentuknya endapan putih menandakan adanya ion Zn2+¿¿.
5.3 Reaksi-reaksi Penentuan Anion
Untuk analisis ini, larutan sampel ditambahkan dengan natrium karbonat jenuh, lalu dimasak lebih kurang 30 menit atau sampai semua ion logam praktis mengendap sebagai garam karbonat, lalu endapan dipisahkan. Filtratnya yang mengandung anion dan disebut juga ekstrak soda digunakan untuk penentuan ion-ion negatif (anion).
5.3.1 Kelompok Halogenida
5.3.1.1 1 mL ekstrak soda di asamkan dengan penambahan HNO3 6 M
berlebih, kemudian tambahkan 5 tetes larutan AgNO3 0,1 M.
Jika terjadi endapan, lalu endapan dicuci dan ditambahkan
5.3.1.2 Ke dalam endapan ditambahkan beberapa tetes ¿ ¿ 1 M aduk
dan sentrifuge. Filtratnya di asamkan dengan HNO3 6 M,
terjadinya endapan putih menunjukkan adanya ion Cl. Endapan yang ada disimpan untuk anion Br−¿¿ dan I−¿¿.
kanji. Jika terjadi warna biru menunjukkan adanya ion I−¿¿.
5.3.1.4 Untuk menganalisis adanya ion Br−¿¿
menggunakan larutan di atas yang mengandung I−¿¿
, maka I−¿¿
harus dihilangkan dengan penambahan FeCl3 0,1 M kedalam larutan, lalu
didihkan sampai semua I2 menguap.
5.3.1.5 3 tetes larutan bebas ion I−¿¿ ini dicampur dengan 5 tetes
kloroform, kemudian tambahkan 3 tetes KMnO4 0,1 M dan 3
tetes H2SO4 3 M, lalu dikocok. Kelebihan KMnO4 dihilangkan
dengan penambahan H2O2 10%. Warna coklat dalam lapisan
berarti Br−¿¿ positif.
5.3.2 Kelompok Sulfat
5.3.2.1 1 mL larutan ekstrak soda dalam tabung reaksi diasamkan
dengan HCl 6 M, lalu tambahkan 1 mL larutan BaCl2 0,1 M.
Jika terjadi endapan putih menunjukkan adanya SO4−¿¿
.
5.3.2.2 Jika pembentukan endapan putih setelah ditambah 5 tetes air
brom, menunjukkan adanya ion SO−¿¿3 .
5.3.3 Kelompok Nitrat
1 mL larutan ekstrak soda diasamkan dengan H2SO4 3 M, lalu ditambahkan larutan
garam mohr yang baru dibuat. Kemudian teteskan melalui dinding tabung dengan hati-hati
H2SO4 pekat 1 tetes s.d 2 tetes. Terbentuknya cincin coklat pada perbatasan larutan dengan
H2SO4 menunjukkan adanya ion nitrat.
Dalam kelompok ini dapat dimasukkan beberapa anion lain yang secara umum dapat diketemukan lewat pengujian pendahuluan
5.3.4.1Ion Asetat
Larutan sampel direaksikan dengan H2SO4 2 M dan dipanaskan. Bau asam cuka
menandakan ion asetat positif.
5.3.4.2 Ion Karbonat
Larutan sampel direaksikan dengan H2SO4, gas yang terbentuk di alirkan ke dalam
air barit dan jika terbentuk endapan putih, berarti ion karbonat positif.
5.3.4.3 Ion Sulfida
Larutan sampel diasamkan dengan asam asetat, kemudian ditambahkan larutan Pb(II). Adanya ion sulfida dengan terbentuknya endapan hitam PbS.
5.2 Data Pengamatan
6.1 Kelompok Halogenida
No Perlakuan Pengamatan
1 Ekstrak soda + HNO3 + AgNO3 Larutan berwarna putih dan terdapat
endapan putih.
5 Larutan ditambahkan FeCl3 Larutan berwarna kuning.
6 Larutan no. 5 diteteskan pada kertas
6.2 Kelompok Sulfat
Pengamatan
Hipotesis
Memasukkan tembaga kedalam
erlenmeyer kemudian
Larutan tersebut ditambahkan larutan garam Mohr perbatasan larutan dengan H2SO4 dan terdapat ion nitrat
6.6 Kelompok Lain, Ion Sulfida
Dalam analisis anion tidak begitu sistematik seperti halnya identifikasi kation. Salah satu cara penggolongan anion adalah pemisahan anion berdasarka kelarutana garam-garam perak,garam-garam kalsium, barium dan seng. Dalam percobaan kami digunakan ekstrak soda untuk menganalisis anion. Fungsi dari larutan ekstrak soda adalah untuk mengendapkan kation loga berat dan untuk mempertinggi kelarutan anion
. Analisa ion adalah analisa yang bertujuan untuk menganalisis adanya ion dalam sampel. Sedangkan analisa kualitatif dilakukan untuk mengetahui jenis unsur atau ion yang terdapat dalam suatu sampel. Jadi, analisa anion secara kualitatif merupakan analisa yang dilakukan untuk mengetahui adanya anion serta jenis anion apa saja yang terdapat dalam suatu sampel.
Cara identifikasi anion tidak begitu sistematik seperti pada identifikasi kation. Salah satu cara penggolongan anion adalah pemisahan anion berdasarkan kelarutan garam-garam perak, garam-garam kalsium, garam-garam barium dan garam-garam seng. Pemisahan anion-anion ke dalam golongan utama tergantung pada kelarutan garam pelarutnya. Garam kalsium, barium ini hanya boleh dianggap berguna untuk memberi identifikasi dari keterbatasan-keterbatasan metode ini. Walaupun tidak ada pembagian secara sistematis, tetapi untuk mempermudah pekerjaan anion ini dapat dibagi menjadi empat golongan, yaitu:
1. Golongan asam pengoksida, yaitu: NO3-, NO2-, ClO3-, Cl-, CrO4-, MnO4-.
2. Golongan asam tanpa oksigen, yaitu: S2-, I-, CN-.
3. Golongan asam sulfat, yaitu: SO42-, SO32-, CrO4
2-4. Golongan sisa, yaitu: PO43-, CH3COO-, CO32-.
yang tidak larut dari logam-logam beratnya dan garam-garam natrium yang larut dari anion-anionnya. Larutan ini dinamakan ekstrak soda. Jadi dapat logam berat dan untuk mempertinggi kelarutan. Setelah diperoleh ekstrak osda ini maka dapat dilakukan beberapa uji yaitu uji sulfat, uji terhadap ion-ion pereduksi, uji terhadap zat-zat pengoksidasi dan uji dengan larutan perak nitrat.
Didalam praktikum ini pemeriksaan anion menggunakan larutan ekstrak soda.
Pembuatan ekstrak soda ini digunakan sampel campuran yang terdiri dari (NH4)2SO4 0,02M 4
mL, NH4NO3 0,5 M 4 mL, Na2C2O4 0,5 M 1 mL, Na2S2O3 0,1 N I mL dan KCN 0,1 M 1 mL.
Kemudian diambil 5 mL sampel campuran dengan menggunakan Erlenmeyer 100 mL
kemudian ditambahkan 25 mL larutan Na2CO3 1,5 M dan didihkan. Larutan didihkan dengan
Na2CO3 untuk menghasilkan endapan logam karbonat dan anionnya, sehingga anion dapat
terpisah dari logamnya, berdasarkan reaksi:
Larutan didihkan menghasilkan sedikit endapan putih, sehingga endapan harus disaring dan dicuci dengan akuades panas untuk mengambil sisa-sisa ion yang masih menempel pada endapan. Sehingga anion-anion yang diharapkan dapat larut dan terambil. Kemudian filtrate dan air cucian dijadikan satu. Larutan inilah yang disebut ekstrak soda, kemudian dilakukan uji terhadap ekstak soda.
Percobaan pertama dari kelompok halogenida. Tujuan percobaan pertama ini adalah
membuktikan adanya ion Cl-, Br- dan I- . Untuk pertamanya yaitu menemukan adanya ion Cl
-digunaka ekstrak soda yang sebanyak 1 ml dengan penambahan HNO3 6M berlebih dan 5
tetes AgNO3 0,1M. Pada saat penambahan ini endapan terjadi dan dicuci lalu ditambah HNO3
pekat dan diuapkan sampai kering. Setelah itu Endapan ini ditetes (NH4)5CO3 1M harus
diaduk dan tentu saja disentrifuge. Maka filtratnya tersebut diasamkan oleh praktikan dengan
HNO3 6M. Terdapat endapan putih yang terbentuk dari proses inilah yang menunjukkan
adanya ion Cl-.
Maka itu untuk ion I- endapan yang ada tadi disimpan. Dalam endapan tadi ditambah
Zn+ dan 1 ml H
campuran yang terjadi diteteskan pada kertas kanji. Warna biru yang tampak menunjukkan adanya ion I-.
Setelah itu untuk ion Br-. Karena masih mengandung I- maka I- harus dihilangkan dengan
penambahan FeCl3 0,1M dan dididihkan. Larutan yang telah bebas dari ion I- dicampur
dengan 5 tetes kloroform dan 3 tetes KmnO4 0,1M dan 3 tetes H2SO4 3 M. Semua campuran
ini dikocok. Pada ion Br- terdapat diketahui melalui warna coklat dalam lapisan. Warna
coklat tersebut menandakan adanya ion Br-. Adapun rekasi-reaksinya :
Ekstrak soda(aq) + HNO3(aq) + AgNO3(aq) AgCO3(S) putih keruh.
AgCO3(s) + HNO3(aq) AgNO3(s) + HCO3(aq)
AgNO3(s) + (NH4)2CO3 AgCl(s) putih.
H2SO4(aq) reduksi HBr(aq) + HI(aq)
HBr(aq) + AgNO3(aq) AgBr(s) coklat.
HI(aq) + AgNO3(aq) AgI(s) biru.
Berikutnya anion dari kelompok sulfat. Pada praktikum bagian ini akan dibuktikan adanya ion SO4- dan SO3. Awalnya untuk ion SO3-. Seperti yang percobaan awal maka
ekstarak soda yang digunakan juga sebanyak 1 ml. Tapi pada percobaan kedua ekstrak soda ini gabungkan atau ditambahkan dengan HCl 6M dan juga ditambah juga dengan 1 ml larutan BaCl2 0,1M. Maka akan terdapat endapan putih yang terbentuk dari percobaan ini
membuktikan adanya SO4-.
Berikutnya anion dari kelompok nitrat.Terdapatnya ion ini terbukti dari terbentuknya cincin coklat pada perbatasan larutan 1 ml ekstrak soda yang tadinya diasamkan dulu dengan
H2SO4 3M ditambah garam Mohr dan diteteskan melalui dinding tabung dengan hati-hati
H2SO4 pekat 1 sampai 2 tetes.
Terakhir yaitu dari kelompok lain. Percobaan yang pertama pada kelompok lain ini yaitu pembuktian ion asetat. Adanya ion asetat ditandai dengan bau asam cuka pada saat larutan
sampel yang digunakan ditambah dengan H2SO4 2M. Kedua yaitu pembuktian ion karbonat.
Sama seperti sebelumnya yaitu larutan sampel ditambah dengan H2SO4, namun kali ini gas
diasamkan dengan asam asetat dan ditambah Pb(II). Adnya ion sulfida ini dapat diketahui dari terbentuknya endapan hitam PbS.
Setelah semua percobaan yang dilakukan dapat dilihat pembuktian adanya ion-ion dari ada atau tidaknya endapan yang terbentuk. Setelah endapan telah terbentuk berarti hal ini membuktikan tahap akhir dari setiap percobaan yang dilakukan. Maka dapat menunjukkan bahwa dalam uji larutan yang dilakukan terdapan ion yang ingin dibuktikan.
8.
Diskusi
Untuk percobaan pertama yaitu pengujian dalam kelompok halogenida praktikan mendapatkan data dari kelompok yang mengerjakan dan terdapat hasil yang tidak sesuai dengan literatur, dari kelompok yang mengerjakan tersebut mengatakan terdapatnya perbedaan hasil dari literatur akibat dari kurangnya bahan dan alat yang ada waktu praktikum dilaksanakan. Pada percobaan yang kedua yaitu pengujian dalam kelompok sulfat praktikan berhasil mendapatkan data dari kelompok hasilnya tidak ada kendala dalam percobaan ini yang menandakan percobaannya sesuai dengan literatur yaitu terdapatnya endapan putih. Pada percobaan yang ketiga yaitu pengujian dalam
kelompok nitrat seharusnya 1 mL larutan ekstrak soda diasamkan dengan H2SO4 3 M
lalu Larutan tersebut ditambahkan larutan garam Mohr setelah itu Larutan tersebut
ditambah H2SO4 pekat 1 s.d 2 tetes. Tetapi yang praktikan dapat kan datanya tidak
seperti percobaan diatas karena kelompok yang menangani pengujian kelompok nitrat ini terkendala oleh bahan, dalam literatur terbentuk cincin cokelat pada perbatasan
larutan dengan H2SO4 dan terdapat ion nitrat. Tetapi kami tidak mendapatkannya.
Pada percobaaan yang keempat yaitu kelompok lain uji ion asetat dalam literatur terdapat pembakaran oleh tisu tetapi yang praktikan lakukan berbeda yaitu larutan sampel direaksikan dengan H2SO4 2M lalu di panaskan, dalam pemanasan ini
praktikan cukup kesulitan karena tidak tersedianya buret yang bagus.
9.
Kesimpulan
Maka dapat kita simpulkan pada percobaan pertama ini yaitu analisis kualitatif yaitu : 1) Aninon/kation dapat dilihat berdasarkan endapan yang terbentuk, warna larutan
maupun gas yang terbentuk.
2) Golongan anion dibuktikan melalui percobaan bahwa dalam kelompok halogenida terdapat anion Cl-, I-, dan Br-. Dalam kelompok sulfat terdapat ion
SO4- dan SO3-. Dalam kelompok nitrat terdapat anion nitrat. Dalam kelompok
lain terdapat ion asetat positif, ion karbonat positif, dan ion sulfida.
3) Dalam Anion kelompok Halogenida dapat dianalisis dari endapan dan warna yang terbentuk pada suatu sampel larutan, dimana anion Halogenida adalan anion-anion golongan Halogen(F,Cl,Br,I).
4) Ekstrak soda adalah bahan yang digunakan untuk menganalisis anion, ekstrak
soda didapatkan dari NaHCO3 (natrium bikarbonat).
5) Dalam menentukan sifat dan karakteristik dari suatu sempel yaitu kelompok halogenida dengan karakteristik perubahan bening akibat adanya glukosa, kelompok sulfat dengan karakteristik menghasilkan gelembung, tembaga akan berubah menjadi warna biru, kelompok nitrat dengan karakteristik menghasilkan dan kelompok lain yang termasuk ion asetat, ion karbonat, ion sulfida.
10. Daftar Pustaka
Svehla, G. 1990. Vogel : Buku Teks Analisis Anorganik Kulitatif Makro dan
Semimakro. Jakarta : PT. Kalman Media PusakaUnderwood, A.L.
Day, R. A. 2002. Analisis Kimia Kuantitatif. Jakarta : Erlangga.
Vogel. 1985. Buku Teks Analisis Anorganik Kualitatif Makro dan Semi Mikro. Jakarta:
PT. Kalman Pusaka.
Hamdani, Syarif, dkk, 2012. Modul Praktikum Kimia Analisis. Bandung : STFI
Tim kimia analitik, 2004. Penuntun Praktikum Dasar – Dasar Kimia Analitik. Jambi :