LAPORAN PRAKTIKUM KESETIMBANGAN KIMIA
KINETIKA REAKSI ORDE 2
Oleh
Nama : Suci Aulia Rahmawati
NIM : 151810301054
Kelompok : V
Asisten : Della Permata
LABORATORIUM KIMIA FISIK JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS JEMBER
BAB 1. PENDAHULUAN
1.1 Latar Belakang
Reaksi kimia yang terjadi disekitar kita kebanyakan bersifat instan, namun ada juga reaksi yang membutuhkan waktu yang lama untuk terbentuknya suatu produk. Reaksi yang berjalan secara cepat biasanya terjadi saat pencampuran suatu reaktan dan langusng menghasilkan produk baru. Reaksi yang dapat mengubah reaktan menjadi zat baru ini disebut reaksi kimia. Proses dalam reaksi kimia ada yang berjalan cepat da nada yang berjalan lambat. Misalnya reaksi kimia berlangsung cepatyaitu pada batang korek api yang cepat terbakar dan reaksi yang lambar seperti pencoklatan pada buah. Topik bahasan seperti ini disebut dengan kinetika reaksi. Kinetika reaksi adalah pengkajian laju dan mekanisme reaksi kimia. Cepat lambatnya suatu reaksi kimia dapat dinyatakan dengan laju reaksi. Laju reaksi suatu rekasi kimia dinyatakan sebagai perubahan konsentrasi yang terlibat dalam reaksi terhadap satuan waktu. Laju atau kecepatan reaksi dapat dinyatakan sebagai laju berkurangnya/bertambahnya konsentrasi suatu produk. Faktor-faktor yang mempengaruhi laju reaksi diantaranya yaitu, konsentrasi reaktan, luas permukaan reaktan, suhu, mekanisme reaksi dan juga katalis.
Persamaan laju reaksi kimia ditentukan oleh konsentrasi awal dari setiap zat yang dipangkatkan orde reaksinya. Orde reaksi berkaitan erat dengan pangkat oleh hukum laju reaksinya. Nilai orde reaksi setiap zat penyusunnya tidak selalu sama dengan koefisien reaksi zat yang bersangkutan. Penentuan orde reaksi pada percobaan ini adalah konstanta reaksi orde dua dari reaksi saponifikasi etil asetat. Reaksi saponifikasi merupaka reaksi hidrolisis lemak oleh alkali. Larutan alkali yang digunakan dalam reaksi saponifiksai bergantung pada jenis sabun yang diinginkan. Larutan alkali yang biasa digunakan dalam pembuatan sabun keras adalah Natrium Hidroksida sedang kan sabun lunak yaitu Kalium Hidroksida. Sabun dalam reaksi saponifikasi berfungsi sebagai pengemulsi kotoran yang berupa minyak atau zat pengotor lainnya. Pembuatan ini dihasilkan dari proses saponifikasi lemak minyak dengan larutan alkali yang membebaskan gliserol.
1.2 Tujuan
BAB 2. TINJAUAN PUSTAKA
2.1 Material Safety Data Sheet (MSDS)
2.1.1 Akuades (H2O)
Akuades merupakan senyawa kimia yang sudah mengalami proses penyulingan dan memiliki rumus molekul H2O. Akuades ditemukan dalam jumlah yang sangat banyak. Akuades diperoleh dari hasil penyulingan air biasa sehingga terbebas dari mineral yang terkandung pada air mineral. Akuades bersifat polar karena ada perbedaan keelektronegatifan antara atom O dan H. Sifat akuades yang polar membuatnya bisa menjadi pelarut bagi banyak senyawa. Akuades berupa cairan yang tidak berwarna, tidak berasa dan tidak berbau.akuades memiliki berat molekul 18,02 g/mol, tekanan uap sebesar 2,3 kPa, bermassa jenis 0,62 g/L dan memiliki titik didih 100oC. Akuades merupakan pelarut universal karena dapat melarutkan berbagai jenis zat dengan sifat polarnya. Akuades tidak memiliki efek bahaya apabila terjadi kontak langsung dengan tubuh karena salah satu sifat akuades yang netral dan memiliki pH 7 (Anonim,2017).
2.2.2 Natrium Hidroksida (NaOH)
Natrium hidroksida merupakan bahan kimia padat dengan rumus molekul NaOH. Bahan ini berwarna putih dan tidak memiliki bau dengan berat molekul 40 g/mol. NaOH mempunyai densitas sebesar 2,1 g/cm³, padat, titik leleh sebesar 318°C (591 K), titik didih 1390°C (1663 K), kelarutan dalam air 111 g/100 ml (20°C) dan pKb -2,43. Bahan ini larut dalam air dingin, etanol, an methanol dan tidak larut pada dietil eter dan pelarut nonpolar lainnya. Indikasi bahay dari bahan ini adalah dapat menyebabkan iritasi pada mata dan garal pada kulit. Penanganan pertama untuk kontak langsung dengan kulit segera bilas kulit denga air mengalil selama 15 menit (Anonim, 2017).
2.1.3 Etil Asetat
2.2 Dasar Teori
Proses industri banyak melibatkan adanya reaksi kimia, oleh karena itu sangat diperlukan peranan ilmu kimia sebagai dasar untuk mengatur suatu proses industri dapat menhasilkan produk yang banyak dalam waktu yang singkat. Proses dalam reaksi kimia ada yang berjalan cepat da nada yang berjalan lambat. Misalnya reaksi kimia berlangsung cepatyaitu pada batang korek api yang cepat terbakar dan reaksi yang lambar seperti pencoklatan pada buah. Topik bahasan seperti ini disebut dengan kinetika reaksi. Kinetika reaksi adalah pengkajian laju dan mekanisme reaksi kimia. Pengkajian laju rekasi dapat diartikan kelajuan perubahan kimia yang terjadi sedangkan mekanisme reaksi digunakan untuk menggambarkan langkah-langkah reaksi yang meliputi perubahan keseluruhan dari suatu reaksi (Sastrohamidjojo, 2002).
Laju reaksi suatu rekasi kimia dinyatakan sebagai perubahan konsentrasi yang terlibat dalam reaksi terhadap satuan waktu. Laju atau kecepatan rekasi dapat dinyatakan sebagai laju berkurangnya/bertambahnya konsentrasi suatu produk. Konsentrasi umumnya dinyatakan dalam mol per liter. Laju reaksi suatu reaksi kimia dapat dinyatakan dengan persamaan laju reaksi dibawah ini :
A + B AB
Persamaan laju reaksi secara umum ditulis sebagai berikut : r = k [A]m[B]n
dengan keterangan k sebagai konstanta laju reaksi, m dan n merupakan orde reaksi masing-masing pereaksi. Besarnya laju reaksi dipengaruhi oleh beberapa faktor antara lain :
1. Konsentrasi reaktan
Laju reaksi akan berjalan lebih cepat apabila konsentrasinya dinaikkan, hal ini diakibatkan dari meningkatnya pertumbukan atom per satuan waktu.
2. Luas Permukaan
Luas permukaan yang besar ajan meningkatkan laju reaksi, 3. Tekanan
Tekanan yang dinaikkan maka volume turun sehingga meningkatkan frekuensi tumbukan antar molekul.
4. Temperatur
5. Katalis
Suatu zat yang merubah lintasan reaksi kimia dan meningkatkan laju reaksi dengan menurunkan energy aktivasi. Katalis ikut bereaksi namun tidak mengalami perubahan saat reaksi.
(Sukamto, 1989)
Orde reaksi di dalam reaski kimia berkaitan dengan pangkat dengan hukum laju reaksinya. Hubungan orde reaksi terhadap suatu komponen merupakan pangkat dari konsentrasi komponen. Orde reaksi dapat ditentukan nilainya dari suatu percobaan dan tidak dapat diturunkan secara terori walaupun stokiometri reaksinya telah diketahui. Metode penentuan orde reaksi memerlukan pengukuran laju reaksi awal. Menentukan orde reaksi dari suatu reaksi kimia pada prinsipnya menentukan seberapa besar pengaruh perubahan konsentrasi pereaksi terhadap laju reaksi (Keenan, 1979). Reaksi yang berjalan dengan konstan dan tidak bergantung pada konsentrasi reaktan disebut orde reaksi nol. Orde reaksi satu biasanya menggunakan konsetrasi tungga dalam hukum laju dan konsetrasi tersebut memiliki pangkat satu. Orde reaksi dua adalah konsetrasi tunggal berpangkat dua atau dua konsentrassi masing-masing berpangkat satu (Hiskia, 1992). Berikut reaksi dari masing-masing orde reaksi :
a. Reaksi orde nol :
c. Reaksi orde dua :
(Iqmal, 2012)
Saponifikasi atau saponify berarti membuat sabun, dimana (sapon = sabun dan fy = membuat). Sabun dibuat dari proses saponifikasi lemak hewan (tallow) dan dari minyak, reaksi saponifikasi tidak lain adalah hidrolisis basa suatu ester dengan alkali (NaOH, KOH) (Poedjiadi, 2006). Proses saponifikasi seperti pada reaksi trigliserida dengan alkali yang terjadi pada suhu 800oC. Saponifikasi suatu trigliseraldehida menghasilkan suatu garam dari asam lemak ke rantai panjang yang merupakan sabun (Spitz, 1996). Reaksi saponifikasi lemak atau minyak ditunjukkan pada gambar 2.1
Gambar 2.1 Reaksi Saponifikasi (Spitz, 1996)
mempengaruhi besarnya konduktivitas molar yang biasa disimbolkan ∆m ini, yaitu konsenstrasi larutan. (Sukardjo, 1997).
Faktor-faktor yang mempengaruhi daya hantar adalah perubahan suhu dan konsentrasi. Apabila semakin besar suhunya maka daya hantar pun juga akan semakin besar dan apabila semakin kecil suhu yang digunakan maka sangat kecil pula daya hantar yang dihasilkan. Hubungan antara konsentrasi dengan daya hantar, apabila konsentrasinya tinggi maka daya hantarnya juga tinggi karena penambahan konsentrasi akan menyebabkan ion-ion dalam larutan semakin banyak yang begerak bebas.hubungan konduktivitas dengan suhu dapat disimpulkan bahwa konduktivitas berbanding lurus dengan suhu. Konsentrasi juga berbangding lurus dengan suhu (Khopkar, 1990).
Konduktansi suatu larutan dapat diukur dengan mencelupkan sel yang berisi dua elektroda platina ke dalam larutan yang akan diukur konduktivitasnya. Elektroda dihubungkan ke satu lengan dari jembatan Wheastone dan tegangan bolak-balik diberikan ke jembatan tersebut. Konduktansi dapat diperoleh dari skala dengan membuat nilai nol (arus listrik) pada jembatan tersebut. Pengukuran akurat diperoleh hanya dengan elektroda yang dipersiapkan dengan baik. Konduktometer yang digunakan dalam percobaan ini sebelumnya harus dikalibrasi terlebih dahulu untuk memastikan bahwa konduktometer benar-benar dalam keadaan baik sehingga mendapatkan hasil yang sesuai
(Hendayana, 1994).
E = tegangan listrik, R = hambatan.
L = C A d
(3) dimana:
C = konsentrasi (ekivalen per cm3) d = jarak antar elektroda (cm), A = luas elektroda (cm2)
= konstanta kondutansi ion ekivalen.
berifat unik untuk setiap ion dan tergantung pada temperatur (Tim Penyusun, 2017).
BAB 3. METODOLOGI PERCOBAAN
3.1 Alat dan Bahan 3.1.1. Alat
- Pipet volume 10 mL - Labu ukur 100 mL - Labu ukur 50 mL - Pipet mohr 10 mL - Konduktometer - Pipet tetes - Komputer - Pengaduk
- Beaker gelas 150 mL - Beaker gelas 100 mL - Ball pipet
- Gelas ukur 25 mL
3.1.2 Bahan - Akuades
- Natrium hidroksida (NaOH) - Etil Asetat (CH3COOC2H5)
3.2. Skema Kerja
- diambil 5 mL dan dimasukkan pada erlemneyer 1 - ditambahakan 40 mL air destilat
- ditambahkan 40 mL air destilat
- dilakukan saponifikasi dengan cara mencampurkan kedua larutan
- diaduk campuran dan diukur konduktifitasnya dengan waktu pertama 0 detik dan selanjutnya selang 100 detik dengan interval 1200 detik (sebelum digunakan alat dikalibrasi dengan larutan NaCl 500 ppm dan 100 ppm). - Dilakukan hal yang sama untuk etil asetat 25 mL
BAB 4. HASIL DAN PEMBAHASAN
4.1 Hasil
Waktu
(s) L 0 ( S/cm) L ( S/cm) L0−t L ( S/cm)
k
Perc 1 Perc 2 Perc 1 Perc 2 Perc 1 Perc 2 Perc 1 Perc
2
100 16399,3 14044,9 16270,8 14151,8 1,285875 −1,06781 0,523
7 9 0,123 9
200 16250,0 14137,5 0,746719 −0,46232
300 16233,8 14111,8 0,551813 −0,22271
400 16245,5 14107,0 0,38475 −0,1551
500 16250,0 14107,0 0,298688 −0,12408
600 16254,1 16254,1 0,242156 −0,06562
700 16249,0 14077,2 0,214795 −0,04602
800 16251,5 14077,2 0,184781 −0,04027
900 16248 14080,8 0,168188 −0,03977
1000 16238,4 14076,6 0,160988 −0,03162
1100 16233,8 14068,9 0,150494 −0,02169
1200 16239,4 14064,7 0,133313 −0,0164
4.2 Pembahasan
Percobaan yang akan dibahas pada praktikum ini ialah menentukan konstatnta reaksi orde-2 dari reaksi saponofikasi etil asetat. Percobaan ini menggunakan etil asetat yang direaksikan dengan natrium hidroksida kemudian diukur konduktivitasnya menggunakan konduktometer. Nilai konstanta dapat diketahui dengan mengolah data konduktifitas campuran yang telah diukur dengan konduktometer. Konduktometer merupakan alat yang digunakan untuk menentukan daya hantar suatu larutan dan mengukur derajat ionisasi suatu larutan elektrolit. Reaksi kimia merupakan percampuran dua zat atau lebih yang menghasilkan sifat baru berbeda dari reaktannya. Reaksi ini disebut sebagai reaksi saponifikasi karena pada reaksi ini hampir sama dengan reaksi saponifikasi dimana terjadi hidrolisis lemak dengan alkali.
Konduktometer yang akan dipakai harus dikalibrasi terlebih dahulu menggunakan NaCl 100 ppm dan NaCl 500 ppm. Kalibrasi alat merupakan suatu proses untuk menentukan kebenaran alat penunjuk terhadap standar ukuran yang terukur. Kalibrasi dilakukan untuk memastikan kesesuaian karakteristik dari larutan yang diukur, dimana dari hal tersebut alat tersebut tidak mengalami penyimpangan jauh saat dilakukan pengukuran. NaCl digunakan pada saat kalibrasi karena pada suhu kamar konduktivitas NaCl tidak berubah-berubah. Prinsip kerja dari konduktometer tersebut tergantung dari interkasi antara elektroda yang digunan dengan larutan yang memiliki ion-ion yang saling berinteraksi sehingga nilai konduktivitasnya dapat diukur. Semakin besar konsentrasi suatu larutan maka semakin besar nilai daya hantarnya karena semakin banyak ion-ion dari larutan yang menyentuh konduktometer.
dengan volume etil asetat yang pertama 5ml dan kedua 25ml. Hal tersebut jelas memyebabkan perbedaan konsentrasi antara sampel 1 dengan sampel 2. Pencelupan elektroda sebenarnya dilakukan pada saat larutan tersebut yang paling tepat yaitu pada saat kedua larutan sehingga konduktivitas saat ion-ion mulai mengalami interaksi dapat terukur. Reaksi yang antara etil asetat dan NaOH dapat ditunjukkan sebagai berikut :
CH3COOC2H5 (aq) + NaOH (aq) CH3COONa (aq) + C2H5OH (aq) Laju reaksi dari persamaan diatas dapat dituliskan sebagai berikut :
V=K
[
CH3COONa] [C2H5OH]
Laju reaksi menyatakan molaritas zat terlarut dalam reaksi yang dihasilkan tiap detik reaksi. Reaksi saponifikasi diatas merupakan laju reaksi orde 2 karena laju berbanding lurus dengan kuadrat konsentrasi satu reaktan.
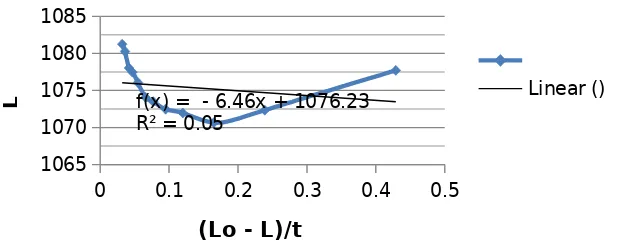
0 0.1 0.2 0.3 0.4 0.5 1065
1070 1075 1080 1085
f(x) = - 6.46x + 1076.23 R² = 0.05
Kurva L vs (Lo - L)/t etil asetat 5ml
Linear ()
(Lo - L)/t
L
Gambar 1. Grafik L Vs (Lo - L)/t pada etil asetat 5ml
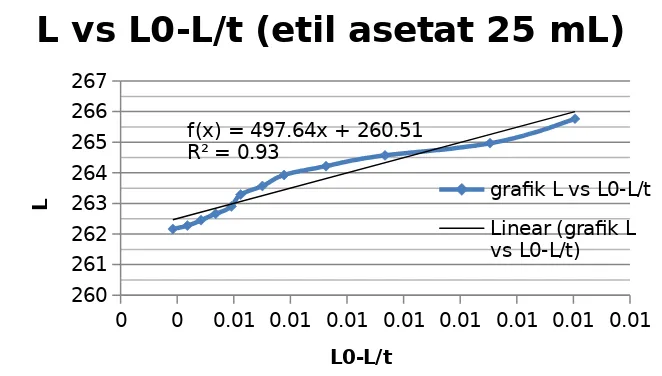
Berdasarkan percobaan yang dilakukan, nilai konduktivitas etil asetat 25 ml yang dilarutkan dengan 40 ml akuades, dan NaOH 10 ml yang dilarutkan dengan 40 ml akuades pada interval 100 s -1200 s yaitu, 265, 768 S; 264, 966 S; 264, 570 S; 264, 219 S; 263, 929 S; 263, 568 S; 263,287 S; 262, 906 S; 262, 661 S; 262, 450 S; 262, 275
0 0 0.01 0.01 0.01 0.01 0.01 0.01 0.01 0.01 260
261 262 263 264 265 266 267
f(x) = 497.64x + 260.51 R² = 0.93
L vs L0-L/t (etil asetat 25 mL)
grafik L vs L0-L/t
Linear (grafik L vs L0-L/t)
L0-L/t
L
BAB 5. PENUTUP
5.1 Kesimpulan
Kesimpulan dari percobaan yang dilakukan yaitu konstanta reaksi orde-2 dapat ditentukan dengan cara mengetahui besar konduktivitas dari suatu reaksi. Konduktivitas suatu rekasi merupakan kemampuan suatu ion-ion yang terurai dan interaksinya dengan elektrode konduktometer. Besar konstantan dapat ditentukan dengan mengetahui gradien dari plot L vs (Lo-L)/t. Besar konstanta reaksi orde dua pada etil asetat 5 ml dan 25 ml yaitu sebesar -15,48 dan 0,0401
5.2 Saran
Saran daripercobaan yang dilakukan yaitu sebelum melakukan percobaan akan lebih baik bila setiap praktikan sudah memahami dasar-dasar tentang keinetika reaksi orde-2 agar percobaan yang dilakukan berjalan lebih baik lagi. Perlaguan pada setiap tahap percobaan lebih baik dikonsultasikan pada asisten supaya kesalahan selama percobaan dapat diminimalisir. Perlakuan saat pengukuran menggunakan konduktometer harus tepat dan harus dipersiapkan agar percobaan yang dilakukan sesuai dengan yang diharapkan.
Anonim. 2017. Material Safety Data Sheet of aquades. [serial online] https : // www. sciencelab. com/msds. php?msdld=9927923. [Diakses pada tanggal 25 April 2017]. Anonim. 2017. Material Safety Data Sheet of etil asetat. [serial online] https : // www. sciencelab. com/msds. php?msdld=9926853. [Diakses pada tanggal 15 April 2017]. Anonim. 2017. Material Safety Data Sheet of natrium hidroksida. [serial online] https : // www. sciencelab. com/msds. php?msdld=9927468. [Diakses pada tanggal 15 April 2017].
Atkins, P.W. 1996. Kimia Fisisk Jilid 1. Jakarta :Erlangga. Suyono. 1990. Kinetika Kimia. Jakarta: Erlangga.
Dogra, S.K dan Dogra, S. 1984. Kimia Fisik dan Soal-soal. Jakarta :UI Press. Keenan. 1984. Kimia untuk Universitas. Jakarta: Erlangga.
Khopkar, S.M. 2003. Konsep Dasar Kimia Analitis. Jakarta : UI Press. Syukri, S. 1999. Kimia Dasar Jilid 1 dan 2. Bandung : UI Press.
Tim Kimia Fisik. 2017. Penuntun Praktikum Kimia Fisik II. Jember: Universitas Jember.
1. Pembuatan 100 mL NaOH 0,1 M
2. Pembuatan 0,1 M etil asetat dari 99% etil asetat M=×10× ρ
0 0.2 0.4 0.6 0.8 1 1.2 1.4
Konstanta laju reaksi (etil asetat 5 mL) y = 19,12x + 16240
4. Grafik etil asetat 25 mL
-1.2 -1 -0.8 -0.6 -0.4 -0.2 0 14020 14040 14060 14080 14100 14120 14140 14160 f(x) = - 80.69x + 14079.98
R² = 0.78
Etil Asetat 25 mL
Linear ()
(L0-L)/t
L
Konstanta laju reaksi (etil asetat 25 mL) y = -80,69x + 14080
1
k c0=−80,69 1
k0,1=−80,69 1