BAB 2
TINJAUAN PUSTAKA 2.1 Definisi DBD
Penyakit Demam Berdarah Dengue (DBD) adalah penyakit yang disebabkan oleh infeksi Virus Dengue serotipe I, II, III, IV (Soegijanto 2003). DBD merupakan kondisi lanjutan dari DD dimana terjadi perembesan plasma yang ditandai oleh hemokonsentrasi (peningkatan hematokrit) atau penumpukan cairan di rongga tubuh. Sedangkan kondisi paling berat dari DBD adalah Sindrom Syok Dengue (SSD) yaitu DBD yang ditandai oleh syok (Suhendro et al, 2009).
2.2 Epidemiologi DBD
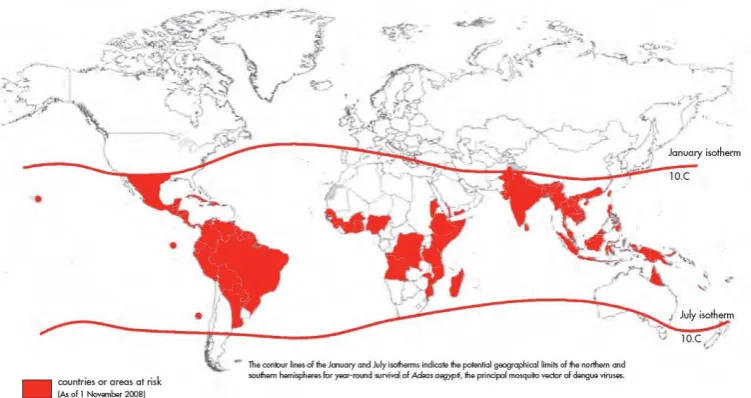
Demam Dengue merupakan penyakit infeksi virus yang paling cepat penyebarannya di dunia. Dalam 50 tahun terakhir insidensinya meningkat 30 kali dan disertai ekspansi ke negara-negara baru. Pada dekade sekarang, penyebarannya berubah dari urban ke rural (WHO, 2009).
World Health Assembly (WHA) tahun 2002 menghasilkan resolusi
WHA55.17 yang isinya supaya WHO dan semua negara anggotanya lebih meningkatkan komitmennya dalam melawan dengue. Sementara itu pada resolusi WHA58.3 pada pertemuan WHA tahun 2005 merevisi International Health Regulation (IHR) yang memasukkan dengue sebagai contoh penyakit yang mungkin
merupakan keadaan darurat kesehatan publik internasional yang berimplikasi pada keamanan kesehatan akibat gangguan dan epidemi yang cepat menyebar ke luar perbatasan negara (WHO, 2009).
dan kurangnya akses ke pengobatan yang memadai. Hal ini semakin diperberat dengan perkembangan daerah urban yang tidak terencana, jeleknya penyimpanan air dan kondisi sanitasi yang belum memadai di negara-negara Asia Pasifik. Kondisi tersebut dapat meningkatkan jumlah vektor utama Virus Dengue yaitu nyamuk Aedes aegypti. Dengan meningkatnya jumlah vektor dan meningkatnya kepadatan penduduk, kemungkinan untuk penularan Virus Dengue juga semakin besar (WHO-SEARO, 2008).
Gambar 2.1 Negara dan daerah yang berisiko DBD (WHO, 2009)
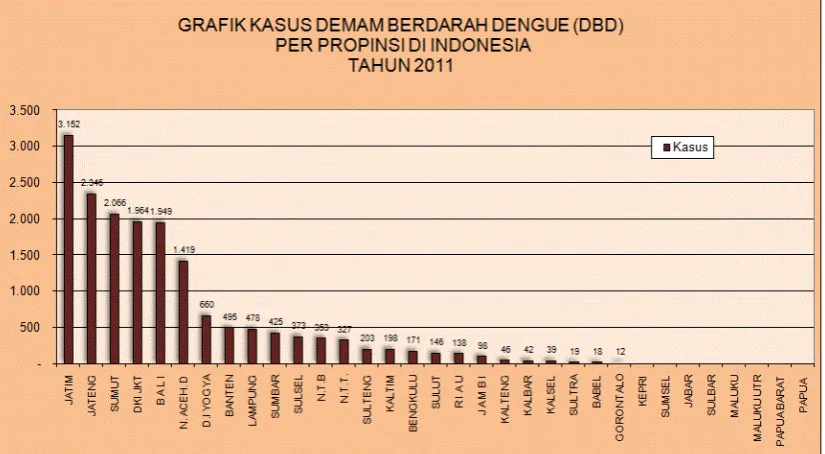
Gambar 2.2 Grafik kasus DBD per provinsi di Indonesia Tahun 2011 (Depkes RI, 2011)
2.3 Etiologi
Virus Dengue termasuk kelompok B Arboviroses yaitu jenis virus yang ditularkan oleh arthropoda. Virus Dengue sekarang dikenal sebagai genus Flavivirus, famili Flaviviridae (Depkes RI, 2010). Karena merupakan family Flaviviridae maka harus dibedakan dengan demam yang disebabkan virus Japanese Enchephalitis dan Yellow Fever (demam kuning) (Soegijanto, 2003). DBD ditularkan ke manusia
melalui gigitan nyamuk Aedes yang terinfeksi Virus Dengue (Depkes RI, 2010).
2.4 Struktur Virus Dengue (DENV)
terbentuk terhadap serotipe lain sangat kurang, sehingga tidak dapat memberikan perlindungan yang memadai terhadap serotipe lain tersebut (Depkes RI, 2010).
Meskipun keempat serotip Virus Dengue berbeda antigennya, terdapat bukti bahwa mungkin ada serologis subkomplek dalam grup Virus Dengue. Misalnya, ditemukan adanya hubungan genetik yg dekat antara DEN 1 dan DEN 3 dengan menggunakan pemeriksaan hybrid antara sequence homology dan complementary deoxyribonucleic acid (cDNA). Dan secara mengejutkan, DEN 2 menunjukkan
adanya sequence yang homolog dengan Edge Hill virus, sebuah flavivirus khas Australia, sebesar 71% (Gubler, D.J., 2001).
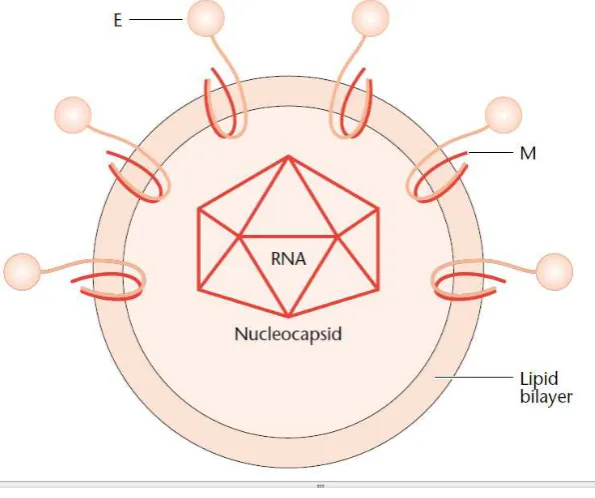
Gambar 2.3. Struktur flavivirus (Gubler, D.J., 2001)
Diperkirakan bahwa Virus Dengue dan flavivirus lainnya menginfeksi sel dengan menempel pada reseptor selular melalui protein selubung (E), meskipun protein reseptor spesifik belum diidentifikasi (Gubler, D.J., 2001). Selain untuk infeksi, protein selubung juga berguna untuk hemaglutisasi sel darah, menginduksi respon imun positif, fusi membrane dan pembentukan virion (Guzman et al, 2004).
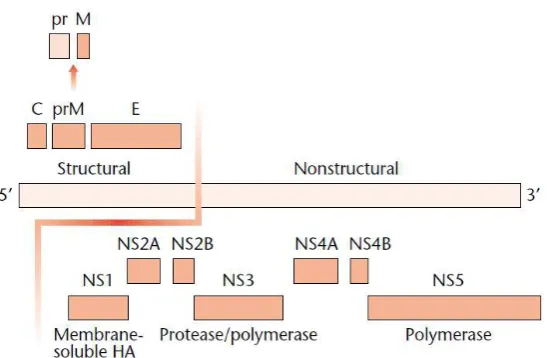
Gambar 2.4 Genom dan susunan gen Flavivirus (Gubler, D.J., 2001)
Sementara itu NS1 adalah protein nonstruktur 1, merupakan glukoprotein yang berfungsi dalam siklus kehidupan virus yang belum jelas diketahui. NS1 dideteksi dengan kadar yang tinggi pada penderita infeksi Virus Dengue dengan reaksi imun sekunder, tetapi jarang dijumpai pada penderita yang menunjukkan reaksi imun primer (Soegijanto, 2009). Diakui adanya NS1 pada perrmukaan sel di sel endoltel dihipotesiskan sebagai mekanisme kebocoran pembuluh darah yang terjadi selama infeksi Virus Dengue yang parah. Namun, tetap tidak jelas bagaimana hubungan NS1 dengan membran plasma, sebagaimana membrane plasma tidak mengandung motif sequence yang membrane-spanning (Avirutnan, 2007).
terhadap sebagian besar sel sel darah perifer. Selain itu, DENV NS1 lebih suka berikatan dengan kultur dari mikrovaskuler manusia dibandingkan dengan aorta atau sel endotel pada vena tali pusar. Perbedaan pengikatan NS1 yang larut pada jaringan endotel dan diikuti oleh pengenalan oleh anti-NS1 antibodi dapat berkontribusi pada sindrom kebocoran vaskular yang terjadi selama infeksi Virus Dengue yang parah.
NS2 memiliki 2 protein (NS2A dan NS2B) yang berperan pada proses poloprotein sedangkan NS3 memiliki sebagian proteinase yang berfungsi sebagai sitosol. Gen NS4 memiliki 2 protein hidrofobik yang berperan pada kompleks replikasi membran RNA. NS5 memiliki berat molekul 105.000 dan merupakan petanda protein Flavivirus. Berdasarkan sequence asam amino, protein ini dapat dipercaya untuk mewujudkan RNA Encoded virus yang tergantung pada polymerase RNA (Soegijanto, 2009).
2.5 Vektor Virus Dengue
Vektor utama dari Virus Dengue adalah nyamuk Aedes sp. terutama Aedes aegypti. Nyamuk ini tersebar di seluruh daerah tropis mulai dari 35o lintang utara sampai 35o lintang selatan dan jarang ditemukan di daerah dengan ketinggian di atas 1000m. Fase imaturnya dapat ditemukan di tempat-tempat dengan genangan air. Beberapa penelitian mengatakan bahwa nyamuk betina menghabiskan hidupnya di tempat dia beranjak dewasa. Telurnya dapat bertahan beberapa bulan tanpa air (Depkes, 2010).
2.6 Respon Imun
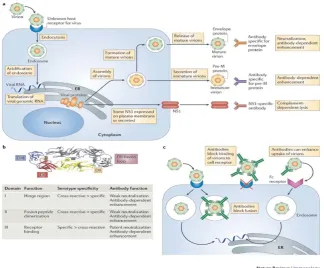
Menurut Rothman (2010), berikut ini adalah respon imun yang terjadi dari mulai masuknya Virus Dengue ke dalam darah.
a| Alur hidup dan sumber antigen. Virion-virion dengue berikatan ke reseptor di permukaan sel, dan virion tersebut masuk melalui proses endositosis. Pengasaman vesikel endosit menyebabkan pembentukan kembali glikoprotein permukaan kapsul (E), penggabungan antara virus dan membrane vesikel dan pelepasan RNA virus ke sitoplasma. Genom RNA dari virus kemudian di translasikan untuk memproduksi protein virus di struktur membrane dari endoplasmic reticulum (ER), kemudian protein dan RNA virus yang baru dibentuk disatukan menjadi virion yang immature di lumen ER. Pemotongan prekusor membran (pre-M) virus oleh enzim furin sel induk mengarah kepada pembentukan virion yang mature, yang kemudian disekresikan dari sell. Pada saat yang sama beberapa non-structural protein 1 (NS1) virus yang sudah disintesis diekpresikan ke membran plasma sel induk dan sebagian disekresikan dan sebagian virion juga disekresikan dalam bentuk immature.
Virion yang mature maupun immature menginduksi respon antibodi ke protein E, dan antibody ini dapat berfungsi dalam meneutralisasi atau dalam infeksi yang antibody-dependent. Virion yang immature juga menginduksi respon antibodi terhadap protein pre-M. Antibodi spesifik untuk NS1 dapat bereaksi dengan membran yang berikatan dengan NS1, menyebabkan complement-dependent lysis dari sel induk.
Gambar 2.5 Reaksi imun pada infeksi Virus Dengue (Rothman, 2010)
c| Mekanisme neutralisasi dan pelekatan oleh antibody yang spesifik Virus Dengue. Pada akupasi epitop tingkat tinggi, antibodi dapat memblok ikatan virus dengan reseptor sel induk atau memblok penyatuan virion pada tahan setelah pengikatan. Pada akupasi epitop tingkat rendah, antibody dapat menyebabkan masuknya kembali virion kedalam sel melalui interaksi dengan reseptor immunoglobulin (Fc).
2.7 Patogenesis DBD
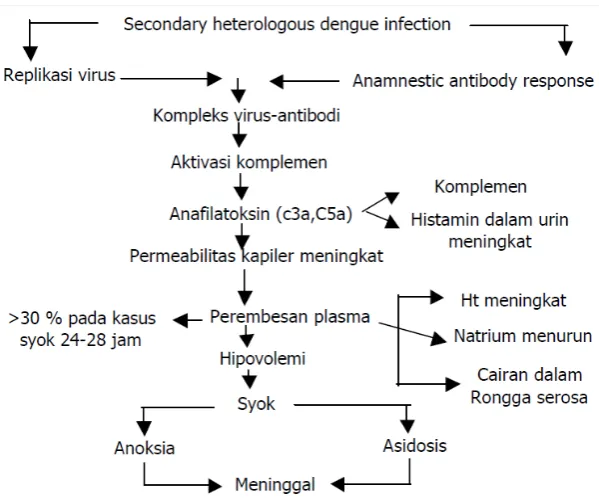
Patogenesis DBD dan SSD (Sindrom syok dengue) masih merupakan masalah yang kontroversial. Dua teori yang banyak dianut pada DBD dan SSD adalah hipotesis infeksi sekunder (teori secondary heterologous infection) atau hipotesis immune enhancement. Hipotesis ini menyatakan secara tidak langsung bahwa pasien
Antibodi heterolog yang telah ada sebelumnya akan mengenai virus lain yang akan menginfeksi dan kemudian membentuk kompleks antigen antibodi yang kemudian berikatan dengan Fc reseptor dari membran sel leokosit terutama makrofag. Oleh karena antibodi heterolog maka virus tidak dinetralisasikan oleh tubuh sehingga akan bebas melakukan replikasi dalam sel makrofag (Sohendro, 2009).
Gambar 2.6 Patogenesis terjadinya syok pada DBD (Depkes RI, 2010)
dengan peningkatan kadar hematokrit, penurunan natrium dan terdapatnya cairan dalam rongga serosa (Depkes RI, 2010).
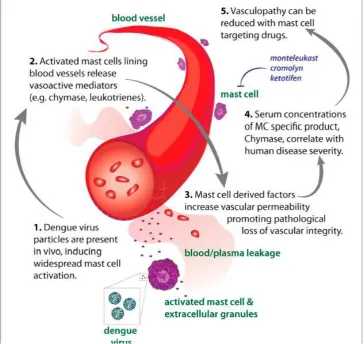
Gambar 2.7 Peranan mast cell terhadap terjadinya DHF/DSS (Saint John et al, 2013)
Dengue. Diferensiasi T helper yaitu TH1 akan memproduksi interferon gamma, IL-2 dan limfokin, sedangkan TH2 memproduksi IL-4, IL-5, IL-6 dan IL-10; c)monosit dan makrofag berperan dalam fagositosis virus dengan opsonisasi antibodi. Namun proses fagositosis ini menyebabkan peningkatan replikasi virus dan sekresi sitokin oleh makrofag; d).selain itu aktifasi komplemen oleh kompleks imun menyebabkan terbentuknya C3a (Complement 3a) dan C5a (Complement 5a) (Sohendro, 2009).
Menurut Martina (2009), terdapat beberapa factor-faktor terlarut dalam darah yang berperan dalam munculnya DBD/SSD, yaitu :
a. Trombin : mengubah fibrinogen di sirkulasi menjadi fibrin dan memicu aktivasi platelet, yang menyebabkan agregasi platelet. Trombin mengaktifasi endothelial cell (EC) untuk meningkatkan permibialitasnya, menyebabkan kebocoran
plasma dan pembentukan edema. Trombin adalah kemotaktik untuk monosit dan juga mitogenik untuk limfosit dan sel-sel mesenkim. Platelet aktif melepaskan beberapa faktor soluble dengan aktifitas inflamasi, antimikroba dan modulasi imun, misalnya Matrix metalloproteinase 9 (MMP-9), yang meningktakan permeable EC. Platelet aktif juga melepaskan CD40 ligand terlarut, yang bisa memicu EC untuk memproduksi beberapa jenis oksigen reaktif, molekus adhesi, kemokin, dan Tissue Factor (TF). Trombin juga menghambat produksi IL-12 oleh sel mononuclear.
b. C3a dan C5a : C3a mengkativasi platelet dan meningkatkan aktivasi dan sifat adhesinya. C5a meningkatkan pembentukan trombosit darah dengan upregulasi TF dan ekspresi plasminogen activator inhibitor 1 (PAI-1) di berbagai tipe sel. C5a menstimulasi monosit untuk memproduksi IL-1, IL-6, IL-8, dan TNF-α. Aktifasi dari komplemen-komplemen itu meningkatkan thrombin, yang membelah C3 dan C5 menjadi C3a/b dan C5a/b secara perlahan. Platelet aktif juga ikut dalam pembelahan C3, yang menginduksi aktifasi pathway komplemen klasik.
d. IL-1 (Interleukin-1) : adalah mediator utama dari aktifasi EC oleh platelet, menyebabkan peningkatan pelepasan kemokin dan upregulasi dari soluble vascular cell adhesion molecule 1 (VCAM-1). VCAM-1 membantu adhesi dari monosit ke
endotel. IL-1 meningkatkan ekspresi dari TF di EC dan menekan aktifitas koagulan permukaan sel EC. Bergantung pada konsentrasinya, dia mungkin menyebabkan upregulasi produksi TNF – α atau downrelugasi TNF-receptor. IL-1 menstimulasi hipotalamus dan sebagai lanjutannya, kelenjar pituitary untuk memproduksi mediator antiinflamasi seperti endorphin, melanocyte-stimulating hormone dan hormone adrenokortitropik.
e. IL-6 (Interleukin-6) : Bersama-sama dengan sitokin proinflamasi lainnya, IL-6 mempotensialkan kaskade koagulasi. Dia dapat menyebabkan down regulasi produksi TNF-α dan reseptor TNF. IL-6, bersama dengan IL-1 adalah pemicu poten dari demam.
f. IL-8 (Interleukin-8) : IL-8 adalah kemokin yang banyak diproduksi oleh monosit, EC dan hepatosit. Kerusakan pada EC di hepar dapat meningkatkan konsentrasi sitemiknya, Aktifasi sistem koagulan adalah akibat dari meningkatnya ekpresi EL-6 dan IL-8 oleh monosit, sementara pathway antikoagulan APC-PS downregulasi produksi IL-8 oleh EC.
g. IL-10 (Interleukin-10) : IL-10 diproduksi oleh monosit dan diregulasi oleh sel T helper dan dapat menyebabkan platelet membusuk. Trombin dapat menstimulasi produksi IL-10 oleh monosit. Sitokin menyebabkan dwonregulasi respon inflamasi dan membentuk proviral survival milieu. IL-10 mempromosikan original antigenic sin (OAS) dengan menginhibisi perkembangan dari efektor sel T ke epitop baru.
IL-10 juga menghambat ekpresi dari TF dan menghambat fibrinolisis.
nitric oxide (NO) dan memediasi activation-induced kematian sel T dan dia dipercaya berimplikasi pada pemusnahan sel T perifer.
i. TGF – β : Transforming Growth Factor - β (TGF – β) dapat berperan sebagai proinflamasi atau sitokin anti-inflamasi, bergantung pada konsentrasinya. Pada awal infeksi, TGF - β yang rendah dapat memicu sekresi IL-1 dan TNF – α. Namun, pada fase akut, sitokin menghambat respon T-helper 1 (Th1) dan meningkatkan produksi sitokin T-Helper 2 seperti IL-10. TGF – β meningkatkan ekpresi TF ke EC dan menyebabkan upregulasi ekspresi dan pelepasan dari plasminogen activator inhibitor (PAI-1).
j. NO : Nitric Oxide (NO) mempunyai beberapa faktor dalam reaksi inflamasi. Dia meningkatkan vasodilatasi dan pembentukan edema. Dia menyebabkan upregulasi produksi TNF – α di monosit. Pada konsentrasi rendah dia memproteksi sel dari apoptosis, sementara pada konsentrasi tinggi dia merangsang apoptosis. NO menyebabkan downregulasi ekspresi MHC class II dan menekan ekpasnsi sel Th1. Pemeliharaan pelindung EC membutuhkan NO dengan tingkat dasar. Baik kekurangan maupun kelebihan NO mengganggu kestabilan ikatan EC.
k. VEGF : vascular endothelial growth factor (VEGF) adalah kunci merubah permiabiliti vascular. Dia mengurangi okludin, klaudin dan isi VE-cadherin dari EC, yang semuanya adalah komponen junction EC. Selama aktifasinya, VEGF merangsang ekpresi intracellular adhesion molecule 1 (ICAM-1), VCAM – 1, dan E-selectin di EC.
2.8 Gejala Klinis
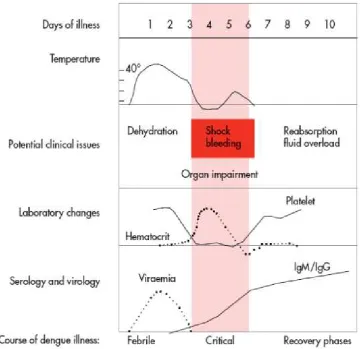
WHO pada tahun 2009 mengeluarkan Guidelines for diagnosis, treatment, prevention and control. Dalam panduan tersebut WHO membagi hari-hari sakit
a.Fase Demam
Penderita mengalami demam akut 2-7 hari disertai muka wajah memerah, kulit memerah, nyeri seluruh badan, mialgia, atralgia dan sakit kepala. Ada juga gejala nyeri tenggorokan, faring hiperemis, konjunctiva hiperemis. Anorexia, nausea dan muntah muntah umum terjadi. Sulit untuk membedakan dengue dengan non dengue pada fase demam, uji torniquet positip mempertinggi kemungkinan penderita mengalami infeksi Virus Dengue. Diperlukan monitor untuk menilai timbulnya tanda bahaya (warning sign) yang akan membuat pasien masuk ke fase ke 2 fase kritis. Manifestasi perdarahan ringan seperti petekie dan perdarahan membran mukosa (seperti perdarahan hidung dan gusi) dapat terjadi. Perdarahan pervaginam yang masif dapat terjadi pada wanita usia muda dan perdarahan saluran cerna dapat terjadi pada fase ini tetapi jarang. Hati dapat membesar dan tegang/nyeri setelah demam beberapa hari. Tanda paling awal dari pemeriksaan darah rutin adalah menurunnya total leukosit (leukopenia) yang dapat menjadi dasar klinisi untuk menilai pasien sudah terjangkit Virus Dengue.
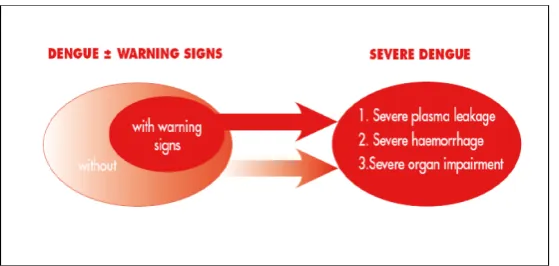
b. Fase Kritis
yang masif dapat terjadi. Pasien yang membaik dalam fase ini disebut sebagai non-severe dengue. Pasien yang memburuk akan menunjukkan tanda bahaya. Pasien ini bisa membaik dengan rehidrasi intravena atau memburuk kembali yang disebut severe dengue.
Severe dengue didefinisikan bila didapati satu atau lebih hal-hal berikut ini
(WHO,2009) :
• Kebocoran plasma yang mengarah pada syok
• Perdarahan hebat
• Gangguan berat organ
Biasanya terjadi pada hari ke-4 atau ke-5 demam (berkisar antara hari ke 3-7), ditandai dengan tanda bahaya. Kompensasi tubuh untuk mempertahankan tekanan sistolik menyebabkan takikardia dan vasokonstriksi perifer, ditandai dengan akral dingin dan peningkatan capillary refill time. Akhirnya terjadi dekompensasi dan TD menghilang. Syok akibat hipotensi dan hipoksia akan menyebabkan kegagalan multiorgan (WHO,2009).
c.Fase Penyembuhan
Gambar 2.8 Karakteristik penyakit Demam Dengue (WHO, 2009)
2.9 Diagnosis DBD
Diagnosa dengue berdasarkan 2 kriteria (WHO 1997 dalam Suhendro et al, 2009) : A. Kriteria klinis:
1. Demam tinggi mendadak tanpa sebab yang jelas, berlangsung terus menerus selama 2-7 hari
2. Terdapat manifestasi perdarahan yang ditandai dengan: a) Uji torniquet positif
c) Perdarahan mukosa (tersering epistaksis atau perdarahan gusi), atau perdarahan dari tempat lain
d) Hematemesis dan atau melena 3. Pembesaran hati (hepatomegali)
4. Syok ditandai dengan nadi cepat dan lemah serta penurunan tekanan nadi, hipotensi, kaki dan tangan dingin, kulit lembab dan pasien gelisah
B.Kriteria Laboratorium
1. Trombositopenia (100.000/ml atau kurang)
2. Adanya kebocoran plasma (plasma leakage) karena peningkatan permeabilitas kapiler dengan manifestasi :
− Peningkatan hematokrit ≥20% dibandingkan standar sesuai dengan umur dan jenis kelamin
− Penurunan hematokrit ≤20% setelah mendapat terapi cairan, dibandingkan dengan nilai hematokrit sebelumnya
− Tanda kebocoran plasma seperti : efusi pleura, asites, atau hipoproteinemia
Dua kriteria klinis pertama ditambah salah satu dari kriteria laboratorium (atau hanya peningkatan hematokrit) sudah dapat menegakkan diagnosis klinis DBD.
Dari diagnosis itu, pasien DD dapat diklasifikasikan ke dalam beberapa kriteria.
Tabel 2.1 Klasifikasi Dinkes RI terhadap derajat penyakit infeksi Virus Dengue
DD/DBD Derajat Gejala laboratorium
DD
Demam, disertai 2 atau lebih tanda: sakit kepala, nyeri
DBD I Gejala di atas ditambah uji
Gejala di atas ditambah kegagalan sirkulasi (kulit
dingin dan lembab serta gelisah
Syok berat disertai dengan tekanan darah dan nadi tidak
terukur
Trombositopenia (<100.000),bukti ada kebocoran
plasma Sumber : Suhendro et al, 2009
Sementara WHO melalui guidelinenya tahun 2009 menyatakan bahwa pasien DD dapat diklasifikasikan ke dalam 3 kriteria yaitu, probable dengue, warning sign dan severe dengue :
5.1.1 Dengue tanpa tanda bahaya
Merupakan kemungkinan infeksi Virus Dengue pada pasien yang bertempat tinggal atau memiliki riwayat perjalanan ke daerah endemik. Pasien tersebut demam dan memiliki dua atau lebih dari gejala dan tanda berikut :
A. Mual, muntah B. Ruam
C. Tes tourniquet positif D. Nyeri kepala
E. Mialgia
5.1.2 Dengue dengan tanda bahaya
Merupakan infeksi Virus Dengue yang membutuhkan observasi ketat. Kriteria pada derajat ini adalah berdasarkan tanda dan gejala pada derajat 1 disertai adanya tanda bahaya, yaitu :
A. Nyeri perut B. Muntah persisten C. Perdarahan mukosa D. Letargi
E. Kegelisahan
F. Hepatomegali >2 cm G. Asites
H. Efusi pleura
5.1.3 Dengue berat
Merupakan infeksi Virus Dengue yang membutuhkan observasi ketat dan merupakan kegawatdaruratan medik. Kriteria pada derajat ini adalah
berdasarkan tanda dan gejala pada derajat 1 dan 2 disertai adanya tanda dan gejala berupa :
- Syok (SSD)
- Penumpukan cairan dengan distress respirasi B. Perdarahan berat
C. Kerusakan organ yang berat, meliputi :
- Hepar : SGOT atau SGPT ≥ 1000
- SSP : Penurunan kesadaran
- Jantung dan organ yang lainnya
2.10 Pemeriksaan Laboratorium
Beberapa parameter pemeriksaan laboratorium sederhana bagi pasien DD adalah : 1. Leukosit : dapat normal atau menurun. Mulai hari ke 3 dapat ditemui
limfositosis relative (>45% dari total leukosit) disertai adanya limfosit plasma biru (LPB) >15% dari total leukosit yang pada fase syok akan meningkat 2. Trombosit : Umumnya terdapat trombositopenia ( <100.000/mm3) pada hari
ke 3-8
3. Hematokrit : kebocoran Plasma dibuktikan dengan ditemukannya peningkatan hematokrit > 20% dari hematokrit awal, umumnya dimulai pada hari ke-3 demam
Respon antibodi terhadap infeksi berbeda sesuai dengan status kekebalan dari penderita. Ketika infeksi dengue terjadi pada orang yang sebelumnya belum pernah terinfeksi sebuah flavivirus atau diimunisasi dengan vaksin flavivirus (misalnya untuk demam kuning, Japanesse encephalitis), pasien menghasilkan respon antibodi primer yang ditandai dengan peningkatan antibodi spesifik secara perlahan. (WHO 2009).
Antibodi IgM adalah imunoglobulin yang pertama muncul. Antibodi ini terdeteksi pada 50% pasien selama hari ke 3-5 setelah onset penyakit, meningkat menjadi 80% pada hari ke-5 dan 99% pada hari ke 10. Tingkat IgM mencapai puncaknya sekitar dua minggu setelah timbulnya gejala dan kemudian menurun umumnya ke tingkat tidak terdeteksi selama 2-3 bulan. Serum anti dengue IgG umumnya terdeteksi pada titer rendah pada akhir minggu pertama penyakit, meningkat perlahan-lahan setelahnya, dengan serum IgG masih terdeteksi setelah beberapa bulan, dan mungkin bahkan seumur hidup (Guzman, 2004).
Selama infeksi dengue sekunder (infeksi dengue pada host yang sebelumnya telah terinfeksi oleh Virus Dengue, atau kadang-kadang setelah vaksinasi flavivirus non-dengue atau infeksi), titer antibodi meningkat pesat dan bereaksi secara luas terhadap banyak flavivirus. IgG adalah immunoglobulin yang dominan terdeteksi pada tingkat tinggi, bahkan di fase akut, dan menetap selama periode yang berlangsung dari 10 bulan sampai seumur hidup. Tingkat IgM lebih rendah pada infeksi sekunder dibandingkan yang primary dan mungkin tidak terdeteksi dalam beberapa kasus. Untuk membedakan Infeksi dengue primer dan sekunder, rasio antibodi IgM / IgG sekarang lebih sering digunakan dibandingkan dengan tes haemagglutination-inhibition (HI) (WHO, 2009).
Antibody IgM dengue umumnya diperiksa dengan menggunakan IgM Antobody-Captured Enzyme-Linked Immunosorbent Assay (MAC – ELISA) sementara IgG
diperiksa dengan IgG ELISA test. Sementara itu NS1 diperiksa dengan NS1 Kit (Malavige, G.N., 2004). Sementara di Indonesia menurut Depkes RI (2011), digunakan Rapid Diagnosis Test (RDT) untuk mendeteksi NS1, IgG dan IgM sebagai uji diagnostik.
Gambar 2.11 Hubungan terbalik antara accessibility dengan confidence uji laboratorium DD (WHO, 2009)
Hasil Analisia Pok et al (2010) menunjukkan bahwa RT-PCR adalah metode diagnostic paling sensitive dan paling specific (100%) dalam 3 hari pertama demam. Sementara sensitifitas rata-rata dari pemeriksaan antigen NS1 dengue dalam periode yang sama adalah 81,7%, yang menunjukkan bahwa pemeriksaan ini cukup potensial sebagai pemeriksaan yang cukup terpercaya dan lebih hemat sebagai metode diagnosis alternative deman dengue dari RT-PCR di pusat kesehatan primer. Namun rendahnya sensitifitas dalam mendiagnosa infeksi DBD sekunder menjadi salah satu kelemahan pemeriksaan uji antigen NS1 dengue.
Tabel 2.2 Sensitivitas dari 2 tes kit NS1 terhadap tiap jenis seotipe Virus Dengue, diambil pada hari ke 5 seletah munculnya tanda infeksi
Kit Tipe sampel No. (%) spesimen %Sensitivitas
(CI95)
Positif Negatif Equivocal
Panbio DENV – 1 44 (78.6) 11 (19.6) 1 (1.8) 66.2–87.3
DENV – 2 34 (75.6) 11 (24.4) 0 61.3–85.8
DENV – 3 37 (71.2) 11 (21.1) 4 (7.7) 57.7–81.7
DENV – 4 20 (36.4) 35 (63.6) 0 24.9–49.6
Total DENV 135 (64.9) 68 (33) 5 (2.4) 58.2–71.1
akut lainnya
Sumber Bessoff et al, 2008
Sementara menurut Hunsperger et al (2009), tingka sensitifitas dari pemeriksaan IgM tergantung dari alat yang kita gunakan. Pada perbandingan antara 9 buah MAC-ELISA kit yang dijual bebas didapati sensitivitasnya berkisar dari 21%-99% sementara spesitifitasnya 77%-98%. Ditemukan juga adanya False positif pada pasien malaria dan mantan pasien DBD.
Menurut Libraty et al 2002, tingkat sekresi nonstructural protein NS1 (sNS1)
bebas Virus Dengue dalam plasma berhubungan dengan tingkat viremia dan lebih tinggi pada pasien dengan DHF dibandingkan dengan DF. sNS1 yang meningkat (≥ 600 ng/mL) dalam 72 jam setelah onset penyakit mempunyai risiko yang tinggi untuk menjadi DHF.
Berikut ini adalah Rapid Diagnostic Test (RDT) yang digunakan di Indonesia (Depkes RI, 2010)
a. Rapid Test NS1
• Kit yang digunakan Dengue Dx NS1 Antigen Rapid Tes
• Setiap tes berisikan satu membrane strip, yang telah dilapisi dengan anti-dengue NS1 antigen capture pada daerah garis tes. Anti-dengue
memiliki dua garis hasil, garis ”T” (garis tes) dan ”C” (garis kontrol). Kedua garis ini tidak akan terlihat sebelum sampel ditambahkan. Garis kontrol C digunakan sebagai kontrol prosedur. Garis ini selalu muncul jika prosedur tes dilakukan dengan benar dan reagen dalam kondisi baik.
• Interpretasi Hasil Pengujian
Hasil Negatif: Jika hanya terbentuk garis pada area garis kontrol (C)
Hasil Positif: Jika terbentuk garis pada area garis (T) dan (C).
Hasil Invalid: jika tidak terbentuk garis pada area garis kontrol (C).
Untuk hasil Invalid dilakukan tes ulang.
b. Rapid Tes IgG/IgM
• Kit yang digunakan adalah Dengue Dx IgG/IgM Rapid Tes
• Dengue Dx IgG/IgM tes memiliki tiga garis pre-coated pada permukaan membran. Garis tes dengue IgG (G), garis tes dengue IgM (M), dan garis kontrol (C). Ketiga garis ini terletak dibagian jendela hasil dan tidak akan terlihat sebelum sebelum dilakukan penambahan sampel. Garis kontrol C digunakan sebagai kontrol prosedur. Garis ini selalu muncul jika prosedur tes dilakukan dengan benar dan reagen dalam kondisi baik. Garis “G” dan “M” akan terlihat pada jendela hasil jika terdapat antobodi IgG dan IgM terhadap virus dengue dalam sampel. Jika tidak terdapat antibodi, maka tidak akan terbentuk garis “G” atau “M”
• Interpretasi hasil lab
Negatif
IgM Positip
Terlihat garis kontrol “C” dan garis IgM (“M”) pada tes. Positip antibodi IgM terhadap virus dengue. Mengindikasikan infeksi dengue primer
IgG Positip
Terlihat garis Kontrol “C” dan garis IgG (“G”) pada tes. Positip antibodi IgG terhadap virus dengue. Mengindikasikan infeksi dengue sekunder ataupun infeksi dengue masa lalu
IgG dan IgM Positip
Terlihat garis Kontrol “C”, garis IgG (“G”), dan garis IgM (“M”) pada tes. Positip pada kedua antibodi IgG dan IgM terhadap virus dengue. Mengindikasikan infeksi dengue primer akhir atau awal infeksi dengue sekunder
Invalid
Tidak terlihat garis Kontrol “C” pada tes. Jumlah sampel yang tidak sesuai, atau prosedur kerja yang kurang tepat dapat mengakibatkan hasil seperti ini. Ulangi pengujian dengan menggunakan tes yang baru.
Tabel 2.3 Perbandingan beberapa jenis uji laboratorium DBD
Metode Waktu
keluar hasil
Spesimen Date of ill Fasilitas dibutuhkan Cost
Isolasi virus
1-5 hari Fasilitas kultur sel atau
nyamuk, Lab
BSL-2/BSL-1-5 hari Lab BSL-2, peralatan
untuk biologi molekular
Deteksi
antigen
≥ 1 hari Serum, jaringan
untuk
immuno-chemistry
1-6hari Fasilitas ELISA, Fasilitas
histologi
$$$
IgM ELISA 1-2 hari Serum, plasma,
whole blood
Setelah 5
hari
Fasilitas ELISA
$
IgM rapid test 30 menit Tidak perlu alat tambahan
IgG ELISA,
HI atau
neutralization
test
7 hari/lebih Serum, plasma,
whole blood
Fasilitas ELISA, Lab
BSL-2 untuk pemeriksaan
neutralization
$