commit to user
SINTESIS DAN KARAKTERISASI KOMPLEKS
KROM(III) DAN MANGAN(II) DENGAN 8-HIDROKSIKUINOLIN
Disusun oleh PITOYO BAYU AJI
M0304057
SKRIPSI
Ditulis dan diajukan untuk memenuhi
sebagian persyaratan mendapatkan gelar Sarjana Sains Kimia
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SEBELAS MARET
SURAKARTA 2009
HALAMAN PENGESAHAN
Skripsi ini dibimbing oleh : Pembimbing I
Prof. Drs. Sentot Budi Rahardjo, Ph.D NIP 19560507 198601 1 001
Pembimbing II
Saptono Hadi, M.Si, Apt NIP 19760403 200501 1 001 Dipertahankan di depan TIM Penguji Skripsi pada :
Hari : Senin
Tanggal : 3 Agustus 2009 Anggota TIM Penguji :
1. Sri Hastuti, M.Si.
NIP. 19710408 199702 2 001 2. Yuniawan Hidayat, M.Si NIP. 19790605 200501 1 003
1. ……… 2. ………
Disahkan oleh
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta
Ketua Jurusan Kimia,
Prof. Drs. Sentot Budi Rahardjo, Ph.D NIP 19560507 198601 1 001
commit to user
iii
iii
PERNYATAAN
Dengan ini saya menyatakan bahwa dalam skripsi saya yang berjudul “SINTESIS DAN KARAKTERISASI KOMPLEKS KROM(III) DAN MANGAN(II) DENGAN 8-HIDROKSIKUINOLIN” adalah benar – benar hasil penelitian sendiri dan tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi, dan sepanjang pengetahuan saya juga tidak terdapat kerja atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Ponorogo, Juli 2009 PITOYO BAYU AJI
ABSTRAK
Pitoyo Bayu Aji, 2009. SINTESIS DAN KARAKTERISASI KOMPLEKS KROM(III) DAN MANGAN(II) DENGAN 8-HIDROKSIKUINOLIN. Skripsi. Jurusan Kimia. Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret.
Penelitian ini bertujuan untuk mengetahui cara sintesis, formula dan karakteristik kompleks 8-hidroksikuinolin dengan Cr(III) dan Mn(II). Kompleks 8-hidroksikuinolin dengan Cr(III) dan Mn(II) telah disintesis dalam metanol dengan perbandingan mol Cr(III) dan mol ligan 1 : 3 dan perbandingan mol Mn(II) dan ligan 1 : 2.
Terbentuknya kompleks ditandai oleh adanya pergeseran panjang gelombang maksimum spektra elektronik kompleks. Formula kompleks diperkirakan dari analisis kadar logam pada tiap-tiap kompleks dengan spektroskopi serapan Atom (SSA). Formula kompleks yaitu Cr(8-hidroksikuinolin)3(H2O)n (n = 3, 4, 5) dan Mn(8-hidroksikuinolin)2(Cl)2(H2O)4. Perbandingan besar muatan kation : anion diukur dengan konduktivitimeter. Pengukuran untuk Mn(II)-(8-hidroksikuinolin) menunjukkan perbandingan besar muatan kation : anion 2 : 1, hal ini berarti bahwa Cl- tidak terkoordinasi pada Mn(II), sedangkan Cr(III)-(8-hidroksikuinolin) bersifat non elektrolit, hal menunjukkan bahwa 8-hidroksikuinolin terkoordinasi pada Cr(III) sebagai anion. Analisis termal mengindikasikan bahwa kedua kompleks mengandung beberapa hidrat, kemunginan formula kompleks adalah Cr(8-hidroksikuinolin)3](H2O)3 dan [Mn(8-hidroksikuinolin)2](Cl)2(H2O)4. Analisis spektra IR kompleks menunjukkan adanya pergeseran serapan gugus C=N dan C-O yang mengindikasikan kedua gugus terkoordinasi pada ion pusat. Pengukuran momen magnet menunjukkan bahwa kompleks bersifat paramagnetik dengan µeff Cr(III)-(8-hidroksikuinolin) 3,77±0,03 BM dan µeff Mn(II)-(8-hidroksikuinolin) 5,33±0,07 BM. Spektra UV-Vis kompleks menunjukkan transisi intra ligan n→π* dan π→π*. Koordinasi ligan 8-hidroskikuinolin pada ion pusat Cr(III) diperkirakan oktahedral, sementara koordinasi 8-hidroskikuinolin pada ion puat Mn(II) diperkirakan tetrahedral.
Kata kunci : Sintesis, Karakterisasi, Kompleks Cr(III) dan Mn(II), 8-hidroksikuinolin
commit to user
v
v
ABSTRACT
Pitoyo Bayu Aji, 2009. SYNTHESIS AND CHARACTERIZATION OF
COMPLEXES OF CHROMIUM(II) AND MANGANESE(II) WITH 8-HIDROXIQUINOLINE. Thesis. Department of Chemistry. Mathematics and
Natural Sciences Faculty. Sebelas Maret University.
The purpose of this research is to find out the synthesis, formula, and characteristic of complexes of 8-hidroxiquinoline with Cr(III) and Mn(II). Complexes of 8-hidroxiquinoline with Cr(III) and Mn(II) have been synthesized in methanol, with 1 : 3 mole ratio of Cr(III) to ligan and 1 : 2 mole ratio of Mn(II) to ligan.
The forming of complexes were indicated by maximum absorption shiff of electronic spectra. The formula of complexes were predicted from analysis of % metal in each complexes by Atomic Absorbtion Spectroscopy (AAS). The formula complexes are Cr(8-hidroxiquinoline)3(H2O)n (n = 3, 4, 5) and Mn(8-hidroxiquinoline)2(Cl)2(H2O)4. The charge size ratio of cation and anion of complexes were measured by conductivitymeter. The measurement for Mn(II)-(8-hidroksikuinolin) shows that the charge size ratio of cation and anion 2 : 1, it means that Cl- do not coordinate to the Mn(II), while Cr(III)-(8-hidroxiquinoline) is non electrolyte, it corresponds that 8-hidroxiquinoline coordinate to the Cr(III) as an anionic form. The thermal analysis indicates that both of complexes contain some hydrate. Thus formula possibility of complexes are [Cr(8-hidroxiquinoline)3](H2O)3 and [Mn(8-hidroxiquinoline)2](Cl)2(H2O)4. Analysis of IR spectra of the complexes shows a shiff of C=N and C-O group and indicates those groups are coordinated to the center ion. Magnetic suscepbility measurement shows that the complexes are paramagnetic with µeff of Cr(III)-(8-hidroxiquinoline) 3,77±0,03 BM and µeff of Mn(II)-(8-hidroxiquinoline) 5,33±0,07 BM. The UV-Vis spectra of complexes shows intra ligan n→π* and π→π* transitions. The ligand of 8-hidroxiquinoline coordinated to Cr(III) center ion is predicted as octahedral, while 8-hidroxiquinoline coordinated to Mn(II) center ion is predicted as tetrahedral.
Key words : Synthesis, Characterization, Complexes Cr(III) and Mn(II), 8-hidroxiquinoline
MOTTO
DENGAN ILMU HIDUP MENJADI MUDAH, DENGAN SENI HIDUP MENJADI INDAH
commit to user
vii
vii
PERSEMBAHAN
Karya besar ini penulis persembahkan untuk: Ibunda dan Ayahanda Adik dan Kakak tersayang Pembimbing tugas akir Pembimbing akademis Saudara seperjuangan Tuhan YME
KATA PENGANTAR
Teriring syukur kepada Allah atas segala limpahan nikmat dan petunjuk, sehingga penulis dapat menyelesaikan penulisan skripsi “SINTESIS DAN KARAKTERISASI KOMPLEKS KROM(III) DAN MANGAN(II) DENGAN 8-HIDROKSIKUINOLIN”. Sholawat dan salam penulis haturkan kepada Rasulullah SAW, tauladan umat manusia.
Skripsi ini tidak akan selesai tanpa adanya bantuan dari banyak pihak. Oleh karena itu penulis ingin mengucapkan terima kasih kepada :
1. Prof. Drs. Sutarno, MSc, PhD selaku Dekan FMIPA UNS.
2. Drs. Sentot Budi Rahardjo,PhD selaku Ketua Jurusan Kimia dan Pembimbing I.
3. Saptono Hadi, M.Si. Apt.selaku pembimbing II
4. Bapak dan Ibu Dosen Jurusan Kimia, FMIPA UNS atas semua ilmu yang berguna dalam penyusunan skripsi ini.
5. Dr.rer.nat. Fajar Rakhman Wibowo, M.Si selaku Ketua Sub Laboratorium Kimia Lab. Pusat FMIPA UNS dan semua stafnya. 6. IF. Nur Cahyo, M.Si selaku Ketua Laboratorium Kimia Dasar
FMIPA UNS beserta stafnya : Mbak Nanik dan Mas Anang.
7. Soerya Dewi Marliyana, M.Si. atas saran dan motivasinya selaku Pembimbing Akademis
8. Rekan – rekan TA anorganik ”NALAR” (Nurhalimah, Antok, Lanjar, Anggun, Rus Maysharoh) atas semangat kebersamaanya.
9. Rekan – rekan terbaik di area 17+ Dormintory ”HAMBEGS” ( Hendro, Aris, Mbeki, Gigih, Saiful huda) atas dukungannya.
10. Rekan – rekan angkatan ’04, ’05, ’06, ’07, ’08. 11. Rekan TA organik ”Icha”
12. Pihak – pihak yang tidak dapat penulis sebutkan satu persatu.
Semoga Allah berkenan memberikan balasan yang lebih baik atas pengorbanan yang diberikan.
Penulis menyadari bahwa banyak kekurangan dalam penulisan skripsi ini. Oleh karena itu, kritik dan saran yang membangun akan sangat membantu penulis
commit to user
ix
ix
dalam memperbaikinya. Semoga karya kecil ini dapat memberikan manfaat bagi perkembangan ilmu pengetahuan dan kita semua.
Surakarta, Juli 2009 Pitoyo Bayu Aji
DAFTAR ISI Halaman HALAMAN JUDUL ... i HALAMAN PENGESAHAN ... ii PERYATAAN ... iii ABSTRAK ... iv ABSTRACT ... v HALAMAN MOTTO ... vi
HALAMAN PERSEMBAHAN ... vii
KATA PENGANTAR ... viii
DAFTAR ISI ... x
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xviii
BAB I PENDAHULUAN ... 1
A. Latar Belakang Masalah ... 1
B. Perumusan Masalah ... 5 1. Identifikasi Masalah ... 5 2. Batasan Masalah ... 5 3. Rumusan Masalah ... 6 C. Tujuan Penelitian ... 6 D. Manfaat Penelitian ... 6
BAB II LANDASAN TEORI ... 7
A. Tinjauan Pustaka ... 7
1. Sintesis Senyawa Kompleks ... 7
2. Kompleks Cr(III) dan Mn(II) ... 7
3. Teori Pembentukan Kompleks ... 10
a. Teori Ikatan Valensi ... 10
b. Teori Medan Ligan ... 12
1). Kompleks Oktahedral ... 12
commit to user
xi
xi
c. Teori Orbital Molekul ... 14
4. Spektroskopi UV-Vis ... 17
5. Sifat magnetik ... 20
6. Analisis Termal ... 22
7. Spektroskopi Infra Merah ... 24
8. Daya hantar Listrik ... 26
9. senyawa 8-hidroksikuinolin ... 27
B. Kerangka Pemikiran ... 28
C. Hipotesis ... 30
BAB III METODOLOGI PENELITIAN ... 31
A. Metode Penelitian ... 31
B. Waktu dan Tempat ... 31
C. Alat dan Bahan ... 31
1. Alat ... 31
2. Bahan-bahan ... 32
D. Prosedur Penelitian ... 32
1. Sintesis Senyawa Kompleks ... 32
a. Sintesis kompleks Mn(II)-(8-hidroksikuinolin) 32
b. Sintesis Kompleks Mn(II)-(8-hidroksikuinolin) 32 2. Pengukuran Logam dalam Kompleks ... 32
3. Pengukuran Momen Magnet ... 33
4. Pengukuran Spektra elektronik ... 33
5. Pengukuran Daya Hantar Listrik ... 33
6. Pengukuran Spektra Infra Merah ... 34
7. Analisis TG/DTA ... 34
E. Teknik Pengumpulan dan Analisis Data ... 34
BAB IV HASIL DAN PEMBAHASAN ... 35
A. Sintesis Kompleks ... 35
1. Sintesis Kompleks Cr(III) dengan 8-hidroksikuinolin 35 2. Sintesis Kompleks Mn(II) dengan 8-hidroksikuinolin 36 B. Penentuan Formula Kompleks ... 37
1. Penentuan kadar Logam dalam Kompleks ... 37
a. Pengukuran Kadar krom dalam Kompleks .... 37
b. Pengukuran Kadar mangan dalam Kompleks 38
2. Pengukuran Daya Hantar Listrik ... 38
3. Analisis Termal TG/DTA ... 39
4. Spektra infra Merah ... 41
a. Kompleks Cr(III)-(8-hidroksikuinolin) ... 41 b. Kompleks Mn(II)-(8-hidroksikuinolin) ... 43 5. Spektra Elektronik ... 45 a. Kompleks Cr(III)-(8-hidroksikuinolin) ... 45 b. Kompleks Mn(II)-(8-hidroksikuinolin) ... 46 6. Sifat Kemagnetan ... 46 a. Kompleks Cr(III)-(8-hidroksikuinolin) ... 46 b. Kompleks Mn(II)-(8-hidroksikuinolin) ... 47
C. Perkiraan struktur Kompleks ... 47
1. Perkiiraan Struktur Cr(III)-(8-hidroksikuinolin) ... 47
2. Perkiraan Struktur Mn(II)-(8-hidroksikuinolin) ... 48
BAB V PENUTUP ... 49
A. Kesimpulan ... 49
B. Saran ... 50
DAFTAR PUSTAKA ... 51
commit to user
xiii
xiii
DAFTAR TABEL
Halaman Tabel 1. Bentuk Hibridisasi Dan Konfigurasi Geometri ... 12
Tabel 2. Sebagian faktor koreksi diamagnetik untul ion dan molekul 21 Tabel 3. Kadar krom dalam kompleks secara teoritis ... 37 Tabel 4. Kadar mangan dalam kompleks secara teoritis ... 38 Tabel 5. Daya Hantar Listrik Larutan Standar 10-3 M dan Larutan
Sampel Kompleks 10-3 M dalam DMSO ... 38 Tabel 6. Serapan Gugus Fungsi Ligan 8-hidrosksikuinolin dan
Senyawa Kompleks Cr(III)-(8-hidroksikuinolin) ... 41 Tabel 7. Serapan Gugus Fungsi Ligan 8-hidrosksikuinolin dan
Senyawa Kompleks Mn(II)-(8-hidroksikuinolin) ... 43 Tabel 8. Panjang Gelombang (λ maks), Absorbansi dan
Absorbtivitas Molar (ε) Cr(III)-(8-hidroksikuinolin) dan Ligan 8-hidroksikuinolin dalam Metanol ... 45 Tabel 9. Panjang Gelombang (λ maks), Absorbansi dan
Absorbtivitas Molar (ε) Mn(II)-(8-hidroksikuinolin) dan ligan 8-hidroksikuinolin dalam metanol ... 46 Tabel 10. Data dan Hasil Perhitungan Kdar Krom dengan SSA dalam
Kompleks Cr(III)-(8-hidroksikuinolin) ... 60 Tabel 11. Data dan Hasil Perhitungan Kdar Krom dengan SSA dalam
Kompleks Mn(II)-(8-hidroksikuinolin) ... 62 Tabel 12. Data Daya Hantar Larutan Standar dan Sampel Kompleks
Cr(III)-(8-hidroksikuinolin) (dalam DMSO dengan konsentrasi 10-3 M) ... 63 Tabel 13. Data Daya Hantar Larutan Standar dan Sampel Kompleks
Mn(II)-(8-hidroksikuinolin) (dalam DMSO dengan konsentrasi 10-3 M) ... 63 Tabel 14. Hasil Pengukuran Kerentanan Magnetik ... 65
Tabel 15. Harga µeff pada Beberapa Harga Xg dari Sampel Kompleks Cr(III)-(8-hidroksikuinolin) dan Mn(II)-(8-hidroksikuinolin) ... 67
Tabel 16. Serapan Gugus Fungsi Ligan 8-hidroksikuinolin,
Kompleks Cr(III)-(8-hidroksikuinolin) dan Mn(II)-(8-hidroksikuinolin) ... 71
Tabel 17. Kondisi Pengukuran Sampel Kompleks
Cr(III)-(8-hidroksikuinolin) dengan TG/DTA ... 72
Tabel 18. Kondisi Pengukuran Sampel Kompleks
Mn(II)-(8-hidroksikuinolin) dengan TG/DTA ... 73
Tabel 19. Hasil TG Kompleks Cr(III)-(8-hidroksikuinolin) dan Mn(II)-(8-hidroksikuinolin) ... 74
Tabel 20. Hasil DTA Kompleks Cr(III)-(8-hidroksikuinolin) dan Mn(II)-(8-hidroksikuinolin) ... 74
Tabel 21. Analisa TG Kompleks Cr(III)-(8-hidroksikuinolin) dan Mn(II)-(8-hidroksikuinolin) ... 75
commit to user
xv
xv
DAFTAR GAMBAR
Halaman Gambar 1. Struktur 8-hidroksikuinolin ... 2
Gambar 2. Koordinasi bpmp pada Co(II) yang membentuk
kompleks Co2(bpmp)(CH3COO)3.3H2O dengan
melibatkan atom donor N cincin siklik ... 3
Gambar 3. Koordinasi PDC pada Ni(II) yang membentuk
kompleks {[Ni(PDC)(dpa)(H2O)].2H2O} dengan
melibatkan atom donor N cincin siklik ... 3 Gambar 4. Koordinasi L pada Cu(II) yang membentuk kompleks
CuL2 (L adalah
3-[(2-Hydroxy-quinolin-3-ylmethylene)-amino]-2-phenyl-3H-quinazolin-4-one) ... 4
Gambar 5. Kemungkinan Ikatan antara Cr(III) dengan 8-hidroksikuinolin ... 5 Gambar 6. Kemungkinan Ikatan antara Mn(II) dengan
8-hidroksikuinolin ... 5
Gambar 7. Struktur senyawa kompleks Cr(III) dengan ligan
makrosiklik
1,5-diaza-8,12-dioxa-6,7:13,14-dibenzocyclo tetradodecane yang bergeometri
oktahedral ... 8 Gambar 8. Struktur kompleks oktahedral Mn(II) dengan
[N’-(2-methoxybenzoyl) hydrazinecarbodithioate]ethyl ester ... 9 Gambar 9. Struktur
{Mn(N,N-bis[4-(benzeneazo)salicylaldehyde]-o-phenylenediamine}dengan geometri square ... 10
Gambar 10. Ilustrasi Pembentukan kompleks CrL(CNS)3 (L=1,5-diaza-8,12-dioxa-6,7:13,14-dibenzocyclo
tetradodecane) yang bergeometri oktahedral ... 11 Gambar 11. Ilustrasi Pembentukan kompleks MnL2 (L=
[N’-(2-methoxybenzoyl)hydrazinecarbodithioate] ethyl ester
yang bergeometri oktahedral ... 11 Gambar 12. Kontur orbital d ... 12
Gambar 13. Arah sumbu x,y, dan z dalam medan oktahedral ... 13
Gambar 14. Diagram tingkat energi orbital d pada medan oktahedral 13 Gambar 15. Hubungan tetrahedral dengan kubus ... 14
Gambar 16. Diagram energi orbital d pada medan tetrahedral ... 14
Gambar 17. Diagram tingkat energi kompleks oktahedral ... 15
Gambar 18. Diagram tingkat energi kompleks tetrahedral ... 16
Gambar 19. Tingkat energi elektron molekul ... 17
Gambar 20. Spektrum [Mn(HO)6]2+ ( ) dengan skala absorbansi di bagian kiri dan spektrum [Mn(Br)4]2- (---) dengan skala absorbansi di bagian kanan ... 18
Gambar 21. Diagram tingkat energi ion Mn(II) d5 pada medan oktahedral ... 19
Gambar 22. Diagram tingkat energi ion d3 pada medan oktahedral ... 20
Gambar 23. Termogram (TG) dekomposisi Co(C8H10N4)(NO3)2 di udara ... 23
Gambar 24. Termogram (DTA) dekomposisi Co(C8H10N4)(NO3)2 di udara ... 24
Gambar 25. Vibrasi rentangan : (a) Rentangan simetri, (b) rentangan asimetri. Vibrasi bengkokan : (c) Guntingan, (d) Goyangan, (e) Kibasan dan (f) Pelintiran ... 25
Gambar 26. Struktur 8-hidroksikuinolin dan dua gugus donor elektron yaitu (1) gugus O-H dan (2) gugus C=N ... 28
Gambar 27. Kompleks [Ag-(8-quinolinol)(8-quinolate)]. ... 29
Gambar 28. Kemungkinan ikatan kovalen koordinasi antara 8-hidroksikuinolin dengan atom pusat Cr(III) dan Mn(II) ... 29
Gambar 29. Spektra Elektronik (a) senyawa 8-hidroksikuinolin dalam metanol (b) senyawa Cr(III)-(8-hidroksikuinolin) dalam metanol ... 35
Gambar 30. Spektra elektronik senyawa MnCl2.4H2O dalam metanol ... 36
commit to user
xvii
xvii
Gambar 31. Spektra Elektronik (a) kompleks
Mn(II)-(8-hidroksikuinolin) dalam metanol (b)
8-hidroksikuinolin dalam metanol ... 37
Gambar 32. Termogram TG/DTA Cr(III)-(8-hidroksikuinolin) ... 39
Gambar 33. Termogram TG/DTA Mn(II)-(8-hidroksikuinolin)... 40
Gambar 34. Serapan gugus fungsi O-H (warna merah), gugus fungsi C=N (warna biru), gugus fungsi C-O (warna hijau) pada (a) 8-hidroksikuinolin dan (b) kompleks Cr(III)-(8-hidroksikuinolin) ... 42
Gambar 35. Serapan gugus fungsi O-H (warna merah), gugus fungsi C=N (warna biru), gugus fungsi C-O (warna hijau) pada (a) 8-hidroksikuinolin dan (b) kompleks Mn(II)-(8-hidroksikuinolin) ... 44
Gambar 36. Perkiraan Struktur [Cr(8-hidroksikuinolin)3](H2O)3 ... 48
Gambar 37. Perkiraan Struktur [Mn(8-hidroksikuinolin)2](Cl)2 (H2O)4 ... 48
Gambar 38. Diagram Sintesis dan Karakterisasi senyawa Kompleks Cr(III)-(8-hidroksikuinolin) ... 55
Gambar 39. Diagram Sintesis dan Karakterisasi senyawa Kompleks Mn(II)-(8-hidroksikuinolin) ... 56
Gambar 40. Kurva Standar Cr(III) pada konsentrasi 0 – 11 ppm ... 59
Gambar 41. Kurva Standar Mn(II) pada konsentrasi 1-5 ppm ... 60
Gambar 42. Spektra Infra Merah 8-hidroksikuinolin... 70
Gambar 43. Spektra Infra Merah Cr(III)-(8-hidroksikuinolin) ... 70
Gambar 44. Spektra Infra Merah Mn(II)-(8-hidroksikuinolin) ... 71
Gambar 45. Termogram TG/DTA Cr(III)-(8-hidroksikuinolin) ... 72
DAFTAR LAMPIRAN
Halaman Lampiran 1. Diagram Alir Percobaan ... 55
Lampiran 2. Perhitungan rendemen Hasil Sintesis ... 57
Lampiran 3. Pengukuran Kadar Krom dalam Kompleks
Menggunakan SSA ... 59
Lampiran 4. Pengukuran Kadar Mangan dalam Kompleks
Menggunakan SSA ... 61 Lampiran 5. Pengukuran Daya Hantar Listrik Kompleks
Cr(III)-(8-hidroksikuinolin) dengan konduktivitimeter . 63 Lampiran 6. Perhitungan Momen Magnet efektif ... 65 Lampiran 7. Perhitungan Nilai absorbtivitas Molar ... 68 Lampiran 8. Spektra Infra Merah Ligan 8-hidroksikuinolin dan
Kompleks ... 70 Lampiran 9. Hasil TG/DTA Logam dan Kompleks ... 72
commit to user
BAB I PENDAHULUANA. Latar Belakang Masalah
Senyawa kompleks memiliki peranan penting dalam kehidupan sehari-hari karena dapat diaplikasikan pada berbagai bidang seperti bidang farmasi, kesehatan, industri, dan lingkungan.
Salah satu kompleks yang telah banyak diaplikasikan adalah kompleks
logam dengan ligan 8-hidroksikuinolin. Kompleks yang terbentuk antara 8-hidroksikuinolin dengan Fe(III) diaplikasikan untuk ekstraksi ion Fe(III) secara
sinergis dengan TOPO (trioktil pospin oksida) menggunakan metode Batch (Wijayanti, 2004).
Diperkirakan struktur kompleks Fe(III)-(8-hidroksikuinolin) adalah oktahedral (Sugiharto, 2006). Kompleks ini juga dapat diaplikasikan sebagai anti bakteri karena terbentuknya senyawa kelat tidak jenuh (2:1) dan (1:1) (Siswandono dan Soekardjo, 1995). Pembentukan kompleks Pb(II)-(8-hidroksikuinolin) diaplikasikan untuk penentuan logam Pb(II) dengan metode voltametri menggunakan elektroda pasta karbon terlapisi pirol yang termodifikasi
8-hidroksikuinolin (Danawati, 2008). Namun demikian struktur kompleks 8-hidroksikuinolin belum banyak dilaporkan, demikian pula pada kompleks antara
8-hidroksikuinolin dengan Cr(III) dan Mn(II).
Krom mempunyai hubungan erat dengan masalah lingkungan, terutama masalah pencemaran logam. Percobaan laboratorium menunjukkan bahwa Cr(II) dapat mengendapkan RNA dan DNA pada pH 7. Cemaran krom dalam tubuh dapat menyebabkan masalah kesehatan misalnya Cr(III) dapat bereaksi dengan protein secara lambat untuk membentuk suatu kompleks yang stabil (Palar, 1994). Mangan termasuk dalam logam berat essensial, dimana keberadaannya dalam jumlah tertentu sangat dibutuhkan oleh organisme hidup, namun dalam jumlah berlebihan dapat menimbulkan efek racun. Daya racun yang dimiliki akan bekerja sebagai penghalang kerja enzim, sehingga proses metabolisme tubuh terputus (www.terranet.or.id/tulisandetil). Mangan bertindak sebagai komponen dari enzim
yang terlibat dalam bermacam jalur metabolisme, termasuk sintesis DNA, metabolisme zat gula dan modifikasi protein (Jain et. al., 2002:1-2). Pada proses modifikasi protein logam mangan yang terdapat pada enzim Mn-arginase dapat menghidrolisis L-arginin menjadi L-ornitin dan urea (Moon et. al., 2008: 447– 452).
Kompleks Cr(III) dengan berbagai ligan dapat membentuk geometri datar, tetrahedral terdistorsi, trigonal bipiramid, oktahedral dan pentagonal bipiramid terdistorsi (Cotton, and Wilkinson, 1998:680-693). Seperti pada kompleks Cr(III) dengan ligan
1,7-diaza-10,14-dioxa-4-thia-8,9:15,16-dibenzocyclohexadeca-2,6-dione yang disintesis dengan menambahkan ligan ke dalam larutan etanol yang
mengandung garam hidrat Krom(III), kemudian direfluks pada suhu 75-850C, diperkirakan kompleks bergeometri oktahedral (Kumar, and Singh, 2006:77-87).
Kompleks [Cr(etdtc)Cl]2 (etdtc= ethylenediamine dithiocarbamato) yang
disintesis dengan mencampurkan antara asetilaseton dalam metanol dengan
etilendiamin dan karbon disulfida dengan CrCl3.6H2O dalam metanol,
diperkirakan bergeometri oktahedral terdistorsi (Saddiqi et. al.,2006:107-112). Kompleks Mn(II) dengan berbagai ligan juga dapat membentuk geometri tetrahedral, segiempat datar, trigonal bipiramid terdistorsi, trigonal bipiramid, oktahedral (Cotton, and Wilkinson, 1998:689). Pada kompleks [Mn2(etdtc)2] yang disintesis dengan mencampurkan antara asetilaseton dalam metanol dengan
etilendiamin dan karbon disulfida dengan MnCl2 2H2O dalam metanol,
diperkirakan bergeometri tetrahedral (Saddiqi et. al., 2006:107-112).
Pada 8-hidroksikuinolin (Gambar 1) mempunyai atom donor elektron lebih dari satu, yaitu O pada gugus OH dan N pada rantai sikliknya, yang dapat digunakan untuk berikatan secara kovalen koordinasi dengan ion logam krom dan mangan sehingga terbentuk senyawa kompleks.
commit to user
3
3
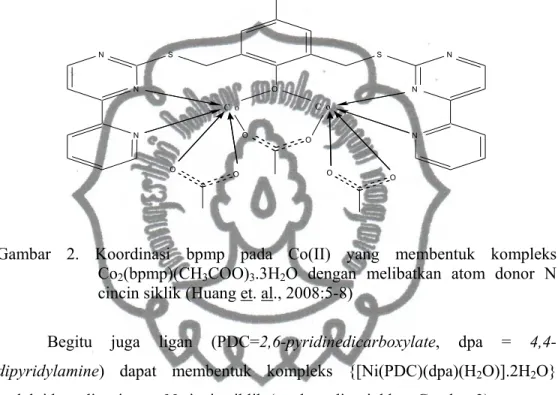
Donor elektron atom N dalam cincin siklis tidak selalu bisa terkoordinasi ke dalam atom pusat. Pada kompleks Co2(bpmp)(CH3COO)3.3H2O, ligan (bpmp=
2,6-bis((4-(pyridin-2-yl)pyrimidin-2-ylthio)methyl)-4-methylphenol) terkoordinasi
pada atom pusat melalui atom N pada cincin siklis (ditunjukkan Gambar 2).
O S N N N S N N N O O O O O O C o C o
Gambar 2. Koordinasi bpmp pada Co(II) yang membentuk kompleks Co2(bpmp)(CH3COO)3.3H2O dengan melibatkan atom donor N cincin siklik (Huang et. al., 2008:5-8)
Begitu juga ligan (PDC=2,6-pyridinedicarboxylate, dpa =
4,4-dipyridylamine) dapat membentuk kompleks {[Ni(PDC)(dpa)(H2O)].2H2O} melalui koordinasi atom N cincin siklik (struktur ditunjukkan Gambar 3).
Gambar 3. Koordinasi PDC pada Ni(II) yang membentuk kompleks {[Ni(PDC)(dpa)(H2O)].2H2O} dengan melibatkan atom donor N cincin siklik (Saylor et. al., 2008:317-326)
Sedangkan pada kompleks CuL2 (L=3-[(2-Hydroxy-quinolin-3-ylmethylene)-amino]-2-phenyl-3H-quinazolin-4-one), atom N cincin siklik tidak terlibat pada proses koordinasi (struktur ditunjukan Gambar 4).
N O N N O N O N N O C u ( I I )
Gambar 4. Koordinasi L pada Cu(II) yang membentuk kompleks CuL2 (dengan L adalah
3-[(2-Hydroxy-quinolin-3-ylmethylene)-amino]-2-phenyl-3H-quinazolin-4-one) (Siddappa et. al., 2008:155-162)
Ligan 8-hidroksikuinolin yang mempunyai atom donor N dalam cincin siklik dapat membentuk kompleks dengan Cr(III) dan Mn(II) dengan berbagai kemungkinan seperti ditunjukkan oleh Gambar 5 dan Gambar 6.
N O H C r ( I I I ) N O H C r ( I I I ) N O H C r(III)
commit to user
5 5 N O H M n ( I I ) N O H M n (II) N O H M n(II)Gambar 6. Kemungkinan ikatan antara Mn(II) dengan 8-hidroksikuinolin Oleh karena itu sintesis dan karakterisasi kompleks Cr(III) dan Mn(II) dengan ligan 8-hidroksikuinolin menarik untuk dipelajari.
B. Perumusan Masalah
1. Identifikasi Masalah
a. Sintesis kompleks dapat dilakukan dengan berbagai macam cara antara lain mencampurkan larutan logam dan ligan dengan pelarut seperti air, metanol, etanol, atau piridin tanpa pemanasan, disertai pemanasan, atau refluks. b. Penentuan formula kompleks dapat dilakukan berdasarkan analisis unsur C,
H, N, O, logam, atau diperkirakan dari hasil analisis logam saja.
c. Kedudukan anion dalam senyawa kompleks dapat bertindak sebagai ligan atau sisa asam.
d. Kompleks yang dihasilkan dapat mengandung H2O ataupun tidak.
e. Gugus yang terkoordinasi pada logam dapat ditentukan secara kristalografi sinar X atau diperkirakan dari data spektra IR.
f. Karakterisasi kompleks meliputi spektra (Ultra Violet-Visible, UV-Vis), spektra ( Infra Red, IR), sifat kemagnetan dan potensial redoks.
2. Batasan Masalah
a. Penentuan formula kompleks diperkirakan dari hasil penentuan kadar logam dalam masing-masing kompleks.
b. Gugus fungsi ligan yang terkoordinasi pada atom pusat diperkirakan dari spektra IR.
c. Karakterisasi kompleks yang dilakukan meliputi spektra UV-Vis, spektra IR dan sifat kemagnetan.
3. Rumusan Masalah
Masalah utama yang dikaji dalam penelitian ini adalah :
a. Bagaimana sintesis kompleks Cr(III) dengan ligan 8-hidroksikuinolin dan Mn(II) dengan ligan 8-hidroksikuinolin?
b. Bagaimana formula kompleks Cr(III)-(8-hidroksikuinolin) dan Mn(II)-(8-hidroksikuinolin)?
c. Bagaimana karakteristik kompleks Cr(III)-(8-hidroksikuinolin) dan Mn(II)-(8-hidroksikuinolin)?
d. Bagaimana perkiraan struktur kompleks Cr(III)-(8-hidroksikuinolin) dan Mn(II)-(8-hidroksikuinolin)?
C. Tujuan Penelitian
1. Mengetahui cara sintesis senyawa kompleks Cr(III) dan Mn(II) dengan ligan 8-hidroksikuinolin.
2. Mengetahui formula kompleks Cr(III)-(8-hidroksikuinolin) dan Mn(II)-(8-hidroksikuinolin).
3. Mengetahui karakteristik kompleks Cr(III)-(8-hidroksikuinolin) dan Mn(II)-(8-hidroksikuinolin).
4. Mengetahui struktur kompleks Cr(III)-(8-hidroksikuinolin) dan Mn(II)-(8-hidroksikuinolin).
D. Manfaat Penelitian
Memberikan informasi tentang pembentukan kompleks antara krom(III) dan mangan(II) dengan 8-hidroksikuinolin.
commit to user
BAB II LANDASAN TEORIA. Tinjauan Pustaka
1. Sintesis Senyawa Kompleks
Sintesis kompleks dapat dilakukan dengan menggunakan berbagai cara antara lain dengan pencampuran larutan pada berbagai perbandingan mol logam : mol ligan dalam berbagai pelarut tanpa pemanasan, pencampuran larutan disertai pemanasan pada berbagai temperatur.
Kompleks [Mn2(H3bida)2(H2O)2] (H3bida = N-(benzimidazol-2-ylmethyl
iminodiacetic acid) disintesis dengan cara menambahkan [Mn(CH3COO)2].4H2O ke dalam larutan H3bida dalam campuran metanol dan piridin (Moon et. al.,
2008:447-452). Kompleks [Mn(ptalat)].½H2O disintesis dengan cara
menambahkan garam Mn(CH3COO)2 kedalam etanol yang mengandung asam
ptalat (perbandingan 1:1) kemudian campuran direfluks selama 2 jam (Devereux
et. al., 2000:275-288). Sintesis lain dapat dilakukan dengan pemanasan campuran
MnCl2 dan L (L= salicylideneimine) dalam etanol dengan perbandingan 1:1, kemudian direfluks selama 4-5 jam untuk menghasilkan kompleks [MnL(H2O)n] (n = 0-2) (Belaid et. al., 2008:63-69). Sintesis kompleks Cr(C26N4H26)(NO3)3 dilakukan dalam dengan menambahkan C26N4H26 kedalam larutan etanol yang mengandung garam Cr(III), kemudian campuran direfluks selama beberapa jam pada suhu 75-85ºC (Kumar et. al., 2006:77-87).
2. Kompleks Cr(III) dan Mn(II)
Krom adalah salah satu unsur logam transisi golongan VIB yang berwarna putih, nomor atom 24 dengan massa atom 51,996 g/mol, mempunyai titik lebur 1765ºC, dapat larut dalam asam klorida encer atau pekat, asam sulfat encer dan asam nitrat (Vogel, 1979:285). Krom memiliki bilangan oksidasi yang paling stabil dan penting yaitu +2 dan +3. Dalam senyawa kompleks krom banyak terdapat sebagai Cr(III), membentuk kompleks dengan bilangan koordinasi 3,4,5 dan 6. Pada umumya kompleks Cr(III) memiliki bilangan koordinasi 6 dengan
geometri oktahedral (Cotton, and Wilkinson, 1998:679-681). Selain itu kompleks Cr(III) juga bisa mempunyai geometri nonoktahedral, misalnya pentagonal bipiramid terdistorsi (Cotton,. and Wilkinson, 1988:689).
Kompleks Cr(III) dengan ligan makrosiklik
1,5-diaza-8,12-dioxa-6,7:13,14-dibenzocyclo tetradodecane memiliki bilangan koordinasi 6 dengan
struktur oktahedral (Kumar et. al., 2006:77-87) seperti ditunjukkan Gambar 7.
HN NH O O Cr CNS CNS (CNS)
Gambar 7. Struktur senyawa kompleks Cr(III) dengan ligan makrosiklik
1,5-diaza-8,12-dioxa-6,7:13,14-dibenzocyclo tetradodecane yang
bergeometri oktahedral (Kumar et. al., 2006:77-87)
Pada kompleks tersebut terjadi pergeseran bilangan gelombang serapan infra merah gugus N-H (3285 cm-1 pada lingan menjadi 3200 cm-1 pada kompleksnya) dan serapan gugus Ph-O-CH2 juga mengalami pergeseran ke arah yang lebih kecil. Pergeseran tersebut mengindikasikan bahwa kedua gugus terkoordinasi pada Cr(III).
Mangan merupakan salah satu unsur logam transisi golongan VIIB, berwarna putih abu-abu, nomor atom 25 dengan massa atom 54,938 g/mol. Mempunyai titik lebur 1250ºC. Mangan dapat larut dalam asam mineral encer dan juga asam asetat dan dapat mempunyai bilangan oksidasi +2, +3, +4, +6 dan +7 (Vogel, 1979:285). Dalam senyawa kompleks mangan banyak terdapat sebagai Mn(II), membentuk kompleks dengan bilangan koordinasi 4, 5 serta memiliki semua jenis geometri utama yaitu tetrahedral, segiempat, trigonal bipiramid terdistorsi dan trigonal bipiramid. Pada umumnya kompleks Mn(II) memiliki
commit to user
9
9
bilangan koordinasi 6 dengan struktur oktahedral (Cotton, and Wilkinson, 1988:697-699). Mangan(II) yang membentuk kompleks dengan
[N’-(2-methoxybenzoyl)hydrazinecarbodithioate] ethyl ester memiliki bilangan
koordinasi 6 dengan geometri oktahedral (Singh et. al., 2009:107-112) seperti ditunjukkan Gambar 8.
Gambar 8. Struktur kompleks oktahedral Mn(II) dengan [N’-(2-methoxybenzoyl)
hydrazinecarbodithioate]ethyl ester (Singh et. al., 2009:107-112)
Pada kompleks tersebut Atom N, S, dan O dari ligan terkoordinasi pada ion pusat Mn(II) yang ditandai dari pergeseran serapan infra merah gugus N-N (1086 cm-1 pada ligan bebasnya menjadi 1101cm-1 pada kompleks) dan C=S (968 cm-1 pada ligan bebasnya menjadi 905 cm-1 pada kompleks) dan bergesernya serapan infra merah C=O (1645 cm-1 pada ligan bebasnya menjadi 1603 cm-1 pada kompleks).
N,N-bis[4-(benzeneazo)salicylaldehyde]-o-phenylenediamine membentuk
kompleks dengan Mn(II) mempunyai 4 bilangan koordinasi (Liu et. al., 2006:41-48) seperti ditunjukkan Gambar 9. Pada kompleks ini pergeseran serapan IR gugus C-O (1281 cm-1 pada ligan bebasnya menjadi 1260 cm-1 pada kompleks) mengindikasikan terkoordinasinya C-O pada atom pusat. Pergeseran serapan
gugus C=N (1605 cm-1 pada ligan bebasnya menjadi 1613 cm-1 pada kompleks) mengindikasikan terkoordinasinya gugus C=N pada atom pusat.
N N O
N N
O N
Mn
N
Gambar 9. Struktur kompleks
{Mn(N,N-bis[4-(benzeneazo)salicylaldehyde]-o-phenylenediamine}dengan geometri square (Liu et. al., 2006:41-48)
3. Teori Pembentukan Kompleks a. Teori Ikatan Valensi
Pada teori ikatan valensi yang dikembangkan oleh Pauling, senyawa kompleks mengandung ion kompleks, dengan ligan harus mempunyai pasangan elektron bebas yang terkoordinasi pada atom pusat yang mempunyai orbital kosong (Lee, 1994 :202).
Pada senyawa kompleks, Cr(III) dan Mn(II) dapat berperan sebagai atom pusat, sehingga Cr(III) dan Mn(II) harus menyediakan orbital kosong untuk ditempati pasangan elektron bebas dari ligan, contohnya pada pembentukan kompleks Cr(III) dengan 1,5-diaza-8,12-dioxa-6,7:13,14-dibenzocyclo
tetradodecane (Kumar, and Singh, 2006:77-87) dan pembentukan kompleks
Mn(II) dengan ligan [N’-(2-methoxybenzoyl)hydrazinecarbodithioate] ethyl ester (Singh et. al., 2009:107-112). Kompleks Cr(III) dengan
1,5-diaza-8,12-dioxa-6,7:13,14-dibenzocyclo tetradodecane yang bergeometri oktahedral dapat
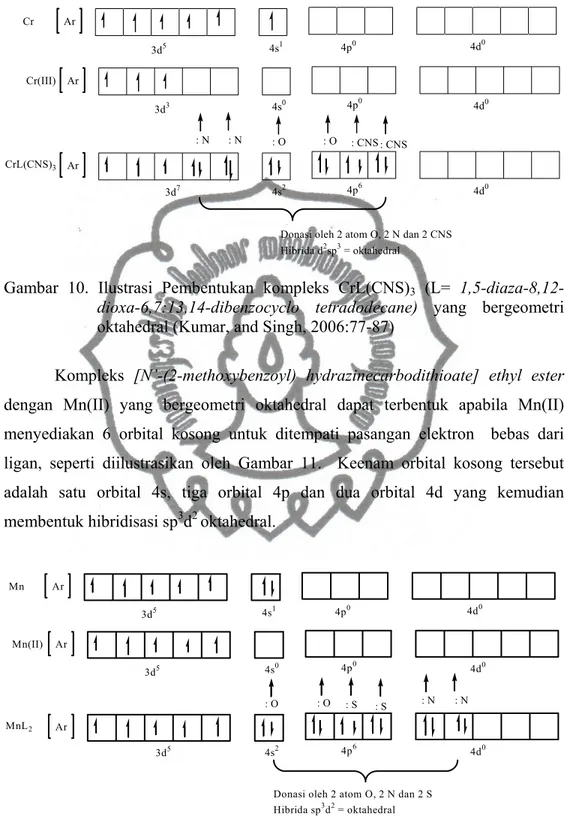
terbentuk apabila Cr(III) menyediakan 6 orbital kosong untuk ditempati pasangan elektron bebas dari ligan. Keenam orbital kosong tersebut adalah satu orbital 4s, tiga orbital 4p dan dua orbital 4d yang kemudian membentuk hibridisasi sp3d2 yang berbentuk oktahedral seperti diilustrasikan Gambar 10.
commit to user
11 11 Ar Cr 3d5 4s1 4p0 4d0 Ar Cr(III) 3d3 4s0 4p0 4d0 : CNS : CNS : O : O : N : N Ar 4p6 4d0 4s2 3d7Donasi oleh 2 atom O, 2 N dan 2 CNS Hibrida d2sp3 = oktahedral
CrL(CNS)3
Gambar 10. Ilustrasi Pembentukan kompleks CrL(CNS)3 (L=
1,5-diaza-8,12-dioxa-6,7:13,14-dibenzocyclo tetradodecane) yang bergeometri
oktahedral (Kumar, and Singh, 2006:77-87)
Kompleks [N’-(2-methoxybenzoyl) hydrazinecarbodithioate] ethyl ester dengan Mn(II) yang bergeometri oktahedral dapat terbentuk apabila Mn(II) menyediakan 6 orbital kosong untuk ditempati pasangan elektron bebas dari ligan, seperti diilustrasikan oleh Gambar 11. Keenam orbital kosong tersebut adalah satu orbital 4s, tiga orbital 4p dan dua orbital 4d yang kemudian membentuk hibridisasi sp3d2 oktahedral.
Ar Mn 3d5 4s1 4p0 4d0 Ar Mn(II) 3d5 4s0 4p0 4d0 : S : S : O : O : N : N Ar 4p6 4d0 4s2 3d5
Donasi oleh 2 atom O, 2 N dan 2 S Hibrida sp3d2 = oktahedral MnL2
Gambar 11. Ilustrasi Pembentukan kompleks MnL2 (L=
[N’-(2-methoxybenzoyl)hydrazinecarbodithioate] ethyl ester yang
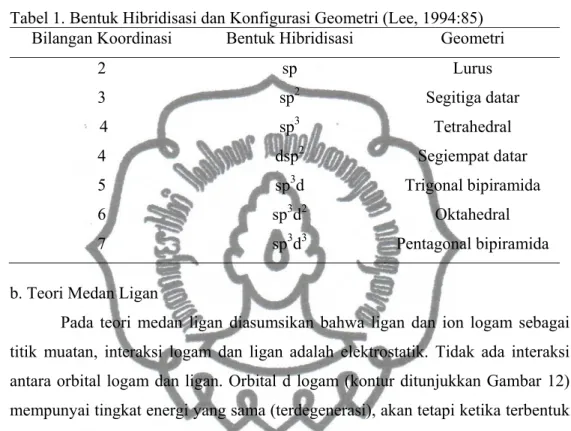
Orbital hibridisasi dapat digunakan untuk meramalkan geometri suatu senyawa, sebagaimana ditunjukkan pada Tabel 1.(Lee, 1994:85).
Tabel 1. Bentuk Hibridisasi dan Konfigurasi Geometri (Lee, 1994:85)
Bilangan Koordinasi Bentuk Hibridisasi Geometri
2 sp Lurus 3 sp2 Segitiga datar 4 sp3 Tetrahedral 4 dsp2 Segiempat datar 5 sp3d Trigonal bipiramida 6 sp3d2 Oktahedral 7 sp3d3 Pentagonal bipiramida
b. Teori Medan Ligan
Pada teori medan ligan diasumsikan bahwa ligan dan ion logam sebagai titik muatan, interaksi logam dan ligan adalah elektrostatik. Tidak ada interaksi antara orbital logam dan ligan. Orbital d logam (kontur ditunjukkan Gambar 12) mempunyai tingkat energi yang sama (terdegenerasi), akan tetapi ketika terbentuk kompleks mengalami pembelahan karena adanya medan ligan (Lee, 1994 :204).
y x z x y x z z y x y 3 dz2 dx2-y2 dxy dyz dxz
Gambar 12. Kontur orbital d (Huheey, et. al., 1993:396) 1). Medan Ligan Pada kompleks oktahedral
Pada medan oktahedral oktahedral, ion logam terletak ditengah oktahedron dan ligan berada dikeenam sudutnya seperti ditunjukkan pada Gambar 13. Orbital
commit to user
13
13
d terpisah menjadi dua kelompok yaitu dxy, dxz, dyz yang disebut t2g dan dx2-dy2, dz2 adalah orbital eg.
Z
Y
X
Gambar 13. Arah sumbu x, y dan z dalam medan oktahedral (Lee, 1994).
Medan ligan akan menyebabkan kenaikan tingkat energi orbital eg lebih besar jika dibandingkan t2g. Diagram tingkat energi orbital d dalam medan ligan oktahedral ditunjukkan pada Gambar 14. Perbedaan energi antara orbital t2g dan eg adalah 10 Dq atau ∆o. Orbital eg mempunyai energi +0,6 ∆o diatas tingkat energi rata-rata, sedangkan orbital t2g mempunyai energi -0,4 ∆o di bawah tingkat energi rata-rata (Lee, 1994:208). -eg t2 g t i n g k a t e n e r g i r a t a - r a t a i o n l o g a m d a l a m m e d a n o k t a h e d r a l e n e r g i r a t a - r a t a i o n l o g a m d a l a m m e d a n s p h e r i c a l + 0 , 6 Ao - 0 ,4 Ao Ao
Gambar 14. Diagram tingkat energi orbital d pada medan oktahedral (Lee, 1994 :206).
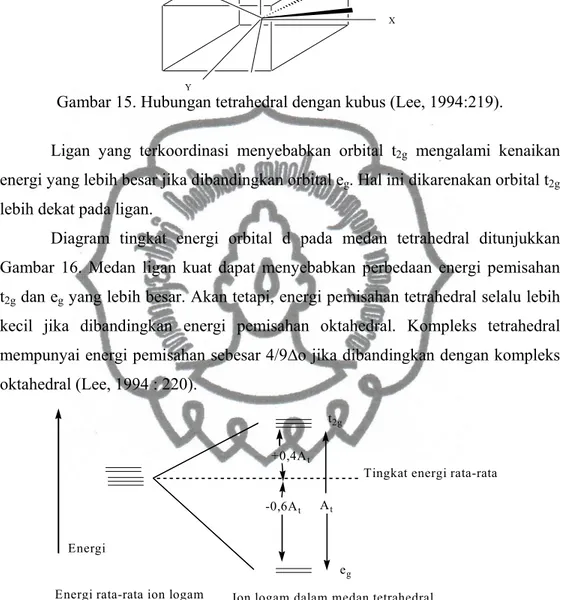
2). Kompleks tetrahedral
Tetrahedral sering dihubungkan dengan sebuah kubus. Pada kompleks tetrahedral, atom pusat terletak di tengah kubus dan empat dari delapan sudutnya terisi oleh ligan, seperti Gambar 15.
Z
Y
X
Gambar 15. Hubungan tetrahedral dengan kubus (Lee, 1994:219).
Ligan yang terkoordinasi menyebabkan orbital t2g mengalami kenaikan energi yang lebih besar jika dibandingkan orbital eg. Hal ini dikarenakan orbital t2g lebih dekat pada ligan.
Diagram tingkat energi orbital d pada medan tetrahedral ditunjukkan Gambar 16. Medan ligan kuat dapat menyebabkan perbedaan energi pemisahan t2g dan eg yang lebih besar. Akan tetapi, energi pemisahan tetrahedral selalu lebih kecil jika dibandingkan energi pemisahan oktahedral. Kompleks tetrahedral mempunyai energi pemisahan sebesar 4/9∆o jika dibandingkan dengan kompleks oktahedral (Lee, 1994 : 220).
Energi
+0,4At
-0,6At At
Tingkat energi rata-rata
Ion logam dalam medan tetrahedral Energi rata-rata ion logam
pada medan sphericalal
t2g
eg
Gambar 16. Diagram tingkat energi orbital d pada medan tetrahedral (Lee, 1994 : 221).
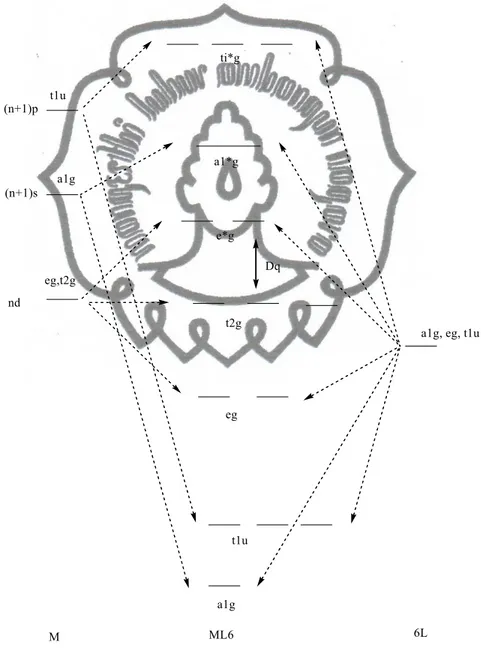
d. Teori Orbital Molekul
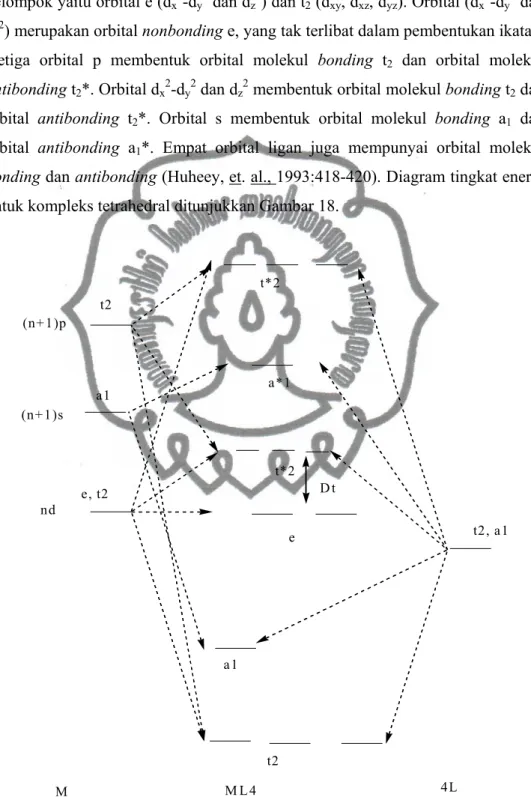
Teori orbital molekul dapat digunakan untuk menjelaskan adanya ikatan kovalen dalam senyawa kompleks. Orbital atom logam dan ligan digunakan untuk membentuk orbital molekul. Pada kompleks oktahedral, orbital dxy, dxz, dyz yang
commit to user
15
15
arahnya berada diantara arah ligan menuju ion pusat tidak terlibat dalam membentuk ikatan, sedangkan orbital dx2-dy2 dan dz2 yang mengarah langsung pada ligan dapat membentuk orbital molekul ikatan (bonding) dan antiikatan (anti
bonding). Selain itu orbital 4s dan 4p juga terlibat dalam pembentukan orbital
molekul (Lee, 1994 :228). Diagram tingkat energi untuk kompleks oktahedral ditunjukkan Gambar 17.
a1g, eg, t1u
eg t1u a1g t2g e*g a1*g ti*g t1u a1g eg,t2g Dq nd (n+1)s (n+1)p M ML6 6L
Gambar 17. Diagram tingkat energi kompleks oktahedal (Huheey, et. al., 1993 :417).
Pada kompleks tetrahedral, lima orbital d logam terpisah menjadi dua kelompok yaitu orbital e (dx2-dy2 dan dz2) dan t2 (dxy, dxz, dyz). Orbital (dx2-dy2 dan dz2) merupakan orbital nonbonding e, yang tak terlibat dalam pembentukan ikatan. Ketiga orbital p membentuk orbital molekul bonding t2 dan orbital molekul
antibonding t2*. Orbital dx2-dy2 dan dz2 membentuk orbital molekul bonding t2 dan orbital antibonding t2*. Orbital s membentuk orbital molekul bonding a1 dan orbital antibonding a1*. Empat orbital ligan juga mempunyai orbital molekul
bonding dan antibonding (Huheey, et. al., 1993:418-420). Diagram tingkat energi
untuk kompleks tetrahedral ditunjukkan Gambar 18.
t2, a1 (n+1)p (n+1)s nd t2 a1 e, t2 e t*2 t2 a1 a*1 t*2 D t M M L 4 4L
Gambar 18. Diagram tingkat energi kompleks tetrahedral (Huheey, et. al., 1993 :419).
commit to user
17
17
4. Spektroskopi UV-Vis
Absorbsi radiasi sinar UV-Vis oleh atom/molekul akan menyebabkan atom/molekul (misalnya M) mengalami eksitasi elektronik. Produk dari reaksi ini berupa atom atau molekul dalam keadaan tereksitasi (misalnya M*), setelah selang waktu tertentu (10-8-10-9 detik) akan terjadi proses relaksasi, yang paling umum yaitu dengan mengubah energi eksitasi menjadi energi panas. Proses absorbsi dan relaksasi tersebut seperti pada reaksi berikut :
M + hv → M*
M* → M + panas
Absorbsi radiasi UV-Vis biasanya dihasilkan dari ekitasi elektron ikatan. Spesies yang dapat mengabsorbsi radiasi UV-Vis meliputi : (1) elektron-elektron n, π, σ, (2) elektron-elektron d dan f, dan (3) elektron transfer muatan (Skoog, et. al., 1998:330).
Penggunaan spektroskopi serapan umumnya didasarkan pada transisi elektron n dan π ke keadaan tereksitasi π* karena energi yang diperlukan untuk proses ini cukup rendah, yaitu pada daerah (200 sampai 700 nm). Energi-energi untuk beberapa jenis orbital molekul sangat berbeda. Biasanya, tingkat energi elektron-elektron nonbonding terletak diantara orbital-orbital π dan σ bonding dan
antibonding. Seperti ditunjukkan dalam Gambar 19.
σ* ________________ antibonding
π* ________________ antibonding
n ________________ nonbonding
π ________________ bonding
σ ________________ bonding
Gambar 19. Tingkat energi elektron molekul (Hendayana, dkk., 1994:158)
Absorbtivitas molar puncak spektrum yang dihasilkan dari transisi n→π* umumnya lemah dan mempunyai rentang harga 10-100 L.cm-1.mol-1, sedangkan untuk transisi π→π* mempunyai rentang harga 1000-10000 L.cm-1.mol-1. Sifat lain yang berbeda antara dua tipe transisi tersebut adalah efek pelarut terhadap λ
puncak spektra. Puncak n→π* biasanya bergeser ke arah λ yang lebih kecil dengan meningkatnya polaritas pelarut, disebut dengan pergeseran biru (hypsochromic). Biasanya, tetapi tidak selalu keadaan yang berkebalikan akan teramati untuk transisi π→π*, disebut dengan pergeseran merah (bathochromic) (Skoog, et. al., 1998:330). Efek hypsochromic disebabkan oleh bertambahnya solvasi pasangan elektron yang mengakibatkan menurunnya energi orbital n. Pergeseran merah atau bathochromic disebabkan oleh gaya polarisasi antara pelarut dan spesies, yang berakibat menurunnya selisih tingkat energi eksitasi dan tingkat energi tidak tereksitasi (Hendayana, dkk., 1994:161).
Kebanyakan ion logam transisi mengabsorbsi radiasi di daerah spektrum sinar tampak. Untuk deret pertama logam transisi menyebabkan transisi elektron 3d yang cenderung mengabsorbsi dengan pita absorbsi melebar (Hendayana, dkk., 1994:165-166). Pada spektrum kompleks oktahedral Mn(II) yaitu [Mn(HO)6]2+ dan kompleks tetrahedral Mn(II) yaitu [Mn(Br)4]2- yang ditunjukkan Gambar 20.
Gambar 20. Spektrum [Mn(HO)6]2+ ( ) dengan skala absorbansi di bagian kiri dan spektrum [Mn(Br)4]2- (---) dengan skala absorbansi di bagian kanan (Cotton, and Wilkinson, 1998:578)
commit to user
19
19
Karakteristiknya adalah: mempunyai serapan yang lemah, mempunyai banyak puncak serapan dan mempunyai variasi lebar pita serapan. Hal ini dikarenakan transisi terjadi dari tingkat energi dasar 6A1 ke tingkat energi eksitasi dengan spin multilisitas yang berbeda (Gambar 21). Transisi ini akan menghasilkan puncak-puncak dengan intensitas yang lemah dan nilai absorbtivitas yang rendah. Harga absortivitas molar kompleks oktahedral Mn(II) sekitar 100 kali lebih lemah jika dibandingkan dengan absorbtivitas molar kompleks tetrahedral Mn(II).
Gambar 21. Diagram tingkat energi ion Mn(II) d 5 pada medan oktahedral (Cotton, and Wilkinson, 1998:580)
Begitu juga pada spektra elektronik Cr(III). Jika dilihat diagram tingkat energi Cr(III) dalam medan oktahedral (Gambar 20) terindikasikan adanya tiga transisi spin yang diijinkan (spin-allowed transitions). Misalnya pada kompleks [Cr(F)6]-3 tiga pita transisi tersebut adalah : transisi 4A1g(F)→ 4T2g(F), yang
muncul di daerah 14900 cm-1, transisi 4A1g(F)→4T1g(F) mempunyai puncak serapan di daerah 22700 cm-1 dan transisi 4A1g(F)→4T1g(P) muncul di daerah 34800 cm-1 (Huheey, et. al., 1993:447).
Gambar 22. Diagram tingkat energi ion d 3 pada medan oktahedral (Cotton, F.A. and Wilkinson, G., 1998 : 690)
5. Sifat Magnetik
Senyawa kompleks dengan orbital d dan f yang belum terisi penuh, dapat diketahui rentang sifat kemagnetannya, yang tergantung pada tingkat oksidasi, konfigurasi elektron dan bilangan koordinasi atom logamnya. Perkalian kerentanan spesifik (Xg) dari suatu senyawa dengan berat molekulnya akan diperoleh harga kerentanan molar (Xm) yang dapat dihubungkan dengan momen paramagnetik permanen (µ) suatu molekul dengan Persamaan 1 (Huheey, et. al., 1993:459). X m = RT N 3 2 2µ ... (1)
commit to user
21
21
Dengan N adalah bilangan Avogadro, R adalah tetapan gas ideal, T adalah suhu (dalam K) dan µ dalam satuan BM (1 BM = eh/4mπ). Dari Persamaan 1 dapat diketahui besarnya harga µ, yaitu dengan :
µ = 2 2 1 3 ⎥ ⎦ ⎤ ⎢ ⎣ ⎡ N RTXm ... (2) µ = 2,84 (X m T) 1/2 ... (3)
Untuk mengubah µ kedalam jumlah spin elektron tak berpasangan, perlu menyertakan kontribusi paramagnet dan diamagnet. Kontrisbusi diamagnet dari suatu senyawa dapat diperoleh dari jumlah kerentanan diamagnetik setiap komponennya (atom, ion dan molekul netral sebagian di tunjukkan Tabel 2). Tabel 2. Sebagian faktor koreksi diamagnetik untuk ion dan molekul (Szafarn, et.
al., 1991;52) dan (Huheey, et. al., 1994:463)
Kation/ Anion/Atom netral/ Molekul Faktor koreksi (10-6 cgs)
Cr(III) 13 Mn(II) 13 Cl- 23 H2O 13 C -6 N -4,61 H -4,61 Dengan demikian diperoleh kerentanan molar terkoreksi, seperti ditunjukkan
Persamaan 4.
X A = X m - X l ... (4) Sehingga persamaan 3 dapat ditulis menjadi :
Senyawa kompleks dengan tingkat energi dasar A seperti d3 oktahedral, dan d5spin tinggi mempunyai rumusan momen paramagnet permanen (µs) secara teoritis :
µs = 2 [S (S+1)]1/2 ... (6)
Persamaan 6 dikenal dengan formula spin-only, dimana S adalah bilangan kuantum momentum anggular spin, S berhubungan dengan jumlah elektron tak berpasangan (n) = S/2, sehingga didapatkan Persamaan 7 (Lee, 1994 : 225).
µs = [n(n+2)] 1/2 ... (7) 6. Analisis Termal
Teknik-teknik yang dicakup dalam metode analisis termal diantaranya adalah analisis termogravimetri (Thermogravimetric Analysis / TGA) yang didasari pada perubahan berat akibat pemanasan dan analisis diferensial termal (Differential Thermal Analysis /DTA) yang didasari pada perubahan kandungan panas akibat perubahan temperatur.
Pada analisis termogravimetri, perubahan berat sampel diamati sebagai fungsi temperatur. Informasi yang diperoleh dari metode termografimetri terbatas pada dekomposisi, reaksi oksidasi dan beberapa proses fisik seperti penguapan, sublimasi dan desorbsi (Skoog et. al., 1998:800). Plot persen kehilangan berat sebagai fungsi temperatur disebut sebagai termogram. Salah satu contoh termogram adalah termogram kompleks Co(C8H10N4)(NO3)2 yang terdapat pada gambar Gambar 23. Pada termogram (TG) Co(C8H10N4)(NO3)2 (Gambar 21) terdapat daerah yang mendatar yang mengindikasikan senyawa kobalt dalam keadaan stabil. Dekomposisi tahap pertama terjadi pada 200-400°C mengindikasikan bahwa kompleks kehilangan senyawa nitrat dalam bentuk radikal. Pada tahap kedua terjadi kehilangan 1,2 diimidazolethane (Arshad et. al., 2008:593-604).
commit to user
23
23
Gambar 23. Termogram (TG) dekomposisi Co(C8H10N4)(NO3)2 di udara (Arshad
et. al., 2008:593-604).
Differential Thermal Analysis (DTA) mengukur perbedaan temperatur
antara sampel dan materi pembanding inert sebagai fungsi temperatur, jika temperatur keduanya dinaikkan dengan kecepatan sama dan konstan. Proses yang terjadi dalam sampel adalah eksoterm dan endoterm, yang ditampilkan dalam bentuk termogram differensial (Skoog et. al., 1998:803). Salah satu contoh termogram differensial (DTA) adalah termogram Cu(C8H10N4)(NO3)2 dengan laju kenaikan temperatur 10°C/min dapat dilihat pada Gambar 24. Pada Gambar 24 terlihat adanya puncak maksimum yang menunjukkan terjadinya reaksi endoterm (320°C) konsekuensinya, sampel menjadi bersuhu lebih tinggi daripada material inert pembandingnya. Satu puncak minimum (eksoterm) pada (600°C) menunjukkan terlepasnya C8H10N4 (Arshad et. al., 2008:593-604).
Gambar 24. Termogram (DTA) dekomposisi Cu(C8H10N4)(NO3)2 di udara (Arshad et. al., 2008:593-604).
7. Spektroskopi Infra Merah
Atom-atom dalam suatu molekul tidak diam melainkan bervibrasi. Bila radiasi infra merah yang kisaran energinya sesuai dengan frekuensi vibrasi rentangan (stretching) dan vibrasi bengkokan (bending) dari ikatan kovalen dalam kebanyakan molekul dilewatkan dalam suatu cuplikan, maka molektul-molekul akan menyerap energi tersebut dan terjadi transisi diantara tingkat energi vibrasi dasar dan tingkat vibrasi tereksitasi (Hendayana, dkk., 1994:189). Namun demikian tidak semua ikatan dalam molekul dapat menyerap energi infra merah meskipun mempunyai frekuensi radiasi sesuai dengan gerakan ikatan. Hanya ikatan yang mempunyai momen dipol dapat menyerap radiasi infra merah
commit to user
25
25
(Sastrohamidjojo, 1992:3). Umumnya daerah radiasi infra merah (IR) terbagi dalam daerah IR dekat (14290-4000 cm-1), IR jauh (700-200 cm-1) dan IR tengah
(4000-666 cm-1). Daerah yang paling banyak digunakan untuk keperluan
penyidikan terbatas pada daerah IR tengah (Silverstein, et. al., 1986:95).
Menurut hukum Hooke, gerakan harmonik sederhana atom-atom diberikan oleh Persamaan 8. ν = π c 2 1 1/2 2 1 2 1 / ⎥⎦ ⎤ ⎢ ⎣ ⎡ + m m m m k ... (8) Keterangan : V = bilangan gelombang (cm-1) c = kecepatan cahaya (cm/detik) k = tetapan gaya ikatan (dyne/cm), m1 = massa atom 1 (g)
m2 = massa atom 2 (g).
Vibrasi rentangan dapat dibedakan vibrasi rentangan simetri dan vibrasi rentangan asimetri. Sedangkan vibrasi bengkokan dibedakan menjadi guntingan (scissoring), kibasan (waging), pelintiran (twisting) dan goyangan (rocking). Ragam vibrasi rentangan dan bengkokan ditunjukkan oleh Gambar 25.
H H a b H H H H c H H d e H H f H H
Gambar 25. Vibrasi rentangan : (a) Rentangan simetri, (b) rentangan asimetri. Vibrasi bengkokan : (c) Guntingan, (d) Goyangan, (e) Kibasan dan (f) Pelintiran (Sastrohamidjojo, 1992 : 5)
Gugus fungsi tertentu dapat menyerap radiasi sinar inframerah antara lain : a). Karbon-karbon pada rantai siklik
Ikatan antara karbon sp2 (C=C) seringkali menunjukkan serapan dengan intensitas sedang-lemah pada 1600-1475 cm-1 (Sastrohamidjojo, 1992 : 15). b). Karbon-Oksigen
Ikatan antara C-O dari suatu alkohol dan eter menyerap radiasi infra merah karena vibrasi rentang di daerah 1050-1200 cm-1 (Hendayana, 1994:196). c). Karbon-Nitrogen imin dan oksin
Ikatan antara C=N imin dan oksin menyerap radiasi infra merah dengan intensitas lemah-kuat pada 1690-1640 cm-1 (Sastrohamidjojo, 1992 :16). d). Oksigen-Hidrogen
Ikatan O-H fenol dan alkohol yang bersifat bebas akan menyerap dengan intensitas kuat pada 3650-3584 cm-1. Sedangkan gugus O-H yang berikatan hidrogen menyerap dengan intensitas sedang pada daerah 3550-3200 cm-1 (Silverstein, et. al., 1986:112).
8. Daya Hantar Listrik
Konduktometri merupakan metode analisis kimia berdasarkan daya hantar listrik suatu larutan, yang bergantung pada konsentrasi dan jenis ion dalam larutan. Daya hantar listrik berhubungan dengan pergerakan suatu ion dalam larutan. Ion yang mudah bergerak mempunyai daya hantar listrik yang besar (Hendayana, dkk., 1994:90).
Daya hantar listrik larutan elektrolit dapat dinyatakan sebagai daya hantar molar (Λm), yang didefinisikan sebagai daya hantar yang ditimbulkan oleh satu mol zat dirumuskan sesuai dengan Persamaan 9 (Atkins, 1990: 301).
C m κ = Λ ... (9) keterangan :
Λm = daya hantar molar (S.cm2.mol-1)
к = daya hantar listrik spesifik larutan elektrolit (S.cm-1)
C = konsentrasi (mol.cm-3)
Apabila satuan konsentrais larutan elektrolit adalah mol. L-1, maka Persamaan 9 di atas dapat ditulis menjadi :
commit to user
27 27 C m κ 1000 = Λ ... (10) keterangan :Λm = daya hantar molar (S.cm2.mol-1)
к = daya hantar listrik spesifik larutan elektrolit (S.cm-1) C = konsentrasi (mol.L-1)
Daya hantar molar larutan bergantung pada konsentrasi dan jumlah ion senyawa elektrolit. Jumlah muatan atau jumlah ion dari spesies yang terbentuk ketika larutan kompleks dilarutkan dapat diketahui dengan cara membandingkan daya hantar molar kompleks tersebut dengan senyawa ionik sederhana dalam berbagai pelarut yang sesuai dan telah diketahui daya hantar molarnya (Lee, 1994:197-198).
9. Senyawa 8-hidroksikuinolin
Senyawa 8-hidroksikuinolin disebut juga oxine merupakan senyawa aromatik bisiklik yang dapat berfungsi sebagai ligan. Hal ini dikarenakan kedua jenis atom donor yaitu N dan O dalam senyawa 8-hidroksikuinolin dapat digunakan untuk berikatan dengan logam.
Senyawa 8-hidroksikuinolin mempunyai berat molekul 145,16 g/mol, berupa serbuk putih, tidak larut dalam air tetapi mudah larut dalam pelarut organik dan asam seperti asam asetat. Dengan ion logam dapat membentuk molekul yang larut dalam kloroform atau karbon tetraklorida (Day, And Underwood, 1980:454). Ligan 8-hidroksikuinolin mempunyai tittik leleh 74 - 76 oC dan mempunyai titik didih 276oC, densitas 1,034 g/mol. Senyawa ini merupakan salah satu jenis dari kelompok obat antiamuba. Obat antiamuba atau amubasida merupakan senyawa yang digunakan untuk pengobatan amubiasis, yaitu suatu infeksi yang disebabkan oleh amuba parasitik. Senyawa ini bekerja pada amuba yang terdapat pada usus, melalui dua mekanisme, yaitu : oksidasi oleh atom iodida dan pembentukan kelat dengan ion fero oleh gugus 8-kuinolinol (Siswandono, dan Soekardjo, 1995:314).
Sugiharto (2006) mensintesis kompleks Fe(III)-(8-hidroksikuinolin) yang bergeometri oktahedral. Indikasi terbentuknya kompleks ditandai dengan adanya
pergeseran spektra IR gugus C=N (1504,4 cm-1 pada ligan menjadi 1496,7 cm-1 pada kompleksnya) dan gugus O-H (3159,4 cm-1 pada ligan menjadi 3433,1cm-1 pada kompleksnya). Kompleks 8-hidrksikuinolin dengan Ag(I) mumpunyai formula [Ag(8-quinolol)(8-quinolate)] menunjukkan puncak serapan pada panjang gelombang 385 nm (Kunkely and Vogler., 2009:196-198).
B. Kerangka Pemikiran
Cr(III) dengan konfigurasi elektron d3 dan Mn(II) dengan konfigurasi elektron d5 dapat menyediakan orbital kosong, sedangkan 8-hidroksikuinolin mempunyai pasangan elektron bebas. Dengan demikian dapat disintesis kompleks Cr(III) dan Mn(II) dengan ligan 8-hidroksikuinolin.
Formula kompleks yang terbentuk tergantung sifat dan jumlah ligan yang terkoordinasi pada atom pusat. Ligan 8-hidroksikuinolin merupakan ligan yang mempunyai atom donor elektron lebih dari satu, sehingga dapat membentuk ikatan koordinasi dengan Cr(III) dan Mn(II) dalam berbagai kemungkinan formula. Berdasarkan penelitian sugiharto (2006) 8-hidroksikuinolin merupakan ligan lemah. Kompleks Cr(III) dengan ligan lemah umumnya mempunyai bilangan koordinasi 6 dengan kemungkinan geometrinya adalah oktahedral. Kompleks Mn(II) dengan ligan lemah dapat mempunyai geometri oktahedral ataupun tetrahedral. Ada dua gugus donor elektron pada 8-hidroksikuinolin yang memungkinkan untuk berikatan dengan atom pusat, yaitu (1) gugus O-H dan (2) gugus C=N seperti ditunjukkan oleh Gambar 26.
N
OH 1
2
Gambar 26. Struktur 8-hidroksikuinolin dan dua gugus donor elektron yaitu (1) gugus O-H dan (2) gugus C=N
commit to user
29
29
Beberapa contoh kompleks yang terbentuk antara atom pusat dengan ligan yang mengandung atom donor N dan O pada tinjauan pustaka, menunjukkan bahwa ligan bersifat bidentat. Terbentuknya kompleks ditunjukkan oleh adanya pergeseran puncak serapan spektra elektronik di daerah ultraviolet dan sinar tampak.
Kompleks [Ag(8-quinolinol)(8-quinolate)] telah disintesis, dan
menunjukkan bahwa ligan 8-hidroksikuinolin terkoordinasi pada Ag(I) secara bidentat seperti ditunjukkan Gambar 27 (Kunkely and Vogler., 2008:196-198). N O N O
Ag(I)
H
Gambar 27. Kompleks [Ag-(8-quinolinol)(8-quinolate)] (Kunkely and Vogler., 2008:196-198).
Dengan demikian atom donor yang kemungkinan terkoordinasi pada atom pusat Cr(III) dan Mn(II) juga bidentat, seperti ditunjukkan oleh Gambar 28 dengan berbagai kemungkinan geometri.
N OH Cr(III) N OH Mn(II)
Gambar 28. Kemungkinan ikatan kovalen koordinasi antara 8-hidroksikuinolin dengan atom pusat Cr(III) dan Mn(II)
Sifat magnetik kompleks dipengaruhi oleh kuat medan ligan. Sifat kemagnetan ini dapat diketahui dari harga momen magnet efektifnya (µeff). Ligan 8-hidroksikuinolin yang merupakan ligan lemah dapat membentuk kompleks dengan Cr(III) dan mempunyai momen magnet efektif antara 3,70-3,90 BM, sedangkan harga momen magnet efektif Mn(II) dengan ligan lemah berkisar antara 5,65-6,10 BM dan bersifat paramagnetik.
C. Hipotesis
1. Senyawa kompleks Cr(III)-(8-hidroksikuinolin) dan senyawa kompleks Mn(II)-(8-hidroksikuinolin) dapat disintesis dari CrCl3.6H2O dan MnCl2.4H2O dengan ligan 8-hidroksikuinolin.
2. Formula, struktur dan sifat kompleks Cr(III) dan Mn(II) dengan 8-hidroksikuinolin antara lain :
a. Kemungkinan formula senyawa kompleks yang terbentuk adalah Cr(8-hidroksikuinolin)m(Cl)b(H2O)n (m=1,2,3,4,5,6), (b=0,1,2,3) dan (n=1,2,3,4,5,6).
b. Kemungkinan formula senyawa kompleks yang terbentuk adalah Mn(8-hidroksikuinolin)m(Cl)b(H2O)n (m=1,2,3,4,5,6), (b= 0,1,2) dan (n=1,2,3,4).
c. Kompleks Cr(III) dan Mn(II) dengan ligan lemah 8-hidroksikuinolin dapat mempubyai struktur oktahedral ataupun tetrahedral.
commit to user
BAB IIIMETODOLOGI PENELITIAN
A. Metode Penelitian
Metode yang dilakukan dalam penelitian ini adalah metode eksperimen. Sintesis kompleks yang dilakukan mengacu pada Belaid et. al., 2008: 63-69. Dan Kumar et. al., 2006:77-87.
B. Tempat dan Waktu Penelitian
Penelitian dilakukan selama 7 bulan yaitu bulan September 2008 sampai dengan bulan maret 2009. Sintesis senyawa kompleks dilakukan di Laboratorium Kimia Fakultas MIPA UNS Surakarta. Pengukuran kadar logam, momen magnet, DHL, dan spektra elektronik dilakukan di Laboratorium Pusat Sub Lab. Kimia UNS Surakarta. Penentuan spektra IR dilakukan di Labotarorium Kimia Organik Fakultas MIPA Universitas Gajah Mada Yogyakarta. Penentuan kandungan air dalam kompleks dengan TG/DTA dilakukan di Laboratorium Uji Polimer LIPI Bandung.
C. Alat dan Bahan
1. Alat b. Peralatan gelas Pyrex dan Duran c. Konduktivitimeter 4071 CE Jenway
d. Magnetik Susceptibility Balance (MSB) AUTO Sherwood Scientific 10169 e. Spektrofotometer UV-Vis Double Beam Shimadzu 1601
f. Spektrofotometer Serapan Atom (SSA) Shimadzu AA-6650 g. Pemanas Listrik AEL-200 Shimadzu dan Cole Palmer 4658 h. Neraca Analitik Shimadzu AEL-200
i. Spektrofotometer FTIR Perkin Elmer 2000
j. Thermogravimetric/Differential Thermal Analyzer 200 Seiko SSC 5200H k. Pengaduk magnetik Haeidholp M1000 Germany
2. Bahan-bahan a. CrCl3.6H2O (Merck)
b. MnCl2.4H2O (Merck) c. 8-hidroksikuinolin (Merck) d. Metanol p.a (Merck) e. Akuades
f. Asam klorida (HCl) pekat 37% (Merck) g. KBr kering (Merck)
h. Kertas saring Whatman 42 i. DMSO (Merck)
D. Prosedur Penelitian
1. Sintesis Senyawa Kompleks
a. Sintesis Senyawa Kompleks Krom(III) dengan 8-hidroksikuinolin
CrCl3.6H2O (0,452 g; 2 mmol) dalam metanol (10 mL) ditambahkan pada 8-hidroksikuinolin (0,870 g; 6 mmol) dalam metanol (10 mL) secara bertetes-tetes. Campuran direfluks selama ±3 jam sambil diaduk. Larutan didiamkan selama ±48 jam sampai terbentuk endapan. Endapan tersebut disaring dan dicuci dengan metanol kemudian dikeringkan dalam desikator selama 24 jam.
b. Sintesis Senyawa Kompleks Mangan(II) dengan 8-hidroksikuinolin
Prosedur sintesis kompleks Mn(II) dengan 8-hidroksikuinolin mirip dengan sintesis kompleks Cr(III) dengan 8-hidroksikuinolin. Pada sintesis ini digunakan MnCl2.4H2O (0,396 g; 2 mmol) dan 8-hidroksikuinolin (0,480 g; 4 mmol).
2. Pengukuran Logam dalam Kompleks a. Kadar Krom dalam kompleks Cr(III)-(8-hidroksikuinolin)
Kadar krom dalam kompleks ditentukan dengan menggunakan Spektrofotometer Serapan Atom (SSA). Larutan standar dibuat dengan melarutkan CrCl3.6H2O (0,5125 g) dalam HCl 0,1 N (100 mL) sehingga didapat
commit to user
33
33
larutan induk Cr(III)1000 ppm. Kemudian diambil 2,5 mL dan diencerkan menjadi 50 mL sehingga didapatkan konsentrasi Cr(III)50 ppm. Larutan standar dengan konsentrasi 1-11 ppm dibuat dari larutan induk 50 ppm. Larutan kompleks dalam HCl 0,1 N dibuat dengan konsentrasi krom diperkirakan berada antara 1-11 ppm, diukur absorbansinya kemudian diplotkan pada kurva standart.
b. Kadar Mangan dalam Kompleks Mn(II)-(8-hidroksikuinolin)
Penentuan kadar mangan dalam kompleks Mn(II)-(8-hidroksikuinolin) mirip dengan penentuan kadar krom dalam kompleks Cr(III)-(8-hidroksikuinolin). Larutan induk Mn(II) 1000 ppm dibuat dengan melarutkan MnCl2.4H2O (0,308 g) dalam HCl (100 mL). Larutan standar dibuat dengan konsentrasi 1-5 ppm. Larutan kompleks dibuat dalam HCl, diukur absorbansinya kemudian diplotkan pada kurva standar.
3. Pengukuran Momen Magnet
Sejumlah sampel kompleks padat dimasukkan dalam tabung kosong pada neraca kerentanan magnetik, diukur tinggi sampel dalam tabung dengan panjang antara 1,5- 4,5 cm dan berat antara 0,001 – 0,999 gram. Hingga diperoleh harga kerentanan magnetik per gram (Xg). Harga Xg yang diperoleh digunakan untuk menentukan momen magnetnya dengan Magnetic Susceptibility Balance (MSB).
4. Pengukuran Spektra Elektronik
Pengukuran spektra elektronik dilakukan pada konsentrasi 10-3-10-4M dalam metanol pada rentang panjang gelombang (290 – 800 nm). Serapan diamati pada panjang gelombang yang sesuai dengan Spektrofotometer UV-Vis Double
Beam.
5. Pengukuran Daya Hantar Listrik
Sampel dan standar dilarutkan dalam metanol dan dibuat pada konsentrasi yang sama (10-3 M), kemudian daya hantar listrik masing- masing larutan diukur
dengan konduktivitimeter (setiap pengukuran dikoreksi terhadap nilai daya hantar spesifik pelarut, Kpelarut). Larutan standar yang digunakan adalah NiSO4.6H2O, CuSO4.5H2O, NiCl2.6H2O, Ni(NO3)2.6H2O dan FeCl3.6H2O.
6. Pengukuran Spektra Infra Merah
Ligan 8-hidroksikuinolin serta kedua sampel senyawa kompleks dikirim ke Labotarorium Kimia Organik Fakultas MIPA UGM untuk dibuat spektrumnya dengan mengunakan Spektrofotometer FTIR pada daerah 4000 – 400 cm-1.
7. Analisis TG/DTA
Sampel kompleks dikririmkam ke Laboratorium Uji Polimer LIPI,
Bandung untuk analisa TG/DTA. Identifikasi adanya molekul H2O dalam
kompleks dapat diperkirakan dari analisis termal dengan menggunakan
Differential Thermal Analyzer (DTA) dan Thermogravimetric Analysis (TGA).
E. Teknik Pengumpulan dan Analisis Data
Penelitian ini akan menghasilkan beberapa macam data. Data indikasi terbentuknya kompleks diperoleh dari spektra UV-Vis ligan dan kompleks. Data kadar logam dalam kompleks diperoleh dari hasil analisis SSA. Perbandingan kation dan anion dalam kompleks diketahui dengan membandingkan daya hantar listrik larutan senyawa kompleks dan daya hantar listrik larutan standar. Adanya H2O dalam kompleks diperkirakan dari hasil pengukuran (TG/DTA). Momen magnetik senyawa kompleks diketahui dari harga kerentanan magnetik per gram (Χg). Gugus fungsi ligan yang terkoordinasi pada ion pusat diperkirakan dari pergeseran spektra IR.
commit to user
BAB IVHASIL DAN PEMBAHASAN
A. Sintesis Kompleks
1. Sintesis Kompleks Cr(III) dengan 8-hidroksikuinolin
Berbagai perbandingan mol logam dengan mol ligan, dan variasi waktu refluks sintesis kompleks Cr(III) dengan ligan 8-hidroksikuinolin telah dicoba namun tidak menghasilkan kompleks yang diharapkan. Hal ini ditandai oleh tidak bergesernya puncak serapan kompleks hasil eksperimen dan persentase logam dalam kompleks hasil ekperimen tidak sesuai dengan persentase logam dalam berbagai formula kompleks secara teoritis. Reaksi antara CrCl3.6H2O (0,532 g; 2 mmol) dan 8-hidroksikuinolin (0,870 g; 6 mmol) dalam metanol menghasilkan endapan serbuk berwarna merah kecoklatan (0,536 g; 48,15 %).
Indikasi terbentuknya kompleks Cr(III)-(8-hidroksikuinolin) dilihat dari perbandingan puncak serapan kompleks Cr(III)-(8-hidroksikuinolin) dengan larutan ligan 8-hidroksikuinolin, yaitu ditandai oleh pergeseran puncak serapan ke arah λ yang lebih besar. Pergeseran puncak serapan ditunjukkan oleh Gambar 29.
Gambar 29. Spektra Elektronik (a) senyawa ligan 8-hidroksikuinolin dalam metanol (b) senyawa Cr(III)-(8-hidroksikuinolin) dalam metanol Gambar 29 menunjukkan bahwa ligan 8-hidroksikuinolin mempunyai puncak serapan pada panjang gelombang 378,50 nm dan 316 nm. Puncak ini mengalami pergeseran ke arah yang lebih besar yaitu masing-masing 401,50 nm
dan 316,5 nm. Hal ini mengindikasikan terbentuknya senyawa kompleks Cr(III)-(8-hidroksikuinolin).
2. Sintesis Kompleks Mn(II) dengan 8-hidroksikuinolin
Berbagai perbandingan mol logam dengan mol ligan, variasi waktu refluks sintesis kompleks Mn(II) dengan ligan 8-hidroksikuinolin telah dicoba namun tidak menghasilkan kompleks yang diharapkan. Hal ini ditandai oleh tidak bergesernya puncak serapan kompleks hasil eksperimen dan persentase logam dalam kompleks hasil ekperimen tidak sesuai dengan persentase logam dalam berbagai formula kompleks secara teoritis dan persentase logam dalam kompleks hasil ekperimen tidak sesuai dengan persentase logam dalam berbagai formula kompleks secara teoritis. Reaksi antara MnCl2.4H2O (0,396 g; 2 mmol) dan ligan 8-hidroksikuinolin (0,480 g; 4 mmol) dalam metanol menghasilkan endapan serbuk berwarna kuning (0,396 g; 40,61%).
Mengingat transisi elektronik kompleks Mn(II) menghasilkan puncak-puncak serapan dengan intensitas lemah (seperti ditunjukkan oleh Gambar 30), maka terbentuknya kompleks Mn(II)-(8-hidroksikuinolin) dilihat dari perbandingan puncak serapan larutan kompleks Mn(II)-(8-hidroksikuinolin) dengan larutan ligan 8-hidroksikuinolin, yaitu ditandai oleh pergeseran puncak serapan ke arah λ yang lebih besar. Pergeseran puncak serapan ditunjukkan oleh Gambar 31.
commit to user
37
37
Gambar 31. Spektra Elektronik (a) kompleks Mn(II)-(8-hidroksikuinolin) dalam metanol (b) 8-hidroksikuinolin dalam metanol
Gambar 31 menunjukkan puncak serapan ligan 8-hidroksikuinolin (378,50 nm) mengalami pergeseran ke arah λ yang lebih besar pada kompleksnya yaitu 382 nm. Serta pada spektra kompleks Mn(II)-(8-hidroksikuinolin) muncul puncak serapan pada 332,50 nm. Hal ini mengindikasikan terbentuknya senyawa kompleks Mn(II)-(8-hidroksikuinolin).
B. Penentuan Formula Kompleks
1. Penentuan Kadar Logam dalam Kompleks a. pengukuran kadar krom dalam kompleks
Kadar krom dalam kompleks Cr(III)-(8-hidroksikuinolin) yang diperoleh dari hasil pengukuran adalah 9,43±0,36%. Jika hasil pengukuran tersebut dibandingkan dengan kadar krom secara teoritis pada berbagai kemungkinan formula kompleks (Tabel 3), maka diperkirakan formula kompleks yang paling mungkin adalah Cr(8-hidroksikuinolin)3(H2O)n (n=3,4,5)
Tabel 3. Kadar Krom dalam Kompleks Secara Teoritis
Komposisi Senyawa Kompleks Mr %Cr
Cr(8-hidroksikuinolin)3 (H2O)2 520,49 9,99
Cr(8-hidroksikuinolin)3 (H2O)3 538,51 9,66
Cr(8-hidroksikuinolin)3 (H2O)4 556,52 9,34

![Gambar 4. Koordinasi L pada Cu(II) yang membentuk kompleks CuL 2 (dengan L adalah 3-[(2-Hydroxy-quinolin-3-ylmethylene)-amino]-2-phenyl-3H-quinazolin-4-one) (Siddappa et](https://thumb-ap.123doks.com/thumbv2/123dok/4275833.2890114/22.918.229.721.303.676/koordinasi-membentuk-kompleks-hydroxy-quinolin-ylmethylene-quinazolin-siddappa.webp)
![Gambar 8. Struktur kompleks oktahedral Mn(II) dengan [N’-(2-methoxybenzoyl) hydrazinecarbodithioate]ethyl ester (Singh et](https://thumb-ap.123doks.com/thumbv2/123dok/4275833.2890114/27.918.268.639.326.653/gambar-struktur-kompleks-oktahedral-dengan-methoxybenzoyl-hydrazinecarbodithioate-singh.webp)