LAPORAN PRAKTIKUM BIOKIMIA
(KI3061)
PERCOBAAN 5
UJI AKTIVITAS ENZIM SUKSINAT DEHIDROGENASE
Nama : Muhamad Gidry Abdurrazak
NIM : 11213016
Kelompok : 4
Tanggal Percobaan : 17 April 2015 Tanggal Laporan : 30 April 2015
Asisten : Hasti
LABORATORIUM BIOKIMIA
PROGRAM STUDI KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT TEKNOLOGI BANDUNG
2015
1. Tujuana. Menentukan pengaruh konsentrasi enzim suksinat dehidrogenase terhadap laju awal reaksi oksidasi suksinat menjadi fumarat.
b. Menentukan pengaruh konsentrasi suksinat terhadap laju awal reaksi oksidasi suksinat menjadi fumarat.
c. Menentukan pengaruh inhibitor kompetitif malonat terhadap aktivitas suksinat dehidrogenase.
2. Data Pengamatan
Tabel 2.1 Volume reagen dan suspensi mitokondria yang ditambahkan pada tiap tabung
Tabung Buffer Uji (mL) Azida (mL) DCIP (mL) Malonat (mL) Suksinat (mL) Suspensi Mitokondria (mL) 1 4 0,5 - - 0,5 0,0 2 3,5 0,5 0,5 - 0,5 0,0 3 3,7 0,5 - - 0,5 0,3 4 3,2 0,5 0,5 - 0,5 0,3 5 3,4 0,5 - - 0,5 0,6 6 2,9 0,5 0,5 - 0,5 0,6 7 2,7 0,5 0,5 0,2 0,5 0,6 8 3,4 - 0,5 - 0,5 0,6 9 3,4 0,5 0,5 - - 0,6
Tabel 2.2 Absorbansi larutan tiap tabung per 9 menit
Tabung Lap 1 Lap 2 Lap 3 Lap 4
1 Menit ke- 0 9 18 27 36 Absorbans i - 0 0 0 0 2 Menit ke- 1 10 19 28 37 Absorbans i - 1,405 1,380 1,345 1,353 3 Menit ke- 2 11 20 29 38 Absorbans i - 0 0 0 0 4 Menit ke- 3 12 21 30 39 Absorbans i - 1,354 1,285 1,282 1,285 5 Menit ke- 4 13 22 31 40 Absorbans i - 0 0 0 0 6 Menit ke- 5 14 23 32 41 Absorbans i - 1,351 1,337 1,322 1,327 7 Menit ke- 6 15 24 33 42
Absorbans i - 1,220 1,084 1,191 1,182 8 Menit ke- 7 16 25 34 43 Absorbans i - 1,351 1,363 1,363 1,345 9 Menit ke- 8 17 26 35 44 Absorbans i - 1,382 1,398 1,364 1,382 3. Pengolahan Data 5 10 15 20 25 30 35 40 1.22 1.24 1.26 1.28 1.3 1.32 1.34 1.36 1.38 1.4 1.42
Tabung 2 Linear (Tabung 2) Tabung 4 Linear (Tabung 4)
Tabung 6 Linear (Tabung 6)
Menit ke-Absorbansi
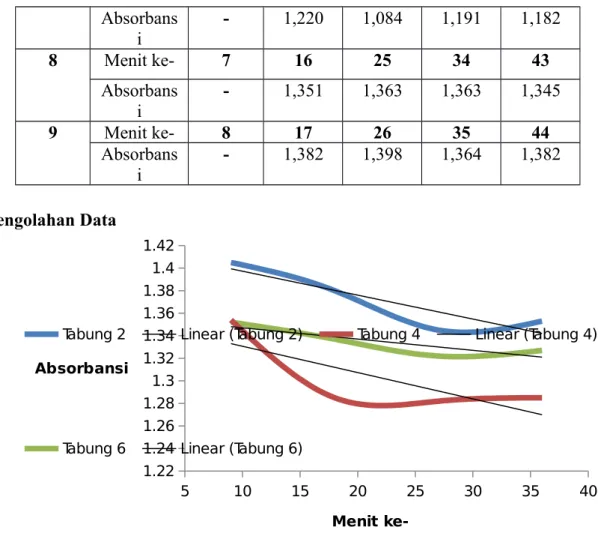
Gambar 3.1 Kurva absorbansi larutan pada tabung 2, 4, dan 6 terhadap waktu
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0 0 0 0 f(x) = - 0x + 0 R² = 0.62 [Enzim] Laju Awal (Vo)
5 10 15 20 25 30 35 40 1 1.05 1.1 1.15 1.2 1.25 1.3 1.35 1.4 1.45 f(x) = - 0x + 1.39 R² = 0.1 f(x) = - 0x + 1.36 R² = 0.07 f(x) = - 0x + 1.17 R² = 0
Tabung 7 Linear (Tabung 7)
Tabung 8 Linear (Tabung 8)
Tabung 9 Linear (Tabung 9)
Menit ke-Absorbansi
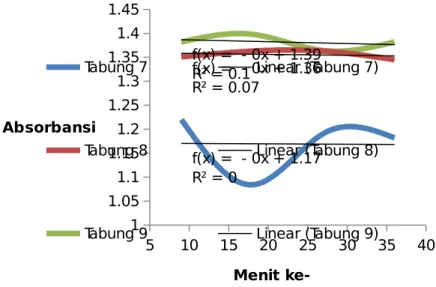
Gambar 3.3 Kurva absorbansi larutan pada tabung 2, 4, dan 6 terhadap waktu
4. Pembahasan
Enzim dehidrogenase adalah enzim yang dapat mengkatalisis reaksi transfer hidrogen (atau elektron) dari suatu substrat kepada senyawa akseptor. Senyawa – senyawa akseptor ini meliputi NAD+ (Nicotinamide Adenine Dinucleotide), NADP (Nicotinamide Adenine
Dinucleotide Phosphate), atau senyawa flavoprotein. Salah satu enzim dengan gugus prostetik flavoprotein yang termasuk enzim dehidrogenase adalah suksinat dehidrogenase (Nelson dan Cox, 2008:628). Enzim ini berfungsi untuk mengkatalisis reaksi oksidasi reversibel asam suksinat menjadi asam fumarat dalam siklus TCA (Raven dkk., 2011:133). Enzim ini juga satu-satunya enzim dalam siklus TCA atau siklus Krebs yang mengkatalisis transfer elektron langsung ke senyawa flavoprotein, yakni FAD. Reaksi enzimatik dari asam suksinat-suksinat dehidrogenase ditunjukkan pada Gambar 2.1 (Nelson dan Cox, 2008:628). Senyawa malonat merupakan salah satu inhibitor kompetitif dari reaksi ini. Struktur senyawa malonat mirip dengan suksinat, sehingga dapat berikatan dengan sisi aktif enzim suksinat dehidrogenase dan dapat menghambat siklus TCA atau disebut juga siklus Krebs. Adapun struktur kimia dari malonat ditunjukkan pada Gambar 2.2 (Nelson dan Cox, 2008:628).
Gambar 4.2 Struktur kimia malonat
Reaksi perubahan suksinat menjadi fumarat diukur dengan melakukan pengamatan terhadap senyawa buatan penerima elektron buatan yang tereduksi. Agar dapat tereduksi, jalur perpindahan elektron pada mitokondria harus dihalangi dengan menambahkan senyawa yang dapat menghambat transfer elektron dari sitokrom a3 ke akseptor terakhir, oksigen, hinggan koenzim Q. Senyawa yang memiliki kemampuan ini diantaranya natrium azida dan kalium sianida (Nelson dan Cox, 2008:714). Hal ini bertujuan agar elektron dari SDH-FADH2 dapat diambil oleh akseptor elektron buatan seperti
2,6-dichlorophenolindophenol (DCIP). Senyawa DCIP yang mendapatkan elektron dari SDH-FADH2 akan berubah warna dari biru menjadi bening. Adapun persamaan reaksinya
ditunjukkan pada Gambar 4.3.
SDH-FADH2 + DCIPoksidasi SDH-FADH+ DCIPreduksi + 2H+
Biru Bening
Gambar 4.3 Reaksi redoks antara SDH-FADH2 dan DCIP
Pada percobaan ini, digunakan kembang kol sebagai sumber suspensi mitokondria. Suspensi mitokondria sendiri adalah sumber dari enzim suksinat dehidrogenase karena reaksi oksidasi suksinat menjadi fumarat yang dikatalisis enzim ini merupakan bagian dari siklus Krebs yang terjadi di matriks mitokondria (Raven dkk., 2011:133). Kembang kol dipotong dan digerus dalam mortar dingin dersama mannitol grinding buffer dingin. Mannitol grinding buffer berfungsi untuk melarutkan sel yang mengandung mitokondria. Pasir juga digunakan saat penggerusan untuk menambah kekuatan mekanik sehingga dinding sel dan jaringan kembang kol dapat rusak dengan mudah. Setelah digerus, kembang kol diperas dan filtratnya disentrifuga. Supernatan hasil sentrifuga kemudian difilter dengan cara dekantasi. Kemudian, supernatan hasil dekantasi disentrifuga kembali agar menghasilkan pellet. Pellet kemudian diresuspensi dengan buffer uji mannitol agar mitokondria yang ada pada pellet larut.
Penentuan pengaruh konsentrasi enzim suksinat dehidrogenase terhadap reaksi oksidasi suksinat menjadi fumarat ditunjukkan pada Gambar 3.1 dan Gambar 3.2. Absorbansi dari larutan pada tabung 2, 4, dan 6 pada Gambar 3.1 menunjukkan konsentrasi DCIP yang tereduksi. Konsentrasi DCIP yang tereduksi ini secara tidak langsung menunjukkan konsentrasi suksinat, karena elektron yang mereduksi DCIP datang dari suksinat yang teroksidasi. Adapun perubahannya terhadap satuan waktu menunjukkan laju awal reaksi enzimatik oksidasi suksinat menjadi fumarat (Vo). Perubahan konsentrasi suksinat per satuan waktu ini ditunjukkan dengan nilai mutlak dari
gradien persamaan kurva hasil regresi. Tabung 2, 4, dan 6 sendiri diberikan konsentrasi suspensi mitokondria yang berbeda seperti ditunjukkan pada Tabel 2.1. Konsentrasi suspensi mitokondria sendiri merepresentasikan konsentrasi enzim suksinat dehidrogenase yang ditambahkan. Kemudian hasil yang didapat dari Gambar 3.1 dan data penambahan suspensi mitokondria dari Gambar 2.1 dihubungkan dengan Gambar 3.2.
Pada Gambar 3.2, didapat bahwa laju awal (Vo) akan berkurang dengan bertambahnya konsentrasi enzim. Menurut Tahir (2013:3), konsentrasi enzim total berbanding lurus dengan laju awal. Persamaan yang menghubungkan konsentrasi enzim dengan laju awal reaksi ditunjukkan pada Gambar 4.3.
Gambar 4.3 Persamaan laju awal reaksi enzimatik (Tahir, 2013:3)
Perbedaan hasil percobaan dengan literatur ini dapat disebabkan oleh kontaminasi senyawa-senyawa pengotor yang datang dari bagian-bagian sel kembang kol selain mitokondria yang tidak berhasil terpisahkan dengan filtrasi dan sentrifugasi. Senyawa – senyawa pengotor ini dapat mengacaukan hasil absorbansi dengan ikut bereaksi redoks dengan DCIP.
Pengaruh inhibitor kompetitif malonat dapat dilihat dari Gambar 3.3. Pada Gambar 3.3, tabung 7 merupakan larutan suspensi mitokondria yang ditambahkan senyawa malonat. Sebagai perbandingan, digunakan absorbansi tabung 6 yang memiliki konsentrasi suspensi mitokondria yang sama dengan tabung 7 (Gambar 3.1). Hasil percobaan menunjukkan bahwa laju awal reaksi pada tabung 7 yang diberi malonat lebih lambat dibandingkan dengan tabung 6 yang tidak diberi malonat. Hal ini sesuai dengan literatur, karena inhibitor kompetitif akan mengurangi laju awal reaksi.
Tabung 8 menunjukkan pengaruh natrium azida pada percobaan ini. Pada tabung 8, natrium azida tidak ditambahkan seperti pada tabung-tabung lain. Sebagai kontrol, digunakan tabung 6. Hasilnya adalah kurva yang terbentuk memiliki nilai gradien mutlak yang sangat kecil. Hal ini terjadi disebabkan tidak adanya senyawa penghalang dari jalur transfer elektron pada mitokondria, sehingga elektron dari senyawa SDH-FADH2 akan
mengalir dari sitokrom a3 ke akseptor terakhir, oksigen, hingga koenzim Q dan tidak mengalir ke DCIP. Sehingga DCIP tidak akan tereduksi dan berubah warna dari biru menjadi bening. Hal ini akan membuat spektrofotometer yang membaca DCIP yang tereduksi akan menghasilkan pembacaan yang relatif statis dan seolah-olah laju awal reaksi suksinat-fumarat pada tabung ini sangat kecil.
Tabung 9 menunjukkan pengaruh dari suksinat sebagai substrat dari reaksi oksidasi suksinat-fumarat. Tabung 9 ditambahkan semua senyawa reagen dan suspensi mitokondria kecuali suksinat. Sebagai kontrol, digunakan tabung 6. Pada Gambar 3.3, didapat hasil bahwa kurva dari absorbansi tabung 9 terhadap waktu memiliki nilai gradien mutlak yang sangat kecil, terutama bila dibandingkan dengan tabung 6. Hal ini menandakan bahwa laju awal reaksi oksidasi suksinat pada tabung 9 relatif kecil. Hal ini terjadi karena suksinat
yang menjadi donor elektron pada FAD tidak ditambahkan pada tabung 9. Dengan demikian, senyawa SDH-FADH2 yang menjadi sumber elektron untuk reduksi DCIP
hanya dapat menerima elektron dari suksinat yang sudah ada di mitokondria sebelumnya. Karena suksinat pada tabung 9 hanya berasal dari mitokondria, maka konsentrasi suksinat sebagai substrat reaksi menjadi sangat kecil. Konsentrasi substrat sendiri sebanding dengan laju awal reaksi enzimatik, sehingga konsentrasi substrat yang rendah akan menghasilkan laju awal reaksi yang rendah pula (Tahir, 2013:3). Hal ini juga ditunjukkan dalam persamaan laju awal reaksi pada Gambar 4.3.
5. Kesimpulan
a. Hasil percobaan menunjukkan terdapat hubungan antara konsentrasi enzim suksinat dehidrogenase dan laju awal reaksi oksidasi suksinat menjadi fumarat. Hubungan ini ditunjukkan pada Gambar 3.2 sebagai berikut:
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0 0 0 0 0 0 f(x) = - 0x + 0 R² = 0.62 [Enzim] Laju Awal (Vo)
b. Hasil percobaan menunjukkan terdapat hubungan antara konsentrasi suksinat dan laju awal reaksi suksinat menjadi fumarat. Konsentrasi suksinat sebagai substrat berbanding lurus dengan laju awal reaksi, seperti yang ditunjukkan pada persamaan pada Gambar 4.3 sebagai berikut:
c. Hasil percobaan menunjukkan inhibitor kompetitif malonat mempengaruhi reaksi enzimatik oksidasi suksinat yang dikatalisis enzim suksinat dehidrogenase. Pengaruh inhibitor ini adalah menurunkan laju awal reaksi suksinat menjadi fumarat.
6. Daftar Pustaka
Tahir, Iqmal. 2013.Kinetika Kimia: Kinetika Reaksi Enzimatis [PDF Document].Slide presentasi pada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas
Gadjah Mada.
Nelson, David L. dan Michael M. Cox.2008. Lehninger: Principles of Biochemistry. New York: W.H. Freeman Company.