LAPORAN RESMI PRAKTIKUM BIOKIMIA
ENZIM KATALASE
Disusun Oleh:
1. Gahar Ajeng Prawesthi (13304241064) 2. Katon Waskito Aji (13304241069) 3. Yustina Bangun R. W. (13304244002) 4. Hidayah Ina Qodriyani (13304244004) 5. Antika Nur Adi W. (13304244015) 6. Rahmayanti (13304244016)
JURUSAN PENDIDIKAN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS NEGERI YOGYAKARTA
A. JUDUL
Uji Katalase : Pengaruh Berbagai Faktor pada Aktivitas Enzim Katalase
B. TUJUAN
1. Melacak dan menunjukkan keberadaan enzim katalase dalam jaringan hewan dan tumbuhan.
2. Mengetahui pengaruh penambahan substrat pada aktivitas enzim katalase. 3. Mengetahui pengaruh pH pada aktivitas enzim katalase.
4. Mengetahui pengaruh suhu pada aktivitas enzim katalase
C. DASAR TEORI
Enzim adalah biokatalisator organik yang dihasilkan organisme hidup di dalam protoplasma, yang terdiri atas protein atau suatu senyawa yang berikatan dengan protein, berfungsi sebagai senyawa yang mempercepat proses reaksi tanpa habis bereaksi dalam suatu reaksi kimia. Enzim sangat penting dalam kehidupan, karena semua reaksi metabolisme dikatalis oleh enzim (Poedjiadi, 1994).
Enzim katalase merupakan enzim perombak hidrogen peroksida yang bersifat racun dan merupakan sisa/hasil sampingan dari metabolisme. Apabila H2O2 tidak
diuraikan oleh enzim ini, maka akan menyebabkan kematian pada sel-sel tumbuhan. Oleh sebab itu, enzim ini bekerja dengan merombak H2O2 menjadi substansi yang tidak
berbahaya,yaitu berupa air dan oksigen. Enzim ini diproduksi oleh peroksisom.Enzim katalase termasuk ke dalam golongan enzim desmolase, yaitu enzim yang dapat memecahkan ikatan C-C atau C-N pada substrat yang diikatnya
Berikut reaksi dari penguraian H2O2 oleh enzim katalase :
2H2O2 2H2O + O2
Enzim ini mengandung empat gugus heme. Heme yang terdapat pada enzim katalase juga terbentuk dari sebuah cincin protoporphyrin dan mengandung atom besi tunggal. Enzim yang mengandung empat gugus ini juga memiliki empat rantai polypeptide yang masing-masing bagian terdiri atas 500 lebih senyawa asam amino (Gaman, 1992).
Terdapat beberapa faktor yang mempengaruhi kerja enzim menurut Poedjiadi (1994) :
a. Konsentrasi enzim : pada suatu konsentrasi substrat tertentu, kecepatan reaksi bertambah dengan bertambahnya konsentrasi enzim,
b. Konsentrasi substrat : dengan konsentrasi enzim yang tetap, maka pertambahan konsentrasi substrat akan menaikan kecepatan reaksi. Akan tetapi pada batas konsentrasi tertentu, tidak terjadi kenaikan kecepatan reaksi walaupun konsentrasi substrat diperbesar. Keadaan ini telah diterangkan oleh Michaelis – Menten dengan hipotesis mereka tentang terjadinya kompleks enzim substrat
c. Suhu : pada suhu rendah reaksi kimia berlangsung lambat, sedangkan pada suhu yang lebih tinggi reaksi berlangsung lebih cepat. karena enzim adalah suatu protein, maka kenaikan suhu dapat menyebabkan terjadinya proses denaturasi dan kecepatan reaksinya pun akan menurun. Kenaikan suhu sebelum terjadinya proses denaturasi dapat menaikan kecepatan reaksi,
d. Pengaruh pH: perubahan pH lingkungan akan berpengaruh terhadap efektivitas bagian aktif enzim dalam membentuk kompleks enzim substrat. pH rendah atau pH tinggi dapat pula menyebabkan terjadinya proses denaturasi dan ini akan mengakibatkan menurunnya aktivitas enzim
e. Pengaruh inhibitor: hambatan yang dilakukan oleh inhibitor dapat berupa hambatan tidak reversibel. Hambatan tidak reversibel pada umumnya disebabkan oleh terjadinya proses destruksi atau modifikasi sebuah gugus fungsi atau lebih yang terdapat pada molekul enzim. Hambatan reversibel dapat berupa hambatan bersaing atau hambatan tidak bersaing.
Enzim dapat mengatur reaksi tertentu sehingga dalam keadaan normal tidak terjadi penyimpangan hasil reaksinya. Enzim akan kehilangan aktivitasnya karena panas, asam dan basa kuat, pelarut organik atau apa saja yang bisa menyebabkan denaturasi protein. Enzim dinyatakan mempunyai sifat yang sangat khas karena hanya bekerja pada substrat tertentu (Girinda, 1986).
D. CARA KERJA
Percobaan Kerberadaan Katalase dan Pengaruh Penambahan MnO2
Setelah pengamatan gelembung kurang lebih 10 menit, pada masing-masing sampel kembali ditambahkan H2O2 1 ml. Kemudian mengamati terbentuknya gelembung dan
melakukan tes nyala.
Mencatat jumlah gelembung dan melakukan tes nyala.
Menghubungkan masing-masing tabung reaksi dengan tabung berskala yang penuh berisi air dengan selang plastik. Tabung berskala diletakkan terbalik didalam gelas
beker berisi air.
Memasukkan masing-masing sampel pada tabung reaksi kemudian menambahkan H2O2 1 ml pada masing-masing tabung reaksi.
Mengambil sampel : Cacing dipotong menjadi tiga bagian (bagian anterior, abdomen, dan posterior), biji kacang hijau, kecambah muda dan kecambah tua.
Setelah pengamatan gelembung kurang lebih 10 menit, pada masing-masing sampel ditambahkan MnO2 1 sendok. Kemudian mengamati terbentuknya gelembung dan
melakukan tes nyala.
Mencatat jumlah gelembung dan melakukan tes nyala.
Menghubungkan masing-masing tabung reaksi dengan tabung berskala yang penuh berisi air dengan selang plastik. Tabung berskala diletakkan terbalik didalam gelas
beker berisi air.
Memasukkan masing-masing sampel pada tabung reaksi kemudian menambahkan H2O2 1 ml pada masing-masing tabung reaksi.
Mengambil sampel : Cacing dipotong menjadi tiga bagian (bagian anterior, abdomen, dan posterior), Biji kacang hijau, kecambah muda dan kecambah tua.
Percobaan pengaruh pH terhadap Aktivitas Katalase
Percobaan Pengaruh Suhu terhadap Aktivitas Katalase
Mencatat jumlah gelembung dan melakukan tes nyala.
Menghubungkan masing-masing tabung reaksi dengan tabung berskala yang penuh berisi air dengan selang plastik. Tabung berskala diletakkan terbalik didalam gelas
beker berisi air.
Menambahkan HCl (pH 1) dan NaOH (pH 9) pada masing-masing tabung Memasukkan masing-masing sampel pada tabung reaksi kemudian menambahkan
H2O2 1 ml pada masing-masing tabung reaksi.
Mengambil sampel : Cacing dipotong menjadi tiga bagian (bagian anterior, abdomen, dan posterior), biji kacang hijau, kecambah muda dan kecambah tua.
Mencatat jumlah gelembung dan melakukan tes nyala.
Menghubungkan masing-masing tabung reaksi dengan tabung berskala yang penuh berisi air dengan selang plastik. Tabung berskala diletakkan terbalik didalam gelas
beker berisi air.
Memasukkan masing-masing sampel pada tabung reaksi kemudian menambahkan H2O2 1 ml pada masing-masing tabung reaksi.
Memasukkan masing-masing sampel pada tabung reaksi kemudian dimasukkan kedalam air es (untuk perlakuan suhu 50C) dan masukkan kedalam waterbath
(perlakuan suhu 810C). Dilakukan bergantian untuk masing-masing perlakuan.
Mengambil sampel : Cacing dipotong menjadi tiga bagian (bagian anterior, abdomen, dan posterior), biji kacang hijau, kecambah muda dan kecambah tua.
E. HASIL
Table Hasil Percobaan Enzim Katalase
Sampel Perlakuan penambahan H2O2
Organisme Bagian/Fase H2O2 H2O2+ H2O2 Jumlah Gelembung Nyala Api Jumlah Gelembung Nyala Api Cacing Anterior 149 +++ 250 ? Posterior 50 +++ 228 ? Abdomen 73 ++ 180 ? Kecambah Biji 28 +++ 25 ? Muda 18 +++ 20 ? Tua 21 ++ 26 ?
Tabel 1. Keberadaan Katalase dan Pengaruh Penambahan H2O2 pada Katalase
Sampel Perlakuan penambahan MnO2
Organisme Bagian/Fase H2O2 H2O2+MnO2
Jumlah Gelembung Nyala Api Jumlah Gelembung Nyala Api Cacing Anterior 73 ++ 0 - Posterior 48 +++ 14 +++ Abdomen 81 +++ 0 - Kecambah Biji 44 ++ 77 +++ Muda 56 + 22 ++ Tua 72 + 94 ++
Tabel 2. Keberadaan Katalase dan Pengaruh Penambahan MnO2 pada Katalase
Sampel pH Organisme Bagian/Fase 1 9 Jumlah Gelembung Nyala Api Jumlah Gelembung Nyala Api Cacing Anterior 65 +++ 64 +++ Posterior 62 ++ 60 +++ Abdomen 57 ++ 63 +++ Kecambah Biji 21 + 5 + Muda 146 +++ 52 +++ Tua 124 ++ 24 ++
Tabel 3. Pengaruh pH pada Aktivitas Enzim Katalase
Sampel Suhu
Organisme Bagian/Fase 5oC 81 oC
Jumlah Gelembung
Nyala Api Jumlah Gelembung Nyala Api Cacing Anterior 166 + 0 - Posterior 10 ++ 0 -
Abdomen 34 + 0 -
Kecambah
Biji 17 + 0 -
Muda 60 + 0 -
Tua 41 + 0 -
Tabel 4. Pengaruh Suhu pada Aktivitas Enzim Katalase
F. PEMBAHASAN
Pada kegiatan topik pertama yang bertujuan mengetahui pengaruh penambahan H2O2 dan substrat H2O2 pada aktivitas enzim katalase, di dapatkan hasil pada percobaan
menggunakan jaringan hewan yaitu cacing. Dari percobaan pada cacing yang ditambahkan H2O2, terdapat sejumlah gelembung muncul. Ketika gelembung sudah tidak
muncul lagi, kemudian ditambahkan 1 ml H2O2. Setelah penambahan 1 ml H2O2
gelembung dalam tabung reaksi menjadi lebih banyak. Saat di tes nyala menghasilkan hasil yang positif. Begitu pula pada percobaan menggunakan jaringan tumbuhan yaitu biji Kacang hijau, biji kacang hijau yang ditambah H2O2 terdapat gelembung muncul.
Ketika gelembung sudah tidak muncul lagi, kemudian ditambahkan 1 ml H2O2. Setelah
penambahan 1 ml H2O2 ternyata gelembung yang muncul lebih sedikit dan saat di tes
nyala menghasilkan hasil yang positif. Namun, pada percobaan kecambah yang ditambah H2O2, didapatkan jumlah gelembung lebih sedikit daripada ketika ditambahkan 1 ml
H2O2. Setelah penambahan 1 ml H2O2 di dapatkan jumlah gelembung yang lebih banyak
dan saat di tes nyala menghasilkan hasil yang positif.
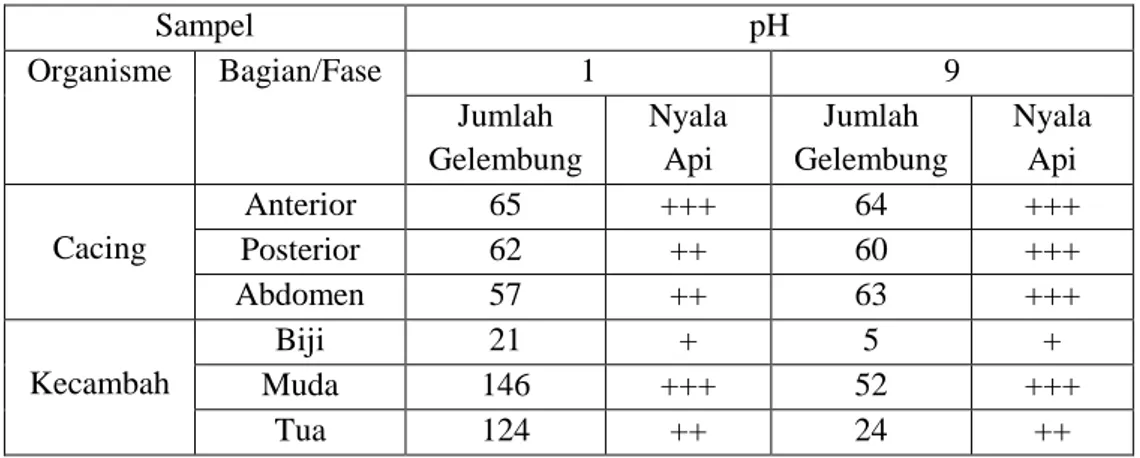
Grafik 1. Keberadaan Katalase dan Pengaruh Penambahan H2O2 pada Katalase
Dari percobaan tersebut, dapat dilihat munculnya gelembung. Banyaknya gelembung merupakan tanda dari adanya enzim katalase yang dapat menguraikan H2O2.
0 50 100 150 200 250 300
Grafik Hubungan Penambahan Substrat H2O2
H2O2
H2O2+ H2O2
Semakin banyak gelembung yang terbentuk maka semakin banyak dan cepat pula aktifitas enzimnya. Enzim katalase akan menguaraikan H2O2, menjadi air (H2O) dan
oksigen (O2). Penguraian menjadi dapat di lihat tandanya dengan timbulnya gelembung.
Timbulnya hasil positif terhadap tes nyala juga bisa menjadi indikator bahwa oksigen di hasilkan pada percobaan ini. Dari hasil di atas dapat kita lihat bahwa Enzim katalase tetap bekerja pada jaringan hewan maupun tumbuhan, dan tetap bekerja saat setelah di tambahkan H2O2, namun terjadinya gelembung lebih banyak pada jaringan
hewan.
Pada percobaan selanjutnya adalah penambahan MnO2 yang bertujuan untuk
mengetahui pengaruh penambahan MnO2 dan substrat pada aktivitas enzim katalase.
Pada pengujian pada bagian tubuh cacing + MnO2 + H2O2, ternyata tidak di dapatkan
jumlah gelembung satupun dan setelah dilakukan tes nyala api hasilnya adalah negatif, dimana bara api padam setelah berada dalam tabung reaksi. Dan pada saat pengujian menggunakan sampel biji kacang hijau + MnO2 + H2O2, mengalami peningkatan jumlah
gelembung dan saat di uji nyala api menghasilkan hasil yang positif. Selanjutnya pada percobaan kedua pada kecambah muda+ MnO2 + H2O2, di dapatkan penurunan jumlah
gelembung dari saat belum ditambahkan MnO2 dan ketika di lakukan pengujian nyala api
menghasilkan hasil yang positif.
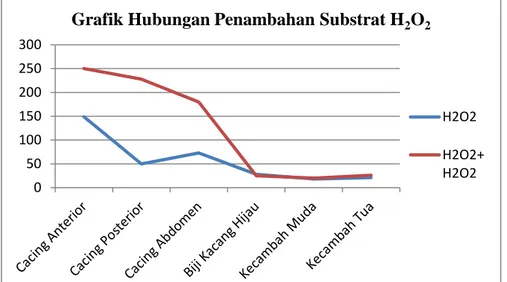
Grafik 2. Keberadaan Katalase dan Pengaruh Penambahan MnO2 pada Katalase
Berdasarkan data sebelum penambahan MnO2 dan sesudah penambahan terjadi
perbedaan jumlah gelembung yang dihasilkan juga volumenya, pada cacing bagian abdomen dan anterior tidak terdapat gelembung setelah penambahan MnO2 dan pada saat
pengujian pada cacing bagian posterior gelembung yang dihasilkan lebih sedikit 0
20 40 60 80
Grafik Hubungan Penambahan Substrat MnO2
H2O2
H2O2+ MnO2
dibanding sebelum ditambahkan MnO2 sebanyak 14 gelembung, hal tersebut
membuktikan bahwa dengan penambahan MnO2 akan mempengaruhi kerja enzim
katalase. Terlihat juga pada tumbuhan kacang hijau, gelembung yang dihasilkan juga berbeda sebelum dan sesudah penambahan MnO2 hal tersebut juga membuktikan bahwa
adanya MnO2 akan mempengaruhi kerja enzim. Percobaan ini sesuai dengan teori yang
menyebutkan bahwa kerja enzim dipengaruhi oleh PH, suhu, konsentrasi enzim, konsentrasi substrat. Dan disini MnO2 sebagai salah satu jenis substrat dan penambahan
MnO2 pada enzim akan mempengaruhi kerja enzim.
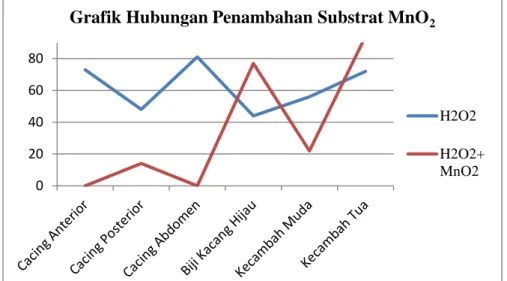
Selanjutnya untuk mengetahui pengaruh pH terhadap aktivitas enzim katalase maka perlakuan diberikan dengan perbedaan besarnya pH, sehingga diperoleh pH masing-masing pH 1, pH 7, dan pH 9. Berdasarkan percobaan yang telah dilakukan dapat dilihat pada grafik hubungan antara pH dengan kerja enzim katalase. Pada pH 1 yang bersifat asam volume gelembung yang dihasilkan sedikit begitu juga pada pH 9 yang bersifat basa volume gelembung yang dihasilkan pun sedikit. Hal ini karena enzim terdenaturasi atau mengalami kerusakan pada pH yang ekstrim yaitu pH yang terlalu tinggi atau basa dan pH terlalu rendah atau asam. Sedangkan pada pH 7 atau pH netral volume gelembung yang dihasilkan maksimal atau banyak. Hal ini menunjukkan bahwa enzim katalase bekerja secara optimal pada pH 7. Percobaan ini sesuai dengan teori.
Grafik 3. Pengaruh pH pada Aktivitas Enzim Katalase
Menurut Poedjiadi (1994), perubahan pH lingkungan akan berpengaruh terhadap efektivitas bagian aktif enzim dalam membentuk kompleks enzim substrat. pH rendah atau pH tinggi dapat pula menyebabkan terjadinya proses denaturasi dan ini akan mengakibatkan menurunnya aktivitas enzim Enzim katalase dapat berkerja dengan baik
0 40 80 120 160
Grafik Pengaruh pH terhadap Aktivitas Katalase
1 7 9
hanya pada pH optimum atau netral yaitu pH 7. Jika pada larutan asam, maka enzim katalase akan rusak dan tidak dapat bekerja. Jika pada basa pun enzim akan kehilangan keefektivitasan kerjanya. Namun pada suasana asam lebih merusak enzim katalase dari pada suasana basa.
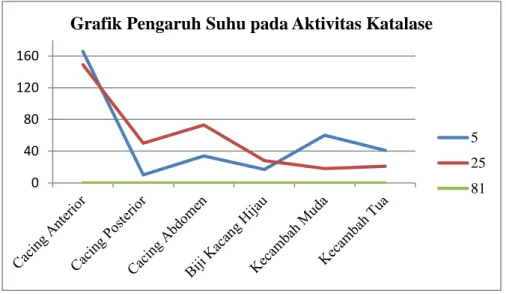
Percobaan terakhir adalah untuk mengetahui pengaruh suhu terhadap aktivitas enzim katalase. Dalam percobaan ini digunakan suhu 5°C, 25°C, dan 81°C. Kecenderungan semakin tinggi suhu aktivitas katalase makin menurun. Dari percobaan yang telah dilakukan, terlihat dari grafik jika semakin tinggi suhu, aktivitas enzim katalase semakin menurun. Terutama jika suhu itu sangat tinggi (di atas 70°C) maka yang terjadi adalah tidak adanya aktivitas enzim sama sekali, bias dilihat dari jumlah gelembung yang muncul adalah nol, tidak muncul gelembung sama sekali. Sedangkan pada suhu rendah (5°C) aktivitas enzim berlangsung sangat lambat.
Grafik 4. Pengaruh Suhu pada Aktivitas Enzim Katalase
Hal ini sesuai dengan Poedjiadi (1994) bahwa pada suhu yang lebih tinggi reaksi berlangsung lebih cepat, namun karena enzim adalah suatu protein, pada suhu tertentu (maksimum) justru dapat menyebabkan terjadinya proses denaturasi dan kecepatan reaksinya pun akan menurun. Kenaikan suhu sebelum terjadinya proses denaturasi dapat menaikan kecepatan reaksi, yang mengatakan bahwa semakin tinggi suhu makin tinggi pula aktivitas enzim yang terjadi. Perbedaan ini dapat disebabkan karena waktu percobaan yang dilakukan berbeda antara perlakuan satu dengan yang lain.
0 40 80 120 160
Grafik Pengaruh Suhu pada Aktivitas Katalase
5 25 81
G. KESIMPULAN
Aktivitas enzim katalase dapat dipengaruhi oleh beberapa factor, yaitu konsentrasi substrat, pH, dan suhu.
1. Pada jaringan hewan dan tumbuhan terdapat enzim katalase yang ditunjukkan adanya gelembung saat pada jaringan hewan maupun tumbuhan ditambahkan H2O2.
2. Penambahan substrat pada aktivitas enzim katalase akan menyebabkan reaksi berlangsung lebih cepat, namun pada konsentrasi tertentu katalase akan mengalami titik jenuh dan tidak terdapat peningkatan kecepatan reaksi.
3. Aktivitas enzim katalase bekerja dengan maksimal pada pH optimal yaitu pH 7 atau pH netral.
4. Enzim katalase dapat bekerja pada suhu optimum, jika pada suhu rendah, reaksi akan berlangsung lambat, namun jika suhu terlalu tinggi maka enzim justru terdenaturasi.
H. DAFTAR PUSTAKA
Gaman, M. 1992. Ilmu Pangan, Penghantar Ilmu Pangan, Nutrisi dan Mikrobiologi. Edisi II. Yogyakarta: Gadjah Mada University Press
Girindra, A. 1986. Enzim dalam Biokimia 1. Jakarta: Gramedia. Poedjiadi. (1994). Dasar-dasar Biokimia. Jakarta : UI Press.