I PENDAHULUAN
Bab ini akan menguraikan mengenai : (1) Latar Belakang Percobaan, (2) Tujuan Percobaan, (3) Prinsip Percobaan, dan (4) Reaksi Percobaan.
1.1. Latar Belakang Percobaan
Enzim adalah biokatalisator organik yang dihasilkan organisme hidup di dalam protoplasma, yang terdiri atas protein atau suatu senyawa yang berikatan dengan protein, berfungsi sebagai senyawa yang mempercepat proses reaksi tanpa habis bereaksi dalam suatu reaksi kimia. (Anonim, 2013)
Enzim biasanya sangat spesifik terhadap reaksi yang ia kataliskan maupun terhadap substrat yang terlibat dalam reaksi. Bentuk, muatan dan katakteristik hidrofilik/hidrofobik enzim dan substrat bertanggung jawab terhadap kespesifikan ini. Enzim juga dapat menunjukkan tingkat stereospesifisitas, regioselektivitas, dan kemoselektivitas yang sangat tinggi. (Anonim, 2013)
1.2. Tujuan Percobaan
Untuk mengetahui karakteristik kekhsan enzim terhadap substrat.
1.3. Prinsip Percobaan
Berdasarkan sisi aktif pada enzim yang sesuia dengan bentuk substrat sehingga membentuk kompleks enzim substrat.
1.4. Reaksi Percobaan
Gambar 1. Reaksi Percobaan Uji Spesifikasi Enzim
II METODE PERCOBAAN
Bab ini akan menguraikan mengenai : (1) Bahan yang Digunakan, (2) Pereaksi yang Digunakan, (3) Alat yang Digunakan, dan (4) Metode Percobaan.
2.1. Bahan yang Digunakan
Bahan yang digunakan dalam Uji Spesifikasi Enzim adalah Pisang, Kacang Koro, dan Pear. Dengan substrat urea, katekol, dan fenol.
2.2. Alat yang Digunakan
Alat yang digunakan dalam Uji Spesifikasi Enzim adalah pipet tetes, dan tabung reaksi.
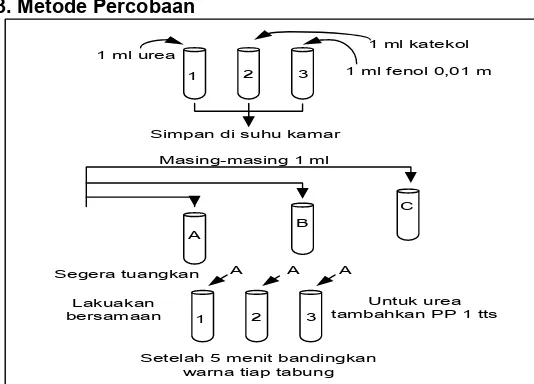
2.3. Metode Percobaan
1 ml urea 1 ml katekol
1 ml fenol 0,01 m
Simpan di suhu kamar Masing-masing 1 ml
A B
C
1 2 3
1 2 3
Segera tuangkan Lakuakan bersamaan
A A A
Untuk urea tambahkan PP 1 tts
Setelah 5 menit bandingkan warna tiap tabung
III HASIL PENGAMATAN
Bab ini akan menguraikan mengenai : (1) Hasil Pengamatan dan, (2) Pembahasan.
3.1. Hasil Pengamatan
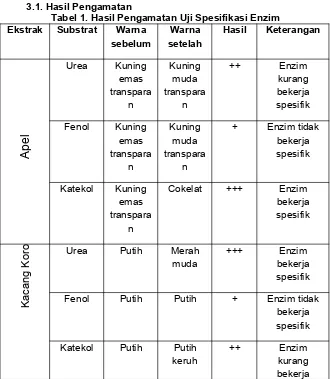
Tabel 1. Hasil Pengamatan Uji Spesifikasi Enzim
Ekstrak Substrat Warna
Fenol Putih Putih + Enzim tidak
spesifik
P
e
a
r
Urea Putih keruh
Putih keruh
++ Enzim
kurang bekerja spesifik Katekol Cokelat
muda
Cokelat tua
+++ Enzim
bekerja spesifik Fenol Putih
keruh
Putih keruh
Gambar 3. Hasil Pengamatan Uji Spesifikasi Enzim
3.2. Pembahasan
Menurut kuhne (1878), enzim berasal dari kata in + zyme yang berarti sesuatu didalam ragi.Berdasarkan penelitian maka dapat disimpulkan bahwa enzim adalah suatu protein yang berupa molekul – molekul besar, yang berat molekulnya adalah ribuan. Sebagai contoh adalah enzim katalase berat molekulnya 248.000 sedang enzim urese beratnya adalah 438.000.Pada enzim terdapat bagian protein yang tidak tahan panas yaitu disebut dengan apoenzim, sedangkan bagian yang bukan protein adalah bagian yang aktif dan diberi nama gugus prostetik, biasanya berupa logam seperti besi, tembaga , seng atau suatu bahan senyawa organic yang mengandung logam.Apoenzim dan gugus prostetik merupakan suatu kesatuanyang disebut holoenzim, tetapi ada juga bagian enzim yang apoenzim dan gugus prospetiknya tidak menyatu. Contoh koenzim adalah vitamin atau bagian vitamin (misalnya : vitamin B1, B2, B6, niasin dan biotin). (Kartasapoetra, 1994)
substansi yang mempercepat reaksi tetapi pada hasil reaksi, mengalami inaktivasi. (Gaman & Sherrington, 1994)
Dalam tubuh manusia terjadi bermacam-macam proses biokimia dan tiap proses menggunakan katalis enzim tertentu. Untuk membedakannya maka tiap enzim diberi nama. Secara umum nama tiap enzim disesuaikan dengan nama substratnya, dengan penambahan ‘ase’ dibelakangnya. Substrat adalah senyawa yang bereaksi dengan bantuan basa kation maupun anion. (Akhyasrinuki, 2011)
Keunggulan enzim atau biokatalis, dikatakan bahwa enzim dapat meningkatkan kecepatan suatu reaksi enzimatis secara spesifik. Suatu enzim hanya dapat mempengaruhi suatu reaksi khusus. Kehususan atau spesifikasi suatu enzim ditentukan oleh tapak ko-enzim atau cetakan yang ada pada kompleks enzim. Kesesuaian cetakan ini tergantung pada: a. Struktur molekul atau struktur gugus radikal yang ada pada
kompleks enzim, sehingga suatu enzim hanya berkenan pada satu substrat saja, kekhususan atau spesifikasi ini disebut spesifikasi absolut.
b. Gugus atau radikal residu asam amino pada kompleks enzim akan berkaitan dengan substrat yang memiliki gugus yang sesuai gugus residu pada kompleks enzim, umumnya enzim yang terdiri dari perotein steruktur primer, kehususan atau spesifikasi seperti ini disebut spesifikasi sisi aktif (pusat aktif)
spesifikasi seperti ini disebut spesifikasi struktur stereo atau ruang. (Darmawan, 2009)
Oleh Commision on Enzyme of the International Union of Biochemistry, enzim dibagi dalam enam golongan besar. Penggolongan ini didasarkan atas reaksi kimia dimana enzim memegang peranan.
1. Golongan I Oksidureduktase
Enzim-enzim yang termasuk golongan ini dapat dibagi dalam dua bagian yaitu dehidrogenase dan oksidase. Dehidrogease bekerja pada reaksi-reaksi dehidrogenase yeitu, reaksi pengambilan atom hidrogen dari suatu senyawa (donor). Hidrogen yang dilepas diterima oleh senyawa lain (akseptor). Reaksi pembentukkan aldehida dari alkohol adalah contoh reaksi dehidrogenase. (Poedjiadi, 1994)
Glutamat dehidrogenase adalah contoh enzim dehidrogenase yang bekerja terhadap asam glutamate sebagai substrat. Enzim ini banyak terdapat pada mitokondria dalam semua sel jaringan. (Poedjiadi, 1994)
Enzim-enzim oksidase juga bekerja sebagai katalis pada reaksi pengambilan hidrogen dari suatu substrat. Xantin oksidase ialah enzim yang bekerja pada reaksi oksidasi xantin menjadi asam urat. Contoh lain enzim oksidase yang bekerja sebagai katalis adalah enzim pada reaksi oksidasi asam-asam amino. Glisin oksidase adalah enzim pada reaksi oksidasi glisin menjadi asam glikosilat. (Poedjiadi, 1994)
2. Golongan II Transferase
Enzim yang termasuk golongan ini bekerja sebagai katalis pada reaksi pemindahan suatu senyawa kepada senyawa lain. Beberapa contoh enzim yang termasuk golongan ini, ialah metil transferase, hidroksi metil transferase, karboksi ltransferase, asiltransferase, dan amino transferase atau sering disebut juga transaminase. (Poedjiadi, hlm: 153, 2005).
Enzim transaminase bekerja pada reaksi transaminasi yaitu suatu reaksi pemindahan gugus amino dari suatu asam amino kepada senyawa lain. (Poedjiadi, 1994)
3. Golongan III HIdrolase
yaitu yang memecah ikatan ester, memecah glikosida, dan yang memecah ikatan peptide. Beberapa enzim sebagai contoh ialah esterase, lipase, fosfatase, amylase, amino peptidase, karboksi peptidase, pepsin, tripsin, dan kimotripsin. (Poedjiadi, 1994)
Esterase ialah enzim yang memecah ikatan ester dengan cara hidrolisis. Esterase yang terdapat dalam hati dapat memecah ester sederhana, misalnya etil butirat menjadi etanol dan asam butirat. Lipase ialah enzim yang memecah ikatan ester pada lemak, sehingga terjadi asam lemak dan gliserol. Fosfatase adalah enzim yang dapat memecah ikatan fosfat pada suatu senyawa, misalnya glukosa 6-fosfat dapat dipecah menjadi glukosa dan asam fosfat. (Poedjiadi, 1994)
Ada dua macam peptidase, yaitu endopeptidase dan eksopeptidase. Endopeptidase memecah protein pada tempat-tempat tertentu dalam molekul protein dan biasanya melepaskan asam amino yang memiliki gugus –COOH bebas pada ujung molekul protein, sedangkan amino peptidase dapat melepaskan asam amino pada ujung lain yang memiliki gugus –NH2 bebas. (Poedjiadi, 1994)
4. Golongan IV Liase
Enzim yang termasuk golongan ini mempunyai peranan penting dalam reaksi pemisahan suatu gugus dari suatu substrat (bukan cara hidrolisis) atau sebaliknya. Contoh enzim golongan ini antara lain dekarboksilase, aldolase, dan hidratase. (Poedjiadi, 1994)
Piruvat dekarboksilase adalah enzim yang bekerja pada reaksi dekarboksilasi asam piruvat dan menghasilkan aldehida. Enzim aldolase bekerja pada reaksi pemecahan molekul fruktosa 1,6-difosfat menjadi dua molekul triosa yaitu dihidroksi aseton fosfat dan gliseraldehida-3-fosfat. Adapun enzim fumarat ghidratase berperan dalam reaksi penggabungan satu molekul H2O kepada molekul asam
5. Golongan V Isomerase
Enzim yang termasuk golongan ini bekerja pada reaksi perubahan intramolekuler, misalnya reaksi perubahan glukosa menjadi fruktosa, perubahan senyawa L menjadi senyawa D, senyawa sis menjadi senyawa trans dan lain-lain. (Poedjiadi, 1994)
Contoh enzim yang termasuk golongan isomerase antara lain ialah ribolosafosfat epimerase dan glukosafosfat isomerase. Enzim ribulosa epimerase merupakan katalis bagi reaksi epimerisasi ribulosa. (Poedjiadi, 1994)
6. Golongan VI Ligase
Enzim yang termasuk golongan ini bekerja pada reaksi-reaksi penggabungan dua molekul. Oleh karenanya enzim-enzim tersebut juga dinamakan sintetase. Ikatan yang terbentuk dari penggabungan tersebut adalah ikatan O, C-S, C-N atau C-C. Contoh enzim golongan ini antara lain ialah glutamin sintetase dan piruvat karboksilase. Enzim glutamin sintetase yang terdapat dalam otak dan hati merupakan katalis dalam reaksi pembentukkan glutamin dari asam glutamate. (Poedjiadi, 1994)
Urea adalah senyawa turunan dari asam karboksilat yang mengikat gugus amida.Urea disintesis di industri dari amonia dan karbon dioksida untuk digunakan sebagai bahan dalam sintesa polimer, obat–obatan, sumber nitrogen non-protein bagi ternak ruminansia dan untuk pupuk nitrogen. (Novianti, 2011)
Katekol adalah suatu o-difenol yang mudah diserang oleh fenolase, dan hanya reaksi yang dikatalisa oleh katekolase. Pembentukan quinon ditentukan oleh keberadaan enzim dan oksigen. Sekali reaksi berlangsung maka reaksi lanjutan berjalan secara spontan, dan keadaan demikian tergantung pada keberadaan fenolase dan oksigen. Kebanyakan teori pencoklatan menggunakan dasar reaksi pembentukan melanin berwarna coklat. (Asfar, 2011)
Substrat urease menggunakan 1 tetes PP yang berfungsi sebagai indikator, sehingga enzim terlihat aktif bekerja spesifik, PP dapat diganti dengan menggunakan methilens blue, ataupun Puchsin basa karena sama-sama bersifat basa, sedangkan tidak dapat menggunakan indikator metil merah karena substrat urea dan metil merah bersifat asam sehingga tidak dapat terlihat enzim bekerja secara spesifik.
Waktu yang diberikan setelah pencampuran yaitu sebesar 5 menit, ini dibagi menjadi dua macam yaitu, 5 menit pertama yang berfungsi agar substrat beradaptasi dengan lingkungan, dan 5 menit kedua yang berfungsi agar substrat bereaksi secara sempurna.
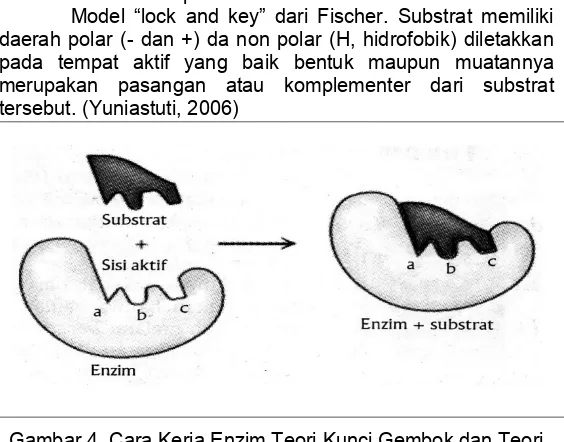
Model “lock and key” dari Fischer. Substrat memiliki daerah polar (- dan +) da non polar (H, hidrofobik) diletakkan pada tempat aktif yang baik bentuk maupun muatannya merupakan pasangan atau komplementer dari substrat tersebut. (Yuniastuti, 2006)
Gambar 4. Cara Kerja Enzim Teori Kunci Gembok dan Teori Kecocokan Induksi.
maupun karena terlalu kecil tidak dapat terikat pada tempat aktif. (Yuniastuti, 2006)
IV KESIMPULAN DAN SARAN
Bab ini akan menguraikan mengenai : (1) Kesimpulan dan (2) Saran.
4.1. Kesimpulan
Dari hasil percobaan Uji Spesifikasi Enzim yang telah dilakukan dapat disimpulkan bahwa ekstrak apel enzimnya bekerja spesifik pada substrat katekol, ekstrak kacang koro enzimnya bekerja spesifik pada substrat ureal dan ekstrak pear enzimnya bekerja spesifik pada substrat katekol.
4.2. Saran
DAFTAR PUSTAKA
Akhyasrinuki. 2011. Definisi dan Fungsi Enzim, Pengertian
Koenzim dan Sifat-sifat Khusus.
http://id.shvoong.com/writing-and-speaking/2150299-definisi-dan-fungsi-enzim-pengertian/. Diakses: 27 April 2014
Anonim. 2014. Enzim. http://id,wikipedia.org. Diakses: 27 April 2014
Asfar, Muhammad. 2011. Pengertian Urea. muhammadasfar.blogspot.com/2011_01_01_archive.h tml. Diakses : 27 April 2014
Darmawan, firman. 2009. Spesifikasi Enzim. http://firman-darmawan.blogspot.com. Diakses: 27 April 2014 Gaman, P.M & K.B. Sherrington. 1994. Ilmu Pangan,
Pengantar Ilmu Pangan, Nutrisi dan Mikrobiologi. Universitas Gadjah Mada press: Yogyakarta
Kartasapoetra, A,G. 1994. Teknologi Penangan Pasca Panen. Rineka Cipta : Jakarta
Musyaffa, Rifani. 2010. Senyawa Golongan Fenol. http://ripanimusyaffalab.blogspot.com/2010/02/identifik asi-gol-fenol-farmasi.html. Diakses: 27 April 2014 Novianti, Novi. 2011. Urea Formaldehid.
http://nova- novianti.blogspot.com/2011/04/laporan-praktikum-urea-formaldehid.html. Diakses: 27 April 2014
Poedjadi, Anna, dkk. 1994. Dasar-dasar Biokimia. UI-Press: Jakarta
LAMPIRAN
APEL
Kandungan Gizi :
Informasi Gizi per 1 sedang (diameter 7 cm) (kira-kira 3 per 450 g)
Energi 301 kj
72 kkal
Lemak 0,23 g
Lemak Jenuh 0,039 g Lemak tak Jenuh
Ganda 0,07 g
Lemak tak Jenuh
Tunggal 0,01 g
Kolesterol 0 mg
Protein 0,36 g
Karbohidrat 19,06 g
Serat 3,3 g
Gula 14,34 g
Sodium 1 mg
KACANG KORO
Kandungan Gizi :
Informasi Gizi per 1porsi,70g (70g)
Energi 1423 kj
340 kkal
Lemak 15 g
Lemak Jenuh 7 g
Protein 17 g
Karbohidrat 36 g
Serat 5 g
Gula 10 g
PEAR
Kandungan Gizi :
Informasi Gizi per 1 sedang (sekitar 2-1/2 per
450 g)
Energi 402 kj
96 kkal
Lemak 0,2 g
Lemak Jenuh 0,01 g Lemak tak Jenuh
Ganda 0,048 g
Lemak tak Jenuh
Tunggal 0,043 g
Kolesterol 0 mg
Protein 0,63 g
Karbohidrat 25,66 g
Serat 5,1 g
Gula 16,27 g
Sodium 2 mg