BAB I PENDAHULUAN
BAB I PENDAHULUAN
A.Latar Belakang
A.Latar Belakang
Sampai saat ini sebagian besar material rekayasa terdiri dari campuran Sampai saat ini sebagian besar material rekayasa terdiri dari campuran fasa-fasa,misalnya : Baja, solder, semen portland, batu gerinda, cat, dan fiber glass. fasa,misalnya : Baja, solder, semen portland, batu gerinda, cat, dan fiber glass. Campuran dari dua atau lebih fasa dalam satu material memungkinkan terjadinya Campuran dari dua atau lebih fasa dalam satu material memungkinkan terjadinya interaksi antara fasa.Diagram fase sangat membantu dalam mengatur dan meringkas interaksi antara fasa.Diagram fase sangat membantu dalam mengatur dan meringkas eksperimental,
eksperimental, data data pengamatan serpengamatan serta dapat ta dapat digunakan untudigunakan untuk membuat k membuat prediksiprediksi tentang proses-proses yang melibatkan reaksi kimia antara fase. Kekuatan listrik atau tentang proses-proses yang melibatkan reaksi kimia antara fase. Kekuatan listrik atau medan magnet dapat diterapkansebagai pengganti suhu, tekanan, dan komposisi medan magnet dapat diterapkansebagai pengganti suhu, tekanan, dan komposisi lainnya. Untuk memberikan informasitentang struktur dan fasa-fasa kesetimbangan lainnya. Untuk memberikan informasitentang struktur dan fasa-fasa kesetimbangan khususnya pada dua komponen unsur atautemperatur, maka dapat digunakan satu khususnya pada dua komponen unsur atautemperatur, maka dapat digunakan satu jenis
jenis plot plot diagradiagram m fase fase temperatemperatur tur terhadap terhadap konsentrkonsentrasi asi relatif relatif dari dari dua dua zatzat dalam biner campuranyang disebut diagram fase biner. Oleh karena itu, disusunlah dalam biner campuranyang disebut diagram fase biner. Oleh karena itu, disusunlah makalah tentang diagram fasa dengan spesifikasi diagram fasa biner ini agar dapat makalah tentang diagram fasa dengan spesifikasi diagram fasa biner ini agar dapat mempermudah pembacaan fasa kesetimbangan paduan dua komponen unsur.
mempermudah pembacaan fasa kesetimbangan paduan dua komponen unsur.
B.Tujuan
B.Tujuan
Tujuan dari pembuatan makalah ini adalah sebagai berikut : Tujuan dari pembuatan makalah ini adalah sebagai berikut :
Mengetahui gambaran umum dan spesifikasi Mengetahui gambaran umum dan spesifikasi mengenai diagram fasa.mengenai diagram fasa.
Memahami dan mengenal grafik Diagram Fasa dari CuNi,PbSn,CuZn,FeFeMemahami dan mengenal grafik Diagram Fasa dari CuNi,PbSn,CuZn,FeFe 33
MeMengngetetahahui ui klasifikklasifikasi diagasi diagram keram kesetisetimbambangan fangan fasasa
BAB II PEMBAHASAN
BAB II PEMBAHASAN
1.Diagram Fasa
1.Diagram Fasa
Dalam kimia fisik, mineralogi, dan teknik material, diagram fase adalah sejenis grafik Dalam kimia fisik, mineralogi, dan teknik material, diagram fase adalah sejenis grafik yang digunakan untuk menunjukkan kondisi kesetimbangan antara fase-fase yang yang digunakan untuk menunjukkan kondisi kesetimbangan antara fase-fase yang berbeda dari suatu zat yang sama. Dalam matematika dan fisika, diagram fase juga berbeda dari suatu zat yang sama. Dalam matematika dan fisika, diagram fase juga mempunyai arti sinonim dengan ruang fase.Pada umumnya logam tidak berdiri mempunyai arti sinonim dengan ruang fase.Pada umumnya logam tidak berdiri sendiri atau keadaan murni, tetapi lebih banyak dalam keadaan dipadu atau logam sendiri atau keadaan murni, tetapi lebih banyak dalam keadaan dipadu atau logam paduan dengan kandungan unsur-unsur tertentu sehingga struktur yang terdapat paduan dengan kandungan unsur-unsur tertentu sehingga struktur yang terdapat dalam keadaan setimbang pada temperatur dan tekanan tertentu akan berlainan. dalam keadaan setimbang pada temperatur dan tekanan tertentu akan berlainan. Kombinasi dua unsur atau lebih yang membentuk paduan logam akan menghasilkan Kombinasi dua unsur atau lebih yang membentuk paduan logam akan menghasilkan sifat yang berbeda dari logam asalnya. Tujuan pemaduan adalah untuk memperbaiki sifat yang berbeda dari logam asalnya. Tujuan pemaduan adalah untuk memperbaiki sifat logam.Sifat yang diperbaiki adalah kekuatan, keuletan, kekerasan, ketahanan sifat logam.Sifat yang diperbaiki adalah kekuatan, keuletan, kekerasan, ketahanan korosi, ketahanan aus, ketahanan lelah, dll.
korosi, ketahanan aus, ketahanan lelah, dll.
Fasa pada suatu material didasarkan atas daerah yang berbeda dalam struktur atau Fasa pada suatu material didasarkan atas daerah yang berbeda dalam struktur atau komposisi dari daerah lainnya. Fasa merupakan bagian homogen dari suatu sistem komposisi dari daerah lainnya. Fasa merupakan bagian homogen dari suatu sistem yang memiliki sifat fisik dan kimia yang seragam. Untuk mempelajari paduan yang memiliki sifat fisik dan kimia yang seragam. Untuk mempelajari paduan dibuatlah kurva yang menghubungkan antara fasa, komposisi dan temperatur.
dibuatlah kurva yang menghubungkan antara fasa, komposisi dan temperatur.
Diagram fasa adalah suatu grafik yang merupakan representasi tentang fasa-fasa yang Diagram fasa adalah suatu grafik yang merupakan representasi tentang fasa-fasa yang ada dalam suatu material pada variasi temperatur, tekanan dan komposisi. Pada ada dalam suatu material pada variasi temperatur, tekanan dan komposisi. Pada umumnya diagram fasa dibangun pada keadaan kesetimbangan (kondisinya adalah umumnya diagram fasa dibangun pada keadaan kesetimbangan (kondisinya adalah pendinginan yang sangat lambat). Diagram ini dipakai untuk mengetahui dan pendinginan yang sangat lambat). Diagram ini dipakai untuk mengetahui dan memprediksi banyak aspek terhadap sifat material.
memprediksi banyak aspek terhadap sifat material.
Informasi penting yang dapat diperoleh dari diagram fasa adalah: Informasi penting yang dapat diperoleh dari diagram fasa adalah:
1. Memperlihatkan fasa-fasa yang terjadi pada perbedaan komposisi dan temperatur dibawah kondisi pendinginan yang sangat lambat.
2. Mengindikasikan kesetimbangan kelarutan padat satu unsur atau senyawa pada unsur lain.
3. Mengindikasikan pengaruh temperatur dimana suatu paduan dibawah kondisi kesetimbangan mulai membeku dan pada rentang temperatur tertentu pembekuan terjadi.
4. Mengindikasikan temperatur dimana perbedaan fasa-fasa mulai mencair.
Jenis pemaduan:
1. Unsur logam + unsur logam
Contoh: Cu + Zn; Cu + Al; Cu + Sn.
2. Unsur logam + unsur non logam
Contoh: Fe + C.
Pemaduan terjadi akibat adanya susunan atom sejenis ataupun ada distribusi atom yang lain pada susunan atom lainnya.
1.Diagram fase 2D
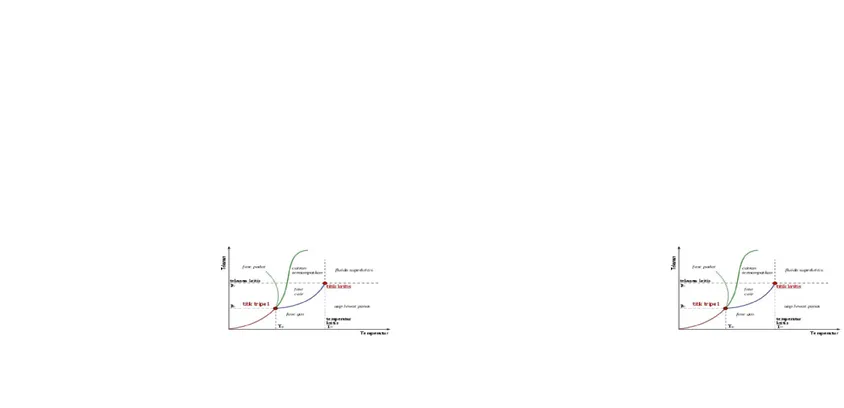
Diagram fase yang paling sederhana adalah diagram tekanan-temperatur dari zat tunggal, seperti air. Sumbu-sumbu diagram berkoresponden dengan tekanan dan temperatur. Diagram fase pada ruang tekanan-temperatur menunjukkan garis kesetimbangan atau sempadan fase antara tiga fase padat,cair,dangas.Penandaan diagram fase menunjukkan titik-titik di mana energi bebas bersifat non-analitis. Fase-fase dipisahkan dengan sebuah garis non-analisitas, di mana transisi Fase-fase terjadi,dandisebutsebagaisempadanfase.
Pada diagaram sebelah kiri, sempadan fase antara cair dan gas tidak berlanjut sampai tak terhingga. Ia akan berhenti pada sebuah titik pada diagaram fase yang disebut sebagai titik kritis. Ini menunjukkan bahwa pada temperatur dan tekanan yang sangat tinggi, fase cair dan gas menjadi tidak dapat dibedakan[1], yang dikenal sebagai fluida superkritis. Pada air, titik kritis ada647Kdan22,064MPa(3.200,1psi)
dari cair menjadi gas, biasanya akan melewati sebuah sempadan fase, namun adalah mungkin untuk memilih lajur yang tidak melewati sempadan dengan berjalan menuju fase superkritis.Oleh karenaitu,fasecairdangasdapatdicampurterusmenerus.
Sempadan padat-cair pada diagram fase kebanyakan zat memiliki gradien yang positif. Hal ini dikarenakan fase padat memiliki densitas yang lebih tinggi daripada fase cair, sehingga peningkatan tekanan akan meningkatkan titik leleh. Pada beberapa bagian diagram fase air, sempadan fase padat-cair air memiliki gradien yang negatif, menunjukkan bahwa es mempunyai densitas yang lebih kecil daripada air.
Sifat-sifat termodinamika lainnya
Selain temperatur dan tekanan, sifat-sifat termodinamika lainnya juga dapat digambarkan pada diagram fase. Contohnya meliputi volume jenis, entalpi jenis, atau entropi jenis. Sebagai contoh, grafik komponen tunggal Temperatur vs. Entropi jenis (T vs. s) untuk air/uap atau untuk refrigeran biasanya digunakan untuk mengilustrasikan siklus termodinamika seperti siklus CarnotdansiklusRankine.
Pada grafik dua dimensi, dua kuantitas termodinamika dapat ditunjukkan pada sumbu horizontal dan vertikal. Kuantitas termodinamika lainnya dapat diilustrasikan dengan bertumpuk sebagai sebuah deret garis atau kurva. Garis-garis ini mewakili kuantitas termodinamika pada nilai konstantertentu.
2.Diagram fase 3D
Adalah mungkin untuk membuat grafik tiga dimensi (3D) yang menunjukkan tiga kuantitas termodinamika. Sebagai contoh, untuk sebuah komponen tunggal, koordinat 3D Cartesius dapat menunjukkan temperatur (T), tekanan (P), dan volume jenis (v). Grafik 3D tersebut kadang-kadang disebut diagram P-v-T. Kondisi kesetimbangan akan ditungjukkan sebagai permukaan tiga dimensi dengan luas permukaan untuk fase padat, cair, dan gas. Garis pada permukaan tersebut disebut garis tripel, di mana zat padat, cair, dan gas dapat berada dalam kesetimbangan. Titik kritis masih berupa sebuah titik pada permukaan bahkan pada diagram fase 3D. Proyeksi ortografi grafik
P-v-T 3D yang menunjukkan tekanan dan temperatur sebagai sumbu vertikal dan horizontal akan menurunkan plot 3D tersebut menjadi diagram tekanan-temperatur 2D. Ketika hal ini terjadi, permukaan padat-uap, padat-cair, dan cair-uap akan menjadi tiga kurva garis yang akan bertemu pada titik tripel, yang merupakan proyeksi ortografik garis tripel.
2.Pembentukan diagram fasa
Hubungan antara temperatur, komposisi diplot untuk mengetahui perubahan fasa yang terjadi. Dengan memvariasikan komposisi dari kedua unsur (0 100%) dan kemudian dipanaskan hingga mencair setelah itu didinginkan dengan lambat (diukur oleh dilatometer/kalorimeter), maka akan diperoleh Cu-Ni. kurva pendinginan (gambar a.). Perubahan komposisi akan merubah pola dari kurva pendinginan, titik-titik A, L1, L2, L3 dan C merupakan awal terjadinya pembekuan dan B, S1, S2, S3 dan D merupakan akhir pembekuan.
Klasifikasi Diagram Kesetimbangan Fasa
1. Larut sempurna dalam keadaan cair dan padat.
2. Larut sempurna dalam keadaan cair, tidak larut dalam keadaan padat (reaksi eutektik).
3. Larut sempurna dalam keadaan cair, larut sebagian dalam keadaan padat (reaksi eutektik).
4. Larut sempurna dalam keadaan cair, larut sebagian dalam keadaan padat (reaksi peritektik).
5. Larut sempurna dalam keadaan cair, tidak larut dalam keadaan padat dan membentuk senyawa.
6. Larut sebagian dalam keadaan cair (reaksi monotektik). 7. Tidak larut dalam keadaan cair maupun padat.
Untuk memahami dan membaca diagram fase diperlukan pemahaman tentang istilah-istilah yang digunakan di dalam diskusi tentang diagram fase. Istilah-istilah-istilah yang berkaitan dengan diagram fase dapat diringkaskan sebagai berikut:
1.Komponen
Bagian yang menyusun suatu paduan (alloy). Komponen dapat berupa unsur atau senyawa. Dalam suatu paduan ada komponen yang bertindak sebagai solute dan ada yang bertindak sebagai solvent .
2.Sistem
Sistem adalah kumpulan dari berbagai komposisi komponen, di mana komponen penyusun sama hanya berbeda komposisinya. Contoh: sistem Fe-C terdiri dari Fe dan C dengan berbagai komposisi.
3.Fase
Fase didefinisikan sebagai bagian dari sistem yang bersifat homogen sehingga memiliki karakteristik fisika dan kimia yang seragam.
Komponen dapat terdiri dari satu komponen tunggal (seperti larutan gas) atau multi komponen (seperti larutan sukrosa). Komponen-komponen yang sama dapat membentuk lebih dari satu fase jika komposisinya berbeda.
Jika lebih dari satu fase terdapat dalam sistem, maka tiap fase akan memiliki sifat yang khas dan berbeda dari fase lainnya. Antara satu fase dan fase yang lainnya akan dibatasi oleh suatu batas yang memisahkan fase-fase tersebut jika mereka ada bersamaan
Untuk suatu sistem dengan komposisi tertentu, terdapat batas kelarutan maksimum pada temperatur tertentu. Jika batas kelarutan telah tercapai, maka penambahan suatu
solut akan menimbulkan fase baru. Sebagai contoh dapat ditunjukkan diagram air-sukrosa Batas Kelarutan (Solubility Limit )
(H2O-C12H22O11) sebagai berikut;
Pada diagram air-sukrosa terlihat bahwa batas kelarutan berubah seiring dengan berubahnya temperatur. Jika sukrosa tetap ditambahkan kendati batas kelarutan telah tercapai, maka akan terbentuk fase baru yaitu larutan sukrosa + padatan sukrosa.
Kesetimbangan fasa dan diagram fasa
Selama ini pembahasan perubahan mutual antara tiga wujud materi difokuskan pada keadaan cair. Dengan kata lain, perhatian telah difokuskan pada perubahan
cairan dan padatan, dan antara cairan dan gas. Dalam membahas keadaan kritis zat, akan lebih tepat menangani tiga wujud zat secara simultan, bukan membahas dua dari tiga wujud zat.
Gambar 7.5 Diagram fasa. Tm adalah titik leleh normal air, , T3 dan P3 adalah titik tripel, Tb adalah titik didih normal, Tc adalah temperatur kritis, Pc adalah tekanan
kritis.
Diagram fasa merupakan cara mudah untuk menampilkan wujud zat sebagai fungsi suhu dan tekanan. Sebagai contoh khas, diagram fasa air diberikan di Gambar 7.5. Dalam diagram fasa, diasumsikan bahwa zat tersebut diisolasi dengan baik dan tidak ada zat lain yang masuk atau keluar sistem.
Pemahaman Anda tentang diagram fasa akan terbantu dengan pemahaman hukum fasa Gibbs, hubungan yang diturunkan oleh fisikawan-matematik Amerika Josiah Willard Gibbs (1839-1903) di tahun 1876. Aturan ini menyatakan bahwa untuk kesetimbangan apapun dalam sistem tertutup, jumlah variabel bebas-disebut derajat
kebebasan F- yang sama dengan jumlah komponen C ditambah 2 dikurangi jumlah fasa P, yakni,
F=C+2-P … (7.1)
Jadi, dalam titik tertentu di diagram fasa, jumlah derajat kebebasan adalah 2 – yakni suhu dan tekanan; bila dua fasa dalam kesetimbangan-sebagaimana ditunjukkan dengan garis yang membatasi daerah dua fasa hanya ada satu derajat kebebasan-bisa suhu atau tekanan. Pada ttik tripel ketika terdapat tiga fasa tidak ada derajat kebebasan lagi. Dari diagram fasa, Anda dapat mengkonfirmasi apa yang telah diketahui, dan lebih lanjut, Anda dapat mempelajari apa yang belum diketahui. Misalnya, kemiringan yang negatif pada perbatasan padatan-cairan memiliki implikasi penting sebagaimana dinyatakan di bagian kanan diagram, yakni bila tekanan diberikan pada es, es akan meleleh dan membentuk air. Berdasarkan prinsip Le Chatelier, bila sistem pada kesetimbangan diberi tekanan, kesetimbangan akan bergeser ke arah yang akan mengurangi perubahan ini. Hal ini berarti air memiliki volume yang lebih kecil, kerapatan leb besar daripada es; dan semua kita telah hafal dengan fakta bahwa s mengapung di air.
Sebaliknya, air pada tekanan 0,0060 atm berada sebagai cairan pada suhu rendah, sementara pada suhu 0,0098 °C, tiga wujud air akan ada bersama. Titik ini disebut titik tripel air. Tidak ada titik lain di mana tiga wujud air ada bersama.
Selain itu, titik kritis (untuk air, 218 atm, 374°C), yang telah Anda pelajari, juga ditunjukkan dalam diagram fasa. Bila cairan berubah menjadi fasa gas pada titik kritis, muncul keadaan antara (intermediate state), yakni keadaan antara cair dan gas. Dalam diagram fasa keadaan di atas titik kritis tidak didefinisikan.
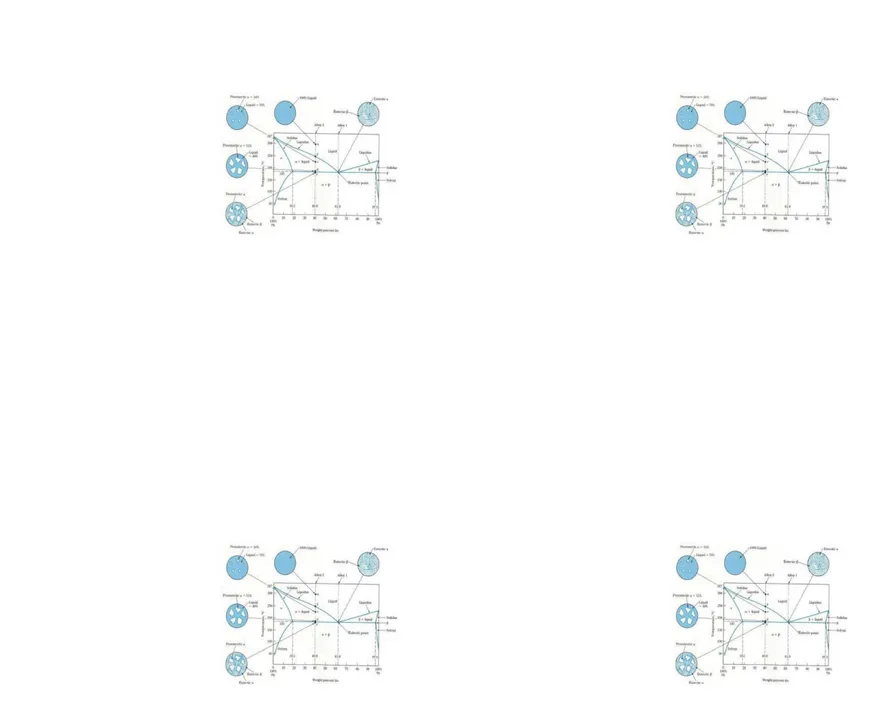
Gambar Diagram fasa CuNi
Pada diagram fase sumbu ordinat mewakili temperatur sistem, sedangkan sumbu absis mewakili komposisi komponen. Komposisi dapat dinyatakan sebagai komposisi berat (wt%) ataupun komposisi atom (at%). Untuk sistem Cu-Ni, komposisi dapat bervariasi mulai dari 0 wt% Ni (100 wt% Cu) sampai dengan 100 wt% Ni (0 wt% Cu)
Terdapat tiga fase yang teramati yaitu fase liquid (L), fase alpha (α), dan fase liquid-alpha (α+L). keberadaan tiap fase dibatasi oleh garis batas fase yang terdapat disepanjang rentang komposisi dan temperatur tertentu. Fase liquid L terdiri dari Cu dan Ni dalam liquid . Fase α adalah substitusional solid solution dari atom Cu dan Ni, serta memiliki struktur kristal FCC. Dari diagram fase dapat terlihat pada temperatur di bawah 1080 oC Cu dan Ni dapat membentuk solid solution pada sembarang komposisi. Fase yang diberi nama dengan huruf Yunani (α, β, γ, dll) menunjukkan fase solid solution dari paduan logam. Daerah fase L dan α+L dipisahkan oleh suatu garis yang disebut liquidus line. Daerah di atas liquidus line hanya terdiri dari L.Sementara itu daerah fase α dan α+L dipisahkan oleh suatu garis yang disebut solidus line. Daerah dibawah solidus line hanya terdiri dari fase α.
Titik potong dari solidus dan liquidus line menunjukkan titik lebur dari masing-masing bahan murni. Untuk diagram fase Cu-Ni, kedua garis berpotongan di dua titik yaitu pada temperatur 1085 oC yang bersesuaian dengan komposisi 0 wt% Ni (100 wt% Cu) dan pada temperatur 1453 oC yang bersesuaian dengan komposisi 100 wt% Ni (0 wt% Cu).
Untuk suatu paduan dengan komposisi tertentu, titik lebur akan terletak sedikit di atas solidus line. Jika temperatur dinaikkan secara perlahan-lahan sedikit demi sedikit fase solid akan berubah menjadi fase liquid. Sebelum mencapai liquid line, fase solid (α) dan liquid akan hadir bersamaan. Saat temperatur mencapai liquidus line, semua fase solid berubah menjadi fase liquid. Jika temperatur dinaikkan terus, hanya fase liquid (L) yang terdapat dalam sistem.
4.Diagram fasa Pb-Sn
Gambar 1. Diagram Fasa Pb-Sn
Diagram fasa Pb-Sn merupakan klasifikasi dari Diagram Kesetimbangan Fasa dimana Fasa Larut sempurna dalam keadaan cair, larut sebagian dalam keadaan padat (reaksi eutektik). Pada diagram fasa Pb-Sn terdapat 3 garis yang menunjukkan dari masing-masing perubahan fasa yaitu antara lain:
Garis liquidus = menunjukkan temperatur terendah dimana logam dalam keadaan cair atau temperatur dimana awal terjadinya pembekuan dari kondisi cair akibat proses pendinginan.
Garis solidus = menunjukkan temperatur tertinggi suatu logam dalam keadaan padat atau temperatur terendah dimana masih terdapat fasa cair.
Garis Solvus = menunjukkan temperatur tertinggi suatu logam dalam keadaan fasa padat yang kedua atau temperatur terendah dimana masih terdapat fasa padat yang pertama.
Pada paduan biner seperti diagram fasa Pb-Sn, ada komposisi paduan spesifik yang dikenal sebagai Eutectic Composition, di mana proses pendinginan/solidifikasi terjadi pada temperatur terendah dibandingkan komposisi lainnya. Temperatur rendah tersebut berkaitan dengan temperatur terendah di mana masih terdapat fasa cair ketika didinginkan dengan lambat. Temperatur tersebut biasa disebut temperatur eutektik . Perhatikan pada alloy 1, titik eutektik pada komposisi 61,9% Sn, 38,9% Pb, T=183°C.
Akibat pendinginan, maka terjadi perubahan fasa: Cairan → a (larutan padat) + b (larutan padat)
Gambar 4.Diagram fasa biner Pb-Sn.
Gambar diatas memperlihatkan diagram fasa dari sistem Pb-Sn. Tampak fasa yang ada untuk semua paduan Pb-Sn pada rentang suhu 0 oC hingga 350oC. Jadi, pada 100oC, paduan terdiri dari 60% Pb (40% Sn) terdiri dari dua fasa, yang disebut α dan β. Pada 200oC terdapat α dan pada300oC hanya terdapat cairan. Sama halnya dengan paduan 20% Pb (80% Sn) yang juga terdiri dari campuran α dan β pada 100oC; tetapi pada 200oC terdiri dari cairan ditambah β. Diagram fasa merupakan suatu kumpulan kurva limit kelarutan. Tiga pasangan kurva seperti ini menghasilkan diagram Pb-Sn pada gambar 4 sebagai berikut:
1.Limit kelarutan timah berbentuk fasa fcc yang disebut α, dan limit kelarutan timbal berbentuk fasa bct disebut β. Kurva ini berlaku untuk suhu tanpa cairan.
2. Limit kelarutan Sn dalam logam cair (61,9% Sn pada 183oC hingga 100% Sn pada232oC). Limit kelarutan timbal dalam logam cair (38,1% Pb pada 183 oC hingga 100%Pb pada 327oC).
3. Limit kelarutan timah dalam α dan dari timbal dalam β, ketika ada cairan.
Kurvapertama turun dari 19,2% Sn pada 183oC menjadi 0 pada titik cair timah (232oC)
Gambar Diagram fasa CuZn
Diagram Fasa Cu-Zn terdiri dari enam fasa yaitu α, β, δ, γ, ε, dan η. Dari semua fasa itu yang penting secara industri adalah logam kuningan dengan fasa α, dan β. fasa α mempunyai struktur FCC dan β mempunyai struktur BCC ada juga fasa β’ dengan kisi super [2]. Dari diagram fasa untuk paduan tembaga seng 70%- 30 %, fasa α merupakan fasa lunak dan mudah dikerjakan, sedangkan paduan tembaga seng 60 – 40, adalah merupakan fasa α + β yang mempunyai kekuatan tinggi dan paduan ini mempunyai kekuatan tarik yang tinggi.
Paduan tembaga seng yang dicampur unsur ke tiga digunakan untuk memperbaiki sifat ketahanan korosi, ketahanan aus dan sifat mampu mesin.Unsur-unsur yang
dipadu terutama Mn, Sn, Fe, Al,Ni dan Pb. Unsur-unsur ini larut padat dal am α dan β, sehingga tidak membentuk fasa baru hanyamengubah perbandingan antara fasa αdan β .
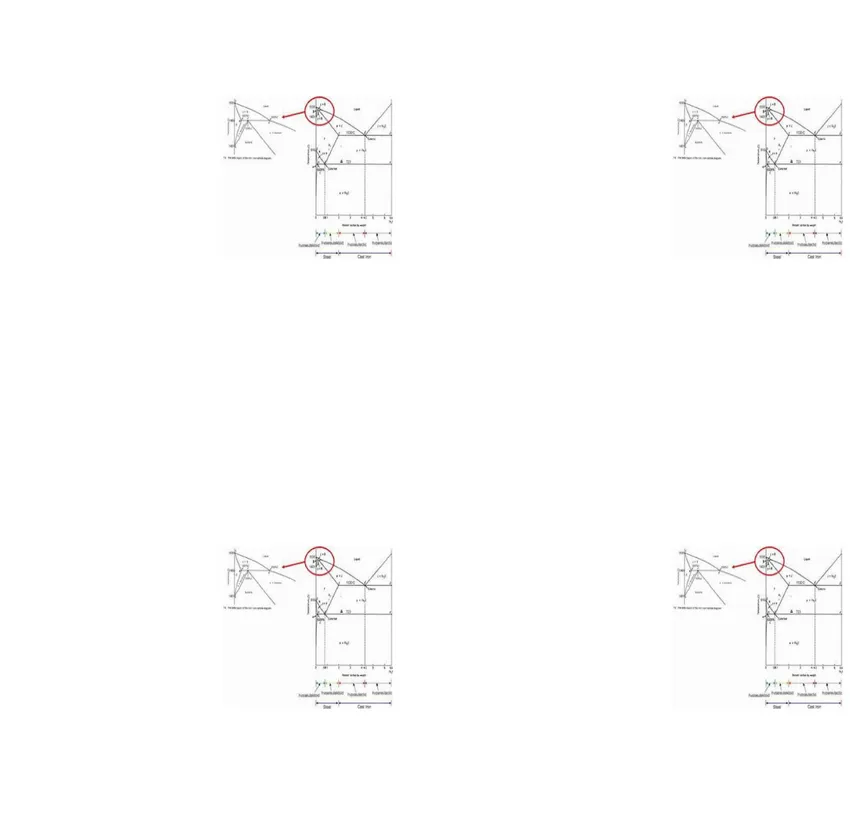
6.Diagram Fasa Fe-Fe3C
Diagram Fasa Fe-Fe3C adalah diagram yang menampilkan hubungan antara temperatur dan kandungan karbon (%C) selama pemanasan lambat. Dari diagram fasa tersebut dapat diperoleh informasi-informasi penting yaitu antara lain :
1. Fasa yang terjadi pada komposisi dan temperatur yang berbeda dengan pendinginan lambat.
2. Temperatur pembekuan dan daerah-daerah pembekuan paduan Fe -C bila dilakukan pendinginan lambat.
3.Temperatur cair dari masing-masing paduan.
4.Batas-batas kelarutan atau batas kesetimbangan dari unsur karbon fasa tertentu. 5.Reaksi-reaksi metalurgis yang terjadi.
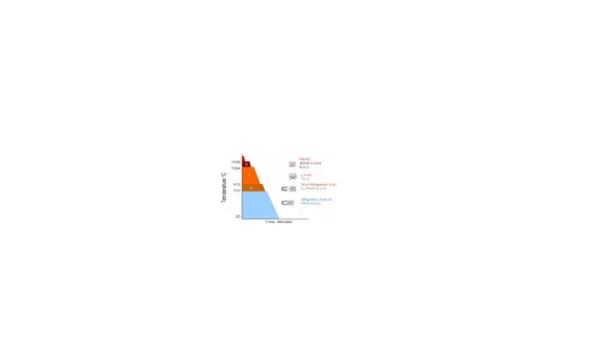
Besi merupakan salah satu logam yang memiliki sifat allotropi. Sifat allotropi yang dimiliki besi sendiri ada 3, yaitu :
• Delta iron (δ) mampu melarutkan karbon max 0,1% pada 1500° C • Gamma iron (γ) mampu melarutkan karbon max 2 % pada 1130° C • Alpha iron (α) mampu melarutkan karbon max 0,025% pada 723° C
Gambar 1. Kurva pendinginan besi murni
sehingga membutuhkan waktu tertentu pada temperatur konstan Æ karena reaksi mengeluarkan panas laten.
Diagram Fase Besi – Karbon
Dalam kondisi cair karbon dapat larut dalam besi. Dalam kondisi padat besi dankarbon dapat membentuk :
• Larutan padat (solid solution)
• Senyawa interstitial (interstitial compound
• Eutectic mixture : campuran antara austenite (γ) dan cementite (Fe3C) • Eutectoid mixture : campuran antara ferrite (α) dan cemen tite (Fe3C)
• Grafit : karbon bebas, tidak membentuk larutan padat ataupun tidak berikatan membentuk senyawa dengan Fe.
Struktur-struktur yang ada pada diagram fase besi – karbida besi :
• Cementite :
– Interstitial compound
– Karbida besi (Fe3C)
– Keras dang etas
– Kekuatan tarik rendah
– Kekuatan tekan tinggi
– Struktur kristal orthorhombic
– Struktur paling keras pada diagram Fe-Fe3C
• Austenite (γ)
– Interstitial solid solution; larutan padat karbon dalam besi γ
– Struktur kristal FCC (face centered cubic, kubus pemusatan bidang)
– Kelarutan karbon max 2 % pada temperatur 1130 C
– Tensile strength 1050 kg/cm2
– Tangguh
– Biasanya tidak stabil pada temperatur kamar
– eutectic mixture (γ+Fe3C)
– Campuran terdiri dari austenite dan cementite – Mengandung 4,3 % berat karbon
– Terbentuk pada temperatur 1130 C (2065 F) • Ferrite (α)
– Interstitial solid solution
– Larutan padat karbon dalam besi α
– Pada temperatur 723 C, batas kelarutan karbon 0,025 % – Pada temperatur kamar, batas kelarutan karbon 0,008 % – Pada temperatur 1492 C, batas kelarutan karbon 0,1 % – Tensile strength rendah
– Keuletan tinggi
– Kekerasan < 90 HRB
– Struktur paling lunak pada diagram Fe-Fe3C • Pearlite
– Eeutectoid mixture dari ferrite dan cementite (α+Fe3C) – Terjadi pada temperatur 723 C
– Mengandung 0,8 % karbon
Garis-garis penting dalam diagram Fe-Fe3C
1. Upper critical temperature (temperatur kritis atas), A3 : temperatur perubahan allotropi
2. Lower critical temperature (temperatur kritis bawah), A1 : temperatur reaksi eutectoid
3. Solvus line Acm : menunjukkan bats kelarutan karbon dalam austenite Reaksi-reaksi yang terjadi pada diagram Fe – Fe3C
• Reaksi Peritectic pada temperatur : S + L ↔ S1
δ + L ↔ γ
L ↔ S1 + S2
L ↔ γ + Fe3C (ledeburite)
• Reaksi Eutectoid pada temperatur 723 C : S ↔ S1 + S2
γ ↔ α + Fe3C (pearlite)
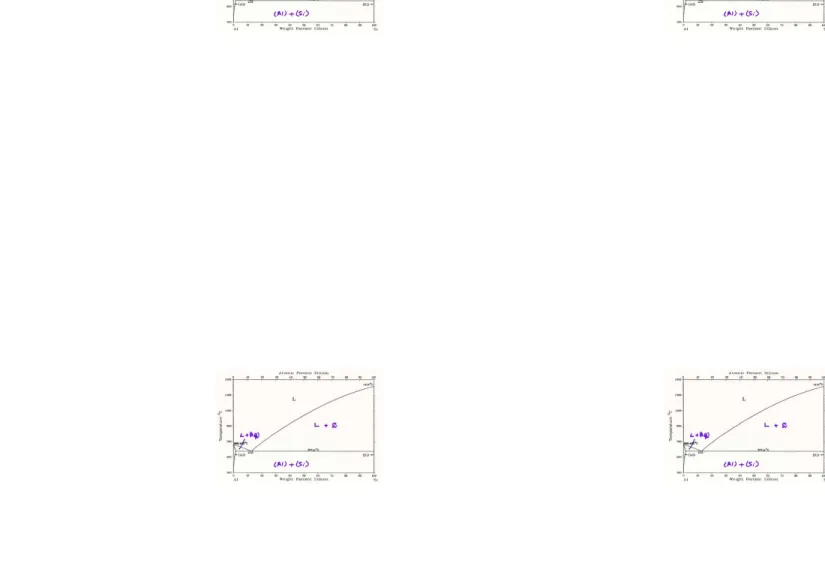
7.Diagram Fasa Al-Si
Gambar di atas, memperlihatkan diagram fasa dari sistem Al-Si. Tampak fasa yang ada untuk semua paduan Al-Si pada rentang suhu 300˚C-1500˚C, gambar sebelah kiri, dan pada rentang 400˚C-1400˚C gambar sebelah kanan untuk berbagai macam
variasi komposisi.Pada diagram fase di atas, α (struktur kristal fcc) dan β (struktur
kristal bcc) digunakan untuk menunjukkan dua fasa yang berbeda masing-masing digunakan untuk menunjukkan fasa Al dan Si. Dari diagram fasa di atas kita dapat
menganalisa, bahwa suatu paduan senyawa yang terdiri dari kira-kira 98% Al dan 2%Si dipanaskan secara perlahan dari suhu ruang hingga 1500˚C. Maka fasa yang terjadi selama proses pemanasan berlangsung adalah
Suhu ruang hingga 550˚C α + β
550˚C hingga 600˚C α
600˚C hingga 660˚C α + liquid
660˚C hingga 1500˚C cairan
Kristal tunggal terbentuk hanya pada fase liquid. Jadi dari analisa di atas, dapat disimpulkan bahwa kristal tunggal terbentuk dengan mengkombinasikan Al dan Si masing-masing sebesar 98% dan 2%, kemudian dipanaskan pada rentang suhu kira-kira antara suhu kamar sampai 700˚C, hingga terbentuk fasa liquid. Setelah itu, untuk memisahkan komponen kristal tunggal (kemungkinan terbesar, didapatkan kristal tunggal Al dengan perbandingan 98:2) dapat dilakukuan proses sintesis.
Polikristal merupakan material yang memiliki banyak kristal dengan batas butir (grain boundary) yang menyertainya serta memiliki orientasi yang acak. Dari analisa diagram fase di atas, dapat diketahui bahwa untuk membentuk polikristal dari campuran Al dan Si, dapat diperoleh melalui paduan komposisi Al dan Si masing-masing 98% dan 2% dengan suhu sintering pada rentang kira-kira pemanasan dari suhu ruang sampai suhu 550˚C. Sehingga pada kondisi ini akan didapatkan akan dua fase secara bersamaan yaitu fase α dan β.
Polikristal terorientasi adalah polikristal yang memiliki spin (domain) searah. Hal ini dapat diperoleh, dengan memberikan magnetic field pada material polikristal. Hingga pada akhirnya akan didapatkan polikristal yanng memiliki spin (domain searah). Arah spin pada material polikristal dapat dilihat melalui AFM (Atomic Force Microscope).
mengkombinasikan komponen Al:Si 98%:2% maka dapat kita sintering dari rentang suhu antara suhu kamar sampai kira-kira pada suhu 660˚C.
8.Diagram fasa Biner
Diagram fase dengan lebih dari dua dimensi dapat dibuat yang menunjukkan efek lebih dari dua variabel pada fase suatu zat. Diagram fasa dapat menggunakan variabel lain disamping atau sebagai pengganti dari suhu, tekanan dan komposisi, misalnya kekuatan listrik yang diterapkan atau medan magnet dan mere ka jug a dap at meli batk an baha n- bah an yang mengambil lebih dari sekadar tiga negara dari materi. Satu jenis plot diagram fase temperatur te rh ad ap konsentrasi relatif dari dua zat dalam biner campuran yang disebut diagram fasebiner , Sebuah diagram fase untuk suatu sistem biner menampilkan
sebuah titik eutektik.Eutektik biner diagram fase menjelaskan perilaku kimia dua tidak bercampur (unmixable)kristal dari yang benar-benar bercampur (mixable) meleleh, seperti olivin dan pyroxene, atau pyroxen e dan Ca plagioclase. Tipe lain dari diagram fasa biner adalah diagram titik didih
campuran dari dua komponen, yaitu senyawa kimia.Selama dua khususvolatilekomponen p ada tekana n tert ent u sepe rti tekanan atmosfer, diagram titik didih menunjukkan apa uap ( g a s ) k o m p o s i s i b e r a d a d a l a m kesetimbangand e n g a n k o m p o s i s i c a i r a n y a n g d i b e r i k a n tergantung pada suhu. Dalam biner khas titik didih diagram suhu diplot pada sumbu vertical dan campuran komposisi pada sumbu horizontal.
Kesimpulan
Adapun Kesimpulan yang dapat diambil dari makalah ini adalah :
1. Diagram fase adalah sejenis grafik yang digunakan untuk menunjukkan kondisi kesetimbangan antara fase-fase yang berbeda dari suatu zat yang sama.
2. Fasa merupakan bagian homogen dari suatu sistem yang memiliki sifat fisik dan kimia yang seragam.
3. Kombinasi dua unsur atau lebih yang membentuk paduan logam akan menghasilkan sifat yang berbeda dari logam asalnya
4. Untuk kesetimbangan apapun dalam sistem tertutup, jumlah variabel bebas-disebut derajat kebebasan F- adalah sama dengan jumlah komponen C ditambah 2 dikurangi jumlah fasa P, yakni,F=C+2-P …
5. Dalam diagram fasa CuNi terdapat tiga fase yang teramati yaitu fase
liquid (L), fase alpha (α), dan faseliquid-alpha (α+L).
6. Diagram fasa Pb-Sn merupakan klasifikasi dari Diagram Kesetimbangan Fasa dimana Fasa Larut sempurna dalam keadaan cair, larut sebagian dalam keadaan padat (reaksi eutektik
7. Diagram Fasa Cu-Zn terdiri dari enam fasa yaitu α, β, δ, γ, ε, dan η. 8. Diagram Fasa Fe-Fe3C adalah diagram yang menampilkan hubungan
antara temperatur dan kandungan karbon (%C) selama pemanasan lambat.
9. Pada Diagram f asa AlSi ,α (struktur kristal fcc) dan β (struktur kristal
bcc) digunakan untuk menunjukkan dua fasa yang berbeda masing-masing digunakan untuk menunjukkan fasa Al dan Si.
10. Diagram fase untuk suatu sistem biner menampilkan sebuah titik eutektik.Eutektik biner diagram fase menjelaskan perilaku kimia dua tidak bercampur (unmixable)kristal dari yang benar-benar bercampu (mixable) meleleh, seperti olivin dan pyroxene, atau pyroxe ne d an C a pl agio cla se.
Daftar Pustaka
1. http://www.google.co.id/search?q=sistem+biner&ie=utf-8&oe=utf 8&aq=t&rls=org.mozilla:en-US:official&client=firefox-a
2. http://id.wikipedia.org/wiki/Sistem_bilangan_biner 3. http://inginkutau.blogspot.com/2009/11/pengertian-diagram-fase-dalam-kimia.html 4. http://digilib.batan.go.id/e-prosiding/File%20Prosiding/Lingkungan/P3TM-Juli 2003/Wisnu-Ari-Adi-Engkir-Sukirman-dan-Didin-S-Winatapura342.pdf 5. http://www.scribd.com/doc/15982886/Phase-Transformation-Series-18Diagram-Fasa 6. http://www.mantantukanginsinyur.blogspot.com