SELEKSI CENDAWAN POTENSIAL PENGHASIL
ENZIM ENDOGLUKANASE (KARBOKSIMETIL SELULASE)
DAN ISOLASI GEN PENYANDINYA
NEO ENDRA LELANA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2009
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa tesis yang berjudul Seleksi Cendawan Potensial Penghasil Enzim Endoglukanase (Karboksimetil Selulase) dan Isolasi Gen Penyandinya adalah karya saya bersama dengan komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Februari 2009
Neo Endra Lelana
NRP P052060101
ABSTRACT
NEO ENDRA LELANA. Selection of Potential Fungal for Endoglucanase (Carboxymethyl Cellulase) Producer and Isolation of Its Gene. Supervised by UTUT WIDYASTUTI and NAMPIAH SUKARNO
Cellulose is the most renewable resources in the earth. Enzymatic hydrolysis of cellulose can be achieved by synergistic action of three types of cellulase enzyme, namely endoglucanases, exoglucanases/cellobiohydrolases and glucanases. Filamentous fungi, particularly Aspergillus and Trichoderma, are well known as efficient producers of cellulolytic enzymes.
The aims of the research were to screen endoglucanases or carboxymethyl cellulase (CMCase) from Aspergillus niger and Trichoderma isolates and to isolate and characterize gene encoding endoglucanase from selected isolate. Fungal isolates were screened by plate screening method in agar medium containing 1% carboxymethyl cellulose with congo red staining and the fungal cellulase activity was measured by dinitrosalicilic acid (DNS) methods from seven days filtrate culture. Trichoderma reesei was used as a standard isolate for cellulase enzyme activity test. Gene encoding endoglucanase of A. niger IPB1, designated eglA, was isolated from RNA to obtain coding sequence (CDS) with RT-PCR using specific primer EAF and EAR. The resulting fragment coding
eglA was cloned into pGEM-T Easy plasmid, introduced into E. coli DH5α and
sequenced by ABI Prism 310 automated DNA sequencer. Characterization of
eglA gene was carried out by using several software programs from webserver
that available online.
Quantitative assay of cellulolytic activity showed that A. niger IPB1 had highest value of specific activity, 5.74 U/mg, compared to other isolates and standard isolate tested and had been chosen as an isolate for isolation gene encoding endoglucanase. The full length of CDS region of eglA gene from A.
niger IPB1 had been successfully isolated and cloned into pGEM-T Easy plasmid.
The gene was 720 bp in length and encoding 239 amino acids. The result of BLAST analysis of this gene showed high similarity, 97 (E-value 1.1e-148) - 99% (E-value 3.7e-152 ) , with other A. niger endoglucanases obtained from database. Based on deduced amino acids sequenced, eglA of A. niger IPB1 was a secreted protein belonging to glycoside hydrolase (GH) family 12. This enzyme lacked of carbohydrate binding moduls (CBM). From sequence comparisons with GH12 homolog with known sequence in which the catalytic residue had been identified, the identities of the catalytic nucleophile and the acid-base of eglA A. niger IPB1 were Glu116 and Glu 204, respectively. Glucosyl binding site were Trp (22, 49, 51, 85, 120, 144), Tyr (61, 98, 115) and Phe (163, 179). Phylogeny analysis showed that the eglA of A. niger IPB1 had close relationship with another
Aspergillus group.
RINGKASAN
NEO ENDRA LELANA. Seleksi Cendawan Potensial Penghasil Enzim Endoglukanase (Karboksimetil Selulase) dan Isolasi Gen Penyandinya. Dibimbing oleh UTUT WIDYASTUTI dan NAMPIAH SUKARNO
Selulosa merupakan sumber daya terbarukan yang paling berlimpah di alam. Secara enzimatik, selulosa dapat dihidrolisis oleh kerja sinergis tiga tipe enzim selulase, yaitu endoglukanase, eksoglukanase/selobiohidrolase dan glukosidase. Kelompok cendawan berfilamen, terutama Aspergillus dan
Trichoderma diketahui merupakan organisme penghasil selulase yang efisien
Penelitian ini bertujuan untuk melakukan skrining terhadap enzim endoglukanase atau karboksimetil selulase (CMCase) dari beberapa isolat
Aspergillus niger dan Trichoderma koleksi Bagian Mikologi Departemen Biologi
F.MIPA Institut Pertanian Bogor dan Pusat Penelitian Sumber Daya Hayati dan Bioteknologi Institut Pertanian Bogor serta mengisolasi dan mengkarakterisasi gen penyandi endoglukanase dari isolat cendawan potensial terpilih. Seleksi endoglukanase dilakukan dengan skrining pada media agar CMC menggunakan pewarnaan congo red dan pengujian aktivitas enzim menggunakan metode DNS (asam dinitrosalisilat). T. reesei digunakan sebagai isolat standar dari aktivitas enzim endoglukanase. Isolat potensial terpilih selanjutnya digunakan untuk isolasi gen penyandi endoglukanase. Daerah coding sequence (CDS) diisolasi menggunakan RT-PCR dengan primer spesifik EAF (5’-CTCTAACGCCCAACA TGAAG-‘3) dan EAR (5’-TCTAGAACCCTAGTTGACACTGG-‘3) dari RNA total. Produk amplifikasi yang diharapkan ialah sebesar 743 bp. Gen eglA yang diperoleh selanjutnya diklon ke dalam plasmid pGEMT-Easy dan diintroduksikan ke dalam E. coli DH5α. Hasil klon kemudian di urutkan nukleotidanya dengan ABI Prism 310 automated DNA sequencer dan dikarakterisasi menggunakan beberapa software yang tersedia secara online.
Berdasarkan uji kualitatif, A. niger IPB1 menghasilkan nisbah selulolitik lebih besar dari isolat Trichoderma dan beberapa A. niger tetapi lebih kecil dari A.
niger KB12 dan A. niger TSR52. Namun uji kuantitatif dengan metode DNS
menunjukkan isolat A. niger IPB1 mempunyai aktivitas spesifik tertinggi dibanding isolat-isolat lainnya termasuk T. reesei, yaitu 5.74 U/mg. Isolat ini selanjutnya dipilih untuk dilakukan isolasi terhadap gen penyandi endoglukanasenya. Gen eglA berhasil diisolasi dan di klon ke dalam plasmid pGEM-T Easy. Gen ini terdiri atas 720 bp dan mengkodekan 239 asam amino. Analisis BLAST menunjukkan eglA mempunyai kemiripan yang tinggi, yaitu 97 (E-value 1.1e-148) - 99% (E-value 3.7e-152) dengan endoglukanase A. niger lainnya dari database. Berdasarkan deduksi asam aminonya, eglA termasuk ke dalam famili glikosida hidrolase famili 12. Enzim ini tidak mengandung
carbohydrate binding moduls (CBM). Berdasarkan perbandingan struktur
homolog dengan struktur endoglukanase lain yang sudah diketahui, residu-residu yang berperan dalam fungsi katalitik EglA A.niger maupun pengikatan substratnya dapat dideduksikan. Glu116 diprediksi berperan sebagai nukleofil dan Glu204 diprediksi berperan sebagai donor proton. Situs pengikatan glikosil
diprediksikan tersusun atas residu Trp (posisi 22, 49, 51, 85, 120, 144), Tyr (61, 98, 115) dan Phe (163, 179). Analisis filogenetik menunjukkan eglA A. niger IPB1 mempunyai kedekatan dengan kelompok Aspergillus lainnya.
© Hak cipta milik IPB, tahun 2009
Hak cipta dilindungi undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tesis tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar Institut Pertanian Bogor
2. Dilarang mengumumkan atau memperbanyak sebagian atau seluruh tulisan dalam bentuk apapun tanpa ijin Institut Pertanian Bogor.
SELEKSI CENDAWAN POTENSIAL PENGHASIL
ENZIM ENDOGLUKANASE (KARBOKSIMETIL SELULASE)
DAN ISOLASI GEN PENYANDINYA
NEO ENDRA LELANA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2009
Judul Penelitian : Seleksi Cendawan Potensial Penghasil Enzim Endoglukanase (Karboksimetil Selulase) dan Isolasi Gen Penyandinya
Nama Mahasiswa : Neo Endra Lelana
NIM : P052060101
Disetujui
Komisi Pembimbing
Dr. Ir. Utut Widyastuti, MS Ketua
Dr. Ir. Nampiah Sukarno Anggota
Diketahui
Ketua Program Studi Bioteknologi
Dr. Ir. Muhammad Jusuf, DEA
Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Khairil A. Notodiputro, MS
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT dimana hanya atas karunia dan ijinNyalah karya ilmiah ini dapat diselesaikan. Penelitian ini mengambil tema Seleksi Cendawan Potensial Penghasil Enzim Endoglukanase (Karboksimetil Selulase) dan Isolasi Gen Penyandinya dan telah dilaksanakan sejak bulan September 2007 sampai bulan Desember 2008. Dalam kesempatan ini penulis ingin mengucakan terima kasih yang tak terhingga kepada :
1. Dr. Utut Widyastuti dan Dr. Nampiah Sukarno selaku pembimbing yang telah memberikan bimbingan dan arahan selama berlangsungnya penelitian dan penulisan karya ilmiah ini.
2. Dr. Aris Tjahjoleksono selaku penguji luar komisi yang telah memberikan arahan dan masukan dalam penulisan karya ilmiah ini.
3. Departemen Kehutanan atas beasiswa yang diberikan kepada penulis dalam menempuh studi S2 ini.
4. Pusat Penelitian Sumberdaya Hayati dan Bioteknologi Institut Pertanian Bogor atas semua fasilitas laboratoriumnya.
5. Proyek Kerjasama Kemitratan Penelitian Pertanian dengan Perguruan Tinggi (KKP3T) antara Departemen Pertanian dan Pusat Penelitian Sumber Daya Hayati dan Bioteknologi Institut Pertanian Bogor atas dana penelitiannya. 5. Seluruh staf pengajar di Program Studi Bioteknologi Sekolah Pascasarjana
IPB atas segala ilmu yang diberikan, beserta seluruh staf administrasi dan staf laboratorium atas segala bantuannya selama penulis menjalankan tugas belajar di IPB.
6. Ayah-Ibu tercinta, Bapak-Ibu mertua, Istriku Ika Prasasty dan anakku Ahmad Aulya Lathief tersayang, dan seluruh keluarga atas segala dukungan dan kesabaran dalam mendampingi penulis.
7. Teman-teman Program Studi Bioteknologi angkatan 2006 : Pak Heri, Pak Tontowi, Pak Roni, Slamat, Ainun, Devi, Wita, Nia, atas dukungan dan bantuan yang diberikan.
8. Teman-teman Lab. Biorin dan Genetika Molekuler : Pak Ulung, Pak Muzuni, Pak Hadi, Pak Mulya, Rizki, Mbak Pepi, Bu Srilis, Bu Yohana, Bu Ratna, Yulia, Niken, Nindya dan sebagainya atas dukungan yang diberikan.
9. Semua pihak yang tidak dapat penulis sebutkan satu persatu yang telah memberikan bantuan kepada penulis dalam menyelesaikan penelitian ini.
Penulis menyadari bahwa tesis ini masih belum sempurna. Namun demikian penulis berharap semoga penelitian ini dapat berguna bagi pihak-pihak yang memerlukannya.
Bogor Februari 2009 Neo Endra Lelana
RIWAYAT HIDUP
Penulis dilahirkan di Sukoharjo pada tanggal 6 November 1978 dari pasangan Bapak Banendro dan Ibu Sriyati. Penulis merupakan anak pertama dari empat bersaudara.
Tahun 1996 penulis lulus dari SMA Negeri 7 Surakarta dan pada tahun berikutnya lulus seleksi masuk UNS melalui jalur UMPTN dan selesai pada tahun 2002. Tahun 2006 penulis diterima di Program Studi Bioteknologi Sekolah Pascasarjana IPB dengan beasiswa dari Departemen Kehutanan Republik Indonesia.
Penulis bekerja sebagai calon peneliti di Pusat Litbang Hasil Hutan sejak tahun 2004 dan ditempatkan di Bogor.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvii
I. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 3
1.3 Hipotesis ... 3
II. TINJAUAN PUSTAKA ... 4
2.1 Selulosa ... 4
2.2 Enzim Selulase ... 5
2.2.1 Klasifikasi selulase ... 6
2.2.2 Struktur organisasi enzim selulase ... 7
2.2.3 Mekanisme hidrolisis oleh selulase ... 8
2.3 Glikosida Hidrolase Famili 12 ... 9
2.4 Mikroorganisme Penghasil Selulase ... 10
2.5 Sistem Selulolitik pada Cendawan ... 12
III. BAHAN DAN METODE ... 14
3.1 Waktu dan Tempat ... 14
3.2 Bahan Penelitian ... 14
3.3 Metode ... 14
3.3.1 Pemeliharaan biakan... 15
3.3.2 Uji aktivitas selulolitik... 15
3.3.2.1 Uji aktivitas selulolitik secara kualitatif ... 15
3.3.2.2 Uji aktivitas enzim endoglukanase secara kuantitatif . 16 3.3.3 Isolasi gen penyandi endoglukanase A. niger IPB1 ... 17
3.3.3.1 Isolasi RNA total ... 17
3.3.3.2 Sintesis cDNA total ... 18
3.3.3.3 Isolasi fragmen cDNA eglA ... 19
3.3.3.4 Pengklonan fragmen cDNA eglA ... 19
3.3.3.5 Seleksi transforman rekombinan ... 20
3.3.3.6 Analisis cDNA sisipan ... 20
3.3.4 Pengurutan nukleotida dan analisis urutan nukleotida ... 21
IV HASIL DAN PEMBAHASAN ... 23
4.1 Uji Aktivitas Selulolitik ... 23
4.1.1 Uji aktivitas selulolitik secara kualitatif ... 23
4.1.2 Uji aktivitas enzim endoglukanase secara kuantitatif ... 24
4.2 Isolasi Gen eglA A. niger IPB1 ... 25
4.2.1 Isolasi RNA total dari ... 25
4.2.3 Isolasi gen eglA... 27
4.2.4 Pengklonan gen eglA... 27
4.2.5 Verifikasi pengklonan gen eglA... 28
4..3 Pengurutan dan Karakterisasi Gen eglA A. niger IPB1... 29
4.3.1 Pengurutan gen eglA dan deduksi asam aminonya ... 29
4.3.2 Analisis kesejajaran urutan nukleotida eglA dengan database di GenBank... 30
4.3.3 Analisis situs pemotongan gen eglA ... 31
4.3.4 Analisis domain EglA... 32
4.3.5 Analisis hidrofobisitas EglA ... 34
4.3.6 Kekerabatan EglA A.niger IPB1 dengan endoglukanase organisme anggota famili GH12 lainnya berdasarkan struktur asam aminonya ... 36
V. SIMPULAN DAN SARAN ... 38
5.1 Simpulan ... 38
5.2 Saran ... 38
DAFTAR PUSTAKA ... 39
DAFTAR TABEL
Halaman 1 Kandungan selulosa dari berbagai sumber ... 4
2 Substrat selulosa dan turunannya ... 6
3 Nisbah selulolitik isolat A. niger dan Trichoderma setelah 24 jam inkubasi pada suhu ruang ... 24
4 Aktivitas CMCase A. niger dan Trichoderma pada suhu 50oC yang dipanen setelah 7 hari inkubasi ... 25
DAFTAR GAMBAR
Halaman 1 Struktur molekuler selulosa (Hilden & Johansson 2004) ... 5
2 Mekanisme hidrolisis oleh selulase. (a). Retaining mechanism (b).
Inverting mechanism ... 9
3 Arsitektur domain famili glikosida hidrolase famili 12 (GH12) ... 10
4 Sinergisme hidrolisis selulosa oleh selulase non-kompleks (Lynd et al. 2002) ... 11
5 Skema urutan tahapan penelitian ... 15
6 Aktivitas selulolitik A. niger yang ditunjukkan dengan terbentuknya zona bening disekeliling koloni setelah inkubasi 24 jam pada suhu ruang... 23
7 Hasil isolasi RNA total A. niger IPB1 yang diisolasi dari miselium setelah inkubasi 3 hari yang dideteksi dengan elektroforesis menggunakan gel agarosa 1% (b/v). ... 26
8 Hasil amplifikasi gen aktin dengan PCR yang dideteksi dengan elektroforesis menggunakan gel agarosa 3% (b/v). Lajur 1. Penanda
ΦX174RF DNA/HaeIII Fragments ; 2. Gen aktin ... 27
9 Hasil amplifikasi eglA dengan PCR yang dideteksi dengan elektroforesis menggunakan gel agarosa 1% (b/v). Lajur 1. Penanda 1 kb; 2. eglA hasil PCR... 27
10 Koloni E. coli hasil transformasi yang ditumbuhkan dalam media selektif yang mengandung ampicilin, X-gal dan IPTG ... 28
11 Hasil amplifikasi eglA dengan PCR yang dideteksi dengan elektroforesis menggunakan gel agarosa 1% (b/v). Lajur 1. Penanda 1 kb; 2. eglA hasil PCR... 28
12 Hasil pemotongan DNA plasmid rekombinan dengan EcoRI yang dideteksi dengan elektroforesis menggunakan gel agarosa 1% (b/v). Lajur 1. Penanda 1 kb; 2. Plasmid rekombinan yang dipotong; 3. Plasmid rekombinan yang tidak dipotong ... 29
13 Urutan nukleotida eglA A. niger IPB1 dan deduksi asam aminonya ... 30
14 Perbandingan domain EglA dari berbagai organisme berdasarkan database pfam ... 32
16 Domain umum cellulase yang terdiri dari domain katalitik dan CBM yang dihubungkan oleh daerah penghubung (linker) ……….... 33
17 Kesejajaran urutan asam amino empat enzim GH 12. Posisi residu nukleofil dan donor proton ditunjukkan dengan tanda anak panah hitam dan putih secara berturut-turut. ... 34
18 Profil hidrofobisitas menggunakan skala Kyte & Doolittle (Protscale) .... 35
19 Prediksi segmen transmembran (TMHMM) ... 36
DAFTAR LAMPIRAN
Halaman
1 Kurva standar glukosa dan bovine serum albumin (BSA) ... 45
2 Peta plasmid pGEM-T Easy (Promega) ... 46
3 Hasil pengurutan sisipan eglA dengan primer T7 dan SP6 ... 47
4 Urutan nukleotida sisipan eglA dan deduksi asam aminonya ... 51
5 Hasil penyejajaran urutan nukleotida eglA dengan database di GenBank menggunakan program BLAST ... 52
6 Hasil penyejajaran urutan nukleotida eglA dengan database di GenBank menggunakan program BLAST ... 55
7 Matrik kesamaan urutan asam amino gen eglA A . niger dengan gen endoglukanase dari organisme lain ... 58
8 Matrik jarak urutan asam amino gen eglA A . niger dengan gen endoglukanase dari organisme lain ... 59
9 Multiple sequence alignment asam amino endoglukanase dari bebrapa organisme anggota famili GH12 ... 60
I. PENDAHULUAN
1.1 Latar Belakang
Biomassa tumbuhan merupakan sumber daya terbarukan yang paling banyak ditemukan di alam. Biomassa ini banyak dihasilkan dari kegiatan di bidang kehutanan, perkebunan dan pertanian, namun demikian sumber daya ini belum termanfaatkan secara optimal. Komponen utama penyusun biomassa tumbuhan adalah selulosa, hemiselulosa dan lignin. Dari ketiga komponen ini, kandungan selulosa adalah yang tertinggi. Selulosa merupakan polimer glukosa yang tersusun dari unit-unit glukosa yang dihubungkan dengan ikatan β-1,4-D-glikosidik (Kroon-Batenburg & Kroon 1997; Saxena & Brown 2005) sehingga hidrolisis selulosa dapat menghasilkan glukosa. Hidrolisis selulosa dapat dilakukan secara kimiawi maupun biologis (enzimatik). Secara kimiawi, selulosa dapat dihidrolisis dengan senyawa asam, sedangkan secara enzimatik oleh enzim selulase. Hidrolisis secara kimiawi dapat mengakibatkan degradasi produk monosakarida yang dihasilkan sehingga produk yang dihasilkan rendah, sedangkan hidrolisis secara enzimatik berjalan secara spesifik dan efisien sehingga produk yang dihasilkan lebih tinggi serta berpotensi menghasilkan produksi monosakarida dengan biaya lebih rendah.
Selain berperan dalam hidrolisis selulosa, enzim selulase digunakan juga untuk keperluan dalam berbagai macam industri, seperti industri pulp dan kertas untuk deinking dan modifikasi serat; industri tekstil untuk pelembut katun dan tahap finishing denim; industri deterjen untuk perawatan warna, pembersih dan antideposisi; dan industri makanan sebagai pelunak makanan (Zhang et al. 2006). Bersama-sama dengan hemiselulase kebutuhan selulase mencapai 20% dari total pasar enzim dunia (Coral et al. 2002). Potensi pasar selulase ke depan diprediksi akan meningkat cukup signifikan dengan meningkatnya isu mengenai konversi bahan-bahan selulosa menjadi bioetanol.
Enzim selulase diklasifikasikan menjadi tiga tipe, yaitu endoglukanase (endo-β-1,4-glucanase, EC 3.2.1.4), selobiohidrolase atau eksoglukanase (exo-β-1,4-glucanase, EC 3.2.1.91) dan glukosidase (β-D-glucoside glucohydrolase, EC 3.2.1.21) (Lynd et al. 2002). Hidrolisis selulosa menjadi glukosa merupakan kerja
secara sinergis dari ketiga kelompok enzim tersebut. Endoglukanase menghidrolisis ikatan internal selulosa untuk memproduksi ujung rantai baru, eksoglukanase menghidrolisis ujung rantai selulosa untuk menghasilkan selobiosa atau glukosa, dan glukosidase menghidrolisis selobiosa menjadi glukosa. Hidrolisis selulosa oleh endoglukanase bersifat random sehingga degradasi selulosa dapat berlangsung dengan cepat.
Beberapa mikroorganisme mempunyai kemampuan untuk memproduksi enzim selulase. Cendawan merupakan mikroorganisme utama penghasil selulase walaupun beberapa jenis bakteri dan aktinomycetes juga menghasilkannya. Kelompok cendawan berfilamen seperti Aspergillus dan Trichoderma diketahui merupakan penghasil selulase yang efisien (Gielkens 1999) dan saat ini sebagian besar produksi komersial enzim selulase di dunia dihasilkan dari kedua kelompok cendawan tersebut (Kirk et al. 2002). Aktivitas selulase dari A. niger (Hurst 1977; Coral et al. 2002; Onsori et al. 2004), dan Trichoderma (Ross et al. 1983; Gosh et
al. 1984) sudah dipelajari dan dikarakterisasi, termasuk beberapa gen yang
menyandikannya. Namun demikian aktivitas selulase tersebut menunjukkan variasi yang cukup tinggi pada isolat yang berbeda. Sistem selulolitik pada T.
reesei mengandung dua gen yang menyandi selobiohidrolase, cbh1 (Teeri et al.1983) dan cbh2 (Chen et al.1997); empat gen yang menyandi endoglukanase, egl1 (Penttila et al. 1986), egl2 (Saloheimo et al. 1988), egl3 dan egl5 (Saloheimo et al. 1994); dan satu gen yang menyandi glukosidase (Barnett et al. 1991).
Sementara itu pada Aspergillus niger, terdiri dari tiga gen yang menyandi endoglukanase, eglA, eglB (van Peij 1998) dan eglC (Hasper et al. 2002) dan dua gen yang menyandi selobiohidrolase, cbhA dan cbhB (Gielkens 1999).
Upaya peningkatan efisiensi penggunaan enzim selulase di bidang industri yang meliputi peningkatan produksi, aktivitas, spesifisitas, dan stabilitas pH dan suhu terus dilakukan. Di negara-negara berkembang, pendekatan-pendekatan yang dilakukan masih banyak terfokus pada eksplorasi strain-strain untuk mendapatkan enzim-enzim baru. Namun demikian, seiring perkembangan teknologi genetika molekuler, selain eksplorasi strain cendawan juga dilakukan dengan teknologi DNA rekombinan. Produksi enzim selulase komersial mulai didominasi oleh strain-strain mutan maupun strain hasil rekayasa genetik, seperti T. reesei RUT C
30, CL-847, dan VTT-D yang dihasilkan dari T. reesei QM 6a tipe liar (Howard et
al. 2003). Oleh karena itu penyediaan data dan informasi mengenai urutan suatu
gen yang menyandikan enzim selulase dan organisasinya sangatlah diperlukan dalam pengembangan teknologi enzim berbasis teknologi DNA rekombinan. Kendala pengembangan industri enzim selulase di Indonesia adalah belum adanya strain lokal yang efektif sehingga penelitian untuk mengeksplorasi strain-strain lokal maupun peningkatan kemampuannya dengan teknologi berbasis genetika molekuler perlu dilakukan.
Pada penelitian sebelumnya, Bagian Mikologi Departemen Biologi F.MIPA Institut Pertanian Bogor dan Pusat Penelitian Sumber Daya Hayati dan Bioteknologi Institut Pertanian Bogor telah memperoleh beberapa isolat cendawan yang mempunyai aktivitas enzim selulase. Namun aktivitas enzim selulase isolat-isolat tersebut belum terkarakterisasi dengan baik. Oleh karena itu perlu penelitian mengenai aktivitas enzim selulase terhadap isolat-isolat koleksi tersebut dengan menggunakan isolat T. reseei sebagai standar aktivitas enzim selulase serta isolasi gen penyandi enzim selulase dari isolat potensial yang dihasilkan.
1.2 Tujuan
Penelitian ini bertujuan untuk:
1. Melakukan skrining terhadap enzim endoglukanase dari beberapa isolat Aspergillus niger dan Trichoderma, dan
2. Mengisolasi dan mengkarakterisasi gen penyandi enzim endoglukanase dari isolat cendawan potensial terpilih.
1.3 Manfaat
Manfaat yang dapat diambil dari penelitian ini adalah diperolehnya informasi dasar mengenai aktivitas spesifik enzim endoglukanase cendawan potensial terpilih dan gen yang menyandikannya sebagai dasar dalam pengembangan isolat potensial untuk keperluan industri.
II. TINJAUAN PUSTAKA
2.1 Selulosa
Selulosa merupakan komponen utama penyusun dinding sel tumbuhan bersama-sama dengan hemiselulosa dan pektin. Komposisi selulosa dalam tumbuhan dapat mencapai 40-50% dari massa tumbuhan sehingga selulosa merupakan biopolimer terbarukan yang paling berlimpah di alam (Milala 2005). Produksi selulosa setiap tahun diperkirakan mencapai 4 x 1010 ton (Coughlan 1985). Selain pada tumbuhan, selulosa juga disintesis oleh berbagai jenis organisme lainnya, seperti bakteri, alga dan cendawan. Kandungan selulosa dari berbagai sumber disajikan pada Tabel 1.
Tabel 1 Kandungan selulosa dari berbagai sumber
Sumber Selulosa (%) Hemiselulosa (%) Lignin (%)
Tongkol jagung 45 35 15 Jerami padi 32.1 24 18 Jerami gandum 30 50 15 Kayu keras 40-55 24-40 18-25 Kayu lunak 45-50 25-35 25-35 Rumput 45 31,4 12
Sumber : Howard et al. (2003)
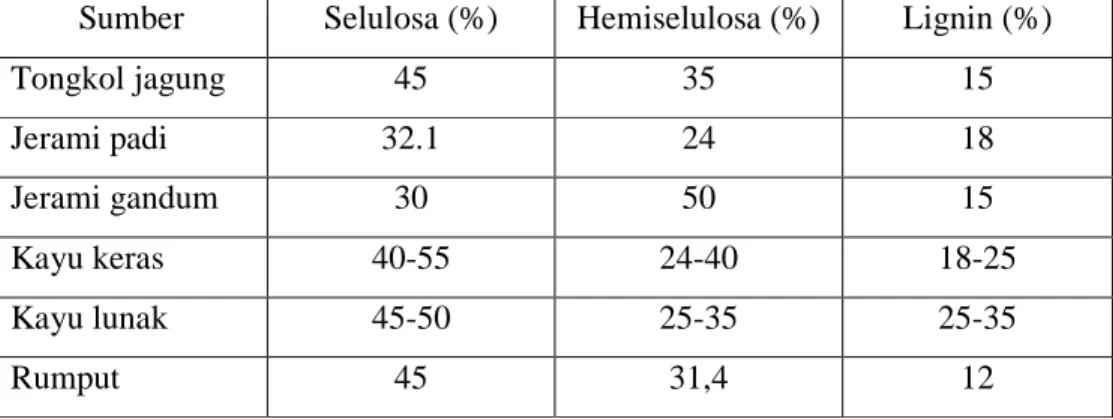
Selulosa merupakan polimer glukosa yang tersusun dari unit-unit glukosa yang dihubungkan dengan ikatan β-1,4-D-glikosidik. Polimer ini tersusun secara paralel dan berikatan silang membentuk sruktur kristalin yang disebut mikrofibril (Gambar 1). Panjang mikrofibril ini bervariasi dari 2000 - 15.000 unit glukosa, tergantung organismenya (Nieduszynski & Preston 1970). Bentuk mikrofibril selulosa ditentukan oleh kompleks geometri selulosa sintase dan lingkungan lokal. Pada tumbuhan, unit mikrofibril mempunyai lebar sekitar 3 nm dan terdiri dari sekitar 36 rantai selulosa dan seringkali di kemas dalam bentuk lebih besar (Doblin et al. 2002).
Gambar 1 Struktur molekuler selulosa (Hilden & Johansson 2004)
Selulosa mempunyai struktur kimia yang sederhana, namun demikian sifat-sifat fisiknya, seperti bentuk kristalin, derajat kristalinitas dan berat molekuler mempunyai variasi yang cukup tinggi. Di alam, kebanyakan selulosa diproduksi sebagai kristalin. Struktur ini terdiri dari dua bentuk yang berbeda, yaitu triclinic cellulose (Iα) dan monoclinic cellulose (Iβ). Kedua bentuk ini dibedakan berdasarkan pengemasan kristal, konformasi molekuler dan pola ikatan hidrogen intramolekuler. Perbedaan ini mungkin berpengaruh terhadap sifat-sifat fisik selulosa. Disamping struktur kristalin, selulosa juga tersusun dari struktur non kristalin (amorf). Jumlah dan perbandingan antara struktur kristalin dan non kristalin ini berbeda-beda tergantung organismenya (Saxena & Brown 2005).
2.2. Enzim Selulase
Enzim selulase merupakan salah satu kelompok enzim yang termasuk dalam sistem enzim lignoselulotik yang diproduksi mikroorganisme yang berperan dalam degradasi material sel tumbuhan. Enzim ini termasuk dalam famili glikosida hidrolase (GH). Enzim selulase berperan dalam hidrolisis selulosa
Unit selobiosa Unit Glukosa
dengan memecah ikatan β-1,4-D-glikosidik untuk menghasilkan oligosakarida maupun glukosa.
2.2.1 Klasifikasi enzim selulase
Enzim selulase dapat diklasifikasikan berdasarkan spesifisitas terhadap substrat, mekanisme reaksi atau kemiripan strukturnya. Berdasarkan struktur proteinnya, enzim selulase termasuk ke dalam famili glikosida hidrolase (GH). GH merupakan kelompok enzim yang mempunyai aktivitas memotong ikatan glikosisik antara dua atau lebih karbohidrat. GH diklasifikasikan berdasarkan similaritas urutan dan struktur asam aminonya (Henrissat 1991; Henrissat & Bairoch 1993; Henrissat & Bairoch 1996). Saat ini terdapat 113 famili GH yang dilaporkan secara online di website (http://www.cazy.org.) (Cantarel et al. 2009). Untuk selulase, saat ini tersebar sedikitnya ke dalam 11 famili GH, yaitu famili 5-9, 12, 26, 44, 45, 48 dan 61.
Tabel 2 Substrat selulosa dan turunannya
Substrat Enzim
Larut dalam air
Rantai pendek (DP rendah)
Silodekstrin
Radio-labelled silodekstrin Turunan silodekstrin
β-methyllumberlliferil oligosakarida p-nitrofenol oligosakarida
Turunan selulosa dengan rantai panjang Carboxymethylecellulose (CMC) Dyed CMC
Tidak larut dalam air
Selulosa kristalin – katun, selulosa mikrokristalin (Avicel), selulosa bakteri Selulosa amorf-PASC
Dyed cellulose
Kromogenik dan turunan fluoreforik
Trinitrofenil-karboksimetilselulosa (TNP-CMC) Fluram selulosa α-selulosa Endo, ekso, BG Endo, ekso, BG Endo, ekso, BG Endo, ekso, BG Endo Endo
Total, endo, ekso
Total, endo, ekso Total, endo
Endo Endo, total Total
Ket: Endo = endoglukanase; Ekso = eksoglukanase; BG = glukosidase; Total = ketiga tipe enzim selulase.
Aktivitas masing-masing enzim selulase dapat diuji menggunakan berbagai substrat selulosa maupun turunannya. Pada umumnya substrat ini dibagi menjadi dua kategori berdasarkan kelarutannya dalam air, yaitu substrat yang larut dalam air dan substrat yang tidak larut dalam air (Tabel 2). Substrat larut dalam air meliputi selodekstrin dengan DP (degree of polymerization) rendah dari 2 sampai 6 unit gula dan turunannya. Sementara itu substrat tidak larut meliputi selulosa yang hampir murni seperti katun, kertas saring Whatman no.1 dan selulosa bakteri, serta selulosa yang tidak murni seperti α-selulosa. Aktivitas enzim endoglukanase pada umumnya dapat diuji dengan substrat CMC (carboxymethyl cellulose) sehingga enzim endoglukanase juga dikenal dengan istilah CMCase. Sementara itu aktivitas enzim selobiohidrolase atau eksoglukanase seringkali diuji dengan substrat avicel sehingga enzim eksoglukanase disebut juga avicelase (Zhang et al. 2006).
2.2.2 Struktur organisasi enzim selulase
Pada umumnya enzim selulase terdiri dari dua domain utama, yaitu domain katalitik dan carbohydrate binding moduls (CBM). Kedua domain ini biasanya dihubungkan oleh suatu penghubung yang pendek dan fleksibel (linker). Domain katalitik merupakan bagian terbesar dari enzim dan merupakan tempat dimana hidrolisis selulosa terjadi. Enzim selulase sedikitnya mempunyai satu domain katalitik dan ukurannya bervariasi tiap organisme, dari yang berukuran pendek seperti CelS Erwinia corotovora (232 AA) sampai yang berukuran panjang seperti CelBb Caldochellum saccharolyticum (1.011 AA) (Gilkes 1991).
Carbohydrate binding modul (CBM) sebelumnya dikenal dengan cellulose binding domain. Saat ini CBM diklasifikasikan menjadi 45 famili berdasarkan
database CAZy (Hashimoto 2006). Domain CBM merupakan daerah yang miskin asam amino bermuatan, mempunyai kandungan asam hidroksiamino yang tinggi dan mengandung residu-residu Trp, Tyr dan Gly yang terkonservasi (Gilkes 1991). Fungsi utama domain CBM adalah meningkatkan efisiensi katalitik enzim terhadap substrat dengan membawa modul katalitik pada substrat (Hashimoto 2006).
Daerah penghubung (linker) merupakan daerah yang menghubungkan antara CBM dan domain katalitik (Gilkes 1991). Linker mempunyai ukuran yang pendek dan sangat bervariasi, dari 6-59 asam amino. Daerah ini kaya prolin, treonin dan serin. Linker berperan dalam menjaga jarak antara domain katalitik dan CBM. Percobaan yang dilakukan dengan menghilangkan daerah linker pada Cel7A T. reesei menunjukkan penurunan kecepatan degradasi selulosa kristalin secara drastis (Srisodsuk et al. 1993).
2.2.3 Mekanisme hidrolisis oleh selulase
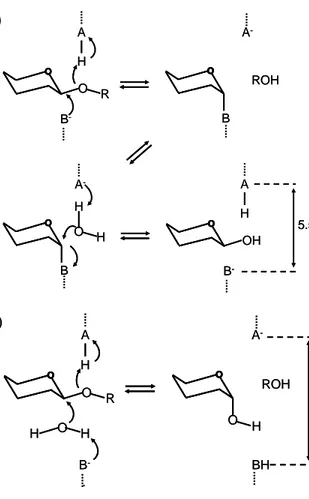
Hidrolisis enzimatik ikatan glikosidik oleh golongan glikosil hidrolase biasanya dilakukan melalui katalisis asam atau basa yang memerlukan dua residu, yaitu donor proton (HA) dan nukleofil/ basa (B-). Aktivitas katalitik ini disediakan oleh residu asam aspartat atau glutamat. Terdapat dua mekanisme yang dapat dibedakan, yaitu retaining mechanism dan inverting mechanism (Gambar 2) (Davies & Henrissat 1995).
Pada retaining mechanism, reaksi tejadi melalui mekanisme penggantian ganda. Pada tahap pertama, salah satu gugus karboksilat berfungsi sebagai katalis asam yang memprotonisasi oksigen dan secara bersamaan karbon C1 diserang oleh nukleofil (B-) dari gugus karboksilat kedua, menghasilkan bentuk antara enzim-glikosil. Pada tahap kedua, gugus karboksilat pertama sekarang berfungsi sebagai katalis basa yang mengaktifkan molekul air. Aktivasi ini menghasilkan nukleofil yang menghidrolisis bentuk antara enzim-glikosil, menghasilkan produk yang mempunyai stereokimia yang sama dengan substrat. Retaining mechanism ini biasanya terjadi pada dua karboksilat yang berjarak 5.5 Å. Sementara itu, pada
inverting mechanism, terjadi pengubahan konfigurasi pada karbon C1 anomerik
setelah pemutusan ikatan glikosidik. Reaksi terjadi melalui mekanisme penggantian tunggal. Basa (B-) melakukan deprotonasi molekul air yang kemudian menyerang karbon C1 dari cincin glukosa, menghasilkan pembalikan konfigurasi pada karbon C1 anomerik. Inverting mechanism ini biasanya terjadi pada dua karboksilat yang berjarak antara 6.5-9.5 Å.
Gambar 2 Mekanisme hidrolisis oleh selulase. (a). Retaining mechanism (b).
Inverting mechanism
2.3 Glikosida Hidrolase Famili 12
GH12 merupakan salah satu famili Glikosida hidrolase yang mempunyai aktivitas endoglukanase dan xyloglukan hidrolase. Mekanisme katalisisnya adalah
retaining dengan Glutamat (Glu) sebagai basa nukleofil maupun donor protonnya.
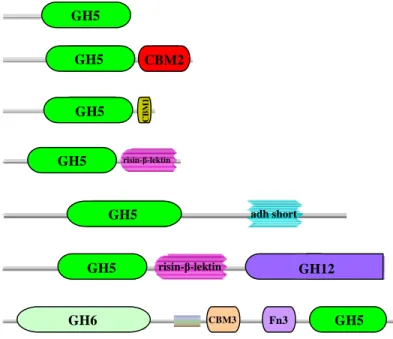
Berdasarkan database pfam, sampai saat ini GH12 mempunyai sekitar 151 anggota dengan 7 arsitektur domain yang berbeda (Gambar 3). Arsitektur pertama hanya terdiri dari domain katalitik famili GH12 (Sandgreen et al. 2003a), arsitektur kedua terdiri dari domain katalitik famili GH12 dan domain CBM2 (Sandgreen et al. 2003b), arsitektur ketiga terdiri dari domain katalitik famili GH12 dan CBM1 (Dean et al. 2005), arsitektur keempat terdiri dari domain katalitik famili GH12 dan risin-β-lektin (Copeland et al. 2006), arsitektur kelima
o o B -H A O R ROH B A -o B A -O H H o B -H A OH 5.5 Å o o oo B -H A O R ROH B A -o o B A -O H H o o B -H A OH 5.5 Å
(a)
(b)
o o B -H A O R ROH BH A -10 Å O H H O H o o oo B -H A O R ROH BH A -10 Å O H H O Hterdiri dari domain katalitik famili GH12 dan adh short (Birren et al. 2005), arsitektur keenam terdiri dari domain katalitik famili GH12, risin-β-lektin dan famili GH5 (Copeland et al. 2007a), dan arsitektur ketujuh terdiri dari domain katalitik famili GH6, CBM3, fn3, famili GH12 dan CBM2 (Copeland et al. 2007b).
Gambar 3 Arsitektur domain GH famili 12
2.4 Mikroorganisme Penghasil Enzim Selulase
Di alam, enzim selulase banyak dihasilkan oleh berbagai jenis cendawan dan bakteri. Namun demikian beberapa jenis organisme, seperti rayap (Watanabe & Tokuda 2001), remis (Xu et al. 2000) dan arabidobsis (Williamson et al. 2002) juga menghasilkannya. Beberapa contoh genus bakteri yang mempunyai aktivitas selulotik adalah Clostridium, Ruminococcus, Caldicellulosiruptor, Butyrivibrio,
Fibrobacter, Cellulomonas, Thermobifida, Cytophaga, dan Sporocytophaga,
Sementara itu beberapa genus cendawan yang mempunyai aktivitas selulolitik adalah Bulgaria, Chaetomium, Helotium, Coriolus, Phanerochaete, Poria,
Schizophyllum, Serpula, serta Aspergillus, Cladosporium, Fusarium, Geotrichum, Myrothecium, Paecilomyces, Penicillium, dan Trichoderma.
Di alam, degradasi selulosa kebanyakan dilakukan oleh mikroorganisme aerobik. Mikroorganisme ini menghasilkan enzim selulase non-kompleks yang (Sandgreen et al. 2003a)
(Copeland et al. 2007b) (Sandgreen et al. 2003b)
(Dean et al. 2005)
(Copeland et al. 2006)
(Birren et al. 2005)
(Copeland et al. 2007a) GH5 GH5 GH5 GH5 GH5 GH5 GH5 GH6 CBM2 C B M 1 CBM3 Fn3 GH12 risin-β-lektin risin-β-lektin adh short
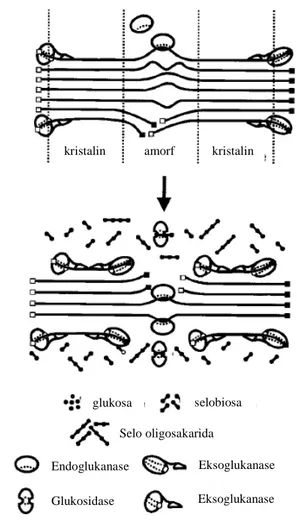
terdiri dari endoglukanase, eksoglukanase dan glukosidase yang bekerja secara sinergis untuk menghidrolisis selulosa (Gambar 4). Berbeda dengan mikroorganisme aerobik, mikroorganisme anaerobik menghasilkan enzim selulase kompleks yang disebut selulosom (Doi et al. 2003; Bayer et al. 2004). Walaupun mikroorganisme anaerobik hanya menyumbang sekitar 5-10% dari biodegradasi total selulosa di alam, namun peranannya sangat penting, karena bertanggung jawab terhadap degragasi daerah anoksik pada danau, laut, dan saluran pencernaan hewan pemamah biak maupun rayap, yang tidak dapat dilakukan mikroorganisme aerobik (Zhang et al. 2006).
Gambar 4 Sinergisme hidrolisis selulosa oleh selulase non-kompleks (Lynd et al. 2002)
kristalin amorf kristalin
glukosa selobiosa Glukosidase Endoglukanase Eksoglukanase Eksoglukanase Selo oligosakarida
Kelompok cendawan merupakan agen yang paling baik dalam mendekomposisi komponen organik, seperti selulosa, dibandingkan dengan bakteri. Kemampuan hidup dan daya saing yang tinggi (Landecker 1972) menjadikan cendawan lebih berperan dalam proses dekomposisi komponen organik di alam. Disamping itu, cendawan juga dikenal sebagai organisme penghasil selulase yang baik, sehingga banyak digunakan dalam produksi enzim selulase secara komersial. Kelompok cendawan berfilamen seperti Aspergillus dan
Trichoderma diketahui merupakan penghasil enzim selulase yang efisien
(Gielkens 1999) dan saat ini sebagian besar produksi komersial enzim selulase di dunia dihasilkan dari kedua kelompok cendawan ini.
2.5 Sistem Selulolitik pada Cendawan
Cendawan mempunyai sistem selulolitik yang berbeda dengan bakteri. Pada cendawan, enzim selulase diproduksi hanya jika diperlukan sedangkan pada bakteri enzim selulase diproduksi secara terus-menerus (konstitutif). Sistem selulolitik pada cendawan yang paling banyak dipelajari dan saat ini dijadikan model sistem selulolitik cendawan adalah sistem selulolitik pada Trichoderma
reesei. Sistem ini mengandung dua gen yang menyandi selobiohidrolase, cbh1
(Teeri et al.1983) dan cbh2 (Chen et al.1997); empat gen yang menyandi endoglukanase egl1 (Penttila et al. 1986), egl2 (Saloheimo et al. 1988), egl3 dan
egl5 (Saloheimo et al. 1994); dan satu gen yang menyandi glukosidase (Barnett et al. 1991). Sementara itu pada Aspergillus niger, tiga gen yang menyandi
endoglukanase, eglA, eglB (van Peij 1998) dan eglC (Hasper et al. 2002) dan dua gen yang menyandi selobiohidrolase, cbhA dan cbhB (Gielkens 1999), sudah dikarakterisasi. Gen-gen penyandi enzim selulase, pada cendawan maupun bakteri, terletak dalam kromosom. Gen-gen ini biasanya terdistribusi secara acak pada genom dan masing-masing mempunyai elemen regulasi sendiri. Pada umumnya gen-gen ini merupakan multidomain, kecuali beberapa gen seperti EGIII dari T. reesei dan EG28 dari P. chysosporium (Lynd 2002).
Sistem ekspresi enzim selulase pada cendawan diregulasi pada tingkat transkripsi dan mekanisme regulasinya sampai saat ini masih belum jelas (Ilmen 1997). Ketika cendawan ditumbuhkan pada media yang mengandung selulosa
sebagai satu-satunya sumber karbon, enzim diekspresikan, sedangkan ketika cendawan ditumbuhkan pada media yang mengandung glukosa, tidak ada ekspresi selulosa. Hal ini menandakan bahwa ekspresi enzim selulase diinduksi oleh selulosa dan dihambat oleh glukosa. Selain selulosa, beberapa molekul lain seperti, laktosa, saporosa, selobiosa, dan selotriosa diketahui dapat menginduksi ekspresi selulase (Kubicek et al. 1993).
III. BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan di Laboratorium BIORIN Pusat Penelitian Sumberdaya Hayati dan Bioteknologi Institut Pertanian Bogor dari bulan Agustus 2007 - Desember 2008.
3.2 Bahan Penelitian
Bahan yang digunakan adalah beberapa isolat A. niger dan Trichoderma koleksi Bagian Mikologi Departemen Biologi F.MIPA dan Pusat Penelitian Sumber Daya Hayati dan Bioteknologi, primer spesifik EAF (5’-CTCTAACGCC CAACATGAAG-‘3) dan EAR (5’-TCTAGAACCCTAGTTGACACTGG-‘3) untuk amplifikasi gen endoglukanase yang didesain menggunakan program Primer3 versi 0.4.0 (http://frodo.wi.mit.edu/primer3/input.htm) berdasarkan gen endoglukanase A Aspergillus niger dari GenBank dengan nomor aksesi AJ225451 (posisi primer EAF= basa ke-14 sebelum kodon awal sampai basa ke-3 setelah kodon awal, primer EAR= basa ke-9 sebelum kodon akhir sampai basa ke-11 setelah kodon akhir) dengan produk yang diharapkan sebesar 743 bp, primer ActF (5’-ATGGCAGATGCCGAGGATAT-‘3) dan ActR2 (5’-TCGAGGTCGGCCAA CAATAC-‘3) untuk amplifikasi gen aktin (posisi primer ActF = 20 basa pertama dari ekson 1, primer ActR2 = basa ke 44 – basa ke 63 dari ekson 2) dengan produk yang diharapkan sebesar 123 bp, pGEM-T Easy sebagai vektor pengklonan dan E.
coli galur DH5α sebagai inang vektor rekombinan.
3.3 Metode
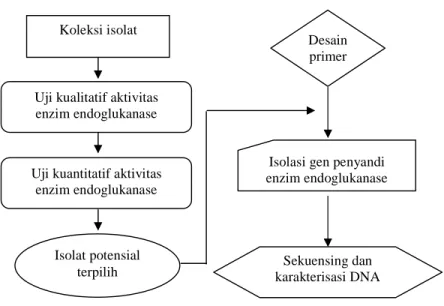
Penelitian dilakukan dalam dua tahap (Gambar 5). Tahap pertama ialah seleksi aktivitas enzim endoglukanase dari beberapa isolat A. niger dan
Trichoderma dan dilanjutkan dengan tahap kedua, yaitu melakukan isolasi gen
3.3.1 Pemeliharaan biakan cendawan
Isolat-isolat Aspergillus niger dan Trichoderma dipelihara dalam media agar CMC (carboxymethyl cellulose) dan diinkubasikan pada suhu ruang selama 7 hari yang selanjutnya digunakan sebagai sumber inokulum.
Gambar 5 Skema urutan tahapan penelitian
3.3.2 Uji aktivitas selulolitik
3.3.2.1 Uji aktivitas selulolitik secara kualitatif
Uji kualitatif aktivitas enzim endoglukanase dilakukan sesuai dengan metode Onsori et al. (2004) yang dimodifikasi dengan mengukur zona bening yang terbentuk pada media agar CMC (CMC 1% (b/v), ekstrak yeast 0.05% (b/v), MgSO4 0.05% (b/v), NaNO3 0.2% (b/v) dan KH2PO4 0.1% (b/v), KCl 0.05%
(b/v), agar 1.5% (b/v)). Sebagai standar digunakan isolat Trichoderma reesei yang merupakan standar aktivitas enzim selulase. Secara garis besar metode yang digunakan adalah sebagai berikut. Koloni dengan diameter sepuluh mm dari masing-masing isolat hasil peremajaan diinokulasikan ke dalam media agar CMC. Kultur kemudian diinkubasi pada suhu ruang selama satu hari. Untuk mengetahui aktivitas selulolitik cendawan, biakan berumur 1 hari diwarnai dengan pewarna
Koleksi isolat TAHAP I
Skrining enzim endoglukanase
TAHAP II Isolasi gen penyandi enzim endoglukanase
Isolat potensial terpilih Uji kualitatif aktivitas enzim endoglukanase
Uji kuantitatif aktivitas enzim endoglukanase
Desain primer
Isolasi gen penyandi enzim endoglukanase
Sekuensing dan karakterisasi DNA
congo red 1 % (b/v) selama 0.5-1 jam, diikuti destaining dengan larutan NaCl 1
M selama 15 menit. Adanya aktivitas enzim endoglukanase ditandai dengan terbentuknya zona bening. Untuk masing-masing isolat digunakan tiga ulangan. Diameter koloni dan zona bening yang terbentuk diukur. Nisbah selulolitik dihitung menggunakan rumus sebagai berikut:
koloni diameter koloni diameter -zona diameter (R) selulotik Nisbah =
3.3.2.2 Uji aktivitas enzim endoglukanase secara kuantitatif
Sebanyak 2 x 106 spora/ml A. niger dan Trichoderma yang diproduksi pada media
agar CMC diinokulasikan ke dalam 50 ml media CMC cair dalam erlenmeyer 250 ml (Narashima et al. 2006). Untuk masing-masing isolat digunakan tiga ulangan.
Kultur diinkubasi dalam inkubator beragitasi selama 7 hari pada kecepatan 150 rpm. Kultur di panen pada umur 7 hari setelah inokulasi. Pemisahan enzim kasar dari biomassa cendawan dilakukan dengan cara menyaring filtrat kasar cendawan dengan kertas saring. Filtrat yang dihasilkan digunakan sebagai ekstrak kasar enzim. Aktivitas enzim endoglukanase diukur berdasarkan produk gula yang dihasilkan dengan metode DNS (asam dinitrosalisilat) (Ghose 1987). Sebanyak 0.5 ml filtrat (ekstrak kasar enzim) dicampur dengan 0.5 ml CMC 1% (b/v) dalam bufer sitrat 50 mM pH 4,8 dan diinkubasikan selama 30 menit pada suhu 50oC. Reagen DNS sebanyak 3 ml ditambahkan ke dalam tabung reaksi. Setelah itu tabung reaksi dipanaskan dalam air mendidih selama 15 menit, kemudian didinginkan pada suhu kamar dan dihitung nilai rapat optis (O.D) pada λ540 nm terhadap blanko. Blanko dibuat dengan mengganti sampel dengan bufer sitrat 50 mM pH 4.8. Hasil pengukuran kemudian dimasukkan ke dalam persamaan kurva standar glukosa yang telah dibuat untuk mengukur kadar glukosa (Lampiran 1). Unit aktivitas enzim endoglukanase dihitung dengan rumus dibawah ini. Satu unit aktivitas enzim endoglukanase didefinisikan sebagai kemampuan enzim dalam menghasilkan 1µmol glukosa per menit.
n pengencera faktor x waktu (ml) enzim V x glukosa BM (ppm) glukosa i konsentras Unit = x
Pengukuran kadar protein total dilakukan dengan metode Lowry (Ghose, 1987). Sebanyak 0.5 ml ekstrak kasar enzim dimasukkan kedalam tabung reaksi dan setelah itu ditambahkan 5 ml reagen C. Reagen C dibuat dengan mencampur 100 ml reagen A (Na2CO3 2% (b/v) dalam NaOH 0.1N) dan 2 ml reagen B
(CuSO4.5H2O 0.5% (b/v) dalam K Tartarat 1% (b/v)). Tabung kemudian
divorteks dan didiamkan pada suhu kamar selama 10 menit. Setelah itu, ke dalam tabung dimasukkan 0.5 ml Reagen D (reagen folin Ciocalteau yang telah diencerkan dengan air sampai 1N). Tabung kemudian divorteks dan didiamkan pada suhu kamar selama 30 menit. Nilai rapat optis (O.D) setiap isi tabung dibaca dengan menggunakan spektrofotometer pada λ750 nm terhadap blanko. Hasil pengukuran kemudian dimasukkan ke dalam persamaan kurva standar bovine serum albumin (BSA) yang telah dibuat untuk mengukur kadar protein (Lampiran
1). Selanjutnya aktivitas spesifik enzim dapat ditentukan berdasarkan unit/ml aktivitas enzim dan kadar protein yang didapat dengan rumus sebagai berikut.
(mg/ml) protein kadar (unit/ml) unit aktivitas (unit/mg) spesifik aktivitas =
3.3.3 Isolasi gen penyandi endoglukanase A. niger IPB1 3.3.3.1 Isolasi RNA total
Isolasi asam ribonukleat (RNA) total A. niger IPB1 dilakukan pada biakan
yang berumur 3 hari. Miselium dari biakan A. niger IPB1 yang ditumbuhkan pada
media cair dipanen. Sebanyak 1 g miselium digerus dengan bantuan nitrogen cair dalam mortal sampai terbentuk bubuk halus, kemudian diekstrak dengan 800 µl reagen TRIzol (Invitrogen). Inkubasi dilakukan selama 5 menit pada suhu ruang,
selanjutnya ditambahkan 200 µl kloroform, dibolak-balik selama 30 detik. Campuran diinkubasi selama 3 menit pada suhu ruang, selanjutnya disentrifugasi pada 9000 rpm (Jouan BR4i) selama 15 menit pada suhu 6oC. Supernatan yang diperoleh dipindahkan ke dalam tabung baru dan ditambahkan 500 µl isopropil alkohol, kemudian diinkubasikan selama 10 menit pada suhu ruang dan disentrifugasi pada 9000 rpm (Jouan BR4i) selama 10 menit pada suhu 6oC. Supernatan dibuang dan endapannya dicuci dengan etanol 75% (v/v) dan
disentrifugasi pada 5700 rpm (Jouan BR4i) selama 5 menit pada suhu 6oC. Endapan yang didapat dikeringkan dengan vakum selama 6 menit dan dilarutkan dalam 20 µl ddH2O yang mengandung diethylpyrocarbonate (DEPC) 0.1% (v/v).
Kuantifikasi dilakukan dengan melarutkan 1 µl suspensi RNA total dalam 700 µl air DEPC 0.1% (v/v), selanjutnya dibaca nilai rapat optisnya dengan spektrofotometer pada panjang gelombang 260 nm (Sambrook et al. 1989).
Keutuhan RNA dianalisis secara kualitatif menggunakan elektroforesis, dengan memigrasikan RNA pada gel agarosa di dalam bufer morpholinopropanesulfonic acid (MOPS) 1% (v/v) (4,2 g/l 3-morpholinopropanesulfonic acid (C7H15NO4),
0.41 g/l Na-Asetat, 0.37 g/l Na2EDTA.H2O) pada tegangan 100 volt selama 35
menit. Visualisasi RNA dilakukan di atas UV transiluminator GelDoc (Labquip).
3.3.3.2 Sintesis cDNA total
Sintesis cDNA total dilakukan melalui proses transkripsi balik. Sebanyak 500 ng RNA total dicampur dengan 4 µl 5x reverse transcriptase (RT) bufer, 1
unit Enzim reverse transcriptase (Invitrogen), 10 pmol primer oligo d(T), 2 µl dithiothreitol (DTT) (0.1 M), 2 µl dNTPmix 2 mM dan ddH2O DEPC 0.1% steril
(konsentrasi final) dalam volume 20 µl. Reaksi transkripsi balik dilakukan pada suhu 30oC selama 10 menit, diikuti oleh suhu 42oC selama 60 menit dan 95oC selama 5 menit.
Evaluasi terhadap keberhasilan sintesis cDNA total dilakukan dengan mengamplifikasi gen penyandi aktin dengan menggunakan primer spesifik gen aktin dan cDNA total sebagai cetakannya. Komposisi reaksi PCR (polymerase chain reaction) ialah 0.75 µl cDNA total, 1x bufer Taq, 0.25 unit Taq DNA
polimerase, 2 mM MgCl2, 0.2 mM dNTPs, 15 pmol dari masing-masing primer ActF dan ActR2, dimethyl sulfoxide DMSO 4% (v/v) (konsentrasi final) dan
ddH2O dengan volume reaksi 15 µl. Reaksi PCR dilakukan dengan kondisi
pra-PCR 95oC selama 5 menit diikuti dengan 30 siklus amplifikasi yang terdiri dari denaturasi 94oC selama 30 detik, annealing 57oC selama 30 detik, dan polimerisasi 72oC selama 2 menit dan pasca-PCR 72oC selama 5 menit dan pendinginan 15oC selama 5 menit
3.3.3.3 Isolasi fragmen cDNA eglA
Fragmen cDNA eglA diisolasi dengan PCR menggunakan primer spesifik
gen endoglukanase yang telah didesain. Komposisi PCR ialah 1 µl cDNA total, 1x bufer Taq, 0.25 unit Taq DNA polimerase, 2 mM MgCl2, 0.2 mM dNTPs, 20
pmol dari masing-masing primer forward dan reverse, DMSO 4% (v/v)
(konsentrasi final) dan ddH2O dengan volume reaksi 20 µl. PCR dilakukan
dengan kondisi pra-PCR 95oC selama 5 menit diikuti dengan 30 siklus amplifikasi yang terdiri dari denaturasi 94oC selama 30 detik, annealing 57oC selama 30 detik, dan polimerisasi 72oC selama 2 menit dan pasca-PCR 72oC selama 5 menit dan pendinginan 15oC selama 5 menit.
3.3.3.4 Pengklonan fragmen cDNA eglA
Fragmen cDNA eglA yang telah diisolasi disisipkan ke dalam vektor
pengklonan pGEM-T Easy (Promega, Madison, WI, USA) (Lampiran 2) dan
diintroduksikan ke dalam E. coli galur DH5α. Hasil PCR diligasikan dengan
pGEM-T Easy mengikuti petunjuk produsen (Promega) yaitu dengan mencampur
7.5 ng hasil PCR, 10 ng pGEM-T Easy, 0.3 Weiss Unit T4 DNA ligase dan 1x
bufer ligasi dengan volume reaksi 10 µl, kemudian diinkubasi pada suhu 4oC selama semalam. Hasil ligasi diintroduksikan ke dalam E. coli galur DH5α
menggunakan metode Suharsono (2002). Metode ini dilakukan dalam dua tahap, yaitu pembuatan sel kompeten dan transformasi bakteri. Sel kompeten dibuat dengan membiakkan koloni tunggal E.coli DH5α dalam 2 ml media LB
(Luria-Bertani) cair (tripton 1% (b/v), ekstrak yeast 0.5% (b/v), NaCl 1% (b/v)) pada suhu 37oC selama semalam dalam inkubator beragitasi (250 rpm). Sebanyak 100
µl biakan E.coli DH5α kemudian dibiakkan kembali dalam 10 ml media LB cair
sampai mencapai OD600=O.5 (densitas sel 4.107 – 7.107 sel/ml. Sebanyak 1.5 ml
biakan bakteri diendapkan dengan senrifugasi pada kecepatan 5000 rpm, suhu 4oC selama 10 menit. Endapan bakteri kemudian disuspensikan dalam 600 µl bufer transformasi (TB) (10 mM PIPES, 15 mM CaCl2.2H2O, 250 mM KCl, 55 mM
MnCl2, pH 6,7) dan diinkubasikan dalam es selama 20 menit. Setelah
disentrifugasi pada kecepatan 5000 rpm pada suhu 4oC selama 10 menit, endapan bakteri diresuspensikan dengan 60 µl TB, ditambah 4.2 µl DMSO dan
diinkubasikan dalam es selama 20 menit. Transformasi dilakukan dengan mencampur sel bakteri kompeten yang dihasilkan dengan 10 µl plasmid hasil ligasi dan diinkubasi dalam es selama 30 menit. Campuran kemudian diberikan kejutan panas dengan diinkubasi pada suhu 42oC selama 1 menit dan setelah itu diinkubasikan kembali dalam es selama 5 menit. Campuran kemudian ditambah dengan 200 µl media YT (16 g/l tripton, 10 g/l ekstrak yeast, 5 g/l NaCl, pH 7,0) dan diinkubasikan pada suhu 37oC selama 60 menit. Bakteri kemudian disebar dalam media agar LB yang mengandung 50 µg/ml ampisilin, 10 µl 100 mM isopropiltio-β-galaktosida (IPTG) dan 50 µl 2% (b/v) X-gal (5- bromo-4-chloro-3-indolyl-β-D-galactoside) dan diinkubasi pada suhu 37oC selama semalam.
3.3.3.5 Seleksi transforman rekombinan
E. coli DH5α yang mengandung vektor rekombinan diseleksi
menggunakan seleksi resistensi terhadap ampisilin dan seleksi biru putih. Koloni yang tumbuh berarti bakteri transforman, sebab E. coli DH5α baru memiliki gen amp (ketahanan terhadap ampisilin) setelah ditransformasi oleh pGEM-T Easy.
Ada dua jenis warna koloni yang tumbuh yaitu koloni biru dan putih. Koloni biru berarti bakteri transforman pGEM-T Easy non rekombinan, sehingga
gen lacZ masih utuh dan menghasilkan enzim β-galaktosidase untuk memotong
substrat X-gal yang tidak berwarna menjadi berwarna biru. Koloni putih berarti bakteri transforman yang mengandung pGEM-T Easy rekombinan, karena gen lacZ menjadi rusak karena tersisipi oleh fragmen DNA (insertional inactivation)
dan tidak akan menghasilkan enzim β-galaktosidase.
3.3.3.6 Analisis cDNA sisipan
Analisis cDNA sisipan dilakukan melalui PCR terhadap koloni putih yang dihasilkan dan pemotongan plasmid rekombinan dengan enzim restriksi EcoRI.
Koloni putih yang terbentuk digunakan sebagai cetakan untuk reaksi PCR dalam mendeteksi keberadaan gen endoglukanase. Koloni putih diambil dengan tusuk gigi steril kemudian disuspensikan ke dalam 7.42 µl ddH2O dan dipanaskan dalam waterbath pada suhu 95oC selama 10 menit dan didinginkan dalam es selama 5
menit. Reaksi PCR dilakukan dengan campuran dan kondisi reaksi yang sama dengan isolasi cDNA eglA.
Koloni putih yang menghasilkan pita sesuai dengan ukuran fragmen cDNA sisipan setelah PCR terhadap koloni digunakan sebagai bahan untuk isolasi plasmid yang akan dianalisis lebih lanjut. Plasmid diisolasi dari E. coli DH5α
transforman rekombinan menggunakan prosedur Suharsono (2002). E. coli
ditumbuhkan dalam 2 ml media LB dan diinkubasi dalam inkubator beragitasi (250 rpm) pada suhu 37oC semalam. Kultur bakteri di sentrifugasi dengan kecepatan 12000 rpm pada suhu 4oC selama 10 menit. Pelet disuspensikan dengan 100 µl coldTEG buffer (50 mM glukosa, 25 mM Tris pH 8, 10 mM EDTA),
ditambahkan 200 µl NaOH/SDS buffer (1 N NaOH, 1% SDS), dibolak-balik perlahan dan diinkubasi dalam es selama 5 menit, selanjutnya ditambahkan 300 µl
icecalsal buffer (3 M NaOAc, 11.5% asam asetat glasial, ddH2O), dihomogenkan
dan disimpan dalam es selama 3 menit. Larutan disentrifugasi 12000 rpm pada suhu 4oC selama 10 menit. Supernatan disuspensikan dengan 1x volume PCI (fenol:kloroform:isoamil alkohol (25:24:1)), diinkubasi selama 10 menit pada suhu ruang dan selanjutnya disentrifugasi 12000 rpm selama 10 menit. Supernatan ditambah 2x volume etanol absolut, diinkubasi selama 2 jam di freezer dan
selanjutnya disentrifugasi 12000 rpm selama 10 menit. Pelet dikeringkan dan kemudian ditambahkan 30 µl ddH2O. RNA didegradasi dengan menambahkan
100 ppm RNAse dan diinkubasi pada suhu 37oC selama 30 menit. Plasmid dielektroforesis di agarosa 1% (b/v) dalam bufer TAE 1x (40 mM Tris-asetat, 1 mM EDTA) pada tegangan 100 volt selama 30 menit.
3.3.4 Pengurutan nukleotida dan analisis urutan nukleotida
Pengurutan fragmen cDNA eglA dilakukan menggunakan DNA sequencer
ABI Prism Model 3100 versi 3.7 di Badan Pengkajian dan Penerapan Teknologi. Urutan nukleotida gen endoglukanase yang dihasilkan dianalisis menggunakan beberapa program yang tersedia. Analisis homologi urutan nukleotida yang dihasilkan terhadap organisme lain dilakukan menggunakan program BLAST2 (basic local alignment search tool) (http://www.ebi.ac.uk/blast2), deduksi asam amino dilakukan dengan menggunakan program Translate Tools
(http://expasy.ch/tools/translate) (Gasteiger et al. 2003), analisis situs pemotongan
dilakukan dengan menggunakan program NEBcutter (http://tools.neb.com/ NEBcutter) (Vincze et al. 2003), analisis hidrofobisitas dilakukan dengan
menggunakan program ProtScale pada http://www.expasy.ch/cgi-bin/protscale.pl dan TMHMM (http://cbs.dtu.dk/services/TMHMM-2.0) (Claverie & Notredame 2003; Gasteiger et al. 2003), analisis domain dilakukan dengan
menggunakan program Pfscan (http://hits.isb-sib.ch/cgi-bin/PFSCAN) (Claverie & Notredame 2003), multiple sequence alignment dilakukan dengan program Tree based Consistency Objective Function For alignmEnt Evaluation (T-COFFEE)
(Notredame et al. 2000), visualisasi multiple sequence alignment dengan program
Chroma (Goodstadt & Ponting 2001) dan konstruksi pohon filogenetik dengan program phylogeny inference package (PHYLIP) (http://bioweb.pasteur.fr/ seqanal/phylogeny/phylip-uk.html) dan visualisasi pohon filogenetik dengan program njplot versi 2.3.
IV. HASIL DAN PEMBAHASAN
4.1 Uji Aktivitas Selulolitik
4.1.1 Uji aktivitas selulolitik secara kualitatif
Aktivitas selulolitik beberapa isolat A. niger dan Trichoderma diuji pada
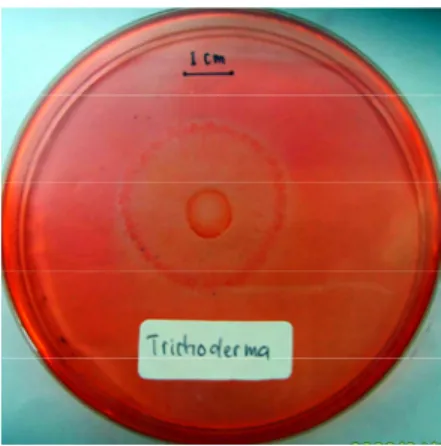
media agar CMC. Adanya aktivitas selulolitik ditandai dengan terbentuknya zona bening disekeliling koloni cendawan (Gambar 6). Pewarna Congo Red
berinteraksi secara kuat dengan polisakarida yang mengandung ikatan β-(1,4) dan
β-(1,3) glikosidik membentuk kompleks warna-glukan (Teather & Wood 1982).
Zona bening yang terbentuk mengindikasikan tidak adanya kompleks warna-glukan akibat terjadinya hidrolisis ikatan glikosidik CMC. Sedangkan daerah yang masih berwarna merah mengindikasikan masih adanya kompleks warna-glukan yang mengindikasikan tidak terjadi hidrolisis substrat CMC.
Rata-rata nisbah selulolitik terbesar ditunjukkan oleh isolat A. niger KB12
sebesar 0.47 dan terkecil ditunjukkan oleh isolat Trichoderma IPB12 sebesar 0.02
(Tabel 3). Besarnya nisbah selulolitik ini seringkali tidak berkorelasi dengan besarnya aktivitas selulase. Hal ini kemungkinan disebabkan adanya variasi kecepatan pertumbuhan cendawan.
Gambar 6 Aktivitas selulolitik yang ditunjukkan dengan terbentuknya zona bening disekeliling koloni setelah inkubasi 24 jam pada suhu ruang. (a)
A. niger, (b) Trichoderma.
Tabel 3 Nisbah selulolitik A. niger dan Trichoderma setelah 24 jam inkubasi
pada suhu ruang
Isolat Rata-rata diameter koloni (cm) Rata-rata diameter zona bening (cm) Rata-rata nisbah selulolitik Aspergillus niger IPB1 20.25 28.08 0.37±0,011 A. niger IPB4 19.92 23.50 0.18±0,078 A. niger IPB5 20.17 23.83 0.18±0,019 A. niger KB12 15.67 23.00 0.47±0,056 A. niger TSR12 18.33 25.08 0.37±0,042 A. niger TSR13 17.58 21.33 0.22±0,076 A. niger TSR52 17.75 24.50 0.38±0,033 Trichoderma reesei 29.33 30.33 0.03±0,001 Trichoderma IPB2 30.00 31.00 0.03±0,001 Trichoderma IPB9 32.67 34.17 0.05±0,028 Trichoderma IPB11 24.00 25.83 0.08±0,007 Trichoderma IPB12 33.17 34.00 0.02±0,007
4.1.2 Uji aktivitas enzim endoglukanase secara kuantitatif
Rata-rata aktivitas spesifik tertinggi ditunjukkan oleh isolat A. niger IPB1
sebesar 5.74 U/mg dan terkecil ditunjukkan oleh isolat Trichoderma IPB2 sebesar
1.31 U/mg (Tabel 4). Beberapa isolat A. niger dan Trichoderma, seperti A. niger
IPB1, A. niger TSR52, A. niger IPB5, A niger KB12, A. niger TSR12, A. niger
TSR13 menunjukkan aktivitas yang lebih tinggi dibandingkan isolat T. reesei
yang merupakan standar aktivitas enzim selulase. Elshafei et al. (1990)
melaporkan bahwa aktivitas enzim endoglukanase A. terreus lebih tinggi
dibandingkan Trichoderma viride yang merupakan standar aktivitas enzim
selulase, sedangkan Pothiraj et al. (2006) melaporkan aktivitas enzim
endoglukanase A. niger lebih tinggi dibandingkan A. terraus. Namun demikian
pembandingan secara langsung hasil ini sulit dilakukan karena banyaknya faktor yang mempengaruhi, seperti komposisi media dan pemilihan substrat yang dapat mempengaruhi aktivitas enzim (Sharma et al. 1986).
Banyak faktor terlibat dalam kinerja suatu enzim, seperti suhu dan pH. Pada penelitian ini digunakan metode yang umum digunakan untuk sistem enzim selulase T. reesei (Ghose 1987) sehinggga tidak menutup kemungkinan aktivitas
beberapa isolat A. niger pada uji ini belum mencapai aktivitas optimalnya.
Beberapa laporan menunjukkan aktivitas enzim endoglukanase A. niger
mempunyai kisaran suhu dan pH yang luas. Suhu optimum aktivitas endoglukanase A. niger dilaporkan berkisar 40oC (Coral et al. 2002) dan 70oC
(Hong et al. 2001). pH optimum aktivitas enzim endoglukanase A. niger
dilaporkan berkisar 4.5 dan 7.5 (Coral et al. 2002), antara 6.0 dan 7.0 (Akiba et al.
1995), dan 6.0 (Hong et al. 2001).
Tabel 4 Aktivitas enzim endoglukanase A. niger dan Trichoderma pada suhu
50oC yang diukur setelah 7 hari inkubasi
Nama isolat Rata- rata biomassa (mg) Rata-rata aktivitas spesifik (U/mg) A. niger IPB1 42 5.74±0.58 A. niger TSR52 48 5.42±0.67 A. niger IPB5 37 4.96±0.24 A. niger KB12 45 4.83±1.01 A. niger TSR12 51 4.68±0.46 Trichoderma IPB11 31 4.30±0.54 A. niger TSR13 41 3.03±0.42 Trichoderma reseei 38 3.01±0.26 A. niger IPB4 43 2.73±0.38 Trichoderma IPB9 47 2.53±0.59 Trichoderma IPB12 35 2.35±0.94 Trichoderma IPB2 37 1.31±0.80
4.2 Isolasi Gen eglA A. niger IPB1 4.2.1 Isolasi RNA total
Isolasi RNA total dilakukan pada isolat yang mempunyai aktivitas spesifik tertinggi, yaitu isolat A. niger IPB1. RNA total berhasil diisolasi dari miselium A. niger IPB1 yang ditumbuhkan dalam medium induksi CMC. Kuantitas RNA total
yang dihasilkan berdasarkan pengukuran dengan spektrofotometer pada panjang gelombang 260 nm adalah 176.4 µg tiap gram miselium. Selanjutnya berdasarkan nilai rasio OD260/OD280, yaitu sebesar 1.72, maka RNA total yang dihasilkan
mempunyai kemurnian yang cukup tinggi (Tabel 5). Manchester (1996) menyatakan bahwa kemurnian RNA yang tinggi ditunjukkan dengan nilai rasio OD260/OD280 antara 1.8 dan 2.0. Hasil elektroforesis menunjukkan RNA total
hasil isolasi mempunyai integritas yang cukup tinggi. Hal ini ditunjukkan dengan adanya dua pita yang dominan, yaitu RNA ribosomal (rRNA) 28S dan 18S (Gambar 7).
Tabel 5 Hasil isolasi RNA total Absorban Bahan λ260 λ280 λ260/ λ280 Total RNA (µg/ g miselium) Miselium A. niger IPB1 0.210 0.122 1.72 176.4
Gambar 7 Hasil isolasi RNA total A. niger IPB1 yang diisolasi dari miselium
setelah inkubasi 3 hari yang dideteksi dengan elektroforesis menggunakan gel agarosa 1% (b/v).
4.2.2 Sintesis cDNA total
Sintesis cDNA dilakukan menggunakan RNA total yang telah diisolasi sebagai cetakan melalui proses transkripsi balik. Proses ini menggunakan primer oligo(dT) sehingga hanya mRNA yang akan disintesis menjadi cDNA karena adanya ekor poli(A) pada ujung 3’. Sebagai kontrol keberhasilan sintesis cDNA, dilakukan amplifikasi terhadap gen aktin menggunakan primer spesifik (ActF dan ActR2).
Hasil amplifikasi gen aktin dengan cDNA sebagai cetakan menghasilkan satu pita DNA yang berukuran 123 bp (Gambar 8). Hasil ini menunjukkan bahwa sintesis cDNA total telah berlangsung dengan baik. Selain itu, hasil ini juga menunjukkan RNA yang dihasilkan tidak terkontaminasi oleh DNA genom. Adanya kontaminasi oleh DNA akan ditunjukkan dengan adanya dua pita DNA yang dihasilkan, yaitu pita berukuran 123 bp yang menunjukkan hasil amplifikasi cDNA dan pita berukuran 223 bp yang menunjukkan hasil amplifikasi DNA
rRNA 28S
genom. Pada DNA genom terdapat intron antara ekson1 dan ekson2 sehingga fragmen yang dihasilkan lebih besar.
Gambar 8 Hasil amplifikasi gen aktin dengan PCR yang dideteksi dengan elektroforesis menggunakan gel agarosa 3% (b/v). Lajur 1. Penanda
ΦX174RF DNA/HaeIII Fragments; 2. Gen aktin
4.2.3 Isolasi gen eglA
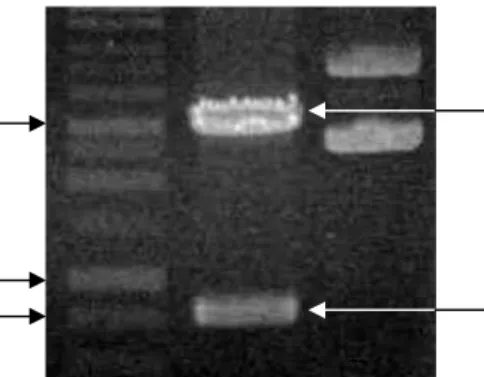
Hasil sintesis cDNA selanjutnya digunakan sebagai cetakan untuk mengisolasi gen eglA. Isolasi gen eglA dilakukan dengan amplifikasi
menggunakan PCR dengan primer spesifik EAF dan EAR. Amplifikasi gen eglA A. niger IPB1 menghasilkan pita sekitar 750 bp sesuai dengan hasil prediksi dari
database (Gambar 9).
Gambar 9 Hasil amplifikasi eglA dengan PCR yang dideteksi dengan
elektroforesis menggunakan gel agarosa 1% (b/v). Lajur 1. Penanda 1 kb; 2. eglA hasil PCR
4.2.4 Pengklonan gen eglA
Gen eglA hasil isolasi disisipkan dalam plasmid pGEM-T Easy, ditengah
gen lacZ dengan bantuan enzim ligase. Hasil ligasi kemudian diintroduksikan ke
dalam E. coli galur DH5α yang selanjutnya ditumbuhkan dalam media seleksi
yang mengandung ampisilin, X-gal dan IPTG. Keberhasilan pengklonan gen eglA
dapat diketahui dengan terbentuknya koloni putih (Gambar 10). 310 bp 194 bp 123 bp 1 2 118 bp 750 bp 750bp 1000 bp 1 2