VI. PEMBAHASAN
Praktikum yang dilaksanakan pada tanggal 7 Maret 2011 ini mengenai pemeliharaan kultur mikroorganisme yang bertujuan agar praktikan dapat mengerjakan proses pengenceran dan dapat menginokulasi mikroorganisme dengan cara metode tuang dan gores. Selain itu, praktikan juga dapat mengerjakan cara pemeliharaan kultur cair dan kultur padat. Namun, sebelum praktikum pemeliharaan kultur mikroorganisme ini dilaksanakan, praktikan terlebih dahulu melakukan praktikum pengamatan bentuk kapang yang seharusnya praktikum ini dilaksanakan pada praktikum sebelumnya.
Kapang adalah kelompok mikroba yang tergolong dalam fungi (Fardiaz, 1992). Kapang merupakan mikroba yang multiseluler, terdiri dari benang-benang halus yang disebut hifa (hypha) dan kumpulan hifa disebut miselium (mycellium) (Sumanti, 2009).
Hifa dapat dibedakan atas dua macam, yaitu hifa vegetatif atau hifa tumbuh, dan hifa fertil yang membentuk bagian reproduksi. Pada kebanyakan kapang, hifa fertil tumbuh di atas permukaan, tetapi pada beberapa kapang mungkin terendam. Penyerapan nutrient terjadi pada permukaan miselium (Fardiaz, 1992).
Kapang dapat dibedakan atas dua kelompok berdasarkan struktur hifanya, yaitu (1) hifa tidak bersekat atau nonseptat, (2) hifa bersekat atau septat yang membagi hifa dalam mangan-mangan, dimana setiap mangan mempunyai satu atas lebih inti sel (Fardiaz, 1992).
Kapang yang digunakan dalam praktikum ini mempunyai ciri-ciri sebagai berikut:
1. hifa nonseptat,
2. mempunyai stolon dan rhizoid yang warnanya gelap jika sudah tua, 3. sporangiofora tumbuh pada noda dimana terbentuk juga rizoid, 4. sporangia biasanya besar dan berwarna hitam,
5. kolumela agak bulat dan apofisis berbentuk seperti cangkir, 6. tidak mempunyai sporanglola,
7. membentuk hifa vegetatif yang melakukan penentrasi pada substrat, dan hifa fertil yang memproduksi sporangia pada ujung sporangiofora,
8. pertumbuhannya cepat, membentuk miselium seperti kapas. (Fardiaz,1992)
Berdasarkan ciri-ciri tersebut, maka kapang yang digunakan dalam praktikum ini adalah Rhizopus sp. Kapang ini biasanya digunakan dalam fermentasi tempe dan oncom hitam, namun dapat pula ditemukan pada roti dan beberapa jenis sayuran dan buah-buahan.
Proses pengamatan kapang memiliki beberapa tahap. Pertama, gelas objek dibersihkan dengan kapas yang sudah diberi alkohol 70% kemudian dikeringkan. Pemberian alkohol ini bertujuan agar gelas objek yang akan digunakan sebagai alas untuk objek / sampel sudah steril. Kedua, memasukkan gelas objek ke dalam cawan petri yang telah dialasi oleh kertas saring dan meneteskan PDA di atas gelas objek dan membiarkannya hingga kering. PDA berfungsi sebagai media untuk tumbuh atau berkembangbiaknya kapang. Ketiga, pemotongan sedikit PDA yang telah kering. Tahap selanjutnya yaitu mengembil kapang menggunakan Öse dan menempelkannya pada bagian agar yang telah dipotong tadi dengan sedikit agak ditekan-tekankan. Hal ini dilakukan dengan tujuan agar kapang dapat tumbuh ke arah samping sehingga mudah untuk diamati. Tahap kelima adalah mengoleskan vaselin pada tiap sudut kaca penutup lalu menutupkannya pada gelas objek yang telah berisi kapang tadi. Maksud dari pemberian vaselin ini adalah untuk memberikan suasana yang aerob. Tahap keenam, meneteskan aquades steril keatas kertas saring yang ada di dalam cawan petri. Pemberian aquades ini bertujuan untuk memberikan suasana lembab, karena kapang hidup pada suasana lembab. Tahap ketujuh, mengeramkan mikrokultur (kapang) selama 48 jam pada suhu 240C (suhu ruang). Tahap terakhir yaitu mengamati kapang di bawah mikroskop.
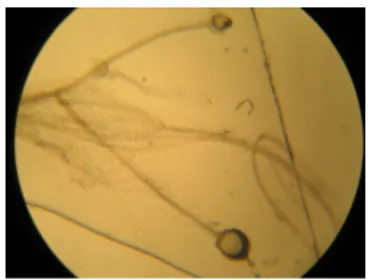
Pada saat pengamatan kapang di bawah mikroskop dengan perbesaran 10
0,25 dilakukan, praktikan tidak menemukan struktur kapang secara jelas. Kesalahan ini mungkin disebabkan karena bentuk PDA yang diteteskan pada
gelas objek berbentuk cembung pada bagian permukaannya sehingga ketika ditempelkan kapang pada bagian sisi agar yang telah dipotong, kapang tersebut tidak tumbuh kearah samping seperti yang diharapkan oleh praktikan, melainkan tumbuh ke arah atas sehingga ketika dilakukan pengamatan terhadap kapang ini bagian yang terlihat hanya hifa.
Berikut ini adalah gambar kapang praktikan peroleh dari hasil pengamatan:
Gambar 1. Rhizopus sp (perbesaran 10 0,25 )
Sedangkan gambar berdasarkan literatur adalah sebagai berikut:
Gambar 2. Rizhopus sp (gedbinlink.files, 2011)
Praktikum selanjutnya adalah pemeliharaan kultur mikroorganisme, yaitu praktikum isolasi bakteri, kapang dan khamir yang mencakup pengenceran, metode agar tuang, metode gores atau agar cawan, pemeliharaan kultur padat yang mencakup agar tegak dan agar miring serta praktikum pemeliharaan kultur cair.
Isolasi bakteri bertujuan untuk memeilhara mikroba untuk keperluan penelitian atau untuk pengamatan. Isolasi menggunakan media yang spesifik sehingga terbentuk suatu kultur murni yang disebut isolat. Isolat ini diperoleh dengan cara metode tuang dan metode gores. Metode inilah yang praktikan lakukan dalam praktikum ini untuk mengisolasi mikroba.
Bakteri, kapang, dan khamir banyak terdapat di alam dan pada bahan pangan yang dikonsumsi. Pada praktikum kali ini, praktikan mengisolasi
ketiga jenis mikroorganisme tersebut dengan menggunakan sampel air mineral, lada bubuk, roti, dan jus jeruk. Sebelumnya, dilakukan pengenceran terhadap sampel. Media yang digunakan dalam tahap isolasi mikroorganisme adalah Nutrient Agar (NA) yang digunakan unuk mendeteksi semua mikroorganisme.
Pengenceran
Sebelum mikroorganisme diisolasi, kita harus melakukan pengenceran pada sampel. Pengenceran dilakukan 10-1, 10-2 dan 10-3. Semakin encer maka mikroorganisme yang terdapat dalam pangan tersebut semakin rendah. Larutan pengencer terdiri dari NaCl fis 0,85%, larutan buffer fosfat, larutan ringer dan aquades steril. Larutan yang digunakan dalam praktikum ini adalah aquades steril. Sampel harus disuspensikan dalam larutan Akuades steril dengan perbandingan pengenceran 1:10 yakni 1 gram sampel dengan 9 ml larutan aquades steril untuk sampel padat sedangkan 1 ml sampel dengan 9 ml larutan aquades steril untuk sampel cair. Setelah terbentuk suspensi maka dilakukan pengenceran sampai tahap 10-3. Pengenceran dilakukan agar pertumbuhan mikroorganisme pada sampel tidak terlalu banyak sehingga dapat dilakukan penghitungan.
Metode Agar Tuang
Pada metode agar tuang, media yang digunakan adalah NA. NA dituangkan ke dalam dua cawan petri yang berbeda. Pada cawan petri pertama, NA dimasukkan pada pengenceran sampel 10-2 dan pada cawan petri kedua NA dimasukkan pada pengenceran sampel 10-3. Kemudian diinkubasi selama 2 hari. Setelah dua hari, dilakukan pengamatan terhadap cawan petri tersebut.
Sampel pada metode agar tuang yang digunakan dalam praktikum ini adalah air mineral, lada bubuk, roti dan jus jeruk. Hasil dari metode agar tuang ini dapat dilihat pada tabel 1 untuk pengenceran 10-2 dan tabel 2 untuk pengenceran 10-3.
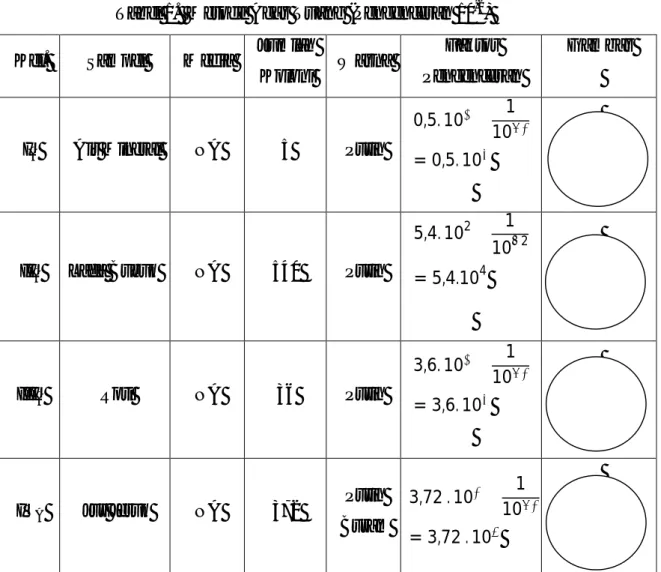
Tabel 1. Metode Agar Tuang (Pengenceran 10-2) Kel. Sampel Media Jumlah
Koloni Warna
Faktor Pengenceran
Gambar
IA Air Mineral NA 5 Putih
0,5. 10 1 10 = 0,5. 10
IIA Lada Bubuk NA 540 Putih
5,4. 102 1 10−2 = 5,4.104
IIIA Roti NA 36 Putih
3,6. 10 1 10 = 3,6. 10 IVA Jus Jeruk NA 372 Putih Buram 3,72 . 10 1 10 = 3,72 . 10
Tabel 2. Metode Agar Tuang (Pengenceran 10-3) Kel. Sampel Media Jumlah
Koloni Warna
Faktor Pengenceran
Gambar
IA Air Mineral NA 7 Putih
0,7. 10 1 10 = 0,7. 10
IIA Lada Bubuk NA 163 Putih
1,63. 10 1 10 = 1,63. 10
IIIA Roti NA 8 Putih
0,8. 10 1 10 = 0,8. 10
IVA Jus Jeruk NA 310 Putih
Keruh
3,1 . 10 1 10 = 3,1 . 10
Pada isolasi sampel air mineral, mikroorganisme yang tumbuh pada cawan petri dengan pengenceran 10-2 berjumlah lima koloni, empat koloni berwarna putih, dan satu koloni berwarna agak putih. Jadi perhitungan koloni mikroorganisme pada pengenceran 10-2 dengan sampel air mineral ini adalah 5 x 1
10−2 = 0,5 x 10 3
koloni mikroorganisme. Jumlah mikroorganisme yang tumbuh pada cawan petri dengan pengenceran 10-3 berjumlah tujuh koloni mikroorganisme dengan semua mikroorganisme tersebut berwarna putih. Koloni tersebut dapat dihitung dengan persamaan 7 x 1
10−3 = 0,7 x 10 4
koloni mikroorganisme.
Pada isolasi sampel lada bubuk, mikroorganisme yang tumbuh pada cawan petri dengan pengenceran 10-2 berjumlah 540 koloni, semua koloni berwarna putih. Jadi perhitungan koloni mikroorganisme pada pengenceran 10-2 dengan sampel lada bubuk ini adalah 540 x 1
10−2 = 5,4 x 104 koloni mikroorganisme. Jumlah mikroorganisme yang tumbuh pada cawan petri dengan pengenceran 10-3 berjumlah 163 koloni mikroorganisme dengan semua mikroorganisme tersebut berwarna putih. Koloni tersebut dapat dihitung dengan persamaan 163 x 1
10−3 = 1,63 x 10 5
koloni mikroorganisme.
Pada isolasi sampel roti, mikroorganisme yang tumbuh pada cawan petri dengan pengenceran 10-2 berjumlah 36 koloni, semua koloni berwarna putih. Jadi perhitungan koloni mikroorganisme pada
pengenceran 10-2 dengan sampel roti ini adalah 36 x 1
10−2 = 3,6 x 10 3
koloni mikroorganisme. Jumlah mikroorganisme yang tumbuh pada cawan petri dengan pengenceran 10-3 berjumlah delapan koloni mikroorganisme dengan semua mikroorganisme tersebut berwarna putih. Koloni tersebut dapat dihitung dengan persamaan 8 x 1
10−3 = 0,7 x 10 4
koloni mikroorganisme.
Pada isolasi sampel jus jeruk, mikroorganisme yang tumbuh pada cawan petri dengan pengenceran 10-2 berjumlah 372 koloni, dan koloni tersebut berwarna putih buram. Jadi perhitungan koloni mikroorganisme pada pengenceran 10-2 dan sampel jus jeruk ini adalah 372 x 1
10−2 = 3,72 x 104 koloni mikroorganisme. Jumlah mikroorganisme yang tumbuh pada cawan petri dengan pengenceran 10-3 berjumlah 310 koloni mikroorganisme dan mikroorganisme tersebut berwarna putih buram. Koloni tersebut dapat dihitung dengan persamaan 310 x 1
10−3 = 3,1 x 10 5
koloni mikroorganisme.
Dari penjelasan di atas dapat disimpulkan bahwa mikroorganisme yang tumbuh pada pengenceran 10-2 lebih banyak dibandingkan yang tumbuh pada pengenceran 10-3. Hal ini disebabkan karena pada sampel pengenceran 10-3 lebih encer dibandingkan pengenceran 10-2. Sehingga, pada pengenceran 10-2 lebih banyak terkandung sampel yang menyebabkan lebih banyak mikroorganisme yang tumbuh.
Pada sampel-sampel yang dituju, banyak ditemukan koloni-koloni mikroorganisme khususnya kapang. Hal ini dapat terjadi dikarenakan pada saat praktikum tidak dilakukan secara aseptis, sehingga mudah terkontaminasi atau karena sampel-sampel yang berupa bahan panngan tersebut memiliki kualitas yang rendah. Sehingga terdapat banyak mikroorganisme-mikroorganisme yang tidak diinginkan.
Metode Gores
Media yang digunakan pada metode gores adalah NA yang dimasukkan ke dalam 4 cawan petri yang berbeda. Kemudian tunggu
beberapa saat sampai media membeku. NA dibiarkan membeku agar sampel yang digoreskan pada NA tersebut dapat menempel Setelah membeku, dilakukan penggoresan 4 buah sampel bakteri dengan tiga cara penggoresan yaitu, goresan langsung, kuadran, dan radial. Sampel yang digunakan adalah sampel bakteri Lactobascillus bulgaricus, Lactobacillus acidophilus, Streptococcus thermophilus dan Bifidobacterium bifidum. Kemudian isolat (bakteri yang diisolasi) diinkubasi selama 2 hari. Setelah dilakukan pengamatan pada keempat sampel yang diuji, pertumbuhan mikroorganisme yang terjadi pada masing-masing sampel berbeda. Hasil dari praktikum metoe gores ini dapat dilihat pada tabel 3.
Tabel 3. Mikroorganisme Pada Metode Gores Kel. Sampel Media Jumlah
Koloni Warna Metode
Gambar IA Lactobacillus bulgaricus (C) NA 262 Putih Langsung IIA Streptococcus thermophilus (D) NA 38 Putih Langsung IIIA Lactobacillus
acidophilus (A) NA 110 Putih Kuadran
IVA Bifidobacterium
bifidum (B) NA 58
Putih
Kecoklatan Radian
Pada sampel Lactobascillus bulgaricus dan media NA dengan metode gores langsung ditemukan koloni sebanyak 262 koloni
mikroorganisme berwarna putih. Pada sampel Streptococcus thermophilus
dan media NA dengan metode gores langsung ditemukan koloni sebanyak 38 koloni mikroorganisme berwarna putih. Pada sampel Lactobacillus acidophilus dengan gores kuadranditemukan koloni sebanyak 110 koloni mikroorganisme berwarna putih. Pada sampel Bifidobacterium bifidum
dengan metode gores radian ditemukan koloni sebanyak 58 koloni mikroorganisme berwarna putih kecoklatan.
Perbedaan jumlah koloni pada masing-masing jenis goresan dapat disebabkan oleh beberapa faktor, diantaranya:
1. Lingkungan yang kurang steril
2. Homogenisasi pada saat pengocokan sampel 3. Waktu yang tidak konstan
4. Kawat ose yang terlalu panas ataupun kurang panas
Pemeliharaan Kultur Padat
Pada pemeliharaan kultur padat, digunakan media NA. Proses pemeliharaan ini dilakukan dengan dua cara, yaitu agar tegak dan agar miring. Agar tegak digunakan untuk membiakkan bakteri anaerobik, sedangkan agar miring untuk membiakkan bakteri aerobik dan anaerobik fakultatif (bakteri asam laktat).
Setelah diinkubasi selama dua hari, terbentuk koloni bakteri. Bentuk koloni pada agar miring dapat berupa filiform, ekinulat, beadad, efus, arboresen, atau rhizoid. Pada agar tegak akan menghasilkan bentuk filiform, beadad, papilat, arboresen, atau vilous. Tabung reaksi yang menunjukkan bentuk filiform mengidentifikasikan tumbuhnya bakteri anaerobik fakultatif. Pengamatan yang dilakukan adalah pertumbuhan mikroorganisme
Agar Tegak
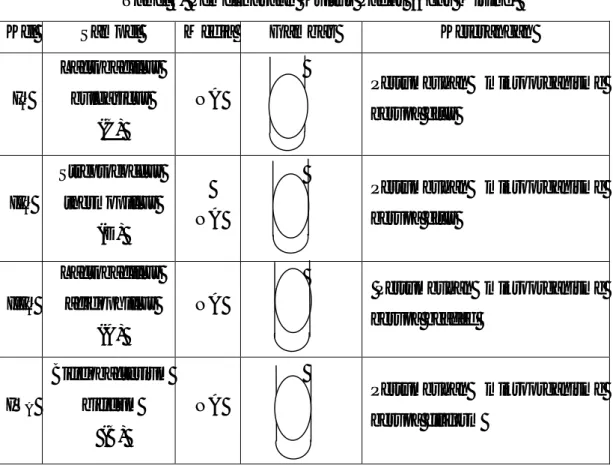
Media yang digunakan pada agar tegak ini adalah NA. Madia telah disiapkan pada tabung reaksi beberapa waktu sebelum praktikum dilakukan. Dalam membuat agar tegak ini diawali dengan inokulasi kultur murni yang dalam praktikum ini kultur murni tersebut berupa
bakteri Lactobacillus bulgaricus, Streptococcus thermophilus, Lactobacillus acidophillus dan Bifidobacterium bifidum. Inokulasi tersebut dengan cara menusukkan loop pada bagian tengah tabung (stab). Kemudian kultur tersebut diinkubasi pada suhu 30-320C selama 48 jam. Inkubasi ini dilakukan untuk membiakkan atau menumbuhkan bakteri. Setelah selesai diinkubasi, kultur tersebut diamati. Hasil pengamatan pada setiap kultur tersebut dapat dilihat pada tabel 4.
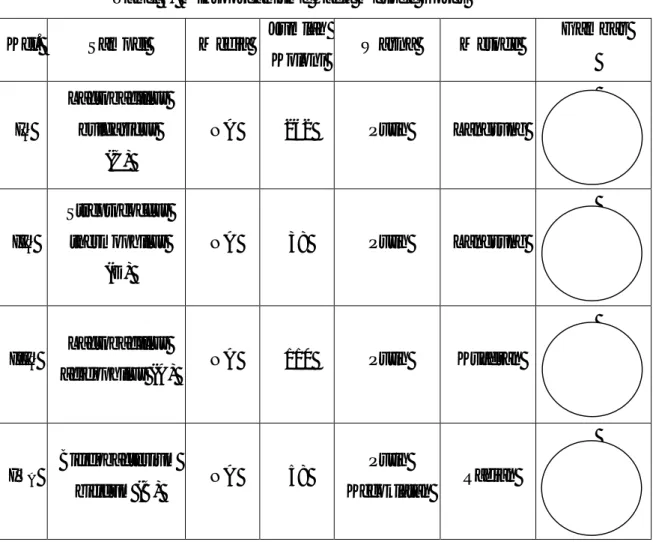
Tabel 4. Pemeliharaan Kultur Padat (Agar Tegak)
Berdasarkan tabel diatas, hasil identifikasi pada sampel
Lactobacillus bulgaricus adalah pertumbuhan mikroorganisme berbentuk filiform dan pada bagian permukaan media terdapat koloni mikroorganisme. Pada sampel Streptococcus thermophillus
pertumbuhan mikroorganisme berupa filiform. Sedangkan pada sampel
Kel Sampel Media Gambar Keterangan
IA Lactobacillus bulgaricus (C) NA -Pertumbuhan mikroorganisme berupa filiform
-Pada permukaan terdapat koloni mikroorganisme
IIA
Streptococcus thermopillus
(D)
NA Pertumbuhan mikroorganisme berupa
foliform IIIA Lactobacillus acidophillus (A) NA -Pertumbuhan mikroorganisme berupa papilet
-Pada permukaan terdapat koloni mikroorganisme
IVA Bifidobacterium
bifidum (B) NA
-Pertumbuhan mikroorganisme berupa filiform
-Pada permukaan terdapat koloni mikroorganisme
Lactobacillus acidophilus pertumbuhan bakteri berupa papilet dan terdapat koloni pada permukaan dari media serta pada sampel
Bifidobacterium bifidum pertumbuhan mikroorganisme berupa filiform dan pada permukaan media.
Pada praktikum pemeliharaan kultur padat berupa agar tegak ini terdapat koloni pada permukaan mikroorganisme. Hal ini menunjukkan bahwa media tersebut ditumbuhi mikroorganisme, dan pada saat pengambilan dan penggoresan kultur dilakukan secara benar sesuai dengan aturan.
Agar Miring
Pada pemeliharaan kultur dengan agar miring ini tidak jauh berbeda dengan agar tegak. Perbedaannya hanya terletak pada bentuk agar yang digunakan. Pada agar tegak, media agar yang digunakan berupa agar yang bentuknya tegak sama persis seperti bentuk dari tabung reaksi. Sedangkan pada agar miring, agar yang digunakan berupa agar yang berbentuk miring, yaitu agar yang yang dituangkan ke dalam tabung reaksi dimiringkan ketika dalam pembuatannya.
Media yang digunakan pada agar miring ini sama dengan media yang digunakan pada agar tegak, yaitu NA. Madia telah disiapkan pada tabung reaksi beberapa waktu sebelum praktikum dilakukan. Dalam membuat agar tegak ini diawali dengan inokulasi kultur murni yang dalam praktikum ini kultur murni tersebut berupa bakteri Lactobacillus bulgaricus, Streptococcus thermophilus, Lactobacillus acidophillus dan
Bifidobacterium bifidum. Berbeda dengan agar tegak, pada agar miring inokulasi tersebut dilakukan dengan cara menggoreskan (streak) bakteri secara zigzag menggunakan loop. Kemudian kultur tersebut diinkubasi pada suhu 30-320C selama 48 jam. Inkubasi ini dilakukan untuk membiakkan atau menumbuhkan bakteri. Setelah selesai diinkubasi, kultur tersebut diamati. Hasil pengamatan pada setiap kultur tersebut dapat dilihat pada tabel 5.
Tabel 5. Pemeliharaan Kultur Padat (Agar Miring)
Kel Sampel Media Gambar Keterangan
IA Lactobacillus bulgaricus (C) NA Pertumbuhan mikroorganisme berupa efus IIA Streptococcus thermopillus (D) NA Pertumbuhan mikroorganisme berupa efus IIIA Lactobacillus acidophillus (A) NA Pertumbuhan mikroorganisme berupa beaded IVA Bifidobacterium bifidum (B) NA Pertumbuhan mikroorganisme berupa filiform
Berdasarkan tabel diatas, hasil identifikasi pada sampel
Lactobacillus bulgaricus dan Streptococcus thermophillus pertumbuhan mikroorganisme berupa efus. Sedangkan pada sampel Lactobacillus acidophilus pertumbuhan bakteri berupa beaded dan pada sampel
Bifidobacterium bifidum pertumbuhan mikroorganisme berupa filiform. Hampir sama dengan metode agar tegak, pemeliharaan mikroorganisme pada agar miring juga terjadi pertumbuhan mikroorganisme yaitu bakteri. Hal ini menandakan bahwa mikroorganisme yang dibiakkan atau ditumbuhkan, berkembang biak dengan baik. Selain itu, pada saat pengambilan dan penggoresan kultur dilakukan secara benar sesuai dengan aturan.
Pemeliharaan Kultur Cair
Pemeliharaan pada kultur cair bertujuan untuk memisahkan pertumbuhan sel-sel mikroorganisme yang satu dan yang lainnya. Kultur cair digunakan untuk mengembangbiakan kultur yang daya hidupnya tidak
lam. Langkah-langkah yang dilakukan dalam pemeliharaan kultur cair ini ialah memasukan NB (Nutrient Broth) pada tabung reaksi. Kemudian pengambilan satu Öse kultur murni yaitu bakteri Lactobacillus bulgaricus,
Streptococcus thermophillus, Lactobacillus acidophilus dan
Bifidobacterium bifidum dan memasukkannya ke dalam medium NB. Setelah itu, dilakukan inkubasi pada suhu 30-320C selama 48 jam. Kemudian pengamatan terhadap kultur cair ini. Setelah itu, lalu dilakukan pengamatan. Hasil pengamatan dari pemeliharaan kultur cair ini dapat dilihat pada tabel 6.
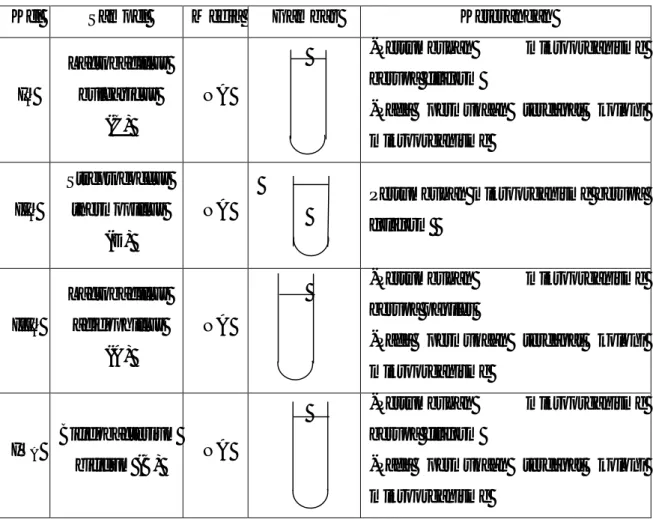
Tabel 6. Hasil Pengamatan Pemeliharaan Kultur Cair
Kel Sampel Media Gambar Keterangan
IA
Lactobacillus bulgaricus
(C)
NB
terdapat kekeruhan pada lapisan permukaan
terdapat endapan pada bagian permukaan pertumbuhan mikroorganisme berupa pelikel IIA Streptococcus thermopillus (D) NB
Terkontaminasi oleh kapang
IIIA
Lactobacillus acidophillus
(A)
NB
terdapat kekeruhan pada lapisan permukaan
terdapat endapan pada bagian permukaan pertumbuhan mikroorganisme berupa membran IVA Bifidobacterium bifidum (B) NB
terdapat kekeruhan pada lapisan permukaan
terdapat endapan pada bagian permukaan
pertumbuhan mikroorganisme berupa flokulen
Berdasarkan tabel diatas, pengamatan yang dilakukan pada pemeliharaan kultur cair ini berupa kekeruhan pada semua bagian medium, sedimentasi yang berupa endapan pada medium, dan pertumbuhan pada permukaan, dapat berupa pelikel, cincin, membran, atau flokulen. Pada bakteri Lactobacillus bulgaricus dan terdapat kekeruhan dan endapan pada lapisan permukaan serta pertumbuhan mikroorganisme yang berupa pelikel. Pada sampel bakteri Streptococcus thermophillus tidak tampak kekeruhan, endapan maupun pertumbuhan mikroorganisme, kemungkinan terjadinya hal ini adalah sampel terkontaminasi oleh kapang. Pada
Lactobacillus acidophilus terdapat kekeruhan dan endapan pada bagian permukaan media disertai pertumbuhan mikroorganisme yang berbentuk membran. Sedangkan pada Bifidobacterium bifidum pertumbuhan mikroorganisme berupa flokulen dan terdapat kekeruhan serta endapan pada bagian permukaan. Pembentukan sedimen (endapan) dan kekeruhan pada medium menandakan bahwa pada medium tumbuh mikroorganisme.
VII. KESIMPULAN
Kapang merupakan mikroorganisme yang tersdiri dari benang-benang halus yang disebut hifa.
Pengenceran berfungsi untuk mengencerkan mikroorganisme. Pengenceran dilakukan dalam praktikum ini hingga 10-3.
Dalam metode tuang, mikroorganisme yang tumbuh pada pengenceran 10 -2
lebih banyak dibandingkan yang tumbuh pada pengenceran10-3. Hal ini disebabkan karena pada sampel pengenceran 10-3 lebih encer dibandingkan pengenceran 10-2. Sehingga, pada pengenceran 10-2 lebih banyak terkandung sampel yang menyebabkan lebih banyak mikroorganisme yang tumbuh.
Metode gores dapat dilakukan dengan tiga metode, yaitu langsung, kuadran dan radian.
Pada pemeliharaan kultur padat berupa agar tegak, pertumbuhan mikroorganisme dapat berupa filiform, beaded, palipat, arboresen dan vilous.
Pada pemeliharaan kultur padat berupa arag tegak, pertumbuhan mikroorganisme dapat berupa filiform, ekinulat, beaded, efus, arboresen dan rhizoid.
Pada pemeliharaan kultur cair dilakukan pengamatan mengenai kekeruhan, endapan dan mikroorganisme yang tumbuh. Pertumbuhan mikroorganisme tersebut dapat berupa pelikel, cincin, membran atau flokulen.
DAFTAR PUSTAKA
Fardiaz, S. 1992. Mikrobiologi pangan I. Gramedia Pustaka Utama, Jakarta.
Sumanti, Debby M. dkk. 2009. Diktat Penuntun Praktikum Mikrobiologi Pangan. Jurusan Teknologi Industri Pangan Fakultas Teknologi Industri Pertanian Universitas Pasjadjaran