BAB II
TINJAUAN PUSTAKA
2.1 Karsinoma Nasofaring 2.1.1 Anatomi nasofaring
Nasofaring merupakan ruang berbentuk trapezoid dengan ukuran tinggi 4 cm, lebar 4 cm dan anteroposterior 3 cm (Vlantis dan Hasselt, 2008) Saat lahir, permukaan nasofaring dilapisi epitel pseudostratified columnar. Pada sepuluh tahun pertama kehidupan epitel akan berubah secara bertahap menjadi non keratinizing stratified squamous, kecuali di beberapa area (zona transisi). Dinding anterior dibentuk oleh koana dan batas posterior septum nasi. Lantai dibentuk oleh permukaan atas palatum mole. Bagian atap dan dinding posterior dibentuk oleh permukaan yang melandai dibatasi oleh badan sfenoid. Dinding lateral terdapat muara tuba Eustachius (Chew, 1997; Jeyakumar, 2006; Wei dan Chua, 2014).
Nasofaring memiliki pleksus limfatik submukosa yang banyak. Daerah drainase urutan pertama adalah nodul retrofaringeal yang terdapat di ruang retrofaringeal di antara dinding posterior nasofaring, fasia faringobasilar, dan fasia prevertebral. Sistem limfatik kemudian bermuara ke cincin juguler interna profunda bagian atas pada dasar tengkorak di dalam ruang parafaring retrostyloid di ujung atas otot sternokleidomastoid.
Kemudian sistem limfatik bermuara ke posterior belakang ke daerah syaraf aksesorius dan bagian depan ke kelompok jugulodigastrik.
Nasofaring adalah struktur yang terletak di garis tengah tubuh, kaya akan
pembuluh limfe dengan muara yang bersilangan sehingga penyebaran sel tumor bilateral dan kontralateral tidak jarang dijumpai (Chew, 1997).
2.1.2 Epidemiologi
Karsinoma nasofaring adalah tumor yang berasal dari sel epitel yang melapisi permukaan nasofaring (Brennan, 2006; Wang, 2013). Di Indonesia KNF menduduki urutan pertama pada keganasan di daerah kepala dan leher serta termasuk urutan kelima pada tumor ganas di seluruh tubuh. Berdasarkan data patologi prevalensi penderita kanker nasofaring di Indonesia adalah 4,7 orang per 100.000 penduduk setahun, angka ini diambil dari data resmi yang dikeluarkan Departemen Kesehatan pada tahun 1980 (Soetjipto, 1989; Roezin, 1995). Marlinda et al (2012) mendapatkan prevalensi KNF di Indonesia adalah 6.2/100 000 penduduk pertahun, dengan 13.000 kasus baru setiap tahunnya. Di Bagian THT FK- UI RSCM selama periode 1988-1992 didapati 511 penderita baru KNF (Roezin, 1995). Di RSUP H. Adam Malik Medan pada tahun 1998-2000 ditemukan 130 penderita KNF dari 1370 pasien baru onkologi kepala dan leher (Lutan, 2003).
Usia insidensi KNF berbeda dengan kanker lainnya. Di Cina KNF mulai muncul usia 15-19 tahun. Pada pria, KNF sering ditemukan pada usia 15-34 tahun dan mencapai puncaknya usia 35-64 tahun kemudian menurun setelah usia tersebut. KNF lebih sering dijumpai pada pria dibanding wanita yaitu 2-3:1 (Chew, 1997, Cao et al, 2013).
2.1.3 Etiologi
Diyakini bahwa terdapat sejumlah faktor lingkungan bersama dengan faktor genetik/host yang mungkin bertanggung jawab terhadap penyebab kanker ini. Ho menyatakan sedikitnya ada 3 faktor etiologi yaitu: infeksi Virus Epstein-Barr, kerentanan genetik dan faktor lingkungan yang berperan dalam tingginya insidensi KNF di Cina (Kumar, 2003, Chou J et al, 2008).
Etiologi dari KNF belum dimengerti dengan jelas, namun dapat dibagi menjadi faktor ekstrinsik dan faktor intrinsik :
Faktor ekstrinsik :
a. Infeksi Virus Epstein-Barr
Karsinoma nasofaring dianggap memiliki hubungan erat dengan Virus Epstein-Barr (VEB) (Cao et al, 2011; Guo et al, 2014). Terutama antibodi IgA terhadap VEB dan DNA VEB dalam kadar yang tinggi pada serum penderita KNF. Dari berbagai jenis KNF hanya tipe undifferentiated yang memiliki hubungan imunositologis dengan VEB. Genom ini juga ditemukan dengan kadar yang lebih rendah pada karsinoma nasofaring yang well differentiated, namun tidak ditemukan peningkatan level antibodi terhadap antigen VEB. Tidak jelas bagaimana DNA virus berhubungan dengan karsinoma sel epitel dan kapan sel epitel terinfeksi dengan VEB, apakah sebelum atau sesudahnya berubah menjadi keganasan atau sebagai akibat rusaknya sistem pertahanan tubuh. VEB mampu merubah limfosit B namun tidak cukup bukti yang menyatakan bahwa dapat merubah sel epitel. VEB itu sendiri tidak bereplikasi di dalam sel tumor karsinoma
nasofaring dan anti gen virusnya tidak diekspresikan pada tumor ini.
Peranan VEB sebagai etiologi KNF sampai saat ini masih menjadi perdebatan (Chew, 1997; Lutzky, 2008)
b. Faktor lingkungan dan kebiasaan hidup
Ikan yang diasinkan dianggap sebagai faktor etiologi penting pada populasi Cina bagian selatan. Ikan laut yang diasinkan mengandung sejumlah nitrosamine volatile terutama N-nitrosodimethylamine dan N- nitroso-diethylamine. Zat ini diketahui merangsang karsinoma sel skuamosa dan adenokarsinoma pada rongga hidung dan paranasal dari beberapa penelitian terhadap hewan. Beberapa penelitian yang menghubungkan insidensi KNF dengan faktor makanan di Hongkong dan Cina menunjukkan adanya hubungan yang erat terutama dengan konsumsi ikan yang diasinkan pada usia dini. Selain ikan yang diasinkan, kadar nitrosamin yang tinggi juga ditemukan pada berbagai bahan makanan yang diawetkan di Tunisia, Cina dan Greenland, dimana beberapa bahan makanan tersebut mengandung prekursor nitrosamin kadar tinggi yang menghasilkan nitrosamine volatile pada lambung manusia setelah dicerna (Chew, 1997; Sivanandan dan Fee, 2005; Cho W, 2007). Suatu studi kasus kontrol menunjukkan bahwa konsumsi ikan asin yang sering sebelum usia 10 tahun berhubungan dengan peningkatan resiko terjadinya KNF (Kumar, 2003; Wei, 2006). Penelitian yang dilakukan pada suku Batak di Medan, dijumpai kebiasaan makan ikan asin sebelum umur 10 tahun mempunyai resiko 6,029 kali akan
menderita KNF pada usia dewasa dibanding yang tidak mempunyai kebiasaan tersebut (Munir, 2007).
Sejumlah faktor inhalasi dari lingkungan telah dilaporkan berhubungan dengan KNF. Dilaporkan juga adanya hubungan positif antara penggunaan bahan bakar fosil untuk memasak dan KNF. Di Kenya dimana insidensi KNF tinggi, penduduk tinggal di rumah dengan ventilasi yang buruk dimana asap dan uap hasil memasak tidak dapat keluar dari atap yang sangat tertutup rapat. Orang yang merokok selama 10 tahun atau lebih, memiliki resiko tinggi terhadap KNF (Kumar, 2003). Guo et al (2014) menyampaikan hipotesa bahwa merokok berhubungan dengan prognosis dan respon klinis pada KNF. Penelitian di Swedia menunjukkan pembuat gelas, pembuat sepatu, pembuat buku serta pekerja di pembakaran tanaman mempunyai risiko tinggi terhadap KNF. Di Selandia Baru peningkatan resiko KNF terjadi pada pekerja kayu, penggergaji kayu dan pekerja di hutan. Di Cina Selatan suatu studi kasus kontrol menunjukkan resiko tinggi KNF pada pekerja yang terpapar bahan-bahan hasil pembakaran batu bara, arang, pengelasan serta bahan bakar cair (Chew, 1997).
Faktor instrinsik : Genetik
Ras Mongoloid terutama bagian selatan merupakan faktor dominan timbulnya kanker nasofaring sehingga kekerapan cukup tinggi pada penduduk Cina bagian selatan, Hongkong, Vietnam, Thailand, Malaysia, Singapura dan Indonesia (Roezin, 1995).
Chew (1997) mendapatkan insiden KNF tinggi dijumpai di Hongkong, imigran Cina di Asia Tenggara dan imigran Cina di tempat lainnya. Insiden menengah ditemukan di ras Asia Tenggara (Malaysia, Indonesia, Thailand, Vietnam, Filipina), Eskimo (Kanada, Alaska, Greenland) dan Afrika Utara. Insiden yang jauh lebih rendah daripada insiden di Asia dijumpai di Malta, Tunisia, Aljazair, Maroko dan Sudan, tetapi insiden tetap lebih tinggi daripada di Amerika dan Eropa.
Pasien dengan KNF pada populasi Cina berasal dari sub populasi dengan genetik yang khas. Sampai saat ini HLA adalah satu-satunya sistem genetik yang memiliki hubungan erat dengan kanker ini. Lokus HLA yang terlibat pada KNF adalah lokus HLA-A, B dan DR yang terdapat pada rantai pendek kromosom 6 (Chew, 1997). Penelitian di bagian THT-KL FKUI/RSCM tahun 1997 didapatkan fenotip antigen HLA kelas 1, HLA-A24 dan HLA-B63 untuk kemungkinan faktor penyebab bagi orang Indonesia asli (Roezin, 1996).
Penelitian di Medan menemukan frekwensi alel gen paling tinggi pada penderita KNF suku Batak adalah alel gen HLA-DRB1*12 dan HLA- DQB*0301 dimana alel gen yang potensial sebagai penyebab kerentanan timbulnya KNF pada suku Batak adalah alel gen HLA-DRB1*08 (Munir, 2007).
2.1.4 Gejala klinik
Pasien KNF jarang ditemukan asimptomatik. Kebanyakan pasien memiliki berbagai gejala yang onsetnya berbeda-beda dan kadang tidak diperhatikan oleh pasien selama berbulan-bulan (Chew, 1997).
Gejala klinik bisa dibagi menjadi gejala dini dan gejala lanjut.
Gejala dini : a. Gejala telinga
Gejala telinga bisa berupa kurang pendengaran tipe hantaran, rasa penuh di telinga, seperti terisi air, berdengung atau tinitus. Gangguan pendengaran terjadi bila ada perluasan tumor ke sekitar tuba sehingga terjadi sumbatan. Meskipun letak tuba relatif dekat dengan fossa Rosenmuller atau tumor primer, tetapi gejala telinga relatif jarang dibanding gejala tumor metastasis di leher (Sudyartono dan Wiratno, 1996). Otitis media serosa dijumpai pada 41% pasien dari 237 pasien baru yang didiagnosis KNF. Sehingga apabila seorang pasien dewasa, ras Cina datang dengan gejala ini, seorang ahli THT-KL harus mempertimbangkan kemungkinan KNF (Wei, 2006).
b. Gejala hidung
Epistaksis yang masif jarang dijumpai sebagai gejala dini, lebih sering dijumpai pada KNF stadium lanjut dengan atau tanpa erosi dasar tengkorak. Sekret hidung dan saliva bercampur darah pada saat membuang ludah sering dijumpai. Erosi ke antrum maksila menyerupai sinusitis. Sumbatan hidung total adalah gejala lanjut, apabila terjadi pada stadium dini, maka seringkali disebabkan oleh infeksi sekunder. Ozaena terjadi sebagai akibat nekrosis tumor dan khas pada KNF stadium lanjut (Chew, 1997, Tabuchi et al, 2011).
Gejala lanjut :
a. Pembesaran kelenjar getah bening leher
Karsinoma nasofaring memiliki kecenderungan untuk cepat menyebar ke kelenjar getah bening leher. Pembesaran kelenjar getah bening servikal merupakan gejala pertama yang timbul pada penderita KNF (Brennan B, 2006). Kelenjar limfe retrofaringeal lateral (rouviere nodes) merupakan filter kelenjar yang pertama, namun tidak dapat di palpasi.
Kelenjar yang paling sering pertama kali dapat di palpasi adalah kelenjar jugulodigastrik dan/atau nodul apikal di bawah sternomastoid. Metastasis kelenjar limfe bilateral dan kontralateral sering dijumpai (Chew, 1997;
Tang et al, 2014).
b. Gejala neurologis
Sindroma petrosfenoidal
Pada sindroma ini syaraf kranialis yang terlibat berturut-turut adalah : n. IV, III, VI, dan n. II yang paling akhir dan jarang terjadi. Parese n. II, memberikan keluhan penurunan ketajaman penglihatan. Parese n. III, menyebabkan kelumpuhan m. levator palpebra dan m. tarsalis superior sehingga kelopak mata atas menurun, fisura palpebra menyempit, dan kesulitan membuka mata. Bila salah satu atau lebih dari n.III, IV dan VI, mengalami parese, maka akan terjadi strabismus dengan gejala diplopia (melihat ganda) disebabkan karena kelumpuhan salah satu atau beberapa otot-otot ekstraokuler. Parese n. V, menimbulkan gejala parestesi sampai hipestesi pada separuh wajah atau timbul neuralgia separuh wajah (Sudyartono dan Wiratno, 1996).
Sindroma parafaring
Syaraf kranial yang terlibat pada sindroma ini adalah n. IX, X, XI, XII, sebagai akibat dari pertumbuhan dan perluasan karsinoma nasofaring.
Parese n. IX, menimbulkan gejala-gejala klinis seperti hilangnya refleks muntah, disfagia ringan, parese lidah, deviasi uvula ke sisi yang baik, hilangnya sensasi pada faring, tonsil, bagian atas tenggorok, dan belakang lidah, salivasi meningkat, dan takikardi pada sebagian lesi n. IX. Hal ini mungkin akibat gangguan reflex karotikus. Parese n. X menimbulkan gejala klinis gangguan motorik seperti afoni, disfoni, perubahan posisi pita suara, disfagi dan spasme esofagus, sedangkan gejala klinis gangguan sensoriknya berupa nyeri pada daerah faring dan laring, dispnea, dan hipersalivasi. Parese pada n. XI menimbulkan gejala seperti kesukaran mengangkat atau memutar kepala dan dagu.
Parese n. XII terjadi akibat infiltrasi tumor ganas melalui kanalis n. hipoglossus atau dapat pula karena penekanan pembesaran limfonodi pada spatium parafaring, maka akan terjadi parese n. XII yang keluar melalui kanalis n. hipoglosus, sehingga terjadi pula parese otot-otot yang dipersyarafinya yaitu m. stiloglossus, m. longitudinalis superior dan inferior dan m. genioglosus (otot-otot lidah). Gejala yang timbul akibat parese n. XII ini adalah lidah menyimpang ke sisi yang lumpuh, penderita pelo dan disfagi (Sudyartono dan Wiratno, 1996).
2.1.5 Diagnosis
Diagnosis KNF ditegakkan terutama berdasarkan anamnesis dan pemeriksaan fisik. Sudah jelas, diagnosis pasti memerlukan biopsi lesi.
Untuk melihat lesi lebih jelas dan untuk melihat lesi yang tidak dapat diraba dapat mempergunakan indirect nasopharyngoscopy atau flexible fiber optic atau endoskopi kaku. Dengan endoskopi maka biopsi dapat dilakukan (Her, 2001; Jeyakumar, 2006).
Pemeriksaan radiologi yang lebih baik untuk KNF adalah CT-Scan dengan kontras dan MRI. Adanya penyangatan (enhancement) pada regio tersebut mencurigakan akan adanya suatu proses keganasan. Umumnya buku onkologi lebih menganjurkan pemeriksaan MRI dari pada CT-Scan karena dapat memberikan detail yang lebih baik tentang perluasan dan keterlibatan intrakranial. Sebaliknya, CT-Scan pada bone setting dapat menunjukkan adanya erosi tulang. Faktor-faktor ini penting untuk menentukan stadium penyakit (Jayekumar, 2006).
CT-Scan dapat menunjukkan perluasan jaringan lunak di daerah nasofaring dan ke arah lateral menuju ruang paranasofaring. CT-Scan sensitif untuk mendeteksi erosi tulang, terutama pada dasar tengkorak.
Perluasan tumor ke intrakranial melalui foramen ovale dengan penyebaran perineural juga dapat di deteksi, yang merupakan bukti keterlibatan sinus kavernosus tanpa erosi dasar tengkorak. CT-Scan juga dapat menunjukkan regenerasi tulang setelah terapi yang mengindikasikan eradikasi tumor telah sempurna (Wei, 2006).
Gambaran lesi T1 pada nasofaring terbatas seluruhnya pada nasofaring menyebabkan penebalan dan asimetri. Lesi diklasifikasikan T2a apabila telah menyebar ke fossa nasalis. Keterlibatan ruang parafaring diklasifikasikan sebagai T2b karena dapat menyebabkan
prognosis yang lebih buruk. T3 tumor dikarakteristikkan dengan perluasan ke sinus paranasal dan ada ditemukannya keterlibatan tulang. Pada gambaran CT-Scan akan terlihat erosis kortikal dan sklerosis. Apabila intrakranial, hipofaring, orbita, sinus maksila atau nervus kranial sudah terlibat, maka tergolong sebagai T4 (Goh dan Lim, 2009)
Identifikasi keterlibatan kelenjar getah bening penting untuk diketahui karena dapat meningkatkan resiko rekurensi lokal dan akan mempengaruhi penatalaksanaan. Untuk penentuan stadium digunakan klasifikasi TNM. Pada KNF nodul < 6 cm (untuk N1) dan bilateral nodul
< 6 cm (untuk N2) di atas fossa supraklavikula. Nodul unilateral berukuran
> 6 dikelompokkan sebagai N3a. Apabila nodul fossa supraklavikula sudah terlibat maka pasien sudah digolongkan sebaga N3b (Goh dan Lim, 2009)
Magnetic Resonance Imaging (MRI) lebih baik dari pada CT-Scan dalam membedakan tumor dengan inflamasi jaringan lunak. MRI juga lebih sensitif dalam mengevaluasi metastasis kelenjar retrofaringeal dan leher dalam. MRI dapat mendeteksi infiltrasi sumsum tulang oleh tumor, dimana CT-Scan tidak dapat mendeteksi infiltrasi ini kecuali disertai oleh erosi tulang. Penting untuk mendeteksi infiltrasi sumsum tulang ini karena berhubungan dengan peningkatan resiko metastasis jauh (Wei, 2006).
Deteksi pasti metastasis jauh pada saat diagnosis sulit dilakukan.
Beberapa penelitian menunjukkan bahwa bone scan, Scintigraphy hati dan biopsi sumsum tulang sedikit membantu (Wei, 2006). Saat ini penapisan tulang (Bone scanning) serta ultrasonografi dilakukan secara
rutin pada semua pasien baru kanker nasofaring. Adanya peningkatan aktivitas pada tulang seyogyanya diikuti dengan foto setempat (x-ray spot photo) pada daerah yang bersangkutan untuk menghindarkan positif palsu pada penyakit degeneratif tulang (artrosis).
a. Pemeriksaan Fisik.
Pemeriksaan tidak langsung daerah nasofaring dapat dilakukan dengan cermin, tetapi variasi anatomi nasofaring pada beberapa pasien akan mengakibatkan evaluasi yang tidak adekuat pada daerah ini (Wei, 2006). Permukaan mukosa nasofaring yang tidak rata atau menonjol, perlu dicurigai adanya tumor, terutama bila relevan dengan gejala klinis.
Tumor yang tumbuh eksofitik dan sudah agak besar akan dapat dilihat dengan mudah (Mulyarjo, 2002).
b. Biopsi nasofaring
Konfirmasi pasti diagnosis KNF diperoleh dari hasil biopsi positif yang diambil dari tumor di nasofaring. Teleskop kaku Hopkins 0° dan 30°
memberikan pandangan yang baik dari nasofaring. Jika terdapat deviasi septum, endoskop 70° dimasukkan melalui cavum nasi yang berlawanan dapat memberikan visualisasi tumor yang adekuat. Endoskop 70° yang dimasukkan di belakang palatum mole dapat memberikan visualisasi atap nasofaring dan kedua muara tuba Eustachius. Endoskop kaku tidak mempunyai jalur penghisap atau jalur biopsi. Darah dan mukus yang menutupi tumor harus dibuang dengan penghisap terpisah untuk mendapatkan pandangan yang jelas pada daerah patologis. Forsep biopsi
harus dimasukkan bersebelahan dengan endoskop untuk mendapatkan biopsi tumor di bawah pandangan langsung (Chew, 1997; Wei, 2006).
Endoskop fleksibel memberikan pemeriksaan yang teliti pada seluruh nasofaring, walau bila dimasukkan melalui salah satu sisi cavum nasi.
Ujungnya dapat bermanuver di belakang septum nasi ke sisi sebelahnya.
Endoskop ini memiliki jalur penghisap dan forsep biopsi yang dapat dimasukkan melaluinya untuk mengambil biopsi tumor di bawah pandangan langsung. Walaupun demikian, gambaran visual yang diperoleh dari endoskop fleksibel kurang baik dibandingkan endoskop kaku dan ukuran forsep biopsi kecil, sehingga pengambilan jaringan tidak optimal (Wei, 2006; Gao et al, 2014).
Teknik biopsi lain yang pernah diperkenalkan adalah biopsi dengan jarum halus. Dilaporkan bahwa kepekaan teknik ini adalah lebih dari 90%
dengan spesifisitas 100%. Teknik ini mungkin kurang praktis untuk tumor stadium dini (Mulyarjo, 2002). Penelitian oleh Stevens et al. (2006) menyimpulkan bahwa monitoring kuantitatif DNA Virus Epstein-Barr dan deteksi mRNA BARF1 dan EBNA1 pada brushing nasofaring merupakan alat diagnostik non invasif yang spesifik pada pasien suspek KNF, secara langsung mendeteksi aktivitas Virus Epstein-Barr yang spesifik terhadap karsinoma di lokasi anatomis dimana tumor primer berkembang. Oleh karena sifat non invasifnya maka metode ini dapat menjadi alat yang bernilai untuk prognostik yang dapat digunakan sesering mungkin selama follow up. Metode brush nasofaring dapat berguna terutama sebagai test konfirmasi untuk perkiraan resiko KNF pada penelitian screening populasi,
misalnya dengan menggunakan serologi IgA dan IgG terhadap protein Virus Epstein-Barr spesifik sebagai marker diagnostik awal (Lu, 2010;
Yoen, 2013).
2.1.6 Histopatologi dan stadium
Klasifikasi histologi KNF yang diajukan oleh World Health Organization (WHO) pada tahun 1978 mengklasifikasikan tumor menjadi 3 kelompok, yaitu:
Tipe 1 : keratinizing squamous cell carcinoma Tipe 2 : non keratinizing squamous cell carcinoma Tipe 3 : undifferentiated carcinoma
Tumor tipe 2 dan tipe 3 memiliki hubungan dengan Virus Epstein-Barr (Wei, 2006; Lutzky, 2008).
Klasifikasi alternatif lainnya membagi tumor atas dua tipe histopatologi, yaitu squamous cell carcinoma dan undifferentiated carcinoma (Wei, 2006;
Wei et al, 2010).
2.1.7 Klasifikasi TNM menurut AJCC 2010
Tumor Primer (T)
TX Tumor primer tidak dapat dinilai T0 Tidak terbukti adanya tumor primer Tis Karsinoma in situ
T1 Tumor terbatas di nasofaring atau tumor meluas ke orofaring dan/kavum nasi tanpa perluasan ke parafaring.
T2 Tumor dengan perluasan ke daerah parafaring.
T3 Tumor melibatkan struktur tulang dasar tengkorak dan/atau sinus paranasal.
T4 Tumor dengan perluasan intrakranial dan/atau terlibatnya syaraf kranial, hipofaring, orbita atau dengan perluasan ke fossa infratemporal/ruang mastikator.
Kelenjar Getah Bening Regional (N) NX KGB regional tidak dapat dinilai.
N0 Tidak ada metastasis ke KGB regional.
N1 Metastasis kelenjar getah bening leher unilateral dengan diameter terbesar 6 cm atau kurang, di atas fossa supraklavikular, dan/atau unilateral atau bilateral kelenjar getah bening retrofaring dengan diameter terbesar 6 cm atau kurang.
N2 Metastasis kelenjar getah bening bilateral dengan diameter terbesar 6 cm atau kurang, di atas fossa supraklavikular.
N3 Metastasis pada kelenjar getah bening diatas 6 cm dan/atau pada fossa supraklavikular:
N3a Diameter terbesar lebih dari 6 cm.
N3b Meluas ke fossa supraklavikular.
Metastasis Jauh (M)
M0 Tanpa metastasis jauh M1 Metastasis jauh
Kelompok stadium :
0 Tis N0 M0
I T1 N0 M0
II T1 N1 M0
T2 N0 M0
T2 N1 M0
III T1 N2 M0
T2 N2 M0
T3 N0 M0
T3 N1 M0
T3 N2 M0
IVA T4 N0 M0
T4 N1 M0
T4 N2 M0
IVB setiap T N3 M0 IVC setiap T setiap N M1
2.1.8 Penatalaksanaan a. Radioterapi.
Radioterapi telah menjadi modalitas terapi primer untuk KNF selama bertahun-tahun. Sejak 1960-1980, pembedahan dan radioterapi dianggap terapi yang paling efektif sebagai pengobatan utama dengan kanker kepala dan leher (Marur et al, 2008). Radioterapi merupakan pilihan utama dalam pengobatan KNF kasus baru dan non-metastasis (Wei et al,
dengan struktur penting dan sifat infiltrasi KNF, sehingga pembedahan terhadap tumor primer sulit dilakukan. KNF umumnya tidak dapat dioperasi karena berada dalam mukosa nasofaring yang melekat erat pada tulang dasar tengkorak, lebih responsif terhadap radioterapi dan kemoterapi dibandingkan tumor ganas kepala leher lainnya (Wei, 2006;
Guigay, 2006, Luthi dan Stupp, 2010).
Pemberian radioterapi telah berhasil mengontrol tumor T1 dan T2 pada 75-90% kasus dan tumor T3 dan T4 pada 50-75% kasus. Kontrol kelenjar leher mencapai 90% pada pasien dengan N0 dan N1, tapi tingkat kontrol regional berkurang menjadi 70% pada kasus N2 dan N3 (Wei, 2006).
Radioterapi dapat diberikan secara konvensional, yakni dengan pemberian dosis total 66,6-75,6 Gy, diberikan 1,8-2 Gy per fraksi, 5 fraksi per minggu (Yeh, 2006; Li et al, 2012; Kong et al, 2012). Penelitian oleh Niibe (2004) menyatakan suatu metode pemberian radioterapi dengan metode hiperfraksinasi pada karsinoma orofaring, yaitu dengan memberikan radiasi 2 Gy per fraksi, 2 fraksi per hari (dengan jarak 6 jam), 5 hari seminggu sehingga total dosis sama dengan radioterapi konvensional yaitu 66 Gy atau lebih, memberikan hasil yang lebih baik dalam hal kesintasan hidup keseluruhan (overall survival rate) dan angka kontrol lokoregional (loco-regional control rate).
Berdasarkan NCCN 2010, radioterapi defenitif diberikan pada karsinoma nasofaring dengan stadium T1N0M0.
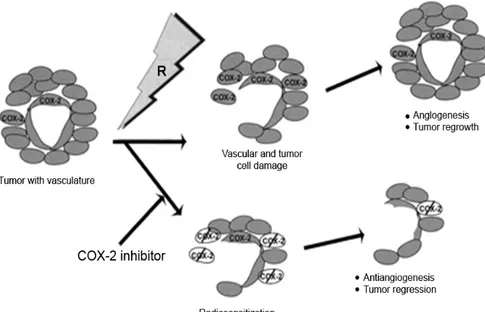
Gambar 2.1Mekanisme COX-2 untuk meningkatkan efek radiasi.
Sel tumor dan sel pada stroma tumor, terutama sel pada endotel neovaskuler mengekspresikan COX-2. Paparan terhadap radiasi meningkatkan ekspresi kemudian merangsang sintesis dari prostaglandin sehingga meningkatkan proliferasi sel tumor dan proliferasi sel endotel serta angiogenesis. Ekspresi COX-2 yang meningkat dan peningkatan proliferasi sel tumor merangsang pertumbuhan kembali tumor secara cepat. Penghambatan terhadap aktivitas COX-2 akan menghambat sintesis prostaglandin dan mencegah perangsangan pertumbuhan serta angiogenesis tumor dan meningkatkan sensitifitas sel tumor terhadap radiasi (Choy dan Milas, 2003).
Efek samping akut radioterapi adalah radiomukositis, stomatitis, ngilu pada gigi dan hilangnya indera pengecapan. Di samping itu, sebagai efek lanjut juga dapat terjadi xerostomia, trismus, otitis media, pendengaran menurun, hipotiroidisme, hiperpigmentasi kulit pada lintasan sinar, fibrosis subkutan atau osteoradionekrosis mandibula. Pada terapi kombinasi
dengan sitostatika dapat timbul depresi sumsum tulang dan gangguan gastrointestinal (Munir, 2009; Abdennadher, 2010).
b. Kemoterapi.
Kemoterapi sebagai komponen terapi kuratif utama pada KNF pertama kali dipergunakan pada tahun 1970-an. Bahkan pada pasien yang gagal dengan radioterapi tunggal atau dengan metastasis sistemik menunjukkan angka respon (response rate) yang tinggi terhadap penggunaan kemoterapi. Kombinasi 5FU dan cisplatin (cisdiamine-dichloroplatinum) telah terbukti mempunyai efek sitostatika secara sinergis pada sel-sel kanker manusia. Dosis cisdiamine-dichloroplatinum (CDDP) adalah 100 mg/m2 dengan bolus infus diberikan pada hari pertama dan dosis 5 FU 1000 mg/m2
c. Kemoradioterapi
/hari diberikan dengan infus selama 24 jam pada hari 1-5.
Siklus diulang setiap 4 minggu. Kemoterapi diberikan 2-4 siklus (Mould dan Tai, 2002; Yeh, 2006, Xu et al, 2013; Chen, 2014).
Penelitian inter grup 1997 pertama kali menunjukkan bahwa penggunaan kemoterapi bersamaan dengan radioterapi meningkatkan kesintasan hidup keseluruhan (overall survival) apabila dibandingkan dengan penggunaan radioterapi tunggal. Kemoterapi berfungsi sebagai radiosensitisizer dan membantu dalam mengurangi metastasis jauh (Mould dan Tai, 2002; Wei, 2006; Wildeman, 2013).
Studi inter grup 0099 dan beberapa penelitian secara acak pada daerah endemik lainnya mendapatkan bahwa kemoradioterapi dengan
atau tanpa kemoterapi adjuvan dapat meningkatkan survival lokoregional KNF stadium lanjut (Liu et al, 2013).
Penelitian meta-analisis Agulnik dan Siu (2005) terhadap 8 penelitian membandingkan kemoradioterapi dengan radioterapi tunggal. Semua penelitian ini menggunakan radioterapi dan kemoterapi cisplatin, mendapatkan peningkatan survival rate apabila kemoterapi diberikan secara konkuren dengan radioterapi. Meta-analisis ini mengkonfirmasi peranan konkuren kemoradioterapi sebagai penatalaksanaan standard untuk KNF stadium lanjut lokoregional.
Sampai sekarang, regimen dengan dasar platinum merupakan standar kemoterapi pada pasien KNF dengan metastasis, dan terapi lini pertama yang paling banyak digunakan adalah kombinasi cisplatin dengan 5 FU.
Kombinasi platinum dengan bahan baru seperti gemcitabine atau paclitaxel telah menunjukkan angka respon yang baik (Guigay, 2006).
Berdasarkan NCCN 2010, untuk karsinoma nasofaring dengan stadium T1, N1-3; T2-4, setiap N maka diberikan terapi cisplatin 100mg/m2 pada hari 1, 22, 43 atau cisplatin 40mg/m2
d. Pembedahan.
setiap minggu bersamaan dengan radioterapi > 70 Gy pada tumor primer dan 50 Gy pada pembesaran kelenjar getah bening leher bilateral.
Pembedahan hanya sedikit berperan dalam penatalaksanaan KNF.
Terbatas pada diseksi leher radikal untuk mengontrol kelenjar yang radioresisten dan metastasis leher setelah radiasi dan pada pasien tertentu. Pembedahan penyelamatan (salvage treatment) dilakukan pada
kasus rekurensi di nasofaring atau kelenjar leher tanpa metastasis jauh (Chew, 1997; Ignace, 2003; Wei (2003, 2006); Lutzky, 2008).
2.1.9 Pengaruh kemoradioterapi konkuren pada hematopoiesis
Struktur sumsum tulang dapat dirusak oleh faktor-faktor luar. Pasien yang mendapat kemoterapi kombinasi dosis tinggi hampir dapat dipastikan akan menderita kerusakan struktur tulang yang berakibat anemia, leukopenia dan trombositopenia. Kerusakan berat yang terjadi pada sumsum tulang dapat diketahui dari gambaran pansitopenia berat. Pasien yang mendapat kemoterapi tunggal hanya akan menderita anemia ringan.
Pasien yang mendapat kemoterapi kombinasi dosis tinggi biasanya harus mendapatkan transfusi eritrosit dan platelet. Pada keadaan tersebut diatas, obat kemoterapi berdampak pada kerusakan permanen ringan dari sumsum tulang, karenanya pemberian kemoterapi harus dihentikan sementara untuk memberikan masa pemulihan bagi sumsum tulang (Hillman, 2005).
Radiasi dapat menyebabkan kerusakan irreversibel pada struktur sumsum tulang sehingga suplai darah menjadi sangat terganggu. Radiasi energi tinggi juga dapat menyebabkan anemia akibat kerusakan sumsum tulang dan pansitopenia. Dampak yang ditimbulkan dapat diperkirakan dari tipe radiasi, dosis radiasi dan keterpaparan sumsum tulang pada saat radiasi. Pasien yang mendapat radiasi pada seluruh tubuh, efek pada sumsum tulang tergantung dari dosis radiasi. Pada dosis yang kurang dari 1 Sv (setara dengan 1 Gy atau 100 rads), akan berdampak minimal pada sumsum tulang. Penurunan jumlah sel-sel darah yang bersifat sementara
dapat terlihat pada pemberian dosis radiasi 1-2,5 Sv (setara dengan 100- 250 rads). Pada dosis radiasi yang lebih besar lagi akan mengakibatkan hilangnya stem sel. Dengan dosis radiasi 5-10 Sv, pasien akan menderita gagal sumsum tulang jika tidak mendapat transplantasi sumsum tulang segera bahkan dapat menyebabkan meninggalnya pasien. Paparan berulang dalam jangka waktu yang lama akan radiasi dosis rendah atau radioisotop yang bekerja melalui saluran cerna, juga dapat mengakibatkan anemia aplastik (Hillman, 2005).
2.2 Cyclooxygenase-2 (COX-2)
Peningkatan level prostaglandin telah dideteksi pada kanker di berbagai lokasi anatomi, termasuk kepala dan leher, dan peran metabolit tersebut dalam pertumbuhan tumor dan metastasis telah dapat dipastikan.
Prostaglandin (PG), terutama yang seri E, ditemukan mempengaruhi proliferasi sel dan respon imun host, menunjukkan perannya sebagai promotor dan/atau memfasilitasi pertumbuhan dan penyebaran tumor (Gallo, 2001).
Prostaglandin (PG) G/H endoperoxydase synthase, yang dikenal sebagai cyclooxygenase (COX), merupakan enzim utama dalam proses sintesa prostanoid (PG dan tromboksan). Terdapat 2 bentuk isoform COX.
COX-1 merupakan bentuk menetap dan COX-2 merupakan bentuk yang dapat terinduksi. Produk PG yang berasal dari aktivitas COX-1 memfasilitasi berbagai proses fisiologis. Sedangkan, COX-2 sangat mudah terinduksi oleh berbagai proses inflamasi, dan dalam respon
Peningkatan level COX-2 telah ditemukan pada berbagai lesi premaligna dan kanker epitel. Peningkatan ekspresi COX-2 telah dilaporkan pada berbagai macam tumor, seperti kanker kolon, kanker paru, kanker payudara, kanker lambung, kanker esofagus, kanker kepala dan leher, yang menunjukkan bahwa COX-2 mungkin terlibat dalam proses karsinogenesis. Peningkatan regulasi COX-2 pada sel kanker juga dihubungkan dengan peningkatan angiogenesis dan metastasis.
Peningkatan ekspresi COX-2 pada sel kanker kolon manusia menginduksi angiogenesis in vitro melalui induksi faktor-faktor angiogenik seperti Vascular Endothelial Growth Factor (VEGF) dan Basic Fibroblast Growth Factor (Murono, 2001; Kyzas, 2005 ; Soo, 2005 ; Kaul, 2006).
Terdapat berbagai bukti sebagai bahan pertimbangan bahwa COX-2 berperan dalam proses karsinogenesis dan pertumbuhan tumor. Ekspresi seluler COX-2 meningkat di atas normal pada stadium awal karsinogenesis dan melalui perkembangan tumor dan pertumbuhan invasif tumor. PG yang berasal dari COX-2 berperan dalam karsinogenesis, inflamasi, supresi respon imun, inhibisi apoptosis, angiogenesis, invasi sel tumor dan metastasis. Peran PG yang berasal dari COX-2 dalam proses karsinogenesis pada manusia didukung oleh temuan retrospektif dan epidemiologis yang menunjukkan bahwa pemakaian NSAID secara reguler mengurangi insidensi beberapa macam kanker pada manusia (terutama pada payudara, kolon dan paru). Suatu laporan awal menunjukkan bahwa pemakaian aspirin dan indometasin mungkin memiliki efek analog dalam menunda pertumbuhan tumor kepala
dan leher baik secara eksperimental dan in vivo (Gallo, 2001; Choy dan Milas, 2003).
Mekanisme NSAID menghambat pertumbuhan tumor masih belum sepenuhnya dimengerti, tapi mungkin melibatkan blokade COX, yang menekan produksi eicosanoid, terutama PG dan mungkin mempengaruhi proliferasi sel, apoptosis dan respon imun (Gallo, 2001).
2.2.1 Peran COX-2 dalam perkembangan kanker
Selain perannya dalam karsinogenesis, peningkatan ekspresi COX-2 juga dihubungkan dengan perkembangan kanker pada manusia. Sel tumor serta komponen seluler stroma tumor (seperti infiltrasi makrofag, limfosit, fibroblas dan sel endotel) menghasilkan COX-2, yang akan meningkatkan produksi beberapa macam prostaglandin, terutama PGE2. Peningkatan ekspresi COX-2 telah dilaporkan pada berbagai jenis kanker pada manusia, termasuk sedikitnya 80% dari kanker payudara, kolon, esofagus, hati, paru, pankreas, prostat, serviks serta kepala dan leher (Choy dan Milas, 2003). Namun, matriks ekstraseluler tumor, sel stromal pada tumor juga berperan penting terhadap progresi dari tumor (Egeblad dan Werb, 2002).
2.2.2 COX-2 dan angiogenesis tumor
Angiogenesis merupakan suatu persyaratan untuk pertumbuhan dan metastasis tumor. Neovaskularisasi memberikan bukan hanya jalur untuk suplai nutrisi, namun juga merupakan saluran sel tumor untuk masuk ke sirkulasi, oleh karena pembuluh darah yang baru berproliferasi memiliki
membran basal yang lebih mudah dimasuki oleh sel tumor dibandingkan dengan pembuluh darah matur. Neovaskularisasi tumor dinilai secara kuantitas dengan pemeriksaan imunohistokimia menggunakan marker endothelial dihitung sebagai microvessel density (MVD) (Poon, 2002).
Kontrol angiogenesis tumor tergantung pada keseimbangan sejumlah aktivator (faktor angiogenik) dan inhibitor (faktor antiangiogenik) yang disekresikan oleh sel tumor dan sel yang menginfiltrasi host seperti makrofag dan fibroblast. Selama perkembangan tumor, perubahan lingkungan dan genetik merangsang perubahan angiogenik, baik oleh faktor angiogenik maupun oleh inhibitor angiogenik. Sinyal lingkungan yang dapat memicu angiogenesis termasuk hipoksia, perubahan pH, stres metabolik, dan sitokin dari respon inflamasi (Pang dan Poon, 2006).
Pertumbuhan suatu pembuluh darah baru dimulai dengan pelepasan faktor angiogenik, yang berikatan dengan reseptor spesifik pada sel-sel endotel pembuluh darah yang telah ada untuk memicu proses angiogenesis. Selain faktor angiogenik, proteinase seperti matriks mettalloproteinase (MMP) dan faktor plasminogen diperlukan untuk melarutkan matriks pada pembuluh darah yang baru tumbuh (Pang dan Poon, 2006).
MMP mempunyai efek langsung terhadap sel endotelial yang diperlukan untuk migrasi sel dan pembentukan saluran. MMP-2, MMP-9 dan MMP-7 terekspresi pada sel endotel vaskular tumor (Amalinei, 2010).
LMP-1 dapat merangsang ekspresi dan aktivitas beberapa faktor yang berperan dalam invasi sel dan metastasis. Pada degradasi matriks
ekstraseluler, LMP-1 secara in vitro dapat merangsang MMP-9 yang disertai dengan adhesi, migrasi dan invasi. LMP-1 memperantarai induksi MMP-9 diatur melalui aktivasi NF-κB dan ERK-MAPK. Selain itu, juga diatur oleh AP-1 dan faktor transkripsi Ets, termasuk c-Jun (Morris, 2009).
Saragih (2012) mendapatkan ekspresi mRNA CK-19 dalam darah tepi penderita KNF dengan LMP-1 positif maupun negatif.
Steinbach (2000) dalam penelitiannya mendapatkan adanya hubungan pemberian celecoxib 400 mg dua kali sehari selama 6 bulan dengan penurunan besar tumor pada penderita familial adenomatous poliposis.
Dari penelitian itu didapatkan penurunan besar tumor dengan rerata 30,7% (SD : 25,7).
COX-2 merupakan sebuah inducible enzyme yang ekspresinya diatur oleh NF-κB. COX-2 sebagai salah satu isoform hasil dari sintesa prostaglandin H terlibat dalam pertumbuhan dan perkembangan pada berbagai macam proses keganasan. Overekspresi dari COX-2 menurunkan tingkat suseptibilitas apoptosis pada sel kanker kolon dengan menginhibisi cytochrome c-dependent apoptotic pathway.
Tumor Necrosis Factor (TNF-α) pertama kali diidentifikasi sebagai sitokin anti-tumor pada sistem imunitas innate dan adaptif. TNF-α diperlukan juga untuk proliferasi dan fungsi yang normal dari NK cells, sel T, sel B, makrofag, dan sel dendrit, serta bertindak sebagai molekul yang penting dalam menghancurkan tumor tertentu. Akan tetapi bukti yang terbaru menunjukkan bahwa TNF-α merupakan suatu mediator utama
pada cancer-related inflammation dan juga berperan sebagai tumour- promoting factor (Wu dan Zhou, 2010; Kumar, 2013).
Aktivitas TNF-α pada level moderat dapat menyebabkan peningkatan pertumbuhan tumor, merangsang angiogenesis, kerusakan pada DNA dan meningkatkan potensi metastatik dari tumor pada model hewan. Salah satu fungsi yang penting dari TNF-α adalah mengaktifkan pro- inflammatory transcription factor NF-κB (Schetter, 2009).
TNF-α juga meningkatkan kelangsungan hidup sel tumor dengan menginduksi molekul antiapoptosis NF-κB dependent. Sebagai tambahan, TNF-α tidak hanya bertindak sebagai autokrin growth factor namun juga dapat memicu ekspresi growth factors yang lain seperti amphiregulin, EGFR, dan TGF-α sehingga dapat meningkatkan proliferasi sel tumor (Wu dan Zhou, 2010).
Berdasarkan penelitian yang dilakukan oleh Kuwano (2004) didapatkan bahwa IL-1α dan TNF-α secara signifikan meningkatkan produksi IL-8, bFGF dan COX-2 di dalam sel endotel dan sel kanker.
TNF-α telah diketahui dapat mengaktifkan beberapa cellular signaling pathways yang akan memediasi ekspresi dari COX-2 dengan memfasilitasi perekrutan berbagai macam faktor transkipsi ke dalam promoter dari COX-2, dimana promoter COX2 mengandung urutan (sequences) untuk mengikat kompleks transkripsi NF-κB, PEA3 dan AP-1 (Yang, 2005).
Matrix metalloproteinases (MMPs) merupakan suatu modulator yang penting dalam proses biologis pada kejadian patofisiologis seperti skeletal
formation, angiogenesis, migrasi seluler, inflamasi, dan kanker. Terjadi upregulation MMP-9 pada angiogenic dysplasias dan invasi sel kanker epidermis pada multi stage tumorigenesis dari model tikus yang ditimbulkan oleh HPV16 oncogenes (Aggarwal, 2006; Nasr, 2009).
MMP, famili zinc dependent endopeptidase, merupakan protease utama yang berperan dalam migrasi sel tumor, penyebaran, invasi jaringan dan metastasis (Chen, 2011). MMP memfasilitasi proses invasi dan metastasis dengan mendegradasi komponen matriks ekstraseluler.
Selain itu juga memperantarai aktivasi faktor pertumbuhan, menekan apoptosis sel tumor dan merusak perkembangan gradien kemokin respon imun host serta pelepasan faktor angiogenesis (Vasala, 2008). Aktivitas MMP juga berhubungan dengan mekanisme sel kanker terhindar dari respon sistem imun. Beberapa MMP termasuk MMP-9 mampu menekan proliferasi limfosit T dengan merusak sinyal IL-2Rα (Krizkova, 2011).
Regulasi dari TNF, interleukin, chemokines, COX-2, 5-LOX, dan MMP-9 diatur oleh faktor transkripsi NF-κB. Walaupun factor ini bersifat inaktif pada kebanyakan sel, namun pada sel kanker menunjukkan ekspresi dan bentuk teraktivasi dari NF-κB. Peranan infeksi laten dari EBV dalam perkembangan limfoid dan keganasan epithelial seperti pada karsinoma nasofaring ternyata di mediasi oleh NF-κB (Aggarwal, 2006).
Peroksisome proliferator activator reseptor gamma (PPARγ) adalah anggota dari family nuklear reseptor dengan beragam fungsi biologis yang mencakup mediasi diferensiasi adiposit, pengaturan aktivitas monosit, makrofag, anti-inflamasi dan penghambatan proliferasi sel tumor (Li, 2003;
Tracey, 2003). PPARγ juga ditemukan terekspresi dalam beberapa karsinoma, sehingga menimbulkan dugaan bahwa memiliki peranan dalam diferensiasi garis sel kanker dan dalam regulasi siklus sel (Koeffler, 2003; Qing, 2009). Pada karsinoma sel skuamous kepala dan leher terlihat adanya overekspresi pada PPARγ, dimana PPARγ akan merangsang apoptosis dan menghambat invasi sel tumor pada karsinoma sel skuamous. Jika PPARγ meningkat maka apoptosis juga meningkat terutama pada tumor stadium dini (Qing, 2009; Horvai, 2008).
PPARγ berperan sebagai faktor transkripsi setelah membentuk heterodimer dengan retinoid x reseptor (RXR) kemudian diaktifkan oleh ikatan dengan ligan spesifik (Knauer, 2009). Yang termasuk ligan alami salah satunya yaitu prostaglandin J2(PG-J2) dan ligan sintesis yaitu thiazolinediones (TZD). Keduanya adalah ligan PPARγ dengan aktivitas agonis anti-proliferasi yang telah diidentifikasi. Yang termasuk dalam ligan sintetik TZD adalah rosiglitazone (Avandia), pioglitazone (Actos), dan troglitazone (Rezulin) (Tracey, 2003; Koeffler, 2003). Ligan sintetik yang baru yaitu Triterpinoid (2-cyano-3, 12-divoaleana-1,9-diene-28oic acid) dapat merangsang diferensiasi dan dapat menghambat proliferasi dari berbagai sel kanker dan mempunyai aktivitas anti peradangan.
Nuklear reseptor memodulasi atau merangsang proliferasi, apoptosis, invasi dan migrasi. PPAR dapat menekan pertumbuhan sel kanker pada manusia. Dengan adanya mutasi pada PPARγ akan mengakibatkan hilangnya ikatan ligan. Ini menunjukkan bahwa pentingnya PPARγ fungsional yang normal untuk pertumbuhan sel-sel manusia. Salah satu
mekanismenya adalah upregulasi tumor oleh agonis PPARγ. Secara keseluruhan ligan PPARγ (agonis) telah dinyatakan sebagai antikanker yang potensial dan dapat berfungsi sebagai dasar yang rasional dalam terapi beberapa tumor atau dalam kemopreventif. Data lain menunjukkan bahwa PPARγ bisa berperan sebagai gen supressor tumor (Knauer, 2009;
Schweitzer, 2009).
Hubungan antara PPARγ dan COX-2 yang dijumpai diberbagai kanker pada manusia, termasuk kepala dan leher, dimana aktivitas PPARγ dapat menghambat ekspresi COX-2, mungkin melalui gangguan negative NF-κB dan/atau aktivitas AP1 (Nikitakis, 2002).
2.2.3 Ekspresi COX-2 pada KNF
Sari (2004) melakukan penelitian tentang korelasi tingkat ekspresi cyclooxygenase-2 dan gambaran angiogenesis pada karsinoma nasofaring tak berdiferensiasi menyatakan bahwa terdapat korelasi positif sedang antara tingkat ekspresi COX-2 dengan angiogenesis pada KNF tak berdiferensiasi.
Tan dan Putti (2005) melakukan penelitian untuk menilai ekspresi COX-2 pada KNF. Penelitiannya menunjukkan terdapat proporsi tinggi (60 dari 85) KNF yang mengekspresikan COX-2.
Soo (2005) menemukan peningkatan ekspresi COX-2 pada 33 dari 42 spesimen KNF dengan menggunakan metode imunohistokimia. Mereka juga menemukan hubungan antara ekspresi COX-2 dan status ekspresi EGFR.
2.2.4 Penghambat COX-2
NSAID merupakan penghambat enzim cyclooxygenase, yang mengkatalisir metabolisme asam arkhidonat menjadi prostaglandin, prostasiklin dan tromboxan. Isoform cyclooxygenase-1 terekspresi secara tetap dalam jaringan yang berperan dalam berbagai fungsi fisiologis seperti sitoproteksi mukosa lambung dan regulasi agregrasi platelet.
Inhibisi COX-1 dapat berperan terhadap efek samping yang biasa terjadi pada NSAID, seperti ulserasi lambung dan pendarahan gastrointestinal.
Isoform cyclooxygenase-2 diinduksi oleh respon sitokin dan faktor-faktor pertumbuhan dan terekspresi dalam proses inflamasi, lesi premaligna (adenoma kolon rectal) dan kanker kolon. Inhibisi COX-2 tidak berhubungan dengan ulserasi lambung. Akan tetapi, efek jangka panjang COX-2 inhibitor selektif dibandingkan dengan NSAID tradisional masih belum dapat dipastikan. Bukti eksperimental menguatkan konsep bahwa efek kemopreventif NSAID mungkin disebabkan oleh efek dari inhibisi cyclooxygenase-2 (Steinbach, 2000; Cormac, 2011).
Khasiat suatu NSAID sangat ditentukan kemampuannya menghambat sintesis prostaglandin melalui hambatan aktivitas COX (Lelo, 2004).
Beberapa penelitian yang telah menggunakan penghambat COX-2 selektif dan penghambat COX non selektif diantaranya :
NO NAMA OBAT PENYAKIT
LAMA PEMBERIAN
(MINGGU)
PENULIS, TAHUN
1. Etoricoxib 30 mg Osteoarthritis 12-26 Bingham, 2007 2. Etoricoxib 60 mg Osteoarthritis 6 Gottesdiener, 2002 3. Etoricoxib 60 mg Osteoarthritis 14 Takemoto, 2008 4. Etoricoxib 90 mg Osteoarthritis 6 Gottesdiener, 2002 5. Etoricoxib 90 mg Rheumatoid arthritis 12 Collantes, 2002 6. Etoricoxib 120 mg Rheumatoid arthritis 12 Hunt, 2003 7. Celecoxib 200 mg Osteoarthiritis 12 Bingham, 2007 8. Celecoxib 400 mg Karsinoma nasofaring 2 Soo, 2006 9. Piroxicam 20 mg Osteoarthritis 4 Chang, 2001 10. Piroxicam 20 mg Osteoarthirits 4 Dequeker,1998 11. Piroxicam 20 mg Osteoarthritis 6 Linden, 1996 12. Piroxicam 20 mg Rheumatoid arthritis 10 Domljan, 1984 13. Piroxicam 40 mg Interstitial cystitis 8 Wammack, 2002 14. Meloxicam 3,75 mg Osteoarthritis 12 Yocum, 2000 15. Meloxicam 7,5 mg Osteoarthritis 4 Chang, 2001 16. Meloxicam 7,5 mg Rheumatoid arthritis 24 Wajtulewski, 1996 17. Meloxicam 15 mg Osteoarthritis 6 Linden, 1996
Tabel 2.1 Beberapa penghambat COX-2 selektif dan penghambat COX-2 non selektif
a. Etoricoxib
Etoricoxib merupakan penghambat COX-2 selektif yang dapat di jumpai di negara-negara Eropa, Amerika Latin dan Asia Pasifik. Efek etoricoxib dengan dosis yang direkomendasikan sebesar 60 mg sekali sehari sama dengan efek yang ditunjukkan oleh natrium diklofenak 50 mg tiga kali sehari. Bila dibandingkan dengan NSAID non selektif, etoricoxib menunjukkan perforasi, ulkus dan perdarahan lambung yang lebih sedikit (Bingham, 2006; Chow, 2009)
b. Piroxicam
Piroxicam, penghambat cyclooxygenase non-selektif termasuk ke dalam golongan obat-obatan NSAID dan analgesik. Piroxicam diserap dengan baik setelah 30 menit pemberian secara oral. Bekerja sangat efektif untuk berbagai karakteristik nyeri dan proses inflamasi pada regimen dosis yang dianjurkan sebesar 20 mg sekali sehari atau 10 mg 2 kali sehari. Piroxicam dengan dosis 40 mg per hari telah terbukti efektif untuk nyeri akut (Keles, 2010).
2.3 Kerangka Teori
Gambar 2.2 Pengaruh COX-2 pada proses tumorigenesis
Plasma membrane
Membrane Phospholipids Arachidonic Acid
cPLA2
cPLA2
COX-2 (Induction) COX-1 (Constitutive)
PG : DEF PGH2
Prostacycline Tromboxane
PGE2
- VEGF - MVD
- Basic Fibroblast GF - Sel Endothel - Sel Inflamasi - Infiltrasi tumor
EGFR
Bcl-2 TNF-α, IL-8 Bax
NF-κB
G Protein cAMP/Ca++
MMP-9 MAPK
PI-3K/AKT PPARγ
C-met
Angiogenesis
Apoptosis Invasi
sel tumor
Tumor / KNF
Proliferasi Migrasi Supresi
Respon Imun
Penghambat COX-2 Selektif Penghambat COX-2
Non Selektif
Stomach, Kidney, Intestine, Platelet,
Endothelium
PGI2
TXA2
PGE2
Fungsi Fisiologis
Membran phospolipid oleh CPLA2 diubah menjadi asam arakhidonat.
Oleh COX-1 yang constitutive yang banyak terdapat pada lambung, ginjal, saluran cerna, platelet dan endotelium, ini akan dirubah menjadi PGE2, TXA2 dan PGI2, yang berperan pada proses fisiologis.
COX-2 yang terinduksi akan merubah asam arakhidonat menjadi 3 bentuk yaitu prostasiklin, tromboksan dan prostaglandin. Terutama PGE2 akan masuk melalui plasma membran membentuk proses-proses tumorigenesis dengan melalui jalur apoptosis yang diperantarai oleh TNF-α, IL-8 dan NF-κB. Angiogenesis diperantarai oleh VEGF, MVD, Basic fibroblast GF, sel endotel dan sel inflamasi. Jalur proliferasi diperantarai oleh PPARγ dan C-met. MAPK dan PI-3K/AKT memperantarai jalur proliferasi dan migrasi. Invasi sel tumor diperantarai oleh MMP-9.
Penghambat COX-2 selektif hanya bekerja pada jalur COX-2, sedangkan penghambat COX-2 non selektif selain bekerja pada jalur COX-2 juga mempengaruhi jalur COX-1.
2.4 Kerangka Konsep
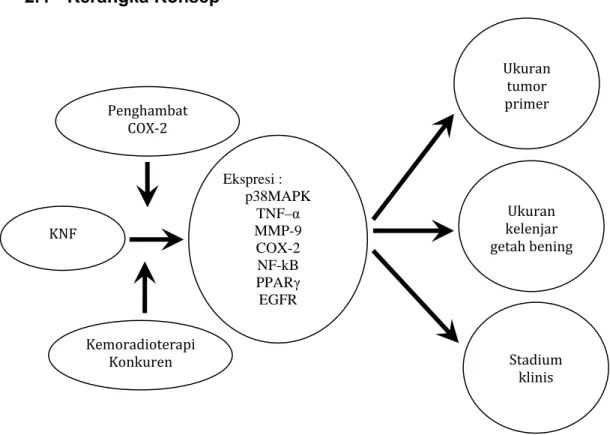
Gambar 2.3 Pemberian penghambat COX-2 pada karsinoma nasofaring
Pada penelitian ini, subyek yang telah memenuhi kriteria inklusi kemudian diberikan perlakuan dengan plasebo, penghambat COX-2 selektif etoricoxib atau penghambat COX-2 non selektif piroxicam sebagai terapi tambahan selama subyek menjalani kemoradioterapi konkuren.
Setelah subyek menyelesaikan kemoradioterapi konkuren, dilakukan penilaian ulang terhadap klinis subyek, CT-Scan nasofaring untuk menilai ukuran tumor, ukuran kelenjar getah bening dan stadium klinis, serta biopsi nasofaring untuk menilai ekspresi immunohistokimia.
KNF
Ukuran tumor primer
Ekspresi : p38MAPK
TNF–α MMP-9 COX-2 NF-kB PPARγ EGFR Penghambat
COX-2
Ukuran kelenjar getah bening
Stadium klinis Kemoradioterapi
Konkuren
2.5 Hipotesa Penelitian
1. Pemberian penghambat COX-2 selektif atau non selektif pada kemoradioterapi konkuren dapat memberikan respon klinis (ukuran tumor, ukuran kelenjar getah bening dan stadium klinis) yang lebih baik pada penderita karsinoma nasofaring.
2. Pemberian penghambat COX-2 selektif atau non selektif pada kemoradioterapi konkuren dapat menyebabkan terjadinya penurunan ekspresi immunohistokimia.
3. Pemberian penghambat COX-2 selektif atau non selektif pada kemoradioterapi konkuren tidak meningkatkan efek samping lokal dan sistemik dari gambaran klinis, Karnofsky Performance Status Scale dan sistem hematopoiesis (Hb, leukosit dan trombosit) pada penderita karsinoma nasofaring.