i
UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN RADIKAL 1,1-DIFENIL-2-PIKRILHIDRAZIL DAN PENETAPAN KANDUNGAN FENOLIK
TOTAL FRAKSI ETIL ASETAT EKSTRAK ETANOL BUAH ANGGUR BALI (Vitis vinifera L.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh: Mikhael Gustandy NIM : 098114033
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
ANTIOXIDANT ACTIVITY TEST USING RADICAL 1,1-DIPHENYL-2-PIKRILHIDRAZIL AND DETERMINATION OF TOTAL CONTENT PHENOLIC FRACTION ETHYL ACETATE OF ETHANOLIC EXTRACT
OF BALINESSE GRAPE (Vitis vinifera L.)
UNDERGRADUATE THESIS
Presented as Partitial Fulfillment of the Requirement To Obtain Sarjana Farmasi (S. Farm)
In Faculty of Pharmacy
By :
Mikhael Gustandy Student Number : 098114033
FACULTY OF PHARMACY SANATA DHARMA UNIVERSITY
YOGYAKARTA 2013
v
Akulah pokok anggur dan kamulah
ranting-rantingnya. Barangsiapa tinggal di dalam Aku dan
Aku di dalam dia, ia akan berbuah banyak, sebab
di luar Aku kamu tidak dapat berbuat apa-apa.
Yohanes 15:5
HALAMAN PERSEMBAHANClimb the mountain not to plant your flag, but to embrace the challenge,
to enjoy the air and behold the view Climb the mountain,
not so the world can see you, but so you can see the world
Kupersembahkan skripsi ini untuk:
Allah Bapa, Allah anak, dan Allah roh kudus
You’re my Father, Provider, and Deliverer
Gideon Hardiyanto, Agustina V. R.
atas doa dan restu serta dukungan baik moril dan materiil
Nichanor Gustandy, Benhard Y. Gustandy
menjadi memotivasiku
viii PRAKATA
Puji syukur kepada Tuhan atas semua berkat dan penyertaan-Nya kepada penulis sehingga penulis dapat menyelesaikan skripsi yang berjudul “UJI
AKTIVITAS ANTIOKSIDAN MENGGUNAKAN RADIKAL 1,1-DIFENIL-2-PIKRILHIDRAZIL DAN PENETAPAN KANDUNGAN FENOLIK TOTAL FRAKSI ETIL ASETAT EKSTRAK ETANOL BUAH ANGGUR BALI (Vitis
vinifera L.)” ini dengan baik. Laporan akhir ini disusun untuk memenuhi salah satu syarat guna memperoleh gelar Sarjana Farnasi Universitas Sanata Dharma Yogyakarta.
Dalam proses penelitian dan penyusunan skripsi ini tidak lepas dari bantuan dan dukungan dari semua pihak sehingga skripsi ini dapat terselesaikan dengan baik. Oleh karena itu, dengan segala kerendahan hati atas segala bantuan yang telah diberikan penulis ingin mengucapkan terima kasih kepada:
1. Ipang Djunarko, M.Sc., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Prof. Dr. C. J. Soegihardjo, Apt., selaku Dosen Pembimbing yang telah memberikan bantuan dan bimbingan selama rancangan, pengusulan skripsi, saat dilakukan penelitian dan selama penulisan skripsi dengan kesabaran dan penuh perhatian.
3. Yohanes Dwiatmaka, M.Si. sebagai Dosen Penguji atas pengarahan, kritik, saran yang membangun dan kesediaannya menguji skripsi ini.
ix
4. Dra. M.M. Yetty Tjandrawati, M.Si. sebagai Dosen Penguji atas pengarahan, kritik, saran yang membangun dan kesediaannya menguji skripsi ini.
5. Rini Dwiatuti, M.Sc., Apt. selaku Dosen Pembimbing Akademik yang telah mendidik dan memberi nasihat positif.
6. Segenap laboran Laboratorium Farmakognosi-Fitokimia (Mas Wagiran) dan Farmasi Fisika (Mas Agung) atas segala bantuan selama penulis melakukan penelitian di laboratorium.
7. Aldo Kristian, W. Danu Patria, Anthony Felix, tim DPPH 2009 yang saling melengkapi, tanpa bantuan kalian skripsi ini tidak akan selesai.
8. Teman-Teman kelas A dan 2009 atas dukungan, doa, semangat, kritik, saran dan segala masukannya, Berta Trifina, Wanda Indriani yang selalu ada dan siap membantu.
9. Apostolos Family, keluarga yang selalu memberikan keceriaan dan nilai kehidupan yang sangat berarti, dan Defilia Anogra Riani yang mewarnai hidup. 10. Segenap instruktur, karyawan, serta anak didik Gilang Ramadan Studio Band
Solo yang membanggakan.
11. Semua pihak yang telah memberikan bantuan dan dukungan yang tidak dapat disebut satu per satu.
x
Penulis menyadari bahwa dalam penulisan skripsi ini banyak kesalahan dan kekurangan mengingat keterbatasan kemampuan dan pengetahuan penulis. Untuk itu penulis mengharapkan saran dan kritik yang membangun dari semua pihak. Akhir kata semoga laporan ini dapat berguna bagi pembaca.
Yogyakarta, 14 Mei 2013
xi DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
PAGE TITTLE ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN ... v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ... vi
PERNYATAAN KEASLIAN KARYA ... vii
PRAKATA ... ix
DAFTAR ISI ... xi
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
INTISARI ... xvii ABSTRACT ... xviii BAB I PENGANTAR ... 1 A. Latar Belakang ... 1 1. Perumusan masalah ... 3 2. Keaslian penelitian ... 4 3. Manfaat penelitian ... 5 B. Tujuan Penelitian ... 5 1. Tujuan umum ... 5 2. Tujuan khusus ... 6
BAB II PENELAAHAN PUSTAKA ... 7
A. Anggur Bali ... 7
xii 2. Deskripsi ... 8 3. Manfaat ... 9 B. Antioksidan ... 9 C. Fenolik Total ... 11 D. Metode DPPH ... 13 E. Metode Folin-Ciocalteau ... 14 F. Ekstraksi ... 15 G. Spektrofotometri Visibel ... 16
H. Validasi Metode Analisis ... 17
I. Landasan Teori ... 19
J. Hipotesis ... 20
BAB III METODE PENELITIAN ... 21
A. Jenis dan Rancangan Penelitian ... 21
B. Variabel Penelitian ... 21
C. Definisi Operasional ... 21
D. Bahan dan Alat Penelitian ... 22
E. Tata Cara Penelitian ... 23
F. Analisis Hasil ... 30
BAB IV HASIL DAN PEMBAHASAN ... 31
A. Hasil Determinasi Tanaman ... 31
B. Hasil Pengumpulan Bahan ... 31
C. Hasil Preparasi Sampel ... 32
D. Hasil Uji Pendahuluan... 36
E. Hasil Optimasi Metode Uji Aktivitas Antioksidan ... 38
F. Hasil Validasi Metode Uji Aktivitas Antioksidan ... 43
G. Hasil Estimasi Aktivitas Antioksidan dengan Radikal DPPH ... 50
H. Hasil Optimasi Metode Penetapan Kandungan Fenolik Total ... 54
I. Hasil Validasi Metode Penetapan Kandungan Fenolik Total ... 56
xiii
BAB V KESIMPULAN DAN SARAN ... 61
A. Kesimpulan ... 61
B. Saran ... 61
DAFTAR PUSTAKA ... 62
LAMPIRAN ... 66
xiv
DAFTAR TABEL
Halaman
Tabel I. Kandungan nutrien buah anggur Bali ... 7
Tabel II. Kriteria nilai presisi yang masih dapat diterima menurut APVMA (2004) ... 17
Tabel III. Hasil Scanning panjang gelombang maksimum DPPH ... 40
Tabel IV. Hasil pengukuran absorbansi seri baku kuersetin yang direaksikan dengan radikal DPPH ... 44
Tabel V. Hasil pengukuran absorbansi seri fraksi etil asetat ekstrak etanol buah anggur Bali yang direaksikan dengan DPPH ... 44
Tabel VI. Hasil presisi aktivitas antioksidan standar kuersetin ... 45
Tabel VII. Hasil presisi aktivitas antioksidan fraksi etil asetat... 46
Tabel VIII. Hasil aktivitas antioksidan kuersetin dengan metode DPPH ... 47
Tabel IX. Hasil aktivitas antioksidan fraksi etil asetat ekstrak etanol buah anggur dengan metode DPPH ... 48
Tabel X. Hasil perhitungan IC50 kuersetin dan fraksi etil asetat ekstrak etanol buah anggur Bali ... 52
Tabel XI. Penggolongan tingkat kekuatan antioksidan kuersetin dan fraksi etil asetat ekstrak etanol buah anggur Bali... 53
Tabel XII. Hasil scanning panjang gelombang maksimum asam galat dan folin ... 55
Tabel XIII. Hasil presisi asam galat dari beberapa parameter ... 58
Tabel XIV. Hasil pengukuran absorbansi asam galat yang direaksikan dengan DPPH ... 58
Tabel XV. Hasil penentuan jumlah fenolik total fraksi etil asetat ekstrak etanol buah anggur Bali ... 60
xv
DAFTAR GAMBAR
Halaman
Gambar 1. Tanaman anggur Bali (Vitis vinifera L.) ... 8
Gambar 2. Mekanisme pembentukan radikal antioksidan (Sihombing, 2011) ... 11
Gambar 3. Kelompok flavonoid produk alam (Samata et al., 2011) ... 12
Gambar 4. Reaksi reduksi DPPH (Prakash, 2001) ... 13
Gambar 5. Hasil uji pendahuluan aktivitas antioksidan (A = kontrol positif [kuersetin], B = kontrol negatif [blanko DPPH], C = larutan uji [fraksi etil asetat ekstrak etanol buah Anggur Bali] + DPPH) ... 37
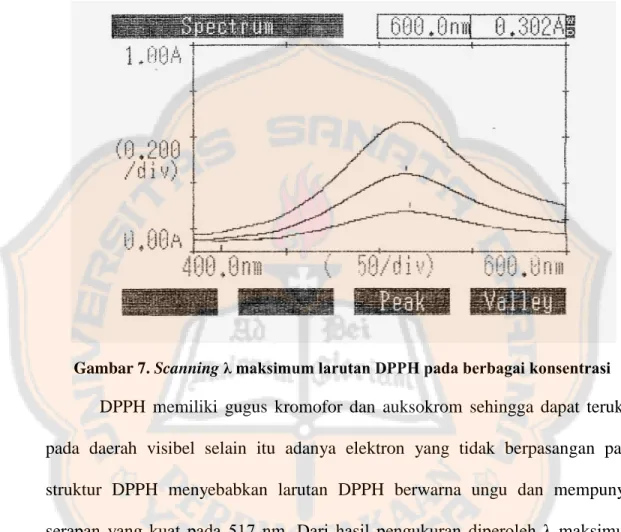
Gambar 6. Hasil uji pendahuluan fenolik (A = kontrol negatif [blanko reagen fenol Folin-Ciocalteu], B = larutan uji [fraksi etil asetat ekstrak etanol buah anggur] + reagen fenol Folin-Ciocalteu, C = kontrol positif [asam galat] + reagen fenol Folin-Ciocalteu) 38 Gambar 7. Scanning λ maksimum larutan DPPH pada berbagai konsentrasi ... 40
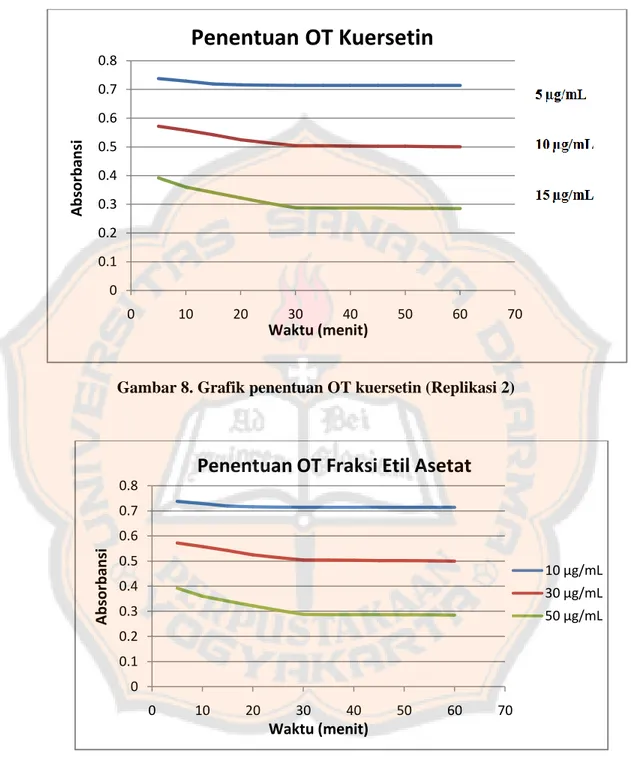
Gambar 8. Grafik penentuan OT kuersetin (Replikasi 2) ... 42
Gambar 9. Grafik penentuan OT fraksi etil asetat (Replikasi 1) ... 42
Gambar 10. Kurva persamaan regresi linear aktivitas antioksidan kuersetin . 47 Gambar 11. Kurva persamaan regresi linier aktivitas antioksidan fraksi etil asetat... 48
Gambar 12. Reaksi reduksi DPPH (Prakash, 2001) ... 50
Gambar 13. Struktur kuersetin (Cartea, 2010) ... 51
Gambar 14. Grafik penentuan OT penetapan kandungan fenolik ... 56
Gambar 15. Kurva persamaan regresi linier penetapan kadar fenolik total .... 57
xvi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat determinasi tanaman anggur ... 67
Lampiran 2. Foto tanaman buah anggur dari kebun Buleleng Bali (Vitis vinifera L.)... 68
Lampiran 3. Perhitungan rendemen ... 69
Lampiran 4. Data penimbangan untuk pengujian aktivitas antioksidan ... 62
Lampiran 5. Data perhitungan konsentrasi pengujian aktivitas antioksidan ... 72
Lampiran 6. Scanning pengkoreksi ... 73
Lampiran 7. Optimasi metode uji aktivitas antioksidan ... 76
Lampiran 8. Uji aktivitas antioksidan menggunakan radikal DPPH ... 84
Lampiran 9. Perhitungan nilai IC50 kuersetin dan fraksi etil asetat buah anggur Bali ... 87
Lampiran 10. Penimbangan bahan pengujian kandungan fenolik total ... 88
Lampiran 11. Perhitungan konsentrasi pengujian fenolik total ... 86
Lampiran 12. Scanning kontrol asam galat ... 91
Lampiran 13. Optimasi penentuan kandungan fenolik total ... 92
Lampiran 14. Perhitungan kandungan fenolik total ... 96
xvii INTISARI
Penelitian ini bertujuan untuk mengetahui aktivitas antioksidan pada fraksi etil asetat ekstrak etanol buah anggur Bali (Vitis vinifera L.) menggunakan radikal bebas DPPH dan untuk mengetahui kandungan fenolik totalnya. Maserasi buah anggur Bali dengan penyari etanol untuk mendapatkan ekstrak etanolnya. Fraksinasi menggunakan etil asetat untuk mendapatkan fraksi etil asetat ekstrak etanol. Hasil fraksi etil asetat tersebut dapat digunakan untuk uji pendahuluan aktivitas antioksidan dan kandungan fenoliknya. Fraksi etil asetat yang diperoleh diuji aktivitas antioksidannya menggunakan radikal 1,1-diphenyl-2-picrylhydrazyl. Hasil dari pengukuran aktivitas antioksidan dinyatakan melalui nilai Inhibition Concentration 50 (IC50) yang menyatakan konsentrasi yang menurunkan 50% dari konsentrasi DPPH awal. Adanya senyawa antioksidan akan mengubah warna ungu larutan DPPH menjadi kuning, disertai penurunan absorbansi DPPH. Penentuan kandungan fenolik total menggunakan metode Folin-Ciocalteau dinyatakan dengan nilai massa ekivalen asam galat per g fraksi etil asetat ekstrak etanol buah anggur Bali. Senyawa fenolik akan dioksidasi oleh pereaksi fenol Folin-Ciocalteau dalam suasana basa sehingga terbentuk larutan berwarna biru.
Hasil penelitian menunjukkan bahwa fraksi etil asetat ekstrak etanol buah anggur Bali mempunyai nilai IC50 sebesar 36,55 ± 0,09 µg/mL dan kandungan fenolik total sebesar 3,23 ± 0,02 mg ekivalen asam galat per gram fraksi etil asetat ekstrak etanol buah anggur Bali.
Kata Kunci: antioksidan, buah anggur Bali (Vitis vinifera L.), fraksi etil asetat,
xviii ABSTRACT
This research was conducted to determine the antioxidant activity of ethyl acetat fraction of extract of Balinesse grape (Vitis vinifera L.) using free radical and determine the total phenolic content. Balinesse grape maceration using ethanolic solvents to obtain the ethanolic extract. Fractionation using ethyl acetate to obtain ethyl acetate fraction of ethanolic extract. Results of ethyl acetate fraction can be used for preliminary testing antioxidant activity and phenolic content. Ethyl acetat fraction obtained were tested using the DPPH radical, expressed as IC50 is the concentration that causes a decrease of 50% of early DPPH concentration. The presence of antioxidant compounds, will change purple colour of DPPH to yellow and the absorbance decreases. Total fhenolics content determined by the Folin-Ciocalteau method, expressed as mg equivalent gallic acid per g of ethyl acetat fraction. Phenolics compound will oxidated by Follin-Ciocalteu reagent in alkaline conditions, formed blue solution.
The results showed that the ethyl acetat fraction of extract of Balinesse grape ethanolic have IC50 of 36,55 ± 0,09 µg/mL and total phenolic content of 3,23 ± 0,02 mg gallic acid equivalents per gram of ethyl acetat fraction of ethanolic extract of Balinesse grape.
Keywords: antioxidants, Balinesse grape (Vitis vinifera L.), fraction of ethyl acetat,
1 BAB I PENGANTAR A. Latar Belakang
Sinar ultraviolet, asap pabrik, asap kendaraan, asap rokok maupun efek dari pemanasan global merupakan faktor yang mempengaruhi proses metabolisme sel normal manusia maupun respon imun yang menyebabkan terbentuknya radikal bebas dalam tubuh manusia (Prakash, 2001). Radikal bebas adalah atom atau molekul yang tidak stabil dan sangat reaktif karena mengandung satu atau lebih elektron tidak berpasangan pada orbital terluarnya. Radikal bebas akan bereaksi dengan molekul disekitarnya untuk memperoleh pasangan elektron sehingga tercapai kestabilan atom atau molekul. Reaksi ini akan berlangsung terus menerus dalam tubuh dan bila tidak dihentikan akan menimbulkan berbagai penyakit seperti kanker, jantung, katarak, penuaan dini, serta penyakit degeneratif lainnya. Oleh karena itu, tubuh memerlukan suatu substansi penting, yaitu antioksidan yang mampu menangkap radikal bebas tersebut sehingga tidak dapat menginduksi suatu penyakit (Kikuzaki and Hisamoto, 2002).
Di dalam tubuh terdapat senyawa yang disebut antioksidan yaitu senyawa yang dapat menetralkan radikal bebas, seperti: enzim SOD (Superoksida Dismutase),
gluthatione, dan katalase. Antioksidan juga dapat diperoleh dari asupan makanan
yang banyak mengandung vitamin C, vitamin E, dan betakaroten serta senyawa fenolik. Bahan pangan yang dapat menjadi sumber antioksidan alami, seperti rempah-rempah, coklat, biji-bijian, buah-buahan, sayur-sayuran seperti buah tomat, pepaya,
jeruk dan sebagainya (Prakash, 2001). Kandungan fenolik termasuk flavonoid diketahui memiliki kemampuan sebagai antioksidan yang dapat menghambat penggumpalan trombosit, merangsang produksi nitrogen oksida (NO) yang berperan melebarkan pembuluh darah (vasorelactation), serta menghambat pertumbuhan sel kanker (Winarsi, 2007).
Usaha untuk mencari senyawa antioksidan baru yang aman dan efektif berkembang selama beberapa tahun terakhir. Banyak penelitian yang menunjukkan bahwa senyawa antioksidan dalam tumbuhan dapat dihubungkan dengan pencegahan stres oksidatif dan penyakit karena penuaan (Zou, Lu, dan Wei, 2004). Indonesia sebagai negara tropis memiliki beraneka ragam tumbuhan yang dapat dimanfaatkan sebanyak-banyaknya untuk kepentingan manusia. Masyarakat Indonesia sejak zaman dahulu telah mengenal tumbuhan yang mempunyai khasiat obat atau menyembuhkan berbagai macam penyakit. Tanaman yang berkhasiat obat tersebut dikenal dengan sebutan tanaman obat tradisional (Thomas, 1993).
Buah anggur dengan berbagai jenis yang beredar di pasaran diketahui memiliki aktivitas antioksidan dan banyak penelitian tentang khasiat buah anggur yang telah dilakukan. Masyarakat sering mengkonsumsinya karena rasa yang manis pada buah tersebut. Di tanah Bali terdapat buah anggur lokal dengan rasa manis selain itu terdapat rasa yang sangat masam, tetapi peneliti menduga kandungan antioksidan yang terdapat pada anggur Bali yang tidak kalah berkhasiat dibanding anggur-anggur import maupun buah-buah lainnya. Pada peneltian ini digunakan semua bagian dari buah anggur karena pola konsumsi masyarakat luas yang
mengkonsumsi buah anggur secara langsung maupun dalam sediaan lain, seperti
wine, kismis, selai, dan lain-lain.
Salah satu uji untuk menentukan aktivitas antioksidan adalah metode DPPH (1,1Difenil-2-pikrilhidrazil). Pada metode ini penangkap radikal bebas menyebabkan elektron menjadi berpasangan yang kemudian menyebabkan penghilangan warna. Nilai aktivitas antioksidan diketahui melalui nilai IC50 yang merupakan konsentrasi
yang menyebabkan penurunan 50% dari konsentrasi DPPH awal (Sunarni, 2005). Salah satu keuntungan uji aktivitas antioksidan dengan metode DPPH adalah dapat dikerjakan dengan cepat dan sederhana dibanding metode lain. Oleh karena itu, penelitian ini bertujuan untuk mengetahui aktivitas antioksidan buah anggur Bali dengan metode DPPH yang didapat dari fraksi etil asetat ekstrak etanol buah anggur Bali. Digunakan etanol untuk ekstraksi karena merupakan pelarut universal dan digunakan pelarut etil asetat untuk fraksinasi karena akan diambil senyawa golongan aglikon yang bersifat non-polar. Dalam penelitian ini juga dilakukan penetapan kandungan fenolik total dengan metode Folin-Ciocalteau. Metode ini umum digunakan sebagai standar penentuan kandungan fenolik total setara massa ekivalen asam galat pada uji aktivitas antioksidan sumber tumbuhan (Aqil et al., 2006).
1. Perumusan masalah
Berdasarkan uraian dalam latar belakang di atas, permasalahan yang diangkat adalah sebagai berikut:
a. Berapakah nilai aktivitas antioksidan fraksi etil asetat ekstrak etanol buah anggur Bali (Vitis vinifera L.) dengan menggunakan radikal bebas DPPH yang dinyatakan dengan IC50 ?
b. Berapakah kandungan fenolik total pada buah anggur Bali (Vitis vinifera L.) yang dinyatakan dengan massa ekivalen asam galat?
2. Keaslian penelitian
Sejauh pengamatan penulis, penelitian tentang uji aktivitas antioksidan buah anggur pernah dilakukan oleh :
a. Jayaprakasha, Singh, Sakariah, (2001) dengan judul “Antioxidant Activity of
Grape Seed (Vitis vinifera) Extracts on Peroxidation Models In Vitro”
menggunakan biji anggur yang diekstrak lalu didapatkan fraksi dari berbagai macam pelarut seperti: aseton, etil asetat, metanol, dan campuran pelarut yang berbeda. Aktivitas antioksidan diuji menggunakan sistem β-karoten-linoleat dan metode peroksidasi asam β-karoten-linoleat.
b. Negro, Tommasi, Miceli, (2002) dengan judul “Phenolic Compounds and
Antioxidant Activity from Red Grape Marc Extracts” menggunakan ekstrak
metanol dari kulit dan biji anggur merah untuk mendapatkan senyawa fenolik dan untuk uji aktivitas antioksidan alami dengan tes β-karoten bleaching. c. Wibiani Santi (2010) dengan judul “Isolasi dan Identifikasi Senyawa
Antosianin dari Kulit Buah Anggur (Vitis vinifera var. PRABU BESTARI)” menggunakan ekstrak kulit buah anggur dengan pelarut metanol 95% dan
senyawa antosianin diperoleh dengan fase gerak etil asetat-asam asetat glasial-asam format-air (10:1,1:1,1:2,6).
3. Manfaat penelitian
Manfaat yang dapat diperoleh dari penelitian adalah: a. Manfaat teoritis
Hasil dari penelitian ini diharapkan dapat memberikan lebih banyak pengetahuan mengenai khasiat darifraksi etil asetat ekstrak etanol pada buah anggur Bali (Vitis vinifera L.) yang dapat memberikan efek antioksidan (penangkap radikal bebas), sehingga hasil penelitian ini dapat menjadi acuan untuk penelitian selanjutnya.
b. Manfaat praktis
Penelitian ini diharapkan dapat memberi informasi bagi penelitian lebih lanjut maupun masyarakat luas mengenai aktivitas antioksidan buah anggur Bali (Vitis vinifera L.) sebagai antioksidan alami.
B. Tujuan Penelitian 1. Tujuan umum
Mengetahui aktivitas antioksidan menggunakan radikal bebas DPPH fraksi etil asetat ekstrak etanol buah anggur Bali (Vitis vinifera L.).
2. Tujuan khusus
a. Mengetahui nilai aktivitas antioksidan fraksi etil asetat ekstrak etanol buah anggur Bali (Vitis vinifera L.) dengan menggunakan radikal bebas DPPH yang dinyatakan dengan IC50.
b. Mengetahui kandungan fenolik total fraksi etil asetat ekstrak etanol buah anggur Bali (Vitis vinifera L.) yang dinyatakan dalam mg ekivalen asam galat.
7 BAB II PENELAAHAN PUSTAKA A. Anggur Bali 1. Klasifikasi tanaman Kingdom : Plantae Subkingdom : Tracheobionta Superdivision : Spermatophyta Division : Magnoliophyta Class : Magnoliopsida Subclass : Rosidae Order : Rhamnales Family : Vitaceae Genus : Vitis L.
Species : Vitis vinifera L.
(USDA, 2008). Tabel I. Kandungan Nutrisi Buah Anggur Bali
(Sumber : Whfoods.org, 2007).
Nutrien Jumlah Kebutuhan per hari (%) Kepadatan nutrisi
Manganese 0,66 mg 33,0 9,6 vitamin K 13,43 mcg 16,8 4,9 vitamin C 3,68 mg 6,1 1,8 vitamin B 10,08 mg 5,3 1,6 Potassium 175,72 mg 5,0 1,5 vitamin B 60,10 mg 5,0 1,5
Gambar 1. Tanaman anggur Bali
2. Deskripsi
Alphonso lavallee adalah jenis anggur varietas dari Vitis vinifera L. Anggur
ini terkenal dengan nama dagang anggur Bali. Populasi anggur ini paling banyak terdapat di pantai utara Bali sepanjang jalan antara Singaraja sampai Gerokgak. Warna daging buah anggur Bali hijau transparan, bentuk buah bulat, kulit ungu kehitaman, umur panen 115 hari sejak pangkas (HSP), kulit mengandung tepung atau lilin yang tebal, daging buah manis dan berwarna putih (Wiryanta, 2004).
Buah anggur Bali berbentuk bulat. Buah yang matang kulitnya berwarna ungu kehitaman dan mengandung tepung atau lilin yang tebal. Daging buahnya berwarna putih dengan rasa manis. Setiap buah berisi 2-3 biji yang ukurannya cukup
besar. Setiap dompolan buah berisi sekitar 35 buah. Setiap 100 buah mempunyai bobot 535 g. Umur panennya antara 105-110 hari setelah pangkas (Anonim, 2007).
3. Manfaat
Grape atau buah anggur mengandung serat dan resveratrol yang merupakan
salah satu sumber antioksidan, yaitu flavonoid. Flavonoid terdiri dari kuersetin, prosiadin, katekin, dan antosianin. Beberapa penelitian menunjukkan bahwa resveratrol sangat bermanfaat bagi kesehatan karena bisa mencegah resiko kanker dan membuat awet muda.
Untuk mencegah oksidasi atau kerusakan sel tubuh akibat terpapar polusi dan zat-zat beracun, maka tubuh memerlukan antioksidan sedangkan buah anggur mempunyai kandungan antioksidan yang lebih tinggi bila dibandingkan dengan antioksidan pada vitamin C (Anonim, 2010).
B. Antioksidan
Antioksidan merupakan suatu senyawa yang berperan dalam menghambat oksidasi yang diperantarai oksigen. Senyawa antioksidan memegang peranan penting dalam pertahanan tubuh terhadap penyakit. Hal tersebut disebabkan senyawa antioksidan dapat mencegah pengaruh buruk yang disebabkan oleh senyawa radikal bebas (Percival, 1998).
Sumber antioksidan dalam sistem biologi, yaitu :
b) Molekul besar (albumin, seruloplasmin, ferritrin dan protein lain),
c) Molekul kecil (asam askorbat, glutation, asam urat, tokoferol, karetenoid, dan polifenol), dan
d) Hormon (estrogen, angiotensin, melatonin) (Prior, Wu, and Schaich, 2005). Menurut sumbernya, antioksidan dapat digolongkan menjadi dua macam, yaitu antioksidan sintetik dan alami. Antioksidan sintetik merupakan antioksidan yang dibuat melalui sintesis secara kimia, sedangkan antioksidan alami merupakan antioksidan yang diproduksi langsung oleh tumbuhan maupun tubuh (Gulcin, Uguz, Oktay, Beydemir, dan Kufrevioglu, 2004).
Menurut Pervical (1998) bahan-bahan antioksidan, seperti vitamin C dan E bisa membatasi efek merusak dari radikal bebas yang berlebihan. Antioksidan alami yang paling efektif adalah tocopherol (vitamin E) yang larut dalam lemak dan vitamin C yang larut dalam air, efektif dalam menyapu radikal bebas.
Antioksidan sintetis mempunyai efektifitas yang tinggi, namun kurang aman bagi kesehatan sehingga penggunaannya diawasi dengan ketat di berbagai negara. Oleh karena itu, perlu dicari sumber antioksidan alami yang lebih aman daripada antioksidan sintetis untuk dikembangkan. Antioksidan alami bisa berasal dari rempah-rempah, buah atau tanaman (Pujimulyani, 2003).
Setelah bereaksi dengan radikal bebas dan menyumbangkan satu elektronnya antioksidan akan membentuk radikal antioksidan namun radikal antioksidan ini bersifat tidak reaktif karena distabilkan oleh cincin fenolik (Pokorny, Yanishlieva, and Gordon, 2001).
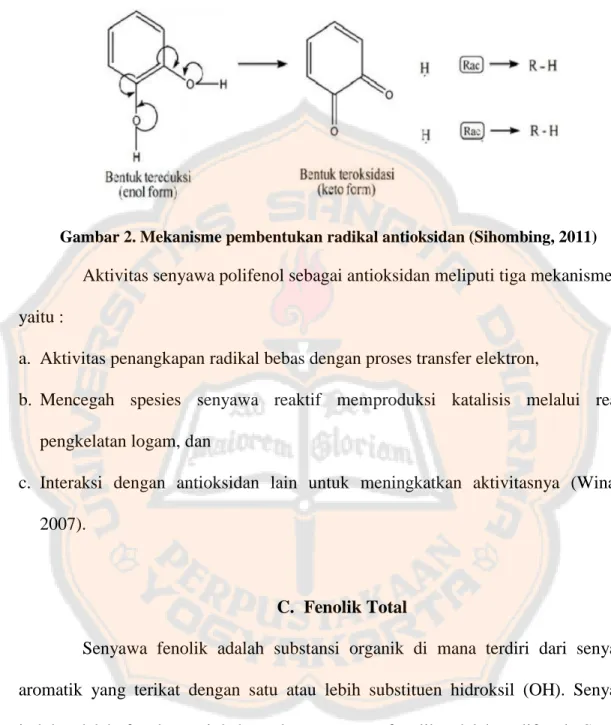
Gambar 2. Mekanisme pembentukan radikal antioksidan (Sihombing, 2011)
Aktivitas senyawa polifenol sebagai antioksidan meliputi tiga mekanisme, yaitu :
a. Aktivitas penangkapan radikal bebas dengan proses transfer elektron,
b. Mencegah spesies senyawa reaktif memproduksi katalisis melalui reaksi pengkelatan logam, dan
c. Interaksi dengan antioksidan lain untuk meningkatkan aktivitasnya (Winarsi, 2007).
C. Fenolik Total
Senyawa fenolik adalah substansi organik di mana terdiri dari senyawa aromatik yang terikat dengan satu atau lebih substituen hidroksil (OH). Senyawa induk adalah fenol tetapi kebanyakan senyawa fenolik adalah polifenol. Sumber senyawa fenolik sangat sedikit pada hewani akan tetapi pada sumber tumbuhan yang diketahui, golongan yang terbanyak adalah flavonoid (Mann, 1994). Senyawa fenolik merupakan sumber antioksidan alami yang aman digunakan dan merupakan golongan
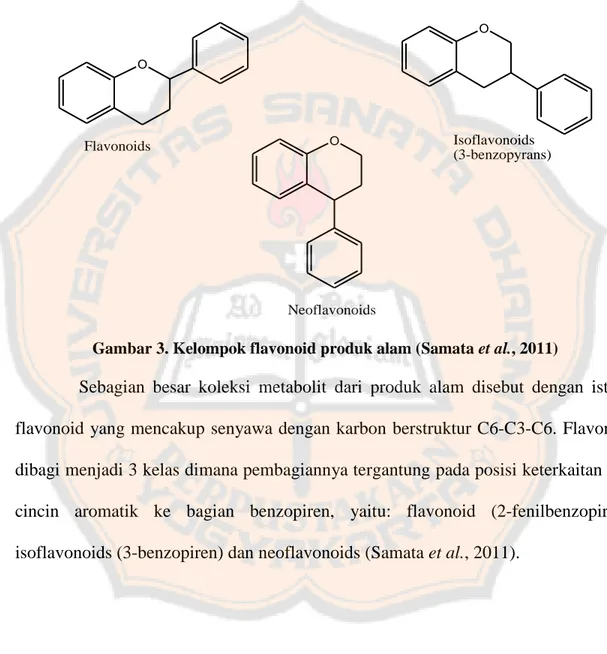
mayoritas senyawa yang bertindak sebagai antioksidan. Aktivitas antioksidan dari fenolik didapatkan dengan cara mereduksi radikal bebas sehingga radikal menjadi stabil (Marken, 2007). O O Flavonoids Isoflavonoids (3-benzopyrans) O Neoflavonoids
Gambar 3. Kelompok flavonoid produk alam (Samata et al., 2011)
Sebagian besar koleksi metabolit dari produk alam disebut dengan istilah flavonoid yang mencakup senyawa dengan karbon berstruktur C6-C3-C6. Flavonoid dibagi menjadi 3 kelas dimana pembagiannya tergantung pada posisi keterkaitan dari cincin aromatik ke bagian benzopiren, yaitu: flavonoid (2-fenilbenzopiren), isoflavonoids (3-benzopiren) dan neoflavonoids (Samata et al., 2011).
D. Metode DPPH
Metode DPPH adalah suatu metode kolorimetri yang efektif dan cepat untuk memperkirakan aktivitas antiradikal. Uji kimia ini secara luas digunakan dalam penelitian produk alami untuk isolasi antioksidan fitokimia dan untuk menguji seberapa besar kapasitas ekstrak dan senyawa murni dalam menyerap radikal bebas (Molyneux, 2003).
Salah satu uji untuk menentukan aktivitas antioksidan penangkap radikal adalah metode 1,1 Difenil-2-pikrilhidrazil (DPPH). Metode DPPH memberikan informasi reaktivitas senyawa yang diuji dengan suatu radikal stabil. DPPH memberikan serapan kuat pada panjang gelombang 517 nm dengan warna violet gelap. Penangkap radikal bebas menyebabkan elektron menjadi berpasangan yang kemudian menyebabkan penghilangan warna yang sebanding dengan jumlah elektron yang diambil (Sunarni, 2005).
Parameter yang diperkenalkan sebagai interpretasi dari hasil pengukuran dengan metode DPPH disebut efficient concentration atau nilai EC50 sering juga
disebut IC50. EC50 didefinisikan sebagai konsentrasi dari substrat yang menyebabkan
50% hilangnya aktivitas DPPH yang ditunjukkan berupa warna (Molyneux, 2003). Metode DPPH memiliki kelebihan antara lain yaitu mudah digunakan, mempunyai tingkat sensitifitas yang tinggi, dan dapat menganalisis sejumlah besar sampel dalam jangka waktu yang singkat (Kim, Lee, Lee and, Lee, 2002).
E. Metode Folin-Ciocalteau
Senyawa fenolik dalam suatu sampel dapat diukur dengan metode Folin-Ciocalteu (Verru, Kishor, and Meenakshi, 2009). Metode ini menggunakan reagen fenol asam fosfomolibdat-fosfotungstat yang biasa disebut reagen fenol Folin-Ciocalteu. Prinsip metode Folin-Ciocalteu adalah oksidasi gugus fenolik hidroksil. Pereaksi ini mengoksidasi fenolat (garam alkali) dan mereduksi asam heteropoli menjadi suatu kompleks molibdenum-tungsten (Mo-W). Fenolat hanya terdapat pada larutan basa, tetapi pereaksi Folin-Ciocalteu dan produknya tidak stabil pada kondisi basa. Selama reaksi belangsung, gugus fenolik-hidroksil bereaksi dengan pereaksi Folin-Ciocalteu, membentuk kompleks fosfotungstat-fosfomolibdat berwarna biru.
Warna biru yang terbentuk akan semakin pekat setara dengan konsentrasi ion fenolat yang terbentuk, artinya semakin besar konsentrasi senyawa fenolik maka semakin banyak ion fenolat yang akan mereduksi asam heteropoli sehingga warna biru yang dihasilkan semakin pekat (Singleton and Rossi, 1965). Intensitas warna
biru yang terbentuk proporsional dengan jumlah senyawa yang dapat mereduksi dan dapat dideteksi dengan spektrofotometer dengan rentang panjang gelombang 500-700 nm (Abdul-Fadl, 1949).
F. Ekstraksi
Ekstrak adalah sediaan pekat yang diperoleh dengan cara mengekstraksi zat aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai, selanjutnya pelarut diuapkan sampai semua pelarut menguap (Dirjen POM, 1995). Maserasi merupakan cara penyarian yang sederhana. Maserasi dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari sehingga cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif di dalam sel dengan yang di luar sel mengakibatkan pendesakan larutan terpekat dari dalam sel ke luar sel. Peristiwa tersebut berulang sehingga terjadi keseimbangan konsentrasi antara larutan di luar sel dan di dalam sel. Dapat dilakukan modifikasi terhadap teknik maserasi, misalnya teknik remaserasi. Pada teknik ini, cairan dibagi menjadi dua kemudian seluruh serbuk simplisia dimaserasi dengan cairan penyari pertama, sesudah dienaptuangkan dan diperas, ampas dimaserasi lagi dengan cairan penyari kedua (Dirjen POM, 1986).
Pengekstraksian kembali larutan dalam air dengan pelarut organik yang tidak bercampur dengan air tetapi agak polar sering kali bermanfaat untuk memisahkan golongan ini dari senyawa yang lebih polar seperti karbohidrat. Etil asetat merupakan pelarut yang baik untuk ini (Robinson, 1995).
G. Spektrofotometri Visibel
Spektrofotometri visibel adalah salah satu teknik analisis fisika-kimia yang mengamati tentang interaksi atom atau molekul dengan radiasi elektromagnetik pada panjang gelombang 380-780 nm (Mulja dan Suharman, 1995). Interaksi antara senyawa yang mempunyai gugus kromofor dengan radiasi elektromagnetik pada daerah UV-Vis (200-800 nm) akan menghasilkan transisi elektromagnetik dan spektra absorbansi elektromagnetik. Jumlah radiasi elektromagnetik yang diserap akan sebanding dengan jumlah molekul penyerapnya, sehingga spektra absorbansi dapat digunakan untuk analisis kuantitatif (Fessenden dan Fessenden, 1995).
Bila suatu molekul senyawa organik menyerap sinar UV atau tampak maka di dalam molekul tersebut terjadi perpindahan (transisi elektron) dari berbagai jenis tingkat energi orbital dari molekul tersebut (Sastrohamidjojo, 2001). Absorbsi cahaya oleh suatu molekul merupakan suatu bentuk interaksi antara gelombang cahaya (foton) dan atom atau molekul. Proses absorbsi cahaya UV-Vis berkaitan dengan promosi elektron dari satu orbital molekul dengan tingkat energi elektronik tertentu ke orbital lain dengan tingkat energi elektronik yang lebih tinggi.
Secara umum, ada tiga macam distribusi elektron dalam suatu senyawa organik, yaitu orbital pi (π), sigma (σ) dan elektron tidak berpasangan (n). Apabila radiasi elektromagnetik mengenai molekul, maka akan terjadi eksitasi elektron ke tingkat energi yang lebih tinggi yang dikenal sebagai orbital elektron antibonding (Mulja dan Suharman, 1995).
H. Validasi Metode Analisis
Validasi metode analisis adalah suatu tindakan penilaian terhadap parameter tertentu, berdasarkan percobaan laboratorium, untuk membuktikan bahwa parameter tersebut memenuhi persyaratan dalam penggunaannya (Harmita, 2004). Parameter-parameter yang digunakan untuk validasi diantaranya adalah sebagai berikut:
1. Presisi
Presisi atau keseksamaan adalah ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual, diukur melalui penyebaran hasil individual dari rata–rata jika prosedur diterapkan secara berulang pada sampel–sampel yang diambil dari campuran yang homogen. Presisi biasanya dinyatakan dalam koefisien variasi (KV) (Harmita, 2004).
Tabel II. Kriteria Nilai Presisi yang Masih dapat Diterima Menurut APVMA (2004)
Kadar zat aktif (%)
Nilai KV yang masih dapat diterima (%) > 10 < 2 1-10 < 5 0,1-1 < 10 <0,1 < 20 2. Linieritas
Linieritas merupakan kemampuan suatu metode (pada rentang tertentu) untuk mendapatkan hasil uji yang secara langsung proporsional dengan konsentrasi (jumlah) analit di dalam sampel (Harmita, 2004).
3. Spesifisitas
Spesifisitas suatu metode adalah kemampuannya yang hanya mengukur zat tertentu saja secara cermat dan seksama dengan adanya komponen lain yang mungkin ada dalam matriks sampel. Selektivitas metode ditentukan dengan membandingkan hasil analisis sampel yang mengandung cemaran, hasil urai, senyawa sejenis, senyawa asing lainnya atau pembawa placebo dengan hasil analisis sampel tanpa penambahan bahan-bahan tadi. Penyimpangan hasil merupakan selisih dari hasil uji keduanya (Harmita, 2004).
I. Landasan Teori
Buah anggur terkenal dengan kandungan fenoliknya yang berkhasiat sebagai antioksidan alami yang berasal dari tanaman. Antioksidan berguna untuk menangkal radikal bebas dengan mekanisme, senyawa antioksidan terdapat kelebihan pasangan elektron bebas yang dapat disumbangkan untuk menetralkan radikal bebas sehingga menjadi tidak reaktif. Antioksidan alami lebih aman digunakan dibandingkan antioksidan sintesis.
Metode pengujian antioksidan yang umum digunakan terutama untuk senyawa dari bahan alam adalah metode DPPH. Metode ini menggunakan sumber radikal bebas berupa senyawa 1,1-difenil-2-pikrilhidrazil (DPPH). Metode ini memiliki kelebihan yaitu mudah, cepat, dan sensitif untuk pengujian aktivitas antioksidan senyawa tertentu atau ekstrak tanaman. Etanol digunakan untuk ekstraksi karena merupakan pelarut universal dan digunakan pelarut etil asetat untuk fraksinasi karena akan diambil senyawa golongan aglikon yang bersifat non-polar.
Kandungan fenolik total dapat ditentukan dengan metode Folin-Ciocalteu. Adanya senyawa fenolik dalam sampel uji akan mereduksi reagen fosfomolibdat-fosfotungstat menjadi produk berwarna biru. Intensitas warna biru yang dihasilkan sebanding dengan kandungan fenolik yang terdapat dalam sampel.
J. Hipotesis
Fraksi etil asetat ekstrak etanol buah anggur Bali (Vitis vinifera L.) mempunyai aktivitas antioksidan yang dinyatakan dalam IC50 dan memiliki
21 BAB III
METODE PENELITIAN A. Jenis dan Rancangan penelitian
Penelitian ini termasuk jenis penelitian eksperimental murni karena diberikan perlakuan terhadap subyek uji.
B. Variabel penelitian
1. Variabel bebas (independent) dalam penelitian ini adalah konsentrasi fraksi etil asetat ekstrak etanol buah anggur.
2. Variabel tergantung (dependent) dalam penelitian ini adalah aktivitas antioksidan dan kandungan fenolik total fraksi etil asetat ekstrak etanol buah anggur.
3. Variabel pengganggu (confounding) dalam penelitian ini terdiri dari dua macam, yaitu:
a. Variabel terkendali : tempat tumbuh tanaman, waktu pemanenan, umur tanaman, dan cara panen.
b. Variabel tak terkendali : cahaya matahari, cuaca, kelembaban, curah hujan.
C. Definisi Operasional
1. Buah anggur diperoleh dari daerah Buleleng, Bali. Pengumpulan dilakukan pada musim kemarau bulan Agustus 2012. Pemanenan dilakukan pada tanaman yang berbuah matang saat pagi hari.
2. Ekstrak etanol buah anggur adalah sari hasil proses maserasi buah anggur dengan penyari etanol.
3. Fraksi etil asetat adalah hasil fraksinasi ekstrak etanol buah anggur dengan menggunakan pelarut etil asetat.
4. Persen inhibition concentration (%IC) adalah persen yang menyatakan kemampuan fraksi etil asetat ekstrak etanol buah anggur untuk menangkap radikal DPPH.
5. Nilai inhibition concentration 50 (IC50) adalah nilai konsentrasi fraksi etil asetat
ekstrak etanol buah anggur yang menghasilkan penangkapan 50% radikal DPPH.
D. Bahan dan Alat Penelitian 1. Bahan penelitian
Bahan yang digunakan dalam penelitian ini adalah: buah anggur Bali (Vitis vinifera L.) yang berasal dari daerah Buleleng Bali, akuades (Laboratorium Kimia Analisis Instrumental Fakultas Farmasi Universitas Sanata Dharma); bahan kualitas p.a. E. Merck, yaitu: metanol, bahan kualitas p.a. Sigma Chem. Co., USA, yaitu: DPPH, reagen Folin-Ciocalteu, asam galat, dan kuersetin kualitas Sigma Chem. Co., USA; bahan kualitas teknis Brataco Chemica, yaitu: etil asetat; bahan kualitas teknis CV. General Labora, yaitu: metanol; dan aluminium foil.
2. Alat penelitian
Alat yang digunakan dalam penelitian ini adalah: neraca analitik (Scaltec SBC 22, BP 160P), vacuum rotary evaporator (Junke & Kunkel), waterbath
(labo-tech, Heraeus), vortex (Janke & Kunkel), spektrofotometer UV-Vis (Perkin Elmer Lamda 20), blender, corong Buchner, oven, mikropipet 10-1000μL; 1-10 mL (Acura 825, Socorex), tabung reaksi bertutup, dan alat-alat gelas yang lazim digunakan di laboratorium analisis (Pyrex-Germany dan Iwaki).
E. Tata Cara Penelitian 1. Determinasi tanaman
Determinasi buah anggur Bali (Vitis vinifera L.) dilakukan di Laboratorium Farmakognosi-Fitokimia, Fakultas Farmasi Universitas Sanata Dharma menurut pustaka Backer & Bahhuizen van den Brink (1965).
2. Pengumpulan bahan
Buah anggur diperoleh dari daerah Kecamatan Buleleng Bali, dikumpulkan pada musim kemarau bulan Agustus 2012. Buah yang diambil adalah buah yang sudah matang dan diambil saat pagi hari. Buah anggur yang akan diteliti di laboratorium farmasi USD Yogyakarta di simpan didalam lemari pendingin, lalu pada hari ketiga dilakukan preparasi.
3. Preparasi sampel
Buah anggur Bali dipilih yang matang, seragam warna hitam keunguan kemudian dicuci dengan akuades. Buah lalu dibersihkan dan dipisahkan dari ranting-rantingnya, kemudian dipotong-potong, ditiriskan, ditimbang sebanyak 150 g. Selanjutnya buah dihaluskan dengan menggunakan blender. Setelah dihaluskan, simplisia tersebut dimasukan ke dalam erlenmeyer 500 ml dan
ditambahkan larutan 300 ml etanol 96% sampai seluruh sampel terendam. Pelarut dilebihkan setinggi kurang lebih 2 cm di atas permukaan simplisia, ditutup dan dibiarkan selama 3 kali 24 jam. Selama proses perendaman, dilakukan proses maserasi agar senyawa yang terkandung di dalam buah anggur (Vitis vinifera L.) dapat larut.
Maserat disaring dengan menggunakan kertas saring. Filtrat diperoleh melalui penyaringan dengan corong Buchner, kemudian ampas dimaserasi kembali dengan etanol selama 3 kali 24 jam, sehingga filtrat hampir tidak berwarna (lebih kurang tiga kali perlakuan). Semua filtrat disatukan dan dipekatkan dengan menggunakan vacuum rotary evaporator sampai tidak ada lagi cairan yang menetes sehingga diperoleh ekstrak etanol buah anggur. Ekstrak kental buah anggur ditambahkan 100 ml air hangat dan diekstraksi cair-cair menggunakan etil asetat dengan perbandingan larutan fraksi air - etil asetat (1:3 v/v) sehingga didapatkan fraksi air dan etil asetat. Setelah dipisahkan, pelarut dari fraksi etil asetat diuapkan menggunakan vacuum rotary evaporator. Hasil fraksi tersebut kemudian ditutup dengan plastik serta aluminium foil lalu disimpan di dalam desikator. Hasil fraksi yang didapatkan digunakan untuk dianalisis lebih lanjut.
4. Pembuatan larutan pembanding dan larutan uji
a. Pembuatan larutan DPPH. 15,8 mg DPPH (BM: 394,33) dilarutkan ke dalam 100 mL metanol p.a sehingga diperoleh larutan DPPH dengan konsentrasi
0,4 mM. Larutan tersebut ditutup dengan alumunium foil dan harus selalu dibuat baru.
b. Pembuatan larutan stok kuersetin. Sebanyak 2,5 mg kuersetin dilarutkan dengan metanol p.a sampai 10,0 mL.
c. Pembuatan larutan pembanding. Diambil sebanyak 0,2; 0,3; 0,4; 0,5; 0,6 mL larutan stok kuersetin, kemudian ditambahkan metanol p.a sampai 10,0 mL, sehingga diperoleh konsentrasi larutan standar kuersetin sebesar 5; 7,5; 10; 12,5; dan 15 μg/mL.
d. Pembuatan larutan uji
1. Larutan uji untuk aktivitas antioksidan
Sebanyak 12,5 mg hasil fraksi etil asetat ditimbang, lalu di tambahkan metanol p.a sampai 25,0 mL. Diambil sebanyak 1; 2; 3; 4; 5 mL larutan tersebut, kemudian ditambahkan metanol p.a sampai 10,0 mL, sehingga diperoleh konsentrasi larutan uji sebesar 10; 20; 30; 40; 50 μg/mL.
2. Larutan uji untuk penentuan kandungan fenolik total
Sebanyak 3 mg hasil fraksi etil asetat ditimbang, lalu ditambahkan 10 mL metanol p.a dan diperoleh konsentrasi larutan uji sebesar 300,0 µg/mL. e. Pembuatan larutan asam galat. Dibuat larutan asam galat dengan konsetrasi 500 µg/mL dalam akuades : methanol p.a (1:1). Diambil sebanyak 1,0; 1,5; 2,0; 2,5; dan 3,0 mL larutan tersebut, kemudian ditambahkan akuades : metanol p.a (1:1) sampai 10,0 mL, sehingga diperoleh konsentrasi larutan baku asam galat sebesar 50; 75; 100; 125; dan 150 µg/mL.
5. Uji pendahuluan
a. Uji fenolik. Sejumlah 0,5 mL larutan uji 500,0 µg/mL dan larutan pembanding asam galat 150,0 µg/mL dimasukan ke dalam tiga tabung reaksi. Lalu ditambahkan 5 mL pereaksi fenol Folin-Ciocalteu yang telah diencerkan dengan akuades (1:10 v/v) kedalam tabung reaksi. Diamkan selama 10 menit. Tambahkan 4 mL larutan natrium karbonat 1 M. Kemudian amati warna larutan tersebut.
b. Uji pendahuluan aktivitas antioksidan. Sebanyak 1 mL larutan DPPH dimasukkan ke dalam masing tiga tabung reaksi. Ditambahkan masing-masing dengan 1 mL metanol p.a, larutan pembanding kuersetin 37,5 μg/mL, dan larutan fraksi etil asetat sampel 500,0 μg/mL. Selanjutnya, larutan tersebut ditambahkan dengan 3 mL metanol p.a. Larutan tersebut kemudian divortex selama 30 detik. Setelah 30 menit, amati warna pada larutan tersebut.
6. Optimasi metode uji aktivitas antioksidan
a. Penentuan operating time (OT). Sebanyak 2 mL larutan DPPH dimasukan ke dalam masing-masing 3 labu ukur 10 mL, ditambahkan masing-masing dengan 2 mL larutan pembanding kuersetin 5; 10; dan 15 μg/mL. Selanjutnya, larutan tersebut ditambahkan dengan metanol p.a hingga tanda batas. Larutan tersebut kemudian divortex selama 30 detik. Setelah itu dibaca absorbansinya dengan spektrofotometer visibel pada panjang gelombang 517 nm selama 1 jam. Dilakukan demikian juga untuk larutan uji 10; 30; 50 μg/mL.
b. Penentuan panjang gelombang serapan maksimum. Pada 3 labu ukur 10 mL, dimasukkan masing-masing 0,5; 1,0; 1,5 mL larutan DPPH. Ditambahkan
larutan tersebut dengan metanol p.a hingga tanda batas sehingga konsentrasi DPPH menjadi 0,020; 0,040; dan 0,080. Larutan tersebut kemudian divortex selama 30 detik. Diamkan selama OT. Lalu dilakukan scanning panjang gelombang serapan maksimum dengan spektrofotometer visibel pada panjang gelombang 400-600 nm.
7. Uji aktivitas antioksidan
a. Pengukuran absorbansi larutan DPPH (kontrol). Pada labu ukur 10 mL dimasukan sebanyak 2 mL larutan DPPH, lalu ditambahkan larutan tersebut dengan metanol p.a hingga tanda batas. Larutan tersebut kemudian dibaca absorbansinya pada saat OT dan panjang gelombang maksimum. Pengerjaan dilakukan sebanyak 3 kali. Larutan ini digunakan sebagai kontrol untuk menguji larutan pembanding dan uji.
b. Pengukuran absorbansi larutan pembanding dan uji. Sebanyak 1 mL larutan DPPH dimasukkan ke dalam tabung reaksi bertutup kemudian ditambah dengan 1 mL larutan pembanding dan uji pada berbagai seri konsentrasi yang telah dibuat, selanjutnya ditambah dengan metanol p.a hingga tanda batas. Larutan tersebut kemudian divortex selama 30 detik dan diamkan selama OT. Larutan dibaca absorbansinya dengan spektrofotometer visibel pada panjang gelombang maksimum hasil optimasi. Pengujian dilakukan dengan 3 kali replikasi.
c. Validasi metode uji aktivitas antioksidan. Hasil dari prosedur 7a dan b, divalidasi presisi (% CV) spesifisitas (spektra kontrol), dan linearitas (nilai r).
% CV = 𝑆𝑡𝑎𝑛𝑑𝑎𝑟 𝐷𝑒𝑣𝑖𝑎𝑠𝑖 𝑆𝐷 𝑘𝑜𝑛𝑠𝑒𝑡𝑟𝑎𝑠𝑖 𝑡𝑒𝑟𝑢𝑘𝑢𝑟
𝑟𝑎𝑡𝑎 −𝑟𝑎𝑡𝑎 𝑘𝑜𝑛𝑠𝑒𝑛𝑡𝑟𝑎𝑠𝑖 𝑡𝑒𝑟𝑢𝑘𝑢𝑟 x 100%
d. Estimasi aktivitas antioksidan. Hasil dari prosedur 7a dan b, dihitung nilai %
IC dan IC50 untuk kuersetin dan fraksi etil asetat ekstrak etanol buah anggur.
8. Optimasi metode penetapan kandungan fenolik total
Optimasi metode penetapan kandungan fenolik total ditentukan dengan menggunakan metode spektrofotometri.
a. Penentuan OT. Sebanyak 0,5 mL larutan asam galat 50; 100; dan 150 μg/mL ditambahkan dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan air (1:10 v/v). Larutan selanjutnya ditambahkan dengan 4,0 mL natrium karbonat 1 M. Setelah itu, dibaca absorbansinya dengan spektrofotometer visibel pada panjang gelombang 750 nm selama 30 menit.
b. Penentuan panjang gelombang maksimum. Sebanyak 0,5 mL larutan asam galat 50; 100; dan 150 μg/mL ditambahkan dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan air (1:1 v/v). Larutan selanjutnya ditambahkan dengan 4,0 mL natrium karbonat 1 M. Diamkan selama OT, absorbansinya dibaca pada λ maksimum dengan spektrofotometer visibel pada panjang gelombang 600-800 nm.
9. Penetapan kandungan fenolik total
a. Pembuatan kurva baku asam galat. Sebanyak 0,5 mL larutan asam galat 50; 75; 100; 125; dan 150 μg/mL ditambah dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan air (1:1 v/v). Larutan selanjutnya ditambah dengan 4,0 mL natrium karbonat 1M. Setelah OT, absorbansinya dibaca pada λ maksimum terhadap
blanko yang terdiri atas akuades : metanol p.a (1:1), reagen Folin-Ciocalteu dan larutan natrium karbonat 1 M. Pengerjaan dilakukan tiga kali.
b. Validasi metode penetapan kandungan fenolik total
Hasil dari prosedur 9a, divalidasi presisi (% CV), spesifisitas (spektra kontrol), dan linearitas (nilai r).
% CV = 𝑆𝑡𝑎𝑛𝑑𝑎𝑟 𝐷𝑒𝑣𝑖𝑎𝑠𝑖 𝑆𝐷 𝑘𝑜𝑛𝑠𝑒𝑡𝑟𝑎𝑠𝑖 𝑡𝑒𝑟𝑢𝑘𝑢𝑟
𝑟𝑎𝑡𝑎 −𝑟𝑎𝑡𝑎 𝑘𝑜𝑛𝑠𝑒𝑛𝑡𝑟𝑎𝑠𝑖 𝑡𝑒𝑟𝑢𝑘𝑢𝑟 x 100%
c. Estimasi kandungan fenolik total larutan uji. Diambil 0,5 mL larutan uji 300 μg/mL, lalu masing-masing dimasukkan ke dalam labu takar 10,0 mL dan dilanjutkan sebagaimana perlakuan pada pembuatan kurva baku asam galat. Kandungan fenolik total dinyatakan sebagai gram ekivalen asam galat (mg ekivalen asam galat per g fraksi etil asetat). Lakukan 3 kali replikasi.
F. Analisis Hasil
Aktivitas penangkapan radikal DPPH (%) dihitung dengan rumus : Absorbansi larutan kontrol − Absorbansi larutan uji
Absorbansi larutan kontrol X 100%
Data aktivitas tersebut dianalisis dan dihitung nilai IC50 mengunakan persamaan
regresi linear dengan sumbu x adalah konsentrasi larutan uji maupun pembanding, sedangkan sumbu y adalah % IC. Data yang didapat dianalisis secara statistik untuk menentukan ada atau tidak adanya perbedaan bermakna antara IC50 larutan pembanding dan larutan uji. Uji kandungan fenolik total
menghasilkan nilai mg ekivalen asam galat dalam per g fraksi etil asetat. Nilai tersebut didapatkan dari analisis regresi linier dengan data kurva baku secara intrapolasi.
31 BAB IV
HASIL DAN PEMBAHASAN A. Hasil Determinasi Tanaman
Determinasi merupakan syarat pertama dan langkah awal yang dilakukan dalam suatu penelitian dengan menggunakan tanaman. Determinasi tanaman ini bertujuan untuk mengetahui dan memastikan kebenaran identitas tanaman yang akan digunakan dalam penelitian serta untuk menghindari terjadinya kesalahan dalam pengambilan sampel untuk analisis fitokimia. Berdasarkan hasil determinasi tanaman anggur (lampiran 1) yang dilakukan di Laboratorium Farmakognosi-Fitokimia, Fakultas Farmasi Universitas Sanata Dharma pada tanggal 7 Februari 2013, telah dibuktikan bahwa tanaman yang digunakan untuk penelitian adalah Vitis vinifera L.
Menurut balai penelitian tanaman jeruk dan buah subtropika dan SK Menteri Pertanian 361/Kpts/LB.240/6/2004 tanaman anggur yang digunakan ini dikenal dengan nama “anggur Bali”.
B. Hasil Pengumpulan Bahan
Buah anggur diperoleh dari daerah Buleleng, Bali pada bulan Agustus 2012. Pengambilan bahan berasal dari satu tempat, hal ini untuk menghindari variasi kandungan senyawa aktif tanaman. Buah anggur yang digunakan adalah buah yang matang berwarna ungu kehitaman bergerombol dalam satu tangkai. Buah yang diperoleh memiliki diameter antara 1,5-2 cm. Buah anggur dipetik pada pagi hari agar senyawa fenolik yang terdapat pada tanaman belum termetabolisme menjadi bentuk
metabolit sekunder lain. Gambar tanaman dan buah anggur Bali disajikan pada lampiran 2.
C. Hasil Preparasi Sampel
Preparasi sampel ini dilakukan untuk mendapatkan fraksi etil asetat ekstrak etanol buah anggur yang diduga dalam fraksi tersebut mengandung senyawa antioksidan. Sampel yang digunakan merupakan buah anggur segar. Digunakan sampel segar bertujuan untuk menjaga kestabilan senyawa fenolik di dalam tanaman karena senyawa fenolik cenderung mengalami perubahan susunan dengan adanya pengeringan atau pemanasan. Perubahan yang terjadi dapat menurunkan aktivitas antioksidan dari senyawa fenolik (Markham, 1988). Selain itu, digunakan sampel segar bertujuan menjaga stabilitas senyawa fenolik pada tanaman. Menurut Handayani (2011) proses pengeringan dapat memicu terjadinya peristiwa browning dan blackening. Peristiwa tersebut terjadi karena reaksi oksidasi akibat adanya pemanasan yang dikatalis oleh enzim fenol oksidase atau polifenol oksidase sehingga menyebabkan senyawa fenolik berubah menjadi quinon dan kemudian dipolimerasi menjadi pigmen melaniadin. Senyawa fenolik dalam bentuk polimer tersebut tidak memiliki aktivitas antioksidan.
Buah anggur segar dicuci terlebih dahulu untuk menghilangkan pengotor yang terdapat pada permukaan buah. Buah anggur yang sudah dipetik dari tangkainya harus segera diolah untuk menghindari peristiwa pembusukan pada buah. Buah anggur yang telah bersih tidak perlu dipotong kecil-kecil maupun dikupas kulitnya karena digunakan seluruh bagian dari buah, yaitu kulit buah dan biji, Seluruh bagian
dari buah anggur dihaluskan terlebih dahulu untuk memperkecil ukuran pemukaan agar penyari dapat kontak lebih luas dengan simplisia. Lalu dilakukan proses maserasi 150 g buah anggur dengan etanol 96% maserasi ini dilakukan dengan tiga replikasi.
Dipilih metode ekstraksi dengan maserasi karena ekstraksi ini tidak melibatkan pemanasan sehingga perubahan-perubahan senyawa dapat dihindari. Selain itu, proses maserasi sangat menguntungkan untuk isolasi senyawa bahan alam karena selain dengan perendaman ekstrak tumbuhan digunakan juga shaker sebagai alat untuk membantu penggojogan yang dapat meningkatkan kontak antara cairan penyari yang digunakan dengan sampel, sehingga terjadi pemecahan dinding sel dan membran sel akibat perbedaan tekanan antara di dalam dan di luar sel yang mengakibatkan metabolit sekunder yang ada di dalam sitoplasma akan terlarut dalam pelarut organik dan ekstraksi senyawa akan sempurna.
Maserasi dilakukan selama tiga kali 24 jam dalam tabung erlenmeyer 500 mL dengan di beri penutup agar etanol tidak menguap karena sifat etanol mudah menguap pada suhu kamar. Selain itu, juga untuk mencegah masuknya kontaminan dari luar. Tabung erlenmeyer dibungkus dengan alumunium foil agar tidak terkena cahaya matahari atau sinar matahari langsung. Hal ini dikarenakan ada beberapa senyawa dapat bereaksi oleh adanya cahaya dan juga dapat mengalami kerusakan oleh sinar ultraviolet matahari.
Penyaringan dilakukan dengan bantuan pompa vakum karena jumlah bahan banyak, sehingga membutuhkan waktu yang lama jika disaring secara biasa. Ampas
yang diperoleh dari hasil penyaringan diremaserasi dengan etanol selama 1 kali 24 jam kemudian dilakukan penyaringan dengan pompa vakum, filtrat disimpan dan ampas kembali diremaserasi selama satu kali 24 jam dengan penyari etanol. Remaserasi ini bertujuan untuk memaksimalkan proses penyarian agar diperoleh lebih banyak senyawa fenolik. Filtrat yang diperoleh dari hasil penyaringan tersebut diuapkan pelarutnya menggunakan vacuum rotary evaporator (rotavapor) pada suhu 65°C.
Tujuan digunakannya rotavapor agar filtrat etanol yang akan diuapkan pelarutnya tidak mengalami kontak dengan panas yang berlebihan dengan demikian, kerusakan senyawa-senyawa kimia yang terkadung dalam filtrat etanol dapat dihindari. Rotavapor menggunakan prinsip penguapan dengan pengurangan tekanan. Suatu cairan akan mendidih jika tekanan uap cairan sama dengan tekanan atmosfir di sekelilingnya. Oleh karena itu, adanya pengurangan tekanan pada alat di bawah tekanan atmosfir dapat menyebabkan etanol mendidih di bawah titik didih normalnya (Depkes RI, 1986). Pada penguapan tersebut hampir semua etanol teruapkan. Sisa etanol dan air yang tertinggal dalam ekstrak kemudian diuapkan dengan waterbath untuk mempercepat penguapan. Hasil penguapan ini selanjutnya disebut ekstrak etanol buah anggur. Hasil ektsrak etanol buah anggur yang diperoleh dari proses maserasi adalah sebesar 45,10 g sehingga diperoleh rendemen ekstrak etanol sebesar 10,022%.
Etanol merupakan salah satu pelarut universal yang dapat menyari banyak senyawa kimia seperti klorofil, minyak, vitamin dan mineral. Oleh sebab itu, dalam
penelitian ini dilakukan fraksinasi yang bertujuan untuk memisahkan senyawa-senyawa didalam ekstrak sehingga yang didapat adalah senyawa-senyawa-senyawa-senyawa yang dituju yaitu senyawa fenolik. Dalam melakukan fraksinasi, pada penelitian ini digunakan prinsip ektraksi cair-cair di mana merupakan teknik ekstraksi yang menggunakan dua pelarut yang tidak tercampurkan yang menimbulkan perpindahan senyawa terlarut dari satu pelarut ke pelarut kedua. Setelah didapatkan ekstrak kental etanol buah anggur, ekstrak dilarutkan dengan air hangat sebanyak 150 mL. Digunakan air hangat agar lebih mudah melarutkan ekstrak. Ekstrak dipartisi dengan etil asetat di dalam corong pisah dengan perbandingan air dan etil asetat 1 : 3. Fraksi etil asetat akan berada di atas sedangkan fraksi air berada di bawah. Hal ini dikarenakan berat jenis etil asetat (0,898) lebih kecil dibandingkan berat jenis air (0,996).
Fraksi air dibuang sedangkan fraksi etil asetat akan dianalisis. Fraksinasi juga dilakukan secara berulang sebanyak tiga kali karena menurut Gandjar dan Rohman (2007) ekstraksi berulang dengan volume yang sama akan lebih efektif dibanding melakukan ekstraksi tunggal dengan volume yang besar. Oleh karena itu, fraksinasi dilakukan sebanyak tiga kali dengan 150 mL etil asetat. Bentuk glikosida senyawa fenolik bersifat polar, sedangkan bentuk aglikonnya bersifat cenderung non polar, sehingga tidak menutup kemungkinan adanya senyawa tersebut larut dalam air maupun etil asetat (Bruneton, 1999).
Fraksi kemudian diuapkan menggunakan vacuum rotary evaporator untuk meminimalkan pemaparan pemanasan supaya stabilitas senyawa fenolik tetap terjaga. Sisa fraksi etil asetat kemudian dimasukkan kedalam oven dengan suhu 40 oC selama
24 jam untuk menguapkan sisa pelarut sehingga didapatkan ekstrak kental. Fraksi kental etil asetat dalam cawan petri kemudian dibungkus dengan plastik dan ditutup dengan alumunium foil supaya tidak terkena udara dan tidak terpapar sinar UV yang dapat mendegradasi senyawa fenolik yang ada didalam fraksi etil asetat. Fraksi etil asetat yang sudah dibungkus dimasukan kedalam desikator agar tidak terpapar lembab dan ditumbuhi jamur atau mikroba. Bobot fraksi etil asetat yang didapat sebesar 0,7299g dan rendemen fraksi etil asetat yang didapat adalah 0,162 %.
D. Hasil Uji Pendahuluan 1. Uji pendahuluan aktivitas antioksidan
Tujuan uji ini adalah untuk mengetahui secara kualitatif aktivitas antioksidan dari fraksi etil asetat ekstrak etanol buah anggur. Uji ini menggunakan reaksi antara senyawa uji dan DPPH. Molekul radikal DPPH akan bereaksi dengan atom hidrogen yang dilepaskan oleh senyawa uji sehingga senyawa DPPH mengalami pengurangan intensitas warna ungu atau berubah menjadi kuning sampai jernih (Prior, Wu, X., and Schaich K., 2005). Sejumlah larutan kuersetin dan fraksi etil asetat ekstrak etanol buah anggur dicampurkan ke dalam larutan DPPH pada sebuah tabung reaksi hasil positif ditunjukkan dengan berubahnya warna larutan uji menjadi kuning. Hal ini menunjukkan potensi fraksi etil asetat ekstrak etanol buah anggur dalam menangkap radikal DPPH.
Gambar 5. Hasil uji pendahuluan aktivitas antioksidan (A = kontrol positif [kuersetin], B = kontrol negatif [blanko DPPH], C = larutan uji [fraksi etil asetat
ekstrak etanol buah anggur Bali] + DPPH)
2. Uji pendahuluan fenolik
Tujuan dari uji ini adalah untuk mengetahui secara kualitatif kandungan senyawa fenolik dalam fraksi etil asetat ekstrak etanol buah anggur. Prinsip uji ini adalah reaksi oksidasi reduksi dari ion fenolik senyawa uji dengan pereaksi fenol Folin-Ciocalteu. Dengan adanya natrium karbonat yang bersifat basa akan mengubah senyawa fenolik dari senyawa uji menjadi ion fenolik. Ion fenolik dapat mereduksi reagen fenol Folin-Ciocalteu sehingga menyebabkan terbentuknya senyawa berwarna biru (Abdul-Fadl,1949). Pengujian menunjukan hasil positif dengan terbentuknya warna biru pada larutan uji (gambar 6). Hal ini menunjukkan bahwa fraksi etil asetat ekstrak etanol buah anggur mengandung senyawa fenolik.
Gambar 6. Hasil uji pendahuluan fenolik (A = kontrol negatif [blanko reagen fenol Folin-Ciocalteu], B = larutan uji [fraksi etil asetat ekstrak etanol buah anggur Bali] + reagen fenol Ciocalteu, C = kontrol positif [asam galat] + reagen fenol
Folin-Ciocalteu)
E. Hasil Optimasi Metode Uji Aktivitas Antioksidan
Pengujian aktivitas penangkapan radikal bebas dari fraksi etil asetat ekstrak etanol buah anggur menggunakan metode DPPH dengan pertimbangan dalam sampel terdapat senyawa yang mempunyai kemampuan menangkap radikal DPPH. Pertimbangan yang lain adalah karena metode ini mudah digunakan, mempunyai tingkat sensitifitas yang tinggi, dan dapat menganalisis sejumlah besar sampel dalam jangka waktu yang singkat (Kim, et al., 2002).
Berkurangnya intensitas warna ungu dari larutan DPPH menunjukkan potensi aktivitas antioksidan dari senyawa uji. Secara kuantitatif dapat dihitung dengan berkurangnya absorbansi larutan tersebut. Mekanisme reaksi antara senyawa uji dan DPPH yaitu molekul radikal bebas DPPH akan bereaksi dengan atom hidrogen yang
dilepaskan oleh senyawa uji sehingga senyawa 1,1-difenil-2-pikrilhidrazil mengalami pengurangan intensitas warna ungu atau menjadi warna kuning sampai jernih (Gulcin, Wu, and Schaich,2004).
Pengukuran aktivitas penangkapan radikal bebas DPPH secara spektrofotometri. DPPH mempunyai λ maksimum pada 517 nm (Sunarni, 2005). Oleh karena itu, untuk memastikan bahwa tidak ada gangguan pengukuran pada daerah λ maksimum DPPH tersebut dilakukan scanning λ maksimum pada pelarut metanol, fraksi etil asetat dan kuersetin pada daerah 400-600 nm. Adanya gangguan pengukuran pada daerah λ maksimum DPPH dapat menyebabkan pengukuran absorbansi DPPH menjadi tidak akurat. Dari hasil scanning λ maksimum terhadap pelarut metanol, fraksi etil asetat dan kuersetin tidak menunjukkan adanya gangguan pada daerah λ maksimum DPPH. Hasil scanning λ maksimum pada daerah 400-600 nm dapat dilihat pada lampiran 6.
Sebelum melakukan pengujian aktivitas antioksidan senyawa uji perlu dilakukan proses optimasi metode DPPH terlebih dahulu. Proses optimasi meliputi
scanning λ maksimum DPPH dan penentuan operating time (OT). 1. Penentuan panjang gelombang maksimum
Pengukuran absorbansi larutan uji dilakukan pada λ maksimum karena pada λ maksimum sedikit perubahan konsentrasi akan memberikan perubahan absorbansi yang besar sehingga akan didapatkan kepekaan analisis yang maksimum. Penentuan λ maksimum dilakukan terhadap larutan DPPH pada λ
visibel 400-600 nm. Secara teoritis λ maksimum larutan DPPH adalah 517 nm (Sunarni, 2005).
Gambar 7. Scanning λ maksimum larutan DPPH pada berbagai konsentrasi
DPPH memiliki gugus kromofor dan auksokrom sehingga dapat terukur pada daerah visibel selain itu adanya elektron yang tidak berpasangan pada struktur DPPH menyebabkan larutan DPPH berwarna ungu dan mempunyai serapan yang kuat pada 517 nm. Dari hasil pengukuran diperoleh λ maksimum DPPH, yaitu 515,5 nm.
Tabel III. Hasil Scanning panjang gelombang maksimum DPPH
Konsentrasi larutan DPPH λ maksimum hasil scanning λ maksimum rata-rata λ maksimum teoritis 0,02 mM 515,5 nm 515,5 nm 515-520 nm 0,04 mM 515,5 nm 0,08 mM 515,5 nm
2. Penentuan operating time (OT)
Penentuan OT ini perlu dilakukan untuk memperoleh rentang waktu dimana larutan uji dan kuersetin sudah mereduksi radikal DPPH dengan sempurna sehingga diperoleh nilai absorbansi yang stabil dengan demikian kesalahan analisis dapat diminimalkan. Operating time merupakan waktu dimana reaksi yang terjadi sudah optimal. Pada rentang waktu tersebut senyawa uji dan larutan pembanding berada dalam keadaan reaksi sempurna dengan DPPH yang ditunjukan dengan diperolehnya absorbansi DPPH yang stabil (Mustariche, 2012)
Operating time dihitung mulai dari larutan sampel yaitu fraksi etil asetat ekstrak
etanol buah anggur maupun kuersetin direaksikan dengan DPPH. Penentuan OT dilakukan terhadap larutan sampel pada tigakonsentrasi yaitu rendah, tengah, atas dan kuersetin sebagai larutan pembanding yang direaksikan dengan DPPH dan diukur absorbasinya pada λ maksimum DPPH yaitu 515,5 nm. Pengukuran absorbansi dilakukan setiap 5 menit selama 60 menit.
Gambar 8. Grafik penentuan OT kuersetin (Replikasi 2)
Gambar 9. Grafik penentuan OT fraksi etil asetat (Replikasi 1)
Berdasarkan hasil yang diperoleh pada gambar 8 dan 9, dari menit ke-5 sampai ke-60 absorbansi larutan uji fraksi etil asetat dan larutan pembanding
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0 10 20 30 40 50 60 70
Penentuan OT Kuersetin
Waktu (menit) Abso rb an si 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0 10 20 30 40 50 60 70 10 µg/mL 30 µg/mL 50 µg/mLPenentuan OT Fraksi Etil Asetat
Waktu (menit)
Abso
rb
an
kuersetin semakin stabil, hal ini menunjukkan bahwa reaksi antara DPPH dengan senyawa antioksidan semakin sempurna. Dari hasil tersebut ditetapkan OT larutan pembanding kuersetin dan larutan uji pada menit ke-30.
F. Hasil Validasi Metode Uji Aktivitas Antioksidan
Validasi metode analisis merupakan ukuran untuk membuktikan bahwa metode yang digunakan memberikan hasil seperti yang diharapkan dengan kecermatan dan ketelitian yang memadai (Mulja dan Hanwar, 2003).
Parameter validasi metode analisis yang dilakukan untuk menguji validitas metode uji aktivitas antioksidan antara lain analisis presisi, linearitas dan spesifitas. Dalam pengujian digunakan tiga replikasi larutan pembanding kuersetin dan larutan uji fraksi etil asetat ekstrak etanol buah anggur sehingga didapatkan tiga persamaan regresi linier antara konsentrasi kuersetin dan larutan uji dengan %IC. Dari ketiga persamaan tersebut dipilih persamaan dengan nilai liniaritas (r) yang paling baik untuk menghitung konsentrasi terukur kuersetin dan juga larutan uji sehingga %CV dapat dihitung. Tabel IV menunjukkan persamaan regresi linier aktivitas antioksidan larutan pembanding kuersetin dan larutan uji fraksi etil asetat ekstrak etanol buah anggur.



![Gambar 5. Hasil uji pendahuluan aktivitas antioksidan (A = kontrol positif [kuersetin], B = kontrol negatif [blanko DPPH], C = larutan uji [fraksi etil asetat](https://thumb-ap.123doks.com/thumbv2/123dok/4256219.3130675/55.918.151.761.163.901/gambar-pendahuluan-aktivitas-antioksidan-kontrol-positif-kuersetin-kontrol.webp)
![Gambar 6. Hasil uji pendahuluan fenolik (A = kontrol negatif [blanko reagen fenol Folin-Ciocalteu], B = larutan uji [fraksi etil asetat ekstrak etanol buah anggur Bali]](https://thumb-ap.123doks.com/thumbv2/123dok/4256219.3130675/56.918.154.761.164.902/gambar-pendahuluan-fenolik-kontrol-negatif-ciocalteu-larutan-ekstrak.webp)