11
II. TINJAUAN PUSTAKA
2.1 Biodiesel
Biodiesel merupakan sejenis bahan bakar diesel yang diproses dari bahan hayati terutama minyak nabati dan lemak hewan dan secara kimiawi dinyatakan sebagai monoalkil ester dari asam lemak rantai panjang yang bersumber dari golongan lipida (Darnoko, et al., 2001; Tapasvi, et al., 2005; Ma dan Hanna, 1999). Biodiesel didefinisikan sebagai monoalkil ester rantai panjang dari asam lemak yang diderivasi dari bahan yang dapat diperbaharui (renewable feedstocks), seperti minyak nabati dan lemak hewan, untuk penggunaan penyundutan kompresi (compression-ignition) dari mesin diesel (Krawczyk, 1996). Biodiesel dianggap sebagai bahan bakar pengganti (alternatif) dari bahan bakar konvensional diesel solar yang tersusun dari metil ester asam lemak (FAME).
Terminologi biodiesel berasal dari persetujuan Department of Energy
(DOE), The Environmental Protection Agency (EPA) dan The American Society of Testing Materials (ASTM) sebagai salah satu energi alternatif untuk mesin diesel
(ASTM, 2002; DOE, 2009; EPA 2009 ). Istilah bio merujuk kepada bahan terbarukan dan bahan hayati yang berbeda dari solar yang berbahan baku minyak bumi. Dalam kenyataannya, biodiesel bisa digunakan murni (100 % metil ester) atau sebagai campuran dengan perbandingan tertentu dengan bahan bakar solar. Dalam istilah perdagangan campuran biodiesel dengan solar dinamakan dengan notasi BXX. Misalnya bila campuran biosolar mengandung 5 % atau 10 % solar maka notasi masing-masing biosolar dinyatakan sebagai B5 dan B10.
Biodiesel merupakan monoalkil ester (misal: fatty acid methyl
ester/FAME) yang diproses dengan metode transesterifikasi antara trigliserida
yang berasal dari minyak nabati atau lemak hewani dengan alkohol rantai pendek terutama metanol untuk digunakan sebagai bahan bakar mesin diesel (Krawczyk, 1996; Mittelbach, and Reshmidt, 2004; Knothe, 2005). Sehubungan dengan proses transesterifikasi ini proses pengolahan banyak diteliti dan dikembangkan untuk mendapatkan proses yang lebih efisien.
12 2.2 Proses Transesterifikasi
Reaksi transesterifikasi memegang peranan penting dalam pengolahan biodiesel dari minyak nabati (trigliserida atau TG). Reaksi transesterifikasi disebut juga reaksi alkoholisis dan proses ini sering dikaitkan dengan proses untuk mengurangi viskositas trigliserida (TG) (Otera, 1993). Reaksi transesterifikasi secara umum dinyatakan sebagi berikut (persamaan 1):
Bila methanol (MeOH) digunakan dalam reaksi di atas maka reaksinya disebut metanolisis dan reaksinya bisa dilihat seperti pada Gambar 4. Untuk menjadikan biodiesel, minyak nabati diproses secara kimia dengan cara transesterifikasi dengan keberadaan alkohol (metanol atau etanol) dan katalis (basa atau asam) untuk menghasilkan alkil ester (biodiesel) dan gliserol sebagai hasil samping. H2C O C O R1 HC O C O R2 H2C O C O R3 3CH3OH MeOH H3C O C O R1 H3C O C O R2 H3C O C O R3 H2C OH HC OH H2C OH TG FAME GL ... [2]
Gambar 4. Reaksi alkoholisis TG dengan MeOH reaksi keseluruhan pers. [2]; tiga reaksi berurutan dan reversibel pers. [3] (R1,2,3 = asam lemak)
Trigliserida (TG) sebagai komponen utama dari minyak nabati bila direaksikan dengan dengan alkohol (misal methanol), maka ketiga rantai asam lemak akan dibebaskan dari skeleton gliserol dan bergabung dengan methanol untuk menghasilkan asam lemak alkil ester (misal asam lemak metil ester atau
TG + CH3OH DG + CH3COOR1
DG + CH3OH MG + CH3COOR2 ……...[3] MG + CH3OH GL + CH3COOR3.
RCOOR1 + R2OH RCOOR2 + R1OH ……….…..…..[1] Ester Alkohol Ester Alkohol
13 FAME). Reaksi transesterifikasi merupakan reaksi tiga tahap dan reaksi balik
(reversible) yang membentuk tiga molar FAME dan satu molar gliserol (GL) dari
satu molar trigliserida (TG) dan tiga molar methanol. Digliserida (DG) dan monogliserida (MG) merupakan hasil reaksi antara (intermediate). Terdapat dua jenis proses transesterifikasi yaitu transesterifikasi dengan katalis dan transesterifikasi tanpa katalis. Katalis diharapkan dapat mempengaruhi laju reaksi dalam memproduksi biodiesel secara katalitik pada skala komersial.
2.2.1 Faktor-Faktor Yang Mempengaruhi Proses Transesterifikasi
Transesterifikasi minyak nabati menjadi biodesel merupakan suatu proses bertahap dan reversible. Proses ini dipengaruhi oleh beberapa parameter antara lain: 1) Homogenisasi reaksi (keseragaman pencampuran), 2) molar rasio antara methanol and minyak nabati, 3) suhu reaksi, 4) tekanan dalam reaksi, 5) waktu reaksi, dan 6) jenis katalis (Mettelbach dan Reshmidt, 2004).
2.2.1.1 Homogenisasi Reaksi (Pencampuran)
Homogenisasi campuran dalam reaksi merupakan salah satu parameter penting yang mempengaruhi efektifitas reaksi karena dari kondisi ini maka reaksi tumbukan akan terjadi yang pada akhirnya akan mempengaruhi laju reaksi, konstanta reaksi, energi aktivasi dan lama reaksi. Transesterifikasi tidak akan berlangsung baik bila campuran bahan tidak dihomogenisasi terutama selama tahap awal proses. Pengadukan yang kuat (vigorous stirring) merupakan salah satu metode homogenisasi yang cukup berhasil untuk proses yang dilakukan secara batch dan kontinyu (darnoko dan Cheryan, 2000)..
2.2.1.2 Rasio Molar
Rasio molar antara methanol dan minyak nabati tergantung dari jenis katalis yang digunakan. Untuk menjamin reaksi transesterifikasi berlangsung ke arah kanan maka direkomendasikan menggunakan katalis berlebih. Menurut Freedman et al.,(1986), perbandingan rasio molar 6 : 1 dari methanol terhadap katalis basa bisa digunakan untuk mendapat rendemen ester yang maksimum. Rasio molar yang digunakan biasanya tidak melebihi perbandingan ini, dan bila
14 jumlah alkohol terlalu berlebih maka akan berakibat menganggu pemisahan gliserol (Srivasta dan Prasad, 2000). Rasio molar untuk proses transesterifikasi dengan katalis asam perbandingannya direkomendasikan bisa mencapai 30 : 1 (Mittelbach dan Reshmidt, 2004).
2.2.1.3 Suhu Reaksi
Transesterifikasi dapat dilakukan pada berbagai tingkatan suhu tergantung dari jenis minyak nabati yang digunakan. Dalam proses metanolisis kastor oil menjadi metil risinoleat, reaksi akan berlangsung memuaskan bila dioperasikan pada suhu 20 – 35oC dengan rasio molar 6 :1 and 12 : 1 menggunakan NaOH sebagai katalis (Fredman et al., 1984). Untuk transesterifikasi minyak kedelai dengan metanol molar ratio yang digunakan adalah 6 : 1 dengan 1 % NaOH, untuk berbagai suhu transesterifikasi (Fredman et al., 1986). Setelah satu jam proses ester yang terbentuk adalah 94,87 % dan 64 % untuk suhu 45 dan 32 oC. Suhu reaksi mempengaruhi laju reaksi dan ester yang terbentuk. Yamazaki et al., (2007) menjelaskan flowrate produksi FAME meningkat dari 0,1 g/menit mulai pada suhu 250 oC menjadi 1,0 g/menit pada suhu 330 oC.
2.2.1.4 Waktu Reaksi
Laju produksi metil ester sangat dipengaruhi oleh waktu reaksi transesterifikasi. Fredman et al. (1984) melaporkan bahwa transesterifikasi minyak kacang, cotton seed, minyak bunga matahari, dan kedelai dengan rasio molar metanol terhadap minyak 6 : 1 dengan katalis sodium methoxide pada suhu 60oC. Hasil pengamatan menunjukkan setelah 1 menit diperoleh hasil metil ester 80 % dan mencapai maksimum setelah waktu reaksi 1 jam dengan hasil metil ester 93 -98 % (Fredman et al., 1986). Ma dan Hanna (1999) juga melaporkan bahwa pengaruh waktu reaksi dalam proses transesterifikasi lemak hewan dengan hasil metil ester 1 – 38 %. Laju produksi metil ester mencapai maksimum setelah waktu berjalan 15 menit (Fredman et al., 1984). Yuswono et al. (2008) mengolah minyak minyak CPO dengan rasio molar metanol terhadap minyak 6 : 1 (katalis NaOH) dengan hasil metil ester 97 – 99 % dalam waktu 1 jam dengan
15 penghitungan waktu reaksi dimulai saat suhu bahan secara keseluruhan telah mencapai 70 oC
2.2.1.5 Tekanan Reaksi
Metil ester dapat direaksikan dalam kondisi tekanan rendah dan tinggi. Secara komersil produksi biodiesel dari minyak nabati dilangsungkan pada tekanan rendah guna mengurangi biaya pengolahan dan keamanan dan umumnya dilakukan pada tekanan atmosfir. Proses produksi biodiesel dengan tekanan tinggi dapat dilangsungkan di atas tekanan 100 bar pada suhu 250 oC dengan kelipatan 7 hingga 8 molar ekses dalam keberadaan katalis basa (Gerpen dan Knothe, 2005). Tekanan reaksi yang tinggi ini juga bisa dilakukan pada transesterifikasi tanpa katalis yang dilakukan pada tekanan 8,09 MPa dan suhu optimal 350 oC (Kusdiana dan Saka, 2000). Keuntungan penggunaan tekanan tinggi dalam proses transesterifikasi adalah bahan baku yang mengandung lebih 20 % FFA dapat diolah tanpa perlakuan pendahuluan serta dapat menghasilkan gliserol kandungan tinggi dapat dihasilkan sebagai hasil samping (Kusdiana dan Saka, 2000 Kusdiana dan Saka, 2000). Pendekatan yang diusulkan Mittelbach dan Junek (1986) yaitu penggunaan tekanan rendah merupakan rekomendasi yang sudah banyak diterapkan dan berhasil dilakukan dalam mengolah biodiesel.
2.2.1.6 Jenis Katalis
Untuk mencapai hasil atau rendemen yang maksimum, transesterifikasi biasanya dilangsungkan dengan keberadaan katalis baik katalis basa (alkali) ataupun asam. Katalis basa yang sering digunakan adalah NaOH dan KOH. Katalis NaOH sering digunakan karena lebih reaktif dan murah. Katalis dari kompon logam, silikat, dan enzim atau biokatalis seperti enzim lipase bisa juga digunakan dalam sintesis biodiesel. Jumlah optimum alkali basa yang baik digunakan berkisar anatar 0,5-1,0 % dari berat minyak nabati (Fredman et al., 1984). Katalis asam bisa juga digunakan untuk proses produksi biodiesel. Transesterifikasi dengan katalis asam lebih lambat dari katalis basa. Katalis asam cocok untuk proses trigliserida dengan kandungan asam lemak dan kandungan air
16 yang tinggi (Aksoy et al., 1988). Contoh katalis asam yang sering digunakan adalah H2SO4 (disajikan lebih lanjut dalam sub Bab 2.2.2).
2.2.2 Penggunaan Katalis
Katalis dalam proses produksi biofuel (misal esterifikasi atau transesterifikasi) merupakan suatu bahan (misal basa, asam atau enzim) yang berfungsi untuk mempercepat reaksi dengan jalan menurunkan energi aktivasi
(actifation energy, Ea) dan tidak mengubah kesetimbangan reaksi, serta bersifat
sangat spesifik. Sebenarnya proses produksi bisa berlangsung tanpa katalis akan tetapi reaksi akan berlangsung sangat lambat, membutuhkan suhu yang tinggi dan tekanan yang tinggi pula. Umumnya untuk mencapai hasil (yields) ester yang memuaskan dalam kondisi reaksi yang sedang, produksi biodiesel dilakukan dengan keberadaan katalis yang meliputi katalis basa (alkali), asam termasuk katalis bahan transisi logam, dan katalis enzim.
Menurut perbedaan fase dengan reaktan, katalis dapat dibagi menjadi katalis homogen yang memiliki fase yang sama dengan reaktannya dan katalis heterogen yang berbeda fase dengan reaktannya (contohnya, katalis padat pada campuran reaktan cair). Katalis heterogen menyediakan permukaan luas untuk tempat reaksi kimia terjadi. Agar reaksi terjadi, satu atau lebih reaktan harus tersebar pada permukaan katalis dan teradsorb ke dalamnya. Setelah reaksi selesai, produk menjauh dari permukaan katalis padat. Seringkali, perpindahan reaktan dan produk dari satu fase ke fase lainnya ini berperan dalam menurunkan energi aktivasi (Mittelbach dan Remschmidt, 2004).
2.2.2.1 Katalis Basa
Kelebihan (keuntungan) penggunaan katalis basa adalah kondisi operasi
dapat dilakukan dalam kondisi reaksi sedang (mild) seperti tekanan dan suhu rendah (1 atm, suhu 60-65oC ), molar rasio yang rendah (1 % dari jumlah minyak nabati), memberikan waktu reaksi yang relatif cepat (sekitar 1 jam), dan memberikan efek korosi yang rendah terhadap peralatan pengolahan (bisa digunakan jenis bahan logam berkarbon / carbon steel reaktor). Kelemahan
17 penggunaan katalis basa adalah memerlukan pengadukan yang cukup kuat sehingga merata untuk memperoleh hasil yang maksimal. Di samping itu dalam proses purifikasi biodiesel dari katalis dan bahan lainnya memerlukan waktu yang cukup lama seperti dalam proses decanting, netralisasi, washing, dan drying. (Friedman et al., 1984; Friedman et al., 1986; Noureddini and Zhu, 1997; Darnoko dan Cheryan, 2000).
Saat ini hampir seluruh reaksi pengolahan biodiesel skala komersial menggunakan katalis basa homogen. Katalis yang bersifat basa lebih umum digunakan pada reaksi transesterifikasi karena menghasilkan metil ester yang tinggi dan waktu yang cepat. Konsentrasi katalis yang umum digunakan adalah 0.5-4% dari berat minyak (Mittelbach dan Reschmidt, 2004; Zhang et al., 2003,). Namun pemakaian katalis basa hanya berlangsung sempurna bila minyak dalam kondisi netral dan tanpa keberadaan air. Secara garis besar reaksi yang berlangsung disajikan dalam persamaan [4] dan reaksi pembentukan sabun disajikan dalam persamaan [5].
Katalis homogen selama ini telah digunakan secara luas pada produksi biodiesel, karena harganya yang murah. Walaupun begitu, untuk aplikasi industri katalis heterogen yang berwujud padat menawarkan keuntungan dibandingkan katalis homogen, yaitu mudahnya pemisahan katalis dari produk dengan cara penyaringan dan tidak perlu proses netralisasi untuk menghilangkan sisa katalis. Beberapa katalis heterogen pada proses pembuatan biodiesel menggambarkan bahwa katalis yang mengandung campuran unsur Ca dan Mg, serta katalis yang mengandung K menghasilkan rendemen metil ester yang tinggi.
Katalis bersifat basa yang umum digunakan adalah basa Brönsted sederhana seperti NaOH dan KOH. Freedman et al. (1984) membandingkan penggunaan katalis basa NaOH dan NaOCH3 pada saat memproduksi biodiesel
RONa RO- + Na+
Na + ROH RO- + Na+ + ½ H2 (g) NaOH + ROH RO- + Na+ + H
2O
R1COOR2 + NaOH R1COONa + R2OH ………...[5] ...…...[4]
18 dari minyak kedelai. Hasil penelitian mereka adalah bahwa jumlah katalis optimal adalah 1% NaOH atau 0,5% NaOCH3.
Noureddini dan Zhu (1997) menghasilkan rendemen metil ester 80% dari minyak kedelai pada rasio molar metanol-asam lemak 6:1, suhu 60°C, laju pengadukan 300 rpm selama dua jam, dan katalis NaOH 2-4%. Freedman et al. (1984) menyebutkan metil ester dari minyak jelantah dengan kondisi terbaik pada rasio molar metanol terhadap minyak 6:1, katalis KOH 1% dan suhu 65°C.
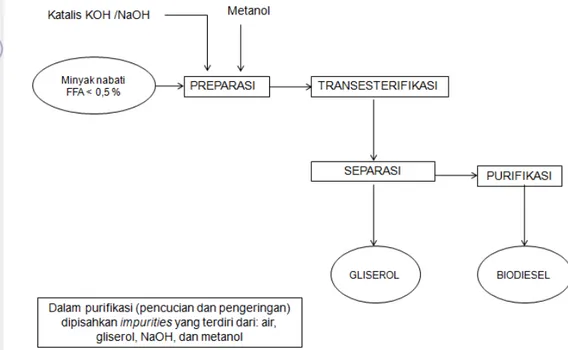
Secara komersial biodiesel banyak diproduksi dengan transesterifikasi alkali (basa) di bawah tekanan atmosfir, diproses secara batch, dioperasikan pada suhu 60 – 70 oC dengan methanol berlebih serta menggunakan katalis NaOH. Dalam proses ini metil ester akan terbentuk secara maksimal dalam waktu 60 menit. Dengan kondisi proses tersebut hasil atau kandungan metil ester yang terbentuk sekitar 97 - 99% (Freedman et al.,1984,) dan proses yang dipilih bergantung dari mutu bahan baku (minyak nabati) awal. Bila minyak mempunyai nilai FFA < 0,5 % maka bisa langsung diproses dengan transesterifikasi dengan katalis basa eperti tersaji dalam diagram proses pada Gambar 5. Bila kandungan FFA > 5 % maka proses harus dilakukan dengan Es-trans (esterifikasi-transesterifikasi). Tahap awal dilakukan netralisasi dengan mereaksikan minyak dengan metanol dan asam misal H2SO4 (proses ini disebut esterifikasi) sehingga nilai FFA minyak akan turun atau < 0,5 dan selanjutnya dilanjutkan dengan proses transesterifikasi. Proses esterifikasi dan esterifikasi-transesterifikasi (estrans) disajikan dalam Gambar 6.
Setelah reaksi selesai akan terbentuk 2 lapisan, lapisan atas berupa metil ester atau biodiesel serta bagian bawah adalah gliserol. Pada metil ester yang terbentuk ditambahkan asam untuk menetralisir katalis basa dan didiamkan
(settling). Untuk purifikasi lebih lanjut biodiesel yang terbentuk dicuci dengan air
panas (90 oC) sehingga impurities (pengotor) seperti FFA, NaOH, sedimen terlarut. Pengeringan (drying) perlu dilakukan guna mencapai kandungan air yang serendahnya dari biodiesel, dan metanol yang tidak bereaksi (unreacted methanol) dalam biodiesel digunakan ulang (recovery) dengan jalan destilasi atau evaporasi
19 (Freedman et al., 1984; Noureddini dan Zhu, 1997; Darnoko dan Cheryan, (2000). Untuk lebih meningkatkan mutu biodiesel hasil purifikasi difilter kembali sehingga grade biodiesel akan lebih baik.
20 2.2.2.2 Katalis Asam
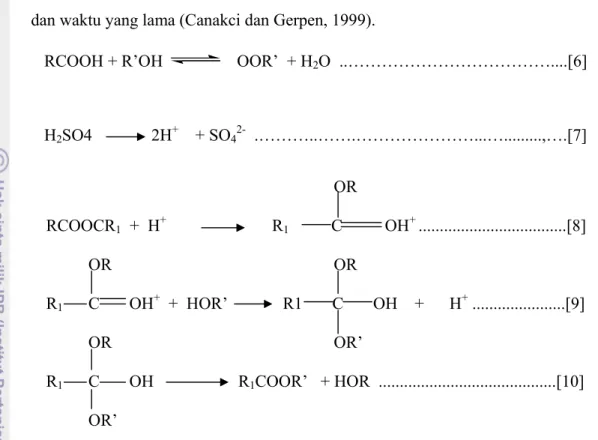
Katalis asam memberikan keuntungan antara lain cocok untuk proses pengolahan biodiesel dengan bahan baku (feedstock) dengan tingkat keasaman yang tinggi atau untuk proses / transesterifikasi (dengan asam lemak bebas yang tinggi). Oleh karena itu cocok untuk proses transesterifikasi minyak sawit atau minyak jelantah (waste edible oil), pada reaksi [6] proses esterifikasi dari asam lemak bebas, sedangkan pada persamaan [7] disajikan mekanisme reaksi transesterifikasi dengan katalis asam. Keunggulan lain dari katalis asam adalah mampu menjadikan produk ester dengan rantai cabang yang panjang, dan katalis asam dapat digunakan dalam tahap pra-esterifikasi. Mekanisme reaksi katalis asam disajikan dalam Gambar 7.
Kekurangan penggunaan katalis asam adalah: 1) memberikan reaksi yang sangat lambat (pada T 65oC, rasio molar metanol terhadap minyak 30, memerlukan waktu 50 jam), 2) menghasilkan produk yang tidak diinginkan (dialkil eter atau gliserol eter bila suhu reaksi dinaikan), dan 3) konversi ester menurun dengan adanya kandungan air. Transesterifikasi berkatalis asam lebih Gambar 6. Diagram proses Es-trans (esterifikasi-transesterifikasi) untuk FFA
21 toleran terhadap asam lemak bebas tinggi, tetapi membutuhkan pemanasan tinggi dan waktu yang lama (Canakci dan Gerpen, 1999).
Secara garis besar katalis asam terdiri dari katalis asam homogen dan katalis asam heterogen. Katalis asam homogen terdiri dari beberapa jenis yang masing-masing memberikan kinerja yang berbeda seperti terlihat dalam Tabel 2. Demikian juga dengan katalis asam heterogen mempunyai fungsi dan karakteristik yang spesifik tergantung dari jenisnya seperti dapat dilihat dalam Tabel 3. Transesterifikasi katalis asam dilakukan dalam rangka mensintesis minyak yang mempunyai nilai FFA tinggi. Katalis asam seperti asam sulfat, asam phospat, asam klorida cocok untuk reaksi yang minyak mempunyai bilangan asam lemak bebas yang tinggi. Menyerupai sistem katalis enzimatis, reaksi katalis asam memerlukan waktu reaksi jauh lebih panjang dibanding reaksi katalis basa (Nelson et al., 1996; Watanabe et al., 2001, Canakci, M dan Gerpen, 2001; Linko
et al., 1998). Proses transesterifikasi tidak banyak diterapkan dalam skala
produksi karena dianggap tidak ekonomis dan dianggap time consuming. Gambar 7. Mekanisme reaksi katalis asam (Schuchardt et al., 1998)
RCOOH + R’OH OOR’ + H2O ..………....[6]
H2SO4 2H+ + SO42- .………..…….………...…...,….[7] OR RCOOCR1 + H+ R1 C OH+ ...[8] OR OR R1 C OH+ + HOR’ R1 C OH + H+ ...[9] OR OR’ R1 C OH R1COOR’ + HOR ...[10] OR’
22 Tabel 2. Karakteristik katalis asam homogen
Jenis katalis Contoh
katalis
Minyak - lemak
Kondisi reaksi Jenis
alkohol Yield ester Asam mineral H2SO4, H3PO4 Minyak nabati FFA tinggi T 65-250o C alkohol:minyak= 5,5-30:1 waktu 3 -50 jam Metanol, etanol, 1-butanol 99 % Asam alfatik
dan sulfonik p-toluen, xilen dan asam sulfat benzena (+H2SO4) C10-C12 asam sulfat benzena alkil, asam sulfat metana Minyak nabati FFA tinggi T 50-130 o C alkohol:minyak= 3-7:1 Metanol, aqu etanol 90,5-97 % Asam Lewis dan halogenida BF3 (NaOH), SnCl2, AlCl3, CoCl2InI3 Minyak sunflower, & minyak lain T 80-180o C alkohol:minyak= 6:1, Waktu 8 jam
metanol tidak ada data
Sumber :Mittlebach dan Remschmidt (2004)
Tabel 3. Karakteristik katalis asam heterogen
Jenis katalis Contoh katalis Minyak - lemak Kondisi reaksi Jenis alkohol Yield ester Penukar ion kuat H2SO4, H3PO4 Minyak nabati FFA tinggi T 65-250o C alkohol:minyak= 5,5-30:1 waktu 3 -50 jam Metanol, etanol, 1-butanol 99 %
Fosfat logam p-toluen, xilen dan asam sulfat benzena (+H2SO4) C10-C12 asam sulfat benzena alkil, asam sulfat metana Minyak nabati FFA tinggi T 50-130o C alkohol:minyak= 3-7:1 Metanol, etanol 90,5-97 % Logam oksida
transisi BFSnCl3 (NaOH), 2, AlCl3,
CoCl2InI3 Minyak sunflower, dan minyaknabati lain T 80-180o C alkohol:minyak= 6:1 Waktu 8 jam
metanol tidak ada data
Garam logam transisi dari asam amino
Zn dan Cd
ariginate Palm oil dn sunflower oil 3 jam metanol > 50 % Garam logam transisi dari asam lemak Zn dan Mn palmitat Minyak nabati FFA tinggi - metanol > 92 % Garam logam transisi dari alkil asam sulfonik benzena dan asamsulfonik alkana Zn, Ti, Cr, Co,
Cd Minyak nabati FFA tinggi (unrefined) dari FFA tallow
4,75 jam metanol 96 %
23 2.2.2.3 Katalis Enzim
Katalis enzim memberikan kemampuan untuk : 1) penggunaan berulang-ulang hingga 50 kali tanpa kehilangan potensi katalitiknya, 2) penggunaan metanol yang sedikit. 3) katalis enzim bisa mengkonversi metil ester pada suhu, tekanan, dan pH sedang, 4) hasil reaksi memberikan proses purifikasi lebih mudah, 5) mutu gliserol yang tinggi sebagai by product, 6) menunjang pencegahan kerusakan lingkungan (mengurangi limbah cair), 7) dilakukan dalam satu tahap proses, dan 8) bisa mengolah feedstock dengan keasaman yang tinggi tanpa perlakuan awal (Choo dan Ong, 1986; Mittelbach, 1990; Nelson et al.,1996; Wu et al.,1999; Fukuda et al., 2001; Ban et al.,2001)
Kekurangannya terkait dengan waktu transesterifikasi yang lama, berlangsung pada pH tertentu, cocok dengan pelarut tertentu, dan kandungan air tertentu, harga katalis yang mahal, efisiensi reaksi rendah, enzim membutuhkan imobilisasi dan membutuhkan penambahan air (10 wt %) sehingga yield ester turun drastis, serta enzim mudah untuk non aktif dalam minyak (phospolipid), sehingga minyak nabati harus dilakukan degumming (Choo and Ong, 1986; Nelson et al.,1996; Wu et al.,1999; Fukuda et al., 2001; Ban et al.,2001)
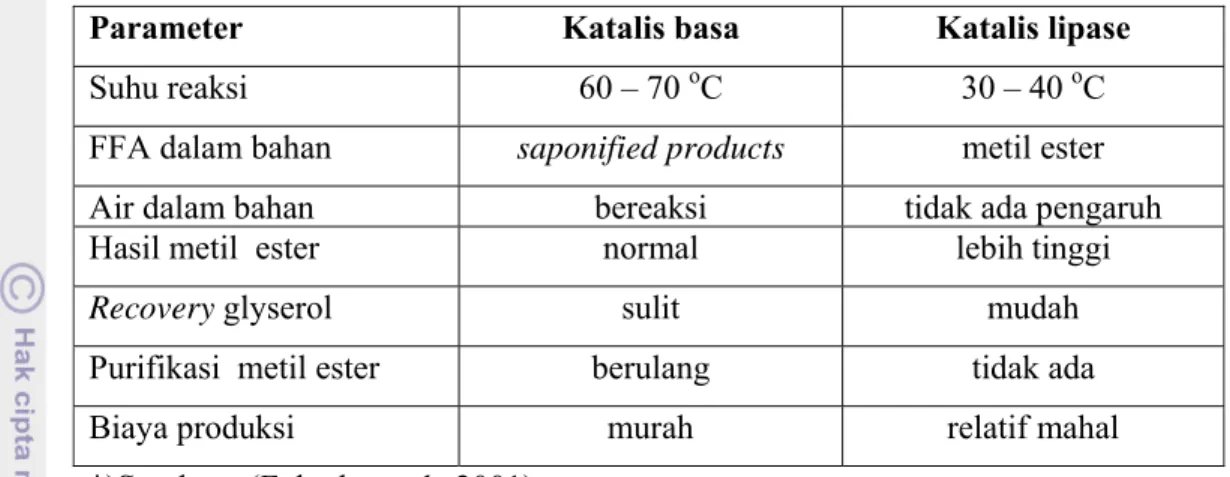
Katalis enzim akan mudah mengubah FFA menjadi FAME dengan konversi yang cukup seperti untuk bahan baku minyak jelantah (Fukuda et al., 2001). Alkoholisis enzimatis masih memerlukan biaya lebih tinggi dibandingkan katalis basa. Enzim lipase sering digunakan sebagai katalis, dan hasil dari proses ini adalah gliserol yang terbentuk dapat dengan mudah digunakan tanpa proses yang rumit serta FFA dalam minyak dapat dengan mudah dikonversi menjadi metil ester. Sebagai perbandingan dari proses katalis basa dan enzimatis dapat dilihat dalam Tabel 4.
24 Tabel 4. Perbandingan Metode katalis lipase dan alkali dalam pengolahan
biodiesel
Parameter Katalis basa Katalis lipase
Suhu reaksi 60 – 70 oC 30 – 40 oC
FFA dalam bahan saponified products metil ester
Air dalam bahan bereaksi tidak ada pengaruh
Hasil metil ester normal lebih tinggi
Recovery glyserol sulit mudah
Purifikasi metil ester berulang tidak ada
Biaya produksi murah relatif mahal
*)Sumber : (Fukuda et al., 2001) 2.2.2.4 Transesterifikasi non-Katalis
Transesterifikasi non-katalis merupakan salah satu metode pengolahan biodiesel dengan tujuan pengurangan waktu reaksi, peniadaan penggunaan katalis, purifikiasi yang lebih baik, dan meningkatkan mutu hasil proses biodiesel. Pada Tabel 5 disajikan perbandingan karakteristik pengolahan biodiesel dengan bantuan katalis dan non-katalis.
Tabel 5. Komparasi metode katalis dan non-katalis *)
Parameter Katalis Superkritik MeOH
Waktu reaksi 1 – 8 jam 120 – 240 detik
Kondisi reaksi tekanan 0,1 MPa,
suhu 30 – 65 oC Tekanan > 8.09 MPa suhu > 239.4 oC
Katalis basa atau asam tidak ada
FFA saponified products metil ester
Hasil (yield) normal lebih tinggi
Hasil purifikasi metanol, katalis dan
saponified products
metanol
Proses bertahap sederhana
Konsumsi energi rendah tinggi
25 2.2.3 Kinetika Reaksi
2.2.3.1 Tumbukan (collisions)
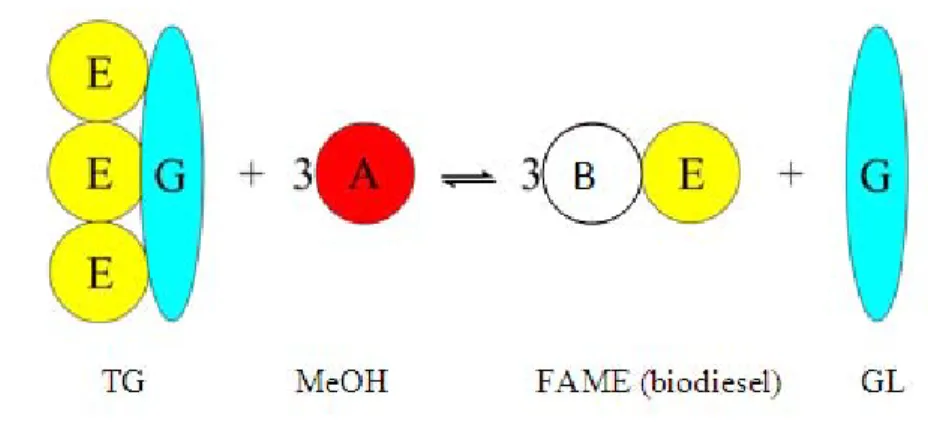
Reaksi yang hanya melibatkan satu partikel mekanisme tumbukan berlangsung secara sederhana akan tetapi bila reaksi yang melibatkan tumbukan antara dua atau lebih partikel mekanisme reaksi menjadi lebih rumit. Reaksi yang melibatkan tumbukan antara dua partikel dapat bereaksi jika partikel-partikel melakukan kontak satu dengan yang lain. Partikel-partikel harus bertumbukan sehingga terjadi reaksi. Reaksi terjadi karena kedua partikel tersebut harus bertumbukan dengan mekanisme yang tepat, dan partikel-partikel harus bertumbukan dengan energi yang cukup untuk memutuskan ikatan-ikatan. Bila dikaitkan mekanisme tumbukan dalam proses transesterifikasi (biodiesel) antara trigliserida (TG) dan methanol (MeOH) maka dapat dijelaskan seperti dalam Gambar 8 di bawah ini.
Tumbukan terjadi antara tiga molekul CH3OH atau (3A) dan satu molekul trigliserida (TG). Keduanya bereaksi untuk menghasilkan 3 molekul fatty acid
methyl ester (FAME) dan 1 molekul gliserol (G). Sebagai hasil dari tumbukan
antara satu molekul TG dan tiga molekul methanol (MeOH) berubah menjadi tiga moleklul FAME dan satu molekul GL. Di dalam reaksi transesterifikasi, sebenarnya antara TG dan MeOH sukar sekali untuk bersatu (bereaksi) karena
Gambar 8. Reaksi transesterifikasi TG dan MeOH (E = ester, G = gliserida, A = alkohol, B = alkil dari alkohol)
26 kedua bahan tersebut mempunyai phase yang berbeda, di samping itu TG dan MeOH mempunyai sifat elektronegatifitas yang berbeda dan menyebabkan ikatan keduanya menimbulkan tolakan karena keduanya memiliki elektronegatifitas yang tinggi (Atkins, 1986)
Untuk menjadikan reaksi berlangsung dan mengarah ke sebelah kanan sehingga terbentuk 3 BE (biodiesel) maka diperlukan efek pengadukan yang sangat tinggi (vigorous stirring) yang salah satunya dipunyai oleh static-mixer yang bisa menghasilkan gaya inersia yang tinggi atau shear stress yang tinggi. Kondisi ini sangat diperlukan terutama dalam tahap-tahap awal reaksi transesterifikasi (persamaan 11) :
Di dalam reaksi transesterifikasi seperti di atas maka nilai konstanta laju reaksi (k) harus mengikuti k1 > k2 >k3 (Levenspiel, 1972)
2.2.3.2. Energi tumbukan dan Laju Reaksi
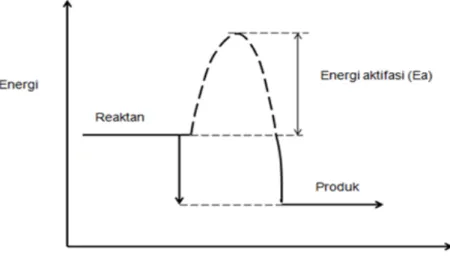
Di dalam reaksi transesterifikasi partikel-partikel tersebut tidak dapat bertumbukan melampui energi minimum yang disebut dengan energi aktivasi reaksi (Ea). Ea adalah adalah energi minimum yang diperlukan untuk melangsungkan terjadinya suatu reaksi. Secara garis besar reaksi eksotermal (termasuk reaksi transesterifikasi) dapat dijelaskan seperti Gambar 9 di bawah ini
k1 TG + CH3OH DG + CH3COOR1 k2 DG + CH3OH MG + CH3COOR2 …………..…[11] k3 MG + CH3OH GL + CH3COOR3
27 Ea adalah energi minimum untuk menghasilkan FAME dan gliserol dari reaktan TG dan MeOH. Jika partikel-partikel bertumbukan dengan energi yang lebih rendah dari energi aktivasi (Ea) maka fluida yang diproses masih dalam bentuk reaktan (TG dan MeOH) dan tidak akan terjadi reaksi transesterifikasi. Reaktan akan kembali ke keadaan semula energi aktivasi sebagai tembok dari reaksi. Hanya tumbukan yang memiliki energi sama atau lebih besar dari energi aktivasi yang dapat menghasilkan terjadinya reaksi (product). Di dalam reaksi kimia, ikatan-ikatan dipisahkan (membutuhkan energi) dan membentuk ikatan-ikatan baru (melepaskan energi). Umumnya, ikatan-ikatan harus diceraikan sebelum yang baru terbentuk. Energi aktivasi dilibatkan dalam menceraikan beberapa dari ikatan-ikatan tersebut (TG, DG, dan MG). Hubungan antara jumlah atau persentase (frekuensi) tumbukan energi aktivasi (Ea) dan konstanta reaksi dinyatakan dalam rumus Arhenius, dalam persamaan [12] dan konstanta laju reaksi dinyatakan dalam persamaan [13] (Levenspiel, 1972):
28 2.2.3.3 Kinetika Kimia
Kinetika kimia adalah studi tentang laju reaksi atau perubahan konsentrasi reaktan (atau produk) per satuan waktu (Atkins., 1986). Laju reaksi sangat penting untuk diketahui karena mampu meramalkan kecepatan campuran reaksi mendekati keseimbangan.
Tahap awal dalam analisis kinetika reaksi adalah menentukan stoikiometri reaksi dan mengenali setiap reaksi samping, maka data dasar tentang kinetika kimia adalah konsentrasi reaktan dan produk pada waktu yang berbeda-beda setelah reaksi dimulai. Karena reaksi kimia pada umumnya peka terhadap suhu, maka suhu campuran reaksi harus dijaga konstan selama reaksi berlangsung, jika tidak maka laju reaksi yang diamati akan merupakan laju rata-rata pada temperatur yang berbeda-beda yang tidak berarti (Atkins, 1986). Faktor yang mempengaruhi laju reaksi antara lain adalah sifat alami reaktan, konsentrasi reaktan, suhu, dan adanya katalis.
Hukum laju reaksi adalah persamaan yang menyatakan laju reaksi sebagai fungsi dari konsentrasi semua spesies yang ada, termasuk produknya. Konstanta laju reaksi (k) tidak bergantung pada konsentrasi, tetapi bergantung pada temperatur. Hukum laju reaksi ditentukan secara eksperimen dan umumnya tidak dapat diduga dari persamaan reaksi. Dengan diketahuinya hukum laju reaksi dan konstanta laju maka laju reaksi dapat diramalkan dari komposisi campurannya, selain itu hukum laju merupakan pemandu untuk mekanisme reaksi.
Orde dari suatu reaksi menggambarkan bentuk matematika yang dapat ditunjukkan oleh hasil percobaan (Atkins, 1986). Orde reaksi hanya dapat ditentukan berdasarkan eksperimen, dan hanya dapat diramalkan jika suatu mekanisme reaksi diketahui. Orde reaksi terhadap suatu komponen merupakan pangkat dari konsentrasi komponen itu di dalam hukum laju, sedangkan orde keseluruhan reaksi adalah penjumlahan orde semua komponennya (Atkins, 1996).
29 Secara umum laju reaksi bertambah dengan naiknya temperatur. Pengamatan empiris menunjukkan bahwa reaksi mempunyai konstanta laju yang mentaati persamaan Arrhenius (Atkins, 1996):
Untuk kebanyakan reaksi ternyata grafik antara ln k terhadap 1/T menghasilkan garis lurus. Persamaan Arrhenius sering dituliskan sebagai:
A disebut faktor praeksponensial atau frekuensi tumbukan dan Ea merupakan energi pengaktifan atau energi aktivasi. Energi aktivasi merupakan energi minimum yang harus dimiliki reaktan untuk berlangsungnya proses, sedangkan faktor praeksponensial ditafsirkan sebagai fraksi tumbukan yang mempunyai cukup energi untuk menghasilkan reaksi. Secara bersamaan keduanya disebut parameter Arrhenius reaksi (Atkins, 1996). Secara garis besar (reaksi secara keseluruhan) dari reaksi trasnesterifikasi dapat dituliskan sebagai nerikut (persamaan 14):
TG + 3CH3OH
⇔ 3CH3COOR + GL ...[10]
Karena reaksi yang berlangsung merupakan reaksi bolak-balik dan mengikuti reaksi orde pertama , konstanta reaksi (k) ke arah kanan berdasarkan k1 dan ke arah kiri berdasarkan k2 sehingga reaksi mengikuti pseudo orde pertrama k’.Kalau dimisalkan reaksi 11 dengan reaksi yang dituliskan sebagai berikut (persamaan 15) Ln k = ln A – Ea/RT ………...………..…..…..[12] k = A e – Ea/RT ………...………...……..……[13] kr TG + 3 CH3OH 3 CH3COOR + GL ……….……[14] kl kr A + B D + C ………...………..…[15] kl
30 Laju reaksi pengurangan reaktan A adalah :
- dCA / dt = k r CA - k l CA = (k r - k l) CA = k ’ CA dCA / CA = k ’ dt
ln CA = k’ t , ( batas integrasi CA danCAo ), CAo adalah konsentrasi awal CA CA / CA o = e - k ’ t
CA = CA o e - k ’ t
Untuk jumlah masa metil ester asam lemak (D) ekivalen dengan : CD = 3 (CA o - CA)
CD = 3 (CA o - CA o e - k ’ t)
CD = 3 CA o (1- e - k ’ t)
C Me = 3 C awal TG (1- e - k ’ t) ...[16] Me adalah konsentrasi metil ester, dan sehingga jumlah mol metil ester yang terbentuk 3 kali mol awal TG dikalikan (1- e - k ’ t)
2.3. Static-mixer
2.3.1 Profil Turbulensi Fluida dalam Static-mixer
Static-mixer merupakan rangkaian elemen untuk pencampuran yang
diletakkan dalam sebuah pipa dan menggunakan energi dari aliran untuk menciptakan pencampuran antara dua atau lebih fluida (Oldshue, 1983; Paul et al., 2003). Static-mixer merupakan satu jenis mixer yang mempunyai kehilangan tekanan yang sangat rendah di samping memberikan efek getaran yang sangat rendah sehingga dikenal sebagai motionless mixer. Dalam operasionalnya input tenaga listrik static-mixer yang diperlukan cukup rendah dibandingkan dengan jenis mixer lainnya. Static-mixer dapat diaplikasikan untuk mencampur fluida yang mempunyai viskositas rendah, viskositas tinggi, material berserat (fibrous
materials) dan untuk keperluan proses blending (Odlshue, 1983; Paul, 2003).
Dalam operasinya static-mixer ditempatkan dalam pipa dan pada kedua
ujung pipa dibuat flens. Struktur bagian dalam static-mixer bersifat rigid dan dihubungkan dengan cara pengelasan dengan housing atau bisa juga dilepas
31 (removable). Umumnya panjang static-mixer mencapai 10 inci dengan diameter 1 inci dengan bahan yang beerasal dari metil, fiberglass, atau polyester (FRP). Dalam operasinya static-mixer berada dalam posisi tidak bergerak (stationary) dan proses mixing terjadi dari proses aliran yang melalui mixer. Static-mixer terdiri dari beberapa elemen atau beberapa seri pitch yang berulang (basic flight
unit) sepanjang ruang static-mixer (mixing chamber) (Paul, 2003).. Nomenclature static-mixer sejauh ini belum seragam dan referensi tentang static-mixer banyak
berasal dari beberapa buku manual produsen static-mixer.
Static-mixer bisa mengintensifkan proses fisik dan kimia dan menciptakan
aliran turbulensi untuk meningkatkan efektifitas mixing. Mekanisme pencampuran fluida yang dihasilkannya terdiri dari: 1) pembagian (dividing), 2) pembelokkan, 3) pemutaran (rotating), 4) penghubungan (channelling). Pencampuran tersebut bisa meningkatkan homogenitas dan mencegah sedimentasi. Mekanisme pengadukan ini juga menghasilkan getaran yang minimal (motionless mixer) serta memberikan kehilangan tekanan yang minimal
(low pressure loss). Static-mixer dikendalikan oleh auxiliary equipment seperti
as, speed reducer, dan motor listrik (Oldshue, 1983).
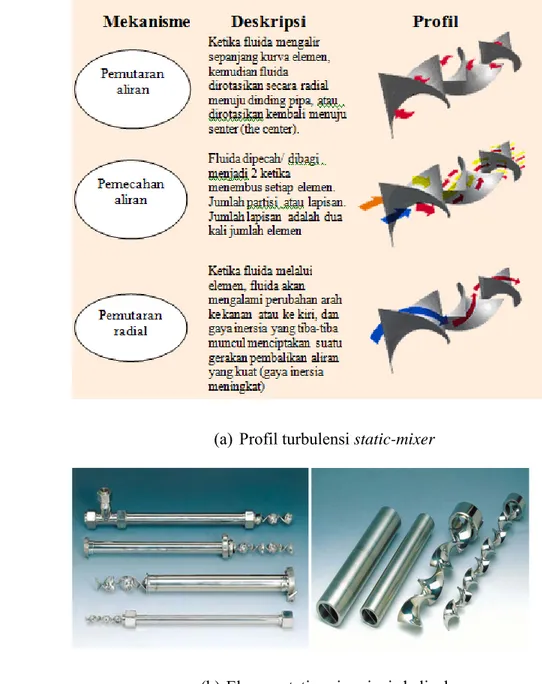
Mekanisme aliran dalam static-mixer adalah pada tahap awal fluida dipecah dalam elemen pertama, dan aliran (channel) yang dihasilkan kemudian diputar 180o . Setiap channel dipecah kembali dan diputar 180o dalam arah yang berlawanan. Posisi elemen diatur sedemikian rupa sehingga membentuk sudut 90o. Proses pembagian (division), pemutaran (rotation), dan pengaliran (flow) yang terjadi secara reversal akan meningkat dengan bertambahnya jumlah perputaran (travel) selama melalui ruang pencampuran (mixing chamber). Menurut Oldshoe (1983) jumlah lapisan yang terbentuk ekivalen dengan 2 kali lipat jumlah elemen yang ada. Pada Gambar 10 (a) disajikan profil aliran dalam
static-mixer.
2.3.2 Jenis Static-mixer
Jenis static-mixer antara lain 1) blade design static-mixer, 2) helical
design static-mixer, 3) non-clog static-mixer, dan 4) wafer style mixer (Oldshue,
1983; Koflo corp, 2006; Kenics corp, 2007). Blade design Static-mixer dirancang terutama untuk fluida dengan viskositas rendah hingga sedang, helical design
32
static-mixer dirancang untuk dua aliran fluida dengan viskositas tinggi atau untuk
mencampur (blending) dua atau lebih bahan (ingredients), non-clog static-mixer digunakan untuk mencampur bahan-bahan yang berserat (fibrous materials), dan
wafer style mixer diaplikasikan untuk pencampuran aliran bahan yang mempunyai
kecepatan tinggi atau bahan-bahan yang dicampur mempunyai masalah dengan kepanjangan pipa. Pada Gambar 10 (b). dapat dilihat salah satu jenis static-mixer jenis helical.
(a) Profil turbulensi static-mixer
(b) Elemen static-mixer jenis helical
33 2.3.3 Aplikasi Static-mixer
Secara garis besar klasifikasi atau pemakaian static-mixer terbagi dalam bidang-bidang sebgai berikut :
1. Umum (General Use)
Untuk reaksi pengadukan biasa, ekstraksi, pewarnaan, polimerisasi, emulsifikasi, netralisasi, pindah panas, pengendalian pH, netralisasi, pencampuran gas dan serbuk. Bahan berasal dari : Carbon Steel, 304SS, 316SS, PVC, Teflon, PP, PE, dan lainnya
2. Pangan dan Farmasi
Untuk pengadukan edible oil, mayonnaise, es krim, coklat, minuman, susu, kecap, dan pengadukan bahan-bahan farmasi, bahan biasanya terbuat dari metil stainless steel (304SS, 316SS)
3. Pilot Plant
Biasanya digunakan untuk pengadukan dalam jumlah kecil resin dan hardener, bahan biasanya terbuat dari metil (304SS, 316SS, Glass atau Acrylic
Housing dengan 304SS atau 316SS element)
4. Viscous Fluids/High Pressure
Digunakan untuk mengaduk polimer cair dan resin, pencampuran dan distribusi panas, pencampuran fluida dengan kecepatan tinggi. Bahan konstruksi biasanya terbuat dari metil Carbon Steel, 304SS, 316SS, 316SS TI
5. High Shear Mixers (HSM)
Digunakan untuk pencampuran yang efektif dari dispersi larutan dengan berbagai viskositas, untuk waktu pengadukan yang pendek, untuk reaksi bahan-bahan kimia (cair dan gas) yang mempunyai viskositas rendah. Beberapa
34 Tabel 6. Petunjuk penggunaan static-mixer
Applikasi Kecepatan Jumlah elemen Material (bahan konstruksi)
Raw Water Blending
1-3 fps 2-4 FRP
Flash mixing 3-5 fps 2-4 Stainless Steel, FRP,
PVC
Chemical Premixing
1-3 fps 2-4 Stainless Steel, FRP, PVC
Polymer Dilution 3-5 fps 6-12 Stainless Steel, PVC
Polymer Addition 1-2 fps 6-12 FRP, PVC
PH Adjustment 3-5 fps 4-6 FRP, PVC
Chlorination/Dechlorination
Liquid/Liquid 1-5 fps 2-4 Stainless Steel, FRP,
PVC
Gas/Liquid 4-10 fps 4-6 FRP, Stainless Steel
In-line Aeration 8-10 fps 4-6 Stainless Steel, FRP Dissolved Air
Flotation
10-12 fps (60 psi) 4-6 Stainless Steel
Sludge Blending 1-3 fps 4-6 Stainless Steel, FRP
Sumber: Paul (2003) 2.4. Blade agitator
Sejauh ini reaktor transesterifikasi biodiesel skala pilot plant atau skala produksi masih menggunakan blade agitator atau reaktor CSTR (continous stirrer
tank reaktor). Komponen utama untuk reaktor transesterifikasi tersebut terdiri
dari tangki reaktor, pemanas (heater) dari steam, pengaduk (blade agitator), serta pompa transfer untuk pengaliran atau sirkulasi produk. Kekurangan reaktor ini yaitu turbulensi yang dihasilkan kurang intensif dan menimbulkan vortex atau
shear stress yang tidak maksimal karena fluida hanya diputar dibandingkan
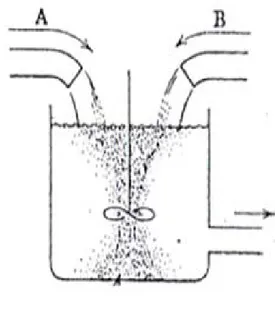
dengan mekanisme homogenisasi yang terjadi pada static-mixer. Menurut Levenspiel (1972), bila reaktan/fluida A dan reaktan B dicampur dengan menggunakan blade agitator maka bila terjadi reaksi, reaksi yang terbentuk berada pada suatu zona reaksi sekitar as pengaduk blade agitator, di samping itu akan terbentuk pula zona non-homgen di mana terdapat reaktan yang masih belum bereaksi (Gambar 11). Bila reaktan yang bereaksi antara A dan B membentuk R kemudian R beraksi dengan B membentuk S maka profil zona reaksi masing-masing reaktan dan produk akan terlihat seperti Gambar 12 (Levenspiel, 1972).
35
Zona reaksi reaktan A dan B
Zona non-homogen
Zona reaksi Konsentrasi
jarak
Gambar 12. Profil zona reaksi reaktan, produk, serta reaktan yang tidak bereaksi (Levenspiel, 1972)
Gambar 11. Profil zona reaksi reaktan A dan B dalam reaktor blade agitator (Levenspiel, 1972) A + B →R R + B→ S kadar B tinggi kadar A tinggi
36 Di dalam suatu reaktor pencampur di atas fluida yang masuk segera akan didispersikan (disebarkan) di dalam tangki. Apabila homogenisasi dalam tangki dilakukan dengan sistem kontinyu (terdapat bagian input dan out put) beberapa bahan pereaksi akan berada lebih lama dalam tangki dari pada mean residence
time (waktu tinggal) dan beberapa bagian lainnya akan berada (tinggal) lebih
pendek waktunya (Oldshoe et al, 1983). Jenis reaktor / tangki dengan blade
agitator) khususnya berguna untuk sistem pengadukan dengan selang konsentrasi
mutu yang dihasilkan lebih besar. Jenis tangki dengan balade agitator ini cocok untuk reaksi berordo nol untuk berbagai tingkat volume yang diinginkan. Sedangkan umumnya proses transesterifikasi biodiesel berordo 1, sehingga dengan demikian untuk reaktor dengan blade agitator dalam mengefektifkan homogenisasi campuran dan meningkatkan konversi FAME dibutuhkan pengadukan yang kuat (vigorous stirring) dan waktu lebih lama. Salah satu penelitian yang dilakukan berkaitan dengan hal ini dilakukan oleh Yamazaki et al (2007) menyatakan bahwa production rate FAME meningkat dari 0,28 gram/menit menjadi 0,3 gram/menit ketika putaran homogenisasi dinaikan dari 400 rpm menjadi 700 rpm.
Hasil pengujian menunjukkan dalam tangki pengadukan dengan blade
agitator atau column mixer yang mempunyai kapasitas homogenisasi antara 1
hingga 15 000 galon/menit (3,8 hingga 5,7 x 104 liter/menit) dalam tangki yang berkapasitas antara 1 hingga 100 galon (3,8 hingga 380 liter) retention time yang diperlukan berkisar antara waktu beberapa menit hingga jam, akan tetapi bila menggunakan static-mixer atau conventional in-line blender dengan hasil homogenisasi yang sama dibutuhkan waktu homogenisasi (retention time) bisa dalam dalam hitungan detik (Oldshoe, 1983).
![Gambar 4. Reaksi alkoholisis TG dengan MeOH reaksi keseluruhan pers. [2];](https://thumb-ap.123doks.com/thumbv2/123dok/2087700.3029772/2.918.166.778.579.851/gambar-reaksi-alkoholisis-tg-meoh-reaksi-keseluruhan-pers.webp)