Kokando rinsanka puroteomu kaiseki shisutemu ni yoru kumamushi no kanmin iko mekanizumu no kaimei
Teks penuh
(2) 修 士 論 文 ダ イ ジェスト. 高感度リン酸 化 プロテオーム解析システムによるクマムシの 乾眠移行メカニズムの解明 慶應義塾大学大学院政策• メディア研究科修士2 年 長谷部百合子. 論文要旨 ク マ ム シ は 極 限 環 境 下 で 驚 異 的 な ス ト レ ス 耐 性 を 持 つ . 乾 燥 環 境 下 で は 体 内 の 水 分 を 低 下 さ せ , 丸い 樽 の 形 状 ( T im 状 態 ) を と る . 乾 眠 を 行 う 生 物 種 は 乾 眠 移 行 に 時 間 を 有 す る も の が 多 く , 水 の 代 わ り に 生体成分などを保護するためトレハロースやL E A タンパク質などを大量に合成し,高い乾燥耐性能力を 獲得している.. しかし, ヨ コ ツ ナ ク マ ム シ ( 及amazzo 如'奶 var/eom 故w>s)は m R N A レ ベ ル の 遺 伝 子 発 現 に お. いて活性状態と乾燥状態で差異がみられずトレハロースの蓄積がない.. これらにより, タンパク質の発. 現制御よりも,翻訳後修飾によって乾眠状態に移行していることが推測される.. 同 種 の //ア; ^ 如•似. ゴゆm/z'm• ( ド ウ ジ ャ ル ダ ン ヤ マ ク マ ム シ ) は 弱 い な が ら も 乾 燥 耐 性 を 持 つ 事 が 報 告 さ れ , 及. に比べ飼育効率が良く細胞系譜が明らかである.. 加Ms. そ こ で 本 研 究 で は , / / . み /ガ ゴ か /が 乾 眠 状 態 に 移 行 す る. 際に, どのタンパク質のどの部位のリン酸化が変動しているかを定量的かつ経時的に把握するために乾 燥 応 答 の シ グ ナ ル 伝 達 経 路 の 解 明 す る こ と が 目 的 で あ る .乾 眠 移 行 時 の リ ン 酸 化 プ ロ テ オ ー ム の 経 時 的 変化を見るには多検体の測定が必要だが, クマムシの試料数の確保が困難であることから,微量試料 でリン酸化プロテオーム解析を確立する必要がある.. そ の た め 丑 ゴ 吵 •ぼ出w •の 測 定 法 を 安 定 さ せ る た め に. 前処理のステップと測定のステップで検討し乾眠移行の経時的なリン酸化プロテオームデータを取得し た.. リ ン 酸 化 部 位 を 280 個 同 定 し , 経 時 的 に 増 加 し て い く タ ン パ ク 質 を 6 個 , 減 少 し て い く タ ン パ ク 質. を 4 個得ることが出来た. K e y w o rd s : ク マ ム シ , ド ウ ジ ャ ル ダ ン ヤ マ ク マ ム シ ,乾 眠 ,. リン酸化プロテオミクス,高感度分析システム. 84.
(3) 1.序論 1.1. クマムシの極限環境耐性 ク マ ム シ は 無 脊 椎 動 物 で 緩 歩 動 物 門 を 形 成 し , 海 洋 や 陸 生 等 の 様 々 な 環 境 下 に 生 息 し 1000 種 類 以 上 が 存 在 ( Guidetti a n dB erto lani ,2005; G u il a n d Cabrero -Saftudo ,2007) す る . ク マ ム シ は 極 限 環 境 下 で ク リ プ ト ビ オ シ ス と 呼 ば れ る 無 代 謝 の 休 眠 状 態 に な り , 絶 対 零 度 か ら 摂 氏 100度 ( Hengherr, et al.,2009 ) ま で の 温 度 変 化 , 真 空 か ら 7 万 5000 気 圧 ま で の 圧 力 ( Seki (A ltie ro , et al. ,2011),. and. To yo sh im a , 1 9 9 8 ) , 10. kJ/m2 以 上 の U V 照 射. 7000G yの X 線 ( J6nsson ,2007) な ど の 環 境 に お い て も 高 い 耐 性 能 力 を 示 す .. また,. ク リ ブ ト ビ 才 シ ス が 起 き る ス ト レ ス 要 因 よ り 大 き く 4種 類 の ク リ ブ ト ビ オ シ ス に 分 け ら れ , 乾 燥 ス ト レ スにより乾眠,酸 素 欠 乏 に よる窒息仮死,低 温 に よ る 凍 眠 ( Guidetti, e t a l . , 2011 ), 高 浸 透 圧 に よ る 塩 眠 が あ る . 陸 生 の ク マ ム シ は 乾 燥 ス ト レ ス が か か る と Tu n 状 態 と い う 樽 の 様 な 形 態 に な り 3 % 以 下 ま で 水 分 を 低 下 す る (W esth, et al. ,1991; H orikaw a, et al.,2006; H o rika w a , et al., 2 0 0 8 ) . さ ら に T u n 状 態 と な っ た Richtersius co ro n ife r とM ilnesium tardigradum は , 真 空 • 太 陽 放 射 • 超 低 温 と い う 宇 宙 空 間 へ の 曝 露 か ら 生. 還できることが動物としては初めて確認されている( J6nsson ,e t a l . , 2 0 0 8 ) . 通 常 , 乾 燥 耐 性 力 の あ る 生 物. Oliver,. は極限環境下において水の代わりに生体成分を保護するグ ル コ ー ス を ト レ ハ ロースに作 り 替 え (. et al., 2001; C ro w e , et al., 2002; C ro w e , et al., 2007; Hengher, et al., 2008; Schill, et al., 2008) Late embryogenesis abundant ( L E A ) タ ン パ ク 質 を 大 量 に 合 成 し ( Kikaw ada, et al. ,2006; Schokraie, et a l . , 2010 ) 高. い乾燥耐性能力を獲得している. Heat Soluble,. 近 年 , 新 た に C y t o p l a s m i c 細 胞 質 型 熱 安 定 性 タ ン パ ク 質 ( A b u n d an t. C A H S ) と 分 泌 型 熱 安 定 性 タ ン パ ク 質 ( Secretory A bundant Heat Soluble , S A H S ) が ク マ ム. シ の 中 で 高 い 耐 性 能 力 を も つ / ^ m azzo 如 ws w/rfeorw油 ^ ( ヨ コ ブ ナ ク マ ム シ ; R.varieom atus ) に お い て 同 定 された.. また, 乾 燥 耐 性 を 示 す ネ ム リ ユ ス リ カ の 幼 虫 も 軽 い D N A 損 傷 を 受 け る ( N eum ann ,e t a l . , 2009 ) も. の の 乾 燥 重 量 あ た り 約 5-20%の ト レ ハ ロ ー ス を 蓄 積 し ( Cleg g, 1962; Watanabe, et al. ,2002; Watanabe, et a l . , 2004). トレハロースを人為的に増加させると放射線耐性能力を高めた( Watanabe, et a l . , 2007 ) . とこ. ろ が , ク マ ム シ は 乾 燥 重 量 あ た り 約 2 . 3 % し か ト レ ハ ロ ー ス を 蓄 積 し て い な い ( Westh and. Ram lev, 1991; Hengherr, 2008; J6nsson and Persson, 2010) . そ の た め T u n 状 態 に な る メ カ ニ ズ ム と し て 代 謝 産 物 だ け で な. く, 耐 性 を 担 う 遺 伝 子 や 機 能 に 着 目 す る 必 要 が あ る と 考 え ら れ る .. また, クリブトビオシスの一例であ. る 乾 眠 を 行 う 生 物 種 は 完 全 に 乾 眠 す る ま で 数 十 時 間 と 長 時 間 を 有 す る も の が 多 い が , R -v a r ie o m a t u s は 約 30 分 で 乾 眠 に 移 行 し , m R N A レ ベ ル の 遺 伝 子 発 現 に お い て 活 性 状 態 と T im 状 態 で 差 異 が み ら れ な い . この乾燥移行時の短さにより, タンパク質の発現制御よりも,翻訳後修飾によってクリブトビオシスに 移行していることが推測される.. こ れ ま で ク マ ム シ に 効 率 的 な 飼 育 系 が 存 在 し な か っ た た め , クリブト. ピ オ シ ス の 網 羅 的 な 分 子 メ カ ニ ズ ム の 理 解 は 限 定 的 で あ っ た . 近 年 堀 川 ら に よ り R .v a r ie o m a t u s の 飼 育 法を確立し( H o r i k a w a , e t a l . , 2 0 0 8 ) , 2009 年 12 月 に 國 枝 ら に よ っ て 同 種 の ド ラ フ ト ゲ ノ ム 配 列 が 解 読 さ れ た 事 に よ り , ゲ ノ ム 解 析 手 法 を 用 い て R .v a rie o m a tu s の 極 限 環 境 耐 性 メ カ ニ ズ ム に ア プ ロ ー チ す る こ と が 可能となってきた.. し か し な が ら , R .v a r ie o m a t u s は 飼 育 に 大 変 な 労 力 が か か り 繁 殖 能 が 低 い た め 飼 育. 効 率 も 低 く ク マ ム シ の モ デ ル 対 象 生 物 に は 適 し て い な い . 一 方 , /fy/w•如 ゴ MyaWwz• ( ド ウ ジ ャ ル ダ ン ヤ マ ク マ ム シ ) は 世 代 時 間 が 約 1 4 日, 孵 化 す る ま で 約 4 日 で あ り 飼 育 効 率 が 高 く ゲ ノ ム サ イ ズ が 約 7 M b p で あ る ( G abriel, et al. ,2007) . 主 に 発 生 や 進 化 ;生 物 学 に お い て 注 目 さ れ ( Gabriel and Goldstein ,2007; B aven ,etal . ,2009) , ク マ ム シ の 中 で も モ デ ル 生 物 と し て 扱 わ れ る よ う に な っ て き た .. 更 に 丑 Jwyar亦 h•は. 今 ま で 乾 燥 耐 性 が な い と 思 わ れ て い た が R .v a r ie o m a t u s に 比 べ 乾 燥 耐 性 は 低 い も の の 耐 性 能 力 が あ る こ とがわかってきた( H o rik a w a ,e ta l. ,2 0 1 3 ) . そ こ で 本 研 究 で は 丑 % •が 乾 眠 状 態 に 移 行 す る 際 に , ど のタンパク質のどの部位のリン酸化が変動しているかを定量的かつ経時的に把握するためにクマムシの 乾燥応答のシグナル伝達経路の解明に迫るためにタンパク質の翻訳後修飾や細胞内シグナル伝達を行う 一つの手段として連続的なスイッチの切り替えを行うのに重要な役割をもつプロテオームリン酸化に着 目し, ク マ ム シ の 乾 眠 移 行 に お け る 網 羅 的 な プ ロ テ オ ー ム 解 析 及 び リ ン 酸 化 解 析 を 行 う .. 2 . 手法. 85.
(4) 3.2.1.実験概要 クマムシの乾眠移行時の経時的な変化の基盤となる前処理法および微量試料の分析手法を確立し, ク マ ム シ の A c tiv e 状 態 • T u n 状 態 の ホ ー ル プ ロ テ オ ー ム デ ー タ 及 び リ ン 酸 化 プ ロ テ オ ー ム デ ー タ を 取 得 した. 定 量 法 と し て rT R A Q 法 や T M T 法 が 主 流 で 使 わ れ て い る が , iT R A Q Absolute Q u a n tit a t io n ) 法 と T M T. (isobaric Tags for Relative and. (Tandem Mass Ta g ) 法 は レ ポ ー タ ー イ オ ン を 測 定 す る 必 要 が あ り そ の. 場合は通常のイオントラップで使用する衝突誘起解離( C o llisio n -in d u ce d ポーターイオンを測定できないため, HCD. (H ig h. collision. dissociation,. C ID ) 法 で は レ. d is s o c ia tio n ) 法 に 変 え る 必 要 が あ る .. HCD. 法 の 場 合 , M S / M S を O rb itm p で 行 う の で ス キ ャ ン に 時 間 が か か り , 同 定 数 は 大 幅 に 落 ち る . 測 定 を し た 際に対象とするペプチドがある検体によって同定されていたり, されていなかったりすることがあるた め, 同 定 さ れ て い な い デ ー タ で は 定 量 値 が 欠 け て し ま う と い う デ メ リ ッ ト が あ る . 一 方 で , ジメチルラ ベルを使用する場合は, 2 群間比較のため検体数が増えトータル5 万匹を使用した場合に1検体の試 料 量 を 減 ら す •最 低 限 の タ イ ム ポ イ ン ト 測 定 に な っ て し ま う . た上でノンラベルの測定をした.. こ れ ら の メ リ ッ ト •デ メ リ ッ ト を 踏 ま え. また, イオンサブレッシヨンにより定量法の再現性不良が引き起こ. さ れ る た め 経 時 的 な ブ ロ テ オ ー ム 解 析 は N = 3 で 行 い , 試 料 前 処 理 や LC/M Sの 分 離 度 向 上 を 図 っ た . Pmtm lm. Tltipia _. 卿. ho MS/MS. E x t r « lic m. D ig «tic »i. gnrtetimant. O a ts. 図 1.実験の ワークフロー タンパク質の抽出,消 化 •脱 塩 , H A M M O C を用いたリン酸化ペプチド濃縮 ,nano LC -M S /M S 測定及びデータ解析のリン 酸化プロテオーム解析における一連のワークフローを示した.. 3.2.2.測定法の確立. 試 料 注 入 方 法 の 検 討 , カ ラ ム の 内 径 検 討 , メ タ ル フ リ ー 測 定 ,LC/M Sの メ ソ ッ ド の 最 適 化 を 行 っ た (修 士 論 文 に 詳 細 を 記 載 ). .. 3.2.3.測定法の確立 ブ ロ テ オ ー ム の 網 羅 性 を 向 上 さ せ る に は タ ン パ ク 質 破 砕 •抽 出 が 肝 心 で あ る た め , ロスの な い 試 料 採 取 法 •タンパク質可溶化液の検討( S D S / S D C とU re a の 比 較 ) • 破 砕 方 法 の 検 討 を 行 っ た ( 修士論文に 詳細を記載) . 2 .4 経時的なリン酸化プロテオーム解析 2.2. • 2 .3 で 得 ら れ た 結 果 に よ り , 実 験 系 を 組 ん だ . i /• みノ•art/fw• に 水 分 を 抜 き 乾 燥 ス ト レ ス を 与 え , ク. マ ム シ 5,000 匹 の A c tiv e 状 態 ( 0 h ) と ス ト レ ス を 与 え て か ら 3 時 間 後 ( 3 h ) , T u n 状 態 ( 12 h 0. h,. 3 h , 12 h と 表 記 す る ) の 3 ポ イ ン ト で 試 料 を 回 収 し た .. ) (以後,. 酵素消化後,HAM M O C法によりリン酸化;. ペプチドを濃縮し脱塩操作を行い,得られたリン酸化ペプチド画分をオートサンプラーを介し内径 10〇H m の 分 析 カ ラ ム で 試 料 を 導 入 し nano. L C -M S で 分 析 し た .. 間 を 踏 ま え 3 ポ イ ン ト を 測 定 し た . Blast で H .. 試料量と検体数,実験的に実行可能な時. d u ja r d in i に R .v a rie o m a tu s の 相 同 性 検 索 を 行 い ア ノ テ ー シ. ヨ ン を つ け , ペ プ チ ド レ ベ ル で は Sw issprot の Gene O n to lo g y を 用 い て ア ノ テ ー シ ヨ ン し た. 86. ..
(5) AnhyilroW#$ii. 細■ _ t©. Tun slat#. #. 12 h - 24 li. 0 min 図 2.回収する時系列のポイント概略図. Active状 態 0 時間,乾燥ストレスを与えてから3 時間,Tun状 態 の 3 ポイントを測定した. //•ゴ. 5000 匹 S D S / S L S を 含 む Extraction buffer で 溶 解 し た . す り 潰 さ れ タ ン パ ク 質 は 濁 っ た 上 清 と. なるたが破砕しきれていないクマムシは個体の形状のまま沈殿するため項のホモジナイザーでストロー ク 回 数 50 回 す り つ ぶ す ご と に 遠 心 ( 4°C , 3500 G ,. 10 m i n ) し, 沈 殿 物 を す り つ ぶ す 行 程 を 顕 微 鏡 で 確. 認 し な が ら , 完 全 に ク マ ム シ の 個 体 が 確 認 で き な く な る ま で こ の 操 作 を 10 回 繰 り 返 し , そ の 後 超 音 波 破 砕 ( 20 m in,. interval5 s e c ) を し た .. 消 化 後 , リン酸化ペプチド濃縮,脱 塩 操 作 を 行 い , オートサン. ブ ラ ー を 介 し 内 径 10 〇H m の 分 析 カ ラ ム で 試 料 を 導 入 し n a n o L C - M S / M S で 測 定 し た . デ ー タ ベ ー ス と し て , //•み /. •. のトランスクリプトームアセンブリ配列を6 フレームで翻訳しM A S C O Tで検索して用い. た. 3 .. 結果と考察. 3.1.測定法の確立 試料導入では,分析間でのばらつきを防ぎ再現性を優先させオートサンプラーを採用した.. 更に,. カラムの内径を小さくすることでフリットを作製する必要があり熱の加え方によりフリットのばらつ き が 生 じ る た め , フ リ ッ ト の 必 要 な い 内 径 l O O p m の 分 析 カ ラ ム で 試 料 を 導 入 し nano. L C -M S で分析し. た.. 3.2•前処理法の確立 従 来 プ ロ テ オ ミ ク ス で 使 用 さ れ て い る 8 M U r e a と 膜 タ ン パ ク 質 可 溶 化 剤 の sodium deoxychdate ( S D C ) sodium lauroyl sarcosinate ( S L S ) を 用 い た Phase-transfer surfactants ( P T S ) 比 較 を 行 っ た • そ の 結 果 , U re a の 2 倍 以 上 の ペ プ チ ド を 同 定 し そ の う ち 約 2/3 以 上 の ペ プ チ ド を 網 羅 し た S D C / S L S の タ ン パ ク 質 可 溶 化 液. を 選 択 し た (図 3 左 ) . 破 砕 は , 超 音 波 と ホ モ ジ ナ イ ザ ー を 組 み 合 わ せ た 方 法 を 採 用 ( 図 3 右 ) し, ホ モ ジ ナ イ ズ 回 数 は 50回 す り つ ぶ す ご と に 遠 心 ( 4 て , 3500 G , 10 m i n ) し, 沈 殿 物 を す り つ ぶ す 行 程 を 顕 微 鏡 で 確 認 し な が ら , 完 全 に ク マ ム シ の 個 体 が 確 認 で き な く な る ま で こ の 操 作 を 10 回 繰 り 返 し , そ の 後 超 音 波 破 砕 ( 20 m in , in te rv a l5 s e c ) を し た .. 87.
(6) w 7. nFmimkm. _P_. Proteins. 滅雜. ^Peptides. o 6 o ^ o w ^ 5 4 3 2 1. , 1 0. - 4 〇- b 〇~. HoTOgenizer SOstroke + sonication. U re a. P T S (+ ). Sonicat ion. ~. —. Mult i beads™ shocker. 図 3 . (左 ) PTS とUreaで の 同 定 し た ペ プ チ ド ( 右 )破 砕 法 を 比 較 し た ク マ ム シ の ホ ー ル プ ロ テ オ ー ム ペ プ チ ド Active状 態 の / / 200匹 の 試 料 を (左 ) ホ モ ジ ナ イ ザ 一 で ス ト ロ ー ク 回 数 100回 し , 超 音 波 で 破 砕 し , PTSで 溶 解 し た 試 料 と Ureaに よ り 溶 解 ( 右 ) ホ モ ジ ナ イ ザ ー で 50ス ト ロ ー ク し 超 音 波 破 砕 法 , 超 音 波 破 砕 , 凍 結 破 碎 法 で 破 砕 し て 得 ら れ た ペ プ チ ド を 示 す (N = 3 ) . オ ー ト サ ン プ ラ ー を 介 し て 内 径 100阿 の 分 析 カ ラ ム を 導 入 し 測 定 し た .. 3.3.3.Active状 態 と Tu n 状 態 の ホ ー ル プ ロ テ オ ー ム • リ ン 酸 化 プ ロ テ オ ー ム デ ー タ 解 析. 上 記 で 選 択 し た 実 験 法 を 用 い て ク マ ム シ 5 ,0 0 0 匹 の A c tiv e 状 態 と ス ト レ ス を 与 え て か ら 3 時 間 後 , T u n 状 態 ( 以 後 , 0 h, 3 h , ドを得た.. 12 h と 表 記 す る ) の 3 ポ イ ン ト の ホ ー ル プ ロ テ オ ー ム デ ー タ と リ ン 酸 化 ;ぺ プ チ. そ の 結 果 , ホ ー ル プ ロ テ オ ー ム で は 1772 個 の ペ プ チ ド の う ち 0. h : 153個 を 検 出 し た .. 3. リ ン 酸 化 ペ プ チ ド は 330 個 検 出 し そ の う ち O h : 104個 , 3 h : 52 個 ,. た (図 4 ) . 同 定 し た 1772 個 の ホ ー ル プ ロ テ オ ー ム ペ プ チ ド の 中 か ら O h , 図 5 左である.. h : 751 個 ,. h : 301 個 ,. 12. 12 h : 5 1 個 得. 3 h , 1 2 h の重複を示したのが. 3 ポ イ ン ト の 試 料 に 共 通 し て 得 ら れ た 115個 の ペ プ チ ド を 時 系 列 に あ わ せ て 4 つ の パ 夕. ーンにクラス夕一分けした( 図 5 右 ) . 時 系 列 に 伴 い 高 く な っ て い る 変 動 •低 く な っ て い る 変 動 ,乾 燥 ストレスを与えてから3. 時 間 経 過 し た タ ン パ ク 質 の み 低 い •高 い 挙 動 パ タ ー ン を 示 し た .そ の 中 で も. 115個 の う ち 81 個 の タ ン パ ク 質 が 乾 燥 ス ト レ ス を 与 え て か ら 3 時 間 後 の み 高 く な る パ タ ー ン を 示 し た .. ^ 歸. *s. 〇P e _ _. JlOOO .£ 2 X -. ..装 800 S 名 400. J 这. 2. ^. f i i j. 〇 。. J: ^?s ■. !. Qh. ;! i. |〇 J9qomz. S. 6 0 0. g e p dodoqdsqd P S 0 0 1 { d. 1200. i. j| 3h. I I it. 4 . • の 乾 眠 移 行 の 経 時 的 な (左 ) プ ロ テ オ ー ム ,(右 ) リ ン 酸 化 プ ロ テ オ ー ム の 定 量 結 果 0 h : 乾 燥 ス ト レ ス を 与 え る 前 の Active状 態 , 3 h : 乾 燥 ス ト レ ス を 与 え て か ら 3 時 間 後 , 12 h :乾 燥 ス ト レ ス を 与 え て か ら 12時 間 後 の Tun状 態 を 示 す . そ れ ぞ れ / / . ゴ 5000匹 の 試 料 を ホ モ ジ ナ イ ザ ー で ス ト ロ ー ク 回 数 500回 し , 超 音 波 で 破 砕 し , PTSで 溶 解 し て 得 ら れ た ペ プ チ ド を 示 す (N = 3 ) . オ ー ト サ ン プ ラ ー を 介 し て 内 径 100 pmの 分 析 カ ラ ム を 導 入 し測定した. 図. 88.
(7) tmmm. 81/115. 22/115. 7/115. 5/115. 図 5 .仗 • の 経 時 的 な ホ ー ル プ ロ テ オ ー ム 定 量 結 果 の ( 左)重複図, ( 右)変 動による 4 つのパターン分類 ベン図は. Oh, 3 h , 12 hの 同 定 数 を 示 し 3ポ イ ン ト に 共 通 し て い る 115個 の ペ プ チ ド を 定 量 結 果 に よ り 4つ の パ タ ー ン に ク .. ラス夕リングした. 一方で,時系列と共に減少したのは 2 2 個,時系列と共に増加したのは 5 個, 3 時間経過後に減少し増加 するのを 7 個のタンパク質を検出した.言い換えれば,A c tiv e 状態から乾眠にかけてタンパク質レベル で増加していき変動するものの T u n 状 態 で は 減 少 す る . A c tiv e 状態から 3 時間後増加するが T u n 状態で減 少し,かつ A c t iv e 状態に比べて T u n 状態の方がより減少するペプチドは 8 1 個のうち 62 個 を 占 め た . ま た, 115個中 92 個が T u n 状態に比べて A c tiv e 状態の方が増加していることが示唆された.これらの結果か ら,転写レベルでトランスクリブトームに変化がないがタンパク質レベルで変動があるいう新たな知 見が得られた.リン酸化プロテオームペプチドの定量結果( 図 6 左)から重複して得られた 19個のぺプ チドを4 つ の パ タ ー ン に 分 類 し た ( 図 6 右).時系列と共にリン酸化が増加されているのは 19個 中 6 個存 在 し た .一 方 ,時系列と共にリン酸化が減少したのは 4 個同定し, 3 時間経過の時に一番減少するの は 4 個同定した.ホールプロテオームでは最も多いパターンの乾燥ストレス 3 時間経過の時が増加する パターンは 5 個であり, そのうち A c tiv e 状態に比べて T u n 状態で減少したのは 2 個同定した.. 19個中 12. 個が A c t iv e 状態より T u n 状 態 で 増 加 し て い た .特 に ,乾燥ストレスをかけ始めるときから 3 時間経過 し, 6 倍増加し,更 に 9 時間経過し T u n 状態になったときに 2 倍増加し,乾眠前後で 14倍も増加したリ ン酸化を発見した.リン酸化ペプチドはホールブロテオームペプチドと異なり特異的にかたよることな くまばらに分散された.. 図 6 .从 •の 経 時 的 な リ ン 酸 化 プ ロ テ オ ー ム 定 量 結 果 の ( 左 )重複図, ( 右)変動 に よ る 4 つのパターン分類 ベン図は た. .. Oh, 3 h, 12 hの 同 定 数 を 示 し 3ポ イ ン ト に 共 通 し て い る 19 個 の ペ プ チ ド を 4つ の パ タ ー ン に ク ラ ス タ リ ン グ し. 89.
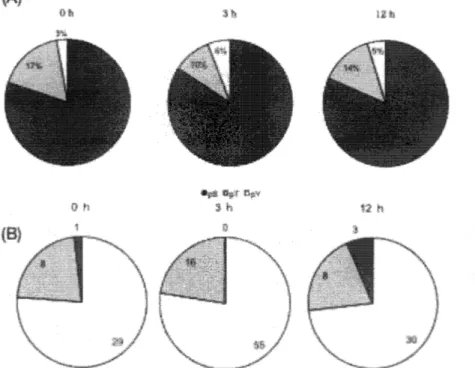
(8) 7 • (A)多 リ ン 酸 化 ペ プ チ ド の 割 合 (B)経 時 的 な 変 化 に よ る リ ン 酸 化 部 位 の 割 合 左 側 の 円 か ら 乾 燥 ス ト レ ス を 与 え る ^tfの Active状 態 , 乾 燥 ス ト レ ス を 与 え て か ら 3 時 間 経 過 後 , 乾 燥 ス ト レ ス を 与 え て か ら 12時 間 経 過 後 の Tu n 状 態 を 示 す • そ れ ぞ れ / / • ゴWar成 w_ 5000 匹 の 試 料 を ホ モ ジ ナ イ ザ ー で ス ト ロ ー ク 回 数 500 回 し , 超 音 波 で 破 砕 し , P T S で 溶 解 し て リ ン 酸 化 ペ プ チ ド 濃 縮 し て 得 ら れ た リ ン 酸 化 ペ プ チ ド を 示 す (N = 3) . オ ー ト サ ン ブ ラ ー を 介 し て 内 径 100 pmの 分 析 カ ラ ム を 導 入 し 測 定 し た . (b ) : S : セ リ ン . T : ス レ オ ニ ン . Y : チロンシンの割合を示した. 図. ま た , 同 定 し た リ ン 酸 化 の う ち 約 7割 以 上 が モ ノ リ ン 酸 化 で あ り ( 図 な変化によって差は見られなかった( 図. 7B).. 7 A ) , リン酸化サイトは経時的. 8.経 時 的 な プ ロ テ オ ー ム の 定 量 解 析 乾 燥 ス ト レ ス を 与 え る 前 の Oh (Active状 態 ) , 乾 燥 ス ト レ ス を 与 え て か ら 3 時 間 経 過 後 , 乾 燥 ス ト レ ス を 与 え て か ら 12時 間 経 過 後 の Tun状 態 に お い て 回 収 し た リ ン 酸 イ 匕 ペ プ チ ド の 定 量 結 果 を 示 し た . 実 線 は , 〇 h < 3 h < 1 2 h及 び 1 2 h < 3 h < 0 h (経 時 的 に 高 く な っ て い る 及 び 低 く な っ て い る ) を 示 し , 破 線 は , 3 h < 1 2 h , 3 h < 0 h (3h の み 低 い ) を 示 し , 点 線 は , 0 h < 3 h ,12h<3h ( 3 h の み 高 い ) を 示 し た 図. 90.
(9) 次にアノテーシヨンをつけるためフィル夕リングした.検出した 1772 個のホールプロテオームペプチド と330 個のリン酸化ペプチドを統合しユニークなペプチドとして 949 個, タンパク質は363 個得られた. Blast でR .v a r ie o m a t u s のデータベースと相同性解析しアノテーシヨンついた 118個のペプチドのうちユニ. ークなタンパク質を25 個同定し,図 8 でその25 個のタンパク質の経時的な定量結果を示した.その中で もタンパク質のフォールデイングに関与し,熱に対する耐性を形成させる Heat A c tive 状態から 3h で. 上 昇 し 12hで減少する挙動を示した.これらより,H .. shock 70 k D a protein C. は. d u j a r d i n i の乾眠移行メカニ. ズムにはリン酸イ匕レベルではなくプロテオームレベルが関与していると想定された.. 謝辞 本 研 究 を 行 う に あ た り 終 始 暖 か く も 厳 し い ご 指 導 ご 鞭 撻 を 頂 い た 京 都 大 学 大 学 院 薬 学 研 究 科 准 教 授 杉 山 直 幸 氏 ,慶. • メ デ ィ ア 研 究 科 特 任 講 師 荒 川 和 晴 氏 ,慶 應 義 塾 大 学 政 策 •メ デ ィ ア 研 究 科 特 任 助 教 森 大 氏 に . 杉 山 氏 に は 基 礎 か ら プ ロ テ オ ー ム 解 析 を 丁 寧 に ご 指 導 し て 頂 き ま し た . また,本 論 文 を ご 精 読 頂 き 有 用 な コ メ ン ト を 頂 應 義 塾 大 学 政 策. 心より感謝申し上げます. き 深 謝 致 し ま す .本 論 文 審 査 に お い て 貴 重 な ご 指 導 と 飼 育 の た め の ク マ ム シ 及 び デ ー タ ベ ー ス を 提 供 し て く だ さ っ た 荒 川 氏に心より感謝申し上げます. .. 森氏に は ,修士. 借りて感謝の意を述べさせて頂きます. .. 2 年目からアドバイザーとして熱心にご指導とご教示して頂きこの場を. また, 増 田 豪 氏 に は , 高 感 度 分 析 シ ス テ ム を 一 か ら ご 教 示 く だ さ り , 分析カラ. . 「高 感 度 Week」 と 名 が つ く ほ ど 高 感 2 4 時間ご指導してくださり大変感謝しておりま. ムへの試料導入や測定は全て手動で行わなければならず大変お世話になりました 度分析は時間と労力がかかる中で,数週間寝ずにラボに泊まりこみで. .. す. 大沼澄子氏には,実験技術を丁寧にご指導して頂き暖かい激励をくださり実験のことで相談した時には優しくご教. 示してくださり感謝しております. .. 斉藤緑氏には,優しく質問に答えて下さり丁寧に教えて下さりいつも笑顔で研究を応. 接 し て く だ さ り と て も 感 謝 し て お り ま す .緑 氏 と は ブ ロ テ オ ー ム グ ル ー プ に 所 属 す る 前 か ら 知 り 合 い 公 私 共 に お 世 話 に な りました. .. なり修士. く旧プロテオームグループ> いつも素敵な笑顔で癒してくださった五十嵐康行氏,高校生の頃からお世話に 1年の時に一番時間を過ごしたと言っても過言ではないほど, どのコミュニティも被っており兄のような玉木. 聡志氏,私にとって憧れであり頼れるお姉さん的な存在で先輩として学生生活や研究に必要な事をご教示してくださっ. . < 新プロテオームグループ> 可愛い後輩である郭セイ氏と山久保純 • 食 事 な ど を 気 遣 っ て く だ さ っ た こ と に と て も 感 謝 し て お り ま す .郭 氏 と 山 久 保 氏 は 私 に と っ て 可 愛 い 双 子 の 妹 の よ う な 存 在 で 2 人 が プ ロ テ オ ー ム グ ル ー ブ に 来 た こ と を と て も 嬉 し く 思 い ま す .郭 氏 に は 美 味 し い 手料理や笑いや優しさを提供して頂き研究のディスカッション及びプロテオーム部屋の隣として支えあってきました. 山 久 保 氏 は , ウ ラ シ ル や FC フ ァ ラ オ で も 一 緒 で 基 本 的 に コ ミ ュ ニ テ ィ が 重 な っ て お り , 「俺 の 背 中 は 任 せ た 」 と 言 わ れ て か ら 1年 で 急 激 に 仲 良 く な り い つ も 笑 顔 で 優 し く 助 け て く だ さ い ま し た . また, 金 井 昭 夫 氏 の 授 業 は 本 当 に 学 ば せ て た岩崎未央氏,今村春奈氏には感謝しております. 氏は, い つ も 体 調や睡眠. 頂 き 今 ま で の ど の 授 業 よ り も 一 番 成 長 し 楽 し く 過 ご す こ と が 出 来 ま し た .公 私 共 に 親 身 に 相 談 に の っ て い た だ き い つ も 激励をくださり心から感謝申し上げます た. .. 修士. .. 板谷光泰氏には. TAや 授 業 で お 世 話 に な り よ く で る 板 谷 さ ん シ ャ レ が 好 き で し. 1年 春 か ら 2 年 間 は 鶴 岡 キ ャ ン パ ス で 学 び 公 私 と も に 充 実 し た 1年間を過ごす事が出来たのもファミリーのよう • 同 期 • 後 輩 方 , 社 会 人 や FCフ ァ ラ オ の 方 々 の お 陰 で す . 特 に , 尊 敬 す る 廣 瀬 友 香 氏 , 上 瀧 萌 氏 , 伊. な鶴岡在住の先輩. 原 頌 ニ 氏 な く し て は 鶴 岡 生 活 を 過 ご せ な か っ た と 言 っ て も 過 言 で は な い ほ ど お 世 話 に な り ま し た .楽 し い 事 を 分 か ち 合 い, 辛 い 時 に は 支 え て 頂 き , 精 神 的 に 支 え て 頂 き ま し た. .. 心 か ら 感 謝 し て お り ま す .修 士 に な り 廣 瀬 氏 に は 今 ま で 以 上. に濃い関係を築き,辛いことや悩んだ時はお互い励まし合い乗り越えられたのも廣瀬氏のお陰です. .. 本音で語り合い,. 価 値 観 や 感 覚 が 違 っ て い て も 認 め ら れ る 関 係 だ と 思 っ て い ま す .上 瀧 氏 は 後 輩 と は 思 え な い 位 い っ も お 世 話 に な っ て お り, 買 い 物 散 歩 や 卓 球 部 , 早 朝 テ ニ ス 等 企 画 し た 時 や ス ポ ー ツ とうございます. .. DAYと い う 無 茶 ぶ り に も 付 き 合 っ て 下 さ り 本 当 に あ り が. 上 瀧 氏 の 笑 い の ツ ボ が お か し い と 思 い ま す が 私 は 大 好 き で す .誰 よ り も 相 手 を 思 い や り 上 瀧 ワ ー ル ド. に取り込む力を尊敬しております. .. 伊原氏は. 08同 期 代 で あ り , 面 倒 見 の い い お 兄 さ ん で あ っ た り , 末 っ 子 力 を 発 揮 し て. いたり,公 私 と も に 頼 っ て ば か り で 多 く の 事 を 相 談 さ せ て 頂 き ま し た が い つ も 率 直 に 話 し て く だ さ る の で 私 に と っ て 癒 やしの存在でした. .. 美味しいものを沢山食べテニスや卓球, ジ ョ ギ ン グ ス ノ ボ , スラックライン等あらゆるスポーツ. を堪能させて頂きました. .. 深謝しております. また, 充 実 し た 鶴 岡 生 活 を 語 る に は 林. ■. .. 太郎氏,村田真也氏, 田中美穂氏,和田圭介氏, 山本優理氏, 中村浩之氏,. 松浦亜里沙氏なくしては語りきれないほど公私ともにお世話になりました て行ってくださり視野が広がりました. .. .. 鶴岡が庭の林氏には,色々なところに連れ. 我 ら の 「真 也 様 」 で あ る 真 也 様 に は い つ も 見 守 っ て 頂 き 今 ま で 以 上 に. MURATISM を 築 け た と 思 い ま す . 田 中 氏 に は 何 事 に お い て も い つ も 親 身 に 相 談 に の っ て く だ さ り あ り が と う ご ざ い ま し た. .. 和 田 氏 に は 色 々 と 助 け て 頂 き ま し た .山 本 氏 と は し ょ っ ち ゅ う ご 飯 や 買 い 物 に 行 き 語 り 合 い ラ ボ で ず っ と 泊 ま り こ. ん で 研 究 活 動 を 励 ま し 合 い な が ら 行 い ま し た ね .中 村 氏 に は 高 校 生 の 頃 か ら 優 し く し て 頂 き 本 当 に お 世 話 に な り ま し た. .. 松浦氏とは. 1年という短い期間でしたが密度の高い關係で高専メンバーや秋場氏にもお世話になり松浦氏とは出会 . く FCフ ァ ラ オ > い つ も 笑 顔 で 低 ボ イ ス の 夕 日 ハ ウ ス 池 田 氏 , 良 い シ ュ ー ト を 決 め た 時 に 絶 対 褒 め て. えて良かったです. くださる村上氏, 可 愛 ら し く フ ッ ト サ ル が 上 手 な 山 中 氏 , き っ ち り 男 の 約 束 を 果 た し か っ こ い い 上 田 氏 , 美味しいご飯 をつくってくださり山伏や何にでもなれてしまう今野優氏,及び日本酒カクテル製作時に大変お世話になった美女の佐 野陽子氏. , < ス パ イ バ ー 〉明 る く い つ も 可 愛 い 上 原 知 子 氏 , ス ラ ッ ク ラ イ ン や ス ポ ー ツ が 上 手 な 広 田 ち え 氏 , < H M T > , < ラボ棟 > ゲ ノ ム デ ザ イ ン グ ル ー プ に も 関 わ ら ず い つ も 美 味 し い 食 べ 物 の. 常に幹事の大賀氏,渋い声で面白い佐藤基氏. 91.
(10) 情 報 や 差 し 入 れ を く だ さ り 優 し い 富樫 氏 及 び 富 樫 夫 妻 , 美 味 し い 赤 ワ イ ン を 教 え て く だ さ る 中 東 氏 ,. < 事 務 〉 アカペラ. で部活の如く練習を行いしっかりした優しいお姉さんのような大池真紀氏,何事にも積極的でパワフルなお姉さま斉藤 彩氏,癒やしの笑顔を放つ菅原和音氏, イベント毎で全力投球し元気な塩澤明子氏のお陰で彩りのある鶴岡生活を送る ことが出来ました. . < 鶴岡在住生>. 2 階唯一の学生とし . < ウラシル棟 > 窓 辺 の 美 女 で あ り カ タ ラ ー ゼ を し あ. 生年月日と誕生時間まで一緒の正反対の福澤玲奈氏とはラボ棟. て様々な事を語り合い色々な一面をしれてとても楽しかったです. った臼居優希氏, どんな運動にも一緒についてきてくれる可愛い梅田栄美氏, 同期であり修士のことでひよこっとプロ テオーム部屋によく来ており, ご飯にさそってくれる可愛い井内仁志氏,. <BC 生 > ば ば ち や ん ワ ー ル ド 満 載 で と て も 優. しい心の持ち主の馬場千聖氏,色々と語り合った可愛い伊藤優太郎氏,卓球部としていつもやる気に満ち溢れどんな時 にもかけつけてくれる森ひでと氏,がいたお陰で笑いが絶えずカタラーゼすると止まらず学生らしく過ごすことが出来 ました. .. 多くの人に色々なイベントに協力して頂きました. .. こ の 場 を 借 り て 感 謝 申 し 上 げ ま す .愛 情 を 込 め て 育 て て は. すりつぶすといった事を繰り返しましたが,愛 ら し い く り く り お め め の ク マ ム シ に は 大 変 お 世 話 に な り ま し た .本 当にありがとうございます. .. クマムシ研究者及びクマムシのいちファンとして感謝申し上げます. .. また, いつも研究活動. を応援してくださり美味しい食べ物や激励をくださった中舘ファミリー,佐藤ファミリー,長谷部ファミリーには大変 感謝しております. .. 最 後 に な り ま し た が ,研 究 活 動 に 励 む 事 が 出 来 た の も 大 き な 愛 情 で. .. す. 心から感謝の意を表したいと思います. .. 2 4 年間支えてくださった長谷部久美子氏のお陰で. また, こ の よ う な 素 晴 ら し い 研 究 環 境 を 与 え て く だ さ っ た 慶 應 義 塾 大 学 環. 境 情 報 学部冨田勝教授に,厚く御礼申し上げます. .. 參考文献 A ltiero , 1. , Guidetti, R., Caselli,V ., Cesari,M . & R ebecchi,L. Ultraviolet radiation tolerance m hydrated and desiccated eutardigrades. J. Zool. Syst. Evol. Res. 49,104-110 (2011). Bavan, S., Straub, V. A., Blaxter, M. L. & Ennion, S. J. A P2X receptor from the tardigrade species Hypsibius dujardini with fast kinetics and sensitivity to zinc and copper. BMC Evol. B iol.9,17 (2009). Boersema, P. J., Raijmakers, R., Lemeer, S., Mohammed, S. & Heck, A. J. R. Multiplex peptide stable isotope dimethyl labeling for quantitative proteomics. Nat. Protoc. 4 ,4 8 4 4 9 4 (2009). Collins, M. 0 . ,Yu, L. & Choudhary,J. S. Analysis of protein phosphorylation on a proteome-scale. Proteomics 7 ,2751—2768 (2007). Crowe, J. H. Trehalose as a “chemical chaperone”:fact and fantasy. Adv. Exp. Med_ Biol. 594, 143-158 (2007). Crowe, L. M. Lessons from nature: the role of sugars in anhydrobiosis. Comp. Biochem. Physiol. A. Mol. Integr. Physiol. 131, 505513 (2002). Davis, M. T. & Lee, T. D. Rapid protein identification using a microscale electrospray LC/MS system on an ion trap mass spectrometer. J. Am. Soc. Mass Spectrom. 9,194-201 (1998). Dayon, L. et al.Relative quantification of proteins in human cerebrospinal fluids by MS/MS using 6-plex isobaric tags. Anal. Chem. 80,2921-2931 (2008). Dephoure, N. et al.A quantitative atlas of mitotic phosphorylation. Proc. Natl. Acad. Sci. U. S. A. 105,10762-10767 (2008). Dieter, A. bei dem Tardigraden Hypsibius dujardini. Chromosoma 23,203-213 (1967). Emmett, M. R. & Caprioli, R. M. Micro-electrospray mass spectrometry: Ultra-high-sensitivity analysis of peptides and proteins. J. Am. Soc. Mass Spectrom. 5,605-613 (1994). Gabriel,W. N. et al. The tardigrade Hypsibius dujardini, a new model for studying the evolution of development. Dev. Biol. 312, 545-559 (2007). Gatlin, C. L., Kleemann, G. R., Hays, L. G., Link, A. J. & Yates, J. R. Protein identification at the low femtomole level from silverstained gels using a new fritless electrospray interface for liquid chromatography-microspray and nanospray mass spectrometry. Anal. Biochem. 263,93-101 (1998). Greven, H. Comments on the eyes of tardigrades. Arthropod Struct. Dev. 36,401-407 (2007). Guidetti, R., Altiero, T. & Rebecchi, L. On dormancy strategies in tardigrades. J. Insect Physiol.57, 567-576 (2011). Guidetti, R. & Bertolani, R. Tardigrade taxonomy: an updated check list of the taxa and a list of characters for their identification. Zootaxa 845, 1-46 (2005). Guil,N. & Cabrero-Safludo, F. J. Analysis of the species description process for a little toown invertebrate group: the limnoten■故 ^ tardigrades (Bilateria, Tardigrada). Biodivers. Conserv.16,1063-1086 (2007). Hengherr, S., Worland, M. R., Reuner, A., Briimmer, F. & Schill,R. O. Freeze tolerance, supercooling points and ice formation: comparative studies on the subzero temperature survival of limno-terrestrial tardigrades. J. Exp. Biol. 212,802-807 (2009). Hengherr, S., Heyer, A. G., Kohler, H.-R. & Schill,R. O. Trehalose and anhydrobiosis in tardigrades—evidence for divergence in responses to dehydration. FEBS J. 275,281-288 (2008). Hopfgartner, G., Bean, K., Henion, J. & Henry, R. Ion spray mass spectrometric detection for liquid chromatography: A concentration- or a mass-flow-sensitive device? J. Chromatogr. A 647, 51-61 (1993). Horikawa, D. D. et al. Analysis of DNA repair and protection in the Tardigrade Ramazzottius varieornatus and Hypsibius dujardini after exposure to UVC radiation. PLoS One 8, e64793 (2013). HoriKawa, D. D. & Higashi, S. Desiccation tolerance of the tardigrade Milnesium tardigradum collected in Sapporo, Japan, and Bogor, Indonesia. Zoolog. Sci. 21,813-816 (2004). Horikawa, D. D. et al. Establishment of a rearing system of the extremotolerant tardigrade Ramazzottius varieornatus: a new model animal for astrobiology. Astrobiology 8, 549-556 (2008). 92.
(11) Horikawa, D. D. et al.Radiation tolerance in the tardigrade Milnesium tardigradum. Int. J. Radiat. B iol.82, 843-848 (2006). Horikawa, D. D. et al.Tolerance of anhydrobiotic eggs of the Tardigrade Ramazzottius varieornatus to extreme environments. Astrobiology 12,283-9 (2012). Huttlin, E. L. et al.A tissue-specific atlas of mouse protein phosphorylation and expression. Cell 143,1174-1189 (2010). Ishihama, Y., Rappsilber, J., Andersen, J. S. & Mann, M. Microcolumns with self-assembled particle frits for proteomics. J. Chromatogr. A 979,233-239 (2002). JQnsson, K. I. Tardigrades as a potential model organism in space research. Astrobiology 7,757-766 (2007). J6nsson, K. 1.,Rabbow, E” Schill,R. ◦ • ,Harms-Ringdahl,M. & Rettberg, P. Tardigrades survive exposure to space in low Earth orbit. Curr. B iol.18, R729-R731 (2008). Jonsson, K. & Persson, O. Trehalose in three species of desiccation tolerant tardigrades. Open Zool. J .1-5 (2010). Kikawada, T. et al. Dehydration-induced expression of LEA proteins in an anhydrobiotic chironomid. Biochem. Biophys. Res. Commun. 348,56-61 (2006). Kosako, H. et al. Phosphoproteomics reveals new ERK MAP kinase targets and links ERK to nucleoporin-mediated nuclear transport. Nat. Struct. Mol. B io l.16,1026-1035 (2009). Mann, M. & Kelleher, N. L. Precision proteomics: the case for high resolution and high mass accuracy. Proc. Natl. Acad. Sci. U. S. A. 105, 18132-18138 (2008). Masuda, T., Saito, N., Tomita, M. & Ishihama, Y. Unbiased quantitation of Escherichia coli membrane proteome using phase transfer surfactants. Mol. Cell. Proteomics 8,2770-2777 (2009). Masuda, 1., Sugiyama, N., Tomita, M. & Ishihama, Y. Microscale phosphoproteome analysis of 10,000 cells from human cancer cell lines. Anal. Chem. 83,7698-703 (2011). Masuda, T., Tomita, M. & Ishihama, Y. Phase transfer surfactant-aided trypsin digestion for membrane proteome analysis. J. Proteome Res. 7,731-740 (2008). Nakagami, H. et al. Large-scale comparative phosphoproteomics identifies conserved phosphorylation sites in plants. Plant Physiol. 153,1161-1174 (2010). Neumann, S., Reuner, A., Briimmer, F. & Schill,R. O. DNA damage in storage cells of anhydrobiotic tardigrades. Comp. Biochem. Physiol. A. Mol. Integr. Physiol. 153,425^ 29 (2009). Oliver, A. E. et al. Non-disaccharide-based mechanisms of protection during drying. Cryobiology 43,151-167 (2001). Olsen, J. V et al. Quantitative phosphoproteomics reveals widespread full phosphorylation site occupancy dunng mitosis. Sci. Signal. 3, ra3 (2010). Ong,S.-E. et al. Stable isotope labeling by amino acids in cell culture, SILAC, as a simple and accurate approach to expression proteomics. Mol. Cell. Proteomics 1,376-386 (2002). Rappsilber, J., Ishihama, Y. & Mann, M. Stop and go extraction tips for matrix-assisted laser desorption/ionization, nanoelectrospray, and LC/MS sample pretreatment in proteomics. Anal. Chem. 75,663-670 (2003). Rappsilber, J., Mann, M. & Ishihama, Y. Protocol for micro-purification, enrichment, pre-fractionation and storage of peptides for proteomics using StageTips. Nat. Protoc. 2,1896-1906 (2007). Rigbolt, K. T. G. et al. System-wide temporal characterization o f the proteome and phosphoproteome o f human embryonic stem cell differentiation. Sci. Signal.4, rs3 (2011). Right, J. C. W. Cryptobiosis 300 Years on from van Leuwenhoek : What Have We Learned about Tardigrades? Zool. Anzeiger - A J. Comp. Zool. 240,563-582 (2001). Ross, P. L. et al. Multiplexed protein quantitation in Saccharomyces cerevisiae using amine-reactive isobaric tagging reagents. Mol. Cell. Proteomics 3,1154-1169 (2004). Schokraie, E. et al. Proteomic analysis of tardigrades: towards a better understanding of molecular mechanisms by anhydrobiotic organisms. PLoS One 5, e9502 (2010). Stoddard, R. Preserving tardigrades under pressure. 3 9 5 , ( 1 9 9 8 ) . Sugiyama, N. et al. Phosphopeptide enrichment by aliphatic hydroxy acid-modified metal oxide chromatography for nano-LC-MS/ MS in proteomics applications. Mol. Cell. Proteomics 6,1103-1109 (2007). Thompson, A. et a l Tandem mass tags: a novel quantilication strategy for comparative analysis of complex protein mixtures by MS/ MS. Anal. Chem. 75,1895-1904 (2003). Watanabe, M. et al. Physiological traits of invertebrates entering cryptobiosis in a post-embryonic stage. Eur. J. Entomol.101,439444 (2004). Watanaoe, M. et al. Physiological changes leading to anhydrobiosis improve radiation tolerance in Polypedilum vanderplanki larvae. J. Insect Physiol.53, 573-579 (2007). Watanabe, M. et al. Biological effects of anhydrobiosis in an African chironomid, Polypedilum vanderplanki on radiation tolerance. Int. J. Radiat. B iol.82, 587-592 (2006). Westh, P. & Ramlov, H. Trehalose accumulation in the tardigrade Adorybiotus coronifer during anhydrobiosis. J. Exp. Zool. 258, 303-311 (1991). Wiese, S” Reidegeld, K. A., Meyer, H. E. & Warscheid, B. Protein labeling by iTRAQ: a new tool tor quantitative mass spectrometry in proteome research. Proteomics 7, 340-350 (2007). Wilm, M. & Mann, M. Analytical properties of the nanoelectrospray ion source. Anal. Chem. 68 ,1 -8 (1996).. 93.
(12) Yamaguchi, A. et al.Two Novel Heat-Soluble Protein Families Abundantly Expressed in an Anhydrobiotic Tardigrade. PLoS One 7, e44209 (2012). Yamashita, M. & Fenn, J. B. Electrospray ion source. Another variation on the free-jet theme. J. Phys. Chem. 434, 4451-4459 (1984). Zieske, L. R. A perspective on the use of iTRAQ reagent technology for protein complex and profiling studies. J. Exp. Bot. 57,15011508 (2006).. 94.
(13)
Gambar
Dokumen terkait
-。 構造を仮定 蕭2翠反 ̄射高遠雷子回折法 - 一致 Doyle&Tumerのtableを用いて rocking curveを計算(一波条件)
第 2 章 四逆散の抗炎症作用に関する処方解析 【背景・目的】 四逆散は、サイコ ( B ) 、シャクヤク ( P ) 、キジツ ( I ) 、カンゾウ ( G
Difficulty levels of English and for Japanese learners: An acoustic analysis Aya Kitagawa Abstract The present study aimed to examine phonetic and phonological
時間的•空間的データベース Global Schema Pecierated Schema 郎师 油 Approach 二 デ— タベ— 双 n層からなるス メタレペルに キ一マ の ^ ^ Global
Fig.. Baicalein, wogonin, oroxylin A および F-mix の、 iNOS の mRNA およびタンパク発現量に.. 対する影響を Fig..
To advance the state of the art of fault detection and failure recovery for operating systems, this dissertation conducts detailed analysis of faults and error propagations in the
の後に追加で二項目の分析を行った。まずは、写真内容によるいいね数獲得数の違いを分析し、
Adi SM, Simpson AG, Lane CE, Lukes J, Bass D, Bowser SS, Brown MW, Burki F, Dunthom M, Hamol V et al:T h e revised classification of eukaryotes.. Inui H, Miyatake K, Nakano Y,