Vol. 1 (1), 2006, h. 7-12
Sintesis Senyawa Kompleks K[Cr(C
2O
4)
2(H
2O)
2].2H
2O dan
[N(
n
-C
4H
9)
4][CrFe(C
2O
4)
3].H
2O
Kiki Adi Kurnia,1 Djulia Onggo,1 Dave Patrick,2 K. L. Stevenson2 1
Kimia Fisik dan Anorganik, FMIPA ITB Jl. Ganesha 10 Bandung 40132, Indonesia
2
Chemistry Department, Purdue University Fort Wayne, Indiana 46805, Amerika Serikat
Email: djulia@chem.itb.ac.id
Abstrak. Senyawa kompleks K[Cr(C2O4)2(H2O)2].2H2O dan [N(n-C4H9)4][CrFe(C2O4)3].H2O telah
berhasil disintesis. Rumus kimia kedua senyawa tersebut ditentukan dari kadar ion-ion penyusunnya. Ikatan ion oksalat pada ion logam telah diamati dari spektrum IR pada 520–490 cm–1 dan 460–405
cm–1 sedangkan puncak pada 1650–1610 cm–1 dan 810–780 cm–1 menunjukkan peran ion oksalat
sebagai ligan jembatan. Ligan oksalat pada senyawa kompleks terkoordinasi secara oktahedral. Ini diamati dari spektrum elektronik pada daerah sinar tampak. Senyawa [N(n-C4H9)4][CrFe(C2O4)3].H2O
merupakan kompleks polimer yang ditandai dengan hantaran molar yang relatif kecil, sekitar 50-60 μS. Pada suhu ruang, kedua senyawa kompleks bersifat paramagnet. Momen magnet K[Cr(C2O4)2
(H2O)2].2H2O bernilai 3,8 BM sesuai dengan keberadaan tiga elektron tidak berpasangan pada ion
Cr(III). Pengukuran kerentanan magnet senyawa [N(n-C4H9)4][CrFe(C2O4)3].H2O pada rentang 1-300
K menunjukkan bahwa senyawa kompleks ini memiliki interaksi feromagnet, dengan tetapan Weiss + 4,31 dan suhu Curie, Tc, terjadi pada 25 K. Senyawa [N(n-C4H9)4][CrFe(C2O4)3].H2O memberikan
momen magnet maksimum 49 BM pada suhu 1 K.
Kata kunci: ligan oksalat, feromagnet, kompleks polimer, ligan jembatan, paramagnet. Pendahuluan
Ion oksalat merupakan ligan yang istimewa karena mampu membentuk senyawa kompleks dengan berbagai ion logam transisi menghasilkan senyawa dengan sifat dan karakter yang bervariasi. Ion oksalat memiliki empat atom donor namun hanya dua atom yang menjadikannya sebagai ligan bidentat yang berikatan dengan ion logam membentuk senyawa kompleks mono, bis dan tris oksalat. Ion oksalat juga dapat berfungsi sebagai ligan jembatan yang menghubungkan lebih dari satu inti ion logam transisi, baik ion logam yang sejenis maupun berbeda jenis sehingga membentuk kompleks polimer berdimensi satu, dua, bahkan tiga.1 Senyawa kompleks oksalat dengan satu ion
pusat disebut senyawa kompleks mononuklir oksalat dan senyawa kompleks dengan dua ion pusat, baik sama maupun berbeda, disebut senyawa kompleks binuklir oksalat. Struktur ion oksalat dapat dilihat pada Gambar 1.
Senyawa kompleks mononuklir oksalat dengan ion Cr3+ sebagai ion pusatnya menunjukkan sifat thermochromic, yaitu perubahan warna yang
Senyawa kompleks binuklir oksalat memiliki struktur bervariasi yang terdiri dari jaringan ion-ion logam bi- dan tri-valensi berkoordinasi dengan oksalat sebagai ligan jembatan membentuk lapisan-lapisan berdimensi satu sampai tiga. Dengan struktur ini ion oksalat berperan sebagai mediator pertukaran sifat magnet di antara ion-ion logam tersebut.
Gambar 1. Struktur ion oksalat
Senyawa kompleks binuklir-oksalat yang me-miliki sifat magnet unik adalah senyawa kompleks A[M(II)Cr(III)(C2O4)3 ] dengan A adalah kation
N(n-C4H9)4]+, dan M(II) adalah ion logam Co, Ni,
Mn, dan Fe. Senyawa kompleks tersebut bersifat feromagnet dengan suhu Curie, Tc, berkisar antara
6 – 14 K.3 Penggantian ion krom(III) dengan ion
besi (III) membentuk kompleks A[M(II)Fe(III)(CO)] dengan M(II) adalah ion
logam Ni dan Fe, ternyata menunjukkan sifat ferimagnet dengan suhu Neel, TN, pada 28 K dan
43 K.4 Jika M(II) yang digunakan pada senyawa tersebut adalah ion mangan(II), ternyata perilaku antiferimagnet teramati pada suhu sekitar 50 K.
Sintesis kompleks mono dan bi-nuklir dengan ligan oksalat dilakukan untuk mendapatkan infor-masi keterkaitan struktur dan sifat magnet senyawa kompleks yang terbentuk.
Percobaan
Sintesis K[Cr(C2O4)2(H2O)2].2H2O. Pada
pe-nelitian ini, dilakukan dua teknik sintesis senyawa kompleks K[Cr(C2O4)2(H2O)2].2H2O. Pada
meto-de yang pertama, sebanyak 4 gram kalium dikromat dilarutkan dalam 5 mL air mendidih. Setelah larut sempurna, ke dalam larutan ini ditambahkan larutan 12 gram asam oksalat dihidrat dalam 10 mL air mendidih. Larutan didinginkan perlahan hingga terbentuk padatan. Padatan yang terbentuk disaring dengan menggunakan kaca masir dan dicuci menggunakan etanol dingin. Kemudian padatan dikeringkan dalam desikator.
Metode kedua dilakukan dengan jumlah bahan yang sama namun prosedur sintesis berbeda. Asam oksalat dihidrat dan kalium dikromat, keduanya dimasukkan ke dalam mortar dan digerus hingga halus kemudian dipindahkan ke dalam gelas kimia 100 mL dan ditambahkan 5 tetes air panas. Reaksi kimia segera terjadi yang teramati dengan warna larutan menjadi makin gelap. Kemudian sebanyak 20 mL etanol ditambahkan ke dalam larutan tersebut sambil dipanaskan menggunakan pemanas listrik. Pemanasan berlangsung sampai volumenya menjadi setengah dari volume awal. Setelah itu la-rutan didinginkan secara perlahan hingga terbentuk padatan. Padatan yang terbentuk disaring dengan menggunakan kaca masir dan dicuci dengan meng-gunakan etanol dingin. Padatan dikeringkan di dalam desikator.
Sintesis [N(n-C4H9)4][CrFe(C2O4)3].H2O.
Sebanyak 4,87 gram senyawa kompleks K3[Cr(C2O4)3]. 3H2O dimasukkan ke dalam gelas
kimia 100 mL dan dilarutkan dalam 5 mL air. Larutan dipanaskan menggunakan pemanas listrik, dan ke dalam larutan ini ditambahkan 2,78 gram FeSO4.7H2O sambil diaduk hingga semua padatan
melarut. Pada larutan ini ditambahkan 3,23 gram N(n-C4H9)4Br yang telah dilarutkan dengan sedikit
air. Larutan didinginkan perlahan hingga terbentuk padatan yang kemudian dipisahkan dan dicuci dengan air dingin dan dikeringkan dalam desikator.
Hasil dan Pembahasan
Sintesis K[Cr(C2O4)2(H2O)2].2H2O yang
dilaku-kan melalui dua teknik sintesis yang berbeda ternyata menghasilkan dua padatan senyawa kom-pleks yang berbeda. Pada metode yang pertama, dihasilkan padatan berwarna merah-ungu, sedang-kan pada metode yang kedua dihasilsedang-kan padatan berwarna ungu. Padatan berwarna merah-ungu relatif mudah terbentuk tetapi kelarutannya cukup tinggi dalam air sehingga rendeman yang diperoleh hanya 68%. Sedangkan padatan berwarna ungu, relatif sulit terbentuk dan kelarutannya juga cukup tinggi dalam air dan rendemen yang diperoleh berkisar 64%. Hasil analisis unsur dan gugus pe-nyusun kedua senyawa ini tidak menunjukkan perbedaan yang berarti, kedua senyawa tersebut memiliki rumus kimia yang sama dan keduanya merupakan senyawa kompleks mononuklir.
Senyawa kompleks binuklir yang telah di-sintesis berupa serbuk berwarna kuning keemasan, dengan rumus kimia [N(n-C4H9)4][CrFe(C2O4)3].
H2O yang dihitung atas dasar hasil analisis ion dan
gugus pendukungnya. Sintesis senyawa ini relatif lebih sulit dilakukan dibandingkan sintesis senyawa kompleks oksalat mononuklir. Waktu yang diperlukan untuk pembentukan produk lebih lama dan rendemen yang diperoleh relatif rendah yaitu sekitar 32%. Ini disebabkan kelarutan senyawa kompleks yang cukup tinggi dalam air, bahkan dalam air dingin sekalipun. Hasil analisis unsur-unsur penyusun senyawa kompleks terang-kum pada Tabel 1.
Karakterisitik adanya ion oksalat dalam senyawa kompleks dapat diamati dari spektrum inframerah. Pada spektrum inframerah senyawa kompleks mononuklir oksalat, adanya ion oksalat dapat diamati pada bilangan gelombang 1660 cm–1,
dan ikatan ligan oksalat pada ion logam ditunjukkan oleh puncak pada bilangan gelombang 520–490 cm–1and 460–400 cm–1. Selain itu puncak lebar pada 3400-3350 cm-1 mengindikasikan
adanya molekul air. Dalam senyawa kompleks binuklir oksalat, ion oksalat menunjukkan getaran asimetri ν(C=O) pada 1655 cm-1 dan δ(CO) pada
897 cm-1. Vibrasi pada 1650–1610 cm–1dan 810–
780 cm–1 mengindikasikan ion oksalat sebagai
ligan jembatan yang menghubungkan ion-ion logam, dan puncak pada 3300-3500 cm-1
menunjukkan adanya molekul amina kuarterner. Spektrum inframerah ion oksalat bebas, ion oksalat sebagai ligan bidentat dan ion oksalat sebagai ligan jembatan dapat dilihat pada Gambar 2.
Spektrum elektronik ion Cr3+ pada senyawa
kompleks oktahedral menunjukkan dua serapan maksimum pada daerah tampak yaitu pada panjang gelombang 418 nm yang sesuai dengan transisi
4T
2g ←4A2g dan pada 588 nm yang sesuai dengan
transisi 4T
1g ←4A2g. Puncak yang diamati pada
spektrum elektronik kompleks [N(n-bu)4]
[CrFe(C2O4)3].H2O hanya pada 595 nm yang
menunjukkan transisi 4T
1g ←4A2g ion Cr3+ dalam
medan oktahedral. Puncak kedua untuk transisi
4T
2g ← 4A2g tidak teramati karena puncak ini
terhalangi oleh serapan ion Fe2+ yang sangat tinggi
pada panjang gelombang di bawah 400 nm. Spektrum elektronik senyawa kompleks binuklir tersebut dapat dilihat pada Gambar 3.
Senyawa kompleks mononuklir K[Cr(C2O4)2
(H2O)2].2H2O merupakan senyawa ion 1:1
sedangkan binuklir [N(n-C4H9)4][CrFe(C2O4)3].
H2O tidak memiliki daya hantar yang sesuai untuk
senyawa ion, oleh karena itu senyawa binuklir ini disebut kompleks polimer. Data hantaran molar senyawa kompleks dapat dilihat pada Tabel 2.
Padatan ungu larut dalam air menghasilkan larutan berwarna ungu, namun warna larutan ini
segera berubah warnanya menjadi hijau. Demikian pula dengan padatan merah ungu, larut dalam air menghasilkan warna merah, namun warna larutan ini segera berubah menjadi berwarna merah ungu dan akhirnya dihasilkan larutan berwarna hijau gelap. Warna hijau yang dihasilkan adalah warna larutan senyawa kompleks K[Cr(C2O4)3].
Ketidakstabilan kedua senyawa kompleks ini dalam air sesuai dengan hasil yang telah dilaporkan oleh Stevenson.5
Ketidakstabilan senyawa kompleks K[Cr(C2O4)2(H2O)2].2H2O bukan hanya dapat
diamati dalam larutan air saja, namun dapat diamati juga menggunakan parameter waktu. Pada saat awal sintesis, dihasilkan padatan merah ungu mengkilap, yang telah diketahui merupakan senyawa kompleks trans-K[Cr(C2O4)2(H2O)2].
2H2O. Lima bulan kemudian, warna padatan merah
ungu mengkilap telah berubah warnanya menjadi ungu. Hal ini menunjukkan bahwa senyawa kompleks trans-K[Cr(C2O4)2(H2O)2].2H2O relatif
tidak stabil dibandingkan dengan isomernya, cis-K[Cr(C2O4)2(H2O)2].2H2O. Seperti halnya senyawa
kompleks mononuklir oksalat yang tidak stabil Tabel 1. Hasil Analisis Unsur-unsur Penyusun Senyawa Kompleks
Komponen Penyusun (%) Senyawa Kompleks
K+ Cr3+ C
2O42- H2O
Padatan Merah Ungu 10,95
(11,50) 15,25(15,34) 52,25 (51,52) 20,75 (21,24) Padatan Ungu 10,88 (11,50) 15,30(15,34) 53,05 (51,52) 20,55 (21,24) Komponen Penyusun (%) Senyawa Kompleks Cr3+ M2+ C 2O42- C H N [N(n-bu)4][CrCu(ox)3] 8,36 (8,36) 10,15(10,22) 43,43(43,47) 42,45(42,47) 5,77(5,79) 2,25(2,25) Keterangan : Angka dalam kurung menunjukkan perhitungan teoritis
(a) (b) (c).
Gambar 2 Spektrum inframerah (a). asam oksalat. (b) K[Cr(C2O4)2(H 2O)2].2H2O
terhadap parameter waktu, pada senyawa kompleks binuklir juga teramati sifat ini, yaitu pada senyawa kompleks [N(n-C4H9)4][CrFe(C2O4)3].H2O. Pada
awal sintesis, warna padatan senyawa kompleks yang dihasilkan adalah kekuningan. Lima bulan kemudian, warna senyawa kompleks yang dihasilkan telah berubah warnanya, yaitu coklat gelap.
Pengukuran sifat magnet menunjukkan bahwa semua senyawa kompleks bersifat paramagnet pada suhu kamar. Besarnya momen magnet senyawa kompleks K[Cr(C2O4)2(H2O)2].2H2O,
sesuai dengan keberadaan tiga elektron tidak berpasangan pada ion Cr3+ dengan S
Cr = 3/2.
Momen magnet senyawa kompleks [N(n-C4H9)4][CrFe(C2O4)3].H2O lebih besar dibanding
secara teoritis yang dihitung dari efek spin saja. Ini berarti, momen magnet yang dihasilkan bukan hanya disebabkan oleh momen spin saja, tetapi juga dihasilkan dari sumbangan momen orbital. Momen magnet senyawa kompleks dirangkum pada Tabel 3.
Tabel 3. Momen Magnet Senyawa Kompleks µeff (BM) Senyawa Kompleks Teoretis Praktis c-K[Cr(C2O4)2(H2O)2].2H2O 3,87 3,65 t-K[Cr(C2O4)2(H2O)2].2H2O 3,87 3,74 [N(n-C4H9)4][CrFe(C2O4)3] 6,24 6,71
Keterangan: Angka dalam kurung menunjukkan perhitungan teoritis
Hasil pengukuran kerentanan magnet molar senyawa kompleks [N(n-C4H9)4][CrFe(C2O4)3]
menunjukkan bahwa pada rentang 300 – 25 K penurunan suhu menyebabkan kerentanan molar meningkat secara perlahan. Namun, pada suhu sekitar 25 K, penurunan suhu menyebabkan terjadinya lonjakan kenaikan kerentanan molar secara drastis. Ini menunjukkan senyawa kompleks binuklir [N(n-C4H9)4][CrFe(C2O4)3]
memiliki suhu Curie, Tc, yaitu 25 K. Alur
kerentanan magnet terhadap rentang suhu 1 – 300 K dapat dilihat pada Gambar 4.
Gambar 3. Spektrum elektronik senyawa kompleks Tabel 2. Data Hantaran Molar Senyawa Kompleks
Larutan Pelarut (S)* Jumlah
Ion Perbandingan Ion (+ : -)
NaCl air 127,71 2 1 : 1 MgCl2.6H2O air 273,62 3 1 : 2 AlCl3.6H2O air 421,13 4 1 : 3 c-K[Cr(C2O4)2(H2O)2].2H2O MeOH** 124,65 2 1 : 1 t-K[Cr(C2O4)2(H2O)2].2H2O MeOH** 124,76 2 1 : 1 [N(n-C4H9)4][CrCu(C2O4)3] air 52,55 -
-* Nilai hantaran telah dikoreksi terhadap nilai hantaran air. ** Nilai hantaran telah dikoreksi terhadap nilai hantaran metanol.
Gambar 4. Kurva pengaluran kerentanan magnet molar
terhadap suhu.
Pada suhu 25–300 K, kerentanan magnet molar senyawa kompleks [N(n-C4H9)4][CrFe(C2O4)3]
mengikuti hukum Curie-Weiss. Pengaluran 1/(kerentanan magnet) terhadap suhu menghasilkan kurva dengan cekungan ke atas yang menunjukkan interaksi feromagnet pada senyawa kompleks [N(n-C4H9)4][CrFe(C2O4)3]. Dengan
membuat persamaan garis lurus yang melalui kurva pengaluran 1/(kerentanan magnet) terhadap suhu dihasilkan garis dengan persamaan y = 0.0013x – 0,0056. Persamaan garis ini sesuai dengan Persamaan Curie-Weiss 1/χM = T/C – θ/C.
Dari persamaan ini dapat diperoleh nilai tetapan Weiss, θ, sebesar +4,31. Nilai θ yang positif menunjukkan interaksi magnet yang terjadi antar inti ion Cr3+ dan Fe2+ adalah feromagnet. kurva
pengaluran 1/χM terhadap suhu dapat dilihat pada
Gambar 5.
Gambar 5. Kurva pengaluran 1/χM terhadap suhu.
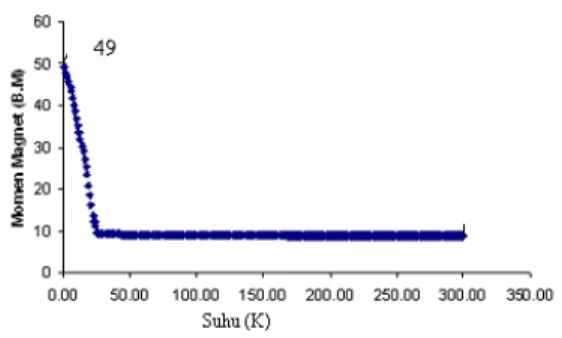
Pada suhu 1 K momen magnet yang dihasilkan sebesar 49 BM. Nilai yang dihasilkan ini jauh lebih besar dibanding dengan nilai momen magnet pada suhu kamar. Ini menunjukkan bahwa pada suhu rendah terjadi interaksi feromagnet. Kurva momen magnet terhadap suhu dapat dilihat pada Gambar 6.
Gambar 6. Pengaluran momen magnet terhadap suhu Kesimpulan
Dari hasil penelitian ini, dapat disimpulkan senyawa kompleks yang berhasil disintesis me-miliki rumus kimia K[Cr(C2O4)2(H2O)2].2H2O dan
[N(n-C4H9)4][CrFe(C2O4)3].H2O. Senyawa
kom-pleks K[Cr(C2O4)2(H2O)2].2H2O memiliki dua
isomer yaitu cis-K[Cr(C2O4)2(H2O)2].2H2O yang
berwarna ungu dan trans-K[Cr(C2O4)2(H2O)2].
2H2O yang berwarna merah-ungu. Padatan isomer
trans-K[Cr(C2O4)2(H2O)2].2H2O dapat berubah
menjadi cis-K[Cr(C2O4)2(H2O)2].2H2O dalam
selang waktu lima bulan. Ini ditandai dari per-ubahan warna padatan senyawa kompleks. Kedua isomer K[Cr(C2O4)2(H2O)2].2H2O larut dalam air
dan larutannya relatif tidak stabil untuk menghasilkan senyawa kompleks K3[Cr(C2O4)3].
Demikian pula dengan ketidakstabilan senyawa kompleks [N(n-C4H9)4][CrFe(C2O4)3].H2O yang
mengalami perubahan warna dari kuning keemasan menjadi coklat tua.
Ikatan antara kedua inti melalui ligan jembatan oksalat telah diamati pada 1650–1610 cm–1 dan 810–780 cm–1. Ligan oksalat terkoordinasi secara
okatahedral pada kedua inti ion logam. Ini di-buktikan dari spektrum elektronik senyawa kompleks binuklir oksalat pada daerah sinar tampak. Senyawa kompleks [N(n-C4H9)4]
[CrFe(C2O4)3].H2O memiliki struktur kompleks
polimer. Ini dibuktikan dari nilai hantaran yang relatif kecil dalam pelarut air, yaitu sekitar 50-60 μS. Semua senyawa kompleks oksalat yang dihasilkan menunjukkan sifat paramagnet pada suhu kamar. Pada suhu rendah, senyawa kompleks binuklir oksalat dengan rumus kimia [N(n-C4H9)4][CrFe(C2O4)3].H2O menunjukkan interaksi
feromagnet dengan Tc terjadi pada 25 K dan nilai
momen magnet 49 BM pada 1 K serta tetapan Weiss + 4,31.
Penghargaan. Penulis mengucapkan terima kasih pada Program Studi Kimia, FMIPA, Institut Teknologi Bandung untuk kesempatan melakukan penelitian, dan pada Chemistry Department, Purdue University, Fort Wayne, Indiana, untuk pengukuran kerentanan magnet pada rentang suhu rendah.
Pustaka
1. Kahn, O; Angew. Chem., Int. Ed. Engl, 1985, 24. 2. Benard, S., Yu, P., Coradin, T., Riviere, E.,
Nakatani, K., Clement, R. Adv. Mater. 1997, 9, 981. 3. Tamaki, H., Zhong, Z. J., Matsumoto, N., Kida, S.,
Koikawa, M., Achiwa, N., Hashimoto Y., Okawa, H. J. Am. Chem. Soc., 1992, 114, 6974-6979. 4. Okawa, H., Matsumoto, N., Tamaki, H., Ohba., M.
Mol. Cryst. Liq. Cryst. 1993, 233, 25.
5. Stevenson, K.L., J.Ing.Nucl.Chem. 1971, 33, 147-151.
![Gambar 2 Spektrum inframerah (a). asam oksalat. (b) K[Cr(C 2 O 4 ) 2 (H 2 O) 2 ].2H 2 O (c) [N(n- C 4 H 9 ) 4 ][CrFe(C 2 O 4 )3].H 2 O](https://thumb-ap.123doks.com/thumbv2/123dok/4418366.2960045/3.918.143.790.135.600/gambar-spektrum-inframerah-asam-oksalat-k-cr-crfe.webp)
![Tabel 3. Momen Magnet Senyawa Kompleks µ eff (BM)Senyawa Kompleks Teoretis Praktis c-K[Cr(C 2 O 4 ) 2 (H 2 O) 2 ].2H 2 O 3,87 3,65 t-K[Cr(C 2 O 4 ) 2 (H 2 O) 2 ].2H 2 O 3,87 3,74 [N(n-C 4 H 9 ) 4 ][CrFe(C 2 O 4 ) 3 ] 6,24 6,71 Keterangan: Angka dalam k](https://thumb-ap.123doks.com/thumbv2/123dok/4418366.2960045/4.918.257.673.128.356/magnet-senyawa-kompleks-senyawa-kompleks-teoretis-praktis-keterangan.webp)