POLA KERAGAMAN GENETIK TANAMAN KUNYIT
(Curcuma longa
xanthorrhiza
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN AL
POLA KERAGAMAN GENETIK TANAMAN KUNYIT
Curcuma longa Linn.) DAN TEMULAWAK (Curcuma
xanthorrhiza Roxb.) ASAL PULAU JAWA DENGAN
PCR-RAPD
NUR AENY PRIHATIN
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN AL
INSTITUT PERTANIAN BOGOR
BOGOR
2013
POLA KERAGAMAN GENETIK TANAMAN KUNYIT
Curcuma
DENGAN
ABSTRAK
NUR AENY PRIHATIN. Pola Keragaman Genetik Tanaman Kunyit (Curcuma
longa Linn.) dan Temulawak (Curcuma xanthorrhiza Roxb.) Asal Pulau Jawa
dengan PCR-RAPD. Dibimbing oleh LAKSMI AMBARSARI dan WARAS
NURCHOLIS.
Tanaman kunyit (Curcuma longa Linn.) dan temulawak (Curcuma
xanthorrhiza Roxb.) merupakan tanaman obat Indonesia yang berkhasiat untuk
meningkatkan kesehatan tubuh. Pola keragaman genetik dan hubungan
kekerabatan kedua tanaman rimpang ini belum banyak diketahui. Penelitian ini
bertujuan menganalisis pola keragaman genetik kedua tanaman dan hubungan
kekerabatannya dengan Polymerase Chain Reaction-Random Amplified
Polymorhic DNA (PCR-RAPD). Sampel yang digunakan dalam penelitian ini
adalah enam tanaman kunyit yang berasal dari Bogor, Wonogiri, Karanganyar,
Sukabumi, dan Ngawi; serta lima tanaman temulawak yang berasal dari Bogor,
Wonogiri, Karanganyar, Sragen dan Sukabumi. Tahapan penelitian ini meliputi
isolasi DNA, amplifikasi DNA serta analisis pola keragaman genetik dan
hubungan genetik dengan NTSYS 2.02. Hasil penelitian menunjukkan bahwa
isolasi DNA kunyit dan temulawak berhasil dilakukan dengan nilai kemurnian
kunyit dan temulawak secara berurutan adalah 1.093-1.417 dan 1.044-1.544.
Jumlah pita yang muncul dari amplifikasi DNA kunyit dan temulawak
masing-masing 131 dan 132 lokus. Jumlah pita hasil amplifikasi yang beragam dan
ukuran yang berbeda pada tiap sampel menunjukkan pola keragaman genetik yang
terdapat pada tanaman kunyit dan temulawak. Koefisien kemiripan genetik
tanaman kunyit dan temulawak secara berurutan 54%-92% dan 55%-83%.
Hubungan kekerabatan terdekat ditunjukkan oleh tanaman kunyit asal Sukabumi
dengan Ngawi dan tanaman temulawak asal Bogor dan Sukabumi.
Kata kunci : Kunyit (Curcuma longa Linn.), temulawak (Curcuma xanthorrhiza
Roxb.), RAPD.
ABSTRACT
NUR AENY PRIHATIN. The Pattern of Genetic Diversity of Origin Java Island
Turmeric (Curcuma longa Linn.) and Temulawak (Curcuma xanthorrhiza Roxb.)
with PCR-RAPD. Under direction of LAKSMI AMBARSARI and WARAS
NURCHOLIS.
Turmeric (Curcuma longa Linn.) and Temulawak (Curcuma xanthorrhiza
Roxb.) are Indonesian medicinal plants which nutritious for improving health. The
pattern of genetic diversity and genetic relationship of these rhizome plants are
not well known yet. The purpose of this research to analyze the pattern of genetic
diversity and genetic relationship both plants using Polymerase Chain
Reaction-Random Amplified Polymorhic DNA (PCR-RAPD). The sample used in this
research include 6 turmeric plants from Bogor, Wonogiri, Karanganyar, Sukabumi
and Ngawi; and 5 temulawak plants from Bogor, Wonogiri, Sragen, Karanganyar
and Sukabumi. Stage of these research include DNA isolation; DNA
amplification; and analysis pattern of genetic diversity and genetic relationship
using NTSYS 2.02. The result of these research showed that isolation DNA was
done successfully. The result of DNA isolation generally has a fairly good purity.
The purity values of turmeric and temulawak in sequence were 1.093-1.417 and
1.044-1.544. The number of bands that arise from DNA amplification of turmeric
and temulawak in sequence were 131 and 132 locus. The number of amplification
bands mixed results and different sizes for each sample show the patterns of
genetic diversity found in turmeric and temulawak plants. The closest genetic
relationship showed by turmeric plants from Sukabumi and Ngawi; and
temulawak plants from Bogor and Sukabumi. Genetic similarity coefficient
ranged from turmeric plants and temulawak plants in sequence are 54%-92% and
55 %-83 %.
Keywords : Turmeric (Curcuma longa Linn.), temulawak (Curcuma xanthorrhiza
Roxb.), RAPD.
POLA KERAGAMAN GENETIK TANAMAN KUNYIT
(Curcuma longa Linn.) DAN TEMULAWAK (Curcuma
xanthorrhiza Roxb.) ASAL PULAU JAWA DENGAN
PCR-RAPD
NUR AENY PRIHATIN
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2013
Judul Skripsi : Pola Keragaman Genetik Tanaman Kunyit (Curcuma longa
Linn.) dan Temulawak (Curcuma xanthorrhiza Roxb.) Asal Pulau
Jawa dengan PCR-RAPD
Nama
: Nur Aeny Prihatin
NIM
: G84080029
Disetujui,
Komisi Pembimbing
Dr. Laksmi Ambarsari, MS.
Waras Nurcholis, M. Si.
Ketua
Anggota
Diketahui,
Dr. Ir. I Made Artika, M. App. Sc.
Ketua Departemen Biokimia
PRAKATA
Puji dan syukur penulis panjatkan atas kehadirat Allah Yang Maha Esa
yang telah menganugerahkan berkat dan rahmat-Nya sehingga karya ilmiah ini
dapat terselesaikan dengan baik. Penelitian dilakukan di Laboratorium Penelitian
Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut
Pertanian Bogor, Dramaga, Bogor. Adapun judul dari karya ilmiah ini adalah Pola
Keragaman Genetik Tanaman Kunyit (Curcuma longa Linn.) dan Temulawak
(Curcuma xanthorriza Roxb.) Asal Pulau Jawa dengan PCR-RAPD.
Ucapan terima kasih penulis sampaikan kepada Dr. Laksmi Ambarsari
MS. selaku pembimbing utama dan Waras Nurcholis, M.Si. selaku pembimbing
anggota atas bimbingan, arahan dan masukan yang diberikan kepada penulis
selama penelitian dan penyusunan karya ilmiah ini. Penulis juga mengucapkan
terima kasih kepada Popi Asri Kurniatin, S.Si., Apt., M.Si., Pak Nana, Pak Yadi,
Bu Merry, Bu Tini, Bu Tuti, Pa Arya, Bu Retno, Pa Erik dan Mba Eli yang telah
banyak membantu penulis. Terima kasih juga penulis sampaikan kepada Grahan,
Annisa, Riani, Adit, Rian, Faris, Yuanita, An-Nisa, Lusi atas dukungan dan
semangat yang diberikan. Rasa terima kasih yang begitu besar juga penulis
sampaikan kepada orang tua penulis tercinta atas segala dukungan, bantuan dan
doa yang telah diberikan untuk kelancaran kegiatan ini. Ucapan terima kasih juga
penulis sampaikan kepada PT. Indofood Sukses Makmur Tbk. sebagai donatur
beasiswa BISMA, Yayasan Karya Salemba Empat, dan Paguyuban KSE IPB yang
sangat membantu kelancaran masa perkuliahan dan DIKTI yang membantu
penyelesaian tugas akhir penulis.
Bogor, Februari 2013
RIWAYAT HIDUP
Penulis dilahirkan di kota Bogor, pada tanggal 28 Mei 1990. Penulis
merupakan anak kedua dari pasangan Utay Hidayat dan Uun Karsunah.
Penulis bersekolah dasar di SDN Tanah Sareal 1 selama 6 tahun, terhitung
tahun 1996 hingga 2002. Sekolah menegah pertama penulis adalah SMPN 8
Bogor. Selanjutnya, penulis melanjutkan sekolah menegah atas di SMAN 2 Bogor
dan menempuh jalur USMI IPB pada tahun 2008, tepatnya di Departemen
Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Kegiatan yang penulis lakukan selama perkuliahan di antaranya menjadi
asisten praktikum Kimia Dasar pada tahun 2010, asisten praktikum Biokimia
Umum pada tahun 2012, asisten praktikum Teknologi Asam Nukleat, dan
Metabolisme pada tahun yang sama. Selain itu, penulis juga menjadi pengajar di
salah satu bimbingan belajar khusus untuk mahasiswa, pengajar privat siswi SD
dan SMA. Penulis juga melakukan praktik lapangan yang bertempat di
Laboratorium Mikrobiologi, LIPI, Cibinong pada tahun 2011 dengan judul
Seleksi dan Identifikasi Isolat Bakteri Proteolitik serta Uji Aktivitas Enzim
Protease yang Dihasilkan.
Organisasi yang penulis ikuti adalah himpunan mahasiswa Biokimia,
FMIPA, IPB, yakni CREBs pada tahun 2011 sebagai staf divisi CIC
(Communication and Information Center). Selain itu, penulis merupakan anggota
dari paguyuban Karya Salemba Empat IPB pada tahun 2009 hingga 2012.
Kepanitiaan yang penulis ikuti adalah Lomba Karya Ilmiah Populer tingkat SMA
se-Indonesia dalam acara Pesta Sains FMIPA IPB pada tahun 2010; Seminar
Kesehatan Nasional dan Launching buku “Teknik Penelitian Biokimia” oleh Prof.
Dr. drh. Maria Bintang, MS., dan Biokimia Fair. Tahun 2011, penulis
mendapatkan dana hibah dari DIKTI untuk karya tulis kategori kewirausahaan
pada ajang Program Kreativitas Mahasiswa (PKM). Karya tulis tersebut berjudul
Bakso Talas EROT (Enak Rasanya Ok Tempatnya) sebagai Alternatif Makanan
Bergizi Khas Bogor.
DAFTAR
ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Kunyit (Curcuma longa Linn.) ... 2
Temulawak (Curcuma xanthorrhiza Roxb.)... 3
Polymerase Chain Reaction (PCR) ... 3
Random Amplified Polymorphic DNA (RAPD) ... 4
BAHAN DAN METODE
Alat dan Bahan ... 5
Metode ... 5
HASIL DAN PEMBAHASAN
DNA Genom ... 7
Kuantifikasi DNA Genom………... 9
Amplikon RAPD ... 9
Matriks Kemiripan Genetik ... 11
Filogenetik ... 11
SIMPULAN DAN SARAN
Simpulan ... 12
Saran ... 13
DAFTAR PUSTAKA ... 13
DAFTAR TABEL
Halaman
1
Matriks kemiripan genetik enam tanaman kunyit lokal ... 11
2
Matriks kemiripan genetik lima tanaman temulawak lokal ... 11
DAFTAR GAMBAR
Halaman
1
Tanaman kunyit (Curcuma longa Linn.) ... 3
2
Tanaman temulawak (Curcuma xanthorrhiza Roxb.) ... 3
3
Reaksi PCR-RAPD ... 5
4
Elektroforegram pita DNA temulawak C
3(Bogor) dengan modifikasi ... 7
5
Elektroforegram pita DNA ... 8
6
Elektroforegram amplikon DNA tanaman kunyit ... 10
7
Elektroforegram amplikon DNA tanaman temulawak ... 10
8
Pohon filogenetik tanaman kunyit ... 12
9
Pohon filogenetik tanaman temulawak ... 12
DAFTAR LAMPIRAN
Halaman
1
Strategi penelitian ... 17
2
Bagan alir modifikasi metode isolasi DNA ... 18
3
Hasil analisis kuantitatif DNA kunyit dan temulawak ... 21
4
Data jumlah amplikon kunyit ... 22
5
Data jumlah amplikon temulawak ... 23
6
Bobot molekul DNA genom tanaman kunyit dan temulawak ... 24
PENDAHULUAN
Indonesia merupakan negara mega biodiversitas. Flora dan fauna yang terdapat di Indonesia sangat beragam. Iklim Indonesia yang tropis menunjang pertumbuhan berbagai organisme, termasuk tanaman obat (Indena 2002). Tanaman obat umumnya diolah secara tradisional dan dibuat menjadi jamu. Dua jenis tanaman obat yang termasuk ke dalam resep jamu tradisional adalah kunyit dan temulawak. Kunyit dan temulawak merupakan tanaman yang termasuk ke dalam famili Zingiberaceae atau jahe-jahean. Khasiat utama dari kedua tanaman ini adalah meningkatkan kesehatan tubuh (Pribadi 2009).
Kunyit merupakan tanaman rimpang yang mudah ditemukan. Hampir di sebagian wilayah di Indonesia terdapat tanaman kunyit. Keragaman kunyit di Indonesia sangat tinggi. Hal ini dibuktikan dengan adanya penelitian yang dilakukan oleh Jan et al. (2011) yang mengemukakan bahwa Indonesia sekurang-kurangnya memiliki 40 jenis spesies tanaman kunyit. Berbagai penelitian yang mengkaji tanaman ini telah banyak dilakukan. Sebagian besar penelitian yang telah ada bertujuan menganalisis khasiat dari tanaman ini. Bagian yang umum digunakan adalah rimpang kunyit. Penelitian yang mengulas metabolit yang terkandung dalam rimpang kunyit menunjukkan bahwa senyawa kurkuminoid yang terdapat pada kunyit memiliki berbagai peranan penting dalam bidang pengobatan. Aggarwal et al. (2005) menyatakan bahwa kurkuminoid memiliki kemampuan sebagai antikanker. Selain itu, kurkuminoid berperan sebagai antifungal (Indena 2002).
Tidak jauh berbeda dengan kunyit, temulawak telah banyak dieksplorasi dan diteliti terkait peranannya sebagai obat tradisional. Rimpang temulawak mengandung senyawa kurkuminoid dan xanthorizol. Kedua senyawa ini berperan sebagai antibakteri, antioksidan, antitumor, antidiabetik, antiinflamasi, antihepatotoksik, diuretika, depresan dan hipolipidemik (Raharjo & Rostiana 2003). Selain itu, temulawak dapat membantu perbaikan fungsi hati serta menurunkan kadar SGPT (Serume Glutamate
Piruvate Transferase) dan SGOT (Serume
Glutamate Oxaloacetate Transferase)
(Hadipoentyanti & Syahid 2001).
Kunyit dan temulawak memiliki lokasi sentra budi daya yang berada di Pulau Jawa. Lokasi sentra budi daya kunyit terdapat di Jawa Tengah (Warintek 2005). Lokasi sentra budi daya temulawak sulit ditentukan karena
umumnya ditanam secara konvensional dan hampir ditemukan di dataran sedang dan tinggi yang teduh (sekitar 5 hingga 1000 m/dpl) (BPPT 2010). Perbedaan lokasi ini akan mempengaruhi jumlah metabolit sekunder yang terkandung pada tanaman. Hal ini disebabkan adanya perbedaan iklim seperti curah hujan; media tanam; dan ketinggian tempat (Nurcholis 2008). Selain faktor lingkungan, kadar metabolit dalam suatu tanaman dipengaruhi oleh pola genetik tertentu (Hayakawa et al. 2011).
Khasiat dari tanaman kunyit dan temulawak telah dibuktikan dan diakui. Namun, pengetahuan yang terkait genetika dari kedua tanaman ini belum banyak diketahui. Pengetahuan mengenai genetika tanaman penting untuk pemuliaan tanaman dan eksplorasi terhadap tanaman tersebut. Oleh sebab itu, diperlukan penelitian yang mengulas tentang genetika dari kedua tanaman rimpang ini. Langkah awal dari pembukaan pengetahuan mengenai genetika tanaman kunyit dan temulawak adalah mencari pola genetik kedua tanaman tersebut dan hubungan kekerabatan dari berbagai tanaman kunyit dan temulawak yang ditanam pada lokasi yang berbeda.
Penelitian mengenai genetika umumnya dilakukan dengan penanda molekular. Penanda molekular merupakan teknik yang digunakan untuk menganalisis genom suatu tanaman berbasis reaksi PCR. Penanda molekular yang umum digunakan di antaranya
Restriction Fragment Length Polymorphism
(RFLP), Amplified Fragment Length Polymorphism (AFLP), Random Amplified Polymorphism DNA (RAPD), dan Simple Sequence Repeat (SSR) (Santos 2000). Teknik
RAPD merupakan teknik yang paling mudah digunakan dibanding teknik lainnya. Teknik RAPD tidak memerlukan enzim restriksi untuk memotong fragmen DNA (Deoxiribose
Nucleic Acid) yang akan diamplifikasi seperti
pada teknik RFLP dan AFLP. Teknik RAPD juga tidak memerlukan senyawa pelabel untuk hasil amplifikasi. Selain itu, biaya yang diperlukan tidak terlalu besar, tidak memerlukan informasi tentang genom yang akan dianalisis dan dapat menghasilkan polimorfisme DNA yang banyak karena primer yang digunakan bersifat acak (NCBI 2011).
Penelitian ini akan menganalisis pola keragaman genetik enam tanaman kunyit dan lima tanaman temulawak yang berasal dari berbagai daerah menggunakan teknik PCR-RAPD dengan primer OPA, OPB, OPC dan
OPD (11-15) serta menganalisis hubungan kekerabatan antar tanaman kunyit dan antar tanaman temulawak. Sebelumnya telah dilakukan amplifikasi tanaman kunyit dan temulawak dengan primer OPA-OPD 01-05 (Utami 2012), 06-10 (Prahaditya 2013) dan 16-20 (Meryalita 2012). Pemilihan primer OPA hingga OPD didasarkan pada penelitian Jan et al. (2011) yang berhasil mengamplifikasi tanaman kunyit lokal Pakistan dengan primer tersebut. Tanaman kunyit yang digunakan berasal dari Bogor, Wonogiri, Karanganyar, Sukabumi dan Ngawi. Temulawak yang digunakan berasal dari Bogor, Wonogiri, Karanganyar, Sragen dan Sukabumi. seluruh tanaman yang digunakan ditanam di kebun percobaan Pusat Studi Biofarnaka. Hipotesis dari penelitian ini adalah pola keragaman genetik tanaman kunyit dan temulawak yang berasal dari berbagai daerah dapat dianalisis dengan RAPD dan dapat ditemukan hubungan kekerabatannya. Pola genetik dapat dimanfaatkan untuk mencari hubungan genetik melalui konstruksi suatu pohon filogenetik. Selain itu, pola genetik yang diperoleh dapat dijadikan sebagai dasar untuk penelusuran asal suatu tanaman kunyit dan temulawak dengan marka ini.
TINJAUAN PUSTAKA
Kunyit (Curcuma longa Linn.) Klasifikasi kunyit secara taksonomi meliputi divisi, kelas, ordo, famili (keluarga), genus dan spesies. Kunyit termasuk ke dalam divisi Spermatophyta dan subdivisi Angiospermae. Kunyit berada dalam kelas Monocotyledonaeae. Kunyit berordo Zingiberales. Kunyit berasal dari keluarga Zingiberaceae. Genus dari tanaman rimpang ini adalah Curcuma. Spesies kunyit terdiri dari Curcuma longa dan Curcuma domestica (Akram et al. 2010).
Tanaman kunyit (Gambar 1) tumbuh dengan tinggi mencapai 40-100 cm. Tanaman ini memiliki batang semu, berbatang bulat, tegak, dan membentuk rimpang. Batang kunyit berwarna hijau kekuningan dan disusun oleh pelepah daun. Daun tanaman ini tunggal, berbentuk bulat telur memanjang dengan ukuran 10-40 cm dengan lebar 8-12.5 cm. Tulang daun menyirip dengan warna hijau pucat. Bagian ujung dan pangkal daun meruncing. Tepi daun rata. Bunga kunyit majemuk, berambut dan bersisik dari pucuk hingga batang semu. Mahkota bunga kunyit
berukuran 3 cm dan lebar 1.5 cm. Mahkota bunga berwarna putih atau kekuningan. Kulit luar rimpang berwarna jingga kecoklatan. Daging buah berwarna merah jingga kekuningan (Rahardjo & Rostiana 2005).
Kunyit ditemukan di Asia Selatan dan Asia Tenggara. Beberapa spesies tanaman ini ditemukan di Cina, Australia, dan selatan Pasifik. Keragaman kunyit yang tinggi ditemukan pada dua negara, yakni India dan Thailand. Negara lain seperti Burma, Bangladesh, Indonesia dan Vietnam sekurang-kurangnya memiliki 40 spesies tanaman kunyit (Jan et al. 2011). Tanaman kunyit juga ditemukan di daerah Kasur, Sahiwal dan Okara, Punjab dan Bannu, daerah Pubbi dan Haripur di provinsi Khyber Pakhtunkhwa, Pakistan (Shinwari 2010). Kunyit di Indonesia dapat ditemukan dengan mudah di Jawa Timur dan Jawa Barat (Rahardjo & Rostiana 2005).
Kunyit mengandung berbagai senyawa bioaktif, di antaranya kurkuminoid, berbagai minyak volatil, flavonoid, karbohidrat, protein dan resin (Akram et al. 2010). Kurkuminoid kunyit terdiri atas tiga bentuk isomer, yakni demetoksi kurkumin, bisdemetoksi kurkumin dan kurkumin. Minyak volatil kunyit terdiri atas tueron, atlanton, dan zingiberon (Araujo & Leon 2001).
Tanaman kunyit telah banyak dimanfaatkan oleh manusia. Akar kunyit dapat dijadikan sebagai bubuk yang digunakan untuk bahan pewarna, termasuk untuk obat. Kunyit memiliki peranan penting dalam sektor industri, yakni sebagai pengganti pewarna sintetik (Rahardjo & Rostiana 2005). Selain itu, minyak kunyit dapat berperan sebagai antifungal, antiflatulence dan
antiplatelet. Senyawa bioaktif yang memiliki
ketiga fungsi tersebut adalah karminatif (Lee 2006). Selain karminatif, minyak kunyit mengandung beberapa senyawa monoterpen dan seskuiterpen lain seperti zingiberen, arturmeron dan turmeron (Rahardjo & Rostiana 2005).
Kunyit memiliki senyawa kurkumin yang sangat bermanfaat. Kurkumin memiliki kemampuan sebagai antikanker kolon (Reddy & Rao 2002) dan payudara (Ramachandaran
et al. 2002). Kurkumin dapat berperan sebagai
agen kemoterapi untuk kanker kolon (Chauhan 2002), kanker payudara (Somasundaram et al. 2002) dan kanker prostat (Dorai et al. 2001). Selain sebagai antikanker, kurkumin juga berperan dalam menurunkan kadar kolesterol darah, menghambat oksidasi LDL (low density lipid),
menghambat agregasi keping darah, menghambat proliferasi sel otot polos, menghambat infraksi miokardial, menekan diabetes dan menstimulasi regenerasi otot. Bahkan, kurkumin dapat bertindak sebagai inhibitor Human Immunodeficiency Virus
Type 1 (HIV-1) integrase (Aggarwal et al.
2005).
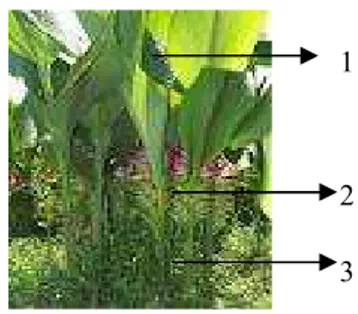
Gambar 1 Tanaman kunyit (Curcuma longa Linn.) meliputi daun (1); dan batang (2) (foto pribadi)
Temulawak (Curcuma xanthorrhiza Roxb.) Tanaman temulawak tersebar di daerah Asia Tenggara. Negara tempat ditemukannya temulawak meliputi Cina, IndoCina, Bardabos, India, Jepang, Korea, Amerika Serikat dan sebagian negara Eropa. Temulawak juga dapat ditemui dengan mudah di Indonesia (BPPT 2010). Wilayah pengembangan temulawak di Indonesia meliputi 13 provinsi, yakni Sumatera Utara, Riau, Jambi, Daerah Khusus Ibu kota Jakarta, Jawa Barat, Jawa Tengah, Jawa Timur, Daerah Istimewa Yogyakarta, Bali, Kalimantan Barat, Kalimantan Timur, Sulawesi Utara dan Sulawesi Selatan (Rahardjo 2010).
Klasifikasi temulawak (taksonomi) meliputi divisi, subdivisi, kelas, ordo, famili, genus dan spesies. Temulawak termasuk ke dalam divisi Spermatophyta. Berada dalam subdivisi Angiospermae. Temulawak menempati kelas Monocotyledonae. Temulawak memiliki famili Zingiberaceae, genus Curcuma dan spesies Curcuma xanthorrhiza Roxb (BPPT 2010).
Tanaman temulawak (Gambar 2) memiliki tinggi mencapai 1 meter. Tanaman ini berbatang semu dengan warna hijau atau coklat gelap. Akar rimpangnya terbentuk sempurna dengan cabang yang kuat dan warna hijau gelap. Daunnya tumbuh pada bagian batang sebanyak dua hingga sembilan helai tiap batang. Daun temulawak berbentuk bundar memanjang dan berwarna hijau atau coklat keunguan terang hingga gelap. Panjang
daun temulawak mencapai 31-84 cm dengan lebar antara 10-18 meter. Tanaman temulawak memiliki perbungaan lateral. Tangkai bunga temulawak ramping dan bersisik. Panjang tangkai bunga mencapai 9-23 cm dengan lebar 4-6 cm. Kelopak bunga sepanjang 8-13 mm, berwarna putih, berbulu, berbentuk tabung dengan panjang mencapai 4.5 cm secara keseluruhan. Warna helaian bunga temulawak adalah putih dengan bagian ujung berwarna merah, berbentuk bundar, dan panjang mencapai 1.25-2 cm dan lebar 1 cm (BPPT 2010).
Kandungan senyawa bioaktif utama temulawak adalah kurkumin. Namun, berbeda halnya dengan kunyit. Temulawak hanya memiliki dua bentuk isomer kurkumin, yakni demetoksikurkumin dan kurkumin. Selain itu, temulawak pun mengandung minyak atsiri, pati dan protein. Minyak atsiri dari temulawak meliputi felandren, kamfer, borneol, sineal dan xantorizol (Rahardjo & Rostiana 2003).
Temulawak sering dimanfaatkan sebagai obat tradisional. Berdasarkan Hadipoentyanti dan Syahid (2001), masyarakat telah banyak menggunakan rimpang temulawak sebagai bahan baku pembuatan obat untuk penyakit liver. Secara klinis, temulawak membantu perbaikan fungsi hati, serta menurunkan kadar SGPT dan SGOT. Selain itu, temulawak dapat dijadikan sebagai pewarna alami, minuman yang bermanfaat dalam meningkatkan imunitas tubuh. Temulawak berperan sebagai antimikrob (Wibowo et al. 2012), antitumor, antidiabetik, antioksidan, antiinflamasi, antihepatotoksik, diuretika, depresan, dan hipolipodemik (Purnomowati 2008).
Gambar 2 Tanaman temulawak (Curcuma
xanthorrhiza Roxb.) meliputi daun (1); bunga (2); dan batang (3) (foto pribadi)
Polymerase Chain Reaction (PCR)
Polymerase Chain Reaction (PCR)
adalah metode molekuler yang dimanfaatkan untuk menggandakan DNA secara in vitro. Penggandaan DNA ini dilakukan dengan 1
2
1
2
menggunakan enzim dan sepasang primer. Primer yang digunakan bersifat spesifik terhadap DNA target. Dengan metode PCR, penggandaan DNA dapat dilakukan dengan lebih cepat. Hal ini termasuk salah satu keuntungan yang ditawarkan dari metode PCR. Konsep metode PCR awalnya diajukan oleh Khorana pada tahun 1970an. Penerapan teknik PCR sendiri dilakukan pertama kali oleh Kary Mullis pada tahun 1983 (Bartlett & Stirling 2010).
Secara umum, PCR melibatkan beberapa tahapan reaksi. Tahapan reaksi tersebut meliputi tahap denaturasi, tahap annealing dan tahap elongasi. Tahap denaturasi merupakan tahap pemisahan utas ganda DNA menjadi utas tunggal pada suhu tinggi. Suhu yang umum digunakan berkisar antara 940 C hingga 960 C. Utas tunggal tersebut kemudian akan menjadi DNA cetakan untuk proses transkripsi. Tahap annealing adalah tahap penempelan primer pada bagian DNA cetakan. Primer akan menempel secara spesifik pada fragmen DNA cetakan, yakni menempel pada fragmen DNA cetakan yang komplemen dengan urutan basa primer. Tahap ini umumnya dilakukan pada suhu antara 450 C hingga 600 C. Primer universal yang umum digunakan adalah 20F dan 1500R. Tahap elongasi adalah tahap pemanjangan primer menjadi utas baru DNA dengan bantuan enzim DNA polimerase (Sambrook & Russel 2001). DNA polimerase umumnya bersifat tahan panas sehingga dapat digunakan dengan baik untuk PCR. Umumnya, enzim DNA polimerase yang tahan panas diisolasi dari bakteri termofilik atau hipertermofilik. Contoh dari enzim DNA polimerase yang sering digunakan adalah Taq polimerase (Carroll & Casimir 2010). Taq polimerase diisolasi dari
Thermus aquaticus yang termasuk ke dalam
golongan arkea termofilik (Brown 2007). Prinsip dasar PCR sama seperti mekanisme replikasi DNA yang terjadi di dalam sel. Saat awal proses PCR, utas ganda DNA diurai menjadi utas tunggal. Kedua utas tunggal yang terbentuk akan menjadi cetakan untuk pembentukan DNA baru. Selanjutnya, primer menempel pada utas tunggal DNA cetakan dan primer diperpanjang oleh enzim DNA polimerase sehingga terbentuk dua utas ganda baru DNA. Umumnya, siklus PCR terus diulang sebanyak 25 hingga 30 kali. Seiring dengan penambahan jumlah siklus PCR, jumlah DNA hasil amplifikasi akan bertambah secara logaritmik. Selanjutnya, PCR akan mengalami fase pendinginan DNA pada suhu 40C dalam waktu yang tidak
terbatas (Hofreiter et al. 2010). Komponen PCR meliputi DNA cetakan dengan konsentrasi antara 1 pg hingga 1 µg, Mg2+ dengan konsentrasi 1.5 mM, dNTP dengan konsentrasi 200 mM, sepasang primer dengan konsentrasi masing-masing 1 µM, DNA polimerase sebanyak 1 hingga 5 subunit dan larutan buffer dengan pH 8.3 (Grunenwald 2010).
Selain PCR, marka molekul lain yang dapat digunakan untuk penggandaan DNA adalah hibridisasi. Teknik ini memerlukan enzim restriksi dalam pengoperasiannya. Penggunaan enzim restriksi ini diharapkan dapat mengungkapkan perbedaan pola antara fragmen DNA pada ukuran tertentu dari individu yang berbeda. Hal ini didasarkan pada adanya perbedaan sekuen DNA yang dapat disebabkan oleh mutasi titik, insersi atau delesi, translokasi, inversi dan duplikasi. Perbedaan sekuen ini, terutama yang terdapat pada situs restriksi akan menghasilkan fragmen sekuen yang berbeda dengan ukuran yang berbeda bila dipotong oleh enzim restriksi tertentu. Enzim restriksi yang umum digunakan berasal dari bakteri, seperti EcoRI,
PstI, dan lainnya. Contoh dari marka
molekular yang telah banyak dikenal adalah
Restriction Fragment Length Polymorphism
(RFLP) (Semagn et al. 2006).
Random Amplified Polymorphic DNA
(RAPD)
Random Amplified Polymorphic DNA
(RAPD) termasuk ke dalam salah satu jenis reaksi PCR. Umumnya, pada reaksi PCR amplifikasi dilakukan pada gen yang telah diketahui. Namun, pada RAPD fragmen yang akan diamplifikasi belum diketahui dan amplifikasi tersebut bersifat acak. Saat beroperasi, RAPD memerlukan marker. Marker RAPD berupa fragmen DNA hasil amplifikasi yang diperoleh secara acak dengan primer tunggal yang tidak tentu. Ukuran primer yang digunakan biasanya terdiri atas 10 pasang basa (NCBI 2011).
Gambar 3 menunjukkan ilustrasi reaksi PCR-RAPD. Terdapat beberapa panah pada fragmen DNA awal. Tanda panah tersebut menunjukkan jumlah salinan primer. Arah sintesis DNA ditunjukkan oleh arah panah. Lokasi cetakan yang berikatan dengan primer ditunjukkan oleh nomor yang terdapat dalam gambar. Primer akan berikatan dengan DNA cetakan pada titik nomor 1, 2 dan 3 di bagian atas DNA cetakan. Titik pengikatan primer pada bagian bawah cetakan terdapat pada nomor 4, 5 dan 6 . Primer antara titik 2 dan 5
serta 3 dan 6 akan menghasilkan produk PCR. Produk A dihasilkan dari titik antara 2 dan 5. Produk B dihasilkan dari sekuen antara titik 3 dan 6. Sekuen antara titik 1 dan 4 tidak akan menghasilkan produk. Hal ini disebabkan jarak antara kedua titik yang cukup jauh. Akibatnya, pasangan primer pada kedua titik tersebut tidak berhadapan sehingga tidak dapat dihasilkan produk. Penggunaan primer yang berbeda akan menghasilkan produk PCR yang berbeda pula (NCBI 2011).
Setelah amplifikasi, pemastian produk PCR yang mengandung fragmen yang tidak diketahui tersebut dilakukan dengan elektroforesis gel agarosa. Munculnya fragmen DNA hasil amplifikasi yang tidak diketahui dalam proses elektroforesis dipengaruhi oleh komplementaritas antara posisi sekuen primer dengan sekuen DNA cetakan. Bila sekuen primer berada pada bagian fragmen yang terlalu jauh (ujung 3’) maka tidak akan ada fragmen yang diproduksi. Selain itu, bila terjadi mutasi pada ruas sebelum titik komplementer pada primer maka produk PCR juga tidak akan dihasilkan (NCBI 2011).
Penggunaan RAPD memiliki berbagai keunggulan. Keunggulan tersebut mencakup segi ekonomi, yakni harga yang tidak mahal. Pengetahuan spesifik tentang sekuen DNA organisme target juga tidak diperlukan dalam penggunaan RAPD (William et al. 1990). Teknik RAPD bersifat powerful, yaitu dapat mengamplifikasi DNA dalam jumlah besar, menghasilkan pita dengan intensitas yang terang dan tebal, serta menghasilkan banyak fragmen. Selain itu, RAPD banyak digunakan untuk spesies bakteri. Teknik ini dapat digunakan untuk mengidentifikasi polimorfisme DNA dalam sekuen DNA cetakan (NCBI 2011).
Gambar 3 Reaksi PCR-RAPD (NCBI 2011)
BAHAN DAN METODE
Alat dan Bahan
Peralatan yang digunakan dalam penelitian ini meliputi peralatan gelas, neraca
analitik, mortar, pipet mikro beserta tip, mikrosentrifus 200 R, tabung Eppendorf, inkubator, lemari asam, autoklaf, pHmeter, spektrofotometer beserta kuvet, perangkat mesin elektroforesis BioRad, mesin Geldoc dan mesin PCR ESCO.
Bahan yang digunakan dalam penelitian ini antara lain daun kunyit (Curcuma longa Linn.) asal Bogor, Wonogiri, Karanganyar, Ngawi, dan Sukabumi; daun temulawak (Curcuma xanthorrhiza Roxb.) asal Bogor, Wonogiri, Karanganyar, Sragen dan Sukabumi yang ditanam di Kebun Percobaan Pusat Studi Biofarmaka ; nitrogen cair; larutan buffer ekstraksi yang mengandung 2% CTAB (Cetyl
Triammonium Bromide) (b/v), 1.4 M NaCl,
mM EDTA, 100 mM Tris-HCl pH 8; polivinil pirolidon (PVP); dan 2% 2-merkaptoetanol (v/v). Bahan lain yang diperlukan dalam penelitian ini adalah kloroform, isoamilalkohol, larutan etanol 76%, buffer TE (10 mM Tris-HCl pH 8 dan 0.1 mM EDTA pH 8), akuabides
Proinjection, molecular water, alkohol
teknis, akuades, gel agarosa, larutan buffer TBE (Tris-Borat-EDTA), ethidium bromida 0.5 µg/mL, marker DNA ʎ, DreamTaqTM DNA Polymerase, MgCl2, dan primer OPA,
OPB, OPC, OPD 11-15.
Metode
Metode Isolasi DNA termodifikasi (Pharmawati 2009)
Modifikasi 1. Daun temulawak C3
(Bogor) ditimbang sebanyak 1 gram dan dimasukkan ke dalam mortar. Daun ditambahkan dengan PVP dan nitrogen cair lalu digerus hingga menjadi tepung. Bufer ekstraksi hangat ditambahkan sebanyak 9.8 mL dan 2-merkaptoetanol sebanyak 0.2 mL. Sampel diinkubasi selama 1 jam pada suhu 550 C dan kecepatan 150 rpm. Selanjutnya, sampel dipindahkan ke dalam 9 tabung Eppendorf masing-masing 1 mL dan ditambahkan kloroform:isoamil alkohol (24:1) dengan volume yang sama. Sampel disentrifugasi pada kecepatan 1000 g selama 5 menit. Ekstraksi dengan kloroform:isoamil alkohol dilakukan sebanyak dua kali. Aliquot dipindahkan ke dalam tabung Eppendorf baru dan ditambahkan dengan isopropanol dingin sebanyak 2/3 volume. Campuran diinversi sebanyak 10 kali dan disentrifugasi pada kecepatan 12000 g selama 20 menit. Setelah disentrifugasi, pelet dikoleksi dan supernatan dibuang. Satu tabung disimpan pada suhu -200
DNA cetakan
Reaksi PCR
C dan tabung lainnya digunakan untuk modifikasi selanjutnya.
Modifikasi 2. Pelet yang diperoleh pada modifikasi 1 dicuci dengan etanol 76% dan disentrifugasi pada kecepatan 14000 g selama 10 menit. Pelet dikoleksi dan disimpan pada suhu -200 C.
Modifikasi 3. Pelet yang diperoleh pada modifikasi 1 dicuci dengan etanol 76% dan disentrifugasi pada kecepatan 14000 g selama 10 menit. Pelet ditambahkan dengan 50 µL TE. Campuran diinversi dan ditambahkan dengan RNase A dengan konsentrasi akhir 10 µg/mL. Campuran diinkubasi pada suhu 370 C selama 30 menit dan disentrifugasi pada kecepatan 7500 g selama 5 menit. Pelet dikoleksi dan disimpan pada suhu -200 C.
Modifikasi 4. Sebelum ekstraksi dengan kloroform:isoamil alkohol, dilakukan penambahan proteinase K dengan konsentrasi akhir 10 µg/mL. Selanjutnya diinkubasi pada suhu 370 C selama 30 menit dan 650 C selama 20 menit. Pelet yang diperoleh pada modifikasi 1 dicuci dengan larutan pencuci (ammonium asetat dan etanol 76%) dan disentrifugasi pada kecepatan 14000 g selama 10 menit. Pelet ditambahkan dengan 50 µL TE. Campuran diinversi dan ditambahkan dengan RNase A dengan konsentrasi akhir 10 µg/mL. Campuran diinkubasi pada suhu 370 C selama 30 menit dan sidentrifugasi pada kecepatan 7500 g selama 5 menit. Pelet dikoleksi dan disimpan pada suhu -200 C.
Modifikasi 5. Seperti modifikasi 4 tetapi pelet yang diperoleh dari modifikasi 1 dicuci dengan etanol 76%.
Modifikasi 6. Seperti modifikasi 5 tetapi penambahan proteinase K dilakukan setelah penambahan TE.
Modifikasi 7. Seperti modifikasi 6 tetapi pelet yang diperoleh dari modifikasi 1 dicuci dengan larutan pencuci (ammonium asetat dan etanol 76%).
Modifikasi 8. Seperti modifikasi 3 tetapi pelet yang diperoleh dari modifikasi 1 dicuci dengan larutan pencuci (ammonium asetat dan etanol 76%).
Modifikasi 9. Pelet yang diperoleh pada modifikasi 1 dicuci dengan larutan pencuci (ammonium asetat dan etanol 76%) dan disentrifugasi pada kecepatan 14000 g selama 10 menit. Pelet dikoleksi dan disimpan pada suhu -200 C.
Analisis Kuantitatif DNA (Hoisington et al. 1994)
Sebanyak 3.5 µL DNA sampel ditambahkan dengan molecular water hingga
350 µL. Campuran diinversi hingga homogen. Nilai serapan sampel diukur pada panjang gelombang 230 nm, 260 nm dan 280 nm. Selanjutnya, nilai serapan sampel pada panjang gelombang 260 nm dihitung rasionya terhadap nilai serapan panjang gelombang 230 nm dan 280 nm. Nilai rasio A260/280 dan A260/230 yang berkisar antara 1.6-1.8 dan 2.0-2.2 dianggap telah murni.
Reaksi PCR-RAPD (William et al. 1990) Campuran reaksi PCR untuk amplifikasi mengandung 1x buffer PCR, 1.5 mM MgCl2,
200 µM masing-masing dNTP, 0.2 µM primer OP, 1 unit Taq DNA polimerase, dan 50 ng DNA cetakan. Amplifikasi dilakukan sebanyak 45 siklus. Satu siklus untuk pradenaturasi pada suhu 920 C selama 2 menit, denaturasi pada suhu 920 C selama 3 menit dan 30 detik, penempelan primer pada suhu 350 C selama 1 menit dan pemanjangan primer pada suhu 720 C selama 1 menit. Sebanyak 44 siklus untuk denaturasi pada suhu 920 C selama 1 menit, penempelan primer pada suhu 350 C selama 1 menit, pemanjangan primer pada suhu 720 C selama 2 menit dan pemanjangan akhir pada suhu 720 C selama 7 menit. Setelah seluruh siklus tercapai suhu dijaga pada 40 C dengan waktu yang tidak dibatasi.
Visualisasi dan Penentuan Bobot Molekul DNA (Sambrook & Russel 1989)
Visualisasi DNA dilakukan dengan elektroforesis gel agarosa. Sebanyak 0.51 gram agarosa ditimbang. Agarosa dilarutkan dalam 30 mL buffer TBE 0.5x. Agarosa dipanaskan hingga mendidih. Larutan agarosa dibiarkan hingga hangat lalu ditambahkan dengan 2 µL ethidium bromida. Larutan diaduk kemudian dituang pada cetakan gel. Gel dibiarkan hingga memadat kemudian sisir pencetak sumur diangkat. Elektroforesis dilakukan dengan arus 80 V selama 60 menit. DNA diamati dengan Geldoc. Konsentrasi DNA ditentukan dengan membandingkan tingkat perpendaran DNA dengan marker DNA ʎ.
Analisis Hasil Elektroforesis (Roulf 2002) Fragmen DNA yang terlihat saat elektroforesis ditentukan bobot molekulnya dengan bantuan perangkat lunak Photocap. Selanjutnya, dilakukan skoring dengan ketentuan skor 1 untuk pita yang muncul dan skor 0 untuk pita yang tidak muncul. Hasil skoring digunakan sebagai input untuk perangkat lunak NTSYS. Keluaran dari
perangkat lunak NTSYS adalah matriks koefisien kemiripan genetik sampel dan pohon filogenetik.
HASIL DAN PEMBAHASAN
DNA Genom
Tahap awal analisis molekuler dilakukan dengan isolasi DNA genom. DNA genom yang telah diisolasi akan digunakan sebagai DNA cetakan untuk
PCR-tanaman kunyit dan temulawak dilakukan dengan buffer CTAB (
Bromide). Metode yang digunakan mengacu
pada Doyle & Doyle (1990). Metode ini merupakan metode isolasi yang memiliki tahapan yang relatif mudah dan cepat, praktis dan sampel yang dibutuhkan tidak banyak (Tibbits et al. 2006).
Beberapa modifikasi metode isolasi tanaman kunyit dan temulawak dilakukan sebelum mengisolasi DNA kedua tanaman tersebut dengan metode terpilih. Modifikasi ini dilakukan agar dapat diperoleh kualitas DNA yang baik dengan kontaminan yang sedikit. Modifikasi ini didasarkan pada metode isolasi daun Grevillea
dioptimasi untuk dianalisis lebih lanjut dengan PCR-RAPD (Pharmawati 2009). Hal ini dilakukan karena belum ada metode isolasi yang efektif untuk memperoleh DNA dari kedua tanaman rimpang ini. Modifikasi yang dilakukan meliputi penambahan enzim Proteinase K dan pemilihan larutan pencuci DNA. Penambahan enzim Proteinase K dilakukan pada tahap awal ekstraksi dan akhir ekstraksi. Larutan DNA dicuci dengan larutan pencuci (ammonium asetat 10 mM dan etanol 76%) dan etanol 76%.
Hasil elektroforesis menunjukkan pita yang cukup tebal dengan metode terbaik, yaitu modifikasi 6 (Gambar 4). Modifikasi m
menunjukkan pita yang tebal meskipun memiliki banyak smear
terbentuk dapat disebabkan RNase yang kurang efisien.
dipengaruhi oleh keberadaan kloroform Tahap yang penting dalam pemisahan kloroform dari sampel yang mengandung DNA adalah saat pemindahan aliquot dari debris sel daun. Pengambilan aliquot pada lapisan atas yang kurang hati
mengikutsertakan kloroform yang berada di lapisan tengah. Kloroform
bersama aliquot akan
RNase bahkan menghilangkan RNAse A gkat lunak NTSYS adalah matriks koefisien kemiripan genetik sampel dan pohon
HASIL DAN PEMBAHASAN
DNA Genom
Tahap awal analisis molekuler dilakukan dengan isolasi DNA genom. DNA genom yang telah diisolasi akan digunakan sebagai -RAPD. Isolasi DNA tanaman kunyit dan temulawak dilakukan dengan buffer CTAB (Cetyl Triammonium ). Metode yang digunakan mengacu pada Doyle & Doyle (1990). Metode ini merupakan metode isolasi yang memiliki tahapan yang relatif mudah dan cepat, praktis dan sampel yang dibutuhkan tidak banyak
Beberapa modifikasi metode isolasi DNA tanaman kunyit dan temulawak dilakukan sebelum mengisolasi DNA kedua tanaman tersebut dengan metode terpilih. Modifikasi ini dilakukan agar dapat diperoleh kualitas DNA yang baik dengan kontaminan yang sedikit. Modifikasi ini didasarkan pada
Grevillea sp. yang telah
dioptimasi untuk dianalisis lebih lanjut RAPD (Pharmawati 2009). Hal ini dilakukan karena belum ada metode isolasi yang efektif untuk memperoleh DNA dari kedua tanaman rimpang ini. Modifikasi yang iputi penambahan enzim Proteinase K dan pemilihan larutan pencuci DNA. Penambahan enzim Proteinase K dilakukan pada tahap awal ekstraksi dan akhir DNA dicuci dengan larutan pencuci (ammonium asetat 10 mM dan etanol
Hasil elektroforesis menunjukkan dua pita yang cukup tebal dengan modifikasi modifikasi metode 5 dan odifikasi metode 5 menunjukkan pita yang tebal meskipun
smear. Smear yang
disebabkan oleh kerja dari RNase yang kurang efisien. Aktivitas RNase dipengaruhi oleh keberadaan kloroform. Tahap yang penting dalam pemisahan kloroform dari sampel yang mengandung DNA adalah saat pemindahan aliquot dari debris sel daun. Pengambilan aliquot pada isan atas yang kurang hati-hati dapat mengikutsertakan kloroform yang berada di Kloroform yang terambil bersama aliquot akan menghambat kerja
menghilangkan RNAse A.
Gambar 4 Elektroforegram pita DNA temulawak C3
modifikasi metode 2 (lajur 1), metode 3 (lajur 2), metode 4 (lajur 3), metode 5 (lajur 4), metode 6 (lajur 5), metode 7 (lajur 6), metode 8 (lajur 7), dan metode 9 (lajur 8)
Berbeda dengan pita pada lajur yang terbentuk pada lajur
kurang tebal. Meskipun demikian,
terbentuk pun lebih tipis dibanding dengan lajur 4 (modifikasi 5). Secara umum, tahapan yang dilakukan pada modifikasi
adalah sama. Namun, terdapat perbedaan dalam penambahan proteinase K. Penamba proteinase K dilakukan pada bagian awal isolasi (modifikasi 5) dan akhir (modifikasi 6).
Smear terbanyak ditunjukkan oleh pita
pada lajur 8 (metode 9). Terdapat dua pita pada lajur 8, yakni pita bagian atas (DNA) dan pita bagian bawah (RNA). Pita bagi bawah terlihat dengan sangat jelas karena tidak ada penambahan RNase pada metode 9. Pita pada lajur 1 pun memiliki
yang cukup tebal dan terdapat kontaminan RNA bagian bawah. Hal ini disebabkan pelet dikoleksi setelah pencucian dengan etanol 76%.
Penambahan proteinase K ternyata memiliki pengaruh yang cukup besar. Penambahan proteinase
sebelum ekstraksi dengan isoamil alkohol (modifikasi setelah penambahan bufer TE ( dan 7). Modifikasi 4 dan 5 yang lebih tebal dibanding modifikasi 6 dan 7. Selain itu, m
dan 8 yang tidak ditambahkan dengan proteinase K menunjukkan
tipis d ibanding dengan metode yang diberi perlakuan proteinase K.
Berdasarkan uraian di atas, metode yang paling efektif untuk isolasi daun
adalah modifikasi metode
banyak dihasilkan dengan penambahan Elektroforegram pita DNA
3 (Bogor) dengan
metode 2 (lajur 1), metode 3 (lajur 2), metode 4 (lajur 3), metode 5 (lajur 4), metode 6 (lajur 5), metode 7 (lajur 6), metode 8 (lajur 7), dan metode 9
Berbeda dengan pita pada lajur 4, pita yang terbentuk pada lajur 5 (modifikasi 6) kurang tebal. Meskipun demikian, smear yang terbentuk pun lebih tipis dibanding dengan ). Secara umum, tahapan modifikasi 5 dan 6 sama. Namun, terdapat perbedaan penambahan proteinase K. Penambahan proteinase K dilakukan pada bagian awal isolasi (modifikasi 5) dan akhir (modifikasi
terbanyak ditunjukkan oleh pita ). Terdapat dua pita , yakni pita bagian atas (DNA) dan pita bagian bawah (RNA). Pita bagian bawah terlihat dengan sangat jelas karena RNase pada metode pun memiliki smear yang cukup tebal dan terdapat kontaminan Hal ini disebabkan pelet dikoleksi setelah pencucian dengan
Penambahan proteinase K ternyata memiliki pengaruh yang cukup besar. K dilakukan dengan kloroform : odifikasi 4 dan 5) dan setelah penambahan bufer TE (modifikasi 6 5 menghasilkan pita yang lebih tebal dibanding dengan
. Selain itu, modifikasi 3 yang tidak ditambahkan dengan proteinase K menunjukkan pita yang lebih ibanding dengan metode yang diberi
uraian di atas, metode yang untuk isolasi daun temulawak metode 5. DNA yang lebih banyak dihasilkan dengan penambahan
proteinase K sebelum penambahan kloroform : isoamil alkohol dan mencuci pelet dengan etanol 76%. Kontaminasi RNA dapat dihilangkan dengan penambahan RNase A.
Tahapan isolasi DNA meliputi pelisisan sel, pemisahan DNA dengan makromolekul lain dan pemekatan DNA. Pelisisan sel dilakukan dengan dua cara, yakni pelisisan secara mekanik dan secara kimia. Lisis sel secara mekanik dilakukan dengan penggerusan. Tekstur daun yang licin umumnya akan menyulitkan penggerusan. Oleh sebab itu, digunakan nitrogen cair untuk mempermudah penggerusan daun. Nitrogen cair memiliki suhu yang sangat rendah. Dengan kondisi seperti ini, daun yang ditambahkan nitrogen cair akan menjadi beku. Selain nitrogen cair, ditambahkan PVP saat penggerusan. Penambahan PVP bertujuan mencegah kerusakan DNA akibat oksidasi dan menarik senyawa fenolik pada daun (Padmalatha & Prasad 2006). Lisis sel secara kimia dilakukan dengan menggunakan buffer ekstraksi yang mengandung CTAB. Buffer CTAB sangat baik digunakan untuk tanaman yang memiliki kandungan polisakarida yang tinggi (Pharmawati 2009). Selain itu, buffer CTAB dapat mendegradasi senyawa metabolit sekunder seperti tanin dan senyawa fenolik. Tiga molekul tersebut merupakan kontaminan yang dapat mempengaruhi kualitas hasil isolasi. Kandungan kontaminan yang tinggi dapat menurunkan kualitas DNA sehingga timbul smear saat elektroforesis. Penambahan buffer CTAB diikuti dengan penambahan larutan 2-merkaptoetanol. Larutan ini berperan dalam penghilangan polifenol (Padmalatha & Prasad 2006).
Tahap selanjutnya adalah pemisahan DNA dengan molekul lain, seperti protein, lipid dan sisa polisakarida. Ekstraksi protein dilakukan dengan penambahan campuran kloroform : isoamilkohol (24:1). Setelah penambahan senyawa tersebut akan terbentuk 3 lapisan. Lapisan bawah merupakan debris sel, lapisan tengah berupa gumpalan yang mengandung protein sedangkan lapisan atas berisi DNA, RNA dan protein berukuran kecil. Sisa protein yang terdapat pada lapisan atas didegradasi dengan proteinase K. Enzim proteinase K aktif pada suhu 370C dan inaktif pada suhu 650C atau lebih (Tibbits et al. 2006).
Tahap akhir isolasi DNA adalah pemekatan DNA. Endapan DNA dipekatkan dengan isopropanol. Semakin lama waktu inkubasi dengan isopropanol, maka jumlah DNA yang didapat akan semakin besar. Sisa larutan dihilangkan dengan pencucian
menggunakan etanol 76%. Kemudian dilakukan pemisahan DNA dan RNA dengan penambahan enzim RNAse. Enzim RNAse berperan dalam mendegradasi RNA (Tibbits
et al. 2006).
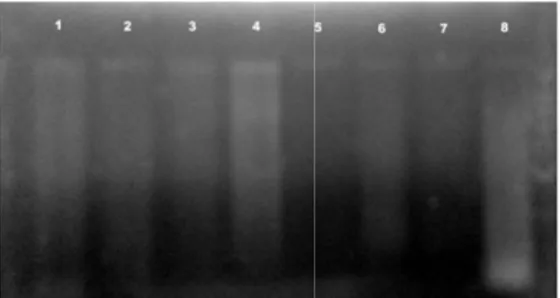
Keberhasilan metode dalam mengisolasi DNA tanaman kunyit dan temulawak ditunjukkan dengan munculnya pita DNA saat elektroforesis. Analisis kualitatif dilakukan dengan elektroforesis gel agarosa 0.8 % dalam buffer TBE 0.5x. Hasil analisis kualitatif tanaman kunyit dan temulawak ditunjukkan oleh Gambar 5. Terdapat 12 lajur yang terdiri atas lima tanaman temulawak, DNA marker dan enam tanaman kunyit. Tanaman yang diisolasi merupakan tanaman yang unggul secara metabolik, yakni memiliki kandungan kurkumin atau dan xantorizol yang tinggi (Rahardjo 2010; Syukur et al. 2006).
Sampel yang digunakan tidak berasal dari daerah asli tanaman tersebut. Daun yang diisolasi berasal dari Kebun Percobaan Pusat Studi Biofarmaka. Menurut Campbell et
al. (2002), DNA genom suatu tanaman
berbeda dengan tanaman lain yang hidup pada daerah yang berbeda. Hal ini merupakan bentuk adaptasi dari tanaman terhadap lingkungan. Susunan genom tersebut akan diwariskan kepada keturunannya dan bersifat tetap (Campbell et al. 2002).
Gambar 5 Elektroforegram pita DNA temulawak Bogor (1); temulawak Wonogiri (2); temulawak Karanganyar (3); temulawak Sragen (4); temulawak Sukabumi (5); marker DNA 1 kb (6); kunyit Bogor (Turina 1) (7); kunyit Bogor (Turina 2) (8); kunyit Wonogiri (9); kunyit Karanganyar (10); kunyit Sukabumi (11); dan kunyit Ngawi (12) dengan modifikasi metode 5
1500bp 1000bp 750bp 500bp
Secara umum, pita yang dihasilkan masih memiliki smear pada bagian bawah. Bentuk pita DNA yang dihasilkan berupa “fire type”. Hal ini menunjukkan adanya kontaminan polisakarida yang terbawa saat isolasi (Pharmawati 2009). Namun, pita yang dihasilkan berjumlah 1 buah. Hal ini menandakan DNA yang dihasilkan cukup baik. Ukuran DNA temulawak yang diperoleh berkisar antara 15333 bp (base pair) hingga 15500 bp. Ukuran DNA kunyit yang dihasilkan berkisar antara 15333 bp hingga 16000 bp. Marker DNA yang digunakan berasal dari Thermo Scientific berukuran 1 kb dengan 14 fragmen DNA. Fragmen DNA marker berukuran 10000 bp, 8000 bp, 6000 bp, 5000 bp, 4000 bp, 3500 bp, 3000 bp, 2500 bp, 2000 bp, 1500 bp, 1000 bp, 750 bp, 500 bp dan 250 bp.
Kuantifikasi DNA Genom
Analisis kuantitatif DNA dilakukan dengan metode spektrofotometri. Larutan DNA diukur nilai serapannya pada tiga panjang gelombang, yakni 230 nm, 260 nm, dan 280 nm. Penyerapan sinar UV oleh DNA disebabkan adanya ikatan rangkap pada basa nitrogen DNA. Panjang gelombang untuk pengukuran DNA adalah 260 nm. Panjang gelombang 230 nm digunakan untuk pengukuran protein, polisakarida dan sebagian DNA. Panjang gelombang 280 nm digunakan untuk pengukuran RNA dan sebagian DNA (Brescia 2012).
Nilai kemurnian DNA kunyit hasil isolasi berkisar antara 1.093 hingga 1.417 (Lampiran 3). Rerata nilai kemurnian DNA kunyit adalah 1.242. Nilai kemurnian DNA kunyit tertinggi diperoleh dari tanaman kunyit asal Sukabumi. Nilai kemurnian DNA kunyit terendah diperoleh dari tanaman kunyit asal Bogor, yakni Turina 2. Konsentrasi DNA kunyit yang diperoleh berkisar antara 80 ng/μL hingga 1625 ng/μL.
Nilai kemurnian DNA tanaman temulawak berada pada rentang 1.044 hingga 1.544. Rerata nilai kemurnian DNA temulawak adalah 1.326. Nilai kemurnian DNA temulawak tertinggi diperoleh dari tanaman temulawak asal Wonogiri. Nilai kemurnian DNA temulawak terendah diperoleh dari tanaman temulawak asal Bogor. Konsentrasi DNA temulawak terkecil diperoleh dari tanaman kunyit asal Sragen, yaitu 525 ng/μL. Konsentrasi DNA temulawak terbesar diperoleh dari tanaman temulawak asal Wonogiri, yakni 965 ng/μL.
Nilai kemurnian DNA tanaman kunyit dan temulawak yang telah diisolasi hanya mencapai 1.544. Nilai kemurnian ini masih berada di bawah rentang nilai DNA murni, yakni 1.8 hingga 2.0 (Hoisington et al. 1994). Hal ini menunjukkan bahwa DNA hasil isolasi kedua tanaman masih mengandung kontaminan protein. Kontaminan protein dapat terbawa saat pengambilan aliquot. Kemurnian DNA hasil isolasi dari tanaman kunyit dan temulawak yang tidak begitu tinggi tidak mempengaruhi analisis molekuler selanjutnya dengan RAPD. Hal ini disebabkan RAPD toleran terhadap tingkat kemurnian DNA (Prana & Hartati 2003). Nilai kemurnian DNA temulawak lebih tinggi dibanding dengan DNA kunyit. Hal ini menunjukkan bahwa kualitas DNA hasil isolasi dipengaruhi oleh jenis tanaman dan kandungan senyawa dalam tanaman tersebut. Hal ini berhubungan dengan komponen dinding sel tiap tanaman (Pharmawati 2009).
Amplikon RAPD
Amplifikasi DNA kunyit dan temulawak dilakukan dengan teknik RAPD. Teknik RAPD membutuhkan primer untuk memulai perbanyakan salinan DNA. Primer yang digunakan untuk RAPD terdiri atas banyak seri. Primer yang digunakan dalam penelitian ini adalah primer seri OPA (11, 12, 13, 14, 15); OPB (11, 12, 13, 14, 15); OPC (11, 12, 13, 14, 15); dan OPD (11, 12, 13, 14, 15). Pemilihan primer seri ini didasarkan pada penelitian Jan et al. (2011) yang mengamplifikasi kunyit lokal Pakistan dengan keempat seri primer ini dan memperoleh jumlah pita DNA yang cukup beragam.
Analisis hasil amplifikasi DNA dilakukan dengan elektroforesis gel agarosa. Konsentrasi gel yang digunakan adalah 1.7% dalam buffer TBE 0.5x. Konsentrasi gel 1.7% dipilih karena kemampuan gel yang dapat memisahkan fragmen DNA yang berukuran 100 bp hingga 4000 bp. Grattapaglia et al (1992) mengemukakan bahwa ukuran amplikon tanaman yang dihasilkan dengan menggunakan primer acak berkisar antara 200 pb hingga 3500 pb. Penggunaan gel dengan konsentrasi tersebut diharapkan dapat memisahkan fragmen amplikon dengan baik.
Amplikon yang dianalisis saat elektroforesis terbagi menjadi dua jenis, yakni polimorfik dan monomorfik. Amplikon DNA bersifat polimorfik bila seluruh sampel yang dianalisis tidak memiliki lokus yang berukuran sama. Pita monomorfik ditunjukkan oleh adanya lokus dengan
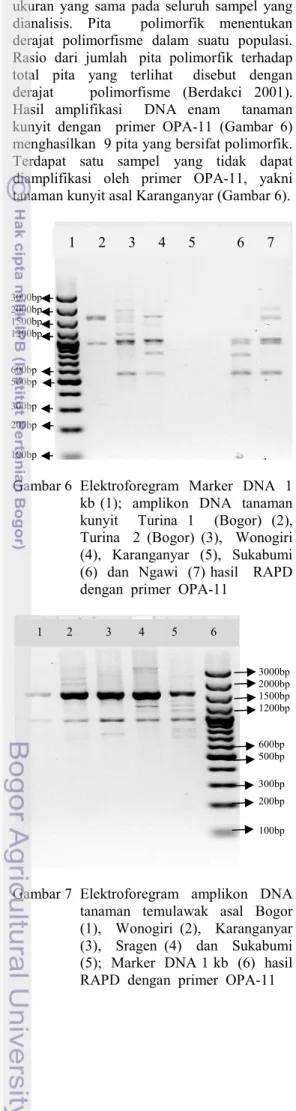
ukuran yang sama pada seluruh sampel yang dianalisis. Pita polimorfik menentukan derajat polimorfisme dalam suatu populasi. Rasio dari jumlah pita polimorfik terhadap total pita yang terlihat disebut dengan derajat polimorfisme (Berdakci 2001). Hasil amplifikasi DNA enam tanaman kunyit dengan primer OPA-11 (Gambar 6) menghasilkan 9 pita yang bersifat polimorfik. Terdapat satu sampel yang tidak dapat diamplifikasi oleh primer OPA-11, yakni tanaman kunyit asal Karanganyar (Gambar 6).
Gambar 6 Elektroforegram Marker DNA 1 kb (1); amplikon DNA tanaman kunyit Turina 1 (Bogor) (2), Turina 2 (Bogor) (3), Wonogiri (4), Karanganyar (5), Sukabumi (6) dan Ngawi (7) hasil RAPD dengan primer OPA-11
Gambar 7 Elektroforegram amplikon DNA tanaman temulawak asal Bogor (1), Wonogiri (2), Karanganyar (3), Sragen (4) dan Sukabumi (5); Marker DNA 1 kb (6) hasil RAPD dengan primer OPA-11
Amplifikasi DNA kunyit dengan 20 primer acak menghasilkan 131 lokus (Lampiran 4). Secara umum, amplikon yang tampak sudah menunjukkan polimorfisme. Polimorfisme merupakan variasi yang terdapat dalam sekuen DNA. Hal inilah yang mendasari adanya keragaman dalam suatu populasi (NCBI 2011). Munculnya polimorfisme saat analisis disebabkan oleh ketidakcocokan sisi primer, adanya penampakan sisi primer baru, dan perbedaan panjang daerah amplifikasi di antara sisi primer (Berdakci 2001).
Amplifikasi DNA lima tanaman temulawak dengan primer OPA-11 (Gambar 7) menghasilkan 12 pita. Satu pita bersifat monomorfik dan sebelas pita lainnya bersifat polimorfik. Primer OPA-11 dapat mengamplifikasi DNA sampel yang dianalisis. Amplifikasi DNA lima tanaman temulawak dengan 20 primer acak menghasilkan 132 lokus. Hanya 16 primer yang dapat mengamplifikasi DNA lima tanaman temulawak yang digunakan (Lampiran 5).
Jumlah amplikon yang dihasilkan tiap primer berbeda. Tiap primer menghasilkan 4 hingga 12 lokus untuk enam tanaman kunyit (Lampiran 2). Jumlah lokus yang dihasilkan dari lima tanaman temulawak berkisar antara 3 hingga 15 lokus (Lampiran 4). Umumnya, amplifikasi dengan primer acak RAPD dapat menghasilkan 5 hingga 20 lokus untuk setiap primer (Grattapaglia et al. 1992). Menurut Campbell et al. (2002), lokus merupakan lokasi spesifik suatu gen yang berada di sepanjang kromosom. Lokus ditunjukkan oleh amplikon yang terlihat saat elektroforesis. Hampir seluruh primer menunjukkan pola amplikon yang berbeda (Lampiran 7).
Perbedaan jumlah lokus yang dihasilkan dipengaruhi oleh sekuen primer yang digunakan. Suatu primer dapat mengamplifikasi DNA cetakan bila terdapat ruas yang komplemen. Semakin banyak ruas DNA cetakan yang bersifat komplemen dengan sekuen primer, maka hasil amplifikasi akan menunjukkan jumlah pita yang semakin banyak. Sebaliknya, semakin sedikit primer yang komplemen dengan DNA cetakan, maka jumlah pita hasil amplifikasi akan semakin sedikit. Bila antara primer dan DNA cetakan tidak memiliki sekuen yang komplemen, maka primer tersebut tidak akan dapat mengamplifikasi DNA cetakan sehingga tidak akan ada pita yang muncul (Semagn et al. 2006).
Elektroforegram amplikon tanaman kunyit menunjukkan tidak terdapat pita monomorfik 1 2 3 4 5 6 7 3000bp 2000bp 1500bp 1200bp 600bp 500bp 300bp 200bp 100bp 1 2 3 4 5 6 3000bp 2000bp 1500bp 1200bp 600bp 500bp 300bp 200bp 100bp
untuk tanaman ini. Artinya, seluruh amplikon yang dihasilkan bersifat polimorfik. Derajat polimorfisme dari tanaman kunyit adalah 100%. Berbeda halnya dengan kunyit, tanaman temulawak memiliki tiga amplikon yang bersifat monomorfik. Amplikon monomorfik diperoleh dari amplifikasi dengan primer OPA-11 dan OPA-13 (Lampiran 7). Tanaman temulawak memiliki derajat polimorfime sebesar 97.73%. Derajat polimorfisme yang diperoleh dari tanaman kunyit dan temulawak sangat tinggi. Derajat polimorfisme menggambarkan keadaan genom suatu organisme. Semakin tinggi derajat polimorfime maka semakin tinggi pula keragaman genetik yang terdapat dalam populasi (Grattapaglia et al. 1992). Intensitas pita yang dihasilkan tiap primer dan sampel berbeda. Perbedaan ini dipengaruhi oleh kualitas dan kemurnian DNA yang diperoleh dan penyebaran situs penempelan primer pada DNA cetakan yang berbeda pula.
Intensitas pita menunjukkan konsentrasi DNA yang teramplifikasi. Ukuran amplikon yang dihasilkan dari tanaman kunyit berkisar antara 100 bp hingga 3000 bp. Temulawak memiliki amplikon dengan ukuran 100 bp hingga 3500 bp. Hal ini sesuai dengan Grattapaglia et al (1992) yang mengemukakan bahwa ukuran amplikon tanaman yang berkisar antara 200 bp hingga 5000 bp. Ukuran amplikon tanaman akan berbeda bergantung pada jenis tanaman dan konsentrasi DNA cetakan (Grattapaglia et al. 1992). Konsentrasi DNA cetakan yang digunakan dalam penelitian ini adalah 50 ng/µL.
Matriks Kemiripan Genetik Analisis kemiripan genetik dilakukan untuk mengetahui hubungan genetik antara tanaman yang diuji. Hal ini diperlukan untuk mengetahui tingkat keragaman genetik dalam suatu populasi. Hubungan genetik antar individu ditunjukkan oleh matriks kemiripan genetik. Analisis kemiripan genetik dilakukan dengan bantuan perangkat lunak NTSYS 2.02. Keluaran dari perangkat lunak ini berupa matriks kemiripan genetik. Matriks kemiripan genetik didasarkan pada proporsi fragmen RAPD. Proporsi pita yang muncul menjadi dasar yang digunakan untuk menentukan tingkat kemiripan genetik (Jan et al. 2011).
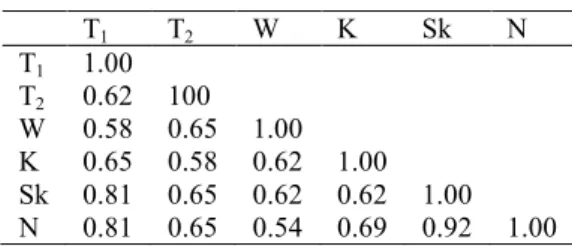
Matriks kemiripan genetik enam tanaman kunyit ditunjukkan oleh Tabel 1. Kemiripan genetik tanaman kunyit lokal berkisar antara 54% hingga 92%. Kemiripan genetik tertinggi ditunjukkan oleh pasangan tanaman
kunyit asal Sukabumi dan Ngawi. Selanjutnya diikuti oleh pasangan tanaman kunyit asal Bogor (Turina 1) dengan Sukabumi dan Turina 1 dengan Ngawi dengan kemiripan genetik sebesar 81%.
Matriks kemiripan genetik lima tanaman temulawak ditunjukkan oleh Tabel 2. Kemiripan genetik antar lima tanaman temulawak lokal berkisar antara 55% hingga 83%. Kemiripan genetik tertinggi ditunjukkan oleh pasangan tanaman temulawak asal Bogor dan Sukabumi. Kemiripan genetik terendah ditunjukkan oleh pasangan tanaman temulawak asal Sukabumi dengan Sragen.
Informasi mengenai tingkat kemiripan genetik bermanfaat dalam kegiatan pemuliaan tanaman. Tanaman dengan tingkat kemiripan genetik yang tinggi dapat ditanam secara terpisah. Hal ini bertujuan untuk mempertahankan keragaman genetik populasi tanaman tersebut. Selain itu, dapat pula digunakan sebagai acuan untuk melakukan persilangan tanaman (Wulandari 2008).
Tabel 1 Matriks kemiripan genetik enam tanaman kunyit lokal
T1 T2 W K Sk N T1 1.00 T2 0.62 100 W 0.58 0.65 1.00 K 0.65 0.58 0.62 1.00 Sk 0.81 0.65 0.62 0.62 1.00 N 0.81 0.65 0.54 0.69 0.92 1.00
Tabel 2 Matriks kemiripan genetik lima tanaman temulawak lokal
C3 W K Sr Sk C3 1.00 W 0.76 1.00 K 0.66 0.76 1.00 Sr 0.59 0.76 0.79 1.00 Sk 0.83 0.72 0.62 0.55 1.00 Keterangan : T1 : Turina 1 (Bogor) T2 : Turina 2 (Bogor) W : Wonogiri K : Karanganyar Sk : Sukabumi N : Ngawi C3 : Cursina 3 (Bogor) Sr : Sragen Filogenetik
Filogenetika digambarkan sebagai klasifikasi suatu organisme berdasarkan
evolusinya. Analisis filogenetik didasarkan pada kemiripan karakter sebagai parameter perbandingan. Parameter yang umum digunakan adalah sekuen DNA, dan sekuen asam amino. Analisis filogenetik umumnya direpresentasikan sebagai sistem percabangan seperti diagram pohon. Diagram ini dikenal sebagai pohon filogenetik. Salah satu tujuan dari penyusunan pohon filogenetik adalah mengonstruksi hubungan antara organisme dengan tepat (Dharmayanti 2011).
Terdapat berbagai metode untuk melakukan konstruksi pohon filogenetik, salah satunya adalah UPGMA. Metode UPGMA (unweighted pair-group method with
arimetric) adalah metode sederhana untuk
konstruksi pohon (Nei & Li 1979). Metode ini mengukur nilai kemiripan antar organisme yang dianalisis. Metode UPGMA merupakan metode yang mendasari perangkat lunak NTSYS. Penyusunan dendogram didasarkan pada data pola pita hasil elektroforesis. Data pola pita hasil elektroforesis diterjemahkan menjadi data biner dengan ketentuan khusus. Nilai 1 diberikan untuk pita yang muncul. Nilai 0 diberikan untuk pita yang tidak muncul. Dendogram yang dihasilkan merupakan turunan dari matriks kemiripan genetik (Dharmayanti 2011).
Dendogram yang diperoleh merupakan keluaran dari hasil skoring pita amplikon DNA yang muncul saat elektroforesis. Skoring dilakukan secara manual. Skoring dilakukan berdasarkan ukuran amplikon yang banyak dihasilkan saat elektroforesis. Masukan hasil skoring yang konsisten akan menghasilkan keluaran berupa matriks kemiripan genetik dan dendogram yang konsisten pula.
Pohon yang menggambarkan hubungan enam tanaman kunyit lokal ditunjukkan oleh Gambar 8. Terdapat dua kelompok besar pada tingkat kemiripan 0.606 yakni kelompok I dan II. Kelompok I terdiri atas empat tanaman, yaitu tanaman kunyit asal Bogor (Turina 1), Sukabumi, Ngawi, dan Karanganyar; sedangkan kelompok II terdiri atas dua tanaman, yakni tanaman kunyit asal Bogor (Turina 2) dan Wonogiri. Subkelompok IA dan IB menunjukkan tingkat kemiripan 0.654. Subkelompok IA1 dan IA2 menunjukkan
tingkat kemiripan 0.808. Anggota kelompok II menunjukkan tingkat kemiripan 0.654.
Pohon filogenetik lima tanaman temulawak ditunjukkan oleh Gambar 9. Secara umum, terdapat dua kelompok yang terbagi pada tingkat kemiripan 0.649. Kelompok I terdiri atas dua tanaman, yakni
tanaman kunyit asal Bogor dan Sukabumi. Tingkat kemiripan kedua tanaman ini adalah 0.828. Kelompok II terdiri atas tiga tanaman, yakni tanaman temulawak asal Wonogiri, Sragen dan Karanganyar. Kelompok II terbagi menjadi dua subkelompok pada tingkat kemiripan 0.758.
Secara umum, semakin tinggi koefisien kemiripan genetik akan menimbulkan pengelompokkan yang semakin banyak. Nilai koefisien kemiripan genetik yang tinggi menggambarkan kedekatan hubungan genetik antar individu dalam populasi. Sebaliknya, hubungan genetik yang relatif jauh ditunjukkan dengan koefisien kemiripan genetik yang rendah. Informasi ini sangat berguna sebagai dasar persilangan tanaman untuk pemuliaan (Setiyo 2001).
Gambar 8 Pohon filogenetik tanaman kunyit Bogor (Turina 1) (1), Bogor (Turina 2) (2), Wonogiri (3), Karanganyar (4), Sukabumi (5) dan Ngawi (6)
Gambar 9 Pohon filogenetik tanaman temulawak asal Bogor (1), Wonogiri (2), Karanganyar (3), Sragen (4) dan Sukabumi (5)
SIMPULAN DAN SARAN
Simpulan
Amplifikasi DNA tanaman kunyit dan temulawak secara berurutan menghasilkan 131 lokus dan 132 lokus yang 100% dan 97.73% polimorfik. Jumlah pita hasil amplifikasi yang beragam dan ukuran yang
berbeda pada tiap sampel menunjukkan pola keragaman genetik yang terdapat pada tanaman kunyit dan temulawak. Koefisien kemiripan genetik 6 tanaman kunyit berkisar antara 53.8% hingga 92.3%. Koefisien kemiripan genetik 5 tanaman temulawak berkisar antara 55.2% hingga 82.8%. Hubungan genetik terdekat ditunjukkan oleh tanaman kunyit asal Sukabumi dengan Ngawi dan tanaman temulawak asal Sukabumi dengan Bogor.
Saran
Perlu dilakukan penambahan jumlah larutan 2-merkaptoetanol untuk menghilangkan kontaminan polisakarida saat isolasi DNA. Analisis lebih lanjut dapat dilakukan dengan menggunakan primer RAPD lainnya. Selain itu, dapat pula ditambahkan jenis sampel yang dianalisis agar kekerabatan tanaman temulawak dan kunyit lokal lebih tereksplorasi. Analisis lainnya dapat digunakan dengan metode marka molekuler lain seperti AFLP, RFLP atau SSR.
DAFTAR PUSTAKA
Aggarwal BB, Kumar A, Aggarwal MS, Shishodia S. 2005. Curcumin derived from tumeric (Curcuma longa) : a spice for all seasons. CRC Prs LLC (05) : 349-386.
Akram et al. 2010. Curcuma longa and curcumin : a review article. Rom J Biol 55 (2) : 65-70.
Araujo CAC, Leon LL. 2001. Biological activities of Curcuma longa L. Mem Inst
Oswaldo Cruz 96 (5) : 723-728.
Bartlett JMS, Stirling D. 2010. Methods in
Molecular Biology : A Short History of the Polymerase Chain Reaction Ed. 226 :
1-6.
Berdakci F. 2001. Random amplified polymorphic DNA (RAPD) markers [review]. Turk J Biol 25: 185-196.
[BPPT] Badan Pengkajian dan Penerapan Teknologi. 2010. Temulawak. [terhubung berkala]
http://lc.bppt.go.id/ttg/Data/bididaya%20 pertanian/obat/temulawak.pdf [4 Juni 2012].
Brescia P. 2012. Micro-volume purity assessment of nucleic acid using A260/A280 ratio and spectral scanning.
[terhubung berkala] http://www.biotek.com [10 Desember 2012].
Brown TA. 2007. Gene Cloning and DNA
Analysis : An Introduction Sixth Edition.
New York : John Wiley and Sons.
Campbell NA, Reece JB, Mitchell LG. 2002.
Biology 5th Ed. Jakarta: Erlangga.
Carroll P, Casimir D. 2010. Methods in
Molecular Biology : PCR Patent Issues
Ed. 226 : 7-14.
Chauhan DP. 2002. Chemoteurapeutic potential of curcumin for colorectal cancer. Curr Pharm Des 8 : 1695-1706. Dharmayanti NLPI. 2011. Filogenetika
molekuler : metode taksonomi organisme berdasarkan sejarah evolusi [review].
Wartazoa Vol. 21(1): 1-10.
Dorai T, Cao YC, Dorai B. 2001. Therapeutic potential of curcumin in human prostate cancer. III. curcumin inhibits proliferation, induces apoptosis, and inhibits angiogenesis of LNCaP prostate cancer cells in vivo. Prostate 47:293-303.
Grattapaglia D et al. 1992. Mapping in woody plants with RAPD markers: Application to breeding in forestry and holticulture. Di dalam: Application of RAPD Technology to Plant Breeding. Joint Plant Breeding Symposia. Minneapolis, 1 November 1992.
Grunenwald H, Bartlett JMS, Stirling D, editor. 2010. Methods in Molecular
Biology : Optimization of Polymease Chain Reaction Ed. 226:89-100.
Hadipoentyanti E, Syahid SF. 2001. Pertumbuhan dan produksi rimpang temulawak di polibag yang benihnya hasil kultur in vitro. Jurnal Biologi
Indonesia III(2) : 118-125.
Hayakawa et al. 2011. Development of molecular marker to candidate line of turmeric (Curcuma longa) with a high curcumin content. American