DAN RICE GRASSY STUNT TENUIVIRUS (RGSV)
DARI BEBERAPA KABUPATEN DI PULAU JAWA
DWI ASTUTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Dengan ini saya menyatakan bahwa tesis berjudul Keragaman Gen Protein
Selubung Isolat Rice tungro bacilliform tungrovirus (RTBV) dan Rice grassy stunt tenuivirus (RGSV) dari Beberapa Kabupaten di Pulau Jawa adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2013
Dwi Astuti
NIM A352090061
* Pelimpahan hak cipta atas karya tulis dari penelitian kerjasama dengan pihak
tungrovirus (RTBV) dan Rice grassy stunt tenuivirus (RGSV) dari beberapa
Kabupaten di Pulau Jawa. Dibimbing oleh ENDANG NURHAYATI dan SRI HENDRASTUTI HIDAYAT.
Indonesia merupakan negara terbesar pengonsumsi beras di dunia.
International Rice Research Institute (IRRI) memperkirakan Indonesia
membutuhkan peningkatan produksi beras untuk 25 tahun mendatang. Salah satu kendala peningkatan produksi beras nasional adalah gangguan hama dan penyakit tanaman diantaranya penyakit tungro dan penyakit kerdil rumput.
Penyakit tungro disebabkan oleh infeksi bersama Rice tungro bacilliform
tungrovirus (RTBV) dan Rice tungro spherical wakaivirus (RTSV). Kedua virus
ini ditularkan melalui vektor wereng daun yang terutama adalah wereng hijau (Nephotettix virescens). RTBV adalah penentu terjadinya gejala walaupun tidak dapat menginfeksi tanaman padi tanpa adanya RTSV. Tanaman terinfeksi menunjukkan gejala khas tungro yaitu kerdil, perubahan warna daun menjadi kuning sampai kuning oranye, penurunan jumlah anakan dan terkadang tampak bercak coklat seperti karat pada daun. Pada tahun 2006 gejala penyakit baru ditemukan di pertanaman padi di Indonesia yaitu perubahan warna daun menjadi kuning-oranye, penurunan jumlah anakan tanpa disertai penurunan tinggi tanaman. Dilaporkan bahwa penyakit ini disebabkan oleh infeksi Rice grassy stunt tenuivirus (RGSV) penyebab penyakit kerdil rumput.
Keragaman genetik isolat-isolat RTBV dari Asia Selatan dan Asia Tenggara serta beberapa daerah endemik tungro di Indonesia berdasarkan variasi gejala dan keragaman gen protein selubung RTBV telah dilaporkan. Keragaman genetik isolat-isolat RGSV juga telah dilaporkan dari dua daerah di Taiwan dan Filipina berdasarkan perbedaan gejala. Gejala yang ditimbulkan salah satu isolat RGSV dari Taiwan dan Filipina mirip dengan gejala infeksi virus tungro. Kemiripan gejala karena infeksi virus tungro dan RGSV menyebabkan kesulitan dalam melakukan diagnosis penyebab penyakit sehingga menimbulkan keresahan dikalangan petani dan para praktisi dalam menentukan strategi pengendalian penyakit. Penelitian mengenai keragaman gejala dan keragaman genetik RTBV dan RGSV sangat diperlukan untuk menentukan strategi pengendalian yang tepat.
Keragaman genetik dan gejala yang disebabkan RTBV dan RGSV dapat diketahui melalui keragaman gen protein selubungnya. Selain sebagai penentu faktor infeksi dan faktor virulensi, gen protein selubung juga berperan sebagai penginduksi gejala. Oleh karena itu, perlu dilakukan penelitian untuk mempelajari keragaman gejala dan keragaman gen protein selubung RTBV dan RGSV dari beberapa kabupaten di Jawa. Daerah-daerah di Kabupaten Bogor, Subang, Pandeglang, Klaten, Batang, Sleman, Jember dan Banyuwangi dipilih sebagai daerah survei penyakit karena daerah-daerah ini dilaporkan sebagai daerah endemis penyakit tungro dan wereng batang coklat, serangga vektor RGSV.
Penelitian meliputi tiga kegiatan pokok yaitu pengamatan gejala dan pengambilan sampel tanaman dari lapangan, deteksi RTBV dan RGSV, serta analisis keragaman gen protein selubung RTBV dan RGSV. Pengamatan gejala dikhususkan pada tinggi tanaman, perubahan warna dan tekstur pada daun serta
dari lapangan menunjukkan gejala terinfeksi virus tungro. Terdapat dua variasi gejala yang dapat dikelompokkan berdasarkan jumlah anakan dan tinggi tanaman. Variasi gejala ini dapat disebabkan oleh infeksi RTBV atau RGSV atau infeksi bersama RTBV dan RGSV.
Deteksi RTBV dan RGSV menggunakan metode Polymerase Chain Reaction (PCR). Seluruh gen protein selubung RTBV berhasil diamplifikasi menggunakan pasangan primer DA-F dan DA-R dengan amplikon sebesar 1224 bp. Sebagian gen protein selubung RGSV berhasil diamplifikasi menggunakan pasangan primer F3 dan B3 dengan amplikon sebesar 243 bp. Sebanyak 64 sampel berhasil diamplifikasi, 13 sampel menunjukkan hasil positif terhadap RTBV, 36 sampel positif terhadap RGSV dan 2 sampel positif terhadap RTBV dan RGSV. Hasil deteksi tersebut menunjukkan bahwa gejala mirip terinfeksi virus tungro ternyata positif terinfeksi RGSV. Dengan demikian gejala saja tidak cukup untuk mengetahui bahwa suatu tanaman terinfeksi RTBV atau RGSV sebelum dilakukan deteksi molekuler.
DNA hasil amplifikasi digunakan untuk perunutan asam nukleat dan selanjutnya dianalisis keragaman antar isolat-isolat. Analisis hubungan kekerabatan dilakukan menggunakan analisis filogenetik berdasarkan metode
Neighbor-Joining. Hasil analisis kesamaan runutan basa nukleotida gen protein selubung dari
10 isolat RTBV memiliki tingkat kesamaan berkisar 40% sampai 100%, sedangkan analisis kesamaan runutan asam amino gen protein selubung tersebut berkisar 88% sampai 100%. Hasil analisis memberikan indikasi bahwa keragaman genetik isolat-isolat RTBV hanya tinggi pada tingkat runutan basa nukleotidanya. Hasil analisis kesamaan runutan basa nukleotida sebagian gen protein selubung RGSV dari 20 isolat memiliki tingkat kesamaan berkisar 30% sampai 98%, sedangkan analisis kesamaan runutan asam amino gen protein selubung tersebut berkisar 20% sampai 100%. Hasil analisis tersebut memberikan indikasi bahwa keragaman genetik isolat-isolat RGSV tinggi pada tingkat runutan basa nukleotida maupun runutan asam aminonya.
Pohon filogenetika berdasarkan runutan basa nukleotida gen protein selubung menunjukkan bahwa 10 isolat RTBV terbagi dalam 3 kelompok dan 20 isolat RGSV terbagi dalam 4 kelompok. Tersebarnya isolat-isolat RTBV dan RGSV dari Jawa pada beberapa kelompok menunjukkan bahwa keragaman isolat-isolat RTBV dan RGSV dari Jawa tidak spesifik lokasi. Nilai genetik yang besar antara isolat-isolat RGSV dari Jawa dengan semua isolat-isolat-isolat-isolat luar Indonesia menjelaskan bahwa isolat RGSV dari Jawa adalah strain yang berbeda dengan isolat-isolat RGSV lainnya yang telah dilaporkan sebelumnya.
Penelitian ini menunjukkan terdapatnya keragaman genetik dan gejala isolat-isolat RTBV dan RGSV dari Jawa. Penelitian untuk mengetahui keragaman genetik dan gejala isolat-isolat RTBV dan RGSV dari daerah endemik tungro dan kerdil rumput lainnya di Indonesia masih sangat diperlukan.
DWI ASTUTI. Diversity of Coat Protein Gene of Rice tungro bacilliform
tungrovirus (RTBV) and Rice grassy stunt tenuivirus (RGSV) Isolates from
Several Districts in Java Island. Supervised by ENDANG NURHAYATI and SRI HENDRASTUTI HIDAYAT
Indonesia is the largest consumer of rice in the world. International Rice
Research Institute (IRRI) estimated that Indonesia may require an increase in rice
production for the next 25 years. Among many constrains in rice production increement is plant diseases including tungro and grassy stunt diseases.
Tungro disease is caused by infection of two viruses, Rice tungro bacilliform
tungrovirus (RTBV) and Rice tungro spherical waikavirus (RTSV). These viruses
are transmitted by the rice leaf hopper vectors which mainly is green leafhoppers (Nephotettix virescens). RTBV is a determinant of the disease symptoms eventhough it could not infect rice without the presence of RTSV. Infected plants showed typical tungro symptoms involving stunting, yellow or orange-yellow discoloration of the leaves, reduced number of tillers and rust-colored spots on the leaves. In 2006 a new symptoms was found in paddy crop in Indonesia, i.e. yellow-orange discoloration of the leaves, reduced number of tillers without any reduction in plant height. It was reported that the disease is caused by infection of Rice
grassy stunt tenuivirus (RGSV) the cause of grassy stunt disease.
Symptoms similarity of tungro and RGSV infection may cause difficulty in disease diagnosis and cause confusion in determining diseases control strategies. Therefore research on symptoms and genetic diversity of RTBV and RGSV is necessary to determine the appropriate control strategy.
The genetic diversity of RTBV isolates from South Asia and Southeast Asia as well as from some tungro endemic area in Indonesia based on the symptoms variation and diversity of coat protein gene have been reported. The genetic diversity of the isolates RGSV from two areas in Taiwan and Philippines based on symptoms variation have also been reported.
Genetic and symptoms diversity of RTBV and RGSV could be analysed through the diversity of coat protein gene. Coat protein gene is known as a determinant factor of infection, virulence, and symptoms induction. The research is conducted to study the diversity of symptoms and coat protein gene of RTBV and RGSV from several districts in Java. The areas in Bogor, Subang, Pandeglang, Klaten, Batang, Sleman, Jember and Banyuwangi were selected as disease survey location because these regions were reported as endemic areas for tungro disease and brown leafhopper.
The study includes three main activities, i.e. observation of symptoms in the field and sampling of infected plants, detection of RTBV and RGSV, and analysis of diversity of coat protein gene of RTBV and RGSV. Most infected plants in the fields showed tungro-like symptoms. Two variations of symptoms can be classified by the number of tillers and plant height. These symptoms variations can be caused by RTBV or RGSV infection or mix infection of RTBV and RGSV as indicated by detection results using PCR.
Therefore identification of diseases based only on symptoms are not sufficient. The whole coat protein gene of RTBV was amplified using DA-F and DA-R primers with the amplicon of 1224 bp. Part of coat protein gene of RGSV amplified using F3 and B3 primers with the amplicon of 243 bp.
Amplified DNAs were then used for sequencing and further analysis of genetic diversity among isolates using phylogenetic analysis by Neighbor-Joining method. Analysis of nucleotide sequence of coat protein gene from 10 isolates of RTBV showed 40% to 100% similarity, whereas analysis of amino acid sequence of the isolates showed 88% to 100% similarity. Analysis of nucleotide sequence of coat protein gene from 20 isolates of RGSV showed 30% to 98% similarity, whereas analysis of amino acid sequence of the isolates showed 20% to 100% similarity. The sequence analysis indicated that genetic diversity of RTBV occurred only in nucleotide level, whereas genetic diversity of RGSV is high on nucleotide as well as amino acid level.
Phylogenetic trees based on nucleotide sequence of coat protein gene showed that 10 isolates of RTBV can be differentiated into 3 groups whereas 20 isolates of RGSV can be differentiated into 4 groups. The diversity of RTBV and RGSV isolates from Java is not location specific. Genetic value between RTBV isolates from Java with isolates outside Indonesia explained that RTBV isolates from Java is similar strain with RTBV isolates that have been reported. Genetic distance‟s value between RGSV isolates from Java with isolates outside Indonesia explained that RGSV isolates from Java is different strain with RGSV isolates that have been reported. Further research is required to determine the genetic and symptoms diversity of RTBV and RGSV isolates from other tungro and grassy stunt endemic areas in Indonesia.
© Hak Cipta Milik IPB, tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apa pun tanpa izin IPB
DAN RICE GRASSY STUNT TENUIVIRUS (RGSV)
DARI BEBERAPA KABUPATEN DI PULAU JAWA
DWI ASTUTI
Tesis
sebagai salah satu syarat untuk mendapatkan gelar Magister Sains pada
Program Studi Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2013
Nama : Dwi Astuti NIM : A352090061 Disetujui Komisi Pembimbing Dr Ir Endang Nurhayati, MS Ketua Dr Ir Sri Hendrastuti H., MSc Anggota Diketahui
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc.
Tanggal Ujian: 22 Januari 2013 Tanggal lulus: Ketua Program Studi Fitopatologi
Dr Ir Sri Hendrastuti H., MSc
Dekan Sekolah Pascasarjana
Puji syukur Kehadirat Allah Subhanahuwata’ala yang telah melimpahkan rahmat serta hidayahNya sehingga penulis dapat menyelesaikan tesis yang berjudul “Keragaman gen protein selubung isolat Rice tungro bacilliform tungrovirus (RTBV) dan Rice grassy stunt tenuivirus (RGSV) dari beberapa kabupaten di pulau Jawa‟. Shalawat dan salam tercurah kepada Nabi Besar Muhammad Shalallahu
Alaihi Wasalam beserta keluarga, sahabat dan para pengikutnya. Tesis ini dibuat
untuk memenuhi syarat memperoleh gelar Magister Sains pada Program Studi Fitopatologi. Penelitian dilaksanakan dari bulan November 2011 sampai bulan Juli 2012.
Penulis mengucapkan terimakasih kepada Dr Ir Endang Nurhayati, MS dan Dr Ir Sri Hendrastuti Hidayat, MSc atas bimbingan, saran, kritik dan dukungan yang besar peranannya dalam penyelesaian tesis ini. Ucapan terimakasih juga disampaikan kepada Dr Ir Hermanu Triwidodo, MSc yang bersedia menjadi penguji luar komisi pada ujian tesis. Terimakasih yang sebesar-besarnya penulis sampaikan kepada Dr Satya Nugroho, Dr Amy Estiati, Dr Enung, Dr Syamsidah, Puspita Deswina, MSc atas ijin penggunaan bahan laboratorium untuk penelitian serta dukungan yang besar kepada penulis dalam penyelesaian studi. Ucapan terimakasih penulis sampaikan kepada suami, orangtua dan saudara yang telah sabar memberi dukungan selama penulis menjalani studi. Ucapan terimakasih yang sebesar-besarnya penulis sampaikan pula kepada segenap pegawai kelompok penelitian PADI yang tidak dapat penulis sebutkan satu per satu baik di laboratorium maupun di RK atas limpahan kasih sayang, semangat, bantuan dan keceriaannya kepada penulis selama penulis menjalani studi.
Penulis menyampaikan terimakasih kepada Bapak Muhtar, Koordinator POPT Dinas Pertanian Kab. Pandeglang; Ibu Dini dan Ibu Usyati di BB Padi Sukamandi; Bapak Sunarno, Koordinator PHT Kab. Klaten; Ana beserta keluarga di Sukoharjo; Bapak Sumarno, Koordinator POPT Disperta Sleman beserta Bapak Suharno, POPT Seyegan dan Bapak Hermanto, POPT Godean; Bapak Susbandoro, Koordinator POPT Disperta Kab. Batang; Mbak Nazwa Faijah beserta keluarga besar di Jember dan Koordinator POPT Disperta Kab. Jember beserta Bapak Sasrur dan rekan-rekan POPT Disperta Kab. Jember; Mbak Yusi beserta keluarga besar di Banyuwangi dan Koordinator POPT Disperta Kab. Banyuwangi beserta para penyuluh POPT Disperta Kab. Banyuwangi atas bantuan yang diberikan. Terimakasih penulis sampaikan pula kepada Bapak Edi dan Pak Dadang selaku teknisi laboratorium Departemen Proteksi Tanaman IPB, serta kawan-kawan di laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman IPB yang tidak dapat penulis sebutkan satu per satu atas masukan moril maupun materi.
Semoga karya ilmiah ini dapat memberikan manfaat.
Bogor, April 2013
DAFTAR TABEL xiii
DAFTAR GAMBAR xiii
DAFTAR LAMPIRAN xiv
PENDAHULUAN 1 Latar Belakang 1 Tujuan Penelitian 3 Manfaat Penelitian 3 Hipotesis 3 TINJAUAN PUSTAKA 3
Karakteristik Penyakit Tungro 3
Arti Penting Penyakit Tungro 3
Gejala Penyakit Tungro 4
Rice Tungro Virus 4
Penularan Virus Tungro 6
Karakteristik Penyakit Kerdil Rumput 7
Arti Penting Penyakit Kerdil Rumput 7
Gejala Penyakit Kerdil Rumput 7
Rice grassy stunt virus (RGSV) 9
Penularan RGSV 10
Keragaman Gen Protein Selubung RTBV dan RGSV 10
Evaluasi dan Analisis Keragaman Genetik RTBV dan RGSV 11
BAHAN DAN METODE 13
Tempat dan Waktu 13
Metode Penelitian 13
Pengamatan Gejala dan Pengambilan Sampel Tanaman 13
Deteksi RTBV 14 18 Isolasi DNA Total Tanaman 14
Perancangan Primer 14
Amplifikasi Gen Protein Selubung RTBV 15
Deteksi RGSV 16
Isolasi RNA Total Tanaman 16
Transkripsi Balik RNA 16
Analisis Kesesuaian Primer Gen Protein Selubung RGSV 16
Amplifikasi Sebagian Gen Protein selubung RGSV 17
Analisis Keragaman Gen Protein Selubung RTBV dan RGSV 17
Perunutan dan Penyejajaran Basa DNA RTBV dan RNA RGSV 17
Analisis Keragaman 18
HASIL DAN PEMBAHASAN 18
Variasi Gejala Infeksi Virus pada Tanaman padi di Lapangan 18
Deteksi RTBV dan RGSV 20
Tingkat Kesamaan Runutan Basa Nukleotida dan Asam Amino Gen Protein Selubung RTBV 23
Tingkat Kesamaan Runutan Basa Nukleotida dan Asam Amino Gen Protein Selubung RGSV 25
Selubung RTBV 27
Filogenetika Berdasarkan Runutan Basa Nukleotida Gen Protein Selubung RGSV 28
SIMPULAN 30
DAFTAR PUSTAKA 30
2 Hasil deteksi RTBV dan RGSV dari beberapa kabupaten di Jawa 22
3 Posisi dan panjang runutan gen protein selubung isolat-isolat RTBV Dari 8 kabupaten di Jawa 24
4 Isolat-isolat yang tersedia pada GenBank sebagai referensi perbandingan analisis gen protein selubung RTBV 24
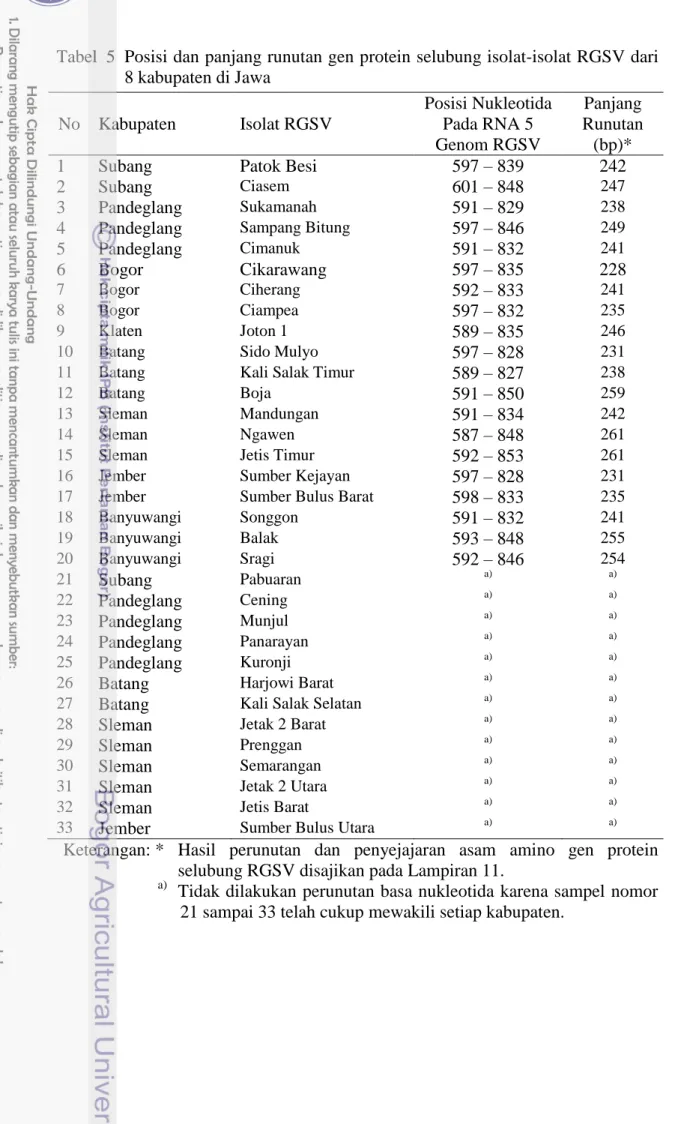
5 Posisi dan panjang runutan gen protein selubung isolat-isolat RGSV dari 8 kabupaten di Jawa 26
6 Isolat-isolat yang tersedia pada GenBank sebagai referensi perbandingan analisis gen protein selubung RGSV 27
DAFTAR GAMBAR
1 Gejala penyakit tungro 42 Gambaran skematik organisasi genom RTBV 5
3 Gejala penyakit kerdil rumput 8
4 Gejala penyakit kerdil rumput tipe-2 9
5 Gambaran skematik organisasi genom RGSV 10
6 Gambaran skematik perancangan primer DA-RTBV 15
7 Gambaran skematik penempelan primer F3 dan B3 17
8 Variasi gejala kelompok pertama 18
9 Variasi gejala kelompok kedua 19
10 Hasil amplifikasi gen protein selubung RTBV 20
11 Hasil amplifikasi sebagian gen protein selubung RGSV 21
12 Pohon filogenetik isolat-isolat RTBV 28
2007-2011 di beberapa kabupaten di Jawa 37 2 Luas serangan wereng batang coklat pada tanaman padi
pada tahun 2007-2011 di beberapa kabupaten di Jawa 38 3 Hasil amplifikasi gen protein selubung RTBV dan RGSV
dari sampel tanaman padi dari beberapa kabupaten di Jawa 39 4 Varietas, umur dan gejala umum sampel tanaman padi
yang diambil dari beberapa kabupaten di Jawa 41 5 Runutan basa nukleotida gen protein selubung isolat-isolat RTBV
dari beberapa kabupaten di Jawa 43 6 Tingkat kesamaan (%) runutan basa nukleotida isolat-isolat RTBV
dari beberapa kabupaten di Jawa 51 7 Runutan asam amino gen protein selubung isolat-isolat RTBV
dari beberapa kabupaten di Jawa 52
8 Tingkat kesamaan (%) runutan asam amino isolat-isolat RTBV
dari beberapa kabupaten di Jawa 55
9 Runutan basa nukleotida gen protein selubung isolat-isolat RGSV
dari beberapa kabupaten di Jawa 56
10 Tingkat kesamaan (%) runutan basa nukleotida isolat-isolat RGSV
dari beberapa kabupaten di Jawa 58
11 Runutan asam amino gen protein selubung isolat-isolat RGSV
dari beberapa kabupaten di Jawa 59
12 Tingkat kesamaan (%) runutan asam amino isolat-isolat RGSV
PENDAHULUAN
Latar Belakang
Padi merupakan sumber pangan utama setengah dari populasi penduduk dunia (FAO 2004), termasuk Indonesia (Zeigler dan Barclay 2008). Indonesia merupakan negara terbesar pengonsumsi beras dengan lebih dari 135 kg per kapita per tahun (IRRI 2010b). Indonesia adalah negara penghasil beras terbesar ketiga di dunia setelah Cina dan India dengan produksi lebih dari 66 juta ton (IRRI 2010a).
International Rice Research Institute (IRRI) memperkirakan Indonesia akan
membutuhkan lebih banyak lagi beras untuk 25 tahun mendatang. Hal tersebut berarti produksi beras sebesar 4.6 ton/ha harus ditingkatkan menjadi lebih dari 6 ton/ha (IRRI 2010b).
Salah satu kendala peningkatan produksi padi nasional adalah gangguan hama dan penyakit tanaman. Organisme pengganggu tanaman (OPT) utama yang menyerang tanaman padi adalah penggerek batang, wereng batang coklat, tikus, cendawan Pyricularia oryzae penyebab penyakit blas, bakteri Xanthomonas oryzae penyebab penyakit kresek, dan virus tungro penyebab penyakit tungro (Direktorat Perlindungan Tanaman Pangan 2011c; Baehaki 2011; Widiarta 2005). Wereng batang coklat selain merugikan secara langsung sebagai hama tanaman juga merugikan sebagai vektor pembawa virus kerdil rumput penyebab penyakit kerdil rumput dan virus kerdil hampa penyebab penyakit kerdil hampa (Baehaki 2011).
Luas serangan virus tungro pada periode Maret sampai September 2011 sebesar 8 399 ha dan 100 ha diantaranya mengalami puso (Direktorat Perlindungan Tanaman Pangan 2011a). Berdasarkan data yang didapatkan dari Direktorat Perlindungan Tanaman Pangan, pertanaman padi di daerah-daerah endemik tungro di beberapa kabupaten di Jawa yaitu antara lain di Kabupaten Pandeglang, Subang, Bogor, Klaten, Batang, Sleman, Jember dan Banyuwangi pada tahun 2011 masih cukup tinggi terinfeksi virus tungro. Pada tahun 2011 luas infeksi virus tungro pada tanaman padi di beberapa kabupaten tersebut mencapai 1 353 ha dan 9 ha mengalami puso (Lampiran 1). Penyakit tungro disebabkan oleh infeksi dua virus yang berasosiasi yakni Rice tungro bacilliform tungrovirus (RTBV) dan Rice tungro spherical waikavirus (RTSV) (Hibino et al. 1978) yang ditularkan terutama oleh wereng hijau (Nephotettix virescens) (Hibino dan Cabauatan 1987). Gejala utama penyakit tungro antara lain tampak pada perubahan warna daun muda menjadi kuning-oranye dimulai dari ujung daun, daun muda agak menggulung, jumlah anakan berkurang dan tanaman menjadi kerdil (Hibino
et al. 1978). Hibino (1996) menyebutkan bahwa penentu gejala tersebut adalah
akibat infeksi RTBV walaupun RTBV tidak dapat menginfeksi tanaman tanpa adanya RTSV.
Isolat-isolat RTBV dari negara Asia Selatan seperti India, dan beberapa negara Asia Tenggara seperti Bangladesh, Malaysia dan Thailand (Banarjee et al. 2011) termasuk Indonesia yang dilaporkan oleh Fan et al. (1996) menunjukkan adanya keragaman genetik. Azzam dan Chancellor (2002b) melaporkan juga adanya keragaman isolat RTBV dari dua daerah di Filipina yang diketahui melalui perbedaan gejala dan Polymerase Chain Reaction-Restriction Fragment Length
melaporkan adanya keragaman gen protein selubung isolat RTBV dari beberapa daerah endemis tungro di Indonesia.
Penyakit kerdil rumput yang disebabkan oleh infeksi virus kerdil rumput juga turut menjadi kendala peningkatan produksi padi nasional. Baehaki (2011) melaporkan bahwa pada tahun 2010 penyakit kerdil rumput telah menyebar di pertanaman padi yang membentang sepanjang Pulau Jawa dari Banten sampai Jawa Timur. Infeksi RGSV meluas seiring terjadinya ledakan wereng batang coklat (Nilaparvata lugens) sebagai vektor virus ini. Berdasarkan data yang didapatkan dari Direktorat Perlindungan Tanaman Pangan, pertanaman padi di beberapa daerah di Jawa pada tahun 2010 sampai 2011 mengalami serangan wereng batang coklat yang cukup tinggi dibanding tahun-tahun sebelumnya. Beberapa daerah tersebut antara lain Kabupaten Bogor, Pandeglang, Subang, Batang, Klaten, Sleman, Jember dan Banyuwangi. Luas serangan wereng batang coklat pada daerah-daerah tersebut berkisar 5 060 ha sampai 7 527 ha dengan 2 ha sampai 134 ha mengalami puso pada tahun 2007-2009. Pada tahun 2010-2011 luas serangan wereng batang coklat pada daerah-daerah tersebut berkisar 19 309 ha sampai 39 881 ha dengan 1 106 ha sampai 2 309 ha mengalami puso (Lampiran 2). Penyakit kerdil rumput disebabkan oleh Rice grassy stunt tenuivirus (RGSV). Tanaman padi yang terinfeksi RGSV menunjukkan gejala kerdil, jumlah anakan banyak, tumbuh tegak serta memendek, daun menyempit, warna daun menjadi hijau pucat hingga kuning dan tidak menghasilkan malai (Knowledgebank 2010).
Seperti halnya virus tungro, keragaman isolat-isolat RGSV telah dilaporkan oleh Chen dan Chiu (1982) yang didasarkan pada perbedaan gejala dari dua daerah di Taiwan. Dua isolat tersebut, isolat B dan isolat Y, menyebabkan perbedaan gejala yang jelas pada jumlah anakan dan lamina daun. Gejala yang ditimbulkan isolat Y mirip dengan gejala infeksi virus tungro. Di Filipina juga dilaporkan adanya keragaman isolat RGSV berdasarkan perbedaan gejala (Hibino et al. 1985). Tanaman padi varietas TN1 diinokulasi isolat RGSV yang berbeda yaitu RGSV-1 dan RGSV-2. Tanaman yang terinfeksi RGSV-2 menunjukkan gejala mirip dengan gejala infeksi virus tungro. Keragaman dua isolat RGSV yang lain di Filipina berdasarkan runutan basa nukleotida dilaporkan oleh Miranda et al. (2000).
Keragaman isolat RGSV dengan gejala mirip tungro seperti di Taiwan dan Filipina ditemui juga pada tanaman padi di Indonesia, khususnya di Subang (Suprihanto 2008). Kemiripan gejala karena infeksi virus tungro dan RGSV menyebabkan kesulitan dalam melakukan diagnosis penyebab penyakit sehingga menimbulkan keresahan dikalangan petani dan para praktisi dalam menentukan strategi pengendalian penyakit tungro dan kerdil rumput.
Penelitian mengenai keragaman gejala dan keragaman genetik RTBV dan RGSV sangat diperlukan untuk menentukan strategi pengendalian yang tepat. Keragaman genetik RTBV dan RGSV dapat diketahui melalui keragaman gen protein selubungnya. Gen protein selubung memiliki peranan penting dalam proses terjadinya penyakit (Mangrauthia et al. 2012). Keragaman genetik dan gejala yang disebabkan RTBV dan RGSV dapat diketahui melalui keragaman gen protein selubungnya. Selain sebagai penentu faktor infeksi dan faktor virulensi, gen protein selubung juga berperan sebagai penginduksi gejala (Bol 2008). Oleh karena itu, perlu dilakukan penelitian untuk mempelajari keragaman gejala dan keragaman gen protein selubung RTBV dan RGSV dari beberapa daerah di Jawa. Daerah-daerah di Kabupaten Bogor, Subang, Pandeglang, Klaten, Batang, Sleman, Jember
dan Banyuwangi dipilih sebagai daerah survei penyakit karena daerah-daerah ini dilaporkan sebagai daerah endemis penyakit tungro dan wereng batang coklat (WBC) (Direktorat Perlindungan Tanaman Pangan 2011a dan 2011b).
Tujuan Penelitian
Penelitian dilakukan untuk mempelajari keragaman gejala dan keragaman gen protein selubung isolat-isolat RTBV dan RGSV yang dikumpulkan dari tanaman yang bergejala mirip tungro di Jawa yaitu dari Kabupaten Bogor, Subang, Pandeglang, Klaten, Batang, Sleman, Jember dan Banyuwangi.
Manfaat Penelitian
Penelitian diharapkan dapat memberikan informasi tentang keragaman RTBV dan RGSV di Jawa yang berguna bagi perancangan strategi pengendalian penyakit tungro dan kerdil rumput.
Hipotesis
Terdapat keragaman gen protein selubung RTBV dan RGSV pada tanaman padi bergejala mirip tungro dari beberapa daerah endemik tungro dan wereng batang coklat di Jawa.
TINJAUAN PUSTAKA
Karakteristik Penyakit Tungro Arti Penting Penyakit Tungro
Tungro berasal dari bahasa Tagalog yang berarti pertumbuhan terhambat (Azzam dan Chancellor 2002a; Mutsanna 2008). Penyakit tungro dikenal dengan berbagai nama daerah di Indonesia seperti “Mentek” di Jawa, “Kebebeng” di Bali, “Habang” di Kalimantan, “Cella Pance” di Sulawesi Selatan dan “Konjo” di Sulawesi Tengah (Burhanuddin 2005).
Penyakit tungro tidak hanya merupakan penyakit tanaman padi terpenting di Indonesia tetapi juga di negara-negara Asia Selatan dan Asia Tenggara (Ganesan et al. 2009). Banyak petani di Asia Selatan dan Asia Tenggara menggambarkan penyakit tungro seperti penyakit kanker karena kerusakan yang parah dan sulit untuk dikendalikan (Azzam dan Chancellor 2002b). Penyakit tungro juga merupakan salah satu kendala produksi padi di Indonesia karena kehilangan hasil yang nyata dengan luas tanaman terinfeksi setiap tahunnya rata-rata mencapai 16 477 ha (BB Padi 2010). Luas serangan virus tungro pada tahun 2010 mencapai 13 461 ha dan 121 ha mengalami puso (Direktorat Perlindungan Tanaman Pangan 2011b). Penyakit ini telah menyebar hampir ke seluruh Indonesia (Direktorat Perlindungan Tanaman Pangan 2010), terutama di daerah sentra
produksi beras nasional seperti di Pulau Jawa, Bali, Nusa Tenggara Barat, Sulawesi dan Kalimantan Selatan (BB Padi 2010).
Penyakit tungro disebabkan oleh infeksi bersama dua bentuk partikel virus tungro yakni Rice tungro bacilliform tungrovirus (RTBV) dan Rice tungro
spherical wakaivirus (RTSV) (Jones et al. 1991). Kedua virus tersebut ditularkan
terutama oleh wereng hijau Nephotettix virescens Distant (Hemiptera: Cicadelidae) (Hibino dan Cabunagan 1986).
Gejala Penyakit Tungro
Tanaman padi yang terinfeksi oleh RTBV dan RTSV secara bersama-sama akan menunjukkan gejala yang kompleks dan menjadi parah termasuk kerdil, penurunan jumlah anakan, perubahan warna daun menjadi kuning sampai kuning-oranye (Dasgupta et al. 1991) dan adanya bercak coklat karat pada daun (Dahal et al. 1992) (Gambar 1). Gejala belang (mottle), memutar dan klorosis antar tulang daun dapat diamati pada daun yang sangat muda (Sta et al. 1993). Apabila tanaman padi hanya terinfeksi oleh RTBV saja maka gejala yang ditimbulkan adalah gejala khas tungro ringan sedangkan apabila tanaman padi hanya terinfeksi oleh RTSV maka tanaman hampir tidak menunjukkan gejala atau kerdil sangat ringan (Hibino 1983). Dalam hal ini RTBV berfungsi sebagai penentu gejala sedangkan RTSV adalah virus helper (Hibino 1996). Secara visual, gejala penyakit tungro sering dikacaukan dengan penyakit yang disebabkan oleh virus lain atau akibat kekurangan unsur hara tertentu seperti nitrogen (Dahal et al. 1992).
Gambar 1 Gejala penyakit tungro. (A) Gejala pada daun yaitu adanya perubahan warna daun menjadi kuning-oranye. (B) Gejala pada rumpun padi yang ditunjukkan dengan tanaman kerdil dan anakan sedikit (Knowledgebank.irri.org).
Rice Tungro Virus
Rice tungro virus terdiri dari dua partikel virus yaitu RTSV dan RTBV. RTSV termasuk Famili Secoviridae, Genus Wakaivirus (ICTVdB 2009). Partikel RTSV berbentuk polihedral (Hibino 1996) terbungkus dalam partikel isometrik dengan diameter 30 nm (Hibino et al. 1978; Hull 2002). Protein selubung RTSV terbentuk dari dua jenis molekul protein (Agrios 2005). RTSV mempunyai genom poliadenil RNA utas tunggal (Jones et al. 1991) berukuran kira-kira 10 kb (kilo base) (Jones et al. 1991).
RTBV termasuk Famili Caulimoviridae, Genus Tungrovirus (ICTVdB 2009). Partikel RTBV berbentuk bacilliform dengan diameter 30-35 nm dan panjang kira-kira 100 sampai 300 nm yang bervariasi antar isolat (Herzog et al. 2000). Partikel berisi suatu genom DNA utas ganda melingkar yang diperbanyak melalui transkripsi balik (Ahmed dan Tissera 2001). Genom DNA RTBV berukuran 8 kb yang mengandung dua site-specific discontinuities hasil dari proses replikasi oleh
reverse transcription dan memiliki empat open reading frames (ORFs) besar
(Gambar 2A) (Herzog et al. 2000). Protein P1, P2, P3 dan P4 disintesis oleh mekanisme translasi khusus (Herzog et al. 2000) dari suatu pregenomic RNA yang digunakan sebagai templat untuk replikasi virus dan sebagai polycistronic mRNA (Hull 1996).
Gambar 2 Gambaran skematik organisasi genom RTBV (A) dan P3 polyprotein (B). DNA digambarkan oleh dua garis tipis dengan
dua daerah tidak bersambung (∆1 dan ∆2). Anak panah tebal di luar menggambarkan empat gen virus ini (I, II, III, IV). Pregenomic RNA ditunjukkan dengan anak panah tipis di sebelah dalam DNA. Lokasi dari domain-domain tersebut berhubungan dengan movement protein (MP), Coat Protein (CP), aspartic protease (PR), reverse transcriptase (RT), dan Rnase H (RH) dalam P3. Fungsi domain yang tidak diketahui ditandai dengan tanda tanya. Posisi daerah pemotongan dicirikan oleh garis vertikal dan anak panah. Dugaan daerah potongan yang lain disimbolkan oleh garis zig zag dan tanda tanya. Posisi ujung amino dan karboksi dari protein selubung (p37) dan RT (p55 dan p62) telah diindikasikan. Lingkaran bulat menunjukkan posisi dari zinc
Fungsi P1 (24 kDa) dan P4 (46 kDa) belum diketahui. P3 adalah suatu poliprotein besar yaitu 196 kDa (Gambar 2B). Perbandingan urutan asam amino P3 tersebut dengan protein retroviral dan pararetroviral lain menunjukkan bahwa P3 berisi domain yang berhubungan dengan movement protein (MP), coat protein (CP), aspartic protease (PR), reverse transcriptase (RT), dan Rnase H (RH), urutan N sampai C terminus. Sebagian PR berfungsi dalam pembentukan P3 (Herzog et al. 2000).
Qu et al. (1991) melaporkan bahwa partikel RTBV mengandung dua spesies protein selubung (coat protein) yaitu 33 kDa dan 37 kDa. Marmey et al. (1999) melaporkan hal yang berbeda yaitu bahwa RTBV mengandung satu spesies protein selubung 37 kDa dengan peptida kedua (34 kDa) kemungkinan besar adalah produk degradasi protein 37 kDa selama proses purifikasi virus. Gen protein selubung RTBV adalah komponen mayor dari kapsid virus yang memainkan peranan penting dalam kontrol selama proses translokasi ke inti sel tanaman. Pada DNA virus tanaman, translokasi genom virus ke dalam inti sel tanaman adalah langkah kunci dalam proses replikasi virus. Proses translokasi ini berjalan dengan melibatkan sebuah signal yang disebut signal lokalisasi inti (Nuclear Localization
Signals, NLSs). Gen protein selubung RTBV memiliki dua NLS di daerah N dan
C-terminal. Daerah C-terminal dari selubung protein RTBV memiliki daerah terpelihara yang panjang (asam amino 743-769) (Peraza et al. 2005).
Gen protein selubung telah banyak digunakan untuk studi keragaman secara molekular karena gen selubung protein telah diketahui sebagai penentu antigenik utama pada permukaan partikel virus dalam interaksi virus dan inang (Mangrauthia et al. 2012). Bol (2008) melaporkan fungsi-fungsi lain dari gen protein selubung yaitu antara lain berperan dalam translasi RNA virus dan replikasi genom virus, perpindahan virus dari sel ke sel atau secara sistemik dalam tanaman inang, penentu terjadinya gejala dan virulensi serta sebagai faktor penentu spesifik penularan virus oleh vektor. Selain dari fungsi, gen protein selubung juga banyak digunakan untuk studi keragaman virus karena komposisi asam amino dari gen protein selubung virus tanaman sangat khas bagi suatu grup virus (Fauquet et al. 1986). Runutan asam amino gen selubung protein virus tanaman menunjukkan sangat kecil atau bahkan tidak ada kesesuaian dengan grup virus tanaman lainnya (Shukla dan Ward 1988).
Penularan Virus Tungro
Virus tungro ditularkan oleh wereng daun antara lain wereng loreng (Recilia
dorsalis) dan wereng hijau (Nephotettix spp). Terdapat empat spesies wereng hijau
di Indonesia sebagai vektor virus tungro yaitu N. virescens, N. nigropictus,
N.malayanus, dan N. parvus (Supriyadi et al. 2004). N. virescens adalah serangga
vektor utama (Azzam dan Chancellor 2002b) yang paling efisien dalam menularkan kompleks virus penyebab penyakit tungro (Hibino dan Cabunagan 1986). N. virescens menularkan RTSV secara bebas, sedangkan untuk menularkan RTBV vektor ini membutuhkan kehadiran RTSV (Ahmed dan Tissera 2001). Hibino (1996) melaporkan bahwa wereng hijau dapat memindahkan RTSV dari tanaman padi yang hanya terinfeksi RTSV, tetapi tidak dapat memindahkan RTBV dari tanaman yang hanya terinfeksi RTBV. RTBV hanya dapat dipindahkan oleh wereng hijau dari tanaman yang telah terinfeksi RTSV. Dengan demikian RTSV berfungsi sebagai helper dan RTBV adalah virus dependent.
RTBV dan RTSV keduanya ditularkan secara tular stilet (stylet-borne) yang bersifat semipersisten nonsirkulatif dan komponen helper sangat penting bagi penjerapan spesifik RTBV dalam dinding mulut wereng daun (Hibino 1996). Ling (1966) menyebutkan bahwa di dalam tubuh vektor, virus tidak dapat ditularkan ke telur maupun stadia perkembangan imago. N. virescens yang telah mendapat virus segera dapat menularkannya sampai virus yang diperoleh habis sehingga kehilangan kemampuan menularkan virus. Masa terpanjang vektor tersebut mampu menularkan virus adalah 6 hari dan gejala akan tampak pada 6-15 hari setelah infeksi (Wathanakul dan Weerapat 1969).
Karakteristik Penyakit Kerdil Rumput Arti Penting Penyakit Kerdil Rumput
Penyakit kerdil rumput dilaporkan pertama kali di temukan pada tahun 1970 di Taiwan (Chen dan Chiu 1982). Pada tahun 1982-1983 penyakit ini dilaporkan ditemukan di Filipina (Hibino et al. 1985) dan pada tahun 1984 di India (Mariappan et al. 1984). Penyakit ini selanjutnya ditemukan terjadi di China dan Jepang (Hibino 1996). Penyakit ini disebabkan oleh infeksi Rice grassy stunt virus (RGSV) (Hibino 1996).
Kerugian ekonomi yang diakibatkan penyakit kerdil rumput belum bisa ditaksir secara tepat karena besarnya kehilangan hasil akibat penyakit ini tidak bisa dipisahkan dari kehilangan hasil yang diakibatkan oleh serangan wereng batang coklat (Tantera 1973 dalam Yoshida dan Oka 1982). Hibino (1989) melaporkan kejadian penyakit kerdil rumput di Indonesia pada tahun 1970-1977. Hal ini diperkuat oleh Tantera (1973) dalam Yoshida dan Oka (1982) yang melaporkan bahwa pada tahun 1971 pertanaman padi di Jawa Tengah seluas 8 000 ha terinfeksi RGSV dan bersama-sama dengan serangan wereng batang coklat mengakibatkan kehilangan hasil sebesar 77.8%. Hibino (1989) juga melaporkan terjadinya ledakan penyakit kerdil rumput di Filipina pada tahun 1982-1983. Du et al. (2005) melaporkan bahwa pada tahun 2000 Vietnam mengalami kerugian ekonomi yang cukup besar akibat penyakit kerdil rumput, kerdil hampa dan akibat langsung serangan wereng batang coklat. Dua laporan tersebut tidak mencantumkan dengan jelas berapa nilai kerugian yang dialami.
Gejala Penyakit Kerdil Rumput
Tanaman padi yang terinfeksi RGSV menunjukkan gejala kerdil, jumlah anakan banyak dan tumbuhnya tegak serta memendek, warna daun menjadi hijau pucat hingga kuning disertai penyempitan daun (Knowledgebank 2010) dengan bercak-bercak berwarna coklat dan kadang-kadang muncul gejala belang (Muhsin dan Widiarta 2008) seperti ditunjukkan pada Gambar 3.
Gambar 3 Gejala penyakit kerdil rumput. (A) Gejala pada rumpun tanaman padi yang menunjukkan perubahan warna daun menjadi hijau pucat hingga kuning. (B) Gejala pada rumpun tanaman padi di pertanaman padi yang menunjukkan jumlah anakan yang banyak, penyempitan daun, kerdil dan perubahan warna daun menjadi hijau pucat hingga kuning (Knowledgebank.irri.org)
Pada tahun 1982-1983 di Filipina ditemukan penyakit kerdil rumput dengan gejala seperti penyakit tungro (Hibino 1996). Selain itu penyakit ini tidak ditularkan oleh wereng daun sebagai vektor virus tungro yaitu wereng loreng dan wereng hijau melainkan oleh wereng batang coklat. Penyakit ini pada akhirnya disebut sebagai penyakit kerdil rumput tipe-2 yang disebabkan oleh infeksi virus
Rice grassy stunt virus-2 (RGSV2) (Hibino et al. 1985)
Pusat Penelitian dan Pengembangan Tanaman Pangan Kementerian Pertanian Republik Indonesia pada tahun 2007 melaporkan dan melakukan pengujian terhadap tanaman padi yang menguning dengan gejala seperti gejala penyakit tungro. Penyakit tersebut diduga sebagai gejala penyakit kerdil rumput tipe-2 (Gambar 4). Tanaman padi yang terinfeksi RGSV2 akan menampakkan warna daun yang lebih kuning hingga oranye dibandingkan dengan yang terinfeksi RGSV (Hibino et al. 1985). Gejala secara visual di lapangan menunjukkan kemiripan dengan gejala penyakit tungro (Hibino et al. 1985) tetapi ada beberapa perbedaan yaitu dalam satu rumpun daun yang menunjukkan gejala kadang hanya pada beberapa anakan atau bahkan gejala hanya pada beberapa daun saja sedangkan pada penyakit tungro biasanya satu rumpun terserang hampir semua anakannya. Tanaman yang terserang pada stadia dewasa daunnya berwarna kuning-oranye sama seperti pada penyakit tungro tetapi lebar daun normal dengan jumlah anakan dan tinggi tanaman sama dengan tanaman sehat (Puslitbangtan 2007).
Gambar 4 Gejala penyakit kerdil rumput tipe-2. (A) Gejala pada rumpun tanaman padi yaitu daun kaku berwarna kuning jingga dan anakan sedikit (BBP2TP 2010). (B) Gejala pada rumpun tanaman padi yang menunjukkan jumlah anakan sedikit, perubahan warna daun menjadi kuning jingga dan agak kerdil (Muhsin 2010)
Rice grassy stunt virus (RGSV)
RGSV termasuk Famili Bunyaviridae, Genus Tenuivirus (Hull 2002). RGSV memiliki keunikan dan beberapa perbedaan dari genus Tenuivirus yang lainnya seperti Rice stripe virus (RSV) terutama dalam hal struktur genomnya (Hull 2002). Partikel RGSV berbentuk pleomorphic, dapat terlihat seperti filamen tipis ataupun filamen yang melingkar dan seringkali membentuk konfigurasi spiral (Toriyama et al. 1998). Organisasi genom RGSV terdiri dari 6 segmen RNA yang seluruhnya adalah molekul single-stranded RNA yang ambisense (Miranda et al. 2000) dan memiliki total 12 ORF (Chomchan et al. 2003).
RNA 1, 2, 5, dan 6 pada RGSV adalah ekuivalen dengan RNA 1, 2, 3, dan 4 pada RSV, dan RNA 3 dan 4 adalah unik pada genus Tenuivirus (Gambar 5). RNA 1 pada RSV dan virus lainnya pada genus Tenuivirus adalah negative sense dan mengkode hanya RNA-dependent RNA polymerase (RdRp) besar pada complementary strand 1 (cRNA 1), sedangkan RNA 1 pada RGSV adalah
ambisense dan terdapat ORF kecil pada viral strand 1 (vRNA1). Sampai saat ini,
dari 12 ORF yang mengkode protein, hanya RdRp yang berukuran 339-kDa yang dikode di cRNA 1 dan nucleo-capsid protein (N) yang dikode di cRNA 5 yang diketahui fungsinya (Chomchan et al. 2002).
Gambar 5 Gambaran skematik organisasi genom RGSV. vRNA, virus genomic
strand; cRNA, complementary strand RNA; kotak berwarna abu-abu
menunjukkan ORF yang ada pada semua Tenuivirus sedangkan kotak dengan titik-titik ditengahnya adalah ORF yang unik yang hanya dimiliki oleh RGSV (Chomchan et al. 2003).
Penularan RGSV
Wereng batang coklat Nilaparvata lugens Stål (Hemiptera: Delphacidae) adalah serangga vektor utama penular RGSV selain dua spesies Nilaparvata spp lainnya yaitu N. bakeri dan N. muiri (Hibino 1996). Selain sebagai vektor RGSV,
N. lugens merupakan hama paling penting pada pertanaman padi di Indonesia
(Subroto et al. 1992). N. lugens menularkan RGSV secara persisten propagatif, tidak ditularkan melalui telur (Cabauatan et al. 2009).
RGSV dapat ditularkan oleh nimfa maupun N. lugens dewasa.
N. lugens mendapatkan virus dengan makan pada tanaman padi sakit (periode
makan akuisisi) selama 5 sampai 10 menit. Persentase virus pada tubuh N. lugens akan semakin meningkat jika periode makan akuisisi semakin lama (Reissig et al. 1986). Hull (2002) menjelaskan bahwa virus yang ditularkan secara persisten propagatif memperbanyak diri dalam vektornya terlebih dahulu sebelum ditularkan pada tanaman inang dan waktu yang dibutuhkan disebut sebagai periode laten. Periode laten RGSV dalam tubuh N. lugens rata-rata 10 hari dan N. lugens sudah dapat menularkan virus pada tanaman sehat (Reissig et al. 1986). Cabauatan et al. (2009) melaporkan bahwa penularan RGSV bersifat transtadial yaitu virus tetap berada dalam tubuh vektor selama siklus hidupnya. Hal ini seperti yang dilaporkan oleh Reissig et al. (1986) bahwa periode retensi (waktu yang dibutuhkan oleh virus dapat bertahan dalam tubuh vektornya) RGSV yaitu selama siklus hidup N. lugens (24 hari).
Keragaman Gen Protein Selubung RTBV dan RGSV
Menurut Fan et al. (1996) genom RTBV memiliki tingkat variasi yang besar. Keragaman genetik isolat RTBV dari India, Bangladesh, Indonesia, Malaysia, dan Thailand telah diteliti meliputi penelitian tentang pemetaan, hibridisasi dan urutan basa DNA. Selanjutnya, Banerjee et al. (2011) melaporkan keragaman genetik yang didasarkan pada runutan basa nukleotida dan asam amino pada beberapa isolat RTBV dari India dan isolat-isolat RTBV dari beberapa daerah di Filipina, Malaysia dan Thailand. Isolat-isolat RTBV tersebut selanjutnya dikelompokkan berdasarkan keragamannya menjadi dua kelompok yaitu kelompok
Asia Selatan dan Asia Tenggara. Keragaman isolat-RTBV melalui pengamatan gejala dan analisis Polymerase Chain Reaction – Restriction Fragment Length
Polymorphism (PCR-RFLP) dari Filipina dilaporkan oleh Azzam dan Chancellor
(2002a) dan Indonesia oleh Suprihanto (2005).
Keragaman pada empat isolat RTBV dari Filipina berdasarkan gejala yang berbeda pada varietas padi TN1 dan FK135 dilaporkan oleh Cabauatan et al. (1995). Uji RFLP dilakukan pula terhadap genom empat isolat RTBV tersebut dan pola RFLP menunjukkan hasil yang beragam. Suprihanto (2005) juga melakukan uji penularan virus tungro pada tanaman diferensial TN1 dan FK135, dan uji PCR-RFLP terhadap delapan isolat RTBV Indonesia. Berdasarkan gejala yang diamati dan pola PCR-RFLP diketahui bahwa delapan isolat RTBV tersebut berturut-turut menyebabkan gejala yang berbeda terutama pada warna daun dan keragaman pada gen protein selubungnya. Demikian juga Arfianis (2006) melakukan uji diferensasi dengan PCR-RFLP terhadap empat isolat Jawa Barat dan Hikmahayati (2010) terhadap dua isolat Sulawesi dan satu isolat Bogor. Hasil yang diperoleh menunjukkan adanya keragaman gen protein selubung RTBV.
Keragaman RGSV telah dilaporkan oleh beberapa peneliti. Chen dan Chiu pada tahun 1982 telah melaporkan keragaman isolat RGSV dari dua daerah di Taiwan berdasarkan perbedaan gejala. Dua isolat tersebut yaitu isolat B dan Y yang memperlihatkan perbedaan yang jelas pada jumlah anakan dan lebar daun. Isolat B menyebabkan jumlah anakan meningkat dan daun menyempit. Isolat Y sebaliknya menyebabkan jumlah anakan berkurang dengan daun yang tidak menyempit dan gejala yang ditimbulkan ini mirip dengan gejala tanaman padi terinfeksi virus tungro. Keragaman strain RGSV dilaporkan pula oleh Hibino et al. (1985) berdasarkan gejala yang berbeda pada suatu daerah di Filipina. Perbedaan gejala tersebut akibat infeksi dua strain RGSV yang berbeda yaitu RGSV-1 dan RGSV-2. Tanaman padi yang terinfeksi virus strain RGSV-2 menunjukkan gejala mirip dengan gejala tanaman padi terinfeksi virus tungro. Miranda et al. (2000) melaporkan bahwa terdapat perbedaan runutan nukleotida pada dua isolat RGSV dari Filipina dari dua daerah yang berjarak 1000 km. Perbedaan tersebut ditunjukkan sebesar 0.26 % pada RNA 5 RGSV yang menyandi 36 kDa protein selubung. Hasil ini menunjukkan adanya keragaman gen protein selubung RGSV.
Evaluasi dan Analisis Keragaman Genetik
Virus mampu berubah ke tipe atau strain baru yang membuat virus dapat cepat beradaptasi pada perubahan maupun situasi yang baru seperti perubahan iklim, pembatasan geografi dan penyebaran penanaman jenis tumbuhan inang dan vektor. Kemampuan tersebut membuat virus memiliki banyak strain (Hull 2002). Strain baru dapat terbentuk dari perubahan molekul dasar yang terjadi pada suatu virus. Perubahan yang terjadi pada satu basa kadang dapat menyebabkan perubahan asam amino sehingga terjadi perubahan struktur primer protein virus. Keragaman genetik virus dipelajari untuk mengetahui sifat virus dari strain-strain yang ada. Evaluasi dan analisis keragaman genetik virus dapat dilakukan dengan beberapa metode dan salah satunya berdasarkan pada teknik molekuler dasar (Hull 2002).
Strain virus dapat diketahui melalui kesamaan dan keragamannya dengan metode Random Amplification of Polymorphic DNA (RAPD) (Comeau et al. 2004). Metode ini umumnya menggunakan sebuah primer acak (random). Berdasarkan pita-pita polimorfisme dapat diketahui adanya keragaman. Kelemahan metode RAPD adalah tidak dapat dengan spesifik mengetahui dimana letak keragaman genetik suatu virus (Comeau et al. 2004) . Metode yang dikembangkan selanjutnya yang lebih spesifik untuk mempelajari keragaman genetik virus adalah
Restriction Fragment Length Polimorphism (RFLP). DNA genom yang didapatkan
dari hasil isolasi DNA maupun fragmen DNA yang didapatkan dengan primer spesifik kemudian dipotong dengan satu atau lebih enzim restriksi. Pola pita polimorfisme yang didapat menunjukkan adanya keragaman dan keragaman ini spesifik di daerah tertentu dari genom virus (Xu et al. 2010; Villegas et al. 1997).
Metode lain yang saat ini paling banyak digunakan untuk mempelajari keragaman genetik virus adalah metode perunutan dan penyejajaran serta analisis kesamaan dan keragaman pada runutan-runutan basa nukleotida virus. Melalui metode evaluasi dan analisis ini akan dapat ditemukan keragaman genetik virus bahkan sampai diketahui letak perbedaan satu basa nukleotidanya. Penyejajaran runutan basa nukleotida dapat digunakan untuk melihat perubahan basa antar strain terutama di daerah-daerah fungsional (Radford et al. 2012; Banerjee et al. 2011). Selain untuk mempelajari keragaman genetik virus, perunutan dan penyejajaran basa nukleotida virus dapat pula digunakan untuk mempelajari kekerabatan dengan analisis filogenetik. Analisis filogenetik memungkinkan untuk mempelajari kekerabatan antar kelompok evolusi strain-strain suatu virus dan penyebaran virus secara geografis (Banerjee et al. 2011).
Analisis filogenetik dengan menggunakan runutan basa nukleotida diawali dengan menerjemahkan informasi yang ada dalam runutan basa ke dalam pohon filogenetik untuk menggambarkan keragaman maupun kekerabatan dari hasil perunutan isolat-isolat uji (Ubaidillah dan Sutrisno 2009). Untuk mendapatkan pohon filogenetik dari runutan basa isolat-isolat uji dilakukan terlebih dahulu penyejajaran runutan-runutan basa isolat-isolat tersebut. Runutan basa yang telah disejajarkan dijadikan data kuantitatif dengan diterjemahkan ke dalam bentuk data matrik jarak berpasangan. Jarak di sini ditentukan oleh jumlah basa yang mengalami perubahan. Semakin banyak perbedaan artinya semakin sering terjadi proses mutasi yang mengindikasikan semakin jauh jaraknya. Data matrik jarak berpasangan ini tidak dihitung secara manual tetapi sudah tersedia berupa program komputer. Dengan begitu data matrik dan hasil akhir adalah pohon filogenetik dapat digunakan untuk menggambarkan keragaman isolat-isolat uji (Ubaidillah dan Sutrisno 2009).
Saat ini tersedia banyak program yang dapat digunakan untuk membuat pohon filogenetik misalnya PAUP (Philogenetic Analysis Using Parsimony) (Swofford dan Begle 1993), PHYLIP dan MEGA (Kumar et al. 1993). Setiap program memiliki kelebihan dan kekurangan. Sebagai contoh, pohon filogenetik yang diperoleh dari program PAUP tidak dapat diedit langsung sehingga membutuhkan perangkat program lain yaitu TreeView agar mendapatkan pohon filogenetik yang baik. Program PAUP tidak dapat diunduh secara bebas dari internet melainkan harus dibeli dengan email dibandingkan dengan program PHYLIP dan MEGA yang bisa diunduh bebas (Ubaidillah dan Sutrisno 2009).
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian IPB, dan Laboratorium serta Rumah Kaca Kelompok Penelitian Padi, Bidang Biologi Molekular Tanaman, Pusat Penelitian Bioteknologi LIPI Cibinong. Sampel tanaman padi diambil dari Kabupaten/Kota Bogor, Kabupaten Pandeglang, Subang, Batang, Klaten, Sleman, Jember dan Banyuwangi. Penelitian dimulai pada bulan November 2011 hingga Juli 2012.
Metode Penelitian
Penelitian meliputi 3 kegiatan pokok, yaitu (1) pengamatan gejala di lapangan dan pengambilan sampel tanaman dari lapangan, (2) deteksi Rice tungro
bacilliform tungrovirus (RTBV) dan Rice grassy stunt tenuivirus (RGSV),
(3) analisis keragaman gen protein selubung RTBV dan RGSV.
Pengamatan Gejala di Lapangan dan Pengambilan Sampel Tanaman Bergejala Tungro maupun Mirip Tungro
Pengamatan gejala di lapangan dan pengambilan sampel tanaman padi sakit dilakukan di 8 kabupaten di Jawa yaitu Bogor, Pandeglang, Subang, Batang, Klaten, Sleman, Jember dan Banyuwangi. Daerah-daerah tersebut dipilih berdasarkan laporan Direktorat Perlindungan Tanaman Pangan (2011a dan 2011b) (Lampiran 1 dan 2) dan informasi dari penyuluh setempat tentang daerah yang diketahui sebagai daerah endemis penyakit tungro dan wereng batang coklat. Informasi tentang kejadian penyakit tungro maupun serangan wereng batang coklat didapatkan dari laporan luas tambah serang periode pengambilan sampel dari Kantor Dinas Pertanian di masing-masing kabupaten.
Pada masing-masing kabupaten diambil 8 sampel dari 8 tempat di beberapa desa dari beberapa kecamatan. Pengamatan gejala dikhususkan pada tinggi tanaman, perubahan warna dan tekstur pada daun, dan jumlah anakan (Tabel 1). Sampel tanaman yang diambil adalah tanaman bergejala tungro maupun mirip tungro. Rumpun tanaman padi sakit yang diambil dari lapangan selanjutnya ditanam kembali di dalam ember plastic berisi campuran tanah dan pupuk kandang
Tabel 1 Deskripsi gejala penyakit tungro dan mirip tungro Kriteria Gejala Gejala Penyakit
Tungro Mirip Tungro
Tinggi Tanaman Kerdil Agak kerdil atau normal
Perubahan warna daun Kuning sampai kuning oranye Kuning sampai kuning oranye
Tekstur daun Tidak kaku Kaku
dengan perbandingan 2:1, kemudian disungkup dan dipelihara di rumah kaca Kelompok Penelitian Padi, Laboratorium Bidang Biologi Molekular Tanaman, Pusat Penelitian Bioteknologi LIPI Cibinong. Daun padi muda dari rumpun yang menunjukkan gejala kemudian diambil, ditimbang masing-masing sebanyak 0.1 g dan 0.2 g lalu dibungkus dengan aluminium foil dan dimasukkan ke dalam nitrogen cair sebelum disimpan pada suhu -80 oC. Sampel daun tersebut digunakan untuk tahapan isolasi DNA dan RNA total tanaman.
Deteksi Rice tungro bacilliform badnavirus (RTBV)
Isolasi DNA total tanaman. Isolasi DNA total tanaman padi sakit dilakukan
menggunakan metode CTAB (cetyl trimethyl ammonium bromide). Metode yang
digunakan mengikuti Doyle dan Doyle (1990) yang dimodifikasi dengan penambahan PVP (Polyvynilpyrrolidone) 2% pada bufer isolasi dan penambahan
chloroform setelah fase penambahan chloroform:isoamylalcohol. Sebanyak 0.2 g daun padi sakit digerus dengan mortar dan pistil dengan bantuan nitrogen cair. Serbuk yang terbentuk kemudian dimasukkan ke dalam tabung mikro 2 ml dan ditambahkan sebanyak 1 ml bufer ekstraksi (2% CTAB; 0.1 M Tris-HCl, pH 8.0; 0.02 M EDTA, pH 8.0; 1.26 M NaCl; 2% PVP) yang mengandung 1% mercapto
ethanol. Setelah serbuk daun dan bufer ekstraksi tercampur dengan baik, campuran
kemudian diinkubasi pada 65 oC selama 30 menit, didiamkan sebentar pada suhu ruang. Setelah campuran dingin kemudian ditambahkan 750 µl campuran
chloroform:isoamylalkohol (24:1), divorteks, kemudian disentrifugasi pada
11 000 rpm selama 10 menit. Supernatan selanjutnya dipindahkan pada tabung mikro 2 ml yang baru dan ditambahkan 1 ml chloroform, dicampur dan disentrifugasi pada 11 000 rpm selama 10 menit. Supernatan yang terbentuk dipindahkan lagi pada tabung mikro yang baru dan ditambahkan sebanyak 1 ml
isopropanol dingin kemudian dicampur dengan membalikkan tabung berulang kali
dengan perlahan. Campuran kemudian diinkubasi pada suhu -20 oC selama 30 menit lalu disentrifugasi pada 11 000 rpm selama 10 menit. Supernatan dibuang dan pelet diresuspensi dengan 200 µl TE pH 8.0 (10 mM Tris; 1 mM EDTA). Suspensi ini kemudian ditambahkan sebanyak 1/10 volum larutan 3 M sodium
acetate pH 5.2 dan 2.5 volum ethanol absolute kemudian dicampur dengan
membalikkan tabung berulang kali dengan perlahan. Campuran kemudian diinkubasi pada suhu -20 oC selama 30 menit untuk presipitasi DNA dan disentrifugasi pada 13 000 rpm selama 10 menit. Supernatan dibuang dan pelet yang terbentuk dikeringkan dan diresuspensi dengan 100 µl bufer TE pH 8.0.
Perancangan primer. Sepasang primer dirancang menggunakan program
online Primer3Plus untuk mengamplifikasi bagian gen protein selubung (Coat Protein) RTBV. Templat untuk perancangan primer ini adalah runutan basa
nukleotida gen selubung protein RTBV yang didapatkan dari GenBank (isolat Phi1, nomor aksesi X57924.1). Runutan DNA tersebut selanjutnya diunggah ke program
online Primer3Plus dan digunakan untuk analisis primer. Beberapa pasang primer
yang diperoleh digunakan untuk mengamplifikasi gen selubung protein dengan ukuran produk amplifikasi berbeda-beda. Pasangan-pasangan primer yang didapatkan kemudian satu per satu dicobakan pada program Primer Premier 5 (Primer Biosoft International) hingga didapatkan pasangan primer yang tepat mengamplifikasi daerah runutan basa nukleotida yang diinginkan. Pada penelitian
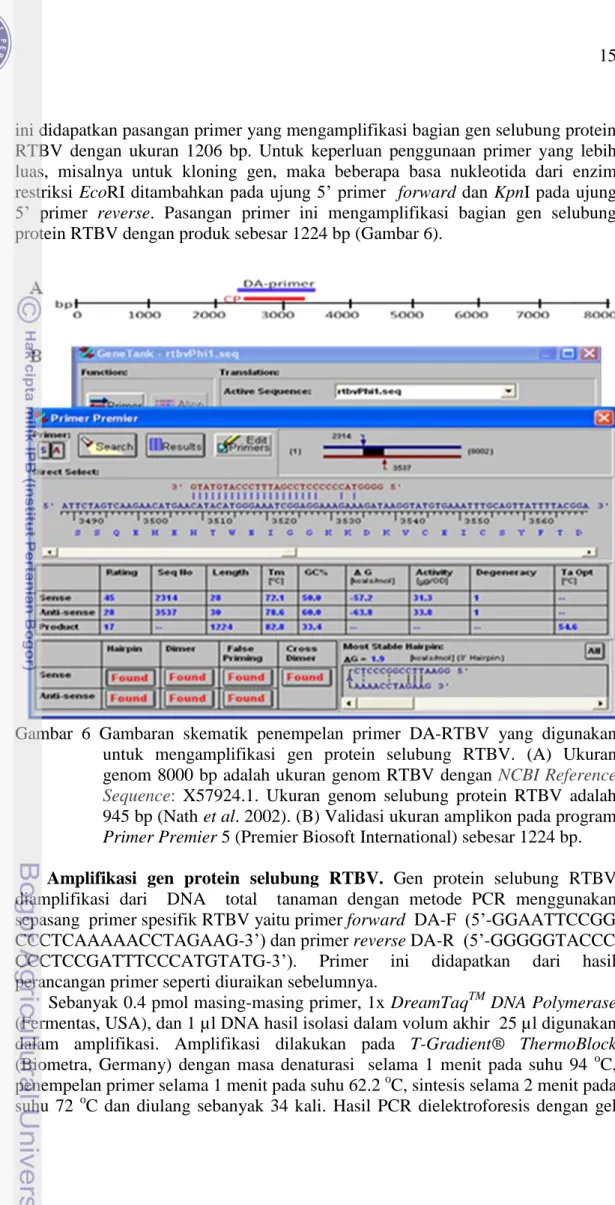
ini didapatkan pasangan primer yang mengamplifikasi bagian gen selubung protein RTBV dengan ukuran 1206 bp. Untuk keperluan penggunaan primer yang lebih luas, misalnya untuk kloning gen, maka beberapa basa nukleotida dari enzim restriksi EcoRI ditambahkan pada ujung 5‟ primer forward dan KpnI pada ujung 5‟ primer reverse. Pasangan primer ini mengamplifikasi bagian gen selubung protein RTBV dengan produk sebesar 1224 bp (Gambar 6).
Gambar 6 Gambaran skematik penempelan primer DA-RTBV yang digunakan untuk mengamplifikasi gen protein selubung RTBV. (A) Ukuran genom 8000 bp adalah ukuran genom RTBV dengan NCBI Reference Sequence: X57924.1. Ukuran genom selubung protein RTBV adalah 945 bp (Nath et al. 2002). (B) Validasi ukuran amplikon pada program
Primer Premier 5 (Premier Biosoft International) sebesar 1224 bp.
Amplifikasi gen protein selubung RTBV. Gen protein selubung RTBV
diamplifikasi dari DNA total tanaman dengan metode PCR menggunakan sepasang primer spesifik RTBV yaitu primer forward DA-F (5‟-GGAATTCCGG CCCTCAAAAACCTAGAAG-3‟) dan primer reverse DA-R (5‟-GGGGGTACCC CCCTCCGATTTCCCATGTATG-3‟). Primer ini didapatkan dari hasil perancangan primer seperti diuraikan sebelumnya.
Sebanyak 0.4 pmol masing-masing primer, 1x DreamTaqTM DNA Polymerase
(Fermentas, USA), dan 1 µl DNA hasil isolasi dalam volum akhir 25 µl digunakan dalam amplifikasi. Amplifikasi dilakukan pada T-Gradient® ThermoBlock (Biometra, Germany) dengan masa denaturasi selama 1 menit pada suhu 94 oC, penempelan primer selama 1 menit pada suhu 62.2 oC, sintesis selama 2 menit pada suhu 72 oC dan diulang sebanyak 34 kali. Hasil PCR dielektroforesis dengan gel
agarosa 1% dan diwarnai dengan merendam gel di dalam larutan ethidium bromide 0.5 µg/ml selama ± 15 menit, kemudian diamati dengan sinar ultraviolet pada UV
transilluminator.
Deteksi Rice grassy stunt virus (RGSV)
Isolasi RNA total tanaman. Isolasi RNA total dilakukan dengan
menggunakan TRIZOL (TRIzol® reagent) (Invitrogen, USA) menurut Chomczynski dan Mackey (1995). Sebanyak 0.1 g daun padi sakit digerus dengan mortar dan pistil dengan bantuan nitrogen cair. Serbuk daun kemudian dimasukkan ke dalam tabung mikro 1.5 ml dan ditambahkan 1 ml pereaksi TRIZOL. Setelah serbuk daun dan pereaksi TRIZOL tercampur dengan baik, kemudian diinkubasi pada 30 oC selama 5 menit dan setelah itu ditambahkan sebanyak 0.2 ml
chloroform. Campuran ini kemudian dikocok perlahan selama 15 detik dan
disentrifugasi pada 10 000 rpm (tidak lebih dari 12 000 gravitasi) pada suhu 4 oC selama 10 menit. Supernatan kemudian dipindahkan pada tabung mikro 2 ml yang baru dan ditambahkan 0.5 ml isoprophanol. Campuran ini diinkubasi pada suhu 30 oC selama 10 menit dan disentrifugasi pada 10 000 rpm pada suhu 4 oC selama 10 menit. Supernatan dibuang dan pelet yang terbentuk dicuci dengan 1 ml
ethanol 70% (1 ml ethanol per 1 ml TRIZOL yang digunakan). Campuran ini
divorteks dan disentrifugasi pada 10 000 rpm pada suhu 4 oC selama 5 menit. Pelet dikeringanginkan di Laminar Air Flow sampai tidak ada lagi sisa ethanol (pelet jangan terlalu kering) dan kemudian diresuspensi dengan 100 µl air bebas RNAse (Fermentas, USA).
Transkripsi balik RNA. Sebelum dilakukan amplifikasi, RNA total tanaman
hasil isolasi terlebih dahulu ditranskripsi balik menjadi cDNA. Transkripsi balik RNA menggunakan kit RevertAidTM (Fermentas, USA). Sebanyak 1 µl RNA total tanaman hasil isolasi, 1x bufer RT, 1.75 mM DTT (di-thio-threitol), 2 mM dNTP, 10 u RevertAidTM MmuLv Reverse transcriptase, 1 u RibolockTM RNAse Inhibitor,
dan 15 pmol primer B3. Primer B3 adalah primer reverse spesifik RGSV (5‟-TCTAGAGCAGTTTCCTGTAGTC-3‟) (Le et al. 2010). Reaksi transkripsi balik dilakukan pada T-Gradient® ThermoBlock (Biometra, Germany) dengan inkubasi awal pada suhu 25 oC selama 5 menit lalu pada suhu 42 oC selama 60 menit dan pada suhu 70 oC selama 15 menit. cDNA yang dihasilkan kemudian dapat digunakan sebagai templat dalam tahap amplifikasi.
Analisis kesesuaian primer gen protein selubung RGSV. Pasangan primer
yang digunakan merupakan primer spesifik RGSV (Le et al. 2010). Untuk memastikan pasangan primer tersebut mengamplifikasi di bagian gen selubung protein RGSV maka dilakukan analisis pada program Primer Premier 5 (Primer Biosoft International). Analisis dilakukan dengan menggunakan urutan basa DNA gen protein selubung RNA (Gambar 7).
Hasil analisis menunjukkan bahwa pasangan primer tersebut mengamplifikasi sebagian dari gen selubung protein yang berada di RNA5 genom RGSV dan menghasilkan produk amplifikasi sebesar 243 bp.
Gambar 7 Gambaran skematik penempelan primer F3 dan B3 yang digunakan
untuk mengamplifikasi sebagian gen protein selubung RGSV. (A) Ukuran genom 2700 bp adalah ukuran genom RNA5 RGSV dengan NCBI Reference Sequence: NC_002327.1 dan 978 adalah ukuran gen selubung protein RGSV dengan NCBI Reference Sequence
GenBank: CBA12676.1 (Toriyama et al. 1997). (B) Validasi ukuran amplikon pada program Primer Premier 5 (Premier Biosoft International) sebesar 243 bp.
Amplifikasi sebagian gen protein selubung RGSV. Amplifikasi sebagian
gen protein selubung RGSV dilakukan dengan metode PCR menggunakan sepasang primer spesifik RGSV yaitu primer forward F3 (5‟-AGACCAACTCAG AGGCA-3‟) dan primer revers B3 (5‟-TCTAGAGCAGTTTCCTGTAGTC-3‟) (Le et al. 2010). Sebanyak 0.4 pmol masing-masing primer, 1x DreamTaqTM DNA Polymerase (Fermentas, USA), dan 1 µl cDNA hasil transkripsi balik dalam volum
akhir 25 µl digunakan dalam amplifikasi. Amplifikasi dilakukan pada T-Gradient®
ThermoBlock (Biometra, Germany) dengan masa denaturasi selama 1 menit pada
suhu 94 oC, penempelan primer selama 1 menit pada suhu 53 oC, sintesis selama 1 menit pada suhu 72 oC dan diulang sebanyak 34 kali. Hasil PCR diamati dengan cara yang sama pada amplifikasi gen protein selubung RTBV.
Analisis Keragaman Genetik RTBV dan RGSV
Perunutan dan penyejajaran basa DNA RTBV dan RNA RGSV.
Perunutan basa nukleotida dilakukan terhadap fragmen DNA gen protein selubung RTBV dan RGSV dari hasil amplifikasi berturut-turut adalah sebanyak 10 dari 13 isolat dan 20 dari 36 isolat. Perunutan basa nukleotida gen protein selubung
RTBV dan RGSV dilakukan dengan memanfaatkan layanan berturut-turut pada
Automatic DNA Sequencing 1st-BASE Laboratories Singapura dan DNA
Sequencing BioSM Laboratories Malaysia.
Elektroferogram yang didapatkan dilihat menggunakan program Sequence
Scanner v1.0 (Applied Biosystems, USA). Hasil perunutan nukleotida yang
diperoleh kemudian dikonfirmasi ke GenBank dengan program Basic Local
Alignment Search Tool (BLAST) pada The National Centre for Biotechnological Information (NCBI). Runutan nukleotida yang telah dikonfirmasi kemudian
disejajarkan dengan menggunakan penyejajaran berganda ClustalW pada program Bioedit (Hall 1999).
Analisis keragaman. Analisis keragaman runutan nukleotida dari gen
protein selubung isolat-isolat RTBV dan RGSV menggunakan beberapa perangkat lunak diantaranya Bioedit (Hall 1999), CLC Sequence Viewer 6.7 dan MEGA 5.05. Menggunakan perangkat lunak yang sama dilakukan pula analisis filogenetika. Rujukan runutan nukleotida isolat RTBV dan RGSV dari luar Indonesia yang digunakan didapatkan dari GenBank.
HASIL DAN PEMBAHASAN
Gejala Infeksi Virus pada Tanaman Padi di Lapangan
Hasil pengamatan gejala di lapangan dari sampel-sampel tanaman padi sakit yang diambil dari lapangan menunjukkan gejala terinfeksi virus tungro. Gejala umum yang diamati pada setiap sampel tanaman yang diambil antara lain perubahan warna daun, tinggi tanaman dan jumlah anakan (Lampiran 4). Variasi gejala dijumpai pada sampel-sampel tersebut. Variasi gejala dapat dibedakan menjadi dua kelompok berdasarkan jumlah anakan dan tinggi tanaman. Gejala kelompok pertama yaitu daun tanaman berwarna kuning sampai oranye, tanaman kerdil dan jumlah anakan sedikit (Gambar 8). Gejala kelompok kedua yaitu daun tanaman kaku berwarna kuning-oranye, tinggi tanaman normal dan jumlah anakan normal seperti tanaman sehat (Gambar 9).
Gambar 8 Variasi gejala kelompok pertama pada tanaman padi dari beberapa
daerah. A) Sumber Salak Barat (Jember); B) Gunung Bunder (Bogor); C) Ngawen (Sleman).