Na2CaEDTA TERHADAP KADAR TIMBAL (Pb) DARAH TIKUS
DENGAN METODE SPEKTROSKOPI SERAPAN ATOM
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh:
Euthalia Sintami Putri NIM: 058114080
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
PENGARUH PEMBERIAN EKSTRAK ETANOL UMBI BAWANG PUTIH
(Allium sativum L.) DAN EKSTRAK ETANOL RIMPANG TEMULAWAK
(Curcuma xanthorrhiza Roxb.) SETELAH PEMBERIAN ANTIDOT Na2CaEDTA TERHADAP KADAR TIMBAL (Pb) DARAH TIKUS
DENGAN METODE SPEKTROSKOPI SERAPAN ATOM
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh:
Euthalia Sintami Putri NIM: 058114080
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
iii
PERSETUJUAN PEMBIMBING
PENGARUH PEMBERIAN EKSTRAK ETANOL UMBI BAWANG PUTIH
(Allium sativum L.) DAN EKSTRAK ETANOL RIMPANG TEMULAWAK
(Curcuma xanthorrhiza Roxb.) SETELAH PEMBERIAN ANTIDOT Na2CaEDTA TERHADAP KADAR TIMBAL (Pb) DARAH TIKUS
DENGAN METODE SPEKTROSKOPI SERAPAN ATOM
Yang diajukan oleh: Euthalia Sintami Putri
NIM: 058114080
Skripsi ini telah disetujui oleh:
Pembimbing
Pengesahan Skripsi Berjudul
PENGARUH PEMBERIAN EKSTRAK ETANOL UMBI BAWANG PUTIH
(Allium sativum L.) DAN EKSTRAK ETANOL RIMPANG TEMULAWAK
(Curcuma xanthorrhiza Roxb.) SETELAH PEMBERIAN ANTIDOT Na2CaEDTA TERHADAP KADAR TIMBAL (Pb) DARAH TIKUS
DENGAN METODE SPEKTROSKOPI SERAPAN ATOM
Oleh:
Euthalia Sintami Putri NIM: 058114080
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sanata Dharma pada tanggal : 2 Februari 2009
Mengetahui Fakultas Farmasi Universitas Sanata Dharma
Dekan
(Rita Suhadi, M. Si., Apt.) Pembimbing:
(Ipang Djunarko, S. Si., Apt.)
Panitia Penguji:
1. Ipang Djunarko, S. Si., Apt. ...
2. Drs. Sulasmono, Apt. ...
v
“Kita tahu sekarang, bahwa Allah turut bekerja dalam
segala sesuatu untuk mendatangkan kebaikan bagi mereka
yang mengasihi Dia, yaitu bagi mereka yang terpanggil
sesuai dengan rencana Allah” (Rm 8:28)
Skripsi ini kupersembahkan untuk
Allah Bapa di Kerajaan Surga, Tuhan Yesus Kristus dan Allah Roh Kudus
Bapak, Ibu, Kak Robet, Kak Bhanu
Sahabat-sahabatku tercinta
Dan Almamaterku
vi PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah Bapa yang Maha Kuasa atas segala kasih karunia, berkat, dan kebaikan-Nya sehingga skripsi dengan judul “Pengaruh Pemberian Ekstrak Etanol Umbi Bawang Putih (Allium sativum L.) dan Ekstrak Etanol Rimpang Temulawak (Curcuma xanthorrhiza Roxb.) setelah Pemberian Antidot Na2CaEDTA terhadap Kadar Timbal (Pb) Darah Tikus dengan
Metode Spektroskopi Serapan Atom” dapat terselesaikan. Skripsi ini disusun untuk memenuhi salah satu syarat memperoleh gelar Sarjana Farmasi (S. Farm.) pada Program Studi Farmasi Universitas Sanata Dharma.
Selama penelitian dan penyusunan skripsi ini, penulis mendapat banyak bantuan dan dukungan dari berbagai pihak. Oleh karena itu, pada kesempatan ini penulis mengucapkan terima kasih kepada :
1. Rita Suhadi, M.Si., Apt., selaku Dekan Fakultas Farmasi USD.
2. Ipang Djunarko, S. Si., Apt. selaku dosen pembimbing yang telah meluangkan waktu, tenaga, dan saran dalam penyusunan skripsi ini.
3. Drs. Sulasmono, Apt., selaku dosen penguji atas pengarahan dan kesediannya menguji.
4. Erna Tri Wulandari, M.Si., Apt., selaku dosen penguji atas pengarahan dan kesediannya menguji.
6. Karyawan Merapi Farma atas serbuk umbi bawang putih dan serbuk rimpang temulawak, serta Bu Astuti dan segenap karyawan LPPT Unit I UGM yang telah banyak membantu dalam penelitian skripsi ini.
7. Bapak, Ibu, Kak Robet, dan Kak Bhanu atas doa dan dukungan yang tidak kenal lelah.
8. Mba Sisil, Mba Fila, dan Yudi atas kerjasama, canda tawa, keluh kesah, dan semangat selama penelitian dan penyusunan skripsi.
9. Sekar, Nolen, Anna, Illon, Lina, dan teman-teman “Kos Pelangi” atas semangat dan dukungannya, Mas Ardian, Vika, Rita, Suci, Made, Bambi, Sasa atas dukungan doa dan nasehat-nasehatnya.
10.Teman-teman angkatan 2005, atas kebersamaan dan suka-dukanya selama menjalani tahun-tahun kuliah di Farmasi.
11.Semua pihak yang telah banyak membantu penyusunan skripsi ini yang tak dapat disebutkan satu-persatu.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini tak lepas dari segala keterbatasan dan kekurangan. Oleh karena itu, penulis sangat mengharapkan kritik dan saran yang membangun untuk penyempurnaan skripsi ini. Akhir kata, penulis berharap semoga skripsi ini dapat memberikan sumbangan dalam perkembangan ilmu pengetahuan.
viii
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 2 Februari 2009 Penulis,
INTISARI
Polusi timbal merupakan masalah lingkungan yang mengancam kesehatan manusia terutama potensial merusak sistem saraf dan otak. Na2CaEDTA yang biasa digunakan sebagai terapi antidot memiliki banyak efek
samping, yaitu defisiensi zink, anemia, dan nekrosis sel tubular ginjal. Sehingga perlu dikembangkan senyawa dari tanaman yang dapat membantu kerja antidot menurunkan kadar timbal darah. Berdasarkan penelitian, bawang putih dan temulawak dapat menurunkan kadar timbal darah.
Penelitian ini bertujuan mengetahui pengaruh dan lama waktu yang efektif pada pemberian ekstrak etanol umbi bawang putih (Allium sativum L.) dan ekstrak etanol rimpang temulawak (Curcuma xanthorrhiza Roxb.) setelah pemberian antidot Na2CaEDTA dalam menurunkan kadar timbal darah tikus.
Penelitian ini termasuk penelitian eksperimental murni dengan rancangan acak pola satu arah.
Na2CaEDTA, ekstrak etanol umbi bawang putih, dan ekstrak etanol
rimpang temulawak diberikan selama 10 hari setelah pemejanan timbal asetat 0,5 g/kg BB/oral/hari/tikus selama 30 hari. Besarnya kadar timbal darah sampel ditentukan dengan metode spektroskopi serapan atom. Perbedaan kadar timbal kelompok perlakuan dianalisis dengan taraf kepercayaan 95%. Data yang diperoleh kemudian diolah secara statistik dengan uji Kruskal Wallis dan uji Friedman.
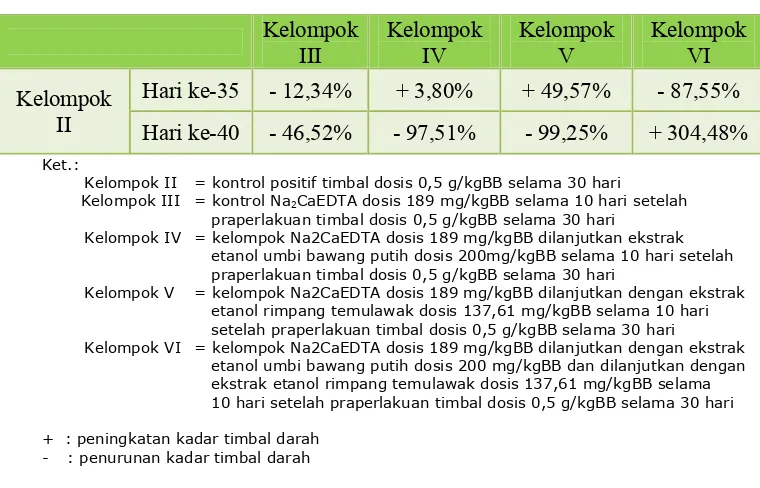
Hasil penelitian menunjukkan bahwa pemberian Na2CaEDTA, ekstrak
etanol umbi bawang putih, dan ekstrak etanol rimpang temulawak dapat menurunkan kadar timbal darah sebesar 87,55% dalam waktu 5 hari.
x
ABSTRACT
Lead pollution is an environment problems that threat man’s health and potentially interfere nervous system and brain. Na2CaEDTA has been used as
antidote, but have many adverse effects, include zinc deficiency, anemia, and renal tubular necrosis. The explore of plants compounds to help antidot to reduce blood lead level is need. At previous study, garlic and turmeric can reduce blood lead level.
The aim of this study is want to know the influence of ethanol extract of garlic bulb (Allium sativum L.) and ethanol extract of tumeric rhizome (Curcuma xanthorrhiza Roxb.) after antidote Na2CaEDTA administration against blood lead
level in rat. This study was pure experimental study with complete randomized design.
Na2CaEDTA, ethanol extract of garlic bulb, and ethanol extract of
tumeric rhizome given for 10 days after 0,5 g/kg BB/orally/day/rat lead acetat for 30 days. Blood lead level was determined by atomic absorption spectroscopy method. Difference of blood lead level were analysed with 95% of confidence interval. The result was analyzed statistically by using Kruskal-Wallis test and Friedman test.
The study’s result showed that administration Na2CaEDTA, ethanol
extract of garlic bulb, and ethanol extract of tumeric rhizome can reduce blood lead level until 87,55% in 5 days.
DAFTAR ISI
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN ... v
PRAKATA ... vi
PERNYATAAN KEASLIAN KARYA ... viii
INTISARI ... ix
ABSTRACT ... x
DAFTAR ISI ... xi
DAFTAR TABEL ... xv
DAFTAR GAMBAR ... xvii
DAFTAR LAMPIRAN ... xix
BAB I PENGANTAR ... 1
A. Latar Belakang ... 1
1. Permasalahan ... 3
2. Keaslian penelitian ... 4
3. Manfaat penelitian ... 5
B. Tujuan Penelitian ... 5
BAB II PENELAAHAN PUSTAKA ... 6
A. Timbal ... 6
1. Farmakokinetika timbal ... 6
xii
3. Mekanisme keracunan timbal ... 8
B. Penanganan Keracunan ... 9
1. Terapi suportif ... 9
2. Penyidikan jenis racun penyebab ... 10
3. Terapi antidot ... 10
C. Kalsium Disodium Edatat (Na2CaEDTA) ... 11
1. Farmakokinetika Na2CaEDTA ... 12
2. Indikasi ... 12
Dosis dan cara pemberian ... 13
4. Efek samping ... 13
5. Mekanisme aksi Na2CaEDTA ... 13
D. Bawang Putih (Allium sativum L.) ... 14
1. Taksonomi tanaman ... 14
2. Deskripsi simpisia ... 14
3. Kandungan kimia ... 15
4. Khasiat dan penggunaan ... 16
E. Temulawak (Curcuma xanthorrhiza Roxb.) ... 16
1. Taksonomi tanaman ... 16
2. Deskripsi simpisia ... 17
3. Kandungan kimia ... 17
4. Khasiat dan penggunaan ... 17
F. Maserasi ... 18
H. Validasi Metode ... 22
1. Akurasi ... 22
2. Presisi ... 23
3. Linearitas dan rentang ... 23
4. Spesifisitas ... 24
5. Limit of detection (LOD) dan limit of quantitation (LOQ) ... 24
I. Landasan Teori ... 25
J. Hipotesis ... 27
BAB III METODE PENELITIAN ... 28
A. Jenis dan Rancangan Penelitian ... 28
B. Variabel dan Definisi Operasional ... 28
1. Variabel utama ... 28
2. Variabel pengacau ... 28
3. Definisi operasional ... 29
C. Bahan atau Materi Penelitian ... 30
D. Alat atau Instrumen Penelitian ... 30
E. Tata Cara Penelitian ... 30
1. Identifikasi simplisia dan serbuk simplisia ... 30
2. Preparasi bahan ... 31
3. Persiapan hewan uji ... 33
4. Pengelompokan dan perlakuan hewan uji ... 33
5. Pengukuran kadar timbal darah ... 35
xiv
BAB IV HASIL DAN PEMBAHASAN ... 38
A. Identifikasi Simplisia dan Serbuk Simplisia ... 38
B. Pembuatan Ekstrak Etanol Tanaman ... 39
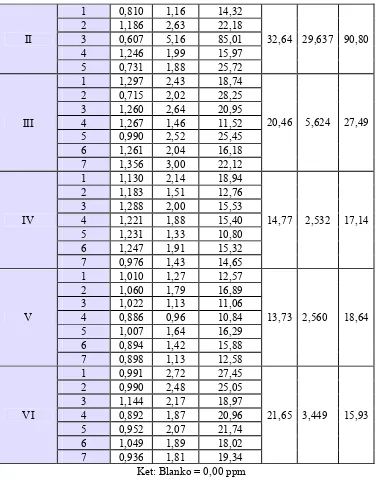
C. Pengukuran Kadar Timbal Darah ... 41
1. Kurva baku timbal ... 41
2. Kadar timbal darah akibat penawarracunan pemberian ekstrak etanol bawang putih dan ekstrak etanol rimpang temulawak setelah pemberian Na2CaEDTA ... 46
BAB V KESIMPULAN DAN SARAN ... 56
A. Kesimpulan ... 56
B. Saran ... 56
DAFTAR PUSTAKA ... 57
LAMPIRAN ... 62
DAFTAR TABEL
Tabel I. Kriteria koefisien variasi (KV) laboratorium yang dapat
diterima ... 23 Tabel II. Parameter validasi metode yang dipersyaratkan untuk
setiap kategori ... 25 Tabel III. Syarat karakteristik validasi metode analisis logam berat
dengan spektroskopi ... 25 Tabel IV Nilai linearitas kurva baku timbal hasil pengukuran
dengan metode spektrometri serapan atom ... 44 Tabel V Nilai koefisien variasi (KV) kontrol dan perlakuan ... 45 Tabel VI Nilai rata-rata kadar timbal darah (ppm) hasil pengukuran dengan metode spektrometri serapan atom ... 46 Tabel VII. Hubungan perbedaan kadar timbal secara statistik ... 47 Tabel VIII. Persen perubahan kadar timbal darah kelompok perlakuan
dibandingkan kelompok kontrol setelah kondisi
praperlakuan ... 48 Tabel IX. Hasil pengujian sensitifitas detektor spektrometer serapan
atom ... 64 Tabel X. Hasil pengujian linearitas detektor spektrometer serapan
atom ... 64 Tabel XI. Perbandingan hasil pembacaan dan standar ... 64
xvi
kadar hari ke-30 ... 72 Tabel XIII. Hasil kadar timbal terlarut dengan metode spektroskopi
serapan atom pada hari ke-0... 72 Tabel XIV. Hasil kadar timbal terlarut dengan metode spektroskopi
serapan atom pada hari ke-15... 73 Tabel XV. Hasil kadar timbal terlarut dengan metode spektroskopi
serapan atom pada hari ke-30... 74 Tabel XVI. Hasil kadar timbal terlarut dengan metode spektroskopi
serapan atom pada hari ke-35... 76 Tabel XVII. Hasil kadar timbal terlarut dengan metode spektroskopi
DAFTAR GAMBAR
Gambar 1. Skema penghambatan sintesis heme oleh timbal ... 8
Gambar 2. Peran kalsium dalam pelepasan neurotransmitter ... 9
Gambar 3. Struktur kalsium disodium edetat ... 11
Gambar 4. Struktur selenometionin dan selenosistein ... 15
Gambar 5. Struktur γ-glutamil-Se-metil-L-selenosistein ... 15
Gambar 6. Skema metabolisme selenometionin menjadi Selenosistein ... 16
Gambar 7. Struktur molekul curcumin ... 17
Gambar 8. Instrumentasi spektrometer serapan atom ... 19
Gambar 9. Skema proses atomisasi sampel. M : logam (metal); M*: atom yang tereksitasi. Pada SSA yang diukur adalah M’ yaitu atom dalam keadaan ground state ... 20
Gambar 10. Pembagian zona nyala pada pembakar pada spektrometer serapan atom ... 20
Gambar 11. Lampu katoda berongga (hollow cathode lamp) pada SSA dan bagian-bagiannya ... 21
Gambar 8. Kurva baku pengukuran larutan timbal hari ke-0 sebelum pemejanan timbal asetat ... 42
Gambar 9. Kurva baku pengukuran larutan timbal hari ke-15 setelah pemejanan timbal selama 15 hari ... 42
xviii
Gambar 11. Kurva baku pengukuran larutan timbal hari ke-35 setelah kondisi praperlakuan selama 30 hari dan pemberian
Na2CaEDTA dilanjutkan ekstrak etanol umbi bawang putih
dan ekstrak etanol rimpang temulawak selama 5 hari .... 43 Gambar 12. Kurva baku pengukuran larutan timbal hari ke-40 setelah
kondisi praperlakuan selama 30 hari dan pemberian Na2CaEDTA yang dilanjutkan ekstrak etanol umbi
bawang putih dan ekstrak etanol rimpang temulawak
selama 10 hari ... 43
DAFTAR LAMPIRAN
Lampiran 1. Hasil determinasi Allium sativum L. dan Curcuma
xanthorrhiza Roxb. ... 62
Lampiran 2. Formulir hasil kalibrasi internal spektrometer serapan atom Hitachi Z-8000 Polarized Zeeman ... 63
Lampiran 3. Foto tanaman bawang putih ... 66
Lampiran 4. Foto tanaman temulawak ... 66
Lampiran 5. Foto umbi bawang putih ... 66
Lampiran 6. Foto rimpang temulawak ... 67
Lampiran 7. Foto maserasi ... 67
Lampiran 8. Ekstrak etanol umbi bawang putih ... 67
Lampiran 9. Ekstrak etanol rimpang temulawak ... 63
Lampiran 10. Destruksi sampel darah dengan wet chemical method .... 68
Lampiran 11. Foto filtrat sampel hasil destruksi ... 68
Lampiran 12. Foto spektrometer serapan atom Hitachi Z-8000 Polarized Zeeman ... 69
Lampiran 13. Perhitungan konsentrasi timbal asetat ... 69
Lampiran 14. Perhitungan dosis dan konsentrasi Na2CaEDTA ... 70
xx
orientasi selama 45 hari ... 72 Lampiran 17. Hasil kadar timbal dalam darah sampel ... 72 Lampiran 18. Uji distribusi kadar timbal darah dengan Shapiro-Wilk . 79 Lampiran 19. Hasil uji signifikansi kadar timbal dalam darah sampel
dengan metode Kruskal-Wallis ... 80 Lampiran 20. Hasil uji signifikansi kadar timbal darah kontrol
aquadest dengan metode Friedman ... 96 Lampiran 21. Hasil uji signifikansi kadar timbal darah kontrol
timbal (Pb) dengan metode Friedman ... 99 Lampiran 22. Hasil uji signifikansi kadar timbal darah kontrol
Na2CaEDTA dengan metode Friedman ... 102
Lampiran 23. Hasil uji signifikansi kadar timbal darah perlakuan
Na2CaEDTA yang dilanjutkan dengan ekstrak etanol umbi
bawang putih dengan metode Friedmann ... 105 Lampiran 24. Hasil uji signifikansi kadar timbal darah perlakuan
Na2CaEDTA yang dilanjutkan dengan ekstrak etanol
rimpang temulawak dengan metode Friedman ... 108 Lampiran 25. Hasil uji signifikansi kadar timbal darah perlakuan
Na2CaEDTA yang dilanjutkan dengan ekstrak etanol
bawang putih dan ekstrak etanol rimpang temulawak
dengan metode Friedman ... 111 Lampiran 26. Histogram standar deviasi kadar timbal pada pengukuran
Lampiran 27. Histogram standar deviasi kadar timbal pada pengukuran
hari ke-15 ... 114 Lampiran 28. Histogram standar deviasi kadar timbal pada pengukuran
hari ke-30 setelah kondisi praperlakuan... 115 Lampiran 29. Histogram standar deviasi kadar timbal pada pengukuran
hari ke-35 setelah kondisi praperlakuan dan pemberian antidot Na2CaEDTA dilanjutkan ekstrak etanol umbi
bawang putih dan ekstrak etanol rimpang temulawak
selama 5 hari ... 115 Lampiran 30. Histogram standar deviasi kadar timbal pada pengukuran
hari ke-40 setelah kondisi praperlakuan dan pemberian antidot Na2CaEDTA dilanjutkan ekstrak etanol umbi
bawang putih dan ekstrak etanol rimpang temulawak
1 BAB I PENGANTAR
A. Latar Belakang
Masyarakat di kota besar dan berdiam di pinggir jalan dengan transportasi kendaraan bermotor yang padat serta di lingkungan industri, merupakan kelompok yang rentan terhadap pencemaran timbal (Pb) (Nordberg, 1998). Hal ini dikarenakan semakin meningkatnya jumlah emisi Pb, dalam bentuk gas, yang dilepas ke udara bebas. Emisi Pb merupakan hasil samping pembakaran Pb tetraetil (TEL / Tetra Ethyl Lead) yang ditambahkan ke dalam bahan bakar kendaraan bermotor dan berfungsi sebagai antiknock (menaikkan bilangan oktan) pada mesin-mesin kendaraan (Ardyanto, 2005).
ini merupakan salah satu metode pengukuran timbal di dalam darah yang sensitif dan spesifik dibandingkan metode lainnya, misalnya double extraction dengan metode Dithizone. Menurut Ebdon (1998), LOD untuk pengukuran timbal menggunakan spektrometer serapan atom adalah 0,015 ppm.
Pengobatan keracunan timbal anorganik biasanya meliputi penghentian paparan dengan segera, perawatan suportif, dan penggunaan terapi khelasi secara bijaksana (Katzung, 2004). Salah satu terapi khelasi timbal yaitu pemberian disodium kalsium edetat (Na2CaEDTA). Penatalaksanaan terapi keracunan timbal
yaitu dengan pemberian Na2CaEDTA dengan dosis 30 mg/kg BB dalam 2-3 dosis
terbagi (setiap 8-12 jam) secara IM selama 2-5 hari (Kosnett, 2006). Akan tetapi, terapi khelasi dengan Na2CaEDTA dapat menimbulkan beberapa efek samping,
antara lain nekrosis sel tubular ginjal, hematuria, proteinuria, mialgia, sakit kepala, mual, muntah, anemia, dan defisiensi zink (Dollery, 1999).
Mengingat pemberian Na2CaEDTA memiliki beberapa efek samping,
maka perlu dikembangkan senyawa yang berasal dari alam yang dapat menurunkan kadar timbal dalam darah serta mudah didapatkan oleh masyarakat. Indonesia merupakan salah satu negara yang kaya penghasil bahan tanaman obat tradisional, antara lain umbi bawang putih (Allium sativum L.) dan rimpang temulawak (Curcuma xanthorrhiza Roxb.).
Nagabhushanam, 2005). Selenium memberikan aksi profilaksis terhadap efek timbal, yaitu memperbesar kapasitas antioksidan endogen sel dengan meningkatkan aktivitas superoksida dismutase, glutation reduktase, dan senyawa glutation lainnya (Othman and El Missiry, 1998). Fedelia (2008) meneliti tentang pengaruh ekstrak etanol umbi bawang putih dosis 200 mg/kg BB setelah pemberian Na2CaEDTA yang terbukti mampu menurunkan kadar timbal darah
dan memiliki efek terapi yang sinergis untuk menurunkan kadar timbal jika digunakan selama 10 hari. Komponen utama yang terkandung dalam rimpang temulawak adalah senyawa kurkuminoid. Ditinjau dari stuktur kimianya, ternyata senyawa kurkuminoid dapat berpotensi sebagai chelating agent karena mempunyai struktur elektron bebas dan memungkinkan untuk mengikat logam berat (Pan et al., 1999). Menurut Astoro (2008), pemberian ekstrak etanol rimpang temulawak setelah pemberian antidot Na2CaEDTA, mampu menurunkan
kadar timbal darah dalam kurun waktu 10 hari pemberian.
Penelitian ini dilakukan untuk mengetahui efektifitas ekstrak etanol umbi bawang putih dan ekstrak etanol rimpang temulawak yang diberikan bersamaan dalam menurunkan kadar timbal darah tikus setelah pemberian Na2CaEDTA.
1. Permasalahan
Berdasarkan latar belakang yang telah dipaparkan, maka dapat dirumuskan beberapa permasalahan sebagai berikut:
a. Bagaimana pengaruh pemberian ekstrak etanol umbi bawang putih dan ekstrak etanol rimpang temulawak setelah pemberian antidot Na2CaEDTA
b. Berapa lama waktu pemberian ekstrak etanol umbi bawang putih dan ekstrak etanol rimpang temulawak setelah pemberian antidot Na2CaEDTA yang
efektif dalam menurunkan kadar timbal darah tikus? 2. Keaslian penelitian
Sejauh pengetahuan penulis belum pernah dilakukan penelitian yang memberikan laporan resmi tentang pengaruh ekstrak etanol umbi bawang putih dan ekstrak etanol rimpang temulawak setelah pemberian antidot Na2CaEDTA
terhadap kadar timbal darah tikus. Penelitian ini merupakan penelitian lanjutan dari penelitian sebelumnya yang telah dilakukan oleh Fedelia (2008) dan Astoro (2008). Hal yang berbeda dari penelitian ini dengan penelitian sebelumnya yaitu pemberian ekstrak etanol umbi bawang putih dan ekstrak etanol rimpang temulawak yang diberikan bersamaan untuk melihat pengaruhnya terhadap kadar timbal darah.
Etanol Umbi Bawang Putih (Allium sativum L.) setelah Pemberian Na2CaEDTA
terhadap Kadar Timbal Darah Tikus dengan Metode Spektroskopi Serapan Atom (Fedelia, 2008).
3. Manfaat penelitian
Penelitian mengenai pengaruh pemberian ekstrak etanol umbi bawang putih dan ekstrak etanol rimpang temulawak setelah pemberian antidot Na2CaEDTA terhadap kadar timbal darah tikus diharapkan memiliki beberapa
manfaat, antara lain:
a. Manfaat teoritis, yaitu untuk melengkapi dan memperkaya teori yang telah ada mengenai terapi penawarracunan timbal.
b. Manfaat praktis, yaitu dapat digunakan sebagai acuan terapi alternatif penawarracunan timbal dari tanaman bawang putih dan temulawak.
B. Tujuan Penelitian
Tujuan penelitian mengenai pengaruh pemberian ekstrak etanol umbi bawang putih dan ekstrak etanol rimpang temulawak setelah pemberian antidot Na2CaEDTA terhadap kadar timbal darah tikus ini adalah:
1. Mengetahui pengaruh pemberian ekstrak etanol umbi bawang putih dan ekstrak etanol rimpang temulawak setelah pemberian antidot Na2CaEDTA
dalam menurunkan kadar timbal darah tikus.
2. Mengetahui lama waktu pemberian ekstrak etanol umbi bawang putih dan ekstrak etanol rimpang temulawak setelah pemberian antidot Na2CaEDTA
BAB II
PENELAAHAN PUSTAKA
A. Timbal 1. Farmakokinetika timbal
Timbal dapat masuk ke dalam tubuh lewat makanan dan minuman yang diabsorbsi melalui usus, inhalasi dan melalui kulit. Absorbsi timbal melalui inhalasi sangat tergantung pada ukuran partikel (Papanikolaou, 2005). Partikel yang lebih kecil dari 10 µg dapat tertahan di paru-paru, sedangkan pertikel yang lebih besar akan tertahan di saluran pernafasan bagian atas (DeRoss, 1997). Timbal yang telah mencapai alveoli paru siap untuk diabsorpsi darah (Manahan, 2003). Pada orang dewasa, Pb yang diabsorbsi melalui usus sekitar 5-10%, sedangkan pada anak-anak usia 3 bulan sampai 8 tahun dapat mencapai 50% (Darmono, 1995). Timbal memiliki banyak kesamaan mekanisme transport seperti kalsium di dalam saluran pencernaan. Absorpsi timbal akan menurun seiring dengan peningkatan asupan kalsium dan demikian juga sebaliknya (Manahan, 2003).
1995). Hampir sekitar 90% Pb dalam tubuh terdapat dalam tulang, yang waktu paruhnya mencapai 20 tahun (Manahan, 2003).
Pb diekskresikan terutama melalui urin, selain itu juga melalui tinja, keringat, dan air susu ibu serta didepositkan dalam rambut dan kuku (Darmono, 1995).
2. Keracunan timbal
Kelebihan timbal memberikan efek toksik multisistemik melalui minimal tiga mekanisme, yaitu melalui aktivitas hambatan enzim, sebagai konsekuensi ikatan pada gugus sulfhidril (-SH); dengan mempengaruhi aksi kation esensial, terutama kalsium, zat besi dan seng; dan dengan mengubah struktur reseptor serta membran sel (Katzung, 2004).
Keracunan Pb akut sudah jarang terjadi. Hal ini biasanya akibat inhalasi industri dari sejumlah besar asap oksida, atau pada anak-anak akibat masuknya dosis oral yang besar dari timbal yang ada pada cat yang mengandung timbal (Katzung, 2004). Hal ini dapat mengakibatkan nyeri perut, anemia, ensefalopati (Kosnett, 2006), rasa haus, mual, muntah, konstipasi, insomnia, tremor, konvulsi (Sjamsudin dan Suyatna, 2007).
Gejala yang ditimbulkan pada keracunan Pb kronis, antara lain anoreksia, lelah, malaise, sakit kepala, depresi, kelemahan otot kaki dan tangan, anemia, neuropati perifer (Katzung, 2004).
yaitu terjadi penurunan fungsi ginjal, termasuk atropi glomular, fibrosis interstisial, dan sklerosis pembuluh darah (Manahan, 2003).
3. Mekanisme keracunan timbal a. Efek timbal terhadap sintesis heme
Efek hematotoksisitas timbal adalah menghambat sebagian besar enzim yang berperan dalam biosintesis heme. Timbal (Pb) menghambat enzim sulfhidril untuk mengikat delta-Aminolevulinic Acid (δ-ALA) menjadi porpobilinogen, serta portoporfirin IX menjadi Hb. Hal ini menyebabkan anemia dan adanya basofilik stipling, yang terjadi karena retensi dari DNA ribosoma dalam sitoplasma eritrosit sehingga mengganggu sintesis protein (Darmono, 1995).
Enzim yang paling rentan terhadap penghambatan timbal yaitu delta-Aminolevulinic Acid Dehydrogenase (δ-ALAD) dan ferrochelatase. Efek yang paling berperan adalah hambatan pada reaksi enzimatik ferrochelatase, dimana
ferrochelatase mengkatalisis penggabungan besi ferro ke dalam cincin heme (Goldstein, 1994). Inhibisi pada δ-ALAD berhubungan dengan konsentrasi Pb
dalam darah. Hampir 50% aktivitas enzim ini dihambat pada kadar Pb darah di atas 15 µg/dL (DeRoos, 1997).
b. Kompetisi timbal dengan kalsium
Kalsium masuk ke dalam ujung presinapsis melalui kanal kalsium akibat respon dari rangsangan depolarisasi. Di dalam sel, kalsium akan mengaktifkan kalmodulin, yang mengawali pembentukan vesikel asetilkolin bersama membran plasma dan akhirnya terjadi pelepasan asetilkolin. Timbal akan menghambat kalsium secara kompetitif, yang berakibat terhambatnya pelepasan asetilkolin untuk transmisi saraf, sehingga menyebabkan kurang berfungsinya asetilkolin dalam perannya sebagai neurotransmitter (Clarkson, 1987). Gejala yang ditimbulkan yaitu lelah, ingatan yang berkurang, sakit kepala, tremor otot (Manahan, 2003).
Ga m ba r 2 . Pe r a n k a lsiu m da la m pe le pa sa n n e u r ot r a n sm it t e r ( Cla r k son , 1 9 8 7 )
B. Penanganan Keracunan
Menurut Donatus (1997), penangan keracunan bahan berbahaya meliputi terapi suportif, penyidikan jenis racun penyebab, dan terapi antidot.
1. Terapi suportif
dan kooperatif untuk menjalani terapi antidot berikutnya. Terapi suportif harus dilakukan dengan cepat dan sesegera mungkin. Tindakan terapi suportif meliputi: a. Jauhkan penderita dari sumber racun.
b. Periksa tanda vital dan bersihkan jalan nafas. Bila penderita memakai gigi palsu, harus dilepas.
c. Periksa pulsus dan pupil.
d. Berikan pernafasan buatan dan atau oksigen, serta bila perlu pijit luar jantung dan siapkan infus.
e. Bila penderita kejang dapat diberikan antikejang, dan bila tekanan darahnya turun atau dehidrasi dapat diberi infus elektrolit (Donatus, 1997).
2. Penyidikan jenis racun penyebab
Penyidikan jenis racun penyebab merupakan tindakan penting untuk menentukan pilihan tindakan terapi antidot. Tindakan ini dilakukan dengan cara : a. Wawancara dengan penderita atau pengantar
b. Pemeriksaan gejala-gejala keracunan yang ada secara sistematis
c. Pemeriksaan wadah dan sisa bahan penyebab yang dicurigai, muntahan, air kencing, atau darah penderita.
d. Pengiriman bahan pada butir c ke laboratorium (Donatus, 1997). 3. Terapi antidot
Strategi penatalaksanaan terapi antidot dapat dilakukan dengan cara : a. Penghambatan keefektifan absorpsi bahan berbahaya
b. Penghambatan keefektifan distribusi bahan berbahaya
c. Peningkatan keefektifan metabolisme dan ekskresi (eliminasi) bahan berbahaya (Donatus, 1997).
C. Kalsium Disodium Edetat (Na2CaEDTA)
Agen khelasi merupakan obat yang digunakan untuk mencegah atau membalik efek toksik dari suatu logam berat atau pada enzim atau sasaran seluler lain untuk mempercepat eliminasi logam tersebut dari dalam tubuh. Agen khelasi adalah molekul fleksibel dengan dua atau lebih kelompok elektronegatif yang membentuk ikatan koordinasi kovalen yang stabil dengan kation logam (Katzung, 2004).
Ligan khelasi, termasuk kelompok gugus fungsional –OH, -SH dan –NH, dapat mendonasikan elektronnya untuk membentuk ikatan koordinasi dengan logam. Ikatan ini secara efektif akan menghalangi interaksi logam dengan kelompok fungsional yang hampir sama, yang juga dimiliki oleh enzim, koenzim, nukleofil seluler dan membran. Sebagian chelator memiliki selektifitas yang terbatas, sehingga dapat mengkhelasi logam esensial seperti Cu2+ dan Zn2+ yang sangat vital untuk fungsi tubuh (Katzung, 2004).
Na2CaEDTA telah digunakan sebagai agen khelasi untuk meningkatkan
eliminasi logam-logam toksik, salah satunya yaitu timbal. Eliminasi logam-logam endogen, seperti zink, mangan, besi dan tembaga, juga terjadi pada tingkat rendah (Kosnett, 2006).
1. Farmakokinetika Na2CaEDTA
Absorpsi Na2CaEDTA pada saluran gastrointestinal setelah pemberian
secara oral sangat rendah. Hal ini disebabkan karena terjadi peruraian khelat kalsium pada pH lambung, yang mengakibatkan meningkatnya absorpsi timbal di saluran pencernaan. Maka, pemberian secara oral dihindari (Dollery, 1999).
Na2CaEDTA memiliki waktu paruh 20-60 menit, dan 50% dari dosis
yang diberikan akan diekskresikan melalui urin kurang dari 1 jam. Peningkatan ekskresi timbal melalui urin terjadi kurang dari 1 jam setelah pemberian Na2CaEDTA dan diikuti dengan penurunan kadar timbal di dalam darah selama
terapi berlangsung. Na2CaEDTA mengakibatkan pelepasan timbal dari jaringan
lunak dan tulang. Orang yang terpapar timbal kadar tinggi, penghentian terapi Na2CaEDTA akan mengakibatkan peningkatan kadar timbal di dalam darah
sebagai dampak penyeimbangan kadar timbal di dalam tulang dengan kadar timbal di dalam jaringan lunak yang rendah (Kosnett, 2006).
2. Indikasi
Na2CaEDTA diindikasikan untuk menurunkan kadar timbal di dalam
3. Dosis dan cara pemberian
Untuk terapi keracunan timbal kronis dengan gejala ensefalopati dan kadar timbal darah lebih dari 150mcg/dL, maka diberikan Na2CaEDTA dengan
dosis 30 mg/kg BB dalam 3 dosis terbagi (setiap 8-12 jam) secara IM selama 2-5 hari (Kosnett, 2006). Pemberian Na2CaEDTA diselingi dengan periode istirahat
(tidak dilakukan pemberian Na2CaEDTA), karena pemberian Na2CaEDTA secara
terus menerus akan meningkatkan nefrotoksisitas dan dapat mengakibatkan gagal ginjal (Chisolm, 1990).
4. Efek samping
Terapi khelasi dengan Na2CaEDTA dapat menimbulkan beberapa efek
samping, antara lain nekrosis sel tubular ginjal, demam, hematuria, proteinuria, mialgia, sakit kepala, nyeri abdominal, mual, anemia, muntah, dan defisiensi zink (Dollery, 1999).
5. Mekanisme aksi Na2CaEDTA
Pada pH cairan tubuh, Na2CaEDTA akan berikatan dengan ion logam
polivalen membentuk komplek atau khelat tidak terion yang larut air dan lebih stabil. Kalsium pada Na2CaEDTA akan digantikan oleh timbal dan khelat tersebut
akan masuk ke dalam cairan tubuh. Na2CaEDTA akan dengan cepat mengkhelat
(Anonim, 2008a) dan akan mengakibatkan redistribusi timbal ke otak jika terapi khelasi Na2CaEDTA dihentikan (Ashton, 1991).
Khelat yang terbentuk akan diekskresikan dengan cepat dan utuh melalui ginjal. Dengan mekanisme ini, timbal dapat dihilangkan dari plasma, saluran gastrointestinal, jaringan lunak, dan lapisan tulang (Dollery, 1999). Obat ini diberikan sebagai suatu garam kalsium dinatrium untuk mencegah kekurangan kalsium yang secara potensial dapat membahayakan jiwa (Katzung, 2004).
D. Bawang Putih (Allium sativum L.)
1. Taksonomi tanaman Divisi : Spermatophyta Sub divisi : Angiospermae
Kelas : Monocotyledonae Ordo : Liliales
Suku : Liliaceae Genus : Allium
Spesies : Allium sativum L. (Hidayat, 1991). 2. Deskripsi simplisia
siung bentuk membulat di bagian punggung, bidang samping rata atau agak bersudut (Anonim, 1995a).
3. Kandungan kimia
Kandungan kimia umbi bawang putih antara lain tanin, minyak atsiri, dialilsulfida, aliin, alisin, enzim aliinase, vitamin K, B6, C (Anonim, 1995a),
terpen termasuk sitral, geraniol, linalool, α- dan β-phellandrene, protein, mineral,
lipid, asam amino (Newall, 1996); Ca, K, Fe, Mg, Na, Zn, P, Mn, dan selenium (Anonim, 2008c). Kadar selenium kurang lebih 0,015 µg tiap gram bawang putih (Izgi, Gucer, Jaćimović, 2005).
Selenium di dalam tanaman terdapat dalam bentuk asam selenoamino, selenometionin, dan selenosistein (gambar 4), sedangkan
γ-glutamil-Se-metil-L-selenosistein (gambar 5) merupakan sumber utama metilγ-glutamil-Se-metil-L-selenosistein yang terdapat pada bawang putih (Majeed et al, 2005). Selenometionin akan dimetabolisme menjadi selenosistein yang kemudian berikatan dengan selenoprotein. Selenium dalam bentuk selenosistein merupakan komponen penting enzim antioksidan yaitu glutation peroksidase.
H3C
Se
OH NH2
O
HSe OH
O
NH2
(a) (b)
Ga m ba r 4 . St r u k t u r se le n om e t ion in da n se le n osist e in ( a ) se le n om e t ion in
( b) se le n osist e in
N H
SeH
O OH
NH2
O
O OH
Ga m ba r 6 . Sk e m a m e t a bolism e se le n om e t ion in m e n j a di se le n osist e in ( An on im , 2 0 0 8 b)
4. Khasiat dan penggunaan
Penggunaan bawang putih di masyarakat biasanya digunakan sebagai diaforetik, ekspektoran, spasmolitik, antiseptik, antikoagulan, antihistamin, bakteriostatik (Soedibyo, 1998), dan terapi hipertensi ringan. Ekstrak etanol umbi bawang putih dosis 200 mg/kg BB setelah pemberian Na2CaEDTA terbukti
mampu menurunkan kadar timbal darah dan memiliki efek terapi yang sinergis untuk menurunkan kadar timbal jika digunakan selama 10 hari (Fedelia, 2008).
E. Temulawak (Curcuma xanthorrhiza Roxb.) 1. Taksonomi tanaman
Divisi : Spermatophyta Sub divisi : Angiospermae
Kelas : Monocotyledonae Ordo : Zingiberales Suku : Zingiberaceae Genus : Curcuma
2. Deskripsi simplisia
Keping tipis, bentuk bundar atau jorong, ringan, keras, rapuh, garis tengah sampai 6 cm, tebal 2-5 mm; permukaan luar berkerut, warna coklat kuning sampai coklat; bidang irisan berwarna coklat kuning buram, melengkung tidak beraturan, tidak rata, sering dengan tonjolan melingkar pada batas antara silinder pusat dengan korteks; korteks sempit, tebal 3-4 mm. bekas patahan berdebu, warna kuning jingga sampai coklat jingga terang (Anonim, 1979).
3. Kandungan kimia
Kandungan kimia rimpang temulawak antara lain minyak atsiri (6%), yang terdiri dari monoterpen dan seskuiterpen. Senyawa berwarna (5%) yaitu kurkuminoid, dimana 50-60% merupakan campuran dari kurkumin, monodesmetoksikurkumin dan bisdesmetoksikurkumin (Anonim, 1999), pati, flavonoid, dan beberapa kation (Fe, Ca, Na, dan K) (Sugiharto, 2006).
Ga m ba r 7 . St r u k t u r m ole k u l k u r k u m in ( An on im , 1 9 9 9 )
4. Khasiat dan penggunaan
Penggunaan temulawak di masyarakat biasanya digunakan sebagai antiinflamasi, antipiretik, menurunkan kolesterol, pelancar ASI, obat sembelit, demam, cacar air, nyeri sendi (Soedibyo, 1998), asma, batuk, epilepsi, perdarahan,
jaundice, gigitan serangga, dan penyakit kulit. Ekstrak etanol rimpang temulawak setelah pemberian antidot Na2CaEDTA, mampu menurunkan kadar timbal darah
F. Maserasi
Maserasi adalah salah satu cara penyarian dengan merendam serbuk simplisia dalam cairan penyari yang sesuai di wadah yang tertutup pada suhu kamar. Proses maserasi berlangsung secara dinamis dan terbagi menjadi beberapa tahapan. Pertama-tama, larutan penyari harus berdifusi ke dalam sel, kemudian melarutkan metabolit, dan akhirnya berdifusi keluar dari sel bersama metabolit yang terekstraksi (Sarker,2006).
Maserasi digunakan untuk penyarian simplisia yang mengandung zat aktif yang mudah larut di dalam cairan penyari. Cairan penyari yang digunakan dapat berupa air, etanol, air-etanol, atau pelarut lain. Keuntungan maserasi adalah cara pengerjaan dan peralatan yang digunakan sederhana (Anonim,1986) serta mencegah terjadinya degradasi metabolit termolabil. Sedangkan kerugiannya adalah pengerjaannnya lama dan beberapa senyawa tidak terekstraksi dengan baik karena kelarutannya rendah pada suhu kamar (Sarker,2006).
Etanol dipertimbangkan sebagai penyari karena lebih selektif bila dibandingkan dengan air, sulit ditumbuhi kapang dan kuman dalam etanol 20% ke atas, tidak beracun, netral, absorbsinya baik, etanol dapat bercampur dengan air pada segala perbandingan, dan panas yang diperlukan saat pemekatan sedikit. Kerugiannya yaitu harga etanol yang mahal (Anonim,1986).
G. Spektroskopi Serapan Atom (SSA)
Metode AAS sangat tepat untuk analisis zat pada konsentrasi rendah. Metode AAS berprinsip pada absorbsi cahaya oleh atom. Atom-atom menyerap cahaya tersebut pada panjang gelombang tertentu, tergantung pada sifat unsurnya. Cahaya pada panjang gelombang ini mempunyai cukup energi untuk mengubah tingkat elektronik suatu atom. Transisi elektronik suatu atom bersifat spesifik. dengan absorbsi energi berarti memperoleh lebih banyak energi, suatu atom pada keadaan dasar dinaikkan tingkat energinya ke tingkat eksitasi. Spektrum atomik untuk masing-masing unsur terdiri atas garis-garis resonansi (Khopkar, 1990).
Ga m ba r 8 . I n st r u m e n t a si spe k t r om e t e r se r a pa n a t om
Keberhasilan analisis ini tergantung pada proses eksitasi dan cara memperoleh garis resonansi yang tepat. Temperatur nyala harus sangat tinggi. Pengendalian temperatur nyala penting sekali. Dibutuhkan kontrol tertutup dari temperatur yang digunakan untuk eksitasi. Kenaikkan temperatur menaikkan efisiensi atomisasi. Tenaga radiasi emisi akan menentukan jumlah atom tereksitasi. Umumnya bahan bakar yang digunakan adalah propana, butana, hidrogen dan asetilen, sedangkan oksidatornya adalah udar, oksigen, N2O dan
Atomisasi dapat dilakukan baik dengan nyala maupun dengan tungku. untuk mengubah unsur metalik menjadi uap atau hasil disosiasi diperlukan energi panas. Temperatur harus benar-benar terkendali dengan sangat hati-hati agar proses atomisasinya sempurna (Khopkar, 1990). Broekaert (2002) menyebutkan bahwa oksidan terdiri dari N2O atau udara. Campuran udara dan asetilen
menghasilkan temperatur sebesar 2300°K.
Ionisasi harus dihindarkan dan ini dapat terjadi bila temperatur terlalu tinggi. Atomisasi sempurna masih sulit untuk tercapai, sehingga digunakan tungku grafit yang dengan mudah dalam beberapa detik dapat mencapai temperatur 2000-3000 0K (Khopkar, 1990).
Ga m ba r 9 . Sk e m a pr ose s a t om isa si sa m pe l. M : loga m (m e t a l) ; M * : a t om y a n g t e r e k sit a si.
Pa da SSA y a n g diu k u r a da la h M ’ ya it u a t om da la m k e a da a n gr ou n d st a t e
( Ba sse t t , D e n n e y, Je ff e r y, M e n dh a m , 1 9 9 4 )
Ga m ba r 1 0 . Pe m ba gia n zon a n y a la pa da pe m ba k a r pa da spe k t r om e t e r se r a pa n a t om ( Sk oog, W e st , H olle r , 1 9 9 4 )
Zona nyala pada SSA yaitu primary combustion zone, interzonal region
interzonal region. Pada zona ini, atom dalam keadaan gas segera menyerap energi radiasi yang diemisikan oleh lampu katoda berongga (Skoog, West, Holler, 1994). Selain itu, juga terjadi kesetimbangan kombinasi dengan radikal. Pada zona ini merupakan bagian terpanas dari nyala dan merupakan bagian yang dipilih dalam analisis spektrometri (Ebdon, 1998).
Karena banyaknya interferensi dan efek nyala yang tersedot balik dan dapat mengakibatkan ledakan, maka nyala mulai kurang digunakan, dan sebagai gantinya digunakan proses atomisasi tanpa nyala, misalnya menggunakan tungku grafit. Pada tungku grafit temperatur dapat dikendalikan secara elektris. Biasanya temperatur dinaikkan secara bertahap, untuk menguapkan dan sekaligus mendisosiasi senyawa yang dianalisis (Khopkar, 1990).
Seperangkat sumber yang dapat memberikan garis emisi yang tajam dari suatu unsur spesifik tertentu dikenal sebagai lampu pijar hollow cathode.
Ga m ba r 1 1 . La m pu k a t oda be r on gga (h ollow ca t h ode la m p)
pa da SSA da n ba gia n - ba gia n n y a ( Le vin son ,2 0 0 6 )
panjang gelombang- panjang gelombang tertentu. Suatu garis yang diinginkan dapat diisolasi dengan suatu monokromator (Khopkar, 1990).
H. Validasi Metode
Validasi metode analisis adalah suatu tindakan penilaian terhadap parameter tertentu, berdasarkan percobaan laboratorium, untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita, 2004). Validasi metode bioanalisis adalah suatu prosedur untuk menyatakan bahwa suatu metode analisis yang digunakan untuk mengukur suatu analit di dalam matriks biologi dapat dipercaya dan memiliki tingkat keterulangan yang baik untuk mencapai tujuannya yaitu mengukur suatu analit dengan tingkat akurasi dan presisi yang sesuai (Chan, Lam, Lee, Zhang, 2004). Parameter– parameter validitas metode analisis meliputi akurasi, presisi, linieritas, rentang, spesifisitas, LOD, dan LOQ (Anonim, 2007).
1. Akurasi
Akurasi dari suatu metode analisis merupakan kedekatan hasil pengukuran yang diperoleh dengan metode tersebut dengan nilai sebenarnya. Akurasi dari suatu metode analisis sebaiknya disajikan dalam rentang. Akurasi dihitung sebagai presentase recovery pengujian sejumlah analit yang diketahui jumlahnya atau sebagai perbedaan antara rata–rata dan nilai sebenarnya yang bisa diterima, bersama dengan taraf kepercayaan (Anonim, 2007). Menurut Chan et.al
2. Presisi
Presisi dari suatu metode analisis adalah derajat kesesuaian antara hasil pengukuran ketika metode tersebut diaplikasikan secara berulang – ulang pada sampel yang homogen. Presisi biasanya ditunjukkan dengan standar deviasi atau koefisien variasi dari sebuah seri pengukuran. Presisi dapat dijadikan ukuran dari salah satu derajat reproduksibilitas atau repeatabilitas suatu metode analisis dalam kondisi pekerjaan yang normal. Reproduksibilitas mengacu pada penggunaan prosedur analisis di laboratorium yang berbeda. Intermediate precission
menyatakan variasi dalam laboratorium, seperti hari berbeda, analisis yang berbeda atau peralatan dalam laboratorium yang sama. Repeatabilitas mengacu penggunaan metode analisis dalam laboratorium pada suatu periode tertentu dengan analis yang sama dengan peralatan yang sama. (Anonim, 2007).
Kriteria seksama diberikan jika metode memberikan simpangan baku relatif atau koefisien variasi 2% atau kurang, tapi sangat fleksibel tergantung kondisi analit yang diperiksa, jumlah sampel dan kondisi laboratorium. Menurut Harmita (2004), koefisien variasi (KV) yang dapat diterima terdapat pada tabel I.
Tabel I. Kriteria koefisien variasi (KV) laboratorium yang dapat diterima
Kadar analit KV (%)
≥1% 2,5
0,1% 5
1 ppm 16
1ppb 32
3. Linearitas dan rentang
parameter adanya hubungan linier digunakan koefisien korelasi (r). Persyaratan data linieritas yang biasa diterima jika memenuhi nilai koefisien korelasi (r) >0,99 (Christian, 2004). Rentang adalah jarak antara level terbawah dan teratas dari metode analisis yang telah dipakai untuk mendapatkan presisi, linieritas dan akurasi yang bisa diterima (Anonim, 2007).
4. Spesifisitas
Spesifisitas didefinisikan sebagai kemampuan untuk mengukur dengan baik komponen lain dalam analit yang mungkin ada seperti pengotor, produk degradasi, dan komponen matriks (Anonim, 2007).
5. Limit of detection (LOD) dan limit of quantitation (LOQ)
LOD adalah kadar terkecil analit yang masih dapat di deteksi, tetapi tidak secara kuantitatif pada kondisi percobaan yang dinyatakan. LOQ merupakan
adalah kadar terkecil analit dalam sampel yang dapat ditetapkan dengan presisi dan akurasi yang dapat diterima pada kondisi percobaan yang dinyatakan. Validasi metode analisis dapat digolongkan menjadi 4 kategori, yaitu:
a. Kategori I, mencakup metode-metode analisis kuantitatif, untuk menetapkan komponen-komponen utama bahan obat atau zat aktif dalam sediaan farmasi. b. Kategori II, mencakup metode-metode analisis kualitatif dan kuantitatif yang
digunakan untuk analisis impurities atau degradation compounds dalam sediaan farmasi.
c. Kategori III, mencakup metode-metode analisis yang digunakan untuk menentukan karakteristik penampilan suatu sediaan farmasi.
Tabel II. Parameter validitas metode yang dipersyaratkan untuk setiap kategori
Parameter
analisis Kategori I
Kategori II
Kategori III Kategori IV
Kuantitatif Kualitatif
Akurasi Ya Ya * * Tidak
Presisi Ya Ya Tidak Ya Tidak
LOD Tidak Tidak Ya * Ya
LOQ Tidak Ya Tidak * Tidak
Linearitas Ya Ya Tidak * Tidak
Range Ya Ya * * Tidak
* = mungkin tidak diperlukan, tergantung sifat spesifik tes (Anonim, 2007)
Menurut Chan et.al (2004), karakteristik validasi metode kuantitatif pada logam berat, termasuk timbal, dengan spektroskopi meliputi:
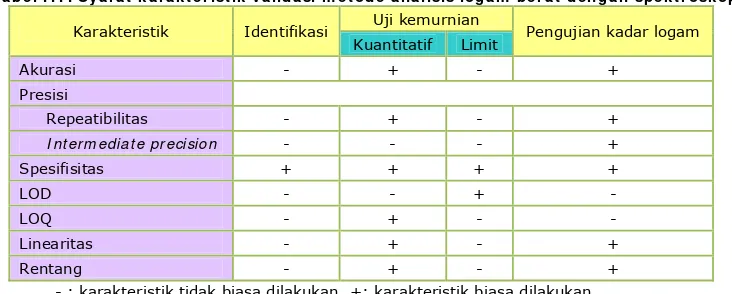
Ta be l I I I . Sy a r a t k a r a k t e r ist ik va lida si m e t ode a n a lisis loga m be r a t de n ga n spe k t r osk opi
Karakteristik Identifikasi Uji kemurnian Pengujian kadar logam
Kuantitatif Limit
Akurasi - + - +
Presisi
Repeatibilitas - + - +
I nt erm ediat e precision - - - +
Spesifisitas + + + +
LOD - - + -
LOQ - + - -
Linearitas - + - +
Rentang - + - +
- : karakteristik tidak biasa dilakukan. +: karakteristik biasa dilakukan
Terdapat 3 prinsip dasar yang perlu diketahui untuk meningkatkan validitas percobaan. Prinsip-prinsip dasar tersebut meliputi replikasi, randomisasi dan adanya kontrol (Nazir, 2005).
I. Landasan Teori
Na2CaEDTA biasa digunakan untuk terapi penawarracunan timbal.
Kalsium pada Na2CaEDTA akan berikatan dengan timbal menghasilkan khelat
yang kurang toksik dan lebih polar sehingga lebih mudah diekskresikan. Akan tetapi, terapi khelasi dengan Na2CaEDTA dapat menimbulkan beberapa efek
samping, antara lain nekrosis sel tubular ginjal, hematuria, proteinuria, mialgia, sakit kepala, mual, muntah, anemia, dan defisiensi zink (Dollery, 1999).
Bawang putih dan temulawak mempunyai aktivitas terapetik potensial untuk mengatasi keracunan timbal. Senyawa pada bawang putih yang diduga dapat mengurangi kadar timbal adalah selenium, sedangkan pada temulawak adalah kurkumin. Penelitian mengenai umbi bawang putih dan rimpang temulawak telah banyak dilakukan. Senapati, Dey, Dwivedi, dan Swarup (2001) telah meneliti efek ekstrak bawang putih dosis 100 mg/kg BB, 200 mg/kg BB, dan 400 mg/kg BB, dapat menurunkan kadar timbal darah tikus. Fedelia (2008) meneliti tentang pengaruh ekstrak etanol umbi bawang putih dosis 200 mg/kg BB setelah pemberian Na2CaEDTA yang terbukti mampu menurunkan kadar timbal
darah dan memiliki efek terapi yang sinergis untuk menurunkan kadar timbal jika digunakan selama 10 hari.
Penelitian mengenai rimpang temulawak yang pernah dilakukan sebelumnya yaitu efek rimpang temulawak terhadap kondisi parameter pemeriksaan darah tikus yang diberi larutan timbal anorganik (Sugiharto, 2003 dan 2006). Menurut Astoro (2008), pemberian ekstrak etanol rimpang temulawak setelah pemberian antidot Na2CaEDTA, mampu menurunkan kadar timbal darah
Penelitian tentang efek pemberian timbal anorganik pada tikus putih telah dilakukan oleh Hariono (2005). Hasilnya, timbal dalam darah tikus mencapai kadar 0,75 µg/ml dalam kurun waktu 4 minggu. Menurut hasil penelitian orientasi sebelumnya, pemejanan timbal selama 45 hari telah mencapai kadar toksik sebesar 0,75 ppm (Wahyunengsih, Fedelia, Astoro, Putri, 2007). Maka dilakukan pemejanan timbal asetat selama 30 hari yang dilanjutkan dengan pemberian Na2CaEDTA, ekstrak etanol umbi bawang putih, dan ekstrak etanol
rimpang temulawak selama 10 hari setelah pemejanan timbal. Keefektifan ketiga bahan tersebut dapat diketahui dengan mengukur kadar timbal darah tikus dengan metode spektroskopi serapan atom.
J. Hipotesis
Pemberian ekstrak etanol umbi bawang putih dan ekstrak etanol rimpang temulawak setelah pemberian Na2CaEDTA memiliki efek yang sinergis dalam
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk dalam jenis penelitian eksperimental murni dengan rancangan acak pola satu arah.
B. Variabel dan Definisi Operasional 1. Variabel utama
a. Variabel bebas dalam penelitian ini yaitu dosis senyawa uji. 1) Dosis antidot Na2CaEDTA 189 mg/kg BB tikus.
2) Dosis ekstrak etanol umbi bawang putih 200 mg/kg BB tikus dan dosis ekstrak etanol rimpang temulawak 137,61 mg/kg BB tikus.
b. Variabel tergantung : kadar timbal darah tikus yang diukur setelah perlakuan. 2. Variabel pengacau
a. Variabel pengacau terkendali :
1) Subyek uji : tikus putih galur Wistar 2) Jenis kelamin hewan uji : tikus betina
3) Umur hewan uji : 1,5 - 2 bulan 4) Berat badan hewan uji : 100 - 150 gram 5) Cara pemberian bahan uji : peroral
8) Suhu penyarian (27-28 0C), cara penyarian (maserasi), dan lama penyarian (5 hari) ekstrak etanol tanaman.
9) Daerah asal (lingkungan tempat tumbuh) tanaman bawang putih dan temulawak yang akan digunakan sebagai bahan baku pembuatan ekstrak etanol umbi bawang putih dan ekstrak rimpang etanol temulawak.
b. Variabel pengacau tak terkendali :
1) Perbedaan kondisi patologis (fungsi organ) tiap hewan uji 2) Profil farmakokinetika timbal yang berbeda pada hewan uji 3) Kadar selenium dan kurkumin di dalam ekstrak etanol tanaman 3. Definisi operasional
a. Senyawa toksik yang digunakan adalah timbal asetat dosis 0,5 g/kg BB tikus yang diberikan selama 30 hari.
b. Ekstrak etanol adalah :
ekstrak etanol umbi bawang putih yaitu hasil ekstraksi dengan metode maserasi menggunakan etanol 45% dan ekstrak etanol rimpang temulawak yaitu hasil ekstraksi dengan metode maserasi menggunakan etanol 80%. c. Uji daya antidot adalah uji potensi penawarracunan menggunakan antidot
Na2CaEDTA dosis 189 mg/kg BB tikus, kemudian setelah 2 jam dilanjutkan
dengan pemberian ekstrak etanol umbi bawang putih dosis 200 mg/kg BB tikus dan ekstrak etanol rimpang temulawak dosis 137,61 mg/kg BB tikus untuk menurunkan kadar Pb darah setelah pemberian Pb asetat selama 30 hari. d. Kadar timbal darah adalah kadar Pb dalam darah tikus, diukur menggunakan
C. Bahan atau Materi Penelitian
Bahan yang digunakan adalah serbuk umbi bawang putih dan serbuk rimpang temulawak (Merapi Farma), tikus betina (Laboratorium Farmakologi dan Toksikologi Fakultas Farmasi USD), timbal asetat (Merck), aquadest, etanol 45% (p.a.), etanol 80% (p.a.), Na2CaEDTA (Merck), NaCl (teknis), HNO3 65% (p.a.
Merck), HClO4 37% (p.a. Merck), larutan standar timbal 1000 ppm (Merck),
kertas alumunium, kertas saring.
D. Alat atau Instrumen Penelitian
Alat yang digunakan adalah spektrofotometer serapan atom (Hitachi Z-8000 Polarized Zeeman), timbangan analitik (Mettler Toledo PL303), heater
(Barnstead Thermolyne Cimarec®), hot plate (Heidolph MR2002), alat maserasi (Innova 2100 Plateform Shaker), oven, corong Buchner, pompa vakum, alat-alat gelas (Pyrex), pipet mikro 200-1000µl (GILSON Z 64581D), yellowtip, pipa kapiler tanpa heparin, eppendorf, spuit injeksi oral dan intramuskular.
E. Tata Cara Penelitian 1. Identifikasi simplisia dan serbuk simplisia
2. Preparasi bahan
a. Penyiapan serbuk umbi bawang putih dan rimpang temulawak.
Pengumpulan, pengeringan dan pembuatan serbuk umbi bawang putih dan serbuk rimpang temulawak dilakukan di kebun obat Merapi Farma Kaliurang. Umbi bawang putih berasal dari daerah Brebes, Jawa Tengah. Sedangkan rimpang temulawak berasal dari daerah Kulonprogo. Serbuk umbi bawang putih dan rimpang temulawak disimpan pada suhu kamar (25ºC) untuk mencegah tumbuhnya kapang dan jamur, kontaminasi mikroba dan rusaknya zat aktif.
b. Pembuatan ekstrak etanol umbi bawang putih dan rimpang temulawak.
• Ekstrak etanol umbi bawang putih
Umbi bawang putih dibuat dalam bentuk sediaan ekstrak dengan metode maserasi. Ekstrak etanol dibuat dengan memasukkan 20 g serbuk umbi bawang putih ke dalam erlenmeyer, kemudian dituangi dengan 200 ml etanol 45%, ditutup dan dibiarkan selama 5 hari terlindung dari cahaya, sambil berulang-ulang digojog.
• Ekstrak etanol rimpang temulawak
Rimpang temulawak dibuat dalam bentuk sediaan ekstrak dengan metode maserasi. Ekstrak etanol dibuat dengan memasukkan 20 g serbuk rimpang temulawak ke dalam erlenmeyer, kemudian dituangi dengan 200 ml etanol 80%, ditutup dan dibiarkan selama 5 hari terlindung dari cahaya, sambil berulang-ulang digojog.
Setelah 5 hari, sari difiltrasi dengan corong Buchner dan pompa vakum. Ampas ditambah cairan penyari secukupnya, kemudian difiltrasi kembali dengan corong Buchner dan pompa vakum, sehingga diperoleh seluruh sari sebanyak 200 ml. Bejana ditutup, dibiarkan di tempat sejuk, terlindung dari cahaya, selama 2 hari. Setelah 2 hari, dilakukan proses pemekatan. Pemekatan dilakukan dengan cara penguapan dalam oven pada suhu 40°C hingga diperoleh ekstrak kental (Anonim, 1986).
c. Pembuatan larutan timbal asetat.
Timbal yang digunakan dalam penelitian ini adalah timbal asetat (Pb(CH3COO)2.3H2O) berupa serbuk halus berwarna putih. Serbuk timbal
d. Pembuatan larutan Na2CaEDTA.
Na2CaEDTA ditimbang lebih kurang 7,56 g kemudian dilarutkan dengan
larutan saline (NaCl 0,9% 0,1 N) (Lacy, Amstrong, Goldman, Lance, 2003) hingga 500 ml. Konsentrasi larutan Na2CaEDTA yang diperoleh adalah
0,01512 mg/L. Larutan saline digunakan sebagai pelarut karena sifatnya yang mirip dengan cairan fisiologis tubuh manusia. Dosis antidot Na2CaEDTA
yang dipejankan sebesar 189 mg/kg BB tikus hasil konversi dari dosis untuk manusia sebesar 30 mg/kg BB (Katzung, 2004) secara i.m. selama 10 hari dengan volume pemberian disesuaikan dengan berat badan tiap hewan uji. 3. Persiapan hewan uji
Persiapan hewan uji dilakukan beberapa bulan sebelum penelitian ini dilakukan, yaitu dengan cara 10 pasang tikus jantan dan betina dikawinkan sehingga bunting. Setelah dua puluh hari masa organogenesis dan dilahirkan, anak tikus yang berumur 3 minggu dipisahkan dari induknya. Tikus betina yang berumur 6 - 8 minggu dipilih sebagai hewan uji.
4. Pengelompokan dan perlakuan hewan uji
Hewan uji dibagi menjadi 6 kelompok, masing-masing berjumlah 7 ekor, yaitu: Kelompok I = kontrol negatif aquadest.
Kelompok II = kontrol positif timbal dosis 0,5 g/kgBB selama kondisi
praperlakuan.
Kelompok III = perlakuan Na2CaEDTA dosis 189 mg/kgBB selama 10 hari
Kelompok IV = perlakuan Na2CaEDTA dosis 189 mg/kgBB, dilanjutkan
dengan ekstrak etanol umbi bawang putih dosis 200 mg/kgBB selama 10 hari setelah kondisi praperlakuan.
Kelompok V = perlakuan Na2CaEDTA dosis 189 mg/kgBB, dilanjutkan
dengan ekstrak etanol rimpang temulawak dosis 137,61 mg/kgBB selama 10 hari setelah kondisi praperlakuan.
Kelompok VI = perlakuan Na2CaEDTA dosis 189 mg/kgBB, dilanjutkan
dengan ekstrak etanol umbi bawang putih dosis 200 mg/kgBB dan dilanjutkan ekstrak etanol rimpang temulawak dosis 137,61 mg/kgBB selama 10 hari setelah kondisi praperlakuan. Pada kondisi praperlakuan, larutan Pb asetat 0,5 g/kgBB dipejankan secara p.o. (Hariono, 2005) selama 30 hari dengan menganalogikan pejanan Pb kronis dan akumulatif pada manusia, sedangkan kontrol negatif diberi aquadest. Setelah pemejanan Pb asetat selama 30 hari, kadar Pb dalam darah mencapai lebih dari 0,75 ppm (Wahyunengsih et al, 2007, Hariono, 2005). Na2CaEDTA 189 mg/kgBB diberikan secara i.m. selama 10 hari setelah
kondisi praperlakuan yang merupakan hasil konversi dari dosis manusia 30 mg/kg BB/hari. Ekstrak etanol umbi bawang putih 200 mg/kgBB (Senapati, 2001) dan ekstrak etanol rimpang temulawak 137,61 mg/kgBB diberikan 2 jam secara p.o. setelah pemejanan Na2CaEDTA. Jeda waktu pemberian
ekstrak tanaman selama 2 jam ini dimaksudkan untuk menghindari interaksi Na2CaEDTA dengan ekstrak etanol tanaman. Dipilih jeda waktu selama 2
5. Pengukuran kadar timbal darah a. Preparasi sampel
Darah tikus diambil dari sinus orbitalis mata, ditampung di effendrof, kemudian ditimbang (harus lebih dari 0,5 g). Sampel didestruksi pada suhu 200°C dengan HNO3 p 10-15 ml dan HClO4 0,5 ml hingga jernih, tidak
berasap kuning dan volume yang tersisa 1-2 mL, kemudian didinginkan. Sampel hasil destruksi disaring dengan kertas saring. Filtrat kemudian diencerkan dengan aquadest hingga volumenya tepat 10 ml.
b. Pengaturan spektrofotometer serapan atom (SSA)
Sumber Cahaya : hollow cathode lamp (timbal) Arus lampu : 7,5 mA
Panjang gelombang : 283,3 nm Celah : 1,3 nm
Pengatom : standar burner
Oksidan : udara
Tekanan oksidan : 1,60 kg/cm2 (9,5 L/menit) Bahan bakar : C2H2 (asetilena)
Tekanan bahan bakar : 0,30 kg/cm2 (2,3 L/menit) Tinggi burner : 7,5 mm
c. Pembuatan kurva baku
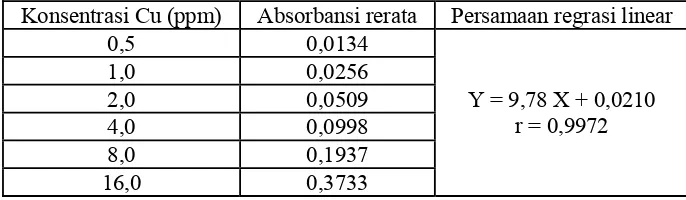
1) Pembuatan larutan baku timbal
stok timbal konsentrasi 100 ppm. Dari larutan ini, dibuat seri larutan baku dengan konsentrasi 0,5 ppm, 1 ppm, 2 ppm, 4 ppm, 6 ppm dan 8 ppm. 2) Pembuatan kurva baku timbal
Kurva baku dibuat dengan mengukur nilai serapan seri kadar larutan baku timbal pada λ = 283,3 nm menggunakan SSA.
d. Penentuan kadar timbal darah kelompok hewan uji
Nilai serapan dan rata-rata konsentrasi yang diperoleh (ppm) dihitung dengan rumus, sehingga diperoleh kadar timbal dalam sampel.
(
)(
)
(
)
faktor pengencerangram berat
volume blanko
ppm -sampel larutan ppm (ppm)
Pb
Kadar = ×
F. Analisis Hasil
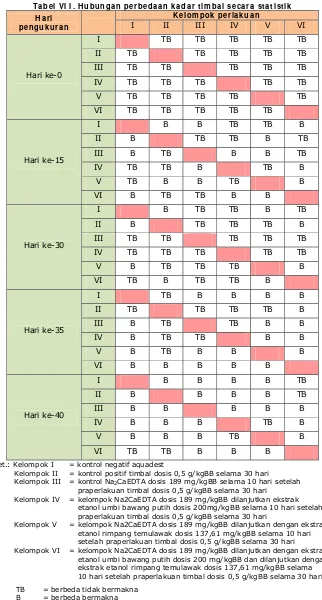
Data perlakuan yang diperoleh dibandingkan dengan data kontrol. Pada kondisi praperlakuan, kadar timbal dibandingkan dengan kontrol negatif dan positif untuk mengetahui kadar di dalam darah sebelum diberi perlakuan. Setelah diberi perlakuan, kadar timbal darah perlakuan dibandingkan dengan kontrol Na2CaEDTA. Untuk kepentingan statistik, maka hipotesis nul (H0) dirumuskan
tidak terdapat perbedaan bermakna kadar timbal antara kontrol Na2CaEDTA
dengan perlakuan ekstrak etanol tanaman setelah pemberian Na2CaEDTA.
BAB IV
HASIL DAN PEMBAHASAN
A. Identifikasi Simplisia dan Serbuk Simplisia
Dalam penelitian ini dilakukan identifikasi simplisia dan serbuk simplisia untuk memastikan kebenaran umbi bawang putih (Allii Sativi Bulbus) dan rimpang temulawak (Curcumae Rhizoma), dengan cara mencocokkan dengan menggunakan buku acuan dan simplisia diidentifikasi di Laboratorium Farmakognosi Fitokimia Fakultas Farmasi Universitas Sanata Dharma.
Pemeriksaan makroskopis terhadap umbi bawang putih dilakukan dengan mengamati warna, bau, dan rasa, yaitu warna umbi putih kekuningan; bau khas aromatik tajam; rasa agak pedas; lama-kelamaan menimbulkan rasa agak tebal di bibir. Dari hasil pengamatan penampang melintang umbi bawang putih secara mikroskopik terlihat adanya epidermis, hipodermis, berkas pembuluh, parenkim.
Hasil pengamatan mikroskopik yang diperoleh yaitu adanya sel parenkim, sel parenkim dengan tetes minyak, epidermis luar dengan parenkim, trakea, dan serabut sklerenkim. Hasil tersebut setelah dicocokkan dengan acuan baku (Anonim, 1995), memang benar sebagai fragmen penyusun serbuk umbi bawang putih. Menurut Anonim (1995), sebagai fragmen pengenal untuk umbi bawang putih yaitu parenkim berisi protein dan tetes minyak, epidermis dan trakea, serat-serat jernih dan panjang.
penampang melintang rimpang temulawak secara mikroskopik terlihat adanya rambut penutup, epidermis, hipodermis, periderm, berkas pembuluh kolateral, sklerenkim, parenkim korteks, sel minyak, butir pati, endodermis, dan parenkim silinder pusat. Bau khas aromatik, rasa pahit.
Hasil pengamatan mikroskopik yang diperoleh yaitu adanya fragmen berkas pembuluh dengan trakeida, rambut penutup tipe non glanduler, butir pati dengan tipe amilum eksentris, sel minyak berwarna kuning dan parenkim korteks. Hasil tersebut setelah dicocokkan dengan acuan baku (Anonim, 1979), memang benar sebagai fragmen penyusun serbuk rimpang temulawak. Menurut Anonim (1979), sebagai fragmen pengenal untuk rimpang temulawak yaitu butir pati, fragmen parenkim dengan sel minyak, fragmen berkas pembuluh, dan warna kuning yang intensif.
B. Pembuatan Ekstrak Etanol Tanaman
dilakukan pada suhu kamar. Sehingga dalam pembuatan ekstrak etanol umbi bawang putih digunakan etanol 45% (Anonim, 1986).
Serbuk simplisia kering diekstraksi dengan pelarut etanol dengan metode maserasi untuk mendapatkan ekstrak etanolik tanaman yang akan digunakan sebagai ekstrak uji. Penyari akan menembus dinding sel dan melarutkan zat aktif yang sesuai dengan kepolaran penyari. Karena adanya perbedaan konsentrasi antara larutan zat aktif dalam sel yang lebih tinggi, maka zat aktif dalam sel tersebut akan terdesak keluar sampai terjadi kesetimbangan konsentrasi. Etanol dapat melarutkan alkaloida basa, minyak menguap, glikosida, kurkumin, kumarin, antrakinon, flavonoid, steroid, damar dan klorofil. Lemak, malam, tanin dan saponin hanya sedikit larut, dengan demikian zat pengganggu yang larut hanya terbatas (Anonim, 1986). Metode penyarian yang dipilih adalah metode maserasi dengan pengadukan terus-menerus karena metode ini sederhana, mudah untuk dilakukan, tidak memerlukan panas tinggi dan cairan penyari yang diperlukan lebih sedikit bila dibandingkan metode perkolasi. Pengadukan bertujuan untuk memaksimalkan proses penyarian zat aktif dari bahan tanaman dan memperbesar kontak serbuk dengan cairan penyari sehingga cairan penyari akan membasahi serbuk secara merata. Pengadukan diperlukan untuk menjaga derajat perbedaan konsentrasi yang besar antara larutan di dalam sel dan larutan di luar sel.
klorofil. Proses ini dilakukan dalam wadah yang tertutup untuk menghindari tumbuhnya bakteri dan jamur pada ekstrak. Pemekatan dilakukan dengan cara penguapan hingga diperoleh ekstrak kental (Anonim, 1986). Tujuan pemekatan ekstrak adalah untuk menguapkan cairan penyari dan air, karena air dapat menjadi media pertumbuhan kapang, jamur dan bakteri pada ekstrak.
C. Pengukuran Kadar Timbal Darah
Pengukuran kadar timbal di dalam darah tikus menggunakan metode spektrometri serapan atom. Prinsip dasar dari metode ini yaitu adanya penyerapan sumber radiasi (sinar ultraviolet) oleh atom-atom netral dalam keadaan gas yang berada dalam nyala, dengan udara sebagai oksidan dan asetilen sebagai bahan bakarnya. Atom-atom netral ini mempunyai sifat yang khas yaitu akan menyerap radiasi elektromagnetik yang dipancarkan oleh lampu katoda (hollow cathode lamp). Jumlah radiasi yang diserap oleh atom sesuai dengan jumlah energi yang diperlukan untuk tereksitasi ke salah satu tingkat energi eksitasi. Sinar radiasi yang dipancarkan akan diukur pada panjang gelombang (λ) tertentu.
1. Kurva baku timbal
penentuan kurva baku untuk setiap pengukuran. Data hasil penentuan kurva baku dapat dilihat pada gambar-gambar berikut:
Ga m ba r 5 . Ku r v a ba k u pe n gu k u r a n la r u t a n t im ba l h a r i k e - 0 se be lu m pe m e j a n a n t im ba l a se t a t ( Y= 1 ,5 1 2 2 .1 0- 3X - 8 ,6 3 6 1 .1 0- 4; r = 0 ,9 9 9 0 3 )
Ga m ba r 6 . Ku r v a ba k u pe n gu k u r a n la r u t a n t im ba l h a r i k e - 1 5 se t e la h pe m e j a n a n t im ba l se la m a 1 5 h a r i ( Y= 1 ,8 5 1 3 .1 0- 3X - 2 ,8 3 8 7 .1 0- 4; r = 0 ,9 9 9 7 3 )
Ga m ba r 8 . Ku r v a ba k u pe n gu k u r a n la r u t a n t im ba l h a r i k e - 3 5 se t e la h k on disi pr a pe r la k u a n se la m a 3 0 h a r i da n pe m be r ia n N a2Ca ED TA y a n g dila n j u t k a n e k st r a k
e t a n ol u m bi ba w a n g pu t ih da n e k st r a k e t a n ol r im pa n g t e m u la w a k se la m a 5 h a r i ( Y= 2 ,0 9 7 8 .1 0- 3X - 7 ,0 0 5 2 .1 0- 4; r = 0 ,9 9 7 8 5 )
Ga m ba r 9 . Ku r v a ba k u pe n gu k u r a n la r u t a n t im ba l h a r i k e - 4 0 se t e la h k on disi pr a pe r la k u a n se la m a 3 0 h a r i da n pe m be r ia n N a2Ca ED TA y a n g dila n j u t k a n e k st r a k e t a n ol u m bi ba w a n g pu t ih da n e k st r a k e t a n ol r im pa n g t e m u la w a k se la m a 1 0 h a r i
( Y= 2 ,5 0 8 7 .1 0- 3X - 9 ,0 0 7 7 .1 0- 4; r = 0 ,9 9 8 8 3 )
Dari table IV dapat dilihat bahwa setiap kali penentuan kurva baku diperoleh harga koefisien korelasi yang mendekati satu, hal ini menunjukkan adanya hubungan linier antara kadar timbal dengan absorbansi, dengan demikian syarat linearitas dari suatu metode analisis telah terpenuhi.
Ta be l I V . N ila i lin e a r it a s k u r v a ba k u t im ba l h a sil pe n gu k u r a n de n ga n m e t ode spe k t r om e t r i se r a pa n a t om
Kurva baku timbal Linearitas (r) Hari ke-0 0,99903 Hari ke-15 0,99973 Hari ke-30 0,99785 Hari ke-35 0,99785 Hari ke-40 0,99883
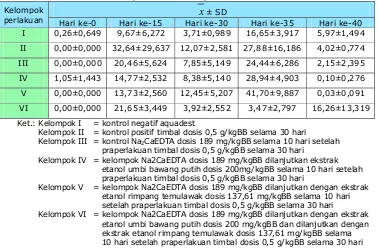
baik. Hal ini dimungkinkan karena adanya variasi sistem metabolisme hewan uji, yang mengakibatkan kadar timbal di dalam darah menjadi bervariasi juga.
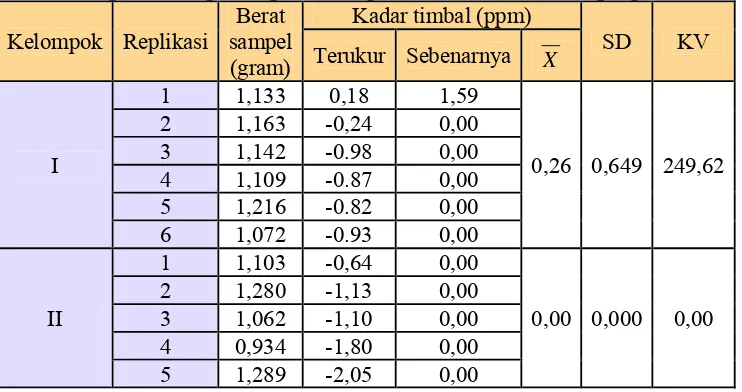
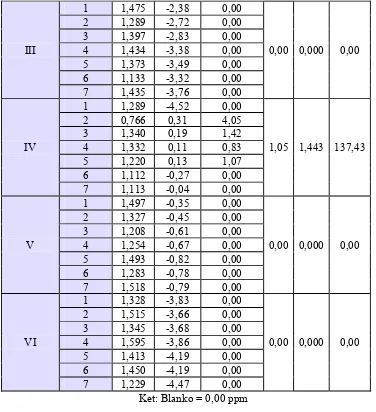
Selain itu, juga tidak dilakukan penentuan LOQ, LOD dan rentang, melainkan hanya dilakukan optimasi dan kalibrasi alat (spektrometer serapan atom) yang digunakan (lampiran 2). Kalibrasi alat dilakukan oleh LPPT Unit I UGM setiap satu tahun sekali, yaitu setiap bulan Agustus, sedangkan optimasi alat dilakukan setiap kali akan dilakukan pengukuran menggunakan spektrometer serapan atom. Selain itu, penelitian ini juga menggunakan metode acak (random) dalam pemilihan sampel, adanya kelompok kontrol dan kelompok perlakuan, serta kontrol penangan hewan uji. Kesahihan data berdasarkan linearitas kurva baku yang diperoleh dan nilai koefisien variasi (KV) perlakuan terhadap kontrol.
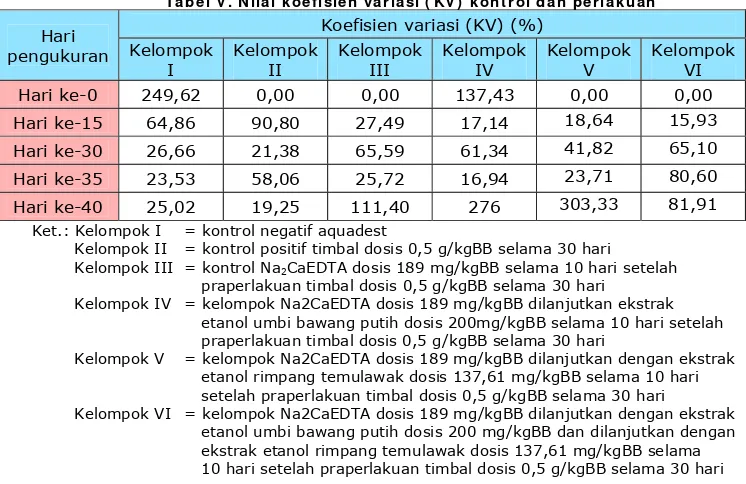
Ta be l V . N ila i k oe fisie n v a r ia si ( KV) k on t r ol da n pe r la k u a n
Hari pengukuran
Koefisien variasi (KV) (%) Kelompok
Ket.: Kelompok I = kontrol negatif aquadest
Kelompok II = kontrol positif timbal dosis 0,5 g/kgBB selama 30 hari Kelompok III = kontrol Na2CaEDTA dosis 189 mg/kgBB selama 10 hari setelah
praperlakuan timbal dosis 0,5 g/kgBB selama 30 hari
Kelompok IV = kelompok Na2CaEDTA dosis 189 mg/kgBB dilanjutkan ekstrak etanol umbi bawang putih dosis 200mg/kgBB selama 10 hari setelah praperlakuan timbal dosis 0,5 g/kgBB selama 30 hari
Kelompok V = kelompok Na2CaEDTA dosis 189 mg/kgBB dilanjutkan dengan ekstrak etanol rimpang temulawak dosis 137,61 mg/kgBB selama 10 hari setelah praperlakuan timbal dosis 0,5 g/kgBB selama 30 hari
Kelompok VI = kelompok Na2CaEDTA dosis 189 mg/kgBB dilanjutkan dengan ekstrak etanol umbi bawang putih dosis 200 mg/kgBB dan dilanjutkan dengan ekstrak etanol rimpang temulawak dosis 137,61 mg/kgBB selama 10 hari setelah praperlakuan timbal dosis 0,5 g/kgBB selama 30 hari