BAB 2
TINJAUAN PUSTAKA
2.1. MENINGIOMA
2.1.1. Sejarah Dan Definisi Meningioma
Pada tahun 1922, Harvey Cushing memaparkan 85 kasus meningeal tumor pada kuliahnya dan Cushing memberikan istilah meningioma untuk menjelaskan lesi tersebut.
Beberapa tahun kemudian Louise Eisenhardt menciptakan monograf tentang tumor ini (Igaki, 2009 dan Nakamura, 2003) Dia menyebutkan bahwa semua tumor yang berasal dari arachnoidal cap cells tergabung dalam arachnoid granulations (Al-Rodhan, 1991).
Pada awalnya tumor ini dinamakan tumor fungoid, sarcoma, cylindroma, endothelioma, fibroma, meningoethelioma, arachnothelioma, meningocytoma, mesothelioma, leptomeningioma, dural exothelioma, arachnoidal fibroblastoma, dan pada akhirnya dinamakan meningioma (Chou, 1991).
Jadi meningioma intrakranial merupakan tumor jinak ekstra-aksial atau tumor yang terjadi di luar jaringan parenkim otak yaitu berasal dari meningens otak dan tumbuh dari sel-sel arachnoid cap dengan pertumbuhan yang lambat (Al-Hadidy, 2007).
Meningioma tidak hanya dijumpai pada intrakranial tetapi dapat juga dijumpai pada medulla spinalis, disebut juga spinal meningioma. Spinal meningioma sering dijumpai pada wanita paruh baya. Rasio wanita berbanding pria tidak jauh yaitu 3:4. Spinal meningioma sering terjadi pada wanita disebabkan adanya kaitan dengan sex hormone. Meskipun pengaruh sex hormone pada meningioma masih kontroversi, hingga saat ini banyak ditemukan reseptor sex hormone pada meningioma (Haugsten, 2010).
2.1.2. Epidemiologi Meningioma Intrakranial
Meningioma intrakranial menduduki 15% hingga 20% dari keseluruhan tumor intrakranial primer, namun insiden pada skrining rutin sekitar 1 dalam 100 populasi. Insidensi meningkat dengan pertambahan usia. Lebih sering dijumpai pada wanita dengan perbandingan pria:wanita sama dengan 1:2,5. Perbedaan ini semakin meningkat pada
meningioma intraspinal, dengan rasio 1:10. Jarang dijumpai pada anak, namun jika ada, cenderung agresif (Landriel, 2012).
intrakranial anak lebih cenderung terjadi pada anak laki-laki dibandingkan anak perempuan, dengan rasio 1,2-1,9:1 dan paling sering dijumpai pada ventrikuler (Landriel, 2012).
Beberapa penelitian melaporkan bahwa insiden meningioma intrakranial pada ras hitam Non-hispanics sedikit lebih tinggi dibandingkan dengan ras putih Non-Hispanics dan Hispanics. Jenis kelamin juga memengaruhi prevalensi dari meningioma intrakranial, yaitu dua kali lebih tinggi pada wanita dibandingkan dengan pria (Wiemels, 2010 dan Rockhill, 2007).
2.1.3. Patologi Meningioma Intrakranial
Meningioma intrakranial merupakan neoplasma yang tumbuh lambat dan berasal dari sel meningotelial yang ditemukan dalam granulasi arachnoid. Terkonsentrasi mayoritas pada dinding sinus vena, struktur ini, mengandung arachnoid cap cell (Al-Mefty, 2011). Kelompok-kelompok arachnoid cap cell akan menjadi lebih jelas, membentuk whorls dan psammoma bodies identik dengan yang ditemukan pada meningioma intrakranial (Marwin, 2010).
Secara makroskopis meningioma intrakranial merupakan tumor yang memiliki batas tegas, permukaan yang halus dan melekat pada duramater. Falx meningioma atau tentorial meningioma dapat berbentuk bilobus, dumbbell shape. Pada meningioma ganas, tumor terpisah dengan jaringan otak atau medula spinalis, dan dijumpai bagian-bagian yang nekrosis serta mudah berdarah. Meningioma intrakranial yang jarang dijumpai ialah en plaque meningioma, suatu meningioma yang melekat dan menutupi dura dalam bentuk yang datar dan menyerupai karpet. Varian ini sering disertai dengan hiperostosis pada tulang yang ditempel, sering berada pada sphenoid ridge atau dalam sinus cavernosus. Kebanyakan meningioma intrakranial menekan dan masuk ke dalam jaringan otak tanpa adanya invasi ke jaringan otak (Scheithauer, 2010).
Struktur jaringan bervariasi, mulai dari lembut bergelatin hingga keras dan berkalsifikasi. Jika dilakukan pemotongan, permukaan yang terpotong akan tampak translucent dan pucat keabuan atau homogen merah kecoklatan pada tumor dengan
2.1.4. Klasifikasi Meningioma Intrakranial
Meningioma intrakranial dapat diklasifikan berdasarkan histopatologi, lokasi tumor, serta pola pertumbuhan tumor.
2.1.4.1. Klasifikasi Meningioma Berdasarkan Histopatologi
Pembagian meningioma secara histopatologi telah ditentukan oleh WHO pada tahun 2007 menjadi 3 grade, yaitu Jinak (Benign :Grade I), Atipikal (Atypical : Grade II), dan
Ganas (Malignant : Grade III). Menurut histopatologinya, meningioma grade I diklasifikasikan sebagai meningioma meningothelial, meningioma fibrous (fibroblastik), meningioma transisional, meningioma psammomatous, meningioma angiomatosa, meningioma mikrokistik, meningioma sekretorik, meningioma lymphoplasmacyte-rich; Meningioma grade II diklasifikasikan sebagai meningioma chordoid, meningioma clear-cell, meningioma atypical; Meningioma grade III diklasifikasikan sebagai meningioma papillary, meningioma rhabdoid, meningioma anaplastik (Marwin, 2010).
Tabel 2.1. Subtipe meningioma dan Grade menurut klasifikasi WHO (Marwin et al, 2010).
Subtipe histologi Grade WHO
Papillary meningioma
2.1.4.2. Klasifikasi Meningioma Berdasarkan Lokasi
Berdasarkan lokasi tumor, meningioma dapat berada di konveksitas, parasagital, tuberkulum sella, falx, sphenoid ridge, CPA, frontal base, petroclival, fosa posterior, tentorial, middle fossa, foramen magnum, dan lainnya (Otsuka, 2010).
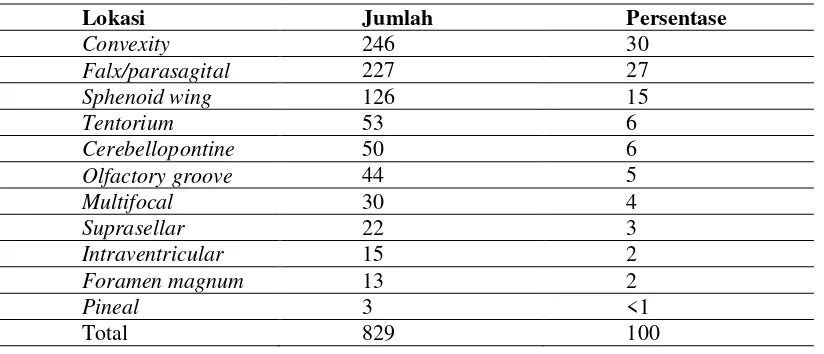
Lokasi umum meningioma primer dalam urutan paling sering adalah parasagital, cavernous, tubercullum sellae, lamina cribrosa, foramen magnum, zona torcular, tentorium cerebelli, sudut serebelopontin, dan sinus sigmoid. Meningioma dengan frekuensi lebih rendah dapat terjadi di medula spinalis, intraventrikular, orbita (optic nerve sheath dan foramina opticum), intraoseus (tulang temporal petrosa), pineal, ekstracalvaria, dan ektopik (cavum nasi, sinus paranasal, glandula parotis, paru-paru, glandula adrenal, dan mediastinum (Chou, 1991).
Tabel 2.2. Lokasi Tumor Meningioma (Otsuka, 2010).
Lokasi Jumlah Persentase
Convexity 246 30
Falx/parasagital 227 27
Sphenoid wing 126 15
Intraventricular 15 2
Foramen magnum 13 2
Pineal 3 <1
Total 829 100
2.1.4.3. Klasifikasi Meningioma Berdasarkan Pola Pertumbuhan
berbentuk seperti karpet dengan adanya abnormalitas tulang, sedangkan meningioma en masse didefinisikan sebagai bentuk antara dari en masse klasik dan meningioma invading en plaque dengan perlekatan dura yang luas tetapi tanpa tampilan seperti karpet (Talacchi, 2011).
2.1.5. Karakteristik dan Diagnostik Meningioma Intrakranial
Secara umum, penampilan karakteristik dan diagnostik dari meningioma intrakranial
adalah batas yang tegas dan perlekatan fokal pada dura. Tumor ini biasanya berbentuk globular, berkapsul, dan memiliki proyeksi pertumbuhan ke arah dalam, menekan tetapi tidak menginvasi parenkim kecuali dalam bentuk maligna, terkadang menginvasi dura dan sinus. Jika meningioma intrakranial segar dipotong akan tampak pucat dan semi transparan atau homogen dan berwana coklat kemerahan tergantung dari derajat vaskularisasinya. Pola kumparan (whorl) biasanya akan tampak pada permukaan potongan setelah dilakukan fiksasi. Konsistensi berpasir adalah tampilan umum yang dihubungkan dengan adanya badan psammoma. Jaringan pembuluh darah yang kasar dapat tampak pada varian meningioma angiomatosa (Chou, 1991).
2.1.6. Prognosis
Prognosis dari meningioma intrakranial memiliki perbedaan pada setiap klasifikasi atau derajat meningioma. Invasi parenkim otak jelas akan mempengaruhi prognosis. Lokasi anatomis akan mempengaruhi laju rekurensi. Tumor-tumor yang berada pada posisi yang sulit akan menimbulkan kesulitan dalam total removal dari tumor, seperti pada ala sphenoidalis. Meningioma intrakranial yang menginvasi sinus, seperti pada meningioma parasagittal, memiliki rekurensi yang tinggi (Al-Mefty, 2011).
Walaupun meningioma intrakranial yang berbatas tegas dapat diangkat secara keseluruhan, meningioma intrakranial dengan ekstensi yang pipih pada ruang subdural (10% meningioma) akan sulit untuk direseksi seluruhnya, seperti pada meningioma en plaque. Rekurensi juga kerap terjadi pada meningioma intrakranial yang memiliki profil ganas, seperti pola hemangiopericytic atau papiler. Kriteria selular keganasan adalah adanya mitosis,
meningkatnya selularitas, polimorfisme inti sel, dan nekrosis fokal. Indeks mitosis yang tinggi juga salah satu aspek yang mengarah pada keganasan (Al-Mefty, 2011).
Hubungan antara hormon dan meningioma telah dibuktikan oleh beberapa penelitian, termasuk data meningkatnya penderita tumor ini pada wanita dibandingkan pada pria (2:1). Dijumpai adanya estrogen, progesteron, dan reseptor androgen pada beberapa meningioma, adanya hubungan antara kanker payudara dengan risiko meningioma, perubahan ukuran meningioma yang semakin membesar pada fase luteal dari siklus menstruasi dan siklus kehamilan, dan adanya proliferasi in vitro pada sel meningioma yang di kultur setelah terpapar dengan estrogen, merupakan bukti bahwa meningioma dipengaruhi oleh hormon
(Fisher, 2007 dan Wrensch, 2002). Sebuah penelitian pada 31 sampel meningioma melaporkan munculnya ekspresi gen lebih kuat berkaitan dengan adanya reseptor progesteron dibandingkan dengan reseptor estrogen (McCarthy, 1998). Penelitian-penelitian pada paparan hormon endogen memperlihatkan bahwa risiko meningioma berhubungan dengan status menopause, paritas, dan usia pertama saat menstruasi. Namun, hal-hal ini masih menjadi kontroversi (Wiemels, 2010 dan Taghipour, 2007).
2.1.7.2. Growth Factor
Growth factor merupakan senyawa – senyawa protein yang memiliki peranan penting dalam pertumbuhan dan proliferasi sel. Sebuah penemuan terkini dalam bidang onkologi bahwa Platelet Derived Growth Factor (PDGF) merupakan sebuah produk onkogen yang menstimulasi pertumbuhan (Krisch,1997). Beberapa growth factor yang mempengaruhi pertumbuhan meningioma ialah Platelet Derived Growth Factor (PDGF), Epidermal Grotwh Factor (EGF), Vascular Endothelial Growth Factor (VEGF), dan Fibroblast Growth Factor (FGF) (Krisch,1997).
Platelet Derived Growth Factor (PDGF) mampu menstimulasi proliferasi dan sintesis DNA pada kultur meningioma manusia melalui sebuah mekanisme yang melibatkan oncogene c-fos (Weisman,1986). PDGF dihasilkan oleh meningioma dan paparan terhadap protein yang menstimulasi sintesis DNA (Wang, 1986). Penelitian lain menunjukkan bahwa PDGF merupakan komponen dari suatu media yang dihasilkan dari kultur meningioma dan dapat menstimulasi pertumbuhan meningioma (Todo,1996)
Epidermal Grotwh Factor (EGF) diekspresikan secara luas pada meningioma
Vascular Endothelial Growth Factor (VEGF) disekresikan oleh meningioma, dan dua reseptor utama dari VEGF telah ditemukan pada vaskularisasi tumor meningioma (Ragel, 2003). VEGF sangat mempengaruhi edema pada peritumoral meningioma dan angiogenesis. Beberapa penelitian menemukan adanya korelasi peritumoral edema dengan ekspresi VEGF dengan transkripsi mRNA (Ragel, 2003). Hubungan antara ekspresi VEGF dan derajat histopatologi meningioma masih kontroversi, beberapa penelitian melaporkan ada nya hubungan, namun penelitian lainnya melaporkan tidak dijumpai hubungan yang positif
(Ragel, 2003).
Fibroblast Growth Factor (FGF) dan Fibroblast Growth Factor Receptors merupakan protein yang dijumpai pada semua meningioma. Dari beberapa penelitian FGF dilaporkan menstimulasi proliperasi sel dan sintesis DNA pada kultur meningioma manusia (Abe,1994). Selain itu FGF juga mempunyai efek angiogenesis dan mitogenesis dalam proses tumorigenesis meningioma. Penelitian – penelitian imunohistokimia telah menunjukkan adanya FGF dan FGF-R pada sel meningioma manusia (Ragel,2008). Hingga saat ini dua puluh jenis FGFs telah ditemukan, dan dinamakan dengan FGF-1 hingga FGF-20. Baru – baru ini, beberapa penelitian menyatakan overekspresi dari FGF-2 pada sel dapat menyebabkan aktivasi dari FGF-2 terus menerus. Menariknya, inhibisi dari FGF-2 signaling pada sel menginduksi apoptosis. Oleh karena itu FGF-2 signaling yang terus menerus diproduksi sebagai akibat dari overekspresi menyebabkan adanya proteksi terhadap apoptosis, dan dapat memicu terjadinnya tumor (Chin, 2006).
2.2. FIBROBLAST GROWTH FACTOR 2
2.2.1. Sejarah dan Struktur FibroblastGrowthFactor 2
Ketika protein disintesis oleh suatu sel, protein tersebut dapat berdifusi ke daerah di sekitarnya dan menginduksi perubahan dari sel di sekitarnya, hal ini disebut sebagai interaksi parakrin, dan protein yang berdifusi tersebut dikenal sebagai faktor parakrin atau Growth and Differentiation Factors (GDFs). Faktor parakrin ini dapat dikelompokkan menjadi empat kelompok besar berdasarkan strukturnya. Kelompok tersebut ialah: Fibroblast Growth Factor (FGF) family, Hedgehog family, Wingless family, dan TGF-ß superfamily (Abnova 2014).
Kelompok FGF memiliki struktur yang sangat banyak. FGF-1 juga dikenal sebagai acidic FGF; FGF-2 dikenal dengan basic FGF, dan FGF7 kadang disebut sebagai keratinocyte growth factor (Abnova 2014).
ekspresi bFGF terdeteksi pada neoplasma intrakranial seperti glioma, dan berhubungan dengan derajat keganasan neoplasma intrakranial serta angiogenesis (Wei,2004)
Hingga saat ini dua puluh jenis FGFs telah ditemukan, dan dinamakan dengan FGF-1 hingga FGF-20, pembagian dapat dlihat pada tabel di bawah ini. Penamaan yang berbeda ini berdasarkan pada perbedaan aktivitas biologi dari masing – masing FGFs dan tidak semua FGF ini memiliki aktivitas stimulasi. Fibroblast Growth Factor yang tidak memiliki efek stimulasi ini tetap dikategorikan sebagai famili FGF dikarenakan bentuk struktur yang sama
(Wei,2004).
Tabel.2.3. Pembagian Fibroblast Growth Factor (Wei,2004)
FGF-2 disebut juga basic FGF. FGF-2 berukuran 18kDa dan sekitar 55%
Saat ini dijumpai empat jenis FGF-2, pembagian ini didasarkan kepada berat molekul FGF-2 yang terdiri dari; 18kDa, 22.5-, 23.1-, dan 24.2-kDa. FGF dengan berat molekul
18-kDa merupakan hasil translasi inisiasi start codon 5’AUG. Sementara lainnya merupakan hasil translasi dari upstream codon, CUG. Oleh karena itu bentuk FGFs dengan berat molekul yang lebih besar merupakan co-linear amino-terminal extensions dari bentuk 18-kDa. Hal ini serupa dengan myc proto-oncogene, yang juga dapat menggunakan alternate non-AUG codon untuk inisiasi translasi (Bikfalvi, 1997).
FGF-2 memiliki empat residu sistein pada asam amino 26, 70, 88, dan 93. Mutasi dari empat sistein ini menjadi senyawa serine menghasilkan protein dengan struktur sekunder dan memiliki kemampuan mitogenik sama dengan sel 3T3 dan dikenal sebagai wild-type FGF-2. FGF-2 juga merupakan substrat untuk posforilasi oleh protein kinase C (PKC) dan protein kinase A (PKA). PKC memposforilasi FGF-2 pada Ser64; namun hal ini tidak memiliki aktivitas biologi, ataupun kapasitas mengikat reseptor. Namun, PKA memposforilasi FGF-2 pada Thr112 pada domain reseptor FGF, dan menghasilkan ikatan yang lebih kuat 3-8 kali lipat (Denizot, 2006).
Selama masa perkembangan embriologi, FGF-2 memiliki peranan dalam mengatur proliferasi sel. Pada organisme dewasa, FGF-2 merupakan faktor homeostatik dan berfungsi untuk memperbaiki jaringan dan respon cedera. Jika FGF-2 salah diekspresikan, beberapa senyawa FGF-2 menyebabkan pertumbuhan kanker.
2.2.3. FGF-2 Signaling Pada Kanker
Pada lingkungan ekstraseluler FGFs akan berikatan dengan reseptor sel di permukaan
sel dan mengaktifkan kaskade transduksi sinyal. Sinyal tersebut kemudian mengaktifkan berbagai variasi program genetik melalui regulasi faktor-faktor transkripsi, menstimulasi pertumbuhan sel dengan memicu progersi siklus sel dan menginhibisi pathway kematian sel. Semua komponen dari pathway ini, mulai dari FGFs hingga faktor transkripsi merupakan onkoprotein yang potensial. Oleh karena itu, hilangnya regulasi pada tahap mana saja dapat memicu komponen downstream dan menyebabkan pertumbuhan sel tidak terkontrol dan menjadi neoplasma (Haughsten, 2010).
2.2.4. Program Genetika Pertumbuhan Tumor
FGF-2 mungkin mengaktivasi program genetika yang merangsang pertumbuhan sel dengan tiga mekanisme: pertama sebagai mitogen terhadap sel tumor itu sendiri, kedua dengan merangsang angiogenesis untuk suplai pertumbuhan tumor, dan ketiga dengan menginhibisi apoptosis dan membiarkan sel tumor untuk tumbuh diatas normal (Haughsten, 2010).
2.2.4.1. FGF-2 Sebagai Faktor Mitogenic
FGF-1 dan FGF-2 awalnya diidentifikasi berdasarkan kemampuan utnuk menstimulasi [3H]thymidine 3T3 fibroblast dan dianggap sebagai faktor mitogen yang kuat. Bagaimanapun juga sangat penting untuk membedakan konsep antara penambahan agen eksogen yang menghasilkan protein dengan konsep overexpresi dari gen itu sendiri. Sementara itu, FGF-1 dan FGF-2 merupakan patogen mitogen dengan sendirinya,
overekspresi FGF-1 dan FGF-2 cDNAs hanya dijumpai pada fibroblast yang sedang bermutasi. Hal ini memberikan asumsi bahwa mutasi yang disertai dengan sekresi FGF-1 atau FGF-2 mungkin bersifat onkogenik (Haughsten, 2010).
1 dan 2 dikenal juga sebagai molekul pro-angiogenic, dan 1 dan FGF-2 telah dibuktikan mampu merangsang angiogenesis secara in vivo pada membran korioalantois (Haughsten, 2010).
Angiogenesis diperantarai oleh sejumlah growth factor dan merupakan proses vital untuk pertumbuhan tumor (Denizot, 2006). Vascular endothelial growth factor (VEGF) dan basic fibroblast growth factor (bFGF) merupakan dua angiogenic growth factor potensial yang merangsang stimulasi proliferasi sel endotelial pembuluh darah dan terlibat dalam
angiogenesis neoplasma dari beberapa tumor termasuk meningioma (Sanmoto, 1995 dan Pietsch, 1997).
Angiogenesis terdiri dari beberapa tahap termasuk migrasi, proliferasi, dan tubulogenesis. Tahapan – tahapan ini terintegrasi secara bertahap dan sesuai dengan urutan proses pada tahap intraseluler dan ekstraseluler. FGF-2 berperan dalam kontrol migrasi, proliferasi, dan tubulogenesis. Peranan dan mekanisme aksi dari isoform FGF-2 dalam regulasi fenomena ini telah dipahami (Bikfalvi, 1997).
Angiogenesis tumor diregulasi tidak hanya pada level FGF-2 tetapi juga pada level reseptor. Arbeit telah menganalisa pola ekspresi dari sistem FGF-FGF reseptor dalam multi tahap karsinogenesis menggunakan tikus transgenik. Sementara FGF-1 berperan hanya dalam up-regulasi displasia, FGF-2 berperan pada semua tahap secara simultan. Dari beberapa penelitian didapat sistem reseptor FGF-FGFR memiliki peran signifikan pada semua tahap karsinogenesis dan angiogenesis tumor pada epidermis. Oleh karena itu angiogenesis tumor mungkin dikendalikan juga pada level reseptor. (Arbeit, 1996)
Data klinis juga mendukung peranan FGF-2 dalam angiogensis tumor. Cairan CSF anak dan dewasa dengan tumor otak mengandung aktivitas angiogenik yang identik dengan FGF-2, dan berkorelasi dengan perluasan microvessel intra tumor. Kemudian, kadar FGF-2 juga meningkat pada sampel urin dari penderita tumor otak. Penderita tumor agresif atau tumor ganas memiliki kadar FGF-2 yang lebih tinggi dibandingkan dengan penderita tumor jinak. (Li,1994).
2.2.4.3. FGF-2 Sebagai Faktor Anti Apoptosis
Basic Fibroblast Growth Factor (bFGF) merupakan faktor pertumbuhan dengan fungsi angiogenesis dan proliferasi. Respon biologi dari bFGF timbul oleh adanya ikatan dengan reseptor spesifik pada permukaan sel. Penelitian menunjukkan Basic Fibroblast Growth Factor (bFGF) memiliki peranan penting dalam angiogenesis tumor, invasi, dan proliferasi (Arbeit, 1996).
Fibroblast Growth Factor 2 (FGF)-2 merupakan anggota tertua dari growth family sejak ditemukan pada tahun 1982. Growth Factor ini mampu menstimulasi pertubuhan sel
endotel dan angiogenesis baik secara in vitro atau in vivo, dan telah lama diperkirakan sebagai faktor angiogenesis tumor (Arbeit, 1996).
2.2.5. Peranan FGF-2 dalam Tumorigenesis Meningioma Intrakranial 2.2.5.1. Reseptor Tyrosine Kinase dan Tumor
FGF-2 merupakan keluarga dari reseptor tyrosine kinase (RTK), yang merupakan reseptor single-pass transmembrane dengan extracellular ligand-binding domains dan intracellular tyrosine kinase domain (Haugsten, 2010). Aktivasi dari RTK oleh respective ligands menginduksi aktivasi kinase yang akan menginisiasi intracellular signaling network sehingga proses – proses seluler akan dimulai, seperti proliferasi sel, pertumbuhan, diferensiasi, migrasi, dan survival (Haugsten, 2010). Dengan cara ini RTK memainkan peranan biologi penting selama pertumbuhan dan kehidupan organisme multiseluler. Oleh karena itu, tidak mengherankan jika terjadi deregulasi sejumlah besar RTK dihubungkan dengan berkembangnya berbagai penyakit pada manusia termasuk pembentukan tumor (Haugsten, 2010).
2.2.5.2. Mekanisme Imbalanced FGF-2 Signaling
Deregulasi aktivitas FGF-2 paling sering dikenal sebagai proses onkogen. Beberapa mekanisme dapat menyebabkan FGF-2 signaling yang berlebihan. Pertama, upregulated FGF-2 expression menyebabkan meningkatnya FGF-2 signaling. Kedua, mutasi atau adanya penyusunan ulang pada kode gen FGF-2 dapat menyebabkan meningkatnya jumlah reseptor dan perubahan aktivitas signaling. Ketiga, availibilitas ligand yang mempengaruhi FGF-2
signaling. Selanjutnya, gangguan pada terminasi FGF-2 signaling seperti deregulasi protein inhibisi atau degradasi defective juga dapat meningkatkan FGF-2 signaling (Haugsten, 2010).
Overekspresi dari gen dapat disebabkan oleh adanya amplifikasi atau regulasi transkripsi yang terganggu. Peningkatan kadar FGF-2 telah ditemukan pada beberapa tumor manusia, seperti tumor otak, kepala dan leher, paru, payudara, lambung, dan prostat, serta sarkoma dan multiple myeloma (Chin, 2006)
Baru – baru ini, beberapa penelitian menyatakan overekspresi dari FGF-2 pada sel dapat menyebabkan aktivasi dari FGFR-2 terus menerus. Menariknya, inhibisi dari FGF-2 signaling pada sel menginduksi apoptosis. Oleh karena itu FGF-2 signaling yang terus
menerus diproduksi sebagai akibat dari overekspresi menyebabkan adanya proteksi terhadap apoptosis, dan dapat memicu terjadinya tumor (Chin, 2006).
2.2.5.4. Switching Antara SplicedIsoforms Alternatif
Switching antara spliced isoforms alternatif juga dapat menyebakan gangguan keseimbangan FGF-2 signaling. Beberapa penelitian mengindikasikan potensial onkogen yang berbeda dari berbagai variasi isoform FGF-2. Pergeseran pada splicing isoform dengan kapasitas FGF-binding yang juga bergeser menyebabkan ketidakseimbangan FGF-2 signaling dan memicu pertumbuhan tumor (Cha, 2008).
2.2.5.5. Mutasi FGF-2
Beberapa variasi displasia skeletal pada manusia talah diketahui disebabkan adanya mutasi fungsi germline dari FGF-1 ke FGF-3, dan mekanisme mutasi yang sama juga dijumpai pada berbagai tumor termasuk meningioma intrakranial. Banyak mutasi yang telah teridentifikasi memberikan bentuk reseptor yang lebih aktif. Titik mutasi dijumpai pada domain ekstraseluler dari reseptor dan dapat meningkatkan ligand binding atau ligand specifity. Beberapa mutasi juga telah menginduksi dimerisasi reseptor dan mengaktifkan terus menerus domain reseptor kinase. Mutasi yang teridentifikasi pada domain reseptor kinase menyebabkan peningkatan aktivitas FGF-2. Lebih lagi, gangguan terminasi FGF-2 signaling dapat merupakan akibat dari mutasi domain tersebut (Cha, 2008 dan Ezzat,2002).
2.2.5.6. Fusi Protein FGF-2
Penyusunan ulang kromosom dapat menyebabkan intragenic, reciprocal
2.2.5.7. AvailibilitasLigand
Peningkatan availibilitas ligand mungkin dapat meningkatkan FGF-2 signaling. Keduanya, ekspresi yang tidak tepat dari FGF-2, seperti up regulation dari ekspresi FGF-2 pada sel malignan atau lingkungan di sekitar sel malignan, dan pelepasan FGF-2 dari penyimpanan lokal di matriks ekstraseluler dapat meningkatkan availibiltas ligand (Itoh, 1994).
2.2.5.8. Gangguan Terminasi FGF-2 Signaling
Gangguan down regulation pada aktivitas FGF-2 dapat menyebabkan ketidakseimbangan FGF-2 signaling. Terminasi FGF-2 signaling terjadi melalui proses deposforilasi/posforilasi dan proses endositosis serta degradasi reseptor di lisosom (Cha, 2008 dan Ezzat,2002).