TINJAUAN PUSTAKA
Bakteri Asam Laktat (BAL)
Bakteri asam laktat (BAL) merupakan bakteri gram positif yang berbentuk batang atau bulat, tidak membentuk spora, fermentasi fakultatif anaeorob, tidak mempunyai sitokrom, tidak memiliki kemampuan untuk mereduksi nitrat dan memanfaatkan laktat, oksidasi negatif, katalase negatif, motilitas negatif dan kemampuan memfermentasi glukosa menjadi asam laktat (Carr et al., 2002).
Gambar 1 : Bakteri Asam Laktat
a. Produk Fermentasi BAL dan Manfaatnya sebagai Probiotik
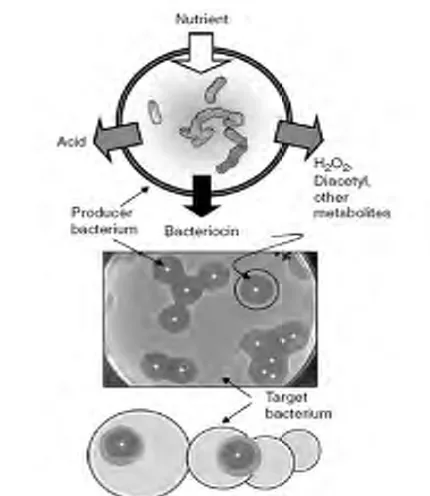
Gambar 2. Produk Fermentasi BAL (Lindgren dan Dobrogosz, 1990)
BAL juga menghasilkan hidrogen peroksida (H2O2) karena adanya oksigen sehingga terjadi reaksi flavoprotein oksidasi atau nicotinamida adenin hidroxy dinucleotida (NADH) perioksida. H2O2 berasal dari oxidation sulfhydril disebabkan karena denaturasi dari sejumlah enzim berasal dari perioksidase membrane lipids sehingga meningkatkan permeabilitas membran (Kong dan Davidson, 1980). H2O2 juga dapat berfungsi sebagai prekusor untuk memproduksi bakteri radikal bebas antara lain O2 dan OH yang dapat merusak DNA (Byczkowski dan Gessner, 1988).
Asetildehida diproduksi oleh L.delbruecki sp dan Bulgaricus yang bila direaksikan dengan threoin aldolase maka treonin tersebut membelah ke dalam asetildehida dan glisin. Ketiga BAL tersebut tidak dapat merombak asetildehida, hanya terakumulasi dalam produk pangan dengan konsentrasi sekitar 25 ppm. Asetildehida dengan konsentrasi 10-100 ppm dapat menghambat pertumbuhan S.aureus, S.typhimurium dan Escherichia coli (Piard dan Desmazeaud, 1992).
Aktivitas lipolitik dan Lactobacillus dan Lactococci secara signitifikan dapat menghasilkan beberapa asam lemak dalam proses pengeringan dan fermentasi susu (Rao dan Reddy, 1984). Aktivitas antimikroba dapat memutuskan ikatan molekul dari asam lemak bukan anionnya, selain itu menurunkan pH memiliki pengaruh besar terhadap aktivitas antimikroba (Kabara, 1993).
b. Reaksi Fermentasi Bakteri Asam Laktat (BAL)
Reaksi fermentasi BAL dibagi menjadi 2 bagian yaitu secara homofermentatif dan heterofermentatif. Reaksi homofermentatif menghasilkan asam laktat, 2 mol ATP dari 1 glukosa/heksosa dalam kondisi normal, tidak menghasilkan CO2 dan menghasilkan biomassa sel dua kali lebih banyak dari pada BAL heterofermentatif. Sedangkan reaksi heterofermentatif selain menghasilkan asam laktat juga menghasilkan etanol, CO2, asam asetat serta 1 mol ATP dari heksosa dan tidak mempunyai enzim aldolase. Untuk lebih jelasnya reaksi fermentasi BAL dapat dilihat di bawah ini.
Reaksi homofermentatif
1 Heksosa + 2 ADP + 2Pi 2 laktat + 2 ATP Reaksi Heterofermentatif
1 Heksosa + 1 ADP + Pi laktat + etanol + CO2 + 1 ATP Atau
Menurut Food and Agriculture Organization/World Health Organization (FAO/WHO) (2001), idealnya strain probiotik seharusnya tidak hanya mampu bertahan melewati saluran pencernaan tetapi juga memiliki kemampuan untuk berkembang biak dalam saluran pencernaan, tahan terhadap cairan lambung dan cairan empedu dalam jalur makanan yang memungkinkan untuk bertahan hidup melintasi saluran pencernaan dan terkena paparan empedu. Selain itu probiotik juga harus mampu menempel pada sel epitel usus, mampu membentuk kolonisasi pada saluran pencernaan, mampu menghasilkan zat anti mikroba (bakteriosin), dan memberikan pengaruh yang menguntungkan inangnya. Syarat lainnya adalah tidak bersifat patogen dan aman jika dikonsumsi. Strain probiotik juga harus tahan dan tetap hidup selama proses pengolahan makanan dan penyimpanan, mudah diaplikasikan pada produk makanan, dan tahan terhadap proses psikokimia pada makanan (Prado et al., 2008).
Efisiensi penggunaan pakan dapat dilakukan dengan pemberian bahan imbuhan (feed additive) atau zat pemacu tumbuh (growth promotant). Pencampuran feed additive ini
dimaksudkan untuk meningkatkan daya simpan ransum dan memacu pertumbuhan ternak. Namun penggunaan feed additif secara terus menerus akan mengakibatkan terdapatnya produk metabolit berupa residu antibiotik. Oleh karena itu penggunaan feed additive alami merupakan alternatif untuk mengurangi akumulasi residu feed additive dalam daging. Salah satu feed additive alami yang mulai digunakan yakni bakteri probiotik (Tensiska, 2008).
mencegah terjadinya gangguan pencernaan terutama pada hewan-hewan muda, pengurai faktor seperti antitripsin (Budiansyah, 2004).
Teknologi Enkapsulasi
Enkapsulasi adalah suatu teknologi dalam proses penyalutan partikel inti dapat berbentuk cair, padat atau gas dengan suatu bahan pengisi khusus sehingga partikel-partikel inti tersebut mempunyai sifat fisik dan kimia sesuai yang dikehendaki (Kim dan Morr, 1996). Teknologi ini berperan dalam melindungi bahan inti dari lingkungan yang merugikan. Bakteri probiotik merupakan salah satu jenis komponen bioaktif yang sebaiknya dilindungi kehidupannya agar dapat dimanfaatkan oleh inangnya. Manfaat enkapsulasi bagi probiotik yaitu untuk mempertahankan viabilitas dan melindunginya dari kerusakan akibat kondisi lingkungan yang tidak menguntungkan (Wu et al. 2000).
Bahan yang umum digunakan sebagai enkapsulan, diantaranya alginat, gum arab, pati, agar, gelatin, karagenan, albumin dan kasein. Masing-masing bahan tersebut memiliki karakter tertentu sehingga perlu adanya pertimbangan agar cocok bila digunakan untuk menyalut suatu bahan inti tertentu. Beberapa peneliti telah melakukan penelitian mengenai enkapsulasi bakteri probiotik dengan menggunakan enkapsulan tertentu diantaranya enkapsulasi Bifidobacteria dan Lactobacillus dalam alginat-pati (Sultana et al. 2000), L. casei dalam alginat-tepung polard dan terigu (Widodo et al. 2003), L.acidophilus dan B. lactis dengan alginat (Kailasapathy 2006), L. acidophilus, L.helveticus, B. longum dan B. lactis dalam alginat, gelatin dan pati pada produk yoghurt dengan metode ekstrusi dan emulsi (Jayalalitha et al. 2011) dan L.plantarum dengan enkapsulan campuran susu skim dan gum arab (Rizqiati et al. 2009). Dalam hal ini, metode enkapsulasi juga dapat
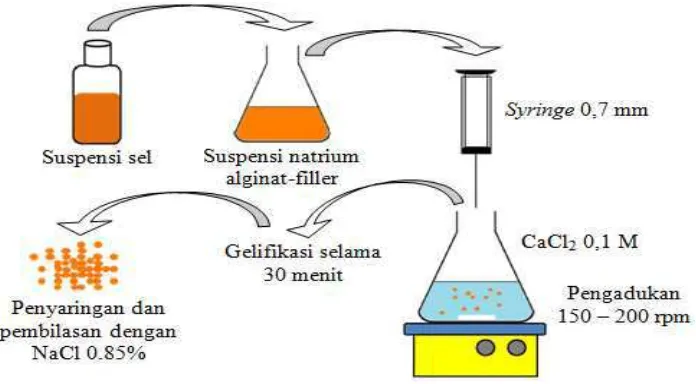
Gambar 3 : Prosedur enkapsulasi dengan metode ekstrusi (Krasaekoopt et al. 2003)
Teknik enkapsulasi probiotik dapat dilakukan dengan dua teknik, yaitu ekstrusi dan emulsi (Krasaekoopt et al. 2003). Teknik ekstrusi dilakukan dengan cara menambahkan mikroorganisme probiotik ke dalam larutan hidrokoloid natrium alginat, kemudian diteteskan ke dalam larutan pengeras (CaCl2) menggunakan syringe sehingga terbentuk beads. Ukuran dan bentuk beads yang dihasilkan bergantung pada diameter jarum dan jarak
tetes jarum dengan larutan CaCl2.
Tabel 1. Kelebihan dan Kekurangan Teknik Ekstrusi dan Emulsi
Ekstrusi Emulsi
Kelayakan teknologi Sulit untuk meningkatkan Mudah untuk meningkatkan skala produksi (scale up) skala produksi (scale up)
Biaya Rendah Tinggi
Kemudahan Mudah Sulit
Ketahanan mikroorganisme 80 – 95% 80 – 95% Ukuran beads 2 – 5 mm 25 μm – 2 mm Sumber : Krasaekoopt et al. (2003)
Pada tahap pengeringan bahan pengkapsul berisi sel probiotik untuk mendapatkan sel terenkapsulasi berbentuk serbuk atau granul dapat dilakukan dengan beberapa teknik, yaitu freezedrying (Sultana et al. 2000, Capela et al. 2006) dan spray drying (Lian et al. 2003, Picot dan Lacroix 2004). Enkapsulasi probiotik dengan teknik pengering semprot dan pengering beku menghasilkan probiotik terenkapsulasi kering dalam bentuk serbuk atau granul, sedangkan teknik emulsi dan ekstrusi menghasilkan probiotik terenkapsulasi dalam bentuk jel (hydrocolloid beads) (Krasaekoopt et al. 2003). Namun, penggunaan teknik freeze drying relatif mahal dan sangat sulit diaplikasikan pada skala industri (Mortazavian et
al. 2007), sedangkan penggunaan teknik spraydrying membutuhkan suhu operasi yang
tinggi sehingga kurang cocok diaplikasikan untuk enkapsulasi probiotik (Kailasapathy 2002).
Bahan Pengkapsul
Bahan pengkapsul merupakan bahan yang berfungsi sebagai pengikat suatu materi serta memperbaiki mutu fisik produk. Enkapsulasi probiotik biasa dilakukan dalam sistem polimer yang bersifat lembut dan tidak beracun (food grade) (Anal dan Singh 2007). Polimer yang biasa digunakan dalam proses enkapsulasi bakteri probiotik adalah polisakarida yang diekstrak dari rumput laut (karagenan dan alginat), tumbuhan (pati dan turunannya, gum arab), atau bakteri (gellan dan xanthan), dan protein hewan (kasein, whey, skim, gelatin) (Rokka dan Rantamaki 2010). Keuntungan penggunaan alginat sebagai bahan pengkapsul adalah tidak toksik, membentuk matriks secara lembut dengan CaCl2 yang dapat menjerap material sensitif seperti sel bakteri probiotik(Kailasapthy, 2002).
1. Alginat
Alginat merupakan salah satu jenis hidrokoloid yang dihasilkan dari ekstraksi alga coklat (Sargassum sp., Turbinaria sp., Hormophyta sp., dan Padinasp.). Alginat telah diaplikasikan secara luas pada produk pangan sebagai penyalut. Bentuk alginat terdiri dari dua yaitu asam alginat dan garam alginat. Asam alginat merupakan kopolimer liniar yang tersusun atas asam D-manuronat dan asam L-guluronat. Dalam suatu larutan, alginat mengadakan interaksi antara kopolimernya dengan kation divalen (garam) seperti kalsium, sehingga terbentuk gel kalsium alginat. Gel tersebut dipengaruhi oleh jumlah kation divalen yang dapat berinteraksi dengan alginat (Nussinovitch, 2010).
(Widodo et al. 2003) sebagai bahan pengisi, chitosan sebagai coating (Krasaekoopt et al. 2004), dan pektin untuk membentuk kompleks alginat-pektin yang kuat (Castilla et al. 2010). Komposisi bahan natrium alginat dapat dilihat pada Tabel 2.
Tabel 2 : Komposisi Natrium Alginat
Spesifikasi Kandungan
Kadar Air (%) 13
Kadar Abu (%) 23
Berat Jenis (%) 1.59
Warna Pink
Desitas Kamba (kg/m3
Suhu Pengabuan (C) 480
) 874
Panas Pembakaran 2.5
Sumber: Food and Agriculture Organization. (2007)
2. Maltodekstrin
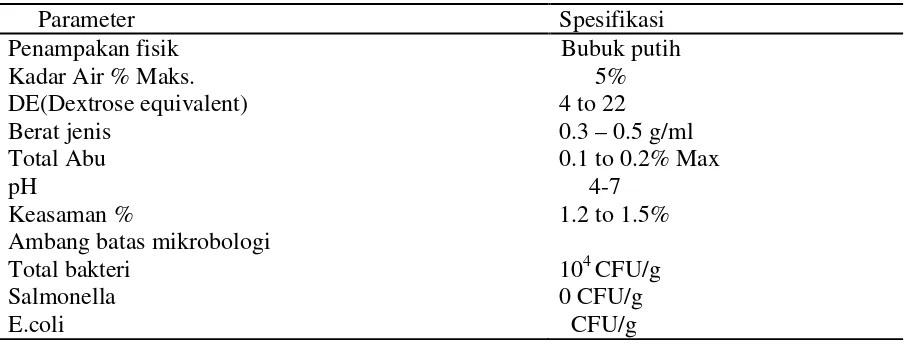
Menurut FDA (The Food and Drug Administration), Maltodekstrin (C6H12O6) adalah polimer sakarida yang bergizi, mengandung unit D-Glukose pada ikatan primer α-1,4 dan memiliki nilai dextrose equivalence (DE) kurang dari 20. Dextrose equivalence (DE) merupakan sifat utama yang menentukan sifat dari maltodekstrin itu sendiri. DE maltodekstrin menunjukkan bahwa bahan tersebut mudah untuk dikeringkan, sedangkan bahan yang memiliki DE lebih besar dari 42 akan sulit untuk dikeringkan dan dipasarkan hanya dalam bentuk sirup (Kenyon, 1995).
Maltodekstrin merupakan bahan yang sering digunakan dalam pembuatan makanan yang dikeringkan karena selain bahan pengisi, maltodekstrin memiliki beberapa kelebihan antara lain tidak manis mudah larut dalam air. Maltodekstrin juga dapat meningkatkan viskositas, menghambat kristalisasi dan baik untuk kesehatan karena rendah kalori. Maltodekstrin biasanya digunakan sebagai campuran bahan pangan dan merupakan pembentuk produk yang baik untuk produk yang sulit kering dan biasanya dijual dalam bentuk tepung padat berwarna putih (Kuntz,1998). Komposisi maltodekstrin pada Tabel 3.
Tabel. 3. Komposisi Maltodekstrin
Parameter Spesifikasi
Penampakan fisik Bubuk putih
Menurut Kenyon dan Anderson (1988), maltodekstrin dan sirup jagung padat memiliki sifat-sifat fungsional yang berpengaruh terhadap proses enkapsulasi, meliputi kestabilan emulsi yang rendah yang dikarenakan tidak memiliki sifat lipofilik dan hidrofilik, sifat pembentukan film, seberapa cepat pembentukan film atau membran pada proses enkapsulasi flavor akan sangat menentukan kualitas produk akhir higroskopisitas.
3. Susu Skim
Protein merupakan komponen yang sangat penting, baik dari segi nutrisi maupun sifat fungsionalnya seperti sebagai bahan pengemulsi, pengikat air atau lemak, serta pembentuk buih atau gel. Selain itu protein juga dapat menghasilkan flavor, memperbaiki penampakan dengan menghasilkan tekstur yang lebih baik (Buckle et al., 1987). Protein memiliki sifat fungsional yang baik seperti viskositas, emulsifikasi serta pembentukan film. Dalam penelitian ini, protein yang digunakan ialah susu skim.
Susu skim adalah bagian susu yang tertinggal setelah krim diambil sebagian atauseluruhnya. Susu skim mengandung semua komponen gizi dari susu kecuali lemak dan vitaminyang larut dalam lemak (Buckle et al. 1987). Karena lemaknya telah dipisahkan, susu skim hanyamengandung 0,5 – 2% lemak (Varnam dan Sutherland 1994).Protein susu dapatdigolongkan menjadi dua bagian, yaitu kasein dan whey. Kasein merupakan fraksi protein yangmenggumpal ketika susu diasamkan pada pH 4,6 pada suhu sekitar 300
Susu skim mengandung semua zat makanan dari susu kecuali lemak dan vitamin-vitamin yang larut dalam lemak. Krim mempunyai berat jenis yang rendah karena banyak mengandung lemak. Susu skim mempunyai berat jenis yang tinggi karena banyak mengandung protein. Susu skim adalah susu sapi yang telah diambil lemaknya dan diubah menjadi bentuk bubuk, mempunyai bentuk seperti granula kecil, dengan warna putih
kekuningan. Susu ini banyak mengandung protein dengan kadar air 5% (Saleh, 2004). Komposisi susu skim dapat dilihat pada Tabel 4.
Tabel 4 : Komposisi Susu Skim
Pada penelitian ini digunakan bakteri indikator E.coli sebagaipengontrol aktivitas hambat bakteriosin yang memiliki daerah zona penghambatan yang luas. E.coliadalahbakterigramnegatif,berbentuk batang, tidak tahan asam, hidup dengan cara
aerob dan anaerob, memilikiflagelaperitrikat,berukuran1,1 - 1,5μmx26μm,tersusuntunggalatauberpasangan,bersifatmotilatau nonmotildan banyakgalurnyayangmemilikikapsuldanmikrokapsul dan sebagian spesiesnya menyebabkan penyakit pada saluran pencernaan. Beberapagalurnyamerupakanpatogen terhadap manusia dan hewan.E.colimempunyaitiperespirasi danfermentasidengansuhuoptimum37ºC dan pH optimum7 (Drasar dan Borrow, 1985).
Pada ayam broiler, infeksi dari bakteri E.coli ini berdampak sangat buruk. Penyakit ini dapat menyebabkan kematian selama periode pemeliharaan hingga perolehan berat badan ayam saat panen akan dibawah standar. Bakteri E.coli ini sangat banyak terdapat di usus, dan akan dikeluarkan dari tubuh dalam jumlah yang sangat besar bersama feses (kotoran). Bakteri ini dapat bertahan sampai beberapa minggu di dalam feses, dengan kondisi yang sangat mendukung. Akan tetapi, E.coli tidak tahan pada kondisi asam, kering, dan akan mati dengan desinfektan (Pierard et al., 1990).
E.coliyang merupakan infeksi bakteri yang paling umum dijumpai pada peternakan
broileryang dikenal dengan penyakit kolibasilosis. Infeksi E.colipada unggas umumnya bersifat sistemik dan menimbulkan bakteriemia (Costa et al., 2002). Infeksi E.colimenyebabkan kematian embrio pada telur tetas, infeksi kuning telur, koliseptisemia,
Bakteri dalam Saluran Pencernaan
Lebih dari 99% bakteri tinggal di dalam usus besar atau colon dan lebih dari 99% berupa bakteri anaerob mutlak diantaranya adalah Clostridium, Bacterioides, Bifidobacterium dan lain-lain. Hanya kurang dari 1% berupa bakteri fakultatif anaerob seperti E.coli, Enterobacter dan bakteri patogen lainnya. Dengan demikian diperlukan adanya efek antagonis terhadap bakteri patogen (Surono, 2004).
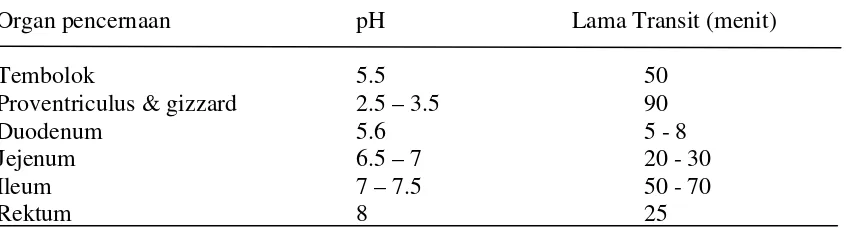
Lebih lanjut Surono (2004) menyatakan bahwa berbagai rintangan yang harus dihadapi mikroba dalam saluran pencernaan dari mulut sampai anus. Pada perjalannya melintasi berbagai sistem pencernaan khususnya yang dijumpai diantaranya enzim lisosom pada air liur, asam lambung, garam empedu dan senyawa metabolit oleh BAL terutama asam laktat. Pada usus besar hampir tidak ditemukan lagi hambatan yang cukup berarti kecuali terjadinya kompetisi terhadap nutrisi. Bakteri probiotik harus mampu bertahan menghadapi rintangan-rintangan tersebut, agar mencapai usus dalam keadaan hidup dalam jumlah yang cukup memadai untuk berkembangbiak dalam menyeimbangkan mikrobiota usus. Untuk mengetahui pH dan waktu transit dapat dilihat pada Tabel 5.
Tabel 5: Derajat Keasaman (pH) di dalam Saluran Pencernaan Ayam
Organ pencernaan pH Lama Transit (menit)
Tembolok 5.5 50
Proventriculus & gizzard 2.5 – 3.5 90
Duodenum 5.6 5 - 8
Jejenum 6.5 – 7 20 - 30
Ileum 7 – 7.5 50 - 70
Rektum 8 25
Sumber: Surono (2004)
500 jenis bakteri yang jumlahnya trilyunan (1012 - 1014) bakteri dan BAL sekitar 104 - 109 bakteri. Mikroba dalam saluran pencernaan bisa membantu pencernaan makanan bahkan beberapa jenis menghasilkan beberapa vitamin yang dibutuhkan oleh tubuh, namun demikian beberapa efek negatif yang secara umum adalah dihasilkan senyawa-senyawa hasil pembusukan protein, produksi toksin (Surono, 2004).
Penampilan Ayam Broiler terhadap Probiotik
Saat ini telah beredar produk probiotik yang mengandung mikroba lipolitik, selulolitik, lignolitik, dan mikroba asam lambung. Beberapa penelitian pada broiler menunjukkan bahwa penambahan probiotik dalam ransum dapat meningkatkan pertambahan bobot badan, menurunkan konversi pakan dan mortalitas. Penelitian Kim et al., (1988)
menunjukkan bahwa penambahan probiotik yang terdiri dari Lactobacillus sporegenes ke dalam pakan broiler yang mengandung jagung meningkatkan pertambahan bobot badan.
Probiotik dapat mengubah pergerakan pada populasi mikroba di dalam usus halus ayam, sehingga keberadaannya dapat meningkatkan fungsi dan kesehatan usus, memperbaiki mikroflora pada sekum, serta meningkatkan penyerapan zat makanan (Mountzouris et al., 2010). Probiotik dapat memperbaiki saluran pencernaan dan meningkatkan kecernaan pakan, yaitu dengan cara menekan bakteri patogen dalam saluran pencernaan sehingga mendukung perkembangan bakteri yang menguntungkan yang membantu penyerapan zat-zat makanan (Kompiang et al., 2002).
BAHAN DAN METODE PENELITIAN
Lokasi dan Waktu Penelitian
Penelitian dilaksanakan pada bulan April – November 2014. Penelitian dilaksanakan di Laboratorium Mikrobiologi Nutrisi dan Bahan Pakan Ternak Fakultas Pertanian Universitas Sumatera Utara Medan. Penelitian ini dilakukan atas 3 tahap yaitu isolasi dan karakteristik BAL asal ayam kampung, pembuatan kapsul BAL dan uji kualitasnya, daya simpan kapsul BAL dan pembuatan enkapsulasi BAL dalam bentuk kering.
Metode Penelitian
Tahap I: Isolasi dan Karakteristik BAL Asal Ayam Kampung terhadap Bakteri Uji Bahan dan Alat Penelitian
Bahan yang digunakan dalam penelitian tahap I ini yaitu isolat bakteri asam laktat (BAL) yang telah diisolasi dari usus ayam kampung, bakteri indikator Escherichia coli yang diisolasi dari feses ayam, media yang digunakan adalah medium selektif MRSA (deMan Rogosa Sharp Agar), deMan Rogosa Sharp Broth (MRSB), Eosin Methylene Blue Agar
(EMBA), Nurient Broth (NB), Nutrient Agar (NA), Muller Hilton Agar (MHA), penicilin, PP 1%, NaOH 0,1N, aquades, NaCl fisiologis 0,85%, kristal violet, iodin, alkohol asam, safranin, HCl, etanol 70%, CaCO3 1%, reagen H2O2 3%, garam empedu sintetik (Ox bile) 1% dan 5%, kertas cakram, alkohol 70%, medium SIM (Sulfid Indol Motility), minyak emersi.
Prosedur Penelitian Tahap I
1. Isolasi dan Karakteristik BAL Asal Ayam Kampung
BAL diisolasi dari berbagai segmen pada saluran pencernaan ayam kampung yaitu pada proventriculus, ventriculus, yeyenum, ileum, usus besar dan cecum. Isolasi dilakukan dengan mensuspensikan 1 gram dari masing-masing saluran pencernaan ayam kampung kedalam 100 ml larutan NaCl 0,85% secara aseptis. Kemudian dibuat pengenceran 10-2 –107. Sebanyak 1 mL hasil pengenceran tadi kemudian diinokulasikan pada medium MRSA (Man Ragosa Sharpe Agar) yang mengandung CaCO3 1 % kemudian diinkubasikan pada suhu 370
Setiap koloni yang terbentuk diamati dan diidentifikasi berdasarkan morfologi, reaksi pengecatan gram, pembentukan gas, pengujian katalase kemudian penamaan taksonomi dilakukan menggunakan Bergey’s manual of Determinative Bacteriology (Buchanan and Gibbons, 1974). Masing-masing koloni yang teridentifikasi ditumbuhkan kembali dalam medium MRSB. Inkubasi pertumbuhan BAL dilakukan pada suhu 37
C selama 48 jam. Koloni yang menunjukkan zona bening disekitar koloni menunjukkan bahwa koloni tersebut adalah bakteri asam laktat (BAL).
o
Koloni yang terpisah dengan bentuk dan ukuran yang berbeda diambil menggunakan jarum ose steril dan digoreskan pada MRSA yang telah beku dan diinkubasi pada kondisi yang sama membentuk goresan kuadran. Penggoresan dilakukan sampai diperoleh koloni yang seragam. Koloni yang murni dipilih, lalu dilakukan pewarnaan gram dan uji katalase.
C selama 48 jam.
2. KarakteristikBAL Berdasarkan Morfologi
coccobacillus) dan penataan bentuk (tunggal, berpasangan, rantai) dilakukan dengan
pengamatan menggunakan mikroskop (Buchanan and Gibbons, 1974). 3. KarakteristikBAL BerdasarkanReaksi Pewarnaan Gram
Prosedur pewarnaan mengikuti metode (Djide dan Sartini, 2008), dalam Trisna (2012), biakan bakteri diambil dari stok dan diratakan diatas preparat yang telah dibersihkan menggunakan etanol 70%. Kemudian difiksasi diatas api bunsen lalu ditetesi dengan zat warna kristal violet selama 1 menit agar zat warna meresap pada bakteri. Preparat kemudian dibilas dengan aquades mengalir dan ditetesi dengan larutan iodine kompleks. Kemudian ditunggu selama 1 menit lalu dibilas dengan aquades mengalir. Preparat dicuci dengan alkohol asam. Kemudian ditetesi dengan zat warna safranin, lalu ditunggu 30 detik. Setelah itu dikeringkan dan diperiksa dibawah mikroskop dengan menggunakan minyak imersi.
4. Karakteristik BAL Berdasarkan Uji Motilitas
Sebanyak 1 ose isolat diambil dari stok kemudian diinokulasikan dengan cara ditusuk pada medium SIM tegak. Selanjutnya diinkubasi pada temperatur 370C selama 48 jam. Hasil positif (motil) jika terdapat rambatan – rambatan disekitar bekas tusukan jarum pada medium dan hasil negatif (non motil) bila tidak terdapat rambatan-rambatan disekitar bekas tusukan jarum ose pada medium.
5. Karakteristik BAL Berdasarkan Uji Katalase
6. Uji Ketahanan BAL terhadap Keasaman Lambung (pH), Garam Empedu dan Suhu a. Uji Ketahanan terhadap Keasaman Lambung (pH)
Menurut Djide dan Wahyuddin (2008), uji ketahanan terhadap asam dilakukan dengan menggunakan medium MRSB yang ditambahkan dengan HCl 0,1 N untuk mendapatkan pH 2,5 dan 3 (sesuai dengan pH lambung). Sebanyak 1 ose (ose bulat) masing-masing isolat bakteri yang diambil dari stok kultur kemudian diinokulasikan pada medium MRSB-HCl. Diinkubasi selama 48 jam pada suhu 370
b. Uji Ketahanan terhadap Garam Empedu
C. Hasil positif apabila terjadi pertumbuhan bakteri pada medium dan hasil negatif apabila tidak terjadi pertumbuhan bakteri pada medium.
Ketahanan isolat mikroba terhadap garam empedu digunakan untuk mengkaji kemampuan isolat bertahan pada saluran pencernaan yang terdapat garam empedu pada permukaan atas usus. Pengujian dilakukan menurut metode Djide dan Wahyuddin (2008). Metode ini dilakukan dengan menambahkan garam empedu sintetik (oxbile) dengan konsentrasi 1 % dan 5 % pada medium MRSB. Selanjutnya isolat bakteri diambil dari stok sebanyak 1 ose kemudian diinokulasikan pada medium MRSB – garam empedu. Diinkubasi selama 48 jam dengan temperatur 370
c. Uji Ketahanan terhadap Suhu
C. Ketahanan terhadap garam empedu ditentukan berdasarkan ada tidaknya pertumbuhan bakteri pada medium. Hasil positif jika ditandai dengan adanya endapan pada dasar tabung dan adanya perubahan media menjadi lebih keruh dibandingkan sebelum diinkubasi.
7. Penentuan Jumlah Koloni BAL
Jumlah koloni BAL dari isolat diukur menggunakan metode Total Plate Count (TPC) (Fardiaz, 1992). Sebanyak 1 g isolat hasil sentrifugassi dimasukkan ke petri dalam 9 ml NaCl fisiologis 0.85%, lalu diencerkan sampai pengenceran 7 kali secara serial. Sebanyak 0,1 ml dari pengenceran 6 dan 7 kali ditanam pada cawan petri berisi media MRS agar. Media agar yang ditanam kemudian diinkubasi pada suhu ruang selama 48 jam. Koloni yang tumbuh berbentuk bulat miring berwarna agak kekuningan. Kemudian dihitung sebagai beirikut:
Populasi BAL (cfu/g) = Jumlah koloni X Pengenceran
8. Uji Daya Hambat BAL terhadap Bakteri E.coli
a. Isolasi Bakteri Uji E.coli
b. Uji Daya Hambat BAL terhadap E.coli
Untuk mengetahui bahwa isolat bakteri mempunyai potensi yang bagus sebagai bakteri BAL maka perlu dilakukan uji daya hambat terhadap bakteri patogen. Bakteri patogen yang digunakan adalah E.coli (bakteri gram negatif).Untuk perlakuan kontrol positif digunakan kertas cakram yang telah berisi antibiotika amoksilin, karena kloramfenikol memiliki sensitivitas yang sangat tinggi, dimana pada dosis 30 μg/kertas cakram mampu
menghasilkan diameter zona hambat sebesar 25-31 mm (Fardiaz, 1992).
9. Pengukuran Total Asam Tertitrasi
Pengukuran total asam tertitrasi dilakukan dengan prinsip titrasi asam basa. Sebanyak 10 ml filtrat dari sampel dimasukkan ke dalam labu erlenmeyer lalu ditambahkan 3 tetes larutan indikator fenolftalein 1%, selanjutnya dititrasi dengan larutan NaOH 0.1 N hingga terbentuk warna merah muda. Tepat saat warna merah muda terbentuk, titrasi dihentikan. Total asam tertitrasi dinyatakan sebagai persen asam laktat. Total asam dapat diperoleh melalui perhitungan berikut.
% Asam laktat = V NaOH X V NaOH X FP X BM Asam Laktat X 100% Bobot Sampel X 1000
Keterangan: BM asam laktat = 90.08
Tahap II : Pembuatan Kapsul BAL dan Uji Kualitasnya
Tujuan tahap ini adalah menentukan komposisi bahan enkapsulasi (biopolimer) yang tepat untuk mengenkapsulasi BAL dengan teknik ekstrusi. Enkapsulasi yang digunakan adalah natrium alginat, maltodeksttri dan skim. Maltodekstrin dan skim digunakan sebagai bahan pengisi. Tahap ini terdiri atas beberapa kegiatan yaitu: penentuan total padatan bahan pengkapsul, penentuan perbandingan natrium alginat dengan bahan pengisi optimum serta pengujian viabilitas, efisiensi dan jumlah populasi BAL terenkapsulasi serta pembuatan BAL enkapsulasi dalam bentuk kering.
Bahan dan Alat Penelitian
Bahan yang digunakan dalam penelitian penelitian ini adalah BAL, natrium alginat, CaCl2 0,1M, NaCl 0,85%, alkohol 70%, aquadest, susu skim, maltodekstrin, MRSB, MRSA.
1. Penentuan Total Padatan Bahan Pengkapsul
Kegiatan ini dilakukan untuk menentukan total padatan enkapsulasi optimum. Enkapsulasi yang digunakan untuk menentukan total padatan optimum adalah natrium alginat. Pembentukan beads jel kalsium alginat dilakukan dengan metode ekstrusi (Krasaekoopt et al., 2003). Sebanyak 20 gram `suspensi natrium alginat (1%, 2%, 3%, 4%, 5%, dan 6% b/v) yang telah didinginkan pada suhu ruang diteteskan dalam 60 ml CaCl2 0,1M menggunakan syringe berukuran 0,7 mm dengan jarak tetes 1 cm dan diaduk menggunakan magnetic stirer dengan kecepatan 150 – 200 rpm. Waktu pengerasan jel dalam larutan CaCl2 0,1M dilakukan selama 30 menit, kemudian beads disaring secara steril dan dibilas dengan NaCl 0,85% lalu ditiriskan selama ± 2 menit. Selanjutnya beads ditimbang. Parameter yang diamati rendemen (yield), bentuk dan ukuran beads:
Rendemen = (massa beads/massa larutan natrium alginat) x 100%
Pada tahap ini, analisis statistik yang digunakan adalah rancangan acak lengkap factor tunggal (single factor), yaitu konsentrasi biopolimer (natrium alginat). Faktor ini terdiri dari empat taraf perlakuan, yaitu alginat 1% (A1), alginat 2% (A2), alginat 3% (A3), alginat 4% (A4), alginat 5% (A5), alginat 6% (A6). Pengulangan dilakukan sebanyak tiga kali. Model rancangan yang digunakan adalah sebagai berikut :
Yij = µ + Ai + εij
Keterangan:
Yij= Pengamatan pada faktor A taraf ke-i dan ulangan ke-j µ = Rataan umum
Ai = Pengaruh faktor A taraf ke-i εij = Pengaruh galat percobaan
Untuk mengetahui pengaruh antara taraf tersebut dilakukan analisis ragam (analisis varian) menggunakan tingkat kepercayaan 95% (α=0,05). Jika hasilnya berbeda nyata,
2. Penentuan Perbandingan Natrium Alginat dengan Bahan Pengisi Optimum
Kegiatan ini dilakukan untuk menentukan perbandingan natrium alginat dengan bahan pengisi optimum pada masing-masing bahan pengisi. Tahap ini diawali dengan menyiapkan sebanyak 20 gram suspensi bahan pengkapsul yang terdiri atas natrium alginat dan bahan pengisi dengan perbandingan 1:1, 2:1, 3:1 (b/v) dari masing-masing bahan pengisi.
Pada tahap ini analisis statistik yang digunakan adalah rancangan acak lengkap faktor tunggal (single factor) yaitu komposisi bahan pengkapsul yang terdiri dari natrium alginat dan bahan pengisi. Faktor ini terdiri dari 7 taraf perlakuan yaitu natrium alginat tanpa bahan pengisi (B0), natrium skim 1:1 (B1), natrium skim 2:1 (B2), natrium alginat-skim 3:1 (B3), natrium alginat-maltodekstrin 1:1 (B4), natrium alginat-maltodekstrin 2:1 (B5), natrium alginat-maltodekstrin 3:1 (B6). Pengulangan dilakukan sebanyak 3 kali. Dengan model rancangan yang digunakan adalah sebagai berikut:
Yij = µ + Bi + εij
Keterangan:
Yij= Pengamatan pada faktor B taraf ke-i dan ulangan ke-j µ = Rataan umum
Bi = Pengaruh faktor B taraf ke-i εij = Pengaruh galat percobaan
Untuk mengetahui pengaruh antara taraf tersebut dilakukan analisis ragam (analisis varian) menggunakan tingkat kepercayaan 95% (α=0,05). Jika hasilnya berbeda nyata,
analisis dilakukan dengan uji lanjut Duncan.
a. Pengujian Viabilitas dan Efisiensi BAL Terenkapsulasi
terlebih dahulu diaktivasi dalam 10 ml MRS broth sebanyak 2–3 kali dan diinkubasi pada suhu 370C selama 24 jam. Suspensi kultur disimpan dalam refrigerator pada suhu 40
Suspensi biopolimer steril yang telah didinginkankemudian ditambahkan suspensi sel sebanyak 0,1% (Homayouni et al. 2008a) atau denganperbandingan 9:1 (Castilla et al. 2010) lalu dikocok hingga homogen. Suspensi biopolimer-seldimasukan kedalam syringe steril dan diteteskan kedalam larutan CaCl2 0,1 M steril(perbandingan suspensi biopolimer-sel dan CaCl2 0,1 M adalah 1:3) dengan jarak tetes 1 cm dandilakukan pengadukan 150 – 200 rpm menggunakan magnetic stirer. Pengerasan jel dilakukanselama 30 menit. Beads kemudian disaring dan dibilas menggunakan NaCl 0,85% yang telahdisterilisasi. Beads basah kemudian dimasukan ke dalam wadah atau botol steril. Jumlah selyang terenkapsulasi di dalam beads dihitung dengan metode yang digunakan Sheu dan Marshal (1993).
C sebagai kultur stok. Suspensi sel yang akan digunakan untuk enkapsulasi merupakan kultur berumur 18 jam dalam MRS broth (Homayouni et al., 2008a).
Viabilitas (%) = Log cfu/gram suspensi biopolimer – sel X 100% Log cfu/gram beads basah
Efisiensi enkapsulasi (%) = P X Q X 100% R
Keterangan:
P = Populasi BAL per gram beads (cfu/g beads)
R = Total BAL didalam suspensi biopolimer – sel (cfu)
Q = Massa beads yang dihasilkan dari total suspensi biopolimer – sel yang digunakan (g)
b. Jumlah Populasi BAL Produk Enkapsulasi
sebanyak 0,1 ml untuk ditanam pada cawan petri berisi media MRS agar. Kultur diinkubasi pada suhu ruang selama 2 hari. Koloni yang tumbuh kemudian dihitung sebagai berikut:
Populasi BAL (cfu/g) = Jumlah Koloni X Pengenceran
Tahap III : Daya Simpan Kapsul BAL dan Uji Kualitasnya a. Daya Simpan Kapsul BAL dan Uji Kualitas
Sebanyak 5 g kapsul BAL disimpan dalam 30 kantong plastik steril pada suhu kamar (270C - 280
Kestabilan BAL dalam menghambat E.coli dihitung berdasarkan daya hambat BAL yang diperoleh sebelumnya dengan asumsi bahwa daya hambat BAL yang tertinggi (awal) mempunyai nilai 100%, selanjutnya diperoleh % penurunan kestabilan BAL seiring dengan semakin menurunnya juga daya hambat yang dihasilkan.
C) dengan kelembaban relatif (75% - 89%) selama 4 minggu. Masing-masing sampel setiap minggu diambil untuk dianalisis jumlah koloni dan daya hambat BAL melawan E.coli. Pengujian jumlah koloni BAL didalam kapsul pada masing-masing perlakuan penyimpanan diukur dengan menggunakan metode Total Plate Count (TPC)menurut Fardiaz (1992). Kapsul yang berisi BAL dilarutkan terlebih dahulu menggunakan NaCl sebelum dilakukan penghitungan jumlah koloni BAL. Begitu juga pengujian terhadap daya hambat E.coli. Jumlah koloni dan daya simpan BAL yang diperoleh selanjutnya dapat diukur dengan viabilitas dan pH BAL.
Kestabilan BAL menghambat E.coli = Daya hambat BAL terendah X 100% Daya hambat BAL tertinggi
Faktor A : Enkapsulasi BAL A1 = BAL (Tanpa Kapsul) A2 = Kapsulasi BAL
Faktor B : Lama Penyimpanan (Minggu) B0 = 0 Minggu
B1 = 1 Minggu B2 = 2 Minggu B3 = 0 Minggu B4 = 4 Minggu
Maka, kombinasi perlakuan yang dapat dibentuk adalah sebagai berikut:
A1B0 A1B1 A1B2 A1B3 A1B4
A2B0 A2B1 A2B2 A2B3 A2B4 Yijk = µ + αi + βj + (αβ)ij + εij Keterangan:
i = 1,2 dan 3 j = 1,2 dan 3 k = 1,2 dan 3
Yijk = Nilai kestabilan data ke-k yang memperoleh kombinasi perlakuan penambahan enkaspulasi ke-i dan lama penyimpanan ke-j
µ = Rataan umum
(αβ)ij = Pengaruh interaksi perlakuan ke-i dan ke-j
εijk = Pengaruh galat perlakuan ke-i dan ke-j pada satuan percobaan
Untuk mengetahui pengaruh antara taraf tersebut dilakukan analisis ragam (analisis varian) menggunakan tingkat kepercayaan 95% (α=0,05). Jika hasilnya berbeda nyata,
b. Pembuatan Enkapsulasi BAL dalam Bentuk Kering.
Tahap ini bertujuan untuk menentukan waktu pengeringan optimum untuk menghasilkan BALterenkapsulasi kering. Pengeringan dilakukan menggunakan oven pada suhu 470
Sebanyak 5 g BALterenkapsulasi dalam beads disebarkan kedalam cawan petri steril kemudian dimasukan ke dalam oven bersuhu 47
C. Waktu pengeringan ditentukan dengan mengukur perubahan kadar air probiotik terenkapsulasi selama pengeringan hingga dicapai kadar air konstan selama pengeringan. Pada tahap ini juga dikaji pengaruh bahan pengkapsul yang digunakan terhadap viabilitas dan ketahanan sel selama proses pengeringan.
0
C. Setiap jam dilakukan penimbangan beads hingga massa beads telah cukup konstan (tidak mengalami penurunan). Kadar air probiotik terenkapsulasi dihitung sebagai berikut:
Kat = MBt - MBk X 100% MBt
Keterangan :
Kat = Kadar air probiotik terenkapsulasi pada jam ke-t (%) MBt = Massa probiotik terenkapsulasi pada jam ke-t (gram) MBK = Massa kering (dry matter) probiotik terenkapsulasi (1050 t = Waktu (lama) pengeringan (jam)
C) (gram)
Setelah didapat waktu pengeringan optimum, BALterenkapsulasi selanjutnya dikeringkan pada suhu 470C selama waktu pengeringan optimum yang didapat. Sebelum dan setelah proses pengeringan dilakukan perhitungan populasi BALterenkapsulasi untuk menguji pengaruh bahan pengkapsul terhadap ketahanan probiotik selama proses pengeringan. BALterenkapsulasi kering disimpan di dalam refrigerator pada suhu 40C.
Pada tahap ini, analisis statistik yang digunakan adalah rancangan acak lengkap faktor tunggal (single factor), dengan perlakuan yaitu natrium aginat 5% dengan natrium alginat – maltodekstrin (2:1) Model rancangan yang digunakan adalah sebagai berikut :
Yij = µ + Ci + εij
Keterangan:
Yij = Pengamatan pada faktor C taraf ke-i dan ulangan ke-j µ = Rataan umum
Ci = Pengaruh faktor C taraf ke-i εij = Pengaruh galat percobaan
Untuk mengetahui pengaruh antara taraf tersebut dilakukan analisis ragam (analisis varian) menggunakan tingkat kepercayaan 95% (α=0,05). Jika hasilnya berbeda nyata,