ABSTRACT
Pineapple peels (Ananas comosus L. Merr) contain proteolytic protein that can act as antioxidant. Antioxidant is a compound that can inhibit the reaction of free radicals within the body. The aims of this study are to determine the concentration of total protein in pineapple peels extract and its antioxidant activity.
The assay of total protein was determined by spectrophotometric with Bovine Serum Albumin (BSA) as the reference. Antioxidant activity was determined using DPPH radical scavenging method, expressed as IC50 (Inhibition Concentration 50). Results showed that the total protein concentration of the pineapple peels extract is (7,8233 ± 0,1096) % w/w. Furthermore, the antioxidant activity of bromelain from pineapple peels extract is found weak with the IC50 value (4869,3 ± 28,2744)
μg/mL.
INTISARI
Kulit buah nanas (Ananas comosus L. Merr) memiliki kandungan senyawa protein proteolitik yang dapat berperan sebagai antioksidan. Antioksidan merupakan senyawa yang dapat menghambat reaksi radikal bebas dalam tubuh. Penelitian ini bertujuan untuk menetapkan kadar enzim bromelain dalam ekstrak kulit buah nanas dan menguji aktivitas antioksidan. Estimasi kadar bromelain ditentukan secara spektrofotometri dengan menggunakan standar Bovine Serum Albumine (BSA). Aktivitas antioksidan ditentukan dengan metode DPPH yang dinyatakan dalam IC50 (Inhibition Concentration 50).
Penelitian menunjukkan bahwa estimasi kadar enzim bromelain yang dihitung terhadap BSA dalam ekstrak kulit buah nanas sebesar (7,8233 ± 0,1096) %. Aktivitas antioksidan ekstrak kulit buah nanas yang dinyatakan dengan nilai IC50 sebesar (4869,3 ± 28,2744) μg/mL.
UJI AKTIVITAS ANTIOKSIDAN DAN PENETAPAN KADAR BROMELAIN TERHADAP BOVINE SERUM ALBUMIN (BSA) DARI
EKSTRAK KULIT BUAH NANAS (Ananas comosus (L.) Merr)
SKRIPSI
Diajukan untuk memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Yohanes Bintang Pambudi NIM : 1281141128
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
UJI AKTIVITAS ANTIOKSIDAN DAN PENETAPAN KADAR BROMELAIN TERHADAP BOVINE SERUM ALBUMIN (BSA) DARI
EKSTRAK KULIT BUAH NANAS (Ananas comosus (L.) Merr)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana (S. Farm.)
Program Studi Farmasi
Oleh:
Yohanes Bintang Pambudi NIM: 128114128
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
“Segala perkara dapat kutanggung di dalam Dia yang memberi
kekuatan kepadaku”
Filipi 4:13
When we pray, God hears more than we say, answer more than we
ask, gives more than we imagine..
In His time and His own way.
Dipersembahkan untuk Gusti Yesus Kristus, Bunda Maria, Keluarga,
orang-orang terkasih yang telah membantu secara moral dan materi.
vii PRAKATA
Puji dan syukur penulis haturkan kepada Tuhan Yang Maha Esa yang telah melimpahkan segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul ” Uji Aktivitas Antioksidan dan Penetapan Kadar Bromelain Terhadap Bovine Serum Albumin (BSA) Dari Ekstrak Kulit Buah Nanas (Ananas comosus L. Merr)” sebagai salah satu syarat untuk mencapai gelar Sarjana Farmasi (S.Farm.) pada Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Dalam menyelesaikan skripsi ini penulis mengalami banyaknya kesulitan dan hambatan. Keberhasilan penulis dalam penyusunan skripsi ini tentunya tidak terlepas dari dukungan, bantuan, nasehat, bimbingan, kritik dan saran dari berbagai pihak. Oleh karena itu, dengan tulus dan kerendahan hati penulis mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Ibu Aris Widayati, M.Si., Ph.D., Apt., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Ibu Dr. Yustina Sri Hartini, M.Si, Apt., selaku dosen pembimbing atas bimbingan, arahan, semangat, kritik dan saran selama penyusunan proposal hingga selesainya skripsi ini.
3. Bapak Maywan Hariono, Ph.D, Apt., selaku dosen penguji atas, arahan, kritik dan saran atas skripsi ini.
viii
5. Segenap dosen Fakultas Farmasi, Universitas Sanata Dharma, yang telah membagikan ilmu selama penulis menempuh pendidikan di Fakultas Farmasi. 6. Segenap staf laboratorium, staf kebersihan, dan staf keamanan Fakultas
Farmasi, Universitas Sanata Dharma, Yogyakarta. Terutama Pak Wagiran, Pak Musrifin, Pak Parlan dan Mas Kunto yang telah banyak membantu kelancaran penelitian.
7. Richard Andrison Sadeli, teman seperjuangan skripsi, atas kerjasama, dukungan, semangat, dan masukan yang diberikan.
8. Teman-teman penghuni dan ibu Kost DMP atas dukungan dan semangatnya. 9. Teman, sahabat tempat bertukar pikiran dan kegembiraan serta kesusahan
(Sarjo, Putra, Indra, Fofo, Gotaro, Jabon, Budi) atas kebersamaan dan dukungan.
10.Teman-teman FSM C, FST B, Mas Boy 2012 dan Farmasi angkatan 2012 atas kebersamaan, kerjasama, dan kenangan selama di Fakultas Farmasi.
11.Semua pihak yang tidak dapat disebutkan satu per satu yang telah membantu penulis dalam menyelesaikan skripsi ini.
ix
kata, penulis berharap semoga skripsi ini dapat bermanfaat bagi perkembangan ilmu pengetahuan dan masyarakat.
Yogyakarta, 15 Juni 2016
x DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
PERNYATAAN PERSETUJUAN PUBLIKASI ... vi
xi
3. Penggolongan antioksidan ... 10
E. Spektrofotometri UV-Visibel ... 11
F. Metode DPPH ... 12
G. Landasan Teori ... 12
H. Hipotesis ... 14
BAB III. METODOLOGI PENELITIAN ... 15
A. Jenis dan rancangan penelitian ... 15
B. Variabel dan definisi operasional ... 15
xii
3. Pembuatan ekstrak kulit buah nanas ... 18
4. Analisis kualitatif ... 19
5. Penetapan kadar enzim bromelain ... 19
6. Pembuatan larutan uji aktivitas antioksidan ... 21
7. Uji aktivitas antioksidan ... 22
2. Uji pendahuluan aktivitas antioksidan ... 31
E. Hasil penetapan kadar enzim bromelain terhadap BSA ... 32
F. Hasil optimasi uji aktivitas antioksidan ... 37
1. Penentuan Operating Time (OT) ... 36
2. Penentuan panjang gelombang serapan maksimum (λ maks) ... 35
G. Hasil uji aktivitas antioksidan ... 38
BAB V. KESIMPULAN DAN SARAN ... 46
A. Kesimpulan ... 46
B. Saran ... 46
xiii
xiv
DAFTAR TABEL
Tabel I. Hasil pengukuran absorbansi kadar enzim bromelain
terhadap BSA ... 34 Tabel II. Hasil penetapan kadar enzim bromelain terhadap BSA ... 35 Tabel III. Hasil scanning panjang gelombang serapan maksimum
DPPH ... 38 Tabel IV. Hasil aktivitas antioksidan rutin dengan metode DPPH ... 41 Tabel V. hasil aktivitas antioksidan ekstrak bromelain kulit buah nanas
dengan metode DPPH ... 42 Tabel VI. Hasil hasil perhitungan IC50 rutin dan ekstrak bromelain
xv
DAFTAR GAMBAR
Gambar 1. Reaksi ninhidrin dengan protein ... 30
Gambar 2. Hasil uji ninhidrin ... 30
Gambar 3. Hasil uji pendahuluan aktivitas antioksidan ... 32
Gambar 4. Kurva persamaan regresi linear Bovine Serum Albumine (BSA) ... 33
Gambar 5. Kurva penentuan Operating Time (OT) rutin ... 37
Gambar 6. Reaksi antara senyawa antioksidan dengan DPPH ... 39
Gambar 7. Kurva persamaan regresi linear rutin ... 40
xvi
DAFTAR LAMPIRAN
Lampiran 1. Surat pengesahan determinasi buah nanas
(Ananas comosus L. Merr) ... 52
Lampiran 2. Gambar buah nanas ... 53
Lampiran 3. Perhitungan rendemen ... 54
Lampiran 4. Penimbangan analisis kualitatif ... 55
Lampiran 5. Data penimbangan penetapan kadar bromelain terhadap BSA ... 55
Lampiran 6. Optimasi penetapan kadar bromelain terhadap BSA ... 56
Lampiran 7. Penetapan kadar bromelain terhadap BSA ... 59
Lampiran 8. Penimbangan pengujian aktivitas antioksidan ... 63
Lampiran 9. Perhitungan konsentrasi DPPH, larutan pembanding dan larutan uji ... 64
Lampiran 10. Optimasi metode uji aktivitas antioksidan... 67
Lampiran 11. Uji aktivitas antioksidan menggunakan radikal DPPH ... 71
Lampiran 12. Perhitungan nilai IC50 rutin dan ekstrak kulit buah nanas ... 73
xvii INTISARI
Kulit buah nanas (Ananas comosus L. Merr) memiliki kandungan senyawa protein proteolitik yang dapat berperan sebagai antioksidan. Antioksidan merupakan senyawa yang dapat menghambat reaksi radikal bebas dalam tubuh. Penelitian ini bertujuan untuk menetapkan kadar enzim bromelain dalam ekstrak kulit buah nanas dan menguji aktivitas antioksidan. Estimasi kadar bromelain ditentukan secara spektrofotometri dengan menggunakan standar Bovine Serum Albumine (BSA). Aktivitas antioksidan ditentukan dengan metode DPPH yang dinyatakan dalam IC50 (Inhibition Concentration 50).
Penelitian menunjukkan bahwa estimasi kadar enzim bromelain yang dihitung terhadap BSA dalam ekstrak kulit buah nanas sebesar (7,8233 ± 0,1096) %. Aktivitas antioksidan ekstrak kulit buah nanas yang dinyatakan dengan nilai IC50 sebesar (4869,3 ± 28,2744) μg/mL.
xviii ABSTRACT
Pineapple peels (Ananas comosus L. Merr) contain proteolytic protein that can act as antioxidant. Antioxidant is a compound that can inhibit the reaction of free radicals within the body. The aims of this study are to determine the concentration of total protein in pineapple peels extract and its antioxidant activity.
The assay of total protein was determined by spectrophotometric with Bovine Serum Albumin (BSA) as the reference. Antioxidant activity was determined using DPPH radical scavenging method, expressed as IC50 (Inhibition Concentration 50). Results showed that the total protein concentration of the pineapple peels extract is (7,8233 ± 0,1096) % w/w. Furthermore, the antioxidant activity of bromelain from pineapple peels extract is found weak with the IC50 value (4869,3 ± 28,2744) μg/mL.
1 BAB I PENGANTAR
A. Latar Belakang
Pada masa modern penyakit degeneratif semakin banyak berkembang. Penyakit degeneratif seperti kanker, diabetes, CHD (Cardiovascular Heart Disease), disfungsi otak dan penuaan dini sering dikatikan dengan adanya
kerusakan oksidatif yang disebabkan oleh radikal bebas (Ames, Shigenaga, dan Hagen, 1993).
Radikal bebas merupakan suatu senyawa yang mempunyai elektron bebas tidak berpasangan. Hal inilah yang menjadikan senyawa radikal bebas bersifat sangat reaktif dan tidak stabil. Karena ketidakstabilannya tersebut, senyawa radikal bebas akan segera menyerang komponen seluler yang berada di sekitarnya, seperti lipid, karbohidrat, protein maupun asam lemak. Radikal bebas melakukan reaksi oksidasi patogenik terhadap sel atau komponennya, sehingga dapat menyebabkan disfungsi sel, kerusakan struktur sel atau mutasi yang berakibat pada timbulnya penyakit degeneratif (Prakash, Rigelhof, dan Miller, 2001).
aromatis fenol inilah yang akan berkontribusi terhadap aktivitas antioksidan (Winarsi, 2007).
Senyawa antioksidan sintetik seperti butylated hydroxyanisole (BHA), propyl gallate (PG) dan butylated hydroxytoluene (BHT) telah banyak digunakan
secara luas selama beberapa waktu. Akan tetapi, terdapat kemungkinan senyawa antioksidan sintetik tersebut mempunyai efek toksik dan karsinogenik. Oleh karena itu dilakukan eksplorasi senyawa antioksidan yang baru, aman dan efektif dari alam yang diambil dari berbagai tanaman. Banyak penelitian telah menunjukkan bahwa senyawa antioksidan dari tanaman tersebut cukup efektif dalam menghambat terbentuknya radikal bebas (Zou, Lu, dan Wei, 2004; Azlim et al., 2010)
Untuk melihat potensi antioksidan dari enzim protease yang telah digunakan dalam perawatan luka, dalam penelitian ini dilakukan pemeriksaan aktivitas antioksidan terhadap kulit buah nanas. Berbagai penelitian telah membuktikan bahwa kulit nanas mempunyai kemampuan sebagai antioksidan dan aktivitas biologis lainnya (Hossain dan Rahman, 2011; da Silva et al, 2010; Erukainure et al, 2012). Kulit dari buah nanas merupakan salah satu bagian dari limbah buah nanas, selain bonggol dan daunnya. Limbah tersebut umumnya dapat digunakan sebagai pakan ternak. Khususnya kulit buah nanas dapat digunakan untuk produksi kertas, baju, dan uang kertas. Hal tersebut disebabkan kulit buah nanas banyak mengandung selulosa, hemiselulosa, dan karbohidrat yang lain (Bartholomew et al., 2003). Bromelain diduga terkandung dalam kulit, selain di bonggol, dan daun
(Ketnawa, Rawdkuen, dan Chaiwut, 2010).
1. Rumusan Masalah
a. Apakah ekstrak kulit buah nanas mempunyai daya antioksidan?
b. Berapa nilai aktivitas antioksidan ekstrak kulit buah nanas yang dinyatakan dengan IC50?
c. Berapa kadar enzim bromelain dalam ekstrak kulit buah nanas yang dihitung terhadap BSA?
2. Keaslian Penelitian
Sejauh penelusuran peneliti, penelitian yang serupa pernah dilakukan oleh Bresolin, Silveira, Tambourgi, dan Mazzola (2013) dengan judul “Isolation and Purification of Bromelain from Waste Peel of Pineapple for Therapeutic
Application”. Penelitian ini menggunakan kulit buah nanas yang didapat di
Campinas (Brazil), purifikasi dengan menggunakan metode presipitasi dengan amonium sulfat, dan pengukuran konsentrasi enzim menggunakan ion exchange chromatography. Selain itu penelitian serupa juga pernah dilakukan oleh Hatam,
Suryanto, dan Abidjulu (2013) dengan judul “Aktivitas Antioksidan dari Ekstrak
Kulit Nanas (Ananas comosus (L.) Merr)”. Penelitia ini dilakukan menggunakan
kulit nanas yang didapatkan di Bolaang Mongondow, Manado (Indonesia), ekstraksi menggunakan etanol 80% dan teknik maserasi, soxhlet dan refluks, dan penentuan aktivitas antioksidan menggunakan metode DPPH (1,1-diphenyl-2-picrylhydrazyl).
buah nanas yang diperoleh di Pasar Stan Maguwoharjo (Yogyakarta), purifikasi menggunakan etanol 95% dengan perbandingan 1:3 selama 24 jam, uji kualitatif menggunakan ninhidrin, dan pengukuran konsentrasi enzim menggunakan metode spektrofotometri 280 nm.
3. Manfaat Penelitian a. Manfaat Teoritis
Penelitian ini diharapkan dapat menambah perkembangan wawasan pengetahuan khususnya dalam ilmu kefarmasian tentang aktivitas antioksidan dari ekstrak dari kulit buah nanas.
b. Manfaat Praktis
Penelitian ini diharapkan dapat menambah wawasan kepada masyarakat tentang aktivitas antioksidan dalam ekstrak kulit buah nanas sehingga kulit-kulit nanas hasil dari kupasan buah nanas dapat digunakan untuk pemeliharaan kesehatan.
B. Tujuan Penelitian
1. Untuk mengetahui daya antioksidan ekstrak kulit buah nanas.
2. Untuk mengetahui nilai aktivitas antioksidan ekstrak kulit buah nanas yang dinyatakan dalam IC50.
6 Sub divisi : Angiospermae Kelas : Monocotyldoneae Bangsa : Bromeliales Suku : Bromeliaceae Marga : Ananas
Spesies : Ananas comosus Merr. (Tjitrosoepomo, 1994; Backer dan van Den Brink, 1963).
2. Morfologi
3. Kandungan kimia
Nanas mengandung vitamin C (Gardner et al., 2000), asam ferulat, asam kafeat, dan p-hidroksi asam benzoat (de Simon et al., 1992; van Lelvveld dan de Bruyn, 1977), serta bromelain. Kulit nanas mengandung selulosa, hemiselulosa dan karbohidrat lain (Bartholomew et al., 2003).
B. Bromelain
Bromelain merupakan enzim proteolitik yang didapat dari tanaman dengan family bromeliaceae, dimana yang paling banyak ditemukan terdapat pada buah nanas (Ananas comosus L. Merr). Penggunaan bromelain pada umumnya adalah sebagai agen anti-inflamasi, anti-edema, antitrombotik, dan aktivitas fibrinolit ik (Manzoor, Nawaz, Mukhtar, dan Haq, 2016). Bromelain umumnya paling banyak ditemukan di bagian stem dan dagingnya. Oleh karena itu munculnya nama stem bromelain dan fruit bromelain dikarenakan enzim tersebut umumnya dapat ditemukan di bagian stem dan daging buah nanas (Maurer, 2001).
Metode isolasi bromelain dapat dilakukan salah satunya dengan metode presipitasi. Metode ini dilakukan dengan penambahan pelarut organik seperti aseton, alkohol, dan amonium sulfat. Bromelain diisolasi dari bagian tanaman yang sudah berbentuk perasan atau sari buahnya dengan menambahkan pelarut organic sebagai bahan pengendap. Dalam beberapa penelitian ada yang menggunakan cara pengendapan yang berbeda, seperti melakukan pengendapan dengan penambahkan larutan pada pH tertentu dan perlakuan pada suhu tertentu (Maurer, 2001).
C. Radikal Bebas
Radikal bebas adalah atom atau molekul yang memiliki sebuah elektron tak berpasangan pada jari-jari terluar dari atom. Sifatnya tidak stabil dan pada struktur biologis dapat menyebabkan kerusakan oksidatif (Chaisawvong dan Supapor, 2009). Radikal bebas dapat mengoksidasi asam nukleat, protein, lipid serta DNA, dan dapat menginisiasi timbulnya penyakit degeneratif (Prakash, Rigelhof, dan Miller, 2007).
D. Antioksidan 1. Definisi antioksidan
Antioksidan merupakan senyawa yang diperlukan tubuh menetralis ir radikal bebas dan mencegah kerusakan yang ditimbulkan oleh radikal bebas terhadap sel normal, protein, dan lemak. Antioksidan memiliki berat molekul kecil akan menstabilkan radikal bebas dengan melengkapi kekurangan elektron yang dimiliki radikal bebas (Winarsi, 2007).
Kebanyakan senyawa ini (misalnya tokoferol) digunakan sebagai pengawet dalam berbagai produk (misalnya dalam lemak, minyak dan produk makanan untuk menunda ketengikan dan perubahan-perubahan yang tidak diinginkan, dalam karet untuk menunda oksidasi). Pengertian antioksidan yang lebih relevan secara biologis ialah senyawa alami atau sintetik yang ditambahkan ke dalam produk untuk mencegah atau menunda kerusakan yang disebabkan oleh udara (Huang, Ou, dan Prior, 2005).
2. Uji aktivitas antioksidan
Uji aktivitas antioksidan dapat dilakukan dengan beberapa metode, baik secara kuantitatif maupun kualitatif. Uji aktivitas antioksidan secara kuantit at if yang biasa dilakukan adalah dengan metode DPPH. Prinsip dari metode ini adalah penangkapan elektron bebas dari senyawa radikal bebas yang dapat menyebabkan adanya reaksi perubahan warna pada DPPH dari ungu menjadi kuning (Dephour, Ebrahimazedh, Fazel, dan Mohammad, 2009). Metode lain yang sering digunakan antara lain, metode Ferric-reducing antioxidant power (FRAP), Cupric ion reducing antioxidant capacity (CUPRAC), dan Trolox equivalent antioxidant
dilakukan dengan metode kromatografi lapis tipis (KLT) atau dengan menggunaka n kromatografi kertas (Davidek, 1997).
3. Penggolongan antioksidan
Menurut sumbernya, antioksidan dapat digolongkan menjadi dua macam, yaitu antioksidan sintetik dan alami (Gulcin, Uguz, Oktay, Beydemir, dan
Kufrevioglu, 2004). a. Antioksidan sintetik
Antioksidan sintetik merupakan antioksidan yang dibuat melalui sintesis secara kimia, contohnya: ter-butyl hidroquinone (tBHQ), butylated hydroxyanisole (BHA), butylated hydroxytoluene (BHT), dan propil galat (PG) (Gulcin, et al., 2004). Konsentrasi rendah dari antioksidan tBHQ dan BHA telah lama digunakan untuk mencegah oksidasi dari produk makanan sehingga dapat menstabilkan produk tersebut (nutrisi, rasa, maupun warna). Dalam konsentrasi yang tinggi, tBHQ dapat menyebabkan kanker. Penyebabnya adalah metabolit dari oksidasi tBHQ, yaitu 2-tertbutyl-1,4-benzoquinone (tBBQ) dan Reactive Oxygen Species (ROS) (Gharavi, Haggarty, dan El-Kadi, 2007).
b. Antioksidan alami
E. Spektrofotometri UV-Visibel
Spektrofotometri visibel merupakan teknik spektroskopik yang memakai sumber radiasi elektromagnetik sinar tampak (380-780 nm) dengan memakai instrumen spektrofotometer. Distribusi elektron didalam suatu senyawa organic secara umum yang dikenal sebagai orbital elektron pi (п), sigma (α) dan elektron tidak berpasangan (n). Apabila pada molekul dikenakan radiasi elektromagnet ik maka akan terjadi ekstasi elektron ke tingkat energi yang lebih tinggi yang dikenal sebagai orbital elektro anti bonding (Mulja dan Suharman, 1995; Fessenden dan Fessenden, 1995).
Setiap senyawa memiliki energi yang sama dengan perbedaan energi antara keadaan tingkat dasar dan energi keadaan tereksitasi, maka elektron-elektron pada keadaan tingkat dasar akan dieksitasi ke tingkat energi eksitasi dan sebagian energi cahaya yang sesuai dengan panjang gelombang ini diserap. Frekuensi yang diserap setiap senyawa sangat spesifik karena perbedaan energi antara tingkat dasar dan tingkat eksitasi setiap senyawa juga spesifik (Sastrohamidjojo, 2001).
kromofor dapat mengubah panjang gelombang dan intensitas serapan maksimum (Sastrohamidjojo, 2001).
F. Metode DPPH
Uji aktivitas antioksidan dengan menggunakan metode DPPH merupakan metode uji yang paling sering digunakan. Metode ini menggunakan senya wa radikal bebas 1,1-dyphenyl-2-picrylhydrazyl (DPPH). Senyawa DPPH merupakan senyawa radikal nitrogen yang tidak stabil karena adanya elektron bebas yang tidak berpasangan yang dapat menyebabkan DPPH memiliki sifat reaktif. DPPH akan mengalami reduksi melalui proses donasi elektron sehingga warna DPPH akan mengalami perubahan warna dari ungu menjadi kuning (Halliwell dan Gutteridge, 2000).
Parameter yang digunakan metode ini adalah parameter IC50. IC50 merupakan parameter konsekuensi yang ekuivalen dapat memberikan 50% efek aktivitas antioksidan. Parameter ini dapat diketahui dengan mengintepretas ika n
hasil uji dalam suatu data eksperimental (Molyneux, 2004).
G. Landasan Teori
asam nukleat, protein, lipid, DNA, dan dapat memicu penyakit degeneratif. Senyawa antioksidan dapat meredam radikal bebas dan menghambat reaksi oksidatif, sehingga kerusakan sel akibat radikal bebas dapat dicegah (Winarsi, 2007)
Nanas merupakan tanaman yang mudah ditemukan di daerah tropis. Selama bertahun-tahun telah banyak kegunaan dari bagian-bagian buah nanas yang digunakan dalam pemeliharaan kesehatan. Seperti kulit nanas yang telah menjadi bahan penting dalam pengobatan tradisional untuk mengobati berbagai penyakit selama bertahun-tahun. Berbagai penelitian telah membuktikan bahwa kulit nanas mempunyai kemampuan sebagai antioksidan dan aktivitas biologis lainnya (Hossain dan Rahman, 2011; da Silva et al, 2010; Erukainure et al, 2012). Bromelain merupakan salah satu enzim protease yang umum digunakan dalam perawatan luka. Enzim protease yang digunakan dalam perawatan luka untuk regenerasi jaringan dan mencegah timbulnya keloid berpotensi memiliki aktivitas antioksidan (Pendzhiev, 2002). Enzim ini tidak hanya dapat ditemukan di bagian daging, stem dan daun, namun juga di kulit nanas (Hebbar, Sumana, dan Raghvarao, 2008).
panjang gelombang 280 nm. Intensitas serapan pada panjang gelombang tersebut sebanding dengan jumlah enzim dalam sampel (Ahmed, 2005).
Metode DPPH merupakan metode pengujian aktivitas antioksidan yang sederhana dan cepat. Metode ini menggunakan radikal bebas DPPH untuk menguj i suatu senyawa antioksidan dalam meredam radikal bebas. Elektron tak berpasangan DPPH memberikan serapan yang kuat pada panjang gelombang 517 nm dengan warna ungu. Warna ungu akan berubah menjadi kuning ketika terdapat senyawa antioksidan yang meredam radikal bebas DPPH (Dehpour, Ebrahimzadeh, Fazel, dan Mohammad, 2009; Molyneux, 2004).
H. Hipotesis
15 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan penelitian eksperimental murni dengan rancangan acak lengkap pola searah.
B. Variabel dan Definisi Operasional Variabel – variabel yang digunakan pada penelitian ini adalah: 1. Variabel utama
a. Variabel bebas
Variasi konsentrasi ekstrak kulit buah nanas. b. Variabel tergantung
Aktivitas antioksidan (%IC) dan kadar enzim bromelain ekstrak kulit buah nanas.
2. Variabel pengacau
a. Variabel pengacau terkendali
Jumlah (g) kulit yang digunakan, suhu evaporasi, waktu pengendapan, dan lama penyimpanan ekstrak kulit buah nanas.
b. Variabel pengacau tidak terkendali
3. Definisi Operasional a. Aktivitas antioksidan
Aktivitas antoksidan adalah kemampuan ekstrak kulit buah nanas untuk menangkap radikal DPPH dibandingkan dengan kontrol negatif.
b. Ekstrak kulit buah nanas
Ekstrak kulit buah nanas adalah ekstrak yang berbentuk cairan kental yang diperoleh dari presipitasi crude extract dengan etanol, dimana menurut Soares (2012) crude extract merupakan supernatan hasil dari proses ekstraksi kulit buah nanas.
c. Kadar enzim bromelain
Kadar enzim bromelain adalah suatu nilai yang dinyatakan dalam bentuk persentase yang menyatakan kadar bromelain dalam ekstrak kulit buah nanas yang ditetapkan menurut Ahmed (2005) yang dihitung terhadap bovine serum albumin (BSA) sebagai reference standard dalam penghitungan kadar enzim
bromelain.
d. Persen inhibition concetration (%IC)
Persen inhibition concetration adalah suatu nilai yang dinyatakan dalam bentuk persentase yang menyatakan kemampuan enzim bromelain dalam ekstrak kulit buah nans dalam menangkap radikal DPPH.
e. Inhibition concetration 50 (IC50)
Inhibition concetration 50 adalah nilai dosis enzim bromelain dalam ekstrak
C. Bahan Penelitian
Bahan uji yang digunakan adalah kulit buah nanas yang dibeli pada bulan Februari - April 2016 dan diperoleh dari pedagang buah pasar Stan, Maguwoharjo, kabupaten Sleman, Yogyakarta. Bahan kimia kualitas farmasetis yang digunakan dalam penelitian ini yaitu aquadest; bahan kimia kualitas teknis (CV. General Labora) berupa ethanol dan air deionisasi; bahan kimia kualitas pro analitik (E. Merck) berupa metanol dan ninhidrin; bahan kimia kualitas pro analitik (Sigma Chem. Co.) berupa rutin dan DPPH; bahan kimia kualitas pro analitik (DiaSys) berupa bovine serum albumine (BSA).
D. Alat Penelitian
Alat yang digunakan dalam penelitian ini, antara lain: blender (Maspion), corong Buchner (Desaga), mikropipet 50-200 µL (Acura 825, Socorex), vortex (Stuart Scientific), sentrifuge (Hettich), magnetic stirrer (Thermo Scientific), vacuum rotary evaporator (BUCHI Rotavator R-3), waterbath (Memmert),
spektrofotometer UV-Vis (Shimadzu UV mini-1240 UV-Vis Spektrofotometer), neraca analitik (Metler Tolledo, BP 160P), serta alat-alat gelas yang lazim digunakan di laboratorium (Pyrex-Germany).
E. Tata Cara Penelitian 1. Determinasi buah nanas.
van Den Brink (1963) dengan mencocokan karakteristik buah nanas yang digunakan dengan gambar, taksonomi, dan keterangan kelompok tumbuhan. Hal ini dilakukan untuk mengetahui kebenaran identitas tanaman yang digunakan dalam penelititan serta untuk meminimalisir adanya kesalahan yang terjadi ketika pengambilan sampel.
2. Pengumpulan kulit buah nanas.
Kulit buah nanas diperoleh dari pasar Stan, Maguwoharjo, kabupaten Sleman, Yogyakarta. kulit yang diambil berasal dari buah yang memiliki jenis dan tingkat kematangan yang sama.
3. Pembuatan ekstrak kulit buah nanas.
Metode yang digunakan berdasarkan pada penelitian oleh Soares, Vaz, Correia, Pessoa, dan Carneiro-da-Cunha (2012) dengan beberapa modifikasi. a. Preparasi buah nanas (Ananas comosus (L.) Merr).
Buah Nanas dicuci dengan air mengalir, dikeringkan, dan dikupas. Kulit buah sebanyak 70,0 g dipotong kecil-kecil kemudian dicampur dengan air deionisasi 4°C (1:1 w/w) dan dihaluskan menggunakan blender. Larutan jus disaring dengan menggunakan kain katun tipis lalu disentrifugasi dengan kecepatan 10.000 rpm selama 15 menit. Supernatan kemudian dikumpulkan dalam gelas beker untuk proses selanjutnya.
b. Purifikasi dengan teknik ethanol precipitation
menit dan didiamkan selama 24 jam pada suhu 4°C sehingga didapatkan endapan koloidal putih hingga kuning muda. Setelah terjadi pengendapan, campuran kemudian diuapkan untuk memisahkan etanol menggunakan vacuum rotary evaporator dengan suhu 50°C selama 30 menit. Endapan dikumpulkan
dalam cawan petri dan dipekatkan menggunakan waterbath dengan suhu 50°C selama 3 jam. Cairan kental berwarna kekuningan dikumpulkan sebagai ekstrak kulit buah nanas.
4. Analisis kualitatif
Metode yang digunakan berdasarkan pada penelitian oleh Panda (2000) dengan beberapa modifikasi. BSA sebanyak 0,5 mL dengan konsentrasi 50 mg/mL dilarutkan ke dalam 10,0 mL air deionisasi, ekstrak kulit buah nanas sebanyak 250,0 mg dilarutkan ke dalam 50,0 mL air deionisasi, dan ninhidrin sebanyak 350,0 mg dilarutkan ke dalam 100,0 mL etanol 90%. Larutan BSA diambil sebanyak 1 mL lalu dimasukan ke dalam tabung reaksi dan ditambah dengan larutan ninhidrin sebanyak 5 mL. Campuran dipanaskan pada suhu 100°C selama 15 menit sehingga muncul warna biru-ungu yang menandakan terjadi reaksi antara asam amino dengan ninhidrin. Analisis yang sama juga dilakukan untuk larutan ekstrak kulit buah nanas dan air deionisasi. Replikasi dilakukan sebanyak 3 kali.
5. Penetapan kadar enzim bromelain ekstrak kulit buah nanas
a. Pembuatan larutan uji
Ekstrak kulit buah nanas ditimbang sebanyak 250,0 mg dan dilarutkan ke dalam 25,0 mL aquadest (5°C) sehingga diperoleh konsentrasi larutan uji sebesar 10000 µg/mL.
b. Pembuatan larutan pembanding BSA
BSA sebanyak 0,5 mL dengan konsentrasi 50 mg/mL dilarutkan ke dalam 25,0 mL aquadest (5°C). Larutan tersebut diambil sebanyak 4,0; 5,5; 7,0; 8,5 dan 10,0 mL lalu ditambah dengan aquadest (5°C) hingga 10,0 mL, sehingga diperoleh konsentrasi larutan pembanding BSA sebesar 400, 550, 700, 850 dan 1000 µg/mL.
c. Penetapan panjang gelombang maksimum
Larutan baku BSA dengan konsentrasi 400, 700, dan 1000 µg/mL dimasukan ke dalam tabung reaksi dan divortex selama 30 detik, lalu didiamkan selama OT. Larutan diukur serapannya pada panjang gelombang 200-400 nm. d. Pengukuran absorbansi larutan standar dan uji
e. Estimasi kadar enzim bromelain
Berdasarkan hasil dari prosedur 5 d untuk BSA dan ekstrak kulit buah nanas kemudian dihitung nilai % kadar enzim.
6. Pembuatan larutan uji aktivitas antioksidan
Metode yang digunakan berdasarkan pada penelitian oleh Thangaraj (2016) dengan beberapa modifikasi.
a. Pembuatan larutan DPPH
DPPH sebanyak 15,8 mg ditimbang dan dilarutkan ke dalam metanol p.a. hingga 100,0 mL, sehingga diperoleh konsentrasi larutan DPPH sebesar 0,4 mM. Larutan tersebut ditutup dengan alumunium foil dan harus selalu dibuat baru.
b. Pembuatan larutan standar rutin
Rutin sebanyak 5,0 mg dilarutkan ke dalam metanol p.a hingga 100,0 mL. Larutan tersebut diambil sebanyak 2,0; 3,0; 4,0; 5.0 dan 6,0 mL lalu ditambah dengan metanol p.a hingga 10,0 mL, sehingga diperoleh konsentrasi larutan standar rutin sebesar 10, 15, 20, 25, dan 30 µg/mL.
c. Pembuatan larutan uji
7. Uji Aktivitas Antioksidan
Metode yang digunakan berdasarkan pada penelitian oleh Thangaraj (2016) dengan beberapa modifikasi.
a. Uji Pendahuluan
Dalam tiga buah tabung reaksi, masing-masing ditambah dengan larutan DPPH dan air deionisasi, larutan rutin 25 µg/mL, dan larutan bromelain 5 mg/mL sebanyak 1,0 mL kemudian ditambah dengan metanol p.a sebanyak 3 mL. Larutan tersebut kemudian divortex selama 30 detik dan didiamkan selama 30 menit. Setelah 30 menit, perubahan warna dari ketiga larutan diamati. Replikasi dilakukan sebanyak 3 kali.
b. Penentuan operating time (OT)
Dalam tiga buah labu ukur 5 mL, masing-masing ditambah dengan larutan DPPH dan larutan rutin 5, 15, dan 25 µg/mL sebanyak 1,0 mL kemudian ditambah dengan metanol p.a hingga tanda batas. Larutan divortex selama 30 detik dan dibaca serapannya dengan menggunakan spektrofotometes visibel pada panjang gelombang 517 nm tiap 5 menit selama 1 jam. Replikasi dilakukan sebanyak 3 kali.
c. Penetapan panjang gelombang maksimum
30 detik, lalu didiamkan selama OT. Larutan diukur serapannya pada panjang gelombang 400-600 nm.
d. Pengukuran absorbansi larutan kontrol DPPH
Larutan DPPH sebanyak 2,0 mL dimasukan ke dalam labu ukur 10 mL dan ditambah dengan metanol p.a hingga tanda batas. Setelah OT, larutan dibaca serapannya dengan menggunakan spektrofotometer visibel pada panjang gelombang maksimum. Replikasi dilakukan sebanyak 3 kali.
e. Pengukuran absorbansi larutan uji
Larutan DPPH sebanyak 2,0 mL dimasukan ke dalam labu ukur 10 mL dan ditambah dengan 2 mL larutan pembanding dan larutan uji pada berbagai seri konsentrasi yang telah dibuat, kemudian ditambah dengan metanol p.a hingga tanda batas. Larutan divortex selama 30 detik, lalu didiamkan selama OT. Setelah OT, larutan dibaca serapannya dengan menggunakan spektrofotometer visibel pada panjang gelombang maksimum. Replikasi dilakukan sebanyak 3 kali.
f. Estimasi aktivitas antioksidan
Berdasarkan hasil dari prosedur 7 d dan e untuk rutin dan ekstrak bromelain kemudian dihitung niai %IC dan IC50.
F. Analisis Hasil
sumbu y adalah absorbansi sehingga diperoleh konsentrasi protein total yang kemudian dikonversi menjadi persentase kadar protein total dalam ekstrak kulit buah nanas.
Aktivitas penangkapan radikal DPPH (%IC) dihitung berdasarkan rumus: Absorbansi larutan kontrol − Absorbansi larutan pembanding/uji
Absorbansi larutan kontrol × %
Data aktivitas tersebut dianalisis dan dihitung nilai IC50 menggunakan persamaan regresi linear dengan sumbu x adalah konsentrasi larutan uji maupun pembanding, sedangkan sumbu y adalah %IC.
Data lalu dianalisis secara statistik untuk menentukan ada atau tidaknya perbedaan bermakna antara nilai IC50 larutan pembanding dan larutan uji. Analisis statistik dilakukan dengan panduan Bolton dan Bon (2010) dan dengan software R 3.2.5. Nilai IC50 diuji dengan Shapiro-Wilk untuk mengetahui distribusi data tiap kelompok. Apabila didapat distribusi data yang normal maka analisis dilanjutkan dengan uji F dengan taraf kepercayaan 95% untuk mengetahui homogenitas data kelompok. Apabila didapat data yang homogen maka analisis dilanjutkan dengan uji T-Independent untuk melihat perbedaan antar kelompok bermakna (signifikan) (p<0,05) atau tidak bermakna (tidak signifikan) (p>0,05). Apabila didapat data yang tidak homogen maka analisis dilanjutkan dengan uji T-Independent unequal variances (Welch’s T-test) untuk melihat kebermaknaan perbedaan tiap kelompok. Apabila didapatkan distribusi tidak normal, maka analisis dilanjutkan dengan uji Lavene dengan taraf kepercayaan 95% untuk mengetahui homogenitas data
26 BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi Buah
Determinasi merupakan sebuah tahap awal dalam sebuah penelitian dengan menggunakan tanaman. Determinasi tanaman bertujuan untuk mengetahui kebenaran identitas tanaman yang digunakan dalam penelitian serta untuk meminimalisir akan adanya kesalahan yang terjadi ketika melakukan pengambila n sampel. Jaminan kebenaran sampel sangat penting karena pada buah nanas terdiri dari berbagai macam varietas. Determinasi tanaman dilakukan di Laboratorium Farmakognosi Fitokimia Fakultas Farmasi Universitas Sanata Dharma Yogyakarta, pada tanggal dengan acuan buku Flora of Java (Backer dan van Den Brink, 1963).
B. Hasil Pengumpulan Bahan
C. Hasil Preparasi Sampel
Kulit buah nanas yang telah dikupas dari daging buah kemudian diblender untuk mendapatkan ukuran partikel yang lebih kecil. Ukuran partikel yang lebih kecil akan membuat luas permukaan sampel yang mengalami kontak dengan pelarut semakin besar. Kontak dengan pelarut yang semakin besar akan memudahkan pelarut untuk menarik senyawa yang diinginkan. Adanya kontak antar penyari dengan sampel mengakibatkan adanya kesempatan penyari untuk masuk menembus membran sel dan menarik senyawa yang diinginkan (Rahayu, 2009). Air deionisasi digunakan sebagai pelarut karena dapat melarutkan enzim bromelain yang bersifat hipofilik yang terkandung di dalam kulit buah nanas. Kulit buah yang telah diblender kemudian disaring menggunakan corong Buchner yang dilapisi dengan kain katun dengan bantuan pompa vakum.
mengandung bromelain diambil sebagai crude extract. Crude extract umumnya mempunyai aktivitas yang rendah karena masih merupakan campuran dari beberapa enzim dan ada kemungkinan masih terkandung senyawa-senyawa yang lain selain enzim. Purifikasi dilanjutkan dengan pendinginan ekstrak kasar pada suhu 4°C, kemudian dilakukan penambahan etanol dingin (90%) dengan perbandingan 1:3. Campuran kemudian diaduk dengan menggunakan magnetic stirrer untuk membantu etanol menarik senyawa-senyawa selain bromelain untuk terpisah. Etanol merupakan pelarut organik yang sesuai untuk memisahkan senyawa selain bromelain karena menurut Englard dan Seifter (1990), pelarut organik seperti etanol akan mengakibatkan pengendapan terhadap protein. Campuran kemudian didiamkan selama 24 jam dalam lemari pendingin. Hal ini untuk memberi waktu bagi campuran untuk terpisah membentuk endapan koloidal, dimana bromelain tidak larut dalam pelarut organik.
ekstrak kulit buah nanas hingga didapatkan bobot tetap dari ekstrak. Ekstrak kental yang telah didapat kemudian ditimbang bobot tetapnya. Bobot tetap menurut Faarmakope Indonesia (1979) adalah bobot yang telah mengalami penimbanga n dua kali berturut-turut tidak mengalami perubahan lebih dari 0,5 mg tiap gram sisa yang ditimbang. Bobot ekstrak kulit buah nanas yang didapat sebesar 3,299 gram dengan rendemen yang didapat sebesar 1,5713%. Pada penelitian ini tidak dilakukan fraksinasi karena belum diketahui secara pasti kandungan senyawa yang ada pada ekstrak kulit buah nanas yang dibuat, sehingga hanya digunakan ekstrak
kulit buah nanas.
D. Hasil uji pendahuluan 1. Uji Ninhidrin
Gambar 1. Reaksi Ninhidrin dengan protein (Bottom, Hanna dan Siehr, 1978)
Ninhidrin akan bereaksi dengan gugus amino alfa yang terdapat dalam asam amino, peptida dan protein. Karena terjadi reaksi antara ninhydrin dengan gugus amino alfa maka akan terbentuk hidrindantin. Ninhidrin kemudian akan berinteraksi dengan hidrindantin dan NH3 untuk membentuk senyawa yang mampu menghasilkan warna ungu.
Uji pendahuluan ini menggunakan kontrol negatif. Kontrol negatif yang digunakan yaitu larutan ninhidrin yang dicampur dengan air deionisasi untuk menunjukkan jika hasilnya negatif. Uji pendahuluan ini memberikan hasil positif dilihat dari terbentuknya warna biru-keunguan pada campuran larutan ninhidr in dengan larutan sampel. Sehingga dapat disimpulkan bahwa kulit buah nanas mengandung protein, yang salah satunya adalah bromelain.
2. Uji pendahuluan aktivitas antioksidan
Uji pendahuluan aktivitas antioksidan bertujuan untuk mengetahui adanya keberadaan senyawa protein yang berperan sebagai senyawa antioksidan. Uji ini merupakan uji kualitatif yang digunakan sebagai dasar untuk uji kuantitatif aktivitas antioksidan ekstrak kulit buah nanas. Prinsip uji ini adalah reaksi antara ekstrak kulit buah nanas dengan 1,1-difenil-2-pikrihidrazil (DPPH).
Gambar 3. Hasil uji pendahuluan aktivitas antioksidan (A : kontrol negatif = DPPH + metanol; B : kontrol positif = DPPH + rutin; C : sampel)
Uji ini menggunakan kontrol positif dan kontrol negatif. Kontrol positif yang digunakan adalah DPPH yang direaksikan dengan rutin yang menunjukka n hasil positif. Kontrol negatif yang digunakan adalah DPPH yang menunjukkan hasil negatif. Reaksi antara ekstrak kulit buah nanas dengan DPPH menunjukkan hasil positif dengan adanya perubahan warna ungu menjadi kuning yang dapat dilihat secara visual dengan mata. Sehingga dapat disimpulkan bahwa ekstrak kulit buah nanas memiliki aktivitas sebagai antioksidan.
E. Hasil Penetapan Kadar Enzim Bromelain Terhadap BSA
Dalam tanaman nanas terkandung banyak mineral, vitamin, lemak, glukosa dan protein. Senyawa-senyawa tersebut banyak tersebar di berbagai bagian, antara lain daging buah, daun, kulit, tangkai, dan batang. Enzim bromelain merupakan salah satu unit fungsional dari protein itu sendiri, dimana dari berbagai penelit ia n terdahulu diketahui bahwa kulit nanas mengandung enzim bromelain. Maka dari itu, dilakukan penetapan kadar enzim bromelain yang terkandung dalam ekstrak kulit buah nanas (Ketnawa, Rawdkuen, dan Chaiwut, 2010).
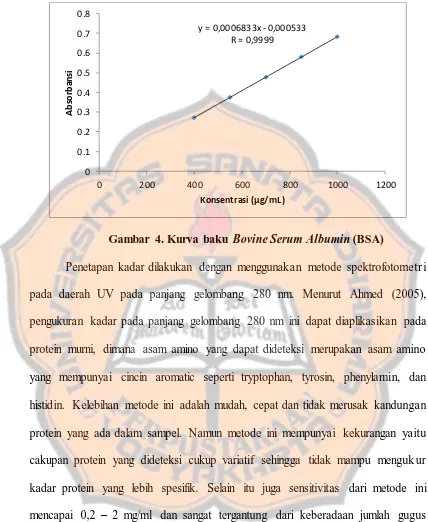
Gambar 4. Kurva baku Bovine Serum Albumin (BSA)
Penetapan kadar dilakukan dengan menggunakan metode spektrofotometr i pada daerah UV pada panjang gelombang 280 nm. Menurut Ahmed (2005), pengukuran kadar pada panjang gelombang 280 nm ini dapat diaplikasikan pada protein murni, dimana asam amino yang dapat dideteksi merupakan asam amino yang mempunyai cincin aromatic seperti tryptophan, tyrosin, phenylamin, dan histidin. Kelebihan metode ini adalah mudah, cepat dan tidak merusak kandungan protein yang ada dalam sampel. Namun metode ini mempunyai kekurangan yaitu cakupan protein yang dideteksi cukup variatif sehingga tidak mampu menguk ur kadar protein yang lebih spesifik. Selain itu juga sensitivitas dari metode ini mencapai 0,2 – 2 mg/ml dan sangat tergantung dari keberadaan jumlah gugus aromatik yang ada pada asam amino. Bovine Serum Albumin (BSA) digunakan sebagai standar referens karena sifatnya yang stabil dan telah banyak digunakan dalam penelitian sebelumnya terhadap penghitungan kadar protein.
y = 0,0006833x - 0,000533
0 200 400 600 800 1000 1200
Tabel I. Hasil pengukuran absorbansi kadar sebesar 0,9999. Sedangkan pada replikasi 3 menunjukkan nilai r sebesar 0,9998. Nilai r yang baik menunjukkan koefisisen korelasi yang baik juga, ditunjukkan dari semakin mendekatinya titik-titik hasil perbandingan antara konsentrasi BSA
dengan absorbansi BSA terhadap garis lurus yang terbentuk (Gambar 6).
Secara berturut-turut, persamaan regresi yang didapat dari replikasi 1, 2, dan 3 yaitu: y = = 0,0006833x – 0,000533; y = 0,0006833x – 0,020933; dan y = 0,0006893x – 0,004333. Hasil yang diperlihatkan pada tabel I menunjukkan bahwa
tinggi konsentrasi dari protein yang diukur (dalam hal ini adalah BSA) maka semakin tinggi pula absorbansi yang dihasilkan. Persamaan regresi yang didapat kemudian akan digunakan dalam menentukan nilai kadar enzim bromelain. Ekstrak kulit buah nanas diukur nilai absorbansinya untuk kemudian digunakan dalam menghitung kadar enzim bromelain yang dihitung terhadap BSA. Secara berturut-turut nilai absorbansi ekstrak kulit buah nanas yang didapat adalah 0,545; 0,531; dan 0,531.
Tabel II. Hasil penetapan kadar enzim bromelain
Replikasi
kandungan air yang terdapat di dalam ekstrak kental. Hal ini berbeda dengan hasil
dari Bresolin et al (2013) dimana hasil purifikasi mencapai bentuk serbuk.
F. Hasil Optimasi Uji Aktivitas Antioksidan 1. Penentuan Operating Time (OT)
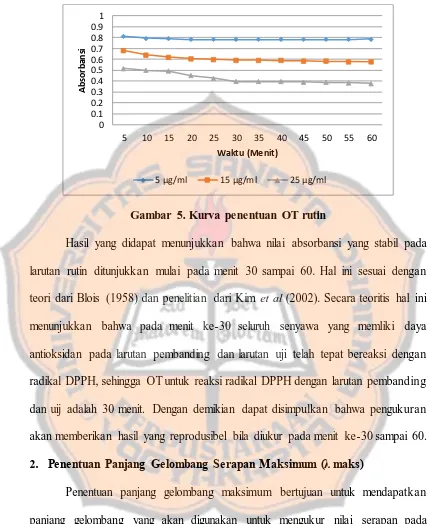
Penentuan OT bertujuan untuk mendapatkan rentang waktu yang tepat dalam pengukuran absorbansi sampel, dimana reaksi antara radikal DPPH dengan senyawa uji telah berlangsung secara optimal sehingga dapat menghasi lka n absorbansi yang stabil. Penentuan OT ini dilakukan dengan cara menguk ur absorbansi dari larutan DPPH dengan larutan rutin menggunakan spektrofotometer visible pada panjang gelombang serapan maksimum teoritis, yaitu 517 nm (Kedare dan Singh, 2011).
Gambar 5. Kurva penentuan OT rutin
Hasil yang didapat menunjukkan bahwa nilai absorbansi yang stabil pada larutan rutin ditunjukkan mulai pada menit 30 sampai 60. Hal ini sesuai dengan teori dari Blois (1958) dan penelitian dari Kim et al (2002). Secara teoritis hal ini menunjukkan bahwa pada menit ke-30 seluruh senyawa yang memliki daya antioksidan pada larutan pembanding dan larutan uji telah tepat bereaksi dengan radikal DPPH, sehingga OT untuk reaksi radikal DPPH dengan larutan pembanding dan uij adalah 30 menit. Dengan demikian dapat disimpulkan bahwa pengukuran akan memberikan hasil yang reprodusibel bila diukur pada menit ke-30 sampai 60. 2. Penentuan Panjang Gelombang Serapan Maksimum (λ maks)
Penentuan panjang gelombang maksimum bertujuan untuk mendapatkan panjang gelombang yang akan digunakan untuk mengukur nilai serapan pada sampel. Pada panjang gelombang maksimum inilah DPPH akan memberika n serapan yang maksimum. Penentuan panjang gelombang maksimum ini menggunakan 3 konsentrasi larutan DPPH, yaitu 0,020; 0,040; dan 0,060 mM. Setiap konsentrasi akan memberikan nilai serapan yang berbeda pada panjang
gelombang maksimum. Nilai serapan yang berbeda pada panjang gelombang maksimum ini merepresentasikan penggunaan ketiga konsentrasi yang berbeda dalam penenentuan panjang gelombang maksimum. Penentuan panjang gelombang maksimum dilakukan pada rentang panjang gelombang 400-600 nm.
Tabel III. Hasil scanning panjang gelombang serapan maksimum DPPH
Dari tabel dapat dilihat bahwa panjang gelombang maksimum yang didapat adalah 515 nm, yang merupakan rata-rata dari ketiga panjang gelombang dari 3 konsentrasi yang berbeda. Hasil yang didapatkan berbeda 2 nm dengan panjang gelombang maksimum teoritis, yaitu 517 nm. Perbedaan selisih antara panjang gelombang maksimum uji dengan panjang gelombang maksimum teoritis ini masih diperbolehkan menurut Farmakope Indonesia IV (1995), dimana pergeseran panjang gelombang yang diperbolehkan yaitu 2 nm dari batas yang ditentukan.
G. Hasil Uji Aktivitas Antioksidan
suatu senyawa radikal nitrogen yang tidak stabil karena mempunyai elektron bebas yang tidak berpasangan yang mengakibatkan DPPH mempunyai sifat reaktif. DPPH yang direaksikan dengan senyawa
Gambar 6. Reaksi antara senyawa antioksidan dengan DPPH (Li, Xu, dan Chen, 2014).
antioksidan, dalam penelitian ini adalah ekstrak kulit buah nanas, akan mengikat atom H dari senyawa antioksidan sehingga menyebabkan terjadinya delokalisas i elektron. Hal inilah yang menyebabkan DPPH menjadi stabil karena adanya donor elektron dari senyawa antioksidan. Peristiwa tersebut yang menyebabkan sifat DPPH sebagai radikal bebas menurun.
Gambar 7. Kurva persamaan regresi linear rutin
Pengukuran aktivitas antioksidan pada metode DPPH ini menggunaka n parameter IC50. IC50 merupakan konsentrasi senyawa uji yang diperlukan untuk menghambat senyawa radikal bebas sebesar 50%. Menurut Zou, Lu, dan Wei (2004), nilai IC50 ini didapatkan dari persamaan regresi linier yang menyatakan adanya hubungan konsentrasi senyawa uji dengan persen aktivitas antioksidan yang ditimbulkan. Hubungan antara aktivitas antioksidan dengan IC50 mempunya i korelasi berbanding terbalik. Semakin kecil nilai senyawa uji IC50, semakin besar aktivitas antioksidan dari senyawa tersebut.
Dari tabel IV dapat dilihat bahwa semakin tinggi konsentrasi rutin, semakin kecil nilai absorbansi yang dihasilkan. Hal ini sebanding dengan besarnya persen aktivitas antioksidan yang ditimbulkan, karena semakin banyaknya pendonor atom untuk radikal DPPH yang membuat DPPH menjadi lebih stabil.
Tabel IV. Hasil aktivitas antioksidan rutin dengan
Persamaan regresi linear dan perhitungan IC50 ekstrak kulit buah nanas ditunjukkan pada tabel V. Dari tabel dapat dilihat bahwa semakin tinggi konsentrasi ekstrak kulit buah nanas yang digunakan semakin tinggi persen aktivitas antioksidannya. Konsentrasi yang digunakan pada ekstrak kulit buah nanas lebih tinggi daripada konsentrasi rutin. Hal ini untuk mendapatkan rentang nilai absorbansi yang masuk dalam rentang 0,2-0,8.
Persamaan regresi linear yang telah didapatkan digunakan untuk menghitung nilai IC50 dari masing- masing replikasi. Perhitungan nilai IC50 rutin dan ekstrak kulit buah nanas ditunjukkan pada tabel VI.
Tabel VI. Hasil perhitungan nilai IC50 rutin dan ekstrak kulit buah nanas
Secara berturut-turut, nilai IC50 yang didapat dari ketiga replikasi adalah 4893,4 g/mL, 4914,2 g/mL, dan 4858,6 g/mL, dengan rerata (4888,733 ±
28,744) g/mL. Hal ini jika dibandingkan dengan penelitian dari Hatam, Suryanto
g/mL. Hal yang menyebabkan perolehan nilai IC50 pada penelitian ini sangat
tinggi masih belum dipahami oleh peneliti.
Uji statistik dilakukan setelah mendapatkan nilai IC50. Uji statistik ini digunakan untuk memastikan kebermaknaan nilai IC50 rutin dengan nilai IC50 ekstrak kulit buah nanas. Uji statistik menggunakan software R seri i386 3.0.2. Uji pertama adalah uji normalitas data. Uji ini dilakukan untuk melihat apakah data terdistribusi normal atau tidak. Uji normalitas ini juga yang akan menentukan jenis uji yang akan digunakan selanjutnya. Apabila jumLah data kurang dari 50, maka digunakan uji normalitas Saphiro-Wilk (Dahlan, 2012).
Hasil uji statistik menunjukkan nilai p-value untuk IC50 rutin adalah 0,568 dan nilai p-value untuk IC50 ekstrak kulit buah nanas adalah 0,5605. Kedua data IC50 mempunyai nilai p-value lebih besar dari 0,05 (taraf kepercayaan 95%). Hal ini menunjukkan nilai signifikansi yang dihasilkan lebih besar daripada nilai signifikansi yang ditentukan. Sehingga dapat disimpulkan bahwa nilai IC50 rutin dan ekstrak kulit buah nanas terdistribusi normal.
46 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Ekstrak kulit buah nanas mempunyai aktivitas antioksidan dengan nilai IC50 sebesar (4869,3 ± 28,2744) μg/mL.
2. Kadar enzim bromelain dalam ekstrak kulit buah nanas yang dihitung terhadap BSA sebesar (7,8233 ± 0,1096) % b/b.
B. Saran
1. Perlu dilakukan penelitian lebih lanjut mengenai penetapan kadar enzim bromelain dari kulit buah nanas dengan menggunakan standar bromelain.
47
DAFTAR PUSTAKA
Ames, B.N., Shigenaga, M.K., and Hagen, T.M., 1993, Oxidants, antioxidants, and the degenerative diseases of aging, Proc. Natl. Sci., California, pp. 7915-7922.
Ahmed, H., 2005, Principles and Reactions of Protein Extraction, Purification, and Characterization, CRC Press, Florida, pp. 35-42.
Ali, A.A., Milala, M.A., and Gulani, I.A., 2015, Antimicrobial Effect of Crude Bromelain Extracted from Pineapple Fruit (Ananas comosus (Linn.) Merr.), Advances in Biochemistry, 3, 1-4.
Backer, C.A., and Backuizen van Den Brink, Jr. R.C., 1963, Flora of Java, Vol. I, 40-56, N.V.P. Noordhoff-Gromingen, The Netherlands.
Backer, C.A., and Backuizen van Den Brink, Jr. R.C., 1963, Flora of Java, Vol. III, 26-33, N.V.P. Noordhoff-Gromingen, The Netherlands.
Bartholomew, D.P., Paull, R.E., and Rohrbach, K.G., 2002, The Pineapple: Botany, Production and Uses, CABI Publishing, Wallingford, p. 113.
Bhattacharyya, B.K., 2008, Bromelain: An Overview, Natural Product Radiance, 7(4), 359-363.
Bolton, S., and Bon, C., 2010, Pharmaceutical Statistics: Practical and Clinical Applications, Informa Healthcare, New York, pp. 82-106
Bottom, C.B., Hanna, S.S., and Siehr, D.J., 1978, Mechanism of the Ninhydrin Reaction, Biochemical Education, 6(1), 4-5.
Bresolin, I.R.A.P., Bresolin, I.G.L., Silveira, G., Tambourgi, E.B., and Mazzola, P.G., 2013, Isolation and Purification of Bromelain from Waste Peel of Pineapple for Therapeutic Application, Brazilian Archives of Biology and Technology, Vol.56, n.6: pp. 971-979
Chaisawvong, N., and Sangsrichan, S., 2009, Antioxidant and Radical Scavenging Activity of Herbal Medicine Samples, Pure and Applied Chemistry International
Conference, 42-44.
da Silva DIS, Nogueira GDR, Duzzioni AG, Barrozo MAS. 2013. Changes of antioxidant constituents in pineapple (Ananas comosus) residue during drying process. Indust Crops Prod 50: pp. 557–62.
de Simon, B. F., Perez-Ilzarbe, J., Hernandez, T., Gomez-Cordoves C and Estrella, I. (1992), Importance of phenolic compounds for the characterization of fruit juices, J Agric Food Chem, 40, pp. 1531-1535.
Dahlan, 2012, Statistik untuk Kedokteran dan Kesehatan, Salemba Medika, Jakarta, hal. 17
Davidek, 1997, in Macek, K., 1972, Pharmaceutical Applications of Thin Layer Chromatography, Elseiver Publishing Company, Amsterdam, London, New York, pp. 569, 608-611
Dehpour, A.A., Ebrahimzadeh, M.A., Fazel, N.S., and Mohammad, N.S., 2009, Antioxidant Activity of Methanol Extract of Ferula Assafoetida and Its Essential Oil Composition, Grasas Aceites, 60(4), 405-412.
Dennison, C., 2003, A Guide to Protein Isolation, Springer International Publishing, New York, pp. 84-88.
Depkes RI, 1995, Farmakope Indonesia, Edisi IV, Departemen Kesehatan Republik Indonesia, Jakarta, pp, 7, 1036, 1061.
Englard, S. and Seifter, S., 1990, Precipitation techniques. in: Guide to protein purification, Eds. Deutscher, M.P., Academic Press, San Diego, USA Erukainure OL, Ajiboye JA, Okafor OY, Kosoko SB, Owolabi FO, Adenekan SO.
Antioxidant effect of pineapple (Ananas cosmosus) peel extract on alcohol induced oxidative stress in splenic tissues of male albino rats, J Food Biochem, 2012; 36:643–7
Fessenden, R.J. dan Fessenden, J.S., 1995, Kimia Organik, Jilid II, edisi 3, Penerbit Erlangga, Jakarta, pp. 119-210.
Gharavi,N,. Haggarty,S., dan El-Kdai, A.O.S., 2007, Chemoprotective and carcinogenic Effect of tert-Butylhydroquinone and Its Metabolites, Current Drug Metabolism, 8, 1-7
Gulcin, I., Uguz, M. T., Oktay, M., Beydemir, S., & Kufrevioglu, O. I. (2004). Evaluation of the antioxidant and antimicrobial activities of clary sage (Salvia sclarea L.). Turkish Journal of Agriculture and Forestry, 28, 25–33 Halliwell, B., 2012, Free Radicals and Antioxidant: Updating a Personal View,
Nutrition Review, 70, 257-265.
Halliwell, B., and Gutteridge, J.M.C., 2000, Free Radical in Biology and Medicine, Oxford University Press, New York, p. 34.
Hatam, S.F., Suryanto, E., dan Abidjulu, J., 2013, Aktivitas Antioksidan dari Ekstrak Kulit Nanas (Ananas comosus (L.) Merr), Jurnal Ilmiah Farmasi, Vol. 2:01, hal. 2302-2493.
Hossain MA, Rahman SM. 2011. Total phenolics, flavonoids and antioxidant activity of tropical fruit pineapple. Food Res Intl 44(3):672–6.
Ishihara, H., Takahashi, N., Oguri, S., dan Tejima, S., 1979, Complete Structure of the Carbohydrate Moiety of Stem Bromelain, The Journal of Biological Chemistry, pp. 10715-10719
Kedare, S.B., and Singh, R.P., 2011, Genesis and Development of DPPH Method of Antioxidant Assay, Journal of Food, Science, and Technology, 48(4), 412-422.
Ketnawa, S., Rawdkuen, S., and Chaiwut, P., 2010, Two Phase Partitioning and Collagen Hydrolysis of Bromelain from Pineapple Peel Nang Lae Cultivar, Biochemical Engineering Journal, 52(2010), 205-211.
Li, X., Xu, M., dan Chen, D., 2012, Protective Effect Against Hydroxyl-Induced DNA Damage and Antioxidant Activity of Radic bupleuri In Vitro, Spatula DD, 2(4), pp. 219-227
Manosroi, A., Chankhampan, C., Pattamapun, K., Manosroi, W., and Manosroi, J., 2014, Antioxidant and Gelatinolytic Activities of Papain from Papaya Latex and Bromelain from Pineapple Fruits, Chiang Mai J. Sci., 41(3), 635-648. Maurer, H.R., 2001, Bromelain: biochemistry pharmacology, and medical use.
Cellular and Molecular Life Science, 58 1234-1245.
Molyneux, P., 2004, The Use of The Stable Free Radical Diphenylpicrylhydrazil (DPPH) for Estimating Antioxidant Activity, Songklanakarin J. Sci. Technol., 26(2), 211-219
Morales-Gonzalez, J.A., 2013, Oxidative Stress and Chronic Degenerative Diseases: a Role for Antioxidants, Intech Publisher, Croatia, pp. 39-41.
Mulja, H.M., dan Suharman, 1995, Analisis Instrumental, Airlangga University Press, Surabaya, pp.26-33.
Ou, B., Huang, D.J., Woodill, M.H., Flanagan, J.A., and Deemer, E.K., 2002, Analysis of Antioxidant Activities of Common Vegetables Employing Oxygen Radical Absorbance Capacity (ORAC) and Ferric Reducing Antioxidant Power (FRAP) Assays: A Comparative Study, J. Agric. Food Chem., 50, 3122-3128.
Panda, H., 2000, Herbal Cosmetics Hand Book, Asia Pasific Business Press, New Delhi, pp. 525-526
Pendzhiev, A.M., 2002, Proteolytic Enzymes of Papaya: Medicinal Applications, Pharmaceut. Chem. J., 36, 315-317.
Prakash, A., Rigelhof, F., and Miller, E., 2001, Antioxidant Activity: Medallion Laboratories, Analithycal Progress, 19(2), 1-4.
Rukmana, 1996, Nanas Budidaya dan Paskapanen, Penerbit Kanisius, Yogyakarta, pp. 75-76.
Sastrohamidjojo, H., 2001, Spektroskopi, Penerbit Liberti, Yogyakarta, hal 1-43. Soares, P.A.G., Vaz, A.F.M, Correia, M.T.S., Pessoa, A., and Carneiro-da-Cunha,
M.G., 2012, Purification of Bromelain from Pineapple Wastes by Ethanol Precipitation, Separation and Purification Technology, 98, 389-395. Tjitrosoepomo, G., 1994, Taksonomi Tumbuhan Obat-Obat, 113, Universitas
Gadjah Press, Yogyakarta.
van Lelyveld, L.J., and de Bruyn, J.A., (1977), polyphenols ascorbic acid and related enzyme activites associated with black heart in Cayenne pineapple fruit, Agrochemophysica, 9, 1-6
LAMPIRAN
Lampiran 3. Perhitungan rendemen
Bobot masing-masing kulit buah nanas yang digunakan adalah 70 gram, sehingga total bobot kulit buah nanas yang digunakan adalah 210 gram.
Cawan 1 (g) Cawan 2 (g) Cawan 3 (g)
Berat cawan 35,5880 38,3940 34,6945
Berat cawan +
ekstrak 55,2464 30,4336 35,8174
Berat ekstrak 1,1005 1,0897 1,1097
Total berat ekstrak kulit buah nanas = 1,1005 g + 1,0897 g + 1,1097 g = 3,2999 g
Rendemen ekstrak kulit buah nanas = � �
ℎ � �� × %
= , � � × %
Lampiran 4. Penimbangan analisis kualitatif
a. Data penimbangan ekstrak kulit buah nanas
Replikasi 1 (g) Replikasi 2 (g) Replikasi 3 (g) Berat wadah 14,6535 13,5859 14,7843 Berat wadah + sampel 14,9091 13,5882 15,0355 Berat wadah + sisa 14,6550 13,8373 14,7868
Berat sampel 0,2541 0,2514 0,2487
b. Data penimbangan ninhidrin
Ninhidrin
Berat wadah 13,5739
Berat wadah + sampel 13,9238
Berat wadah + sisa 13,5744
Berat sampel 0,3494
Lampiran 5. Data penimbangan penetapan kadar protein total
Replikasi 1 (g) Replikasi 2 (g) Replikasi 3 (g) Berat wadah 25,8160 14,2743 23,7527 Berat wadah + sampel 26,0672 14,5256 24,0039 Berat wadah + sisa 25,8164 14,2751 23,7534
Lampiran 6. Optimasi penetapan kadar protein total
a. Penentuan operating time (OT) bovine serum albumine pada λ = 280 nm
Waktu (Menit) Absorbansi konsentrasi 400 µg/ml
Replikasi 1 Replikasi 2 Replikasi 3
5 0,271 0,268 0,270
OT yang diperoleh 5 menit
Waktu (Menit) Absorbansi konsentrasi 700 µg/ml
Replikasi 1 Replikasi 2 Replikasi 3
5 0,475 0,477 0,478
OT yang diperoleh 5 menit
Waktu (Menit) Absorbansi konsentrasi 1000 µg/ml
Replikasi 1 Replikasi 2 Replikasi 3
5 0,680 0,683 0,681
b. Penentuan λ maksimum bovine serum albumine 1. Spektra bovine serum albumine 400 µg/ml
Lampiran 7. Penetapan kadar protein total
a. Konsentrasi bovine serum albumine
1. Konsentrasi larutan induk bovine serum albumine
Replikasi V1
2. Konsentrasi seri larutan bovine serum albumine
b. Kurva baku bovine serum albumine
Replikasi Konsentrasi (µg/ml) Absorbansi Persamaan regresi linear
Persamaan regresi linear yang digunakan adalah y = 0,0006833x – 0,000533
c. Penetapan kadar protein total larutan uji 1. Konsentrasi ekstrak kulit buah nanas
Replikasi 3 ���� � � =
5 ,5 �
5 = µg/ml
2. Absorbansi ekstrak kulit buah nanas
Replikasi Absorbansi
1 0,545
2 0,531
3 0,531
3. Konsentrasi dan bobot enzim ekstrak kulit buah nanas Replikasi 1
Persamaan regresi linear y = 0,0006833x – 0,000533 0,545 = 0,0006833x – 0,000533 x = 798,380 µg/ml
massa = konsenstrasi x volume
massa = konsentrasi x volume
massa = konsentrasi x volume
= 777,891 x 25 = 19447,27 µg = 19,44 mg
Replikasi
Lampiran 8. Penimbangan pengujian aktivitas antioksidan
a. Data penimbangan DPPH
Replikasi 1 (g) Replikasi 2 (g) Replikasi 3 (g) Berat wadah 14,2743 13,5727 13,5835 Berat wadah + sampel 14,2902 13,5885 13,5996 Berat wadah + sisa 14,2744 13,5727 13,5837
Berat sampel 0,0158 0,0158 0,0159
b. Data penimbangan rutin
Replikasi 1 (g) Replikasi 2 (g) Replikasi 3 (g) Berat wadah 14,2743 13,5727 13,5835 Berat wadah + sampel 14,2793 13,5779 13,5885 Berat wadah + sisa 14,2743 13,5729 13,5836
c. Data penimbangan ekstrak kulit buah nanas
Replikasi 1 (g) Replikasi 2 (g) Replikasi 3 (g) Berat wadah 14,3645 23,8360 20,5345 Berat wadah + sampel 14,6155 24,0875 20,7858 Berat wadah + sisa 14,3650 23,8375 20,5358
Berat sampel 0,2505 0,2500 0,2500
b. Konsentrasi rutin
1. Konsentrasi larutan induk Replikasi 1
c. Konsentrasi ekstrak kulit buah nanas 1. Konsentrasi larutan induk
Replikasi 1
Lampiran 10. Optimasi metode uji aktivitas antioksidan
a. Penentuan operating time (OT) rutin pada λ = 517 nm
Waktu (Menit) Absorbansi konsentrasi 5 µg/ml
Replikasi 1 Replikasi 2 Replikasi 3
5 0,812 0,811 0,816
OT yang diperoleh 30 menit
Waktu (Menit) Absorbansi konsentrasi 15 µg/ml
Replikasi 1 Replikasi 2 Replikasi 3
5 0,681 0,689 0,680
Waktu (Menit) Absorbansi konsentrasi 25 µg/ml
Replikasi 1 Replikasi 2 Replikasi 3
5 0,518 0,503 0,510
10 0,501 0,511 0,499
15 0,493 0,483 0,463
20 0,453 0,451 0,438
25 0,429 0,426 0,409
30 0,398 0,408 0,410
35 0,397 0,394 0,399
40 0,397 0,381 0,394
45 0,393 0,381 0,389
50 0,389 0,375 0,386
55 0,386 0,372 0,382
60 0,380 0,369 0,375
OT yang diperoleh 30 menit
b. Penentuan λ maksimum