DAN MENGHASILKAN IAA (INDOLE-3-ACETIC ACID)
SKRIPSI
RISKA ANNISA PUTRI BR. SITEPU 170805085
PROGRAM STUDI BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2021
DAN MENGHASILKAN IAA (INDOLE-3-ACETIC ACID)
SKRIPSI
Diajukan untuk memenuhi syarat mencapai gelar Sarjana Sains
RISKA ANNISA PUTRI BR. SITEPU 170805085
PROGRAM STUDI BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN
2021
i
ii
POTENSI Rhizobium ISOLAT Mucuna bracteata DC. DALAM MENGHAMBAT PERTUMBUHAN Ganoderma boninense Pat.
DAN MENGHASILKAN IAA (INDOLE-3-ACETIC ACID)
ABSTRAK
Upaya pengendalian penyakit busuk pangkal batang pada kelapa sawit yang disebabkan oleh jamur Ganoderma boninense terus dilakukan antara lain dengan memanfaatkan agen pengendalian hayati yang bersifat antagonis terhadap jamur G.
boninense seperti Rhizobium yang terdapat pada tanaman Mucuna bracteata.
Penelitian ini bertujuan untuk mendapatkan jenis Rhizobium dari bintil akar M.
bracteata yang berpotensi antagonis terhadap G. boninense, mengetahui mekanisme antagonis dan kemampuan menghasilkan zat pengatur tumbuh IAA (Indole-3-Acetic Acid). Rhizobium diisolasi dari bintil akar tanaman M. bracteata dari perkebunan sawit daerah Aek Pancur provinsi Sumatera Utara. Bakteri diisolasi dengan memecah bintil akar dan menumbuhkannya pada media spesifik Yeast Extract Mannitol Agar (YEMA). Isolat bakteri yang diperoleh kemudian dikarakterisasi dan diidentifikasi secara molekuler lalu duji kemampuan antagonisnya terhadap G. boninense, dipelajari mekanisme antagonis, serta kemampuan menghasilkan IAA. Hasil isolasi bakteri dari bintil akar M. bracteata diperoleh sebanyak 3 isolat yang menunjukkan karakter sebagai bakteri dari genus Rhizobium. Identifikasi secara molekuler menunjukkan bahwa ketiga isolat tersebut benar Rhizobium dengan persentase kesamaan yang tinggi dengan Rhizobium sp. Strain J007 yaitu sebesar 97-98%. Namun, diduga merupakan jenis Rhizobium leguminosarum strain SmrVr -115 berdasarkan hasil konstruksi pohon filogenetik. Uji antagonis ketiga bakteri Rhizobium tersebut terhadap G. boninense menghasilkan persentase hambatan miselium sebesar 43,33%-66,7%. Ketiga Rhizobium menunjukkan mekanisme penghambatan terhadap G. boninense berupa produksi senyawa antijamur dengan persentase 11,67-27% dan produksi enzim glukanolitik dengan indeks glukanolittik 0,25-0,4. Namun, tidak ditemukan kemampuan kitinolitik. Ketiga Rhizobium mampu menghasilkan IAA dengan konsentrasi IAA 1,166-23,66.
Kata Kunci: Ganoderma boninense, Kelapa Sawit, Mucuna bracteata, Rhizobium,
iii
THE POTENCY OF Rhizobum ISOLATED FROM Mucuna bracteata DC. INHIBITING GROWTH Ganoderma boninense Pat.
AND PRODUCING INDOLE-3-ACETIC ACID (IAA)
ABSTRACT
Efforts to control basal stem rot disease of oil palm caused by Ganoderma boninense are still continued to be carried out, i.e by application of antagonistic biological control agents against G. boninense, such as Rhizobium. The aim of this study was to obtain the antagonistic species of Rhizobium from root nodules of Mucuna bracteata against G. boninense, to determine their antagonistic mechanisms and their potency to produce Indol acetic acid (IAA) growth regulator Rhizobium was isolated from the root nodules of M. bracteata that was cultivated in Aek Pancur oil palm plantations, in North Sumatra province. Rhizobium isolated from root nodules by breaking-out the nodules and then cultivated it on specific medium of Yeast Extract Mannitol Agar (YEMA). The isolated bacterial were characterized and identified molecularly, find out their antagonistic activity and mechanisms against G. boninense, and their ability to produce IAA. The results showed that isolation and characterization of bacteria from root nodules of M. bracteata were obtained 3 candidates isolates of Rhizobium. Molecular identification showed that the three isolates were positive species of Rhizobium with a high percentage of similarity index with Rhizobium sp. Strain J007 was 97-98%. However, it is suspected to be a type of Rhizobium leguminosarum strain SmrVr -115 based on the results of the phylogenetic tree construction. The antagonistic test of three species of Rhizobium against G.
boninense with dual culture test resulted in the percentage of mycelium inhibition value in a range of 43.33%-66.7%. The antagonistic mechanisms of 3 species of Rhizobium against G. boninense were shown by producing antifungal compounds with the percentage 11,67-27% glucanolytic mechanisms with the index of glunacanolitics 0,25-0,4. but none of chitinolytic activity. All species of Rhizobium are able to produce IAA with the concentration of IAA 1,166-23,66.
Keywords: Ganoderma boninense, Mucuna bracteata, Oil palm, Rhizobium,
iv PENGHARGAAN
Puji dan syukur atas kehadirat Tuhan Yang Maha Esa karena rahmat-Nya penulis dapat menyelesaikan penelitian dan penulisan skripsi yang berjudul Potensi Rhizobium Isolat Mucuna bracteata DC. Dalam Menghambat Pertumbuhan Ganoderma boninense Pat. dan Menghasilkan IAA (Indole-3-Acetic Acid)
Pada kesempatan ini penulis ingin mengucapkan terimakasih yang sebesar- besarnya kepada Ibu Dr. Yurnaliza, S.Si., M.Si dan Bapak Fandi Hidayat M.Sc Selaku Dosen Pembimbing dan kepada Bapak Prof. Dr. Erman Munir, M.Sc selaku Dosen Penguji 1 dan Ibu Liana Dwi Srihastuti M.Si., Ph.D selaku Dosen Penguji 2 yang telah meluangkan waktu dan tenaganya selama penyusunan skripsi ini. Terimakasih kepada Ibu Dr. Yurnaliza S.Si., M.Si dan Bapak Riyanto Sinaga, S.Si., M.Si selaku ketua program studi dan sekretaris program studi Biologi FMIPA USU beserta staf administrasi Departemen yang telah membantu penulis dalam masa perkuliahan hingga mampu menyelesaikan skripsi ini. Penulis juga mengucapkan terima kasih kepada dekan FMIPA USU beserta seluruh wakil dan staf administrasinya.
Penulis mengucapkan terima kasih kepada orang tua tercinta, ayah saya Iman Rudiansyah Rizal Sitepu S.E dan ibu saya Alm. Dra. Seniati Anitha Susila, Ibuk saya Shandra Himalaya M,M. , Om saya Toto Djoediatmoko M.M. Abang saya Rian Ifky Nanda Sitepu, dan adik-adik saya Anindya Chandra Faizah, Nailah Yudi Permata yang senantiasa memberikan kasih sayang sepenuh hati dan dorongan semangat serta selalu mendoakan penulis agar menyelesaikan penulisan skripsi.
Ucapan terima kasih kepada sahabat satu penelitian saya (Hasmilah, Kiki, Gita, Melin, dan Natasya) yang selalu setia menemani dan memberikan semangat dalam mengerjakan penelitian ini dan terimaksih kepada teman-teman stambuk 17 (Biochrome) atas segala motivasi selama masa perkuliahan. Terima kasih juga penulis ucapkan kepada sahabat-sahabat tercinta” Hamba Allah” (Sipo, Dewi, Oky, Sheila, Chae. Suci, Haniyah) dan teman seperjuangan saya Fajar Shiddiq yang tak henti- hentinya memberikan dorongan semangat, bantuan, doa, dan motivasi kepada penulis agar dapat menyelesaikan penelitian dan penulisan skripsi.
v Penulis menyadari sepenuhnya bahwa masih terdapat begitu banyak kekurangan dan kesalahan dalam penulisan skripsi ini. Oleh karena itu, penulis memohon maaf atas segala kekurangan yang sekiranya terdapat pada skripsi ini. Oleh karena itu, penulis memohon maaf atas segala kekurangan yang sekiranya terdapat pada skripsi ini, serta memohon segala jenis kritik dan saran yang bersifat membangun demi pematangan dan penyempurnaan penulisan hasil penelitian ini, karena sejatinya kesalahan adalah awal dari kesempurnaan. Terima kasih banyak atas segala perhatian dari pembaca.
Medan, Desember 2021
Riska Annisa Putri Br. Sitepu
vi DAFTAR ISI
Halaman LEMBAR PENGESAHAN
ABSTRAK
I ii ABSTRACT
PENGHARGAAN DAFTAR ISI DAFTAR TABEL DAFTAR GAMBAR DAFTAR LAMPIRAN DAFTAR SINGKATAN
iii
iv
vi
viii
ix
x
xi BAB 1 PENDAHULUAN 1.1 Latar Belakang 1 1.2 Permasalahan 3 1.3 Hipotesis 3 1.4 Tujuan Penelitian 3 1.5 Manfaat Penelitian 3 BAB 2 TINJAUAN PUSTAKA 2.1 Kelapa Sawit dan Permasalahannya 4
2.2 Jamur Patogen Ganoderma boninense 6
2.3 Pengendalian Penyakit BPB Kelapa Sawit 6
2.4 Mucuna bracteata 8
2.5 Bakteri Rhizobium dan Manfaatnya 2.6 Kemampuan Antijamur Bakteri Rhizobium 9
10
BAB 3 METODE PENELITIAN 3.1 Waktu dan Tempat 12
3.2 Bahan Penelitian 12
3.3 Koleksi Bintil Akar dan isolasi Rhizobium 12
3.4 Karakterisasi Rhizobium 13
3.5 Identifikasi Molekuler Rhizobium 14
3.6 Kemampuan Antagonis Rhizobium Terhadap Ganoderma boninense 3.7 Mekanisme Antagonis Bakteri Rhizobium 14
14
3.7.1 Kemampuan Produksi Senyawa Antijamur 15
3.7.2 Kemampuan Kitinolitik 15
3.7.3 Kemampuan Glukanolitik 3.8 Produksi Indole-3- Acetic Acid BAB 4 HASIL DAN PEMBAHASAN 4.1 Isolasi Bakteri Rhizobium 16
16
17
vii 4.1.1 Karakter Morfologi
4.1.2 Pewarnaan Gram Bakteri
4.1.3 Karakter Isolat Pada Medium Selektif
4.2 Identifikasi Molekuler Rhizobium
4.3 Seleksi Kemampuan Antagonis Rhizobium Terhadap G. boninense
4.4 Mekanisme Antagonis Rhizobium Terhadap G. boninense 4.4.1 Produksi Senyawa Antijamur
4.4.2 Kemampuan Kitinolitik dan Glukanolitik
4.5 Produksi Indole-3-Acetic Acid BAB 5 KESIMPULAN DAN SARAN 5.1 Kesimpulan
5.2 Saran DAFTAR PUSTAKA LAMPIRAN
17 18 19
21
25
27
27 28
30
32
32 33 39
viii DAFTAR TABEL
Nomor Tabel
Judul Halaman
4.1 4.2 4.3
4.4 4.5 4.6 4.7
4.8
4.9
4.10
Karakteristik Morfologi Koloni dari Bintil Akar Mucuna bracteata
Bentuk Sel Bakteri dan Sifat Pewarnaan Gram dari Bakteri Isolat Bintil Akar Mucuna bracteata
Karakter Pertumbuhan Bakteri Isolat Bintil Akar Mucuna bracteata pada Medium Selektif YEMA+CR dan YEMA+BTB Waktu Inkubasi 2 Hari
BlastN Isolat MB1AP1 BlastN Isolat MB2AP1 BlastN Isolat MB3AP2
Persentase Hambatan Miselium Ganoderma boninense oleh Rhizobium Pada Medium PDA+Yeast extract Umur 5 Hari dan Suhu ±28℃
Persentase Hambatan Miselium Ganoderma boninense Ektrak Etil Asetat Oleh Isolat Bakteri Rhizobium selama 24 Jam dengan Suhu ±28℃
Indeks Kitinolitik dan Glukanolitik oleh Bakteri Rhizobium Masa Inkubasi Kitinolitik Selama 5 Hari dan Glukanolitik selama 48 Jam dengan ±28℃
Konsentrasi IAA yang Dihasilkan Oleh Bakteri Rhizobium
17 18
19
22 22
23 25
27
29
30
ix DAFTAR GAMBAR
Nomor Gambar
Judul Halaman
2.1 2.2 3.1 4.1 4.2 4.3
4.4 4.5
4.6
4.7 4.8
Kelapa Sawit yang Terserang Ganoderma boninense Mucuna bracteata
Bintil Akar Mucuna bracteata
Koloni Bakteri yang Berwarna Merah dan Putih pada Media YEMA+CR Selama 48 Jam dengan Suhu ±28℃
Koloni Bakteri yang Berwarna Kuning pada Media YEMA+BTB Selama 48 Jam dengan Suhu ±28℃
Visualisasi Hasil Amplifikasi Gen 16S rRNA Isolat MB1AP1, MB2AP2, dan MB3AP2 pada konsentrasi 1%
gel agarosa
Pohon Filogenetika Berdasarkan Perbandingan Sekuens 16S rRNA
Uji Antagonis Bakteri Rhizobium Umur Lima Hari Terhadap G. boninense pada Medium PDA+Yeast Extract yang Diinkubasi Selama 5 Hari Pada Suhu ±28℃
Zona Hambat yang Terbentuk dari Produksi Senyawa Antijamur Ekstrak Etil Asetat pada Medium YEM (Yeast Extract Mannitol) Selama 48 Jam Pada Suhu ±28℃
Zona Bening yang Dihasilkan Bakteri Rhizobium
Perubahan Warna Supernatant Sebelum dan Sesudah Diberi Reagen Salkowski
5 9 13 20 21 21
24
26 28
29 31
x DAFTAR LAMPIRAN
Lampiran Judul Halaman
1 2 3 4 5
Komposisi Media dan Reagen
Mucuna bracteata, Bintil Akar Mucuna bracteata, dan Ganoderma boninense
Dokumentasi Penelitian Kurva Standar IAA Surat Tugas
38 40 41 51 52
xi DAFTAR SINGKATAN
BTB = Bromothymol Blue
CGI = Colony Growth Inhibition
CR = Congo Red
DMSO = Dimethyl Sulfoxide DZB = Diameter Zona Bening IAA = Indole Acetic Acid IG = Indeks Glukanolitik NaCl = Natrium Klorida
PPKS = Pusat Penelitian Kelapa Sawit PDA = Potato Dextrose Agar
YEMA = Yeast Extract Mannitol Agar
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Kelapa sawit merupakan komoditas perkebunan unggulan dan utama di Indonesia. Produk utama tanaman ini adalah minyak sawit dan minyak inti sawit yang memiliki nilai ekonomis tinggi dan menjadi salah satu penyumbang devisa negara yang terbesar (Fauzi, 2012). Upaya peningkatan produksi kelapa sawit dilakukan dengan memperluas areal dan perbaikan manajemen perkebunan. Dalam manejemen perkebunan, jumlah dan mutu minyak sawit yang dihasilkan menjadi hal yang perlu diperhatikan dan dijaga. Produksi minyak sawit seringkali mengalami penurunan, dan salah satu penyebabnya adalah tingginya serangan jamur penyakit yang menyerang kelapa sawit terutama jamur Ganoderma boninense (Setyamidjaya 2006),
Ganoderma boninense adalah jamur patogen dari kelompok Basidiomycota yang menyebabkan penyakit Busuk Pangkal Batang (BPB). G. boninense dapat hidup pada sisa tanaman mati (saprofit fakultatif) dengan memanfaatkan sisa-sisa tanaman berupa selulosa. Indonesia merupakan salah satu negara yang banyak menderita kerugian pada produksi kelapa sawit akibat penyakit BPB ini. Penyakit BPB ini sulit untuk dikendalikan, sebab inokulum G. boninense akan tetap berada dalam tanah sebagai saprofit jika tidak ada tumbuhan inangnya, dan jika ada tanaman kelapa sawit maka jamur ini akan berubah menjadi parasit yang sangat merugikan . Penyakit ini dilaporkan menyebabkan kerugian produksi tandan buah sawit sekitar 50-80% per ha (Susanto et al., 2005).
Upaya pengendalian penyakit BPB ini sudah banyak dilakukan antara lain secara fisik, kimia maupun biologi. Pengendalian secara fisik antara lain dengan menghilangkan bagian tanaman yang terserang (Juliarta, 2015). dan secara kimia dengan menggunakan fungisida sintetis (Susanto et al., 2005). Kedua mekanisme pengendalian ini masih kurang efektif karena selain butuh biaya yang besar, juga bersifat merusak lingkungan. Menurut (Simanjuntak et al., 2013) Penggunaan bahan kimia sintetik dapat menyebabkan tanah mengeras, gangguan kesehatan, musnahnya mikroorganisme, serta pencemaran air. Alternatif pengendalian yang banyak
dilakukan adalah secara biologis dengan menggunakan agen hayati mikroorganisme.
Mikroorganisme yang sudah pernah dicoba antara lain Stenotrophomonas rizophila (Rupaedah et al., 2018)., Bacillus subtilis (Ilyas et al., 2017). Pseudomonas aeuruginosa dan bakteri endofit lain yang mengandung senyawa-senyawa metabolit sekunder seperti phenazine, oomycin, hidrogen sianida dan pyoverdin (Chin-A-Woeng et al., 2003).Upaya lain masih terus dilakukan antara lain dengan memanfaatkan organisme yang terdapat pada tanaman lain yang ada di kebun kelapa sawit seperti Mucuna bracteata.
Mucuna bracteata merupakan legume Cover Crop (LCC) yang banyak ditanam di lahan kelapa sawit sebagai tanaman penutup lantai kebun dan juga dijadikan sebagai pupuk hijau. Pada akar tanaman M. bracteata terdapat bintil akar yang merupakan simbiosis dengan akar dengan bakteri Rhizobium. M. bracteata di kebun kelapa sawit juga dimanfaatkan untuk menekan pertumbuhan gulma dan meningkatkan ketersediaan carbon dan nitrogen dalam tanah, serta mengurangi laju erosi di areal penanaman (Ma’ruf 2017). Rhizobium yang terdapat pada akar M. bracteata di sekitar kelapa sawit merupakan kandidat yang menarik digunakan sebagai agen hayati.
Beberapa penelitian melaporkan bahawa Rhizobium secara signifikan dapat menghambat pertumbuhan jamur patogen seperti Macrophomina phaseolina, Rhizoctonia spp, Fusarium sp., dan Phytium spp. (Srinivasan, 2017). Senyawa antijamur dapat bekerja dengan cara mengganggu kinerja pada membran sel dan menghambat biosintesis ergosterol dalam sel jamur (Solichah, 2010).
Fungsi Rhizobium pada tanaman adalah sebagai penambat nitrogen bebas diudara. Disamping itu Rhizobium juga mampu menghasilkan hormon pertumbuhan tanaman. Yao et al., (2008) melaporkan bahwa sejumlah isolat Rhizobium sp. yang dikoleksi di China Barat Laut mampu menghasilkan IAA. Hormon IAA adalah auksin endogen yang berperan dalam pertumbuhan dan perkembangan tanaman. Hormon IAA yang dihasilkan bakteri akan masuk ke jaringan tanaman dan berpengaruh pada tanaman, salah satunya adalah penambahan jumlah rambut akar lateral tanaman auksin juga dapat mempengaruhi panjang akar dimana akar merupakan organ yang paling sensitif terhadap fluktuasi IAA (Leveau dan Lindow, 2004).
1.2 Permasalahan
Bakteri Rhizobium merupakan bakteri yang bersimbiosis dengan tanaman legume antara lain M.braceata. M. bracteata LCC yang ditanam secara sengaja di kebun kelapa sawit. Tanaman ini tumbuh meluas di kebun kelapa sawit dan dimanfaatkan sebagai pupuk hijau. Rhizobium yang bersimbiosis dengan tanaman M.
bracteata ini kemungkinan dapat dijadikan agen pengendali G. boninense yang ada di tanah sekitar perakaran kelapa sawit karena Rhizobium diketahui memiliki kemampuan antijamur. Disamping dapat menambat N, Rhizobium juga mampu menghasilkan IAA. Masalah dalam penelitian ini adalah belum diketahuinya sejauh mana potensi Rhizobium tanaman M. bracteata dapat menghambat pertumbuhan G.
boninense. dan menghasilkan IAA.
1.3 Hipotesis
Bakteri Rhizobium mampu menghambat jamur G. boninense dan menghasilkan zat pemacu pertumbuhan tanaman sejenis auksin.
1.4 Tujuan Penelitian
a. Untuk mendapatkan dan mengidentifikasi bakteri Rhizobium yang diisolasi dari akar tanaman M. bracteata
b. Untuk menguji kemampuan antagonis Rhizobium dalam menghambat pertumbuhan G. boninense.
c. Mengetahui kemampuan Rhizobium menghasilkan zat pengatur tumbuh IAA.
1.5 Manfaat Penelitian
Penelitian ini bermanfaat untuk memperoleh informasi Rhizobium yang paling berpotensi sebagai agen pengendali hayati G. boninense. dan menghasilkan zat pemacu pertumbuhan tanaman IAA
BAB 2
TINJAUAN PUSTAKA
2.1 Kelapa Sawit dan Permasalahannya
Kelapa sawit (Elaeis guineensis Jacq.) merupakan tumbuhan yang berasal dari Nigeria, Afrika Barat. Pendapat lain menyatakan bahwa kelapa sawit berasal dari Amerika, yakni Brazilia. Sehingga dapat disimpulkan bahwa kelapa sawit berasal dari daratan tersier, yang merupakan daratan penghubung dintara benua Afrika dan Amerika (Risza, 1994).
Indonesia merupakan negara produsen kelapa sawit terbesar kedua setelah Malaysia. Sebanyak 85% lebih pasar dunia kelapa sawit dikuasai oleh Indonesia dan Malaysia. Kelapa sawit merupakan komoditas perkebunan yang penting di Indonesia selain karet, kopi, kakao, dan teh. Kelapa sawit memiliki nilai yang cukup tinggi dikarenakan minyak nabati yang diperoleh dari kelapa sawit dinilai memiliki keunggulan dibandingkan minyak nabati yang diperoleh dari tanaman lain. Kelebihan minyak kelapa sawit antara lain memiliki komposisi asam lemak jenuh dan asam lemak tidak jenuh yang seimbang, memiliki kandungan omega 9, memenuhi kebutuhan lemak dalam tubuh dan minyak kelapa sawit tidak melewati proses hidrogenisasi parsial (Suriana, 2019).
Tanaman kelapa sawit dapat diolah menjadi minyak kelapa sawit yang disebut Crude Palm Oil (CPO). Produksi CPO dikabarkan sebesar 19,4 juta pada tahun 2009, dan 21,8 juta pada tahun 2010. Hal ini didukung oleh penambahan luas areal perkebunan kelapa sawit yaitu 7,9 juta hektare pada tahun 2010, dan pada tahun 2011 luas arealnya menjadi 8,2 juta hektare. Kenaikan produksi minyak sawit disebabkan oleh jumlah permintaan yang besar baik dari pasar dalam negeri maupun luar negeri, terutama pada produksi minyak goreng dan industri makanan lainnya. Ekspor CPO dari Indonesia antara lain ke Belanda, India, Cina, Malaysia dan Jerman. Selain CPO juga diproduksi PKO (Palm Kernel Oil) atau yang biasa disebut sebagai minyak inti kelapa sawit, hasil produksi kelapa sawit ini diekspor ke Belanda, Amerika Serikat, dan Brazil. ). PKO digunakan untuk produksi sabun, lemak nabati, oleokimia, dan kebutuhan lainnya (Pardamean, 2014).
Budidaya kelapa sawit terus ditingkatkan sehingga produksi minyak sawit terus meningkat. Kendala utama dalam proses budidaya sawit antara lain adalah serangan hama dan penyakit. Akibat yang ditimbulkan hama dan penyakit sangat besar.
Kematian tanaman yang terserang penyakit menyebabkan penurunan produksi. Hama dan penyakit dapat menyerang kelapa sawit mulai dari pembibitan hingga tanaman kelapa sawit siap untuk dipanen. Sebagian penyakit kelapa sawit disebabkan oleh hama yaitu serangga dan mamalia, dan sebagian lainnya disebabkan oleh kelompok mikroorganisme bakteri, jamur dan virus (Fauzi, 2008).
Salah satu penyakit yang menyerang tanaman kelapa sawit adalah busuk pangkal batang yang disebabkan oleh jamur G. boninense. Penyakit busuk pangkal batang adalah penyakit kelapa sawit yang paling merusak di Asia Tenggara. Penyakit ini dapat menginfeksi semua tahapan tanaman kelapa sawit mulai dari pembibitan hingga kelapa sawit siap untuk dipanen. Penyakit ini umumnya berkembang lambat tetapi setiap tanaman yang terinfeksi biasanya mati. Pada tahap awal infeksi tidak akan muncul gejala, gejala akan muncul pada saat tanaman sudah terifeksi parah. Gejala khas yang biasanya terlihat antara lain pembusukan pada pangkal batang sehingga akan menyebabkan busuk kering pada jaringan bagian dalam (Semangun, 2008).
Penyakit ini dikabarkan menyebar dari tanaman ke tanaman melalui sambungan akar sehingga dikatakan patogen tular tanah, walaupun beberapa kejadian dikabarkan ditularkan melalui spora yang disebarkan oleh angin (Flood, 2000). Tanaman kelapa sawit yang terinfeksi parah akhirnya akan roboh dan mati seperti yang dapat dilihat pada gambar dibawah.
Gambar 2.1 Kelapa Sawit yang roboh akibat terserang G. boninense
2.2 Jamur Patogen Ganoderma boninense
Ganoderma boninense merupakan jamur penyebab penyakit busuk pangkal batang. Pada tanaman yang sudah tua, infeksi dapat terjadi melalui kontak akar antar tanaman ataupun dari spora, sedangkan pada tanaman yang masih muda infeksi hanya dapat terjadi melalui kontak akar antar tanaman. Cara pengendalian penyakit ini antara lain pembersihan sumber dari infeksi, pencegahan penyeberan dari penyakit, penggunaan tanaman toleran, ataupun dengan menggunakan fungisida (Pahan, 2008).
Ciri lain dari jamur Ganoderma antara lain memiliki ukuran basidiokarp yang besar, abadi, dan membentuk badan buah, Basidiokarp Ganoderma terbagi atas dua jenis yaitu memiliki batang dan tidak memiliki batang, diameter tudungnya dapat berukuran 60 cm ataupun lebih, warna pileus beraneka ragam, warna pileus dipengaruhi oleh lingkungan dan usia. Ganoderma banyak ditemukan didaerah tropis dan menempel pada akar ataupun pangkal batang pohon. Ganoderma termasuk heterotrof yaitu memperoleh nutrisi dengan mengambil makanan berupa bahan organik disekitar tempat hidupnya (Surahmaida dan Sudarwati, 2018).
Jamur Ganoderma merupakan kelompok jamur poliporus dari kelas Basidiomycetes. Ganoderma mempunyai dinding sel yang tersusun atas kitin dan tidak memiliki klorofil didalam tubuhnya. Ganoderma memiliki keunikan yaitu Basidiospronya berdinding ganda oleh karena itu disebut juga dengan Bracket Fungus (Donk, 1964).
2.3 Pengendalian Penyakit BPB Kelapa Sawit
Pengendalian penyakit pada kelapa sawit khususnya penyakit BPB, di beberapa perkebunan kelapa sawit masih menggunakan bahan kimia sintetik yang berfungsi untuk menurunkan populasi mikroorganisme penyebab penyakit secara cepat. Namun, penggunaan bahan kimia yang kurang bijaksana dapat menyebabkan dampak negatif bagi lingkungan, dan justru dapat mengakibatkan hama yang resisten terhadap bahan kimia sehingga terjadi ledakan populasi hama yang dapat menurunkan produksi. Penggunaan bahan kimia juga dapat meningkatkan resiko keracunan pada manusia serta hewan ternak, terkontaminasinya air tanah, menurunnya nilai keanekaragaman, dan bahaya lain yang berhubungan dengan lingkungan (Untung, 1984). Sehingga untuk menghindari kerusakan lingkungan dibutuhkan pengendaliah
hayati yang ramah lingkungan. Pengendalian penyakit tanaman dapat menggunakan cara fisika, kimia ataupun biologis.
Untuk mengendalikan penyakit tular tanah (Soil borne disease) biasanya ditanggulangi dengan metode sterilisasi uap panas ataupun pengendalian biologis dengan merubah lingkungan dengan cara: (a) Penambahan bahan organik pada tanah;
(b) Merubah pengelolaan sistem air tanah; (c) Sterilisasi sebagian dari tanah dengan uap panas ataupun bahan kimia yang selektif. Pengendalian hayati untuk penyakit tular tanah dapat juga dengan menggunakan agen antagonis. Contoh oenggunakan agen antagonis yang berhasil antara lain Trichoderma viridae untuk mengendalikan Rhizoctonia (Sastrahidayat, 2012).
Di beberapa perkebunan kelapa sawit masih menggunakan bahan kimia sintetik yang berfungsi untuk menurunkan populasi hama penyakit secara cepat, sehingga dapat menghindari penyakit kelapa sawit. Para petani juga menggunakan pengendalian dengan cara Pembersihan sumber infeksi sebelum dilakukannya penanaman ulang, dan Penumbangan atau pembongkaran tanaman yang terkena sakit berat, Namun petani lebih sering menggunakan Fungisida sintetik untuk menghambat laju itensitas serangan. Petani memilih menggunakan fungisida sintetik dikarenakan penggunaannya yang mudah (Pahan, 2008).
Dalam pengendalian penyakit busuk pangkal batang yang disebabkan oleh jamur G. boninense dapat memanfaatkan mikroba antagonis yang merupakan alternatif ramah lingkungan. kelompok jamur yang banyak digunakan sebagai agen pengendalian hayati antara lain Penicilium sp. Trichoderma sp. dan Phytium oligandrum. Sedangkan kelompok bakteri yang banyak digunakan sebagai pengendali hayati adalah Bacillus sp. dan Pseudomonas sp. (Herliyana et al., 2013). Usaha pengendalian hayati menggunakan agen mikroorganisme memiliki peluang yang besar dikarenakan mikroorganisme selalu tersedia di alam dan aktivitasnya dapat diatur dengan memodifikasi lingkungan ataupun tanaman. Kelebihan menggunakan mikroorganisme yang bersifat antagonis antara lain: (a) ramah lingkungan, (b) tidak menghasilkan residu, (c) dan berkelanjutan karena mikroorganisme dapat memperbanyak diri, dan sehingga tidak memerlukan aplikasi yang berulang-ulang (Baker dan Cook, 1993).
2.4 Mucuna bracteata
Mucuna bracteata dikenal sebagai tanaman yang digunakan sebagai penutup tanah yang berasal dari Kerala India Selatan. M. bracteata berakar tunggang, akar berwarna putih kecokelatan, batangnya tumbuh menjalar berwarna hijau kecokelatan, daunnya berbentuk oval, bunganya berupa bunga tandan, dan buahnya berupa polong- polongan. M. bracteata memiliki bintil akar yang merupakan simbiosis mutualisme dengan bakteri Rhizobium yang dapat menfiksasi nitrogen bebas diudara (Harahap.
2011).
Perbanyakan M. Bracteata biasanya melalui melalui stek ataupun biji. Namun, cara perbanyakan yang paling sering digunakan adalah cara vegetatif yaitu stek dikarenakan kulit biji yang berstruktur keras sehingga biji sulit untuk berkecambah.
Pada penanaman di perkebunan kelapa sawit Mucuna bracteata dengan jarak sekitar 4 m dari kelapa sawit dan jarak antar Mucuna 1m. Penanaman ini dilakukan satu bulan sebelum penanaman bibit kelapa sawit (Fauzi et al., 2008).
Kelebihan lain dari M. bracteata yaitu tumbuhan ini cukup toleran terhadap perubahan iklim. Namun tumbuhan ini masih membutuhkan suhu optimum untuk tumbuh secara optimal. Ketinggian optimum untuk tumbuhan ini adalah >1000 meter di atas permukaan laut (Sebayang et al., 2004). Temperatur optimum untuk tumbuhan ini adalah dengan suhu minimum 12℃ dan suhu maksimum 23℃. Jika suhu tidak mencapai suhu optimum maka akan menyebabkan tanaman terhambat proses pembungaannya. Serta dengan lama penyinaran 6-7 jam dikarenakan tumbuhan ini merupakan tumbuhan berhari pendek (Harahap, 2008).
Manfaat dari penanaman M. bracteata antara lain meningkatkan jumlah bahan organik didalam tanah, memperbaiki struktur tanah, memperbaiki unsur hara didalam tanah terutama konsentrasi nitrogen, memperbaiki sifat-sifat dari tanah, melindungi permukaan tanah dari pengaruh lingkungan contohnya erosi hal ini umumnya terjadi pada struktur tanah yang curam, dapat mengendalikan gulma-gulma yang dapat merusak perkebunan, dan mendorong pertumbuhan tanaman sehingga dapat meningkatkan produksi (Pahan, 2008). Pada akar M. bracteata terdapat bintil akar yang merupakan bentuk simbiosis antara bakteri Rhizobium dengan tanaman M.bracteata. Rhizobium dapat mengikat nitrogen sehingga kemudian dapat dimanfaatkan oleh tanaman.
Gambar 2.2 Mucuna bracteata
2.5 Bakteri Rhizobium dan Manfaatnya
Rhizobium merupakan bakteri yang bersimbiosis dengan tanaman kacang- kacangan (Leguminosa) sehingga membentuk bintil akar yang mampu mengikat nitrogen bebas (Young dan Haukkan, 1996). Rhizobium termasuk kedalam famili Rhizobiaceae dan genus Rhizobium. Karakteristik Rhizobium secara makroskopis antara lain berwarna putih susu, tidak transparan, konveks, bentuk koloni sirkuler, diameter 2-4 mm jika diinkubasi 3-5 hari. Secara mikroskopis Rhizobium berbentuk batang, Gram negatif, dan memiliki flagella polar atau sub polar. Suhu optimumnya 18℃ - 26℃, dan pH optimum 5,0 (Surtiningsih et al., 2009). Selain dapat mengikat nitrogen bebas Rhizobium juga mampu menghasilkan fitohormon IAA, perlarut posfat, dan penghasil hormon giberelin (Novriani, 2011).
Proses pembentukan bintil akar meliputi beberapa tahapan : rekognisi yaitu suatu komunikasi kimiawi akar tanaman leguminosa sehingga Rhizobium membentuk benang infeksi melalui invaginasi dalam membran plasma. Setelah itu terjadi proses invasi yaitu masuknya Rhizobium menembus jaringan korteks akar. Sehingga menyebabkan sel korteks dan perisikel terbelah, lalu kantung yang mengandung bakteri Rhizobium memisah ke sel pada bagian korteks dari benang yang bercabang.
Pertumbuhan sel pada korteks dan perisikel kemudian membentuk bintil. Jaringan tanaman yang menghubungkan bintil dengan xilem dan floem kemudian berkembang untuk menyediakan zat-zat dari bintil ke xilem dan floem untuk kemudian didistribusikan ke seluruh bagian tanaman (Campbell et al., 2003).
Fungsi utama Rhizobium adalah memfiksasi N2 di atmosfer. Fiksasi nitrogen terjadi melalui beberapa proses yaitu pertama-tama nitrogen di udara (N2) diubah menjadi amonia (NH3) (Loveless, 1991). Didalam tanah amonia mengalami ionisasi menjadi NH4+ yang kemudian diserap oleh tumbuhan (Campbell et al., 2003).
Tumbuhan memperoleh nitrogen sebagian besar dalam bentun nitrat (NO3) dikarenakan nitrat memliki kemampuan mobilitas yang tinggi sehingga lebih mudah masuk ke akar tanaman (Tortora, 2001). Jumlah nitrogen yang ditambat oleh bakteri Rhizobium bervariasi tergantung strain ataupun jenis , tanaman inang, serta lingkungan tempat hidup dan ketersediaan unsur hara nitrogen. Karena sifatnya yang dapat menambatt nitrogen bebas diudara oleh Rhizobium banyak digunakan sebagai Biofertilizer sehingga memberikan keuntungan bagi tanaman (Hanum, 2011).
Penggunaan Rhizobium sebagai biofertilizer merupakan teknologi budidaya tanaman yang ramah lingkungan karena dapat mengurangi penggunaan pupuk sintetik yang dapat merusak lingkungan dan layak untuk digunakan untuk peningkatan produktivitas tanaman (Purwaningsih, 2015).
2.6 Kemampuan Antijamur Bakteri Rhizobium
Rhizobium dilaporkan dapat menghambat pertumbuhan jamur patogen secara signifikan seperti Macrophomina phaseolina, Rhizoctonia spp. dan Fusarium sp.
Proses penghambatan ini melalui beberapa mekanisme ataupun kombinasi mekanisme yang berbeda. Misalnya dengan menghasilkan antibiotik, produksi siderophore, induksi mekanisme pertahanan tanaman, dan menghasilkan enzim pengurai dinding sel misalnya kitinase yang dapat menyebabkan lisis dinding sel patogen dan juga kompetisi (Srinivasan, 2017).
Antibiotik yang diproduksi Rhizobium telah diketahui memainkan peranan penting dalam pengendalian penyakit. Sekresi antibiotik trifolitoxin oleh R.
Leguminosarum telah ditemukan untuk melindungi tanaman kedelai dari infeksi M.
Phaseolina. Efek penghambatan pada Rhizobium jenis lain juga dilaporkan disebabkan oleh produksi rhizobitoksin (Breil, 1996). HCN (Hidrogen Sianida) adalah suatu metabolit sekunder yang dihasilkan oleh mikroorganisme mempunyai efek merusak pada beberapa mikroorganisme. Beberapa mikroorganisme yang hidup di tanah (rhizosfer) diketahui melindungi tanaman inangnya melalui penghambatan
pertumbuhan patogen melalui produksi HCN. (Beuchamp et al., 1996) dan (Antoun et al., 1978). Hidrogen sianida merupakan senyawa yang dapat mengganggu kerja mitokondria pada sel sehingga menghambat sel untuk menghasilkan energi.
Bakteri Rhizobium dilaporkan juga menghasilkan Siderophore. Siderophore adalah senyawa pengkompleks Fe3+ atau penkhelat besi dan responsif untuk pelarutan serta pengangkutan elemen besi kedalam sel bakteri. Kelompok bakteri yang mampu menghasilkan siderophore menguntungkan bagi tanaman karena siderophore dapat menekan pertumbuhan patogen. Besi merupakan cofaktor atau elemen vital untuk aktivasi enzim. Hingga saat ini terdapat dua tipe siderophore yaitu Catecholat dan hydroxamat (Neilands dan Nakamura, 1991).
Mikroorganisme yang mampu memproduksi enzim kitinase disebut sebagai mikroorganisme kitinolitik. Enzim kitinase dapat melisiskan sel jamur. Mikroba menghasilkan enzim ini untuk menghidrolisis kitin pada sel jamur (Suryadi et al., 2013). Kitinase adalah enzim yang dapat menghidrolisa polimer pada kitin menjadi kitin oligosakarida atau monomer N-asetilglukosamin (Rostinawati, 2008).
Mikroorganisme mendegradasi kitin sehingga N-asetilglukosamin diambil untuk proses hidup bakteri. N-asetilglukosamin kemudian dimetabolisme hingga menghasilkan H2O, NH3, CO2, dan energi (Meata, 2014). Selain kitinase mekanisme antijamur juga terjadi karena dihasilkannya enzim β-1,3-glukanase yang menghidrolisis β-glukan pada dinding sel jamur (Shetty et al., 2009).
Glukanase adalah enzim dari golongan hidrolitik yang mampu menghidrolisis glukan. Glukan merupakan polimer linier dari karbohidrat yang tersusun atas monomer dari glukosa yang banyak terdapat pada dinding sel jamur (Budiarti et al., 2004). Hidrolisis glukan pada dinding sel jamur akan menyebabkan turunnya interitas dinding sel, sehingga jamur tidak berhasil menginfeksi tanaman (Shetty et al., 2009).
Pada jamur β-1,3-glukanase memiliki fungsi antara lain pada proses morfogenesis dan morfolitik selama diferensiasi dan perkembangan. Aktivitas senyawa antijamur β-1,3- glukanase terjadi dengan adanya kemampuan untuk menghidrolisa β-1,3-glukanase yang ada pada dinding sel jamur terutama pada bagian ujung hifa karena tempat tersebut merupakan tempat paling banyak glukan ditemukan sehingga kemudian dinding sel akan menjadi lemah, lisis, dan bahkan menyebabkan kematian jamur (Hjeljord dan Tronsmo 1998).
BAB 3
METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Februari sampai Oktober 2021. Lokasi penelitian di Laboratorium Pusat Penelitian Kelapa Sawit (PPKS) Medan dan Laboratorium Mikrobiologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara.
3.2 Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah tanaman Mucuna bracteata yang diperoleh dari perkebunan kelapa sawit Aek Pancur, Sumatera Utara, Jamur G.
boninense diperoleh dari koleksi Pusat Penelitian Kelapa Sawit (PPKS). Media-media pertumbuhan jamur yaitu Potato Dextrose Agar (PDA) dengan komposisi kentang (4g/L), dextrose (15 g/L), dan aquadest 1 L. Media pertumbuhan bakteri yaitu Nutrient Broth (NB ). Media YEMA (Yeast Extract Mannitol Agar) dengan komposisi:
Mannitol (10 g/L); dipotasium phosphate (K2HPO4.3H2O) (0,5 g/L) Magnesium Sulphate (MgSO4.7H2O) (0,2 g/L); Yeast extract (1 g/L); Sodium cholide (NaCl) 0,1 (g/L); agar (20 g/L) dan 1 L aquadest. Bahan bahan lainnya adalah L-triptofan, Reagen Salkowski untuk analisis IAA dengan komposisi 150 ml H2SO4, 250 ml aquadest dan 7,5 ml FeCl3.6H2O 0,5 M. Bahan lain yang digunakan untuk analisis IAA adalah Indole-3- Acetic Acid (IAA). Pewarna yang digunakan adalah congo red, bromothymol blue, kristal violet, safranin, dan iodine
3.3 Koleksi Bintil Akar dan Isolasi Rhizobium
Bintil akar dikoleksi dari tanaman M. bracteata yang tua. Sampel diambil dari akar M. bracteata pada tiga titik lokasi di perkebunan kelapa sawit Aek Pancur. Pada setiap titik diambil sebanyak tiga kali ulangan. bintil akar merupakan bagian yang menonjol pada akar. Pemilihan bintil akar untuk isolasi Rhizobium dilakukan menurut (Dini, 2020). Bintil akar yang diambil adalah yang berwarna merah muda hingga kecokelatan (Gambar 3.1). Bintil akar selanjutnya dibelah untuk melihat warna merah
muda hingga kecokelatan dibagian tengahnya. Bintil akar M. bracteata kemudian dicuci bersih dengan air mengalir, dan terakhir dengan aquadest steril sambil di vortex selama satu menit selama tiga kali.
Bintil akar yang sudah bersih selanjutnya disterilisasi permukaan menggunakan larutan antiseptik konsentrasi 10% dengan cara divortex selama dua menit, kemudian bintil akar disterilkan menggunakan aquades steril dengan cara divortex selama satu menit. Bintil akar kemudian dipecah dan diambil 1 ose kemudian digoreskan pada cawan petri yang berisi media YEMA (Yeast Extract Mannitol Agar) dan diinkubasi pada suhu 35 °C selama 48 jam. Koloni yang paling dominan dipilih dan disubkultur ke media YEMA miring yang baru untuk dilakukan uji lebih lanjut (Saputra, 2014).
Gambar 3.1 Bintil Akar Mucuna Bracteata
3.4. Karakterisasi Rhizobium
Karakterisasi Rhizobium diawali dengan mengamati karakteristik morfologi secara makroskopis (bentuk, tepian, permukaan, elevasi, dan tekstur koloni) dan mikroskopis (pewarnaan Gram). Seleksi bakteri Rhizobium selanjutnya menggunakan medium selektif yaitu YEMA + Congo Red 0,25% dan YEMA +Bromothymol Blue (BTB) 1 %. Pada pengujian YEMA + CR, apabila koloni yang terbentuk tidak dapat menyerap warna merah berarti koloni tersebut adalah koloni Rhizobium. Sedangkan pada media YEMA+BTB , apabila isolat yang tumbuh berwarna kuning maka termasuk golongan Rhizobium (Dini, 2020).
3.5 Identifikasi Molekuler Rhizobium
Identifikasi bakteri dilakukan dengan cara mengirim isolat bakteri ke PT.
Genetika science Indonesia. Metode identifikasi bakteri dilakukan dengan menggunakan kit Quick-DNA Fungal/Bacterial Miniprep (Zymo Research, D6005) dan amplifikasi PCR dengan (2x) My Taq HS Red Mix (Bioline, BIO-25048). Primer yang digunakan adalah primer 27 F dan 1492 R. Sekuens yang telah diperoleh kemudian di BLAST menggunakan website NCBI untuk mengetahui persentase kemiripan genetik dengan Rhizobium. Setelah itu, dilakukan Multiple Sequence Alignment (MSA) menggunakan metode ClustalW pada aplikasi Bioedit. Setelah disejajarkan sekuens yang diperoleh kemudian dibuat pohon filogenetiknya dengan menggunakan fitur Neighbor Joining Tree pada aplikasi Mega 11.
3.6 Kemampuan Antagonis Rhizobium Terhadap Ganoderma boninense Uji kemampuan antagonis Rhizobium terhadap G. boninense dilakukan menggunakan metode dual culture. Jamur G. boninense ditumbuhkan pada media PDA+Yeast extract 1% dan ditempatkan pada bagian tengah petri. Isolat bakteri Rhizobium diletakkan pada sisi kanan dan kiri jamur G. boninense dengan jarak ±3cm dari tengah petri dan diinkubasi pada suhu ± 28 °C selama 5 hari. Persentase hambatan pertumbuhan miselium yang terbentuk diukur menggunakan rumus menurut Yurnaliza et al., (2014) yaitu:
% CGI = R1-R2 x 100%
R1
Keterangan: CGI : Colony Growth Inhibition (Hambatan pertumbuhan miselium Gboninense).
R1 : Jari-jari koloni jamur patogen yang berlawanan arah dengan bakteri.
R2 : Jari-jari koloni jamur patogen menuju ke bakteri.
3.7 Mekanisme Antagonis Bakteri Rhizobium
Kemampuan antagonis bakteri Rhizobium dalam menghambat pertumbuhan jamur G. boninense dapat dilihat dari kemampuan memproduksi senyawa antijamur, kitinolitik, dan glukanolitik.
3.7.1 Kemampuan Produksi Senyawa Antijamur
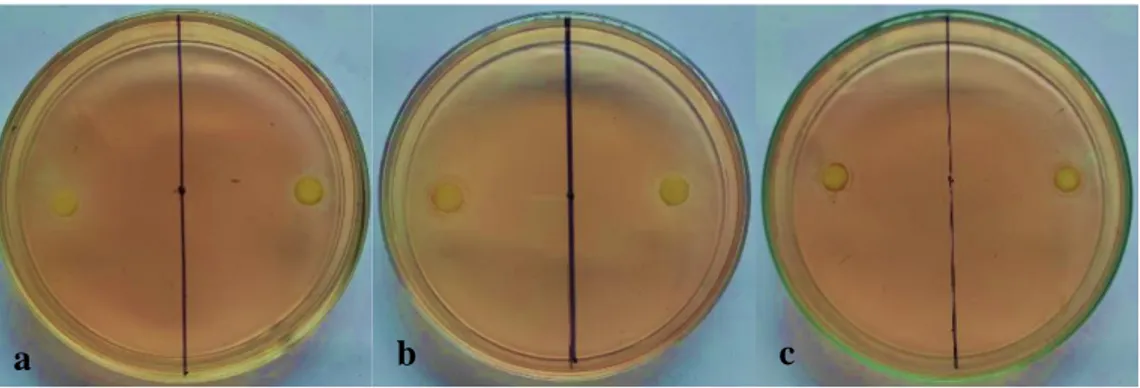
Produksi senyawa antijamur dari Rhizobium dilakukan dengan dimasukkan suspensi sebanyak 10 ml (konsentrasi setara dengan larutan McFarland 0,5) kedalam 100 ml media YEM (Yeast Extract Mannitol) lalu diinkubasi pada suhu ± 28 °C selama 2 hari dan diguncang dengan orbital shaker dengan kecepatan 110 rpm. Isolasi senyawa antijamur dilakukan dengan cara memasukkan kedalam kultur bakteri sebanyak 10 ml larutan etil asetat dan diguncang selama ± 10 menit kemudian didiamkan hingga terbentuk 2 lapisan cairan. Penambahan etil asetat diulangi sebanyak 2 kali. Larutan hasil ekstraksi etil asetat kemudian diuapkan hingga terbentuk ekstrak kering.
Ekstrak etil asetat kering kemudian dilarutkan dengan dimethyl sulfoxide (DMSO) dengan perbandingan 1:1 (berat ekstrak kering : DMSO). Konsentrasi ekstrak dalam pelarut DMSO adalah 50%. Sebanyak 30µl ekstrak diteteskan pada kertas cakram steril yang sudah diletakkan pada sisi bagian luar jamur G. boninense yang sudah ditumbuhkan pada media PDA dalam waktu 3 hari dengan kontrol kertas cakram yang berisi larutan DMSO tanpa penambahan ekstrak.
Persentase hambatan pertumbuhan miselium diukur setelah 24 jam dengan rumus:
% CGI = R1-R2 x 100%
R1
Keterangan: CGI : Colony Growth Inhibition (Hambatan pertumbuhan miselium Ganoderma boninense).
R1 : Jari-jari pertumbuhan miselium Ganoderma boninense kearah kontrol
R2 : Jari-jari pertumbuhan miselium Ganoderma boninense kearah perlakuan.
3.7.2 Kemampuan Kitinolitik
Produksi Kitinase secara kualitatif dilakukan menggunakan prosedur Soeka et al., (2011), dengan memodifikasi komposisi media dengan mengganti pepton dengan koloidal kitin. Sebanyak 1 ose bakteri diinokulasikan pada media kitin agar kemudian diinkubasi pada suhu ± 28 °C selama 5 hari. Indeks kitinolitik ditentukan dengan membandingkan diameter zona bening yang tebentuk pada sekeliling bakteri dengan diameter koloni bakteri yang terbentuk.
3.7.3 Kemampuan Glukanolitik
Bakteri ditumbuhkan pada media glukan agar yang mengandung laminarin 1%.
Media glukan yang telah dituang kedalam cawan petri dan ditunggu hingga memadat.
Satu ose isolat bakteri Rhizobium diinokulasikan pada medium glukan agar diinkubasi pada suhu ± 28 °C selama 48 jam. Kemudian permukaan media ditetesi congo red 0,1% dan diinkubasi kembali selama 5 menit didalam ruangan yang gelap. Permukaan media kemudian dibilas dengan larutan NaCl 1M (Purba, 2018). Zona bening yang terbentuk kemudian diukur dan ditentukan aktivitas glukanolitik dengan rumus:
IG = DZB-DK DK Keterangan: IG : Indeks Glukanolitik
DZB : Diameter Zona Bening DK : Diameter Koloni 3.8 Produksi Indole-3-Acetic Acid (IAA)
Uji IAA dilakukan dengan metode Datta dan Basu (2000). Sebanyak 10 ml inokulum bakteri yang kerapatan selnya sesuai dengan larutan McFarland 0,5 dimasukkan kedalam 100 ml media YEM (Yeast Extract Mannitol) yang telah ditambahkan L-triptophan sebanyak 0,1 gram. lalu diinkubasi pada suhu ± 28 °C selama 2 hari menggunakan orbital shaker dengan kecepatan 110 rpm. Selanjutnya sebanyak 5 ml cairan kultur disentrifugasi selama 30 menit dengan kecepatan 7000 rpm. Kadar IAA yang dihasilkan diukur dengan metode Salkowski. Sebanyak 1 ml supernatan ditambahkan dengan 4 ml reagen salkowski (150 ml H2SO4, 250 ml aquades steril dan 7,5 ml FeCL3.6H2O 0,5 M) dan kemudian dimasukkan ke dalam tabung reaksi. Campuran reaksi diinkubasi pada ruang gelap selama 1 hari dan selanjutnya diamati perubahan warna yang terjadi. Jika sampel berwarna merah mengindikasikan bahwa isolat mampu menghasilkan IAA. Perubahan warna yang terbentuk selanjutnya diukur dengan spektrofotomentri pada panjang gelombang 520 nm. Kadar IAA yang dihasilkan dari sampel ditentukan dengan mengkalibrasi nilai absorbansi yang dihasilkan dari kurva standar IAA murni pada konsentrasi 10, 20, 30, 40, dan 50 ppm.
BAB 4
HASIL DAN PEMBAHASAN
4.1 Isolasi Bakteri Rhizobium
Hasil isolasi bakteri Rhizobium dari bintil akar M. bracteata dengan menggunakan medium Yeast Extract Mannitol Agar (YEMA) diperoleh sebanyak 9 isolat bakteri dalam kultur murni.
4.1.1 Karakter Morfologi
Karakter morfologi koloni dari 9 isolat bakteri yang diperoleh bervariasi baik bentuk, tepian, elevasi, warna, dan tekstur. Dari karakter koloni tersebut kemungkinan besar yang merupakan bakteri Rhizobium adalah isolat MB1AP1, MB2AP1, dan MB3AP2 (Tabel 4.1). Karena memiliki bentuk circular, tepian entire, elevasi flat dengan tekstur mucoid dan berwarna putih.
Tabel 4.1 Karakteristik Morfologi Koloni dari Bintil Akar Mucuna bracteata.
No. Kode Isolat Bentuk Tepian Elevasi Warna Koloni
Tekstur
1. MB1AP1 Circular Entire Flat Putih mucoid
2. MB1AP2 Irregular Undulate Flat Cream Smooth
3. MB1AP3 Irregular Undulate Raised Cream Smooth
4. MB2AP1 Circular Entire Flat Putih mucoid
5. MB2AP2 Irregular Undulate Raised Cream Smooth
6. MB2AP3 Irregular Undulate Flat Cream Smooth
7. MB3AP1 Irregular Curled Flat Putih Smooth
8. MB3AP2 Circular Entire Flat Putih mucoid
9. MB3AP3 Circular Entire Raised Cream Smooth
*MB: Mucuna bracteata, AP: Aek Pancur
Karakter morfologi koloni Rhizobium dapat dijadikan sebagai pembeda dengan koloni yang bukan Rhizobium. Menurut Heliati (2003) bahwa koloni Rhizobium dalam skala laboratorium berbentuk cembung hingga circular, warna putih susu dengan tekstur yang lengket. Sementara itu, Sutriningsih et al., (2009) menambahkan bahwa
karakteristik makroskopik Rhizobium adalah warna putih, tidak transparan dengan bentuk koloni sirkuler, convex atau semitransparan. Menurut Sari et al., (2018) pada media miring Rhizobium menunjukkan koloni yang berwarna putih susu, tidak bisa ditembus oleh cahaya, memiliki bentuk circular dengan permukaan yang halus dan mengkilap dengan tepian berbentuk entire.
Umumnya Rhizobium menghasilkan lendir. Menurut Fuhrman (1990) Rhizobium menghasilkan lendir yang banyak, hal ini disebabkan oleh produksi EPS (Eksopolisakarida) yang tinggi. EPS berfungsi untuk meningkatkan viskositas sel, melindungi sel bakteri dari pengaruh lingkungan, serta berperan dalam proses pelekatan Rhizobium pada rambut akar tanaman.
4.1.2 Pewarnaan Gram Bakteri
Hasil pewarnaan Gram dari 9 isolat bakteri yang diisolasi dari bintil akar tanaman M. bracteata diperoleh sebanyak 3 isolat memiliki bentuk sel basil dengan sifat Gram negatif dan 6 isolat lainnya berbentuk coccus dengan sifat Gram positif (Tabel 4.2). Dari ke 9 bakteri tersebut, kemungkinan besar yang merupakan jenis Rhizobium adalah isolat MB1AP1, MB2AP1, dan MB3AP2 karena umumnya bakteri Rhizobium memiliki bentuk basil dengan sifat Gram negatif. Hasil penelitian yang sama juga dilaporkan oleh Purwaningsih (2004) yang mengisolasi Rhizobium dari tanah Wamena dan Saputra (2014) yang mengisolasi Rhizobium dari Akar tanaman Alfafa (Medicago sativa L.).
Tabel 4.2 Bentuk Sel Bakteri dan Sifat Pewarnaan Gram dari Bakteri Isolat Bintil Akar Tanaman M. bracteata.
No. Kode Isolat Bentuk Gram
1. MB1AP1 Bacil Negatif
2. MB1AP2 Coccus Positif
3. MB1AP3 Coccus Positif
4. MB2AP1 Basil Negatif
5. MB2AP2 Coccus Positif
6 MB2AP3 Coccus Positif
7. MB3AP1 Coccus Positif
8. MB3AP2 Bacil Negatif
9. MB3AP3 Coccus Postif
*MB: Mucuna bracteata, AP: Aek Pancur
Pada bintil akar tanaman tidak hanya terdapat bakteri Rhizobium. Hal ini dibuktikan oleh penelitian Gonnerman (1894) dan Beijenrick (1888) dalam Fred et al., (1932). yang menemukan beberapa pesies bakteri pada bintil akar yaitu bakteri Bacillus fluorescens, Bacillus tuberigenus, Micrococcus tuberigenus, Bacillus luteo- albus, Bacillus agglomerans, dan Bacillus trimethylamin.
4.1.3 Karakter Isolat pada Medium Selektif
Karakterisasi bakteri Rhizobium juga dilakukan dengan menumbuhkannya pada medium selektif yaitu YEMA+CR dan YEMA+BTB. Hasil karakterisasi menunjukkan bahwa terdapat variasi warna koloni putih dan merah pada medium YEMA+CR. Sementara bakteri yang tumbuh pada medium YEMA+BTB semuanya menunjukkan warna kuning (Tabel 4.3)
Tabel 4.3 Karakter Pertumbuhan Bakteri Isolat Bintil Akar Mucuna bracteata Pada Medium Selektif YEMA+CR dan YEMA+BTB Waktu Inkubasi 2 Hari.
No. Kode Isolat YEMA+CR YEMA+BTB
1. MB1AP1 Putih Kuning
2. MB1AP2 Merah Kuning
3. MB1AP3 Merah Kuning
4. MB2AP1 Putih Kuning
5. MB2AP2 Merah Kuning
6. MB2AP3 Merah Kuning
7. MB3AP1 Merah Kuning
8. MB3AP2 Putih Kuning
9. MB3AP3 Merah Kuning
*MB: Mucuna bracteata, AP: Aek Pancur
Berdasarkan warna medium pertumbuhan pada medium selektif ini, isolat bakteri yang menunjukkan ciri positif Genus Rhizobium adalah yang memiliki morfologi koloni berwarna putih pada medium YEMA + Congo Red. Menurut Soekartadiredja (1992) ciri-ciri bakteri Rhizobium adalah tidak menyerap warna merah pada media YEMA + Congo Red sehingga koloni yang tumbuh akan berwarna putih . Berdasarkan (Tabel 4.3) isolat dengan kode MB1AP1, MB2AP1, dan MB3AP2 tidak menyerap warna merah (berwarna putih) pada media yang mengindikasikan bahwa
ketiga isolat tersebut merupakan bakteri Rhizobium. Hal ini juga didukung oleh penelitian Shetta et al., (2011) yang menyatakan bahwa seluruh isolat Rhizobium yang ditumbuhkan pada media yang mengandung Congo Red tidak menyerap warna merah.
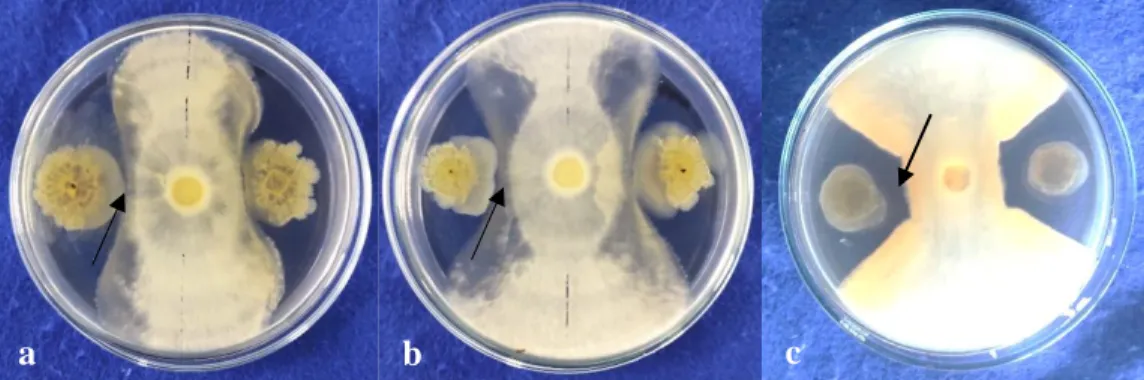
Koloni bakteri berwarna merah dan putih (Gambar 4.1)
Gambar 4.1 Koloni bakteri pada media YEMA+CR selama 48 jam dengan suhu ±28 °C .
Pengamatan koloni bakteri pada medium YEMA+BTB juga mengindikasikan bahwa isolat bakteri MB1AP1, MB2AP1, dan MB3AP2 merupakan Rhizobium karena mrnghasilkan koloni berwarna kuning meskipun isolat lainnya juga berwarna kuning.
Hal ini menandakan bahwa semua isolat merupakan kelompok bakteri dengan pertumbuhan yang cepat (fast growing). Menurut Purwaningsih (2009) pada media YEMA+BTB adalah medium selektif untuk membedakan kecepatan pertumbuhan bakteri. Isolat yang tumbuh pada medium YEMA+BTB akan berwarna kuning atau biru. Perubahan warna koloni menjadi kuning dikarenakan adanya produksi asam oleh mikroorganisme (Shetta et al., 2011).
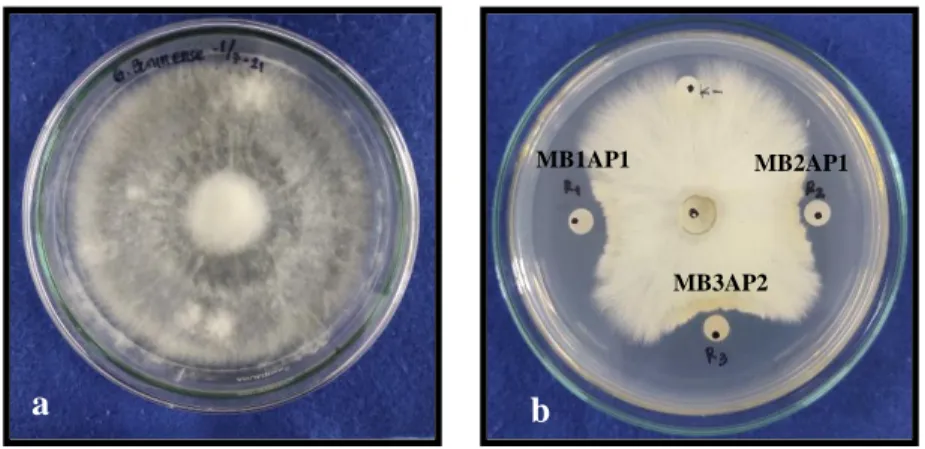
Warna biru menandakan bahwa bakteri yang diperoleh merupakan bakteri yang pertumbuhannya lambat (slow growing). Sementara itu koloni yang berwarna kuning merupakan bakteri yang pertumbuhannya cepat (fast growing). Menurut Purwaningsih (2002) isolat yang berwarna biru menunjukkan reaksi basa, sementara isolat yang berwarna kuning menunjukkan reaksi asam. Menurut Segiman (2005) dan Kaur et al. (2012) Pada jenis Bradyrhizobium jika ditumbuhkan pada media YEMA+BTB akan menghasilkan koloni berwana biru karena kelompok bakteri ini merupakan bakteri yang pertumbuhannya lambat (slow growing). Koloni bakteri yang berwarna kuning (Gambar 4.2). Selain sebagai indikator pH bromothymol blue biasanya juga digunakan sebagai indikator respirasi serta fotosintesis,
Gambar 4.2 Koloni bakteri berwarna kuning pada media YEMA+BTB selama 48 jam dengan suhu ±28 °C .
4.2 Identifikasi Molekuler Rhizobium
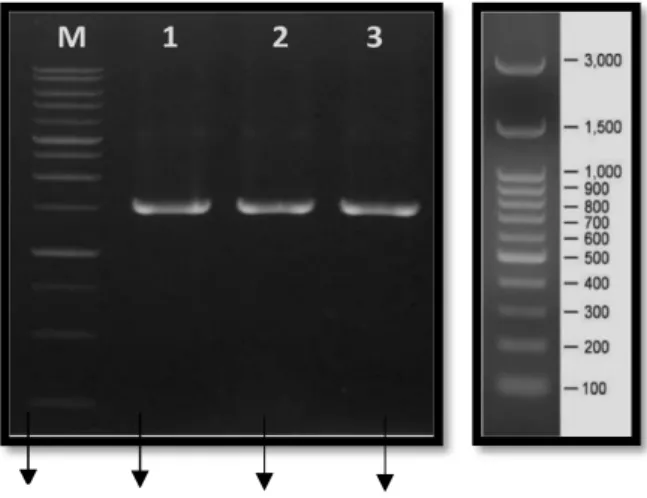
Hasil visualisasi elektroforesis sekuens yang diperoleh dapat dilihat pada (Gambar 4.3).
Gambar 4.3 Visualisasi hasil amplifikasi gen 16s rRNA isolat MB1AP1, MB2AP1, dan MB3AP2 pada konsentrasi 1% gel agarose.
Hasil elektroforesis gen 16s rRNA menunjukkan bahwa isolat MB1AP1 memiliki panjang DNA sekitar 576 bp, isolat MB2AP1 577 bp, dan isolat MB3AP2 memiliki panjang DNA sekitar 495 bp. Hasil BLAST (Basic Local Alignment Search Tool) sekuen DNA isolat MB1AP1, MB2AP1, dan MB3AP2 menunjukkan bahwa ketiga isolat yang diperoleh memiliki tingkat kemiripan 98,24%, 97,88%, dan 97,77%
dengan spesies Rhizobium sp. Strain J007 dari Gene Bank menggunakan website NCBI (National Centre for Biotechnology Information) (Tabel 4.4 - 4.6).
Marker MB1AP1 MB2AP1 MB3AP2
Tabel 4.4 BlastN Isolat MB1AP1
No. Description Max Score
Total Score
Query Cover
Per. Ident Accession
1. Rhizobium sp.
Strain J007
992 992 98% 98,24% KY471126.1
2. Rhizobium sp. SPC RN2
850 850 99% 93,57% FJ911604.1
3. Rhizobium sp.
CCNWYC119
837 837 97% 93,59% DQ674859.1
4. Rhizobium sp.
clone i.27
815 815 99% 92,37% MW326964.1
5. Rhizobium sp.
Strain HBUM200067
808 808 94% 93,31% KY945833.1
6. Rhizobium leguminosarum Strain SmrVr-115
808 808 94% 93,41% GQ240632.1
7. Rhizobium sp.
clone Cvi78
769 769 99% 91,02% FJ712885.1
8. Rhizobium leguminosarum
Strain LRM-5
758 758 94% 91,85% MF996753.1
9. Rhizobium leguminosarum Strain LRM-10
747 747 94% 91,49% MF996754.1
Tabel 4.5 BlastN isolat MB2AP1
No. Description Max Score
Total Score
Query Cover
Per. Ident Accession
1. Rhizobium sp.
Strain J007
979 979 97% 97,88% KY471126.1
2. Rhizobium sp.SPC RN2
833 833 97% 93,29% FJ911604.1
3. Rhizobium sp.
CCNWYC119
819 819 97% 92,76% DQ674859.1
4. Rhizobium leguminosarum Strain SmrVr-115
802 802 95% 92,91% GQ240632.1
5. Rhizobium sp.
clone 1.27
793 793 97% 91,90% MW326964.1
6. Rhizobium sp.
Strain HBUM200067
784 784 97% 91,70% KY945833.1
7. Rhizobium leguminosarum
Strain LRM-5
752 752 95% 91,38% MF996753.1
8. Rhizobium sp.
clone Cvi78
747 747 97% 90,53% FJ712885.1
9. Rhizobium leguminosarum
Strain LRM-5
741 741 95% 91,02% MF996753.1
Tabel 4.6 BlastN isolat MB3AP2
No. Description Max Score
Total Score
Query Cover
Per. Ident Accession
1. Rhizobium sp.
Strain J007
848 848 99% 97,77% KY471126.1
2. Rhizobium sp.SPC RN2
721 721 97% 93,61% FJ911604.1
3. Rhizobium sp.
CCNWYC119
693 693 95% 93,21% DQ674859.1
4. Rhizobium sp.
clone i.27
678 678 97% 91,99% MW326964.1
5. Rhizobium sp.
Strain HBUM200067
667 667 96% 92,03% KY945833.1
6. Rhizobium leguminosarum Strain SmrVr-115
658 658 93% 92,26% GQ240632.1
7. Rhizobium sp.
clone Cvi78
643 643 97% 90,82% FJ712885.1
8. Rhizobium leguminosarum
Strain LRM-5
608 608 93% 90,45% MF996753.1
9. Rhizobium leguminosarum Strain LRM-10
597 597 93% 90,02% MF996754.1
Hasil BlastN menunjukkan bahwa sekuen isolat MB1AP1, MB2AP1, dan MB3AP2 memiliki persentase kesamaan sekuens yang tinggi dengan jenis Rhizobium sp. Strain J007. Hal ini dapat dilihat pada nilai Per. Ident (Percent Identity) , dimana nilai Per. ident merupakan nilai yang menunjukkan kesamaan antar sekuen yang dimiliki dengan sekuen target. Menurut Bagus et al. (2019). Nilai Per Ident 99%
mengindikasikan bahwa isolat merupakan spesies yang sama. Jika nilai Per Ident lebih kecil dari 97% maka isolat yang diperoleh berasal dari genus yang sama. Sedangkan jika nilai Per Ident bernilai 83-93% menunjukkan bahwa isolat berasal dari famili yang berbeda.
Query coverage adalah persentasi dari panjang nukleotida yang selaras dengan database yang terdapat pada BLAST. Max identitiy adalah nilai tertinggi dari persentasi identitas atau kecocokan antara sekuen query dengan sekuen database yang tersejajarkan. Sementara itu, score adalah jumlah keselarasan semua segmen dari urutan database yang cocok (Miller 1990). 10 sekuens Rhizobium dengan jenis yang berbeda. Kemudian, pohon filogenetik digunakan untuk melihat kedekatan kekerabatan dengan ketiga isolat yang telah diperoleh (Gambar 4.4).
Gambar 4.4 Pohon filogenetika berdasarkan perbandingan sekuens 16S rRNA
Hasil dari pohon filogenetika menunjukkan bahwa isolat MB1AP1, MB2AP1, dan MB3AP2 dekat kekerabatannya dengan Rhizobium sp. Strain J007. Tetapi kemungkinan besar adalah jenis Rhizobium leguminosarum. Bakteri Rhizobium leguminosarum adalah bakteri yang memang ditemukan pada tanaman M. bracteata sesuai dengan penelitian Salwani et al., (2012) yang meneliti dan mengidentifikasi bakteri yang bersimbiosis dengan M, bracteata. Pohon Filogenetik dibuat untuk melihat kekerabatan antara isolat MB1AP1, MB2AP1, dan MB3AP2 dengan strain- strain Rhizobium yang diduga memiliki tingkat kemiripan berdasarkan urutan basa nukleotidanya. Menurut Claverie dan Notredame (2007). Filogenetik merupakan filogeni yang sesungguhnya membandingkan gen-gen yang ekuivalen yang datang dari beberapa spesies untuk merekontruksi pohon kehidupan (genealogic tree) dari spesies-spesies ini dan mengetahui siapa yang relatif berkerabat dengan yang lain.
Tujuan filogeni adalah untuk mengetahui kekerabatan suatu individu dengan individu lainnya dan menjelaskan keragaman makhluk hidup. Pada saat ini dari genus Rhizobium sudah ditemukan sekitar 98 spesies Rhizobium pada inang yang berbeda-
MB1AP1 MB2AP1 MB3AP2