PEMBUATAN PREPARAT MITOSIS SEBAGAI
MEDIA PEMBELAJARAN PADA MATERI
PEMBELAHAN SEL
SKRIPSI
Oleh
ACHMAD ZAINAL ABIDIN
NIM 08030204216
UNIVERSITAS NEGERI SURABAYA
FAKULTAS MATEMATIKA DAN ILMU
PENGETAHUAN ALAM
JURUSAN BIOLOGI
i
AKAR TANAMAN BAWANG UNTUK
PEMBUATAN PREPARAT MITOSIS SEBAGAI
MEDIA PEMBELAJARAN PADA MATERI
PEMBELAHAN SEL
SKRIPSI
Diajukan kepada Universitas Negeri Surabaya untuk memenuhi persyaratan penyelesaian
Program Sarjana Pendidikan Biologi
Oleh
ACHMAD ZAINAL ABIDIN
NIM 08030204216
UNIVERSITAS NEGERI SURABAYA
FAKULTAS MATEMATIKA DAN ILMU
PENGETAHUAN ALAM
JURUSAN BIOLOGI
ii Skripsi oleh : Achmad Zainal Abidin NIM : 08030204216
Judul : Studi Indeks Mitosis Meristem Ujung Akar Tanaman Bawang untuk Pembuatan Preparat Mitosis sebagai Media Pembelajaran pada Materi Pembelahan Selini telah disetujui dan dinyatakan memenuhi syarat untuk diajukan dalam ujian skripsi.
Surabaya, 21 Juli 2014
Pembimbing I
Drs. Johanes Djoko Budiono, M.Si
NIP 195005151974121001
Pembimbing II
Dra. Isnawati, M.Si.
NIP 196711221992032002
iii Skripsi oleh : Achmad Zainal Abidin NIM : 08030204216
Judul : Studi Indeks Mitosis Meristem Ujung Akar Tanaman Bawang untuk Pembuatan Preparat Mitosis sebagai Media Pembelajaran pada Materi Pembelahan Sel ini telah dipertahankan di hadapan dewan penguji pada tanggal 23 Juli 2014.
Dewan Penguji Tanda Tanggal
Tangan Selesai Revisi 1. Drs. Johanes Djoko Budiono, M.Si... ...
NIP 195005151974121001
2. Dra. Yuliani, M.Si ... ... NIP 196807211993032002
3. Muji Sri Prastiwi, S.Pd., M.Pd. ... ... NIP 198003062005012003
Mengesahkan,
Dekan Fakultas MIPA
Prof. Dr. Suyono, M.Pd.
NIP 196006201985031003
Mengetahui,
Ketua Jurusan Biologi
Dr. Raharjo, M.Si.
iv
PROGRAM STUDI PENDIDIKAN BIOLOGI
Alamat : Jalan Ketintang Gedung C3 Lt. 2 Kampus Ketintang, Telp.+6231-8280009, Faks +6231-8298382
SURAT PERNYATAAN KEORISINILAN SKRIPSI
Yang bertanda tangan di bawah ini:
Nama : Achmad Zainal Abidin
Tempat, tanggal lahir : Surabaya, 3 Maret 1990
NIM : 08030204216
Program studi/angkatan : Pendidikan Biologi 2008
Alamat : Perum Taloon Permai Blok J/15, RT.6 RW.7 Desa Kamal, Kecamatan Kamal, Kabupaten Bangkalan
menyatakan dengan sesungguhnya bahwa:
(1) skripsi yang diujikan ini benar-benar hasil karya saya sendiri (tidak didasarkan pada data palsu dan/atau hasil plagiasi/jiplakan atau autoplagisi)
(2) apabila pada kemudian hari terbukti bahwa pernyataan saya tidak benar, saya akan menanggung resiko dan siap diperkarakan sesuai dengan aturan yang berlaku.
Demikianlah surat pernyataan yang saya buat dengan sebenar-benarnya.
Surabaya, 23 Juli 2014 Yang Menyatakan,
v
Assalamu’alaikum Warahmatullahi Wabarakatuh
Segala puji dan syukur kehadirat ALLAH SWT yang telah melimpahkan rahmat serta hidayah-Nya sehingga skripsi yang
berjudul“Studi Indeks Mitosis Meristem Ujung Akar Tanaman
Bawang Untuk Pembuatan Preparat Mitosis Sebagai Media Pembelajaran Pada Materi Pembelahan Sel” telah dapat terselesaikan dengan baik.
Skrispi ini disusun sebagai salah satu syarat untuk memperoleh gelar sarjana pendidikan. Dalam skripsi ini penulis meneliti indeks mitosis meristem ujung akar tanaman bawang untuk digunakan sebagia waktu acu potong pada pembuatan preparat mitosis bawang. Penulis juga mengembangkan
pemanfaatan pewarna alami filtrat Syzygium cumini sebagai
bahan alternatif dalam pembuatan preparat mitosis sehingga diharapkan dapat membantu siapapun menekan biaya dalam pembuatan preparat mitosis sehingga dimanfaatkan dalam proses pembelajaran di kelas.
Keberhasilan penulisan skripsi ini tidak lepas dari dukungan serta bantuan dari berbagai pihak. Untuk itu, dalam kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada yang terhormat:
1. Drs. Johanes Djoko Budiono, M.Si. dan Dra. Isnawati, M.Si selaku Dosen Pembimbing Skripsi yang selalu membimbing, memberi masukan, kritikan, dan motivasi dalam penulisan skripsi ini.
vi
dan motivasi dalam penulisan skripsi.
4. Dr. Raharjo, M.Si. selaku Ketua Jurusan Biologi Universitas Negeri Surabaya.
5. Prof. Dr. Suyono, M.Pd. selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Surabaya. 6. Seluruh Dosen Pengajar di lingkungan Jurusan Biologi
FMIPA Unesa yang telah memberikan bekal ilmu pengetahuan kepada penulis.
7. RR. Herlin Wahyu Indriati, S.Pd., selaku guru Biologi SMA Negeri 1 Kamal sekaligus penelaah yang telah membantu pelaksanaan penelitian ini.
8. Bapak (Zaini), Ibu (Siti Amina), Kakak (Achmad Zainal Arifin & Nurul Arifah) dan Adik (Siti Sufiya) serta keluarga yang senantiasa memberikan dukungan materiil, semangat, motivasi, dan do’a dalam menyelesaikan skripsi ini.
9. Rekan-rekan Pendidikan Biologi 2008 dan Nizar Hanafi Hamdan (Alm.) yang turut memberikan saran, kritik, dan bantuan dalam menyelesaikan skripsi ini.
10. Seluruh pihak yang telah membantu terselesaikannya skripsi ini yang tidak bisa penulis sebutkan satu persatu.
Semoga Allah SWT memberikan balasan yang terbaik kepada semua pihak yang telah membantu dan memberikan dukungan dalam menyelesaikan skripsi ini, amin. Harapan peneliti dengan tersusunnya skripsi ini diharapkan dapat bermanfaat bagi peneliti khususnya dan pembaca pada umumnya.
Wassalamualaikum Warahmatullahi Wabarakatuh
Surabaya, 23 Juli 2014
vii
STUDI INDEKS MITOSIS MERISTEM UJUNG AKAR TANAMAN BAWANG UNTUK PEMBUATAN PREPARAT
MITOSIS SEBAGAI MEDIA PEMBELAJARAN PADA MATERI PEMBELAHAN SEL
Nama : Achmad Zainal Abidin
NIM : 08030204216
Program studi : S-1
Jurusan : Pendidikan Biologi, Biologi
Fakultas : Matematika dan Ilmu Pengetahuan Alam
Nama Lembaga : Universitas Negeri Surabaya
Pembimbing : 1. Drs. Johanes Djoko Budiono, M.Si.
2. Dra. Isnawati, M.Si
Waktu pemotongan ujung akar tanaman sangat penting dalam membuat preparat mitosis dengan fase lengkap. Waktu pemotongan ujung akar terkait dengan indeks mitosis (IM) tanaman. Setiap tanaman memiliki waktu yang berbeda-beda dimana terjadi IM tertinggi. Terbatasnya referensi IM tanaman menjadi kendala utama dalam pembuatan preparat mitosis sehingga diperlukan studi IM tanaman. Kendala lain dalam pembuatan preparat mitosis adalah pewarna baku yang harganya cukup mahal. Penggunaan pewarna alternatif sebagai pengganti zat warna baku inti sel / kromosom dapat menekan
biaya pembuatan mitosissquash.
Tujuan penelitian ini adalah 1) Menemukan tanaman alternatif yang dapat digunakan sebagai utama pembuatan
preparatsquashuntuk pengamatan mitosis 2) Menemukan acuan
waktu pemotongan ujung akar tanaman bawang untuk pembuatan preparat mitosis yang didasarkan pada nilai indeks mitosis tertinggi tanaman bawang 3) Mengembangkan pewarna
alternatif dari filtrat kulit buahSyzygium cuminiuntuk pemulasan
kromosom dalam pembuatan preparat mitosis 4)
viii
dengan mengacu pada metode Research and Development (R&D)
yang hanya dilakukan sampai tahap telaah desain produk. Data dikumpulkan dengan menggunakan teknik observasi dan telaah. Teknik observasi digunakan untuk memperoleh data kuantitatif
tentang nilai IM Allium, sedangkan teknik telaah digunakan
untuk memperoleh data kualitatif tentang kelayakan media preparat mitosis menggunakan pewarna filtrat kulit buah Syzygium cumini.
Hasil penelitian ini adalah 1)Allium sativum, A. cepa dan A.
fistulosum dapat dijadikan sebagai bahan utama alternatif
pembuatan preparat mitosissquash. 2) Waktu pemotongan ujung
akar tanaman bawang untuk digunakan sebagai acuan dalam pembuatan preparat mitosis ditemukan dalam waktu yang berbeda-beda berdasarkan pada waktu ditemukannya nilai
Indeks Mitosis (IM) tertinggi. IMA. sativumtertinggi terjadi pada
jam 09.00 WIB dengan nilai 11.410%; IM A. cepa tertinggi terjadi
pada jam 12.00 WIB dengan nilai 11.326%; sedangkan IM A.
fistulosum tertinggi terjadi pada jam 06.00 WIB dengan nilai
12.617%. 3) Filtrat kulit buah Syzygium cumini dapat digunakan
sebagai pewarna alternatif untuk mewarnai inti sel / kromosom.
4) Kelayakan media preparat mitosissquashmeristem ujung akar
Alliumtentang indeks mitosis yang menggunakan pewarna filtrat
kulit buah Syzygium cumini memperoleh nilai bervariasi antara
81%-100% dengan kategori sangat layak sehingga dapat digunakan sebagai media preparat untuk pengamatan pembelahan mitosis sel.
ix
MITOSIS INDEX STUDY OF ONION PLANT ROOT TIP TO MAKE MITOSIS SLIDES AS LEARNING MEDIA FOR
MITOSIS CELL SUBJECT
Name : Achmad Zainal Abidin
Number : 08030204216
Study Program : S-1
Department : Pendidikan Biologi, Biologi
Faculty : Mathematic and Natural Sciences
Name of Institution : The States University of Surabaya
Lecturer : 1. Drs. Johanes Djoko Budiono, M.Si.
2. Dra. Isnawati, M.Si
The time of cutting root tip plant is an important thing when making mitosis slides with complete phase of mitosis. The Time of Cutting Root Plant has concerned by Mitosis Index (MI). Each of plant has a different time for makes the highest MI. The limited reference for plant MI becomes the main problem for making the mitosis slides so it needs a literature study for plant MI. The other problem in making the mitosis slides is the standard stain that spend a high cost. The use of alternative stain as a substitution of standard nucleus (chromosome stain) to decrease the cost of making mitosis squash.
The objectives of this research are 1) finding alternative plants that can be use as main material for makes slides squash for mitosis observation. 2) finding the reference of onion root tip cutting time to make mitosis squash slides based on the highest value of onion IM. 3) developing alternative stain from skin
filtrate of Syzygium cumini as chromosomes staining for mitosis
squash slides. 4) Describing feasibility of mitosis slides media
about MI with skin filtrate ofS. cumini as a learning media.
x
of mitosis slides media that use filtrate of Syzgium cumini’s skin
fruit as a stain.
Result of this research are 1) Allium sativum, A. cepa and A.
fistolusum can be use as an alternative main material to make mitosis squash slides. 2) The time of the root tip cutting of the onion plants to be used as a reference in making mitosis slides squash found within different based on the time of the discovery
of the value of the highest MI. The Highest MI forA. sativumwas
observed at 09.00 WIT (11,410%); for A. cepa at 12.00 WIT
(11,326%) and forA. fistulosum at 06.00 WIT (12,617%). 3) Filtrate
of fruit skin Syzygium cumini can be use as alternative stain for
staining the nucleus (chromosomes). 4) Feasibility of Allium root tip meristem as a mitosis squash slides media with MI that use
filtrate of fruit skinS. cuminias stain have various value between
81%-100% with a viable category so that it can be used as a as a slides media for observation of mitosis cell divison.
xi
HALAMAN JUDUL... i
HALAMAN PERSETUJUAN... ii
HALAMAN PENGESAHAN...iii
SURAT PERNYATAAN KEORISINILAN SKRIPSI... iv
KATA PENGANTAR... v
ABSTRAK...vii
ABSTRACT... ix
DAFTAR ISI... xi
DAFTAR TABEL... xv
DAFTAR GAMBAR...xvii
DAFTAR GRAFIK...xix
DAFTAR LAMPIRAN...xx
BAB I PENDAHULUAN... 1
A. Latar Belakang... 1
B. Rumusan Masalah... 7
C. Tujuan Penelitian... 7
D. Manfaat Penelitian... 8
E. Batasan Penelitian... 8
BAB II KAJIAN PUSTAKA...11
A. Media Pembelajaran...11
B. Media Preparat Sebagai Media Pembelajaran...15
C. Zat Warna...17
D. Pulasan (Pewarnaan) Kromosom dengan Hematoksilin dan FiltratSyzygium cuminiLinn...18
1. Hematoksilin...21
2. Syzygium cuminiLinn...25
E. Mempelajari dan Memahami Mitosis Melalui Preparat Mitosis...28
F. Durasi Mitosis dan Indeks Mitosis...31
G. Siklus Sel... 33
1. Interfase... 35
a. Fase G1 (Gap 1)...35
xii
b. Metafase...37
c. Anafase...38
d. Telofase... 38
3. Sitokinesis...39
H. Penelitian yang Relevan...39
I. Kerangka Berpikir...42
BAB III METODE PENELITIAN...47
A. Jenis Penelitian...47
B. Tempat dan Waktu Penelitian... 47
C. Sasaran Penelitian...48
D. Definisi Operasional...48
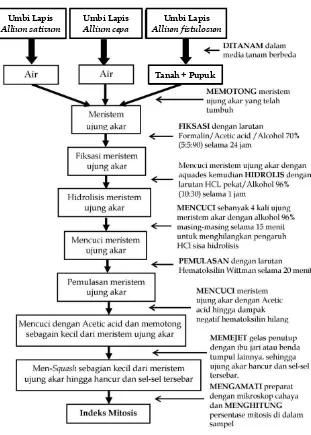
E. Prosedur Penelitian... 49
1. Tahap Potensi dan Masalah...51
a. Analisis Potensi...51
b. Analisis Masalah...51
2. Tahap Pengumpulan Informasi... 53
a. Durasi Mitosis dan Indeks Mitosis... 53
b. Preparat Squash Mitosis...54
c. Pewarna Alami Kromosom dari Hematoksilin danSyzygium cumini... 60
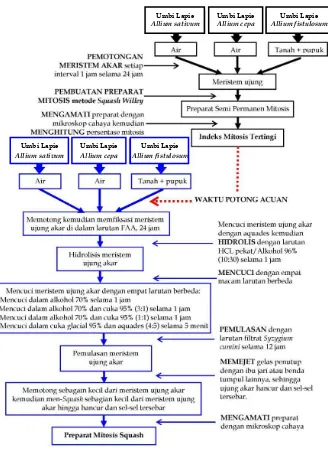
3. Tahap Desain Produk...63
a. Tahap Koleksi dan Penentuan Tanaman...64
b. Tahap Menemukan Indeks Mitosis...65
c. Tahap Pembuatan Pewarna Alternatif FiltratSyzygium cuminidan Pengaplikasiannya pada Media Preparat Squash Mitosis...69
4. Tahap Telaah Desain Produk... 71
5. Tahap Perbaikan Desain...71
6. Tahap Uji Coba Produk...71
7. Tahap Revisi Produk... 72
8. Tahap Uji Coba Pemakaian...72
xiii
1. Metode Observasi...73
2. Metode Telaah... 73
G. Instrumen Penelitian... 73
1. Lembar Data Pengamatan Indeks Mitosis...73
2. Lembar Telaah Preparat Mitosis...74
H. Teknik Analisis Data... 75
BAB IV HASIL PENELITIAN DAN PEMBAHASAN... 77
A. Hasil Penelitian... 77
1. Koleksi dan Pemilihan Bahan Utama Preparat Mitosis...77
2. Pengamatan Nilai Indeks Mitosis Genus Allium...81
3. Pembuatan Pewarna Alternatif Filtrat Syzygium cuminidan Pengaplikasiannya pada Media Preparat Squash Mitosis... 93
4. Telaah Media Preparat...97
a. Mitosis Squash Meristem Ujung Akar Allium sativumdengan Pewarna Hematoksilin dan PewarnaSyzygium cumini(Preparat 1 - 3 dan Preparat 10 - 12) ... 97
b. Mitosis Squash Meristem Ujung Akar Allium cepadengan Pewarna Hematoksilin dan PewarnaSyzygium cumini(Preparat 4 - 6 dan Preparat 13 - 15) ...103
c. Mitosis Squash Meristem Ujung Akar Allium fistulosum dengan Pewarna Hematoksilin dan PewarnaSyzygium cuminiPreparat 7 - 9 dan Preparat 16 - 18) ...108
B. PEMBAHASAN...114
xiv
Syzygium cuminidan Pengaplikasiannya pada
Media Preparat Squash Mitosis...119
4. Telaah Media Preparat...123
a. Telaah pewarnaan hematoksilin dan pewarna filtrat kulit buahSyzygium cumini pada preparat mitosis squash meristem ujung akar Allium...123
b. Telaah kelayakan preparat mitosis meristem ujung akar Allium dengan pewarna hematoksilin dan pewarna filtrat kulit buahSyzygium cumini...126
BAB V KESIMPULAN DAN SARAN...131
A. Kesimpulan...131
B. Saran...132
DAFTAR PUSTAKA...133
xv Nomor Tabel
2.1 Kesalahan yang Banyak Terjadi dalam Pengamatan
Mitosis Sel dan Penyebabnya... 31
3.1 Kriteria interpretasi skor berdasarkan skala likert...76
4.1 Daftar tanaman koleksi, media tanam dan referensi...78
4.2 Hasil pengamatan tanaman koleksi... 79
4.3 Rata-rata Indeks Mitosis (IM) meristem ujung akar genusAlliumsetiap jam selama 24 jam berturut-turut...81
4.4 Hasil uji normalitas data Indeks MitosisAllium... 83
4.5 Hasil uji homogenitas data Indeks MitosisAllium...83
4.6 Hasil perhitungan Anava untuk indeks mitosis meristem ujung akarAllium sativumsetiap jam berturut-turut selama 24 jam...84
4.7 Hasil perhitungan Anava untuk indeks mitosis meristem ujung akarAllium cepasetiap jam berturut-turut selama 24 jam...87
4.8 Hasil perhitungan Anava untuk indeks mitosis meristem ujung akarAllium fistulosumsetiap jam berturut-turut selama 24 jam...90
4.9 Daftar media preparat mitosis squash yang telah dibuat menggunakan pewarna hematoksilin dan pewarna filtrat kulit buahSyzygium cuminiyang dinilai kelayakannya... 95
4.10 Perbandingan hasil pewarnaan selAllium menggunakan pewarna hematoksilin dan pewarna filtrat kulit buahSyzygium cumin...96
4.11 Hasil telaah penyerapan warna dan kejelasan waran
xvi
4.12 Hasil telaah kelayakan preparat mitosis meristem ujung
akarAllium sativumdengan pewarna Hematoksilin
(Preparat 1-3) dan filtrat kulit buahSyzygium cumini
(Preparat 10-12) ...101
4.13 Hasil telaah penyerapan warna dan kejelasan waran
Hematoksilin (Preparat 4-6) dan filtrat kulit buah Syzygium cumini(Preparat 13-15) pada sel meristem
ujung akarAllium cepa... 104
4.14 Hasil telaah kelayakan preparat mitosis meristem ujung
akarAllium cepadengan pewarna Hematoksilin
(Preparat 4-6) dan filtrat kulit buahSyzygium cumini
(Preparat 13-15)...106
4.15 Hasil telaah penyerapan warna dan kejelasan waran
Hematoksilin (Preparat 7-9) dan filtrat kulit buah Syzygium cumini(Preparat 16-18) pada sel meristem
ujung akarAllium fistulosum...109
4.16 Hasil telaah kelayakan preparat mitosis meristem ujung
akarAllium fistulosumdengan pewarna Hematoksilin
(Preparat 7-9) dan filtrat kulit buahSyzygium cumini
xvii Nomor Gambar
2.1 Kerucut pengalaman Edgar dale yang dikaitkan
Dengan tahap pengalaman dari Bruner... 12
2.2 Struktur kimia guguschromophoredanauxochromo pada molekul sianidin (A) dan hematein (B)...20
2.3 Struktur kimia molekul hematoksilin, hematein hematein anion... 22
2.4 Kompleks hematein-mordant iron(HmFe)...22
2.5 Mekanisme reaksi antara pewarna hematein (HmFe)2+...25
2.6 Syzygium cumini: (a) daun, (b) bunga, (c) tanaman muda belum berbunga, (d) buahS. cuminimuda yang berwarna merah sampai ungu, (e) buahS. cumini matang, (f) tanamanS. cuminidewasa...26
2.7 Struktur kimia molekul antosianidin dalamSyzygium cuminidalam bentuk sianidin kation... 27
2.8 Mitosis dan interfase inti padaAllium cepa(2n = 16)... 28
2.9 Profase...37
2.10 Metafase... 38
2.11 Anafase... 38
2.12 Telofase dan sitokinesis...39
2.13 Diagram kerangka berpikir... 45
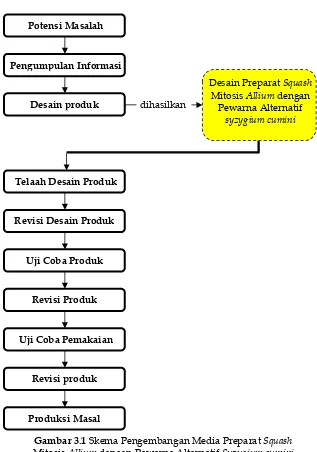
3.1 Skema pengembangan media preparatsquashmitosis Alliumdengan pewarna alternatifSyzygium cumini... 50
3.2 Posisi perhitungan sampel...66
3.3 Diagram alur pemerolehan indeks mitosis meristem ujung akarAllium sativum, A. cepadanA. fistulosum... 68
3.4 Diagram alur pemerolehan indeks mitosis meristem ujung akarAllium sativum, A. cepadanA. fistulosum dengan menggunakan pewrana alternatif filtrat Syzygium cumini...70
4.1 A. FiltratSyzygium cuminiyang berwarna merah, B.
xviii
pewarnaan kromosom...94
4.2 Tampilan fisik media preparat mitosissquash... 95
4.3 Foto obyek preparat mitosissquashmeristem ujung
akarAllium sativumdengan pewarna hematoksilin (preparat 1-3) maupun pewarna filtrat kulit buah
Syzygium cumini(preparat 10-12) perbesaran 640 X... 97
4.4 Foto obyek preparat mitosissquashmeristem ujung
akarAllium cepadengan pewarna hematoksilin (preparat 4-6) maupun pewarna filtrat kulit buah
Syzygium cumini(preparat 13-15) perbesaran 640 X... 103
4.5 Foto obyek preparat mitosissquashmeristem ujung
akarAllium fistulosumdengan pewarna hematoksilin (preparat 7-9) maupun pewarna filtrat kulit buah
Syzygium cumini(preparat 16-18) perbesaran 640 X... 108
4.6 Struktur kimia molekul antosianidin dalamSyzygium
cumini, sianidin, sianidin anion...120
4.7 Mekanisme reaksi antara pewarna cyanidin (CyFe)2+
xix Nomor Grafik
4.1 Grafik rata-rata indeks mitosis meristem ujung akar
Allium sativum setiap jam selama 24 jam
berturut-turut...85
4.2 Grafik indeks fase-fase mitosis meristem ujung akar
Allium sativum setiap jam selama 24 jam
berturut-turut...86
4.3 Grafik rata-rata indeks mitosis meristem ujung akar
Allium cepa setiap jam selama 24 jam berturut-turut... 88
4.4 Grafik indeks fase-fase mitosis meristem ujung akar
Allium cepasetiap jam selama 24 jam berturut-turut... 89
4.5 Grafik rata-rata indeks mitosis meristem ujung akar
Allium fistulosumsetiap jam selama 24 jam
berturut-turut...91
4.6 Grafik indeks fase-fase mitosis meristem ujung akar
Allium fistulosumsetiap jam selama 24 jam
xx Nomor Lampiran
Lampiran 1
1 Gambar Tanaman yang Digunakan sebagai Bahan
Utama Preparat Mitosis...141 Lampiran 2
2A Prosedur Pembuatan Preparat MitosisSquashWilley...142
2B Tahapan Pembuatan PreparatSquashWilley...143
Lampiran 3
3A Hasil Pra-Lab Pewranaan Sel Meristem Ujung Akar
Menggunakan Berbagai Tanaman...147
3B Kandungan Metabolit Sekunder Tanaman...150
3C Foto Hasil Uji Penerapan Filtrat Tanaman
Menggunakan Pewarna Alami...154 Lampiran 4
4A Prosedur Pembuatan Preparat MitosisSquash
Menggunakan Pewarna FiltratSyzygium cumini...155
4B Tahapan Pembuatan FiltratSyzygium cumini...159
4C Tahapan Pembuatan Preparat MitosisSquash
Menggunakan Pewarna FiltratSyzygium cumini...160
Lampiran 5
5 Intrumen A Lembar Data Pengamatan Indeks Mitosis
Sel Ujung AkarAllium... 161 Lampiran 6
6A Intrumen B Lembar Telaah Penyerapan Warna
Hematoksilin...162
6B Intrumen C Lembar Telaah Tampilan Umum Media
Preparat Semi Permanen MitosisAllium
xxi
Semi Permanen MitosisAlliumMenggunakan
Pewarna Hematoksilin...168 Lampiran 7
7A Intrumen B Lembar Telaah Penyerapan Warna
Hematoksilin...173
7B Intrumen C Lembar Telaah Tampilan Umum Media
Preparat Semi Permanen MitosisAllium
Menggunakan Pewarna Hematoksilin... 175
7C Intrumen D Lembar Telaah Manfaat Media Preparat
Semi Permanen MitosisAlliumMenggunakan
Pewarna Hematoksilin...179 Lampiran 8
8A Data pengamatan indeks mitosis sel ujung akarAllium
sativum...184
8B Analisis statistik data indeks mitosisAllium sativum...189
Lampiran 9
9A Data pengamatan indeks mitosis sel ujung akarAllium
cepa...194 9BAnalisis statistik data indeks mitosisAllium cepa...199 Lampiran 10
10AData pengamatan indeks mitosis sel ujung akarAllium
fistulosum...204
10B Analisis statistik data indeks mitosisAllium fistulosum....209
Lampiran 11
11A Hasil Telaah Penelaah 1 : Telaah Penyerapan Warna Hematoksilin Pada Preparat Semi Permanen Mitosis
Squash Allium...214
11B Hasil Telaah Penelaah 1 : Telaah Tampilan Umum
Pada Preparat Semi Permanen MitosisSquash Allium
xxii
Menggunakan Pewarna Hematoksilin... 230
11DHasil Telaah Penelaah 1 : Telaah Penyerapan Warna
FiltratSyzygium cuminiPada Preparat Semi Permanen
MitosisSquash Allium...239
11E Hasil Telaah Penelaah 1 : Telaah Tampilan Umum
Pada Preparat Semi Permanen MitosisSquash Allium
Menggunakan Pewarna FiltratSyzygium cumini...249
11F Hasil Telaah Penelaah 1 : Telaah Tampilan Manfaat
Preparat Semi Permanen MitosisSquash Allium
Menggunakan Pewarna FiltratSyzygium cumini...255
Lampiran 12
12AHasil Telaah Penelaah 2 : Telaah Penyerapan Warna
Hematoksilin Pada Preparat Semi Permanen Mitosis
Squash Allium...264
12B Hasil Telaah Penelaah 2 : Telaah Tampilan Umum
Pada Preparat Semi Permanen MitosisSquash Allium
Menggunakan Pewarna Hematoksilin... 274
12C Hasil Telaah Penelaah 2 : Telaah Tampilan Manfaat
Preparat Semi Permanen MitosisSquash Allium
Menggunakan Pewarna Hematoksilin... 280
12DHasil Telaah Penelaah 2 : Telaah Penyerapan Warna
FiltratSyzygium cuminiPada Preparat Semi Permanen
MitosisSquash Allium...289
12E Hasil Telaah Penelaah 2 : Telaah Tampilan Umum
Pada Preparat Semi Permanen MitosisSquash Allium
Menggunakan Pewarna FiltratSyzygium cumini...299
12F Hasil Telaah Penelaah 2 : Telaah Tampilan Manfaat
Preparat Semi Permanen MitosisSquash Allium
xxiii
13AHasil Telaah Penelaah 3 : Telaah Penyerapan Warna
Hematoksilin Pada Preparat Semi Permanen Mitosis
Squash Allium...314
13B Hasil Telaah Penelaah 3 : Telaah Tampilan Umum
Pada Preparat Semi Permanen MitosisSquash Allium
Menggunakan Pewarna Hematoksilin...324
13C Hasil Telaah Penelaah 3 : Telaah Tampilan Manfaat
Preparat Semi Permanen MitosisSquash Allium
Menggunakan Pewarna Hematoksilin...330
13DHasil Telaah Penelaah 3 : Telaah Penyerapan Warna
FiltratSyzygium cuminiPada Preparat Semi Permanen
MitosisSquash Allium...339
13E Hasil Telaah Penelaah 3 : Telaah Tampilan Umum
Pada Preparat Semi Permanen MitosisSquash Allium
Menggunakan Pewarna FiltratSyzygium cumini...349
13F Hasil Telaah Penelaah 3 : Telaah Tampilan Manfaat
Preparat Semi Permanen MitosisSquash Allium
1 A. Latar Belakang
Wilson (1962) menjelaskan, pada pengamatan preparat mitosis yang diamati adalah pola kromosom di dalam inti saat proses pembelahan sel. Kromosom merupakan materi genetik yang berperan dalam pewarisan sifat suatu individu. Kualitas preparat yang digunakan selama kegiatan pengamatan memengaruhi pemahaman siswa dalam mempelajari pembelahan mitosis sel (Jones dan Rickards, 1991). Fakta di lapangan menunjukkan penggunaan preparat kualitas rendah dapat menyebabkan siswa sulit memahami konsep pembelahan mitosis sel.
Berdasarkan hasil wawancara yang dilakukan peneliti dengan dua guru biologi di dua Sekolah Menengah Atas (SMA) diantaranya SMA Negeri 8 Surabaya dan SMA Negeri 1 Kamal, preparat mitosis di laboratorium sekolah yang digunakan sebagai bahan praktikum pengamatan mitosis memiliki kelemahan yaitu sebagian besar fase-fase pembelahan sel pada preparat tidak dapat dilihat dengan jelas. Kelemahan preparat menyebabkan guru tidak dapat menjelaskan secara konkret fase pembelahan sel dan bentuk sebenarnya kromosom kepada siswa. Pada dasarnya preparat mitosis dapat dibuat sendiri oleh guru dengan menggunakan bahan dan metode yang sederhana.
Bahan utama pembuatan preparat mitosis adalah sel yang melakukan pembelahan mitosis. Sel-sel yang sedang melakukan mitosis ditemukan pada bagian tanaman yang aktif mengalami pertumbuhan (meristematis), paling mudah ditemukan pada bagian ujung akar (Loveless, 1983). Akar mudah tumbuh dan seragam,sel akar tidak berklorofil serta mudah dipulas oleh pewarna (Fukui,1996).
Ujung akar beberapa spesies dari genus Allium diantaranya adalah bawang putih (Allium sativum), bawang bombay (A. cepa) dan bawang prei (A. fistulosum) merupakan bahan yang baik untuk diproses menjadi preparat mitosis karena kromosom ketiga spesies tersebut termasuk bertipe besar serta memiliki jumlah autosom sedikit yaitu 16 kromosom sehingga kromosom mudah diamati (Fukui, 1996). Selain itu, tanaman tersebut mudah didapat dan murah.
Pemulasan kromosom pada pembuatan mitosis umumnya menggunakan pewarna basa. Kromosom terdiri dari benang-benang kromatin, tersusun dari untaian basa nukleotida yang membentuk untaian DNA. Pada fase pembelahan sel bagian kromatin yang bersifat asam akan terkondensasi, menebal akan dapat terpulas dengan hematoksilin sebagai pewarna basa (Suntoro, 1983). Pemulasan akan mengontraskan kromosom dari organel sel yang lain sehingga dapat diamati serta dikenali dengan bantuan mikroskop. Hematoksilin merupakan pewarna alami hasil ekstrak batang tanamanHaematoxylum campechianum.
Hematoksilin sendiri sebenarnya bukanlah zat warna, karena tidak dapat memberikan warna (Kiernan, 2010). Untuk dapat berfungsi sebagai pewarna, hematoksilin harus dioksidasi terlebih dahulu menjadi hematein melalui proses ripening yang membutuhkan waktu selama berbulan-bulan. Pada penggunaannya, hematein harus dilarutkan dengan larutan tertentu dan bila disimpan dalam waktu lama akan rusak. Harga hematein yang relatif mahal yaitu Rp7,798,000/25 gram (http://www.merckmillipore.com) juga menjadi keluhan sekolah dalam memperoleh pewarna hematein. Untuk mengatasi keterbatasan sekolah dalam memperoleh hematein dan kelemahan lain maka dibutuhkan pewarna alternatif yang memiliki fungsi sama sebagai pemulas kromosom yaitu menggunakan filtrat kulit buah tanamanSyzygium cumini.
terlampau matang dan tidak dipanen akan jatuh ke tanah tidak dimanfaatkan penduduk hanya dibiarkan begitu saja menjadi sampah. Selama ini, pemanfaatan tanaman S.cumini umumnya hanya sebatas sebagai bahan obat (Ayyanar dan Babu, 2012). Pemanfaatan buah S. cumini sebagai pewarna alternatif alami dalam pembuatan preparat mitosis dapat menekan biaya pembuatan preparat serta mempertinggi nilai manfaat buahS. cumini.
Warna merah tua keunguan buah S. Cumini merupakan ekspresi dari pigmen sianidin yang terkandung didalam kulit buah (Sah dan Verma, 2011). Sianidin adalah glukosida dari antosianidin yang tergolong senyawa flavonoid. Senyawa flavonoid merupakan contoh senyawa metabolit sekunder yang banyak ditemukan pada tanaman (Manitto, 1992; Harborne, 2006) .
mitosis pada preparat memengaruhi penilaian kelayakan preparat dalam kaitan keakuratan materi. Agustin (2009) juga melakukan uji coba penggunaan preparat mitosis A. ascalonicum sebagai media pembelajaran untuk membantu siswa mengamati pembelahan mitosis secara langsung. Uji coba ini mendapat respon positif sebesar 60% dari siswa dengan persentase ketuntasan hasil belajar siswa sebesar 60%. Penelitian lain tentang pemanfaatan media preparat dalam pembelajaran juga pernah dilakukan oleh Kusumawati (2008). Pemanfaatan media preparat stomata dan foto stomata daun sebagai media pembelajaran menunjukkan rata-rata hasil belajar siswa sebesar 78,01 dengan ketuntasan klasikal 92,5%; rata-rata aktivitas siswa yang positif sebesar 78,23%; rata-rata persentase tanggapan siswa terhadap media pembelajaran sebesar 82,38% sehingga awetan stomata dan foto stomata daun efektif digunakan dalam kegiatan pembelajaran konsep struktur dan fungsi organ tanaman. Penelitian yang dilakukan oleh Zaini (2011) yaitu mengembangkan media kromosom untuk membantu siswa dalam memahami konsep kromosom mendapat respon positif siswa sebesar 95%.
Lonchocarpus cyanescens, Pterocarpus osun untuk pewarna jaringan tanaman (Akinloye, et al., 2010); ekstrak Lawsonia inermis, Hibiscus sabdariffa untuk pewarna jaringan hewan (Wiam, et al., 2006); filtrat Punica Granatum untuk pewarna atrosit dan neuron (Gharravi,et al., 2006).
Berkaitan dengan latar belakang di atas, maka penulis berniat untuk melakukan penelitian dengan judul “Studi Indeks Mitosis Meristem Ujung Akar Tanaman Bawang untuk Pembuatan Preparat Mitosis sebagai Media Pembelajaran pada Materi Pembelahan Sel”.
B. Rumusan Masalah
Berdasarkan latar belakang yang telah diuraikan dapat dirumuskan permasalahan:
1. Apa saja tanaman alternatif yang dapat digunakan sebagai bahan utama pembuatan preparat squash untuk pengamatan mitosis?
2. Bagaimana waktu pemotongan ujung akar tanaman bawang untuk digunakan sebagai acuan dalam pembuatan preparat mitosis?
3. Bagaimana kelayakan pemanfaatan filtrat Syzygium cumini sebagai pewarna alternatif untuk pembuatan preparat mitosissquash?
4. Bagaimana kelayakan media preparat mitosis tentang indeks mitosis yang menggunakan pewarna filtrat kulit buahSyzygium cumini?
C. Tujuan Penelitian
Tujuan penelitian yang ingin dicapai dalam penelitian ini adalah untuk:
2. Menemukan acuan waktu pemotongan ujung akar tanaman bawang untuk pembuatan preparat mitosis yang didasarkan pada nilai indeks mitosis tertinggi tanaman bawang.
3. Mengembangkan pewarna alternatif dari filtrat kulit buah Syzygium cumini untuk pemulasan kromosom dalam pembuatan preparat mitosis.
4. Mendeskripsikan kelayakan media preparat mitosis tentang indeks mitosis yang menggunakan pewarna filtrat kulit buahSyzygium cumini.
D. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat bermanfaat diantaranya:
1. Memberikan informasi bagi guru dan peneliti lain tentang waktu potong ujung akar yang tepat dalam membuat preparat mitosis, alternatif pemilihan bahan utama serta penggunaan pewarna alternatif filtrat Syzygium cumini untuk menekan biaya pembuatan preparat mitosis. 2. Menyediakan media preparat mitosis sebagai sumber
belajar bagi siswa untuk mendukung kegiatan praktikum. 3. Memberikan pengalaman bagi peneliti dalam membuat
preparat mitosis yang berguna sebagai bekal dalam mengajarkan konsep-konsep pembelahan sel.
E. Batasan Penelitian
Supaya penelitian ini mengenai sasaran dan tidak meluas, maka diberi batasan-batasan masalah sebagai berikut:
2. Faktor endogen dan eksogen tidak termasuk dalam penelitian ini.
3. Indeks mitosis tertinggi setiap spesies dijadikan sebagai waktu potong acuan dalam pembuatan preparat.
4. Kriteria buah Syzygium cumini yang digunakan sebagai pewarna alternatif yaitu buah berwarna ungu tua dan telah jatuh dari pohon
5. Materi biologi yang akan dibahas adalah pembelahan mitosis sel.
11 A. Media Pembelajaran
Media adalah salah satu komponen komunikasi, yaitu sebagai pembawa pesan dari komunikator menuju komunikan. Media pembelajaran merupakan sarana atau alat yang membawa pesan-pesan atau informasi yang bertujuan instruksional atau megandung pengajaran untuk mengefektifkan komunikasi dan interaksi antara guru (komunikator) dan siswa (komunikan) dalam proses pembelajaran sehingga mendorong terjadinya proses belajar pada siswa yang dapat meningkatkan pemahaman siswa mengenai informasi yang disampaikan sehingga dapat meningkatkan efektivitas (tepat guna) dan efisiensi (daya guna) pencapaian tujuan pembelajaran. Media pembelajaran merupakan bagian integral dari proses pembelajaran dan bertumpu pada tujuan, materi, pendekatan, metode, dan evaluasi pembelajaran termasuk juga ke dalam kriteria ini yaitu tingkat perkembangan intelektual siswa (Arsyad, 2011). Penggunaan media pembelajaran memegang peranan penting dalam proses pembelajaran IPA untuk mengembangkan keterampilan proses sains siswa diantaranya keterampilan melakukan observasi, mengukur, mengelompokkan, menafsirkan, memprediksi dan membuat kesimpulan.
media pembelajaran sangat berkaitan erat dengan tahapan berfikir tersebut sebab melalui media pembelajaran hal-hal yang abstrak dapat dikonkretkan, dan hal-hal yang kompleks dapat disederhanakan. Sebagaimana yang diungkapkan Arsyad (2011) bahwa penggunaan media akan membuat pembelajaran lebih menarik perhatian siswa dan memperjelas makna materi pembelajaran yang diberikan sehingga lebih mudah dipahami oleh siswa dan memungkinkan siswa menguasai tujuan pengajaran lebih baik.
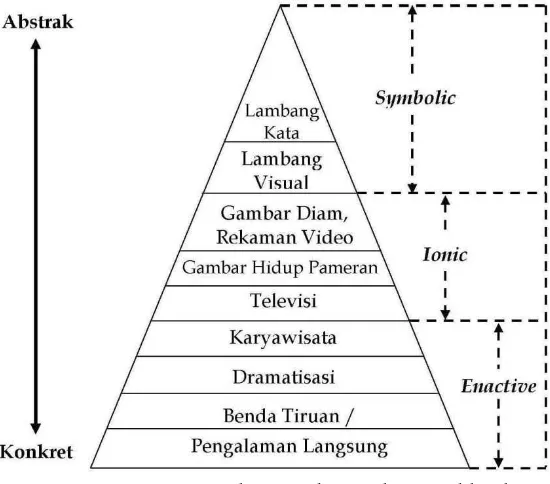
Gambar 2.1Kerucut pengalaman Edgar Dale yang dikaitkan dengan tahap pengalaman dari Bruner (Arsyad 2011).
langsung (konkret), menuju siswa sebagai pengamat atas suatu kejadian tidak langsung (melalui beberapa medium), dan akhirnya siswa mengamati simbol-simbol yang mewakili kejadian itu. Kerucut Pengalaman Dale merupakan elaborasi dari konsep tiga tingkatan yang dikemukakan oleh Bruner, yaitusymbolic experience, ionic experiencedanenactive experience. Pengalaman belajar konkret yang secara langsung dialami siswa terletak di bagian bawah kerucut.
Arsyad (2011) mengemukakan tiga ciri media:
1. Ciri Fiksatif (Fixative Property), media mampu merekam, menyimpan, melestarikan, dan merekonstruksi suatu peristiwa atau objek sehingga memungkinkan suatu rekaman kejadian atau objek yang terjadi pada satu waktu tertentu ditransportasikan tanpa mengenal waktu. 2. Ciri manipulatif (Manipulative Property), media mampu
menransformasi suatu objek atau kejadian sehingga konsistensi informasi objek atau kejadian terjamin sama atau hampir sama dengan aslinya.
3. Ciri distributif (Distributive Property), media memungkinkan suatu objek atau kejadian ditransportasikan melalui ruang, dan secara bersamaan kejadian tersebut disajikan kepada sejumlah besar siswa dengan dengan stimulus pengalaman yang relatif sama mengenai kejadian itu.
Arsyad (2011) mengemukakan beberapa jenis media pembelajaran diantaranya:
1. Media cetak/teks, meliputi: buku, brosur, leaflet dan handout. Bahan grafis juga tergolong media cetak yang memuat informasi dan pengetahuan spesifik misalnya: gambar, diagram,chart, grafik, poster, dan kartun;
3. Media audio, misalnya kaset,compact disk(CD);
4. Gambar bergerak/motion pictures, media yang mampu memperlihatkan gambar bergerak yag diintegrasikan dengan unsur suara;
5. Multimedia, media ini dapat menampilkan pesan dan pengetahuan dalam bentuk gabungan antara beberapa unsur seperti: teks, audio, grafis, video, dan animasi; 6. Media berbasis web atau internet.
Adapun untuk memilih jenis media yang tepat saat akan digunakan pada proses pembelajaran, maka Arsyad (2011) menjelaskan beberapa kriteria pemilihan media diantaranya:
1. Sesuai dengan tujuan yang dicapai media dipilih berdasarkan tujuan instruksional yang telah ditetapkan dan mengacu kepada salah satu atau gabungan dari dua atau tiga ranah kognitif, afektif dan psikomotor;
2. Tepat untuk mendukung isi pelajaran yang sifatnya fakta, konsep, prinsip atau generalisasi;
3. Praktis, luwes, dan bertahan lama;
4. Keterampilan guru untuk menggunakannya artinya apapun jenis media yang diperlukan maka guru harus dapat menggunakannya dalam proses pengajaran. Nilai dan manfaat bukan pada medianya tetapi dampak penggunaannya oleh guru pada saat terjadinya interaksi belajar siswa dengan lingkunganya;
5. Pengelompokan sasaran, kesesuaian dengan sarana belajar yaitu karakteristik atau kondisi anak dan tujuan pembelajaran;
6. Mutu teknis yaitu kesesuaian antara situasi dan kondisi anak.
1. Memperjelas penyajian pesan dan informasi sehingga dapat meningkatkan proses dan hasil belajar serta kegiatan pembelajaran menarik;
2. Meningkatkan dan mengarahkan perhatian siswa sehingga menimbulkan motivasi belajar siswa, membantu siswa berinteraksi dengan lingkungannya; 3. Mengatasi keterbatasan indera, ruang dan waktu; 4. Memberikan kesamaan pengalaman kepada siswa. B. Media Preparat Sebagai Media Pembelajaran
Penyajian preparat sebagai media pembelajaran biologi merupakan salah satu media dalam komunikasi edukatif yang dapat mengembangkan keterampilan proses siswa sehingga tidak dapat dipisahkan dari suatu proses belajar mengajar. Budiono (1992) menjelaskan manfaat penggunaan preparat sebagai media pembelajaran dalam kegiatan belajar mengajar antara lain:
1. Mengatasi perbedaan pengalaman siswa, preparat membantu guru dalam menjelaskan bentukan sebenarnya dari objek mikroskopis melalui pengamatan dengan bantuan mikroskop membuat siswa mendapatkan pengalaman dan persepsi yang sama mengenai objek yang mereka amati;
2. Mengatasi keterbatasan ruang, waktu dan daya indera, preparat mikroskopis dapat mengatasi objek yang sangat kecil untuk dilihat dengan mata telanjang melalui pengamatan menggunakan mikroskop;
3. Menimbulkan interaksi siswa dengan lingkungan, dalam kegiatan praktikum menggunakan bahan preparat mikroskopis akan terjadi interaksi antara siswa dengan siswa, guru ataupun dengan preparat sebagai objek nyata; 4. Menanamkan konsep dasar yang benar dan konkrit, preparat mikroskopis menyajikan objek yang nyata kepada siswa; 5. Membangkitkan minat dan keinginan siswa dalam belajar,
preparat mikroskopis menampilkan sel-sel maupun jaringan yang tak tampak oleh mata telanjang maka dengan bantuan mikroskop siswa dapat mengamati sel-sel maupun jaringan membuat minat dan keinginan siswa dalam ingin tahu hal-hal yang baru akan selalu timbul; 6. Mempertinggi retensi dan efektivitas belajar, melalui kegiatan
7. Memfokuskan pengajaran dan meningkatkan kualitas pengajaran, tampilan sel-sel maupun jaringan pada preparat mikroskopis dapat memfokuskan pandangan dan mengarahkan perhatian para siswa kepada objek yang mereka amati. Hal ini berdampak positif dalam pengaruh terhadap penguasaan materi pelajaran yang lebih baik oleh siswa.
C. Zat Warna
Zat warna merupakan suatu senyawa kompleks yang memiliki warna dan kemampuan afinitas yang selektif dengan materi yang diwarnainya. Suatu zat warna memiliki gugus chromophoreyaitu gugus senyawa radikal yang terdiri dari ikatan rangkap terkonjugasi yang mengandung elektron terdelokalisasi dan auxochrome (Suntoro, 1983). Gugus chromophorebiasanya meliputi gugus nitro (-NO2 atau =NO-OH), karbonil (-C=O-), karbon (-C=C-), azo (-N=N-), karbon-nitrogen (-CH=N-), nitroso (-O=N-O-), dan sulfur (C=S). Struktur senyawa yang mengandung chromophore disebut sebagai kromogen. Kromogen umumnya ditemukan dalam senyawa aromatis cincin benzena, naftalena, atau antrasena yang didalamnya terdapat gugus auxochrome. Gugus chromophore berfungsi menyerap radiasi elektromagnetik di daerah panjang gelombang ultraviolet. Adanya gugus auxochrome di dalam gugus chromophore akan memengaruhi pergeseran batokromik - pergeseran panjang gelombang yang lebih panjang (λmax) sehingga memberikan peningkatan absorpsi dan kekuatan ikatan pada suatu senyawa. Beberapa gugus auxochrome adalah –NH2, -NH-, -OH, -O- (Mehta dan Mehta, 2005).
pemakaiannya. Zat warna yang langsung dapat mewarnai jaringan disebut zat warna substantif dan zat warna yang memerlukan zat-zat pembantu supaya dapat mewarnai jaringan disebut zat warna ajektif. Kemudian penggolongan zat warna berdasarkan pada sistemchromophoreyang berbeda diantaranya golongan zat warna triphenil methane, golongan zat warna xanthene, golongan zat warna thiazine, golongan zat warna azine, golongan zat warna azo, dan golongan zat warna nitro.
D. Pulasan (Pewarnaan) Kromosom dengan Hematoksilin dan FiltratSyzygium cuminiLinn
Pulasan (pewarnaan) adalah proses pemberian warna pada jaringan yang telah dipotong sehingga unsur jaringan menjadi kontras dan dapat diamati serta dikenali dengan bantuan mikroskop. Zat warna yang umum digunakan untuk pulasan dalam pemeriksaan histologi bersifat seperti senyawa asam atau basa yang mempunyai kecenderungan untuk membentuk ikatan elektrostatik dengan gugus-gugus jaringan yang dapat berionisasi. Komponen jaringan yang lebih mudah diwarnai dengan zat warna basa disebut basofilik sedangkan yang menpunyai afinitas terhadap zat warna asam disebut asidofilik (Suntoro, 1983).
Pada pewarnaan inti sel / kromosom diperlukan suatu ion logam sebagai pengikat antara zat warna dengan jaringan kromosom. Zat warna dan jaringan terdiri dari ligan yang akan mengikat ion logam sehingga terbentuk senyawa kompleks. Senyawa kompleks merupakan senyawa yang tersusun dari suatu ion logam pusat dengan satu atau lebih ligan yang menyumbangkan pasangan elektron bebasnya kepada ion logam pusat dalam formasi kelat.
Ligan adalah suatu ion atau molekul yang memiliki sepasang elektron atau lebih yang dapat disumbangkan. Ligan akan bertindak sebagai agen kelating terhadap ion logam sehingga terbentuk kelat. Ligan merupakan basa lewis yang dapat terkoordinasi pada ion logam atau sebagai asam lewis membentuk senyawa kompleks. Jika suatu logam transisi berikatan secara kovalen koordinasi dengan satu atau lebih ligan maka akan membentuk suatu senyawa kompleks, dimana logam transisi tersebut berfungsi sebagai atom pusat (Day dan Underwood, 1998). Ion logam yang biasa digunakan dalam pewarnaan disebut mordant.Mordant yang umum digunakan dalam pewarnaan histologi berupa garam elektrolit daripotassium alum, ammonium alum, iron alum, dan chrome alum.
menjadi berwarna. Selain itu, struktur fenolik atau polifenolik pada golongan senyawa flavonoid berfungsi sebagai pengkelat logam karena adanya satu gugus karboksil dan satu gugus fenolik atau dua gugus hidroksil yang berdekatan dapat bereaksi dengan ion logam membentuk suatu komplek yang stabil (Day dan Underwood, 1998). Struktur fenolik juga berfungsi sebagai auxchrome yaitu ikatan –OH pada gugus katekol. Senyawa flavonoid yang dapat digunakan sebagai pewarna adalah hematoksilin dan sianidin. Struktur kimia gugus chromophore dan auxchrome pada molekul sianidin (A) dan hematein (B) (Gambar 2.2)
A B
Gambar 2.2Struktur kimia guguschromophoredanauxchrome pada molekul sianidin (A) dan hematein (B) (Sumber: Robinson, 1991)
1. Hematoksilin
Hematoksilin adalah senyawa falvonoid rumit hasil ekstraksi dari pohon Haematoxylum campechianum yang merupakan contoh pewarnaan alami. Baker (1958) dan Kiernan (2010) menjelaskan hematoksilin sendiri sebenarnya bukanlah zat warna, karena tidak dapat memberikan warna. Struktur hematoksilin (C16H14O6) seperti pada gambar 2.3.1 terdiri atas dua gugus orto-hidrokuinon (katekol) yang dihubungkan oleh rantai alifatik tak jenuh empat karbon. Molekul hematoksilin harus dioksidasi menjadi hematein dengan melepas dua atom hidrogen sehingga berubah menjadi hematein (C16H12O6) seperti pada gambar 2.3.2. Proses oksidasi senyawa hematoksilin dikenal sebagai ripening yang membutuhkan waktu berbulan-bulan dan dapat dipercepat prosesnya dengan menambahkan senyawaan yang bertindak sebagai oksidator seperti merkuri oksida, hidrogen peroksida, potassium permanganat dan sodium iodat.
Gambar 2.3Struktur kimia molekul hematoksilin, hematein, hematein anion (Sumber: Kiernan, 2010)
Hematein yang dilarutkan dengan menambahkan mordant iron alum [Fe(NH4)(SO4)2·12H2O], akan membentuk iron hematein yaitu ikatan antara hematein denganiron. Campuran pewarna dan mordant membentuk ikatan kompleks yang terbentuk oleh pewarna hematein dan ion logamiron. Campuran ini disebutlake(Baker, 1958)
Gambar 2.4.1 (HmFe)2+ Gambar 2.4.2 (HmFe2)2+ Gambar 2.4Kompleks hematein-mordantiron (HmFe)
(Sumber: Kiernan, 2010) Gambar 2.3.1
Molekul Hematoksilin (C16H14O6) dalam bentuk serbuk berwarna kuning (berwarna
putih bila tanpa oksigen)
Gambar 2.3.2 Molekul Hematein
(C16H12O6) dalam bentuk terlarut berwarna merah kekuningan
pada pH 5 (λmax= 445 nm)
Gambar 232.3 Molekul Hematein
Anion dalam bentuk terlarut
berwarna keunguan (violet)pada pH <7
Iron alum yang larut akan membebaskan kation besi (III) (Fe3+). Hematein anion akan mengikat Fe3+ menjadi senyawa kompleks melalui proses pengkelatan sesuai reaksi asam-basa lewis. Ikatan terjadi diawali dengan terdelokalisasinya kation H+ pada 1-hidro-2-oksi-quinon akibat ion Fe3+ yang terikat menggantikan posisi H+. Delokalisasi H+ menyebabkan orto-hidrokuinon bermuatan negatif berubah menjadi orto-hidroquinon (katekol). Kompleks yang terbentuk adalah hematein dan satu logam iron ((HmFe)2+) dengan dua elektron bebas pada atom Fe (Gambar 2.4.1). Iron hematein (HmFe)2+ memiliki isomer yang sama-sama menghasilkan warna merah pada bentuk larutan. Elektron yang tidak dipakai bersama pada ikatan rangkap atom O akan didonorkan pada Fe3+dan Fe3+juga mendonorkan satu elektron pada ikatan tunggal atom O, karena itu membentuk cincin beranggota lima. Dua ion Fe3+ yang bebas bertindak sebagai elektron donor kepada atom O pada ikatan anion fosfat seperti pada gambar 2.4.1. (Kiernan, 2010). Banyaknya ion Fe3+ bebas dalam bentuk larutan dapat bereaksi dengan gugus orto-hidrokuinon (katekol) pada kompleks (HmFe2+) sehingga membentuk (HmFe2)2+.
beranggota lima. Satu ion Fe2+ yang bebas bertindak sebagai elektron donor kepada atom O pada ikatan anion fosfat (Kiernan, 2010).
Pembentukan sebuah kompleks disebut sebagai reaksi asam-basa disebut sebagai reaksi asam-basa Lewis. Asam Lewis adalah penerima pasangan elektron sedangkan basa Lewis adalah penyumbang elektron pasangan (donor) (Day dan Underwood, 2001). Dalam proses pemulasan kromosom, kompleks (HmFe)2+ ataupun (HmFe2)+ bertindak sebagai penyumbang elektron dengan adanya elektron bebas dari atom Fe akan menyumbangkan satu ion Fe3+ (bertindak sebagai basa Lewis) pada fosfat anion (bertindak sebagai asam Lewis). Kompleks pewarna hematein yang mengikat mordant Fe ini disebut ligan, Fe3+ akan bertindak sebagai pengkelat pada senyawa kelat (ikatan kompleks pewarna hematein, mordant dan fosfat anion pada polinukleotida).
Gambar 2.5
Mekanisme reaksi antara pewarna hematein (HmFe)2+dengan fosfat anion (Sumber: Kiernan, 2010)
2. Syzygium cuminiLinn
lonjong, panjang 2-3 cm, buah berwarna hijau saat masih mudah, setelah masak warnanya merah keunguan. Biasanya buah jamblang yang masak dimakan segar. Rasanya agak asam sepat. Nama lain dari tanaman ini antara lain juwet (Jawa), jamblang (Sumatera), dhuwak (Madura) (Steenis,et al., 2008).
Warna merah tua keunguan buah S. cumini merupakan ekspresi dari pigmen sianidin yang terkandung didalam kulit buah (Sah dan Verma, 2011). Sianidin adalah glukosida dari antosianidin yang tergolong senyawa flavonoid. Senyawa flavonoid merupakan contoh senyawa metabolit sekunder yang banyak ditemukan pada tanaman. Sebagai kelompok antosianin maka stabilitas sianidin dipengaruhi oleh pH, temperatur, cahaya, oksigen serta faktor lainnya seperti ion logam. Ion logam yang sering ditemukan mengubah warna ialah magnesium dan aluminium.
Gambar 2.6Syzygium cumini: (a) daun, (b) bunga, (c) tanaman muda belum berbunga, (d) buahS. cuminimuda yang berwarna merah sampai ungu, (e) buahS. cuminimatang, (f) tanamanS. cuminidewasa
Sianidin (C15H10O6) seperti pada gambar 2.7.1 memiliki struktur dua gugus benzena tersubtitusi yaitu orto-hidrokuinon (katekol) dan meta-hidrokuinon (resorkinol) yang dihubungkan oleh rantai alifatik tak jenuh tiga karbon (Robinson, 1991). Pada keadaan terlarut dalam larutan alkali gugus katekol akan melepas ion H+ yaitu 1-hidro-2-oksi-quinon (gambar 2.7.2) dan berwarna berwarna merah lembayung.
Gambar 2.7Struktur kimia molekul antosianidin dalamSyzygium cuminidalam bentuk sianidin kation
(Sumber: Minghui,et al.,2009)
Senyawa sianidin memiliki dua gugus katekol (orto hidrokuinon). Pada setiap gugus katekol terdapat gugus hidroksil berdekatan yang dapat bereaksi dengan ion logam membentuk ikatan kompleks yang stabil (Day dan Underwood, 1998). Pada pewarnaan dengan penambahan mordaniron alum, atom O pada gugus fosfat DNA dan atom O pada gugus -OH katekol akan berfungsi agen pengkelat (ligan) ion Fe3+. Ikatan pewarna dan mordant membentuk ikatan kompleks disebut lake (Baker, 1958). Lake kemudian akan terikat dengan jaringan kromosom.
Gambar 2.7.1 Molekul Sianidin Kation (C15H11O6) berwarna merah
pada pH <3
Gambar 276.2 Molekul Sianidin
E. Mempelajari dan Memahami Mitosis Melalui Preparat Mitosis
Jones dan Rickards (1991) menjelaskan untuk membuat siswa bisa memahami dan mempelajari mitosis dalam kegiatan laboratorium, bergantung pada kualitas preparat mitosis yang diamati dan juga alat yang digunakan dalam pengamatan. Ketika mengamati preparat mitosis maka yang dilihat sebenarnya adalah siklus sel, pola dasar dari kelakuan kromosom seperti pada gambar 2.8 (Wilson dan Loomis, 1962). Berbagai variasi ukuran nukelus dalam tahap interfase bisa ditunjukkan dan dibahas dalam kaitannya dengan sintesis DNA dan replikasi kromosom. Selain itu, bisa juga digunakan untuk menghitung jumlah kromosom pada saat sel dalam tahap metafase atau anafase, atau juga digunakan untuk mempelajari morfologi kromosom. Sangat penting menekankan kepada siswa secara konkret bentuk nyata dari setiap fase untuk kemudian meminta siswa menggambarnya daripada hanya sekedar mengetahui nama-nama fase dari mitosis. Karena itulah, penting untuk memperhatikan kualitas dan kelayakan preparat mitosis yang akan diamati.
Jones dan Rickards (1991) dan Jurcak (1999) menjelaskan, di dalam sebuah preparat mitosis yang layak secara mikroteknik dan digunakan dalam pembelajaran di sekolah harus memiliki fase-fase lengkap pembelahan mitosis dan tampak jelas. Untuk membuat preparat dengan fase-fase lengkap mitosis, maka yang sangat perlu diperhatikan pada saat proses awal pembuatan adalah waktu pemotongan akar yang merupakan faktor kritis dalam menentukan hasil akhir preparat. Waktu pembelahan sel tiap tanaman berbeda-beda dan tidak konstan sepanjang hari, sebagai contoh waktu pemotongan dan fiksasi ujung akar yang baik untuk bawang bombay adalah pada pagi hari. Beberapa spesies tanaman memerlukan suhu tertentu dan lama penyinaran yang berbeda, sehingga untuk mendapatkan waktu yang tepat diperlukan pengamatan yang berulang-ulang pada waktu yang berbeda (Jurcak, 1999). Waktu pemotongan ini terkait dengan durasi mitosis dan indeks mitosis.
Agustin (2009) menyatakan dengan menggunakan mikroskop cahaya telah dapat melihat fase-fase mitosis asalkan kualitas lensa yang dipakai baik. Mikroskop elektrik dan mikroskop manual yang sumber cahaya dari cahaya matahari merupakan contoh mikroskop cahaya, namun mikroskop elektrik memiliki kualitas lensa yang lebih baik daripada mikroskop cahaya. Dengan menggunakan mikroskop elektrik perbesaran 10x40 sudah dapat dilihat jelas fase-fase mitosis (Jones dan Rickards, 1991).
Hasil penemuan aktivitas kromosom pada spesimen difoto dan kemudian diamati dengan software pada komputer sehingga memudahkan penghitungan jumlah kromosom. Beberapa kasus yang perlu diperhatikan di dalam melakukan pengamatan analisis kromosom yang dicantumkan pada tabel 2.1 (Jurcak, 1999).
Tabel 2.1Kesalahan yang Banyak Terjadi dalam Pengamatan Mitosis Sel dan Penyebabnya (Jurcak 1999).
Kesalahan Penyebab
Pemotongan material tanaman tidak pada waktu yang tepat.
Kromosom tidak
jelas. 1.Waktu fiksasi terlalu pendek.2.Konsentrasi pewarna terlalu rendah. 3.Pewarna yang digunakan sudah rusak atau
terlalu lama disimpan.
4.Suhu selama pewarnaan terlalu rendah. 5.Waktu pewarnaan terlalu pendek . Beberapa sel
menumpuk satu sama lain.
1.Waktu melunakan jaringan terlalu pendek. 2.Pembuatan larutan untuk maserasi tidak
tepat.
F. Durasi Mitosis dan Indeks Mitosis
Setyawan dan Sutikno (2000), menjelaskan setiap tanaman memiliki jam biologi yang mengatur waktu optimum pembelahan mitosis. Umumnya tanaman melakukan pembelahan sel pada pagi hari. Perbedaan durasi mitosis pada setiap spesies bergantung pada kondisi lingkungan. Temperatur dan nutrisi, merupakan faktor utama dalam durasi mitosis (Yadav, 2007).
Setiap sel pada setiap spesies memiliki kandungan DNA yang berbeda, semakin besar kandungan DNA maka semakin lama durasi mitosis. Keploidian tidak memengaruhi durasi waktu tersebut. Tanaman dikotil pada umumnya memiliki waktu yang lebih lama dalam satu siklus sel dibandingkan pada tanaman monokotil. Namun, secara umum fase interfase memerlukan waktu yang paling lama daripada fase profase (Singh, 2003).
Naithani dan Sarbhoy (1973) menuturkan bahwa suhu memengaruhi mitosis. Suhu optimum dalam pembelahan sel tanaman adalah 24oCelcius, namun suhu yang berbeda tidak memengaruhi Nilai Index Mitosis (IM) dan Fase Index Mitosis (PI) (Cistue dan Lasa, 1979). Dane (2006) menjelaskan beberapa kandungan makromolekul dan mikromolekul yang ada di lingkungan memengaruhi pertumbuhan dan perkembangan tanaman. Penumbuhan akar Allium cepa Sel meristem
pecah, tahapan mitosis atau kromosom tidak dapat dilihat.
1.Gelas penutup bergeser jauh ketika ditekan. 2.Gelas penutup ditekan terlalu keras atau
berulang-ulang.
Lensa mikroskop tergores atau pecah
dalam medium air yang mengandung lebih banyak makromolekul (Fe) dan mikromolekul (Mn dan Co), memperlihatkan aktifitas pemanjangan dan mitosis indeks yang tinggi. pH memengaruhi perpanjangan dan indeks mitosis akar A. cepa, akar A. cepa yang ditumbuhan pada media dengan pH yang lebih tinggi memiliki nilai perpanjangan dan indeks mitosis lebih tinggi dibandingkan akarA. cepayang ditumbuhkan pada media dengan pH yang lebih rendah. Bracale (1997) menjelaskan cekaman air mengakibatkan penurunan tingkat mitosis meristem ujung akar kacang tanah dengan cepat, hal ini berhubungan dengan enzim dehidrin yang menyebabkan siklus dari sel-sel terhenti pada fase G2. Sacks (1997) menyimpulkan pada ujung meristem akar jagung yang berada dalam cekaman air setelah dilakukan pengukuran berdasarkan tingkat produksi sel, terjadi penurunan tingkat pembelahan sel pada sel kortikal akar primer. Penurunan aktivitas siklus mitosis sel di bawah pengaruh cekaman air berhubungan dengan penurunan ekspresi daricyclin dependent kinase(Cdk) (Schuppler, 1998).
IM = x 100% Keterangan:
IM = Indeks Mitosis
Nm = jumlah sel yang bermitosis N = jumlah seluruh sel
Hasil penelitian Matias dan Fontanilla (2011) nilai indeks mitosis ujung akar tanaman dalam interval 1 jam selama 24 jam tidak selalu sama disebabkan adanya durasi dan jam biologi yang mengatur waktu pembelahan mitosis. Data periodisitias dan ritmisitas indeks mitosis diperoleh dengan mengetahui nilai indeks mitosis setiap jam. Berdasarkan data tersebut diketahui waktu potong yang terbaik yaitu waktu dimana terjadi indeks mitosis tertinggi. Waktu potong yang tepat digunakan sebagai acuan pembuatan preparat (Jurcak, 1999).
G. Siklus Sel
Siklus sel merupakan proses vital dan terjadi secara kontinu dalam kehidupan suatu organisme. Secara normal, siklus sel menghasilkan pembelahan sel. Pembelahan sel terdiri dari 2 proses utama, yaitu tahap persiapan (interfase) dan tahap pembelahan (Subowo, 2007). Pembelahan sel terbagi menjadi dua kategori yaitu mitosis dan meiosis. Keduanya merupakan bentuk proses pembelahan inti dan terjadi pada sel eukariot. Singh (2003) menjelaskan bahwa siklus sel terdiri dari beberapa fase yaitu fase G1 (Gap 1) → S (Sintesis DNA) → G2 (Gap 2).→ M (mitosis atau meiosis) → C (sitokinesis). Mitosis terjadi pada sel somatik sedangkan meiosis terjadi pada sel kelamin. Mitosis akan menghasilkan dua sel anak dengan jumlah kromosom yang identik baik secara kualitatif dan kuantitatif. Kromosom merupakan pembawa sifat yang diturunkan. Pembelahan sel sangat berperan penting dalam mewariskan sifat (genetik) yang ada
pada sel yang sedang membelah tersebut kepada sel-sel turunannya.
Suryo (2007) menjelaskan seluruh urutan kejadian mulai dari membelahnya nukelus sampai membelahnya nukelus berikutnya disebut siklus mitotik dari sel. Durasi siklus ini tidak sama antara satu spesies dengan spesies yang lain berkisar antara 3-174 jam. Namun, secara umum fase interfase memerlukan waktu yang paling lama dibandingkan fase lainnya (Singh, 2003).
Pertumbuhan sel atau siklus sel digambarkan sebagai jam, yang diatur oleh sinyal-sinyal (reseptor) yang memengaruhi yaitu sinyal internal berupa pesan-pesan dari kinetokor dan juga sinyal eksternal yang berasal dari faktor-faktor pertumbuhan (Campbell, 1987). Sel tidak selamanya membelah dan berhenti pada saat tertentu. Ada sel yang berhenti membelah (sel yang sudah berdiferensiasi) sehingga tidak lagi memiliki kemampuan untuk membelah. Semua faktor-faktor tersebut yang menentukan apakah sel dalam fase G0 (sel tidak membelah) atau akan membelah.
1. Interfase
Singh (2003) menjelaskan interfase disebut juga fase metabolik merupakan tahap yang paling penting pada siklus sel karena pada tahap ini secara metabolisme biokimia sel berada dalam keadaan sangat aktif untuk menyiapkan komponen-komponen untuk pembelahan sel. Pada fase interfase terjadi replikasi DNA dan transkripsi, menuju pada replikasi kromosom dan sintesis protein. Interfase dibagi dalam 3 fase yaitu: G1 (Gap 1) → S (Sintesis DNA) → G2 (Gap 2).
a. Fase G1 (Gap 1)
Fase G1 menghabiskan waktu 30-50% dari seluruh interfase. Selama fase ini nukleus membesar dan volume sitoplasma meningkat dengan cepat sehingga disebut fase sintesis, protein yang dapat memacu pembelahan sel, tubulin dan protein yang akan membentuk spindel (Suryo, 2007). Pada fase G1 sel akan memantau keadaan lingkungannya dan ukurannya sendiri, ini diperlukan untuk mengetahui sel sudah matang untuk melakukan pembelahan sel atau tidak. Jika sel tidak melakukan pembelahan sel, maka sel akan masuk dalam kondisi istirahat (fase G0) yang dapat membutuhkan waktu selama berminggu-minggu atau bertahun-tahun. Perbedaan variasi durasi siklus pembelahan berbagai jenis sel secara umum bergantung dari proses selama fase G1 (Subowo, 2001).
b. Fase S (Sintesis DNA)
Replikasi DNA terjadi dengan bantuan enzim DNA-polimerase sehingga rantai tunggal DNA menjadi rantai ganda menyebabkan jumlah DNA dalam inti meningkat dua kali semula, dengan ini pembelahan sel akan dipersiapkan (Subowo, 2007). Suryo (2007) menyebutkan bahwa pada akhir fase ini terbentuk dua kromatid.
c. Fase G2 (Gap 2)
Fase G2 menghabiskan waktu 10-20% dari seluruh interfase. Pada fase ini DNA cepat sekali bertambah kompleks dengan protein kromosom, juga dibentuk RNA serta protein lainnya (Suryo, 2007). Pada akhir fase G2 terjadi aktivasi enzim kinase untuk katalisator fosforilasi (Subowo, 2007).
2. Mitosis a. Profase
Profase merupakan transisi dari fase G2 ke fase pembelahan inti atau mitosis (M) dari siklus sel. Pada fase awal profase, kromatin yang menyebar selama interfase secara perlahan-lahan terkondensasi menjadi kromosom. Kromosom akan memendek dan menebal dengan bentuk memanjang. Pada saat interfase dan profase, inti, kinetokor (sentromer), terletak pada satu kutub (tidak terletak acak), sementara telomere-telomer berhadapan sebaliknya dengan kinetokor dan melekat pada membran inti. Dua sister kromatid dari tiap kromosom letaknya berdekatan dan dihubungkan oleh sentromer. Selama profase, nukleolus dan membran nukleus menghilang. Mendekati akhir profase, terbentuk spindle kemudian kromosom-kromosom akan menempatkan diri di bidang ekuator dari sel seperti pada gambar 2.9 (Singh, 2003; Suryo, 2007).
Gambar 2.9Profase
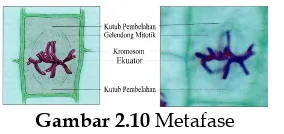
(Sumber: Stern, Jank dan Bidlack, 2008) b. Metafase
Gambar 2.10Metafase
(Sumber: Stern, Jank dan Bidlack, 2008) c. Anafase
Pada fase anafase, diawali oleh membelahnya kinetokor menjadi dua bagian yang masing-masing fungsional, sehingga kedua kromatid kakak beradik dari metafase memisahkan diri dan bergerak ke masing-masing kutub pembelahan. Pada fase akhir profase gelendong mitotik menghilang dan dihasilkan dua kelompok kromosom kompak dengan jumlah kromosom dan bahan genetik secara kuantitaif sama dalam masing-masing sel anakan seperti pada gambar 2.11 (Singh, 2003; Suryo, 2007).
Gambar 2.11Anafase
(Sumber: Stern, Jank dan Bidlack, 2008) d. Telofase
3. Sitokinesis
Pembagian sitoplasma dan organel-organel antara sel anak disebut sitokinesis, yang dimulai selama tahap telofase akhir sehingga akan terbentuk dua sel anakan yang identik. Sitokinesis pada tanaman berbeda dari pada hewan. Pada tanaman ditandai dengan terbentuknya pelat sel (dinding pemisah) di daerah ekuator sel sedangkan pada hewan ditandai dengan proses pelekukan sel ke dalam seperti pada gambar 2.12 (Singh, 2003; Suryo, 2007).
Gambar 2.12Telofase dan sitokinesis (Sumber: Stern, Jank dan Bidlack, 2008) H. Penelitian yang Relevan
Pembelajaran dengan menggunakan media preparat sudah pernah dilakukan oleh beberapa peneliti. Dari beberapa hasil penelitian tersebut sebagan besar menunjukkan bahwa penerapan pembelajaran dengan menggunakan media preparat dapat mengoptimalkan hasil belajar siswa. Hasil penelitian tersebut antara lain:
2. Mutaqin (2008) menyatakan dengan memanfaatkan preparat awetan sebagai media pembelajaran pada materi sistem ekskresi kepada 39 siswa menunjukkan rata-rata hasil belajar 73,58% dan persentase kelulusan klasikal 79,62%. Skor hasil analisis angket tanggapan siswa terhadap penggunaan media pembelajaran sebesar 81% dan skor hasil analisis angket tanggapan ahli terhadap kelayakan media pembelajaran sebesar 77%. Disimpulkan bahwa preparat awetan layak dimanfaatkan sebagai media pembelajaran pada materi sistem ekskresi.
3. Agustin (2009) menyatakan hasil telaah preparat mitosis ialah 80,5% dari 8 aspek kriteria penilaian dengan kategori sangat baik dan dapat dikatakan layak untuk diujicobakan. Persentase langkah kegiatan RPP yang terlaksana pada pertemuan pertama sebesar 80,76% dan pada pertemuan kedua terlaksana sebesar 97,222%. Sebanyak 57% siswa menganggap konsep dapat dipahami dengan menggunakan media preparat mitosis. 4. Zaini (2011) menyatakan dengan menggunakan media
preparat kromosom Drosophila sp. dan student worksheet dapat membantu siswa dalam memahami konsep kromosom. Sebanyak 95% siswa merespon positif pembelajaran dengan menggunakan media preparat kromosom Drosophila sp. dan student worksheet dapat membantu siswa dalam memahami konsep kromosom. Beberapa temuan lain dari penelitian sebelumnya yang mendukung penelitian ini, akan diuraikan antara lain:
2n = 14 : 14m. Ukuran kromosom kedua spesies relatif besar dan terpencar-pencar sehingga sangat cocok untuk studi eksperimental mitosis.
2. Anggarwulan (1999) menyatakan jumlah kromosom diploid dari beberapa spesies pada genus Allium yaitu Allium sativum, A. porrum, A. sp., A. ascalonicum, A. cepa dan A. fistulosum adalah sama, yaitu 16 buah kromosom, dengan hampir semua berbentuk metasentris sehingga memiliki rumus kariotip 2n = 16m, kecuali Allium sp. Dimana rumus kariotipnya 2n = 14m + 2sm, karena pasangan kromosom pertama berbentuk submetasentris. Secara berturut-turutAllium sativum, A. porrum, A. sp., A. ascalonicum, A. cepa dan A. fistulosum memiliki panjang keseluruhan kromosom haploid (HCL) adalah: 196,34; 137,27; 132,69; 124,71; 116,80 dan 113,60; indeks asimetri relatif (AsI%) adalah: 55,45; 54,88; 56,26; 57,30; 53,79 dan 57,70; sedang perbandingan pasangan kromosom terpanjang dan terpendek (R) adalah: 1,70; 2,67; 2,71; 1,60; 2,25 dan 2,28. A.ascalonicum berkerabat dengan A.fistulosum pada indek similaritas 80. A.cepa berkerabat dekat dengan Allium sp. pada indeks similaritas 75. Keempat spesies tersebut berkerabat dekat dengan A.porrum pada indek similaritas 65. Dan akhirnya kelima spesies tersebut berkerabat dekat dengan A.sativum pada indeks similaritas 35.
menunjukkan bahwa faktor cahaya tidak memengaruhi aktifitas mitosis, periodisitas dan ritmisitas tetap terjadi selama eksperimen. Besar intensitas cahaya yang diberikan sebesar 70-171,5 Fcandle tidak memengaruhi aktifitas mitosis. Akan tetapi, pada intensitas terang dan gelap terjadi secara periodik sedangkan pada cahaya terang-gelap terjadi secara ritmis. Penyebab adanya pola ini masih belum jelas tapi diperkirakan bahwa hal ini dikontrol oleh siklin dan protein kinase tergantung siklin (Cdk) yang dikenal sebagai hormon sitokinin. Tidak ada perbedaan nilai indeks mitosis yang berarti pada pemberian tiga intensitas cahaya yang berbeda-beda. Pemotongan akar disarankan dilakukan pada pukul antara 23.00 WIB sampai 01.00 WIB. Karena pada saat itulah indeks mitosis besar.
4. Shikara dan Al-Khafagi (2009) memanfaatkan pewarna alami dari ekstrak buah mulberry hitam (Morus nigra) sebagai pewarna alternatif pengganti Azur II Eosin, Giemsa dan Methylene blue untuk memulas kromosom sehingga dapat menekan biaya penelitian.
5. Dewi dan Wahyuni (2010) memanfaatkan pewarna alami dari ekstrak Breynia sp., Curcuma domestica, daun Tectona grandis, daun Annacardium sebagai pewarna alternatif pengganti safranin untuk pewarna inti sel sehingga dapat menekan biaya penelitian.
I. Kerangka Berpikir