Prosiding Tugas Akhir Semester Genap 2010/2011 SK - 091304
KITOSAN SEBAGAI MATRIKS PENDUKUNG AMMOBILISASI PAPAIN Khrisna Stefanus Pamungkas *, Refdinal Nawfa 1
Jurusan Kimia,
Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Teknologi Sepuluh Nopember, Surabaya
ABSTRAK
Industri pengolahan udang menghasilkan limbah udang berupa kulit atau cangkang udang yang merupakan biopolimer terbanyak kedua setelah selulosa dan merupakan sumber potensial kitosan. Derivat kitin yaitu kitosan telah diaplikasikan pada beberapa bidang seperti industri farmasi dan biomedis sebagai matriks pendukung untuk ammobilisasi enzim dan salah satu aplikasinya adalah untuk ammobilisasi enzim papain.
Enzim papain (dalam bentuk enzim kasar) yang diperoleh dari getah buah pepaya dapat digunakan untuk mendegradasi protein. Pemisahan enzim tersebut dilakukan dengan metode pengendapan yaitu dengan cara menambahkan larutan ammonium sulfat jenuh. Uji aktivitas katalitik menunjukkan adanya enzim proteolitik pada fraksi pengendapan 50%. Enzim tersebut selanjutnya diammobilisasi menggunakan matriks kitosan. Pada penelitian ini juga dilakukan optimasi waktu, pH, konsentrasi substrat dan uji perulangan terhadap pengaruh aktivitas enzim.
Hasil penelitian menunjukkan bahwa enzim papain ammobil memiliki aktivitas enzim optimum pada waktu inkubasi 4 jam, pH 8,0 dan konsentrasi substrat 4000 ppm. Hasil uji perulangan menunjukkan. Hasil uji perulangan ke 5 menunjukkan bahwa aktivitas enzim papain ammobil mengalami penurunan aktivitas sebesar 15%.
Kata kunci : Kitosan, Papain, Ammobilisasi Enzim
ABSTRACT
Industrial shrimp manufacture produces dumbs such as shrimp skin, in that skin have a lot of biopolymer after than cellulose and potential resource chitosan. Derivat of chitin as chitosan as long as aplication in several sector for example pharmation industrial and biomedic to support matrix enzyme immobilization.
Papain enzyme (that from of crude enzyme) from papayas latex can be used to reduce of protein.The separation of enzyme was done by precipitation with ammonium sulphate liquid. A test of catalityc activity showed there is a proteolytic enzyme in precipitate fraction when concentrate of ammonium sulphate is 50%. Then, the enzyme is immobilized with cross-linking method by using chitosan. In this research, optimation time, optimation pH, optimation substrate concentration, and repetition test was enzyme activity worked.
Based on the research, papain immobilized the result shows that papain immobilized enzyme has optimum enzyme activity from substrate with pH 8,0 and substrate concentration 4000 ppm for 4 hours. The result from repetition test shows immobil papain enzyme activity decrease 15%
PENDAHULUAN
Kemajuan bidang bioteknologi dan industri, memungkinkan dilakukannya berbagai upaya untuk memanfaatkan proses-proses enzimatis. Enzim mempunyai sifat yang potensial untuk dimanfaatkan, antara lain daya katalitiknya yang besar dan spesifitasnya terhadap substrat dari reaksi yang dikatalisisnya (Lehninger, 1990).
Pada industri yang menggunakan enzim tersebut, 59% enzim yang digunakan adalah kelompok protease, dimana salah satunya adalah papain. Papain dapat menghidrolisa ikatan peptida pada residu asam α-amino seperti tirosin, lisin, glutamin, histidin dan glisin. Papain merupakan protease sulfihidril, yang mempunyai residu sulfihidril (SH) pada situs aktifnya. Pada proses dan analisa yang melibatkan enzim, umumnya menggunakan cara bath yaitu mereaksikan substrat dengan enzim yang sudah dilarutkan dalam air, sehingga enzim bercampur dengan substrat (Sarah, 2001; Agustini, 2001).
Cara ini memiliki kelemahan karena enzim hanya digunakan sekali pakai. Secara teknis sangat sulit untuk memisahkan enzim dan produk dan mendapatkan kembali enzim yang aktif diakhir reaksi. Umumnya setelah reaksi selesai, enzim diinaktifkan dengan pemanasan, pengubahan pH, atau cara lain yang dapat menyebabkan enzim terdenaturasi (Chibata,1978).
Salah satu cara mengatasi kelemahan dalam penggunaan enzim tersebut adalah melalui imobilisasi enzim yaitu mengikatkan enzim pada bahan pendukung yang tidak larut air. Enzim dapat membentuk ikatan ionik, kovalen, ikatan silang atau terjebak pada bahan pendukung. Pada saat digunakan, enzim imobil dapat berfungsi sebagai katalis tanpa ikut terlarut dalam substrat (Darwis dan Sukara, 1990).
Setelah proses selesai, enzim imobil dapat dipisahkan dari produk dan diperoleh kembali, sehingga enzim imobil dapat dipakai berulangkali. Beberapa matriks pendukung yang dapat digunakan pada proses imobilisasi enzim antara lain bentonit, sheparose, gelatin dan kitosan. Pada penelitian ini digunakan kitosan sebagai matriks pendukung pada amobilisasi papain.
Kitin merupakan biopolimer alam paling melimpah kedua setelah selulosa. Senyawa kitin atau (α(1-4)-N-asetil-D-glukosamin) dapat dipertimbangkan sebagai suatu senyawa turunan selulosa, dimana gugus
hidroksil pada atom C-2 digantikan oleh gugus
asetamido (Pujiastuti, 2001). Kitosan merupakan hasil deasetilasi
kitin, sedangkan kitin dapat diisolasi dari serangga dan jamur, kerangka dan cangkang hewan golongan Artropoda, Molusca, Nematoda, dan Crustacea. Pada penelitian ini kitin diisolasi dari cangkang udang. Pada industri pengolahan udang disamping menghasilkan produk utama berupa udang bersih juga menghasilkan limbah, berupa cangkang udang yang sangat potensial sebagai pencemar lingkungan. Limbah udang dapat mencapai 30% sampai 40% dari berat udang. Limbah cangkang udang ini masih mengandung protein, karbohidrat dan mineral. Jika dibuang begitu saja, akan mengalami denaturasi protein dan hidrolisis secara alami. Proses tersebut menghasilkan bau busuk, meningkatkan BOD air, sehingga menurunkan kualitas air (Indra, 1994 ).
Sebagai matriks pendukung pada proses imobilisasi enzim, kitosan mempunyai beberapa keuntungan karena mudah didapat, prosedur isolasinya mudah, tidak beracun dan tidak membahayakan. Kitosan merupakan polimer alam yang dapat berikatan secara crosslink apabila ditambahkan cosslinked agent misalnya glutaraldehid, glioksal atau kation Cu2+ (Sarah, 2001). Proses amobilisasi enzim dengan kitosan yang telah mengalami crosslinked disebut sebagai imobilisasi tipe pengikatan carrier–crosslinked. Pada penelitian ini cosslinked agent yang digunakan adalah glutaraldehid.
Permasalahan pada penelitian ini adalah bagaimana cara mengamobilisasi enzim papain dengan menggunakan kitosan dari limbah udang sebagai matriks pendukung, dan mengetahui aktivitas enzim papain yang teramobilisasi terhadap pengaruh waktu, pH, dan konsentrasi substrat yang mempengaruhi kerja enzim, serta pengaruh perulangan penggunaan enzim papain amobil terhadap pengurangan kadar protein.
Penelitian ini bertujuan untuk mengetahui cara mengamobilisasi enzim papain dengan menggunakan kitosan dari limbah udang sebagai matriks pendukung dan mengetahui aktivitas enzim papain yang teramobilisasi terhadap pengaruh waktu, pH, dan konsentrasi substrat yang mempengaruhi kerja enzim, serta pengaruh perulangan penggunaan enzim papain amobil terhadap pengurangan kadar protein.
BAHAN DAN METODE
Alat-alat yang digunakan dalam penelitian ini adalah freeze dryer, sentrifuge, spektrofotometer Spectronic Genesis, neraca analitik, pH meter, shaker, magnetik stirer,
hot plate, oven, erlenmeyer, gelas ukur, labu
ukur, spatula, termometer, pipet tetes, beaker gelas, kaca arloji, cawan petri, botol timbang, dan peralatan gelas lainnya.
Bahan-bahan yang digunakan dalam penelitian ini adalah cangkang udang, getah
pepaya, NaOH, HCl, (NH4)2SO4, NaH2PO4,
Na2HPO4, kasein, aquades, biuret, dan
glutaraldehid. 3.2.1 Isolasi Kitin
3.2.1.1 Persiapan Cuplikan
Kepala dan kulit udang dibersihkan,
kemudian dikeringkan dengan sinar
matahari. Setelah kering digiling dan diayak menjadi serbuk / tepung.
3.2.1.2 Tahap Deproteinasi
Cuplikan ditempatkan dalam suatu bejana tahan asam basa yang dilengkapi dengan pengaduk, thermometer, dan penangas air. Cuplikan ditambahkan NaOH 3.5% dengan perbandingan 1 : 10 (w/v). Proses ini dilakukan selama 2 jam pada suhu 650C. Residu dicuci dengan air hingga mencapai pH netral, kemudian dikeringkan dalam oven 1000C selama 4 jam.
3.2.1.3 Tahap Demineralisasi
Ekstrak pekat kitin hasil deproteinasi ditempatkan dalam suatu bejana tahan asam basa yang dilengkapi dengan pengaduk, kemudian ditambahkan HCl 1 N dengan perbandingan 1 : 15 (w/v) proses ini dilakukan selama 30 menit pada suhu kamar. Residu dicuci dengan air hingga mencapai pH netral, kemudian dikeringkan dalam oven 1000C selama 4 jam. 3.2.2 Deasetilasi Kitin Menjadi Kitosan
Serbuk kitin direaksikan dengan NaOH 50% dengan perbandingan 1 : 10 (w/v) dalam suatu bejana tahan asam basa yang dilengkapi dengan pengaduk, thermometer, dan penangas air. Proses ini dilakukan pada suhu 1000C selama 4 jam. Residu dicuci dengan air hingga mencapai pH netral, kemudian dikeringkan dalam oven 1000C selama 4 jam.
3.2.3 Penentuan Protein secara Kolorimetri (Biuret)
3.2.3.1 Penentuan Panjang Gelombang Maksimum
Penentuan panjang gelombang maksimum (λmaks) dilakukan dengan
menggunakan larutan stok kasein dengan konsentrasi 5333 ppm 533.3 mg kasein dilarutkan dalam aquades, kemudian diambil 6 ml dan ditambahkan 4 ml reagen biuret. Larutan kemudian diaduk dan diinkubasi selama 20 menit pada temperatur 370C. Larutan standar kasein diukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 500-590 nm dengan interval 5 nm, sehingga diperoleh λmaks yang digunakan untuk
pengukuran selanjutnya. Kurva dibuat antara panjang gelombang (λ) terhadap absorbansi (A). Blanko yang digunakan adalah 6 ml aquades yang ditambah dengan 4 ml reagen biuret.
3.2.3.2 Pembuatan Kurva Standar Kasein Pembuatan kurva standart dilakukan dengan menggunakan larutan stok kasein 5333 ppm yang telah dibuat sebelumnya, diambil sebanyak 1.8, 2.2, 2.6, 3.0, 3.3, 3.7, 4.1, 4.5, 4.8, 5.2, 5.6, dan 6 ml lalu ditambah 4 ml reagen biuret serta diencerkan dengan aquades hingga 10ml, sehingga konsentrasi larutan menjadi 1000, 1200, 1400, 1600, 1800, 2000, 2200, 2400 2600, 2800, 3000, dan 3200 ppm. Larutan kemudian diaduk dan diinkubasi selama 20 menit pada temperatur 370C. Pengukuran absorbansi dilakukan dengan menggunakan spektrofotometer pada panjang gelombang maksimum yang telah ditentukan sebelumnya. Selanjutnya dibuat kurva kalibrasi antara konsentrasi larutan kasein terhadap absorbansi, sehingga diperoleh persamaan garis regresi liniernya.
3.2.4 Isolasi Enzim Papain dari Getah Pepaya
Getah pepaya yang diperoleh dari menggores buah pepaya yang masih mudah ditampung dalam wadah, lalu getah dilarutkan dalam air dan disentrifuge selama 15 menit dengan kecepatan 2000 rpm lalu diambil supernatan dengan cara dekantasi. Supernatan yang diperoleh kemudian diendapkan menggunakan larutan ammonium sulfat jenuh sesuai dengan fraksi yang diinginkan dan dididnginkan dalam lemari es semalaman, kemudian disentrifuge dengan kecepatan 2000
rpm selama 15 menit. Pelet yang didapatkan kemudian dipisahkan dan diuji aktivitas enzim proteolitiknya terhadap kasein dengan menggunakan metode kolorimetri.
3.2.5 Amobilisasi Enzim
Amobilisasi enzim dilakukan dengan cara cross-linking seperti yang pernah diterapkan oleh Petre dkk. untuk amobilisasi sel Escherichia coli dengan sedikit modifikasi. Prosedur yang digunakan adalah sebagai berikut : 5 ml laruan buffer dengan pH 7 yang mengandung 5% (b/v) glutaraldehid, 50 mg kitosan, dan 50 mg/ml enzim dicampur dalam gelas piala ukuran 100 ml. Campuran diusahakan merata ke dasar gelas dengan cara menggoyangkan dan memutar pelan-pelan gelas piala, kemudian disimpan dalam freezer. Setelah satu hari, lapisan enzim amobil yang terbentuk dicuci dengan air suling dan air hasil pencucian diencerkan sampai volume 50 ml untuk menentukan jumlah enzim yang teramobil.
3.2.6 Uji Aktivitas Enzim Amobil
3.2.6.1 Pengaruh Waktu terhadap Aktivitas Enzim Papain Amobil
Larutan stok kasein 4000 ppm diambil sebanyak 20 ml dan dimasukkan ke dalam Erlenmeyer dan ditambahkan enzim papain amobil yang telah dibuat sebelumnya. Larutan dishaker dengan kecepatan 110 rpm selama 0, 2, 4, 6, dan 8 jam. Penentuan kandungan protein dilakukan seperti prosedur di atas. Enzim papain dengan waktu inkubasi optimal yang didapat, akan digunakan untuk percobaan selanjutnya. Selanjutnya dihitung besarnya aktivitas enzim yang digunakan.
3.2.6.2 Pengaruh pH terhadap Aktivitas Enzim Papain Amobil
Substrat kasein 4000 ppm, dikondisikan pada berbagai pH yaitu 6,0; 6,5; 7,0; 7,5, dan 8,0 dengan menambahkan NaOH atau HCl, kemudian diambil sebanyak 17.5 ml lalu dimasukkan ke dalam erlenmeyer serta ditambahkan 2.5 ml buffer fosfat (campuran dari garam NaH2PO4 dan Na2HPO4) sesuai dengan
pH yang divariasikan. Selanjutnya enzim papain amobil dimasukkan ke dalam larutan substrat, kemudian dishaker dengan kecepatan 110 rpm selama waktu inkubasi optimum yang telah diperoleh dari percobaan sebelumnya. Penentuan kandungan proteinnya seperti yang dilakukan pada prosedur di atas. Hal yang sama dilakukan pada kontrol (17.5 ml kasein dengan pH 6,0; 6,5;
7,0; 7,5, dan 8,0 ditambah 2.5 ml buffer fosfat dengan pH yang sesuai). Selanjutnya dihitung besarnya aktivitas enzim yang digunakan. Pembuatan enzim papain amobil dilakukan dengan prosedur yang sama, hanya saja 50 mg kitosan larutan buffer fosfat yang ditambahkan sesuai dengan pH yang divariasikan sebanyak 5 ml yang mengandung 5% (b/v) glutaraldehid. Sebelum dimasukkan ke dalam larutan substrat, enzim papain amobil dibilas dengan 10 ml aquades sebanyak tiga kali.
3.2.6.3 Pengaruh Konsentrasi Substrat terhadap Aktivitas Enzim Papain Amobil
Optimasi konsentrasi substrat dilakukan dengan membuat variasi konsentrasi kasein yaitu dan 2000, 2500, 3000, 3500, dan 4000 ppm. Enzim papain amobil ditambahkan ke dalam 17.5 ml substrat yang telah dikondisikan pH optimumnya, kemudian ditambahkan masing-masing larutan dengan 2.5 ml buffer fosfat dengan pH optimum yang telah didapat dari percobaan sebelumnya. Selanjunya, cuplikan dishaker dengan kecepatan 110 rpm selama waktu inkubasi optimum yang telah diperoleh dari percobaan sebelumnya. Penentuan kandungan proteinnya seperti yang dilakukan pada prosedur di atas. Hal yang sama dilakukan pada kontrol. Selanjutnya dihitung besarnya aktivitas enzim yang digunakan.
3.2.7 Uji Perulangan terhadap Aktivitas Enzim Papain Amobil
Untuk mengetahui pengaruh perulangan penggunaan enzim papain amobil terhadap pengurangan kadar protein dalam kasein, enzim papain amobil digunakan berulang dengan kondisi kecepatan pengocokan yang sama, waktu optimum, pH optimum, dan konsentrasi substrat optimum. Setelah proses degradasi protein pertama selesai, enzim papain amobil dipisahkan dengan cara disaring, dibilas dengan aquades sekali dan langsung dimasukkan ke dalam cuplikan yang baru untuk diproses berikutnya dengan kondisi yang sama. Perlakuan ini diulangi sebanyak lima kali dan dianalisis kadar protein yang terdegradasi pada setiap perulangan. Selanjutnya dihitung besarnya aktivitas enzim yang digunakan.
4.1 Isolasi Kitin
Dalam penelitian ini dilakukan proses isolasi kitin dari kulit udang windu (Penaeus monodon) dimana untuk mengisolasi kitin dari sampel meliputi tahap deproteinasi dan tahap demineralisasi.
4.1.1 Tahap Deproteinasi
Deproteinasi bertujuan untuk menghilangkan protein dari kitin dengan menggunakan larutan NaOH 3,5 % selama dua jam pada suhu 650C. Apabila digunakan larutan NaOH dengan konsentrasi dan suhu lebih tinggi akan menyebabkan kitin terdeasetilasi. Untuk menghilangkan protein yang telah diikat oleh Na+, residu yang diperoleh dicuci dengan aquades sehingga pH netral yang diukur dengan menggunakan pH meter. Proses pencucian juga bertujuan untuk menghilangkan NaOH yang mungkin masih tersisa dalam residu.
4.1.2 Tahap Demineralisasi
Demineralisasi bertujuan untuk menghilangkan mineral atau senyawa anorganik yang terdapat pada kulit udang windu (Penaeus monodon). Kandungan mineral utamanya adalah CaCO3 dan Ca3(PO4) dalam jumlah kecil dan
lebih mudah dipisahkan dibandingkan dengan protein karena hanya terikat secara fisik. Proses demineralisasi dilakukan dengan menggunakan larutan HCl 1 N pada temperature ruang selama 30 menit dengan perbandingan berat sampel dan volume HCl 1:15 (w/v). Apabila digunakan konsentrasi asam lebih tinggi dan waktu perendaman yang lebih lama, akan menyebabkan kitin terdegradasi. Pada proses ini senyawa kalsium akan bereaksi dengan asam klorida menghasilkan kalsium klorida yang larut dalam air, gas CO2 dan air, dan asam pospat yang larut
dalam air.
Reaksi garam tersebut dengan HCl sebagai berikut :
CaCO3(s) + 2HCl CaCl2(s) + H2O(l) + CO2(g)
Ca3(PO4)2(s) + 6HCl(l) 3CaCl2(s) + 2H3PO4(l)
Untuk menghilangkan asam klorida yang mungkin masih tertinggal, maka pada residu dilakukan pencucian dengan aquades sampai pH netral. Hal ini penting untuk mencegah terjadinya degradasi produk selama proses pengeringan.
4.2 Deasetilasi Kitin menjadi Kitosan
Proses deasetilasi merupakan proses pembentukan kitosan dari kitin menggunakan NaOH untuk mengganti gugus asetamida dengan
gugus amino. Untuk memutuskan ikatan antara gugus asetilnya dengan gugus nitrogen sehingga berubah menjadi gugus amino (NH2) perlu
digunakan natrium hidroksida dengan konsentrasi tinggi dan waktu deasetilasi yang lama.
Pemutusan gugus asetil pada kitin mengakibatkan terbentuknya gugus amin yang menunjukkan terbentuknya kitosan. Proses ini menggunakan larutan NaOH 50 % dan dipanaskan pada suhu 1000C selama 4 jam. Setelah dicuci hingga pH netral dan dikeringkan diperoleh kitosan
Hasil kitosan dari isolasi kitin cangkang udang dikarakterisasi gugus fungsinya dengan FTIR. Pada Gambar 4.2, tampak pita serapan pada bilangan gelombang 3626,29 cm-1 yang berasal dari vibrasi ulur –OH dan pita serapan 2805,6 cm-1 yang berasal dari vibrasi ulur C-O.muncul serapan pada 1678,13 cm-1 yang berasal dari vibrasi tekuk N-H yang diperkuat oleh pita serapan 3603,15 cm-1 menunjukkan keberadaan amina (-NH2) pada kitosan.
4.3 Penentuan Protein secara Kolorimetri (Biuret)
4.3.1 Penentuan Panjang Gelombang Maksimum
Penentuan panjang gelombang maksimum ditentukan dengan menggunakan larutan kasein stok 5333 ppm yang dibuat dari 533.3 mg kasein yang dilarutkan dalam air. Sebanyak 6 ml larutan kasein diambil dan ditambah 4 ml reagen Biuret dan diencerkan hingga 10 ml sehingga dihasilkan larutan kasein 2666 ppm. Larutan kasein yang telah ditambah reagen biuret diinkubasi selama 20 menit pada suhu 370C (Cooper,1979). Inkubasi ini berfungsi agar reaksi antara larutan kasein dengan reagen biuret berlangsung sempurna dimana reagen biuret bereaksi spesifik dengan protein bukan dengan asam amino. Pemakaian suhu 370C
dimaksudkan agar tidak terjadi denaturasi pada kasein yang disebabkan oleh panas berlebih.
Cuplikan protein sering terdiri atas campuran yang kompleks antar jenis protein yang berbeda. Penentuan kandungan protein secara kuantitatif dari larutan protein kasar seperti itu sering ditunjukkan dengan cara reaksi antar gugus fungsional protein dengan reagen kromogenik (senyawa yang dapat menimbulkan warna dan dapat diukur pada daerah sinar tampak). Banyaknya kompleks berwarna yang terbentuk sebanding dengan jumlah protein.
Warna larutan berubah dari bening menjadi ungu. Hal ini disebabkan adanya reaksi antara larutan tembaga (II) sulfat (dari reagen biuret) dengan larutan kasein. Ikatan antara dua peptida atau lebih ditunjukkan sebagai perubahan warna hanya jika ikatan peptida dapat mengelilingi ion Cu2+.
Larutan kasein tersebut diukur absorbansinya pada daerah panjang gelombang 500-590 nm dengan blanko (air sebanyak 6 ml ditambah 4 ml reagen biuret) menggunakan spektrofotometer UV-vis. Pengukuran dilakukan pada range λ tersebut karena warna komplementer (warna yang diserap oleh larutan) adalah ungu dimana warna ungu memiliki daerah λ antara 500-560 nm. Pemakaian larutan blanko yang berwarna biru berfungsi untuk menghasilkan penyerapan sinar oleh larutan selain analat sehingga pengukuran absorbansi pada cuplikan tepat. Pengukuran setiap panjang gelombang dilakukan sebanyak 3 kali untuk memperoleh nilai yang lebih akurat
Kurva diatas menunjukkan kenaikan absorbansi hingga mencapai puncak pada panjang gelombang 540 nm, kemudian turun seiring dengan bertambahnya panjang gelombang. 4.3.2 4.3.2 Pembuatan Kurva Standart Kasein
Larutan standart yang digunakan adalah larutan kasein dengan bermacam-macam konsentrasi yang diperoleh dari larutan stok kasein yang berkonsentrasi 5333 ppm. Larutan stok kasein tersebut diambil sebanyak 6 ml, 5.6 ml, 5.3 ml, 4.8 ml, 4.5 ml, 4.1 ml, 3.7 ml, 3.4
ml, 3 ml, 2.6 ml, 2.2 ml, dan 1.8 ml untuk membuat larutan kasein dengan konsentrasi 3200 ppm, 300 ppm, 2800 ppm, 2600 ppm, 2400 ppm, 2200 ppm, 2000 ppm, 1800 ppm, 1600 ppm, 1400 ppm, 1200 ppm,dan 1000 ppm. Masing-masing larutan ditambah dengan reagen biuret sebanyak 4 ml sehingga pengenceran dengan reagen biuret juga diperhitungkan dan selanjutnya ditambah air destilasi sampai tanda batas labu ukur 10 ml. Larutan tersebut diinkubasi elama 20 menit pada suhu 370C kemudian diukur absorbansinya dengan blanko (6 ml air + 4 ml biuret) pada λmaks 540 nm.
Kurva standart dibuat dengan mengalurkan absorbansi sebagai ordinat (sumbu Y) dan konsentrasi kasein sebagai absis (sumbu X). Nilai absorbansi mengalami kenaikan seiring bertambahnya konsentrasi kasein sehingga diperoleh persamaan garis antara konsentrasi kasein dan absorbansi yaitu:
Y = 0,000047x – 0,010199
Analisa dengan spektrofotometri, hubungan linier antara konsentrasi dengan absorbansi harus memenuhi hokum Lambert-Beer yang dinyatakan dengan persamaan sebagai berikut A = ε.b.c, dimana A adalah absorbansi dan c adalah konsentrasi, jadi dapat disimpulkan bahwa absorbansi berbanding lurus dengan konsentrasi, namun kenyataannya data-data yang tepat memenuhi persamaan sulit diperoleh sehingga perlu diekstrapolasikan melalui titik nol. Dari persamaan Y = 0,000047x – 0,010199 setelah diektrapolasikan melalui titik nol maka diperoleh persamaan : Y = 0,000043x.
4.4 Isolasi Enzim Papain dari Getah Buah Pepaya
Enzim proteolitik dari buah getah buah pepaya diperoleh dengan cara menggores buah pepaya dan ditampung getahnya. Getah ini berupa cairan kental yang berwarna putih yang lama kelamaan menggumpal yang selanjutnya dilarutkan dalam air sebanyak 100 ml. Getah larut dalam air dan membentuk larutan berwarna putih. Larutan getah ini disentrifuge dengan kecepatan 2000 rpm selama 10 menit. Pemisahan 0 0,01250,025 0,03750,05 0,06250,075 0,08750,1 0,11250,125 0,13750,15 0,16250,175 0,18750,2 450 500 550 600 ab so rb an si Panjang Gelombang (nm) y = 0.000043x R² = 0.996070 0 0,05 0,1 0,15 0,2 0 1000 2000 3000 4000 A bsor ba nsi
getah dari cairannya menggunakan sentrifugasi karena prosesnya cepat, endapan terpusatkan pada dasar tabung sentrifuge sehingga mudah diamati dan diperkirakan banyaknya dan pengambilan endapan dapat dilakukan dengan cepat dan efisien. Cairan yang terbentuk dari prose sentrifugasi menjadi bening dan endapan/peletnya berwarna putih. Supernatan diambil dengan cara dekantasi/penuangan karena pellet dan supernatan terpisah secar sempurna.
Supernatan yang diperoleh sebanyak 80 ml kemudian ditambah larutan ammonium sulfat jenuh untuk mengendapkan enzim. Pemisahan enzim menggunakan garam ammonium sulfat karena tingkat kelarutannya tinggi, tidak mengganggu bentuk dan fungsi enzim dan harganya murah. Pengaruh ion dari garam ammonium sulfat pada kelarutan protein dalam jumlah kecil bekerja sebagai pelindung molekul protein dari yang lain untuk saling berinteraksi sehingga menaikkan kelarutan protein (salting in). Akan tetapi pada konsentrasi garam yang tinggi mengakibatkan menurunnya kelarutan protein (salting out). Penambahan larutan ammonium sulfat dilakukan secara gradien yaitu dengan konsentrasi 20 – 60 % (v/v) (De Deles, 2000) dan dilakukan dengan penambahan dalam bentuk larutan ammonium sulfat jenuh. Pada penambahan konsentrasi garam yang rendah biasanya enzim yang berukuran besar akan terendapkan lebih dulu lalu untuk molekul kecil ditambahkan lagi garamnya dengan konsentrasi yang lebih besar.
Larutan ammonim sulfat jenuh yang ditambahkan ditambahkan pada supernatan sebanyak 20 ml sehingga diperoleh konsentrasi akhir 20% (v/v). Larutan diaduk untuk mempercepat terjadinya reaksi percampuran antar larutan ammonium sulfat jenuh dengan protein enzim dan menghomogenkan larutan lalu didiamkam semalam dalm lemari es. Penyimpanan ini berfungsi untuk mempercepat proses pengendapan dimana pada suhu rendah endapan lebih mudah terbentuk dibanding pada suhu tinggi. Namun, pengendapan dengan gradien konsentrasi ammonium sulfat yang dilakukan bukan merupakan proses pemurnian tetapi merupakan langkah awal proses pemisahan enzim pada getah buah pepaya yang mengacu pada penelitian (De Deles,2000). Dari pengendapan ini diharapkan ada jenis protein tertentu yang mengendap pada variasi yang dilakukan. Hasil pengendapan dengan 20% sampai 40% larutan ammonium sulfat jenuh
ternyata tidak mengahsilkan endapan, sehingga dilanjutkan penambahan 50% sampai 60% (v/v). Enzim papain dari masing-masing fraksi diambil sebanyak 2,5 mg kemudian ditambahkan 9 ml larutan kasein (3000 ppm) dan volume larutan dijadikan 10 ml, sehingga kandungan kasein dalam 10 ml larutan tersebut adalah 2700 ppm (27 mg), kemudian dikocok pada kecepatan 110 rpm selama 1 jam lalu dipanaskan, kemudian diambil sebanyak 6 ml dan ditambahkan 4 ml reagen biuret. Setelah diinkubasi selama 20 menit pada suhu 370C, diukur absorbansi dengan menggunakan spektrofotometer pada λmaks = 540 nm.
Unit aktivitas pada penelitian ini didefinisikan sebagai: banyaknya µg protein terdegradasi oleh 1 mg protein enzim selama 1 menit.
Tabel 4.1 Berat Protein Terdegradasi oleh Enzim Papain Fraksi dengan pengendapan
larutan ammonium sulfat jenuh
Berat protein terdegradasi (mg)
50% 17,9109
60% 15,1977
Tabel 4.1 di atas menunjukkan bahwa fraksi enzim papain kasar dengan penambahan larutan jenuh ammonium sulfat 50% mampu mendegradasi protein terbanyak, yaitu 17,9109 mg.
4.5 Amobilisasi Enzim
Pada ammobilisasi enzim proteolitik ini digunakan kitosan sebagai matriks pendukungnya. Kitosan sebanyak 50 mg masing-masing dilarutkan dalam 5 ml buffer fosfat pH 7 yang mengandung 5% (b/v) glutaraldehid. Kemudian ditambahkan enzim sebanyak 50 mg dan disimpan dalam lemari es semalam. Enzim papain amobil kemudian dibilas dengan aquades 10 ml (3x).
Kitosan digunakan untuk berikatan silang dengan enzim karena kitosan merupakan polimer alam yang dapat berikat silang bila ditambahkan agen ikat silang misalnya glutaraldehid atau glioksal. Ada dua kemungkinan ikatan silang yang terjadi yang pertama yaitu, ikat silang terjadi antara ujung aldehid agen ikat silang dengan gugus amina kitosan (Guibal,dkk, 1998), bila ini terjadi maka enzim terjebak dalam ikatan silang. Kemungkinan yang kedua, terjadi ikatan silang antara ujung aldehid dengan gugus amina pada kitosan dan gugus amina pada protein enzim.
4.6 Uji Aktivitas Enzim Papain Amobil 4.6.1 Pengaruh Waktu terhadap Aktivitas
Enzim Papain Amobil
Larutan stok kasein 4000 ppm diambil sebanyak 20 ml dan dimasukkan ke dalam Erlenmeyer A sebagai control, dan larutan stok kasein 4000 ppm diambil lagi 20 ml dan dimasukkan ke dalam Erlenmeyer B sebagai cuplikan. Larutan pada Erlenmeyer B ditambahkan enzim papain amobil yang telah dibuat sebelumnya. Semua larutan tersebut di shaker dengan kecepatan 110 rpm selama 2, 4, 6 dan 8 jam. Penentuan kandungan protein yang tersisa dilakukan seperti prosedur di atas. Enzim papain dengan waktu inkubasi optimal yang didapat, akan digunakan untuk percobaan selanjutnya.
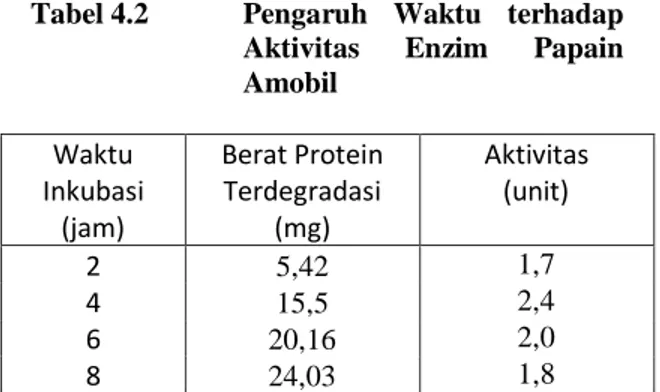
Tabel 4.2 Pengaruh Waktu terhadap Aktivitas Enzim Papain Amobil Waktu Inkubasi (jam) Berat Protein Terdegradasi (mg) Aktivitas (unit) 2 5,42 1,7 4 15,5 2,4 6 20,16 2,0 8 24,03 1,8
Bila dibuat kurva hubungan aktivitas enzim terhadap waktu, maka diperoleh kurva sebagai berikut:
Gambar 4.13 Kurva Pengaruh Waktu terhadap Aktivitas Enzim Papain Amobil
Gambar 4.13 di atas menunjukkan bahwa pada waktu inkubasi dari 2 jam menuju ke waktu inkubasi 4 jam, terjadi peningkatan yang drastis pada aktivitas (unit) protein. Setelah lebih dari 4 jam aktivitas (unit) dari enzim
papain ammobil mengalami penurunan. Hasil penelitian ini menunjukkan bahwa reaksi enzimatik optimal pada waktu inkubasi selama 4 jam.
Penelitian ini juga dilakukan kontrol untuk mengetahui banyaknya protein yang terdegradasi oleh kontaminan-kontaminan yang terdapat dalam substrat. Hasil pengukuran absorbansi dari larutan kontrol mengalami penurunan yang tidak begitu besar, sedangkan absorbansi cuplikan menurun cukup besar. Absorbansi yang terukur menunjukkan banyaknya protein sisa yang ada dalam substrat. Sehingga banyaknya protein yang terdegradasi adalah [mg protein mula-mula - mg protein sisa]– mg protein akibat kontaminan.
4.6.2 Pengaruh pH terhadap Aktivitas Enzim Papain Amobil
Penentuan pH optimum dari enzim papain amobil ini dilakukan pada pH 6,0; 6,5; 7,0; 7,5 dan 8,0. Variasi pH dilakukan untuk mengetahui pH optimal dari enzim yang mampu mengurangi kandungan protein dalam substrat dengan jumlah yang relatif besar dimana pH merupakan salah satu faktor yang mempengaruh kerja dari enzim.
Substrat dikondisikan pada berbagai pH yaitu 6,0; 6,5; 7,0; 7,5 dan 8,0 dengan menambahkan NaOH atau HCl, kemudian diambil sebanyak 17,5 ml lalu dimasukkan ke dalam erlenmeyer serta ditambahkan 2,5 ml buffer fosfat (campuran dari garam NaH2PO4
dan Na2HPO4) sesuai dengan pH yang
divariasikan. Penambahan buffer tersebut untuk mempertahankan pH yang kemungkinan besar akan berubah saat inkubasi. Larutan buffer yang digunakan adalah buffer fosfat, karena memiliki range pH sesuai dengan pH yang dibutuhkan dalam penelitian ini, yaitu pH antara 5-8. Selanjutnya, enzim papain amobil dimasukkan ke dalam larutan cuplikan, kemudian dishaker dengan kecepatan 110 rpm selama 4 jam. Hal yang sama dilakukan pada kontrol (17,5 ml kasein 4000 ppm dengan pH 6,0; 6,5; 7,0; 7,5 dan 8,0 ditambah 2,5 ml buffer fosfat dengan pH yang sesuai). Pembuatan enzim papain amobil dilakukan dengan prosedur yang sama, hanya saja 50 mg kitosan larutan buffer fosfat yang ditambahkan sesuai dengan pH yang divariasikan sebanyak 5ml yang mengandung 5% (b/v) glutaraldehid. Sebelum dimasukkan ke dalam larutan cuplikan, enzim papain amobil dibilas dengan 10 ml aquades sebanyak tiga kali. 0 0,250,5 0,751 1,251,5 1,752 2,252,5 2,75 0 5 10 15 A kt iv it as (un it ) Waktu
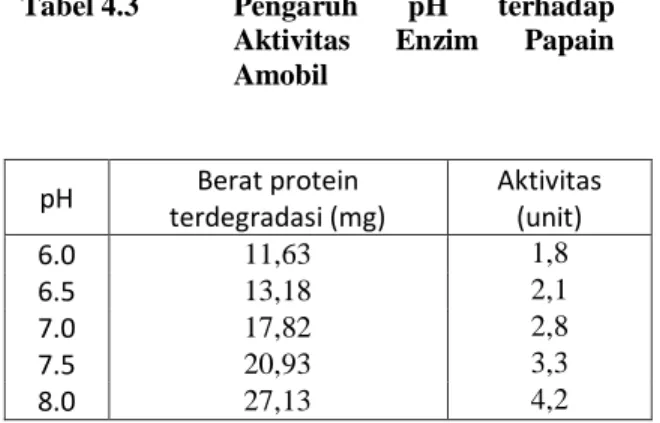
Tabel 4.3 Pengaruh pH terhadap Aktivitas Enzim Papain Amobil
Bila dibuat kurva hubungan aktivitas enzim terhadap pengaruh pH, maka diperoleh kurva sebagai berikut:
Gambar 4.14 Kurva Pengaruh pH terhadap Aktivitas Enzim Papain Amobil
Berdasarkan kurva di atas dapat dilihat bahwa perubahan pH akan menyebabkan perubahan terhadap aktivitas (unit) enzim papain ammobil. Adanya perubahan pH akan dapat mempengaruhi konformasi gugus-gugus yang ada pada sisi aktif enzim. Tentunya mempengaruhi ikatan enzim dengan substratnya, sehingga diperlukan pH yang sesuai untuk mencapai kestabilannya. Dari Gambar 4.14 terlihat bahwa pH optimum untuk kerja enzim papain teramobilisasi adalah pada pH 8,0. Hasil penelitian ini menunjukkan hasil yang sama dengan penelitian sebelumnya yang dilakukan oleh Afag (2001).
4.6.3 Pengaruh Konsentrasi Substrat terhadap Aktivitas Enzim Papain Amobil
Penentuan konsentrasi optimum kerja enzim papain amobil terhadap substrat, dilakukan dengan membuat variasi konsentrasi substrat (kasein) yaitu 2000, 2500, 3000, 3500, dan 4000 ppm. Enzim papain amobil dimasukkan ke dalam 17,5 ml substrat yang telah dikondisikan pHnya menjadi pH 8,0 kemudian ditambahkan 2,5 ml buffer fosfat pH 8,0. Selanjutnya, cuplikan dan larutan kontrol (17,5 ml kasein dengan pH 8,0 ditambah 2,5 ml buffer fosfat pH 8,0) dishaker dengan kecepatan 110 rpm selama 4 jam. Dengan semakin kecilnya konsentrasi substrat maka pengurangan kandungan protein akibat enzim juga semakin kecil Kurva pada gambar 4.15 menunjukkan bahwa pengurangan kandungan protein terbesar terjadi pada konsentrasi kasein 4000 ppm yaitu sebesar 44,19 mg.
Tabel 4.4 Pengaruh Konsentrasi Substrat terhadap Aktivitas Enzim Papain Amobil Konsentrasi substrat (ppm) Berat protein terdegradasi (mg) Aktivitas (unit) 2000 20,16 3,1 2500 24,04 3,8 3000 27,91 4,4 3500 34,11 5,3 4000 44,19 6,9
Bila dibuat kurva hubungan aktivitas enzim terhadap pengaruh konsentrasi substrat, maka diperoleh kurva sebagai berikut:
Gambar 4.15 Kurva Pengaruh Konsentrasi Substrat terhadap Aktivitas
Enzim Papain Amobil
Dari data yang diperoleh dapat dilihat bahwa pada konsentrasi substrat yang besar aktivitas katalitik dari enzim juga besar, tetapi pada batas konsentrasi tertentu tidak terjadi 0 0,51 1,52 2,53 3,54 4,5 00,511,522,533,544,555,566,577,588,59 A kt iv it as (un it ) pH 0 0,51 1,52 2,53 3,54 4,55 5,56 6,57 7,5 0 50010001500200025003000350040004500 A kt iv it as (un it ) Konsentrasi Substrat pH Berat protein terdegradasi (mg) Aktivitas (unit) 6.0 11,63 1,8 6.5 13,18 2,1 7.0 17,82 2,8 7.5 20,93 3,3 8.0 27,13 4,2
kenaikan kecepatan reaksi walau konsentrasi substrat diperbesar. Hal ini disebabkan karena konsentrasi enzim sudah jenuh dengan substrat. Pada konsentrasi substrat yang rendah, sisi aktif tempat terjadinya kontak antara enzim dan substrat hanya menampung substrat yang sedikit. Oleh karena itu konsentrasi kompleks enzim-substrat sedikit, sehinga kecepatan reaksinya kecil. Bila konsentrasi substrat besar, makin banyak substrat yang dapat berhubungan dengan enzim pada sisi aktif tersebut. Dengan demikian, konsentrasi kompleks enzim-substrat makin besar sehingga reaksi semakin besar. Akan tetapi, penambahan konsentrasi substrat lebih lanjut tidak akan berpengaruh pada kecepatan reaksi enzim. Pada konsentrasi-konsentrasi substrat yang menghasilkan laju reaksi maksimum, dapat dianggap bahwa enzim telah dalam keadaan “jenuh dengan substrat”. Pada penelitian ini penggunaan konsentrasi substrat belum mencapai konsentrasi substrat maksimum seperti yang ditunjukkan pada Gambar 4.15. 4.7 Pengaruh Aktivitas Enzim Papain Amobil
terhadap Uji Perulangan
Aspek efektivitas enzim papain amobil jika digunakan dalam pengurangan protein secara berulang, diuji dalam penelitian ini dengan cara menggunakan enzim papain amobil untuk 5 kali proses degradasi, dengan kondisi kecepatan shaker 110 rpm, pH 8,0 dan konsentrasi substrat sebesar 4000 ppm. Setelah proses degradsi protein pertama selesai, enzim papain amobil dipisahkan dengan cara disaring, dibilas dengan aquades sekali untuk menghilangkan sisa dari cuplikan sebelumnya dan langsung dimasukkan ke dalam cuplikan yang baru untuk proses berikutnya.
Kadar protein dalam substrat yang terdegradasi secara berurutan dari perulangan pertama sampai kelima dapat dilihat pada tabel 4.5. Setelah 4 kali perulangan, maka enzim papain amobil dapat mengurangi protein dalam substrat sebesar 236,78 mg.
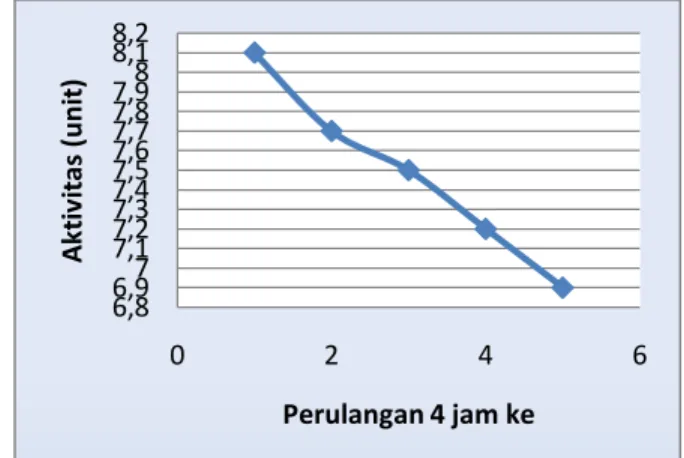
Tabel 4.5 Pengaruh Uji Perulangan Aktivitas Enzim Papain Amobil Perulangan 4 jam ke Berat protein terdegradasi (mg) Aktivitas (Unit) 1 51,94 8,1 2 49,61 7,7 3 48,07 7,5 4 46,52 7,2 5 41,09 6,9
Bila dibuat kurva hubungan aktivitas enzim terhadap pengaruh uji perulangan, maka diperoleh kurva sebagai berikut:
Gambar 4.16 Pengaruh Uji Perulangan terhadap Aktivitas Enzim
Berdasarkan Gambar 4.16 di atas menunjukkan bahwa pada saat perulangan pertama diperoleh aktivitas enzim sebesar 7,7 unit (terjadi penurunan aktivitas enzim sebesar 5%), pada saat perulangan kedua diperoleh aktivitas enzim sebesar 7,5 unit (terjadi penurunan aktivitas enzim sebesar 7%), pada saat perulangan ketiga diperoleh aktivitas enzim sebesar 7,2 unit (terjadi penurunan aktivitas enzim sebesar 11%), pada saat perulangan keempat diperoleh aktivitas enzim sebesar 6,9 unit (terjadi penurunan aktivitas enzim sebesar 15%). Hasil uji perulangan ke 5 menunjukkan bahwa aktivitas enzim papain ammobil mengalami penurunan aktivitas sebesar 15% dan menunjukkan bahwa metode ammobilisasi enzim baik digunakan karena masih memiliki aktivitas enzim sebesar 85%.
KESIMPULAN
Berdasarkan hasil penelitian yang telah dilakukan diperoleh kesimpulan bahwa aktivitas enzim papain ammobil optimum pada waktu inkubasi 4 jam, pH 8,0 dan konsentrasi substrat 4000 ppm. Hasil uji perulangan ke 5 menunjukkan bahwa aktivitas enzim papain ammobil mengalami penurunan aktivitas sebesar 15% dan menunjukkan bahwa metode ammobilisasi enzim baik digunakan karena masih memiliki aktivitas enzim sebesar 85%.
6,8 6,97 7,1 7,2 7,3 7,4 7,5 7,6 7,7 7,8 7,98 8,1 8,2 0 2 4 6 A kt iv it as (un it ) Perulangan 4 jam ke
Ucapan Terimakasih:
Terimakasih kepada Drs Refdinal Nawfa, MSi, selaku dosen pembimbing yang telah memberikan pengarahan, bimbingan dan motivasi dalam penyusunan tugas akhir ini
DAFTAR PUSTAKA
Afag, Sarah dan Jawaid, Iqbal, (2001), “Immobilization and Stabilization of Papain on Chelating Sepharosa: a Metal Chelate Regeneable Carrier”, Electronic Journal of Biotechnology
Agustini, (2003), Karakterisasi Imobilisasi Protease Mikroorganisme Thermofilik Isolat CG-10 Yang Hidup Di Air Panas Cangar Jawa Timur Dengan Matriks Pendukung Bentonit, Disertasi UNAIR, Surabaya
Chibata,I., 1978, Immobilixe Enzymes Research and Development, Kodansha LTD, Tokyo, Johan and Wiley and Sons, New York Darwis dan Sukara, (1990), Penuntun Praktikum
Isolasi, Purifikasi dan Karakterisasi Enzim, IPB, Bogor
De Deles, Gina Rio, (2000), “Microbial Demetalization of Crude Oil : Nickel Protoprophyrin Disodium as a Model Organometallic Substrate”, Journal of Bioscience and Bioengineering, vol 90, No 5, hal 515-521
Guibal, E., Milot, C., dan Tobin, 1998, Meta -Anion Sorption by Chitosan Beads: Equilibrium and kinetic studies, Industrial and Engineering Chemistry Research, 37(4): 1454-1463
Indra., Akhlus, S., 1994, Hidrolisis Khitin Menjadi Khitosan serta Aplikasinya Sebagai Pendukung Padat, Jurusan Kimia FMIPA ITS, Surabaya
Lehninger AL., 1990, Dasar-dasar Biokimia , terjemahan Maggy Thenawidjaya., Penerbit Erlangga, Jakarta
Pujiastuti, P., 2001, Kajian Transformasi Khitin Menjadi Kitosan Secara Kimiawi dan Enzimatik, Seminar Nasional Jurusan Kimia, Jurusan Kimia FMIPA UNS, Surakarta
Sarah, A., 2001. Immobilization and Stabilization of Papain on Chelating Sepharose, Electronic J. Biotechology, Catolica de Velparaaiso Chile