ANALISIS MARKA MOLEKULER
TERPAUT KARAKTER FISIOLOGI DARI SIFAT
TOLERANSI ALUMINIUM PADA PADI
AKHMAD
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2009
PERNYATAAN MENGENAI TESIS
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis berjudul “Analisis Marka Molekuler Terpaut Karakter Fisiologi dari Sifat Toleransi Aluminium pada Padi” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2009
Akhmad
ABSTRACT
AKHMAD. Moleculer Marker Analysis Linked to Physiological Characters of Aluminum Tolerance Trait in Rice. Under direction of MIFTAHUDIN and DWINITA WIKAN UTAMI
Aluminum (Al) toxicity is one of the major constrains in crop cultivation in acid soil. The objective of this study is to analyze molecular markers that linked to physiological parameter of Al tolerance trait in rice. The physiological characters that were used in this study were root re-growth maximum tiller number and flowering time of 379 F2 plants derived from a cross between an
Al-sensitive rice var. IR64 and an Al-tolerant rice var. Hawarabunar. and molecular marker linkage analysis. To perform root re-growth analysis, the seedlings were grown on minimum culture solution containing 15 ppm of Al for 72 hours, and then transferred to non Al-treated culture solution for 48 hours. The root length that was obtained during recovery was measured as RRG value. Maximum tiller number and flowering time were observed on F2 population in green house. RRG
analysis showed that this character was multigenic trait as well as maximum tiller number and flowering time. Among seventeen polymorphic simple sequence repeats (SSR) that were analyzed, 12 markers showed 1:2:1 segregation pattern. Nine of those markers were located in chromosome 1 and 3 markers were in chromosome 3. Linkage analysis between molecular markers and physiological character using single marker analysis method showed that RM138 located on chromosome 2 and RM231 on chromosome 3 were linked RRG. RM174 that located chromosome 2 was linked to maximum tiller number. While RM250 that located on chromosome 2 was linked to the flowering time.
RINGKASAN
AKHMAD. Analisis Marka Molekuler Terpaut Karakter Fisiologi dari Sifat Toleransi Aluminium pada Padi. Dibimbing oleh MIFTAHUDIN dan DWINITA WIKAN UTAMI.
Indonesia merupakan negara dengan jumlah penduduk yang cukup besar di dunia. Peningkatan jumlah penduduk akan berpengaruh pada peningkatan kebutuhan pangan. Padi (Oriza sativa L.) merupakan tanaman pangan yang sangat penting karena sampai saat ini masih digunakan sebagai sumber makanan pokok sebagian besar penduduk Indonesia. Lahan-lahan pertanian yang produktif beralih fungsi menjadi kawasan industri dan pemukiman terutama di pulau Jawa. Untuk peningkatan produksi pertanian, terjadi peralihan lahan pertanian ke lahan-lahan marginal yang meliputi lahan-lahan kering dan lahan pasang surut. Kendala yang dihadapi adalah keasaman tanah, kahat hara makro dan mikro, kandungan bahan organik rendah, tingkat kejenuhan Al yang tinggi. Pada pH < 4,0 bentuk Al3+ merupakan bentuk yang paling dominan dan sangat beracun bagi tanaman.
Padi merupakan tanaman yang relatif toleran terhadap keracunan Al dibanding tanaman sereal lainnya. Akan tetapi tingginya kandungan Al di tanah menyebabkan pertumbuhan akar terhambat, pendek dan tebal, percabangan tidak normal, tudung akar rusak dan berwarna cokelat atau merah, dan pada akhirnya akan merusak sistem perakaran dan mengganggu penyerapan hara oleh tanaman. Untuk menghadapi masalah tersebut salah satu cara yang dapat dilakukan adalah menggunakan varietas yang toleran terhadap cekaman Al melalui seleksi dan persilangan. Akan tetapi seleksi dan persilangan secara konvensional akan memerlukan waktu yang lama dan areal yang luas untuk memproduksi galur yang baru. Oleh karena itu, seleksi melalui analisis marka molekuler terpaut sifat fisiologi dari sifat toleransi Al dapat membantu proses seleksi dalam program perakitan galur harapan toleransi cekaman Al serta dapat dilakukan pada tahap pembibitan. Salah satu marka molekuler yang dapat dipergunakan adalah marka SSR (simple sequence repeats) atau mikrosatelit.
Tujuan penelitian ini adalah menganalisis karakter fisiologi yaitu Root Regrowth (RRG), jumlah anakan maksimum, dan umur berbunga yang dapat dipergunakan sebagai parameter dari sifat toleransi Al dan pola pewarisannya serta mengidentifikasi marka molekuler yang terpaut dengan sifat toleransi terhadap cekaman keracunan Al pada populasi F2 (IR64 x Hawarabunar).
Analisis RRG dilakukan dengan menggunakan kultur hara minimum, dengan cekaman Al 15 ppm selama 72 jam dan recovery (tanpa Al) selama 48 jam, diperoleh hasil bahwa tetua 1 (IR64) yang bersifat sensitif Al memiliki kemampuan recovery yang rendah setelah diberi cekaman Al selama 72 jam. Sebaliknya tetua 2 (Hawarabunar) memiliki kemampuan recovery yang tinggi setelah diberi cekaman Al selama 72 jam. Kisaran nilai RRG 22 mm dijadikan batas pembeda kelompok padi sensitif dan toleran Al. Jika nilai RRG < 22 mm maka digolongkan ke padi yang sensitif Al dan jika nilai RRG 22 mm maka digolongkan ke padi yang toleran Al. Hal ini menunjukkan bahwa RRG merupakan parameter fisiologi untuk sifat toleransi Al. Pola segregasi RRG pada populasi F2 tidak mengikuti pola pewarisan gen tunggal (3:1), tetapi menyebar
Analisis jumlah anakan maksimum dan umur berbunga diamati saat populasi padi F2 di tanam secara gogo di rumah kaca, pada tanah asam Podsolik Merah
Kuning dari Jasinga Bogor. Pengamatan dilakukan saat 50% dari populasi berbunga. Dari hasil pengamatan diperoleh bahwa baik jumlah anakan maksimum maupun umur berbunga bukan termasuk parameter fisiologi dari sifat toleransi terhadap cekaman Al. Pola pewarisan jumlah anakan maksimum dan umur berbunga pada F2 tidak mengikuti pola pewarisan gen tunggal. Hal ini
menunjukkan bahwa kedua parameter tersebut dikendalikan oleh lebih dari satu gen.
Analisis marka molekuler dilakukan dengan teknik Polymerase Chain Reaction (PCR) menggunakan 17 marka SSR pada kromosom 1 dan 3 yang bersifat polimorfis pada kedua tetua. Berdasarkan analisis terhadap pita-pita DNA hasil PCR dari 346-379 tanaman populasi F2 diperoleh bahwa 9 dari 10 marka
pada kromosom 1 dan 3 marka dari 7 marka pada kromosom 3 pola pewarisannya menunjukkan pola segregasi 1:2:1 untuk rasio genotipe IR64:Heterozigot:Hawarabunar. Hal ini menunjukkan bahwa marka-marka tersebut bersegregasi mengikuti pola segregasi gen tunggal.
Analisis keterpautan antara marka molekuler dengan karakter fisiologi dilakukan dengan metode marka tunggal menggunakan software QTL Cartographer Ver.2,0. Berdasarkan hasil analisis marka tunggal dengan menggunakan 38 marka SSR pada kromosom 1, 2, dan 3, diperoleh bahwa marka RM138 pada kromosom 2 dan RM 321 pada kromosom 3 terpaut dengan karakter RRG. Marka RM174 yang terletak pada kromosom 2 terpaut dengan karakter jumlah anakan maksimum, sedangkan marka RM250 pada kromosom 2 terpaut dengan karakter umur berbunga.
© Hak Cipta milik Institut Pertanian Bogor, tahun 2009
Hak Cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.
a. pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. dan pengutipan tidak merugikan kepentingan yang wajar IPB. 2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya
ANALISIS MARKA MOLEKULER
TERPAUT KARAKTER FISIOLOGI DARI SIFAT
TOLERANSI ALUMINIUM PADA PADI
AKHMAD
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2009
Judul Tesis : Analisis Marka Molekuler Terpaut Karakter Fisiologi dari Sifat Toleransi Aluminium pada Padi
Nama : Akhmad
NIM : G351060151 Departemen : Biologi
Disetujui Komisi Pembimbing
Dr. Ir. Miftahudin, M.Si Dr. Dwinita W. Utami, M.Si Ketua Anggota
Diketahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana IPB
Dr. Ir. Dedy Duryadi Solihin, DEA Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga tesis ini berhasil diselesaikan. Tema dalam penelitian yang dilaksanakan sejak bulan Mei 2007 ini adalah cekaman aluminium dengan judul Analisis Marka Molekuler Terpaut Karakter Fisiologi dari Sifat Toleransi Aluminium pada Padi.
Penulis menyadari bahwa terlaksananya penelitian dan penyusunan tesis ini dengan baik, atas bantuan dari berbagai pihak. Oleh karena itu, penulis menyampaikan terima kasih yang sebesar-besarnya kepada:
1. Dr. Ir. Miftahudin, M.Si. yang telah memberikan dana dan kesempatan untuk ikut serta dalam proyek penelitian Kerjasama Kemitraan Penelitian Pertanian dengan Perguruan Tinggi (KKP3T) dan bersama dengan Dr. Dwinita Wikan Utami, M.Si. selaku pembimbing, atas bimbingan yang penuh kesabaran dan keikhlasan sehingga tesis ini dapat diselesaikan dengan baik.
2. Dr. Ir. Utut Widyastuti Suharsono, M,Si. selaku penguji luar komisi, atas kesediaan, saran, dan kritik untuk kesempurnaan tesis ini.
3. Departemen Agama RI atas kesempatan dan beasiswa yang diberikan.
4. Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian Bogor yang telah memberikan fasilitas untuk menunjang pelaksanaan penelitian.
5. Isteri tercinta Tintin Kusumaningtyas, S.Pd. dan kedua anakku Muhammad Rizky Andrianto dan Rahmat Ilmi Andrianto atas pengorbanan, dorongan, cinta, dan doa yang tulus yang telah diberikan.
6. Keluarga tercinta yang telah memberikan doa dan semangat : Ayahanda Salam dan Ibunda Asiyah, mertua Ibunda Sumili, serta semua saudara dan saudara-saudara iparku.
7. Rekan-rekan di Lab Fisiologi dan Biologi Molekuler Tumbuhan, Departemen Biologi, FMIPA, IPB, Bogor terutama Dewi Indriyani Roslim dan Hariyanto. 8. Rekan-rekan BUD Departemen Agama RI angkatan 2006 dan 2007 yang tidak
bisa disebutkan satu persatu.
9. Semua pihak yang tidak dapat penulis sebutkan satu persatu. Semoga tesis ini dapat bermanfaat, Amin Ya Robbal ’Alamin.
Bogor, Januari 2009
Akhmad
RIWAYAT HIDUP
Penulis dilahirkan di Airsuning Kabupaten Sumbawa pada tanggal 26 Oktober 1969 dari ayah Salam dan ibu Asiyah. Penulis merupakan putra ke tujuh dari sembilan bersaudara.
Pada tahun 1988 penulis lulus dari SMA Negeri I Sumbawa Besar dan pada tahun yang sama lulus seleksi masuk Universitas Mataram melalui jalur Sistem Penerimaan Mahasiswa Baru (Sipenmaru). Penulis memilih program studi Biologi, Fakultas Keguruan dan Ilmu Pendidikan. Pendidikan sarjana diselesaikan pada tahun 1993.
Tahun 1997 penulis diangkat menjadi Calon Pegawai Negeri Sipil dan ditempatkan di Madrasah Aliyah Negeri Buntok Kabupaten Barito Selatan Kalimantan Tengah. Tahun 2006 penulis mendapatkan kesempatan melanjutkan studi sebagai mahasiswa pada Program Studi Biologi Sekolah Pascasarjana Institut Pertanian Bogor.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 4
TINJAUAN PUSTAKA ... 5
Toksisitas Aluminium ... 5
Mekanisme Toleransi Tanaman Terhadap Cekaman Aluminium ... 8
Pewarisan Sifat Toleransi Aluminium pada Tanaman ... 11
Pemanfaat Marka Molekuler dalam Proses Seleksi Pemuliaan Tanaman ... 15
METODOLOGI ... 17
Waktu dan Tempat ... 17
Bahan Tanaman ... 17
Metode Penelitian ... 18
Alur penelitian ... 18
Perlakuan cekaman Al. ... 18
Analisis Parameter Fisiologi Cekaman Al ... 19
Analisis RRG ... 19
Pengamatan jumlah anakan maksimum ... 20
Analisis umur berbunga ... 20
Analisis data fenotipe ... 20
Analisis Marka Molekuler ... 20
Isolasi DNA tanaman padi ... 20
Marka molekuler ... 22
PCR (Polymerase Chain Reaction) ... 22
Analisis Polimorfisme ... 23
Analisis Segregasi ... 23
Analisis Keterpautan ... 23
HASIL DAN PEMBAHASAN ... 24
Analisis Parameter Fisiologi ... 24
RRG ... 24
Jumlah anakan maksimum ... 27
Umur berbunga ... 29
Analisis Marka Molekuler ... 31
Analisis Keterpautan Marka Molekuler dengan Karakter Fisiologi ... 32
KESIMPULAN DAN SARAN ... 35
Kesimpulan ... 35
Saran ... 35
DAFTAR PUSTAKA ... 36
DAFTAR TABEL
Halaman 1 Nilai rata-rata parameter fisiologi dari respon tanaman padi terhadap
cekaman Al ... 24 2 Uji Khi-Kuadrat dari pola segregasi parameter fisiologi pada populasi F2 27
3 Uji Khi-Kuadrat dari pola segregasi parameter jumlah anakan maksimum pada popupasi F2 ... 29
4 Uji Khi-Kuadrat pada marka molekuler kromosom 1 dan kromosom 3 ... 32 5 Hasil analisis statistik marka tunggal pada karakter fisiologi ... 34
DAFTAR GAMBAR
Halaman 1 Bahan tanaman ... 17 2 Kultur hara dan cekaman Al pada populasi F2 ... 19
3 Termocycle ESCO swift maxi ... 22 4 Distribusi nilai RRG pada populasi F2 hasil persilangan padi varietas IR64 dan Hawarabunar ... 24 5 Panjang akar setelah perlakuan cekaman Al selama 72 jam dan panjang akar setelah recovery selama 48 jam ... 25 6 Distribusi nilai jumlah anakan maksimum pada populasi F2 hasil
Persilangan padi varietas IR64 dan Hawarabunar ... 28 7 Distribusi nilai umur berbunga pada populasi F2 hasil persilangan padi
varietas IR64 dan Hawarabunar ... 30 8 Peta fisik dari 38 marka SSR yang tersebar pada kromosom 1,2, dan 3 dari padi ... 33
DAFTAR LAMPIRAN
Halaman
1 Jadual kegiatan penelitian ... 43
2 Komposisi hara minimum ... 44
3 Hasil analisis kandungan tanah asam Podsolik Merah Kuning dari Jasinga Bogor ... 45
4 Daftar primer SSR yang polimorfis untuk kromosom 1 da 3 pada padi ... 46
5 Hasil pengamatan terhadap parameter fisiologi ... 47
PENDAHULUAN
Latar Belakang
Indonesia merupakan suatu negara dengan jumlah penduduk yang cukup besar di dunia. Peningkatan jumlah penduduk akan berpengaruh pada peningkatan pemenuhan kebutuhan pangan. Padi (Oriza sativa L.) merupakan tanaman pangan yang sangat penting karena sampai saat ini masih digunakan sebagai sumber makanan pokok bagi sebagian besar penduduk Indonesia.
Indonesia saat ini menghadapi masalah produksi pangan seiring dengan meningkatnya jumlah penduduk. Lahan-lahan yang subur dan produktif yang semestinya berfungsi untuk lahan pertanian terutama di pulau Jawa beralih fungsi menjadi kawasan industri dan pemukiman. Selain itu juga disebabkan oleh bencana alam berupa kemarau panjang atau banjir yang terjadi hampir setiap tahun serta serangan hama dan penyakit yang menyebabkan makin menurunnya produksi padi (Rahmawati 2006).
Untuk peningkatan produksi pertanian dalam rangka pemenuhan kebutuhan pangan maka program ekstensifikasi lahan pertanian perlu diarahkan pada lahan-lahan marginal yang ada di luar pulau Jawa. Lahan asam dan lahan-lahan pasang surut merupakan tipologi lahan yang sering menjadi perhatian untuk pengembangan pertanian di masa mendatang, selain pembukaan areal pertanian pada lahan kering. Pengembangan padi ke lahan tersebut dihadapkan pada kendala fisikokimia seperti keasaman tanah (pH 3,5-5,5), kahat hara makro dan mikro, kandungan bahan organik rendah, tingkat kejenuhan Al tinggi, dan sangat peka terhadap erosi (Roesmarkam et al. 1992; Sanchez 1992).
Pada lahan asam, proses asidifikasi tanah bisa disebabkan oleh pencucian kation dari tanah, praktek-praktek pertanian dan hujan asam. Pada lahan-lahan tersebut keracunan yang utama disebabkan oleh kandungan Al yang tinggi. Pada pH < 4,0 bentuk Al3+ merupakan bentuk yang paling dominan dan bersifat racun bagi tanaman (Marschner 1995).
Kelebihan konsentrasi Al dalam larutan tanah pada umumnya berakibat buruk pada pertumbuhan tanaman, kecuali beberapa tanaman seperti teh yang mampu bertahan pada konsentrasi Al yang tinggi. Gangguan penyerapan hara
mineral pada tanah asam disebabkan oleh dua hal yang sangat berkaitan yaitu efek langsung dengan menghambat penyerapan hara secara langsung dan efek tidak langsung dengan menghambat pertumbuhan akar sehingga secara tidak langsung menghambat penyerapan hara (Marschner 1995). Matsumoto (1991) menyatakan bahwa pengaruh langsung dari keracunan Al yaitu merusak sistem perakaran yang menyebabkan gangguan penyerapan mineral oleh tanaman.
Padi merupakan tanaman yang relatif toleran terhadap keracunan Al dibanding tanaman sereal lainnya. Akan tetapi tingginya kandungan Al di tanah menyebabkan pertumbuhan akar terhambat, pendek, tebal, percabangan tidak normal, tudung akar rusak dan berwarna cokelat atau merah, yang pada akhirnya merusak sistem perakaran dan mengganggu penyerapan hara (Kochian 1995). Beberapa galur baik lokal maupun hasil persilangan memiliki sifat toleran terhadap cekaman keracunan Al pada tanah asam. Khatiwada et al. (1996) telah melaporkan bahwa terdapat 10 kultivar padi yang berasal dari Indonesia yang bersifat toleran cekaman keracunan Al. Hasil penelitian tersebut juga diperkuat oleh Jagau (2000) yang melakukan penyaringan terhadap 150 galur padi gogo baik lokal maupun varietas hibrid guna menentukan galur yang toleran dan peka terhadap cekaman keracunan Al. Hasil penelitiannya menunjukkan bahwa konsentrasi Al 45 ppm sudah dapat mengelompokkan galur padi gogo ke dalam kelompok galur yang peka dan toleran. Empat galur padi gogo lokal asal Indonesia yang termasuk toleran Al adalah Ketombol, Krowal, Grogol dan Hawara Bunar. Sedangkan varietas hibrid yang toleran Al adalah CT6510-24-1-3. Padi IR64 yang banyak dikonsumsi masyarakat termasuk ke dalam kelompok padi yang peka cekaman Al (Khatiwada et al. 1996; Nguyen et al. 2003).
Beberapa penelitian menunjukkan bahwa toleransi padi terhadap cekaman Al dikendalikan oleh lebih dari satu gen (Wu et al. 1997; Nguyen et al. 2001). Khatiwada et al. (1996) menunjukkan bahwa nilai relatif panjang akar (RPA) yang tinggi dikendalikan oleh pengaruh aditif dan dominan, tetapi lebih banyak karena pengaruh aditif. Wu et al. (1997) melakukan studi genetik untuk sifat toleransi terhadap keracunan Al padi dengan membuat persilangan dialel tidak sempurna pada delapan tetua jantan dan tujuh tetua betina. Hasilnya menunjukkan
bahwa ragam General Combine Ability (CGA) lebih besar dibandingkan dengan Spesifik Combine Ability (SCA), sehingga pengaruh gen-gen aditif lebih besar.
Hal yang dapat dilakukan untuk mengatasi masalah cekaman keracunan Al pada tanah asam adalah dengan pengapuran dan menggunakan varietas-varietas yang toleran terhadap cekaman keracunan Al. Pembentukan varietas-varietas yang toleran dapat dilakukan melalui seleksi dan persilangan. Menurut Bennet (1993) seleksi akan memerlukan waktu yang lama dan areal yang luas untuk memproduksi satu galur baru. Seleksi berdasarkan fenotipe saja akan menemui kesulitan karena kondisi lingkungan yang bervariasi. Selain itu, bila gen-gen yang mengatur sifat ketahanan bersifat aditif, seleksi akan lebih sulit dilakukan karena masing-masing gen hanya menyumbang sebagian kecil terhadap fenotipe tersebut. Analisis karakter fisiologi dan marka molekuler yang terpaut sifat toleransi cekamn keracunan Al dapat membantu proses seleksi dalam program perakitan galur harapan toleran cekaman keracunan Al. Selain itu, marka molekuler mampu menyeleksi sifat-sifat yang diinginkan pada tahap awal pertumbuhan seperti tahap pembibitan. Salah satu marka molekuler yang telah digunakan secara luas adalah SSR (Simple Sequence Repeats) atau mikrosatelit. Marka ini bersifat kodominan, dapat mendeteksi variasi alel yang tinggi (Wu & Tanskley 1993), dan khususnya pada padi, sekarang ini jumlahnya sudah sangat banyak yang tersebar di 12 kromosom padi.
Penggunaan 41 marka SSR oleh Mao et al. (2004) berhasil mendeteksi tiga QTL untuk toleran Al yaitu QTL untuk Relative Root Length (RRL) pada kromosom 1,3, dan 9 dan satu QTL untuk Stress Root Length (SRL) pada kromosom 1 tanaman padi. Nguyen et al. (2003) berhasil mendeteksi lokasi QTL untuk karakter Control Root Length (CRL), Al-Stress Root Length (SRL), dan Root length Ratio (RR) yang terdapat pada kromosom-kromosom padi.
Diperolehnya marka molekuler yang terpaut karakter fisiologi dari sifat toleran Al pada padi, maka seleksi untuk mendapatkan kandidat galur toleran Al dari suatu populasi menjadi lebih terarah. Dalam rangka pembentukan galur-galur toleran terhadap cekaman keracunan Al maka penelitian ini perlu dilakukan untuk menganalisis parameter fisiologi sifat toleran keracunan Al seperti Root Regrowth (RRG), jumlah anakan maksimum dan umur berbunga, beserta marka molekuler
terpaut sifat pada populasi hasil persilangan padi varietas IR64 dengan Hawarabunar, suatu galur padi lokal Indonesia.
Berdasarkan uraian di atas, dengan mengetahui parameter fisiologi dari sifat toleransi terhadap cekaman keracunan Al pada padi diharapkan dapat mengetahui parameter yang dapat digunakan sebagai parameter dari sifat toleransi terhadap cekaman keracunan Al dan pola pewarisannya serta mendapatkan marka molekuler yang terpaut karakter toleransi terhadap cekaman keracunan Al yang dapat dipergunakan dalam membantu program seleksi.
Tujuan Penelitian Penelitian ini bertujuan :
1. Menganalisis karakter fisiologi yaitu Root Regrowth (RRG), jumlah anakan maksimum, dan umur berbunga yang dapat digunakan sebagai parameter dari sifat toleransi terhadap keracunan Al dan pola pewarisannya.
2. Mengidentifikasi marka molekuler yang terpaut dengan karakter fisiologi dari sifat toleransi terhadap cekaman keracunan Al pada populasi F2 (IR64 x
TINJAUAN PUSTAKA
Toksisitas Aluminium
Pada pertumbuhannya, tanaman selalu dihadapkan pada berbagai cekaman lingkungan baik cekaman biotik seperti serangan hama, penyakit, dan gulma maupun cekaman abiotik seperti kekeringan, kadar garam tinggi, logam berat, suhu tinggi maupun suhu rendah, dan tanah asam.
Secara normal, Al berada dalam bentuk oksida dan kompleks aluminosilikat yang tidak larut dan tidak toksik. Pada pH netral, Al membentuk kompleks dengan ion hidroksida yang tidak larut, sedangkan pada pH asam Al berada dalam bentuk Al3+ yang merupakan bentuk yang paling toksik. Dalam larutan pH yang lebih rendah dari 5,0, ion Al berada dalam bentuk oktahedral Al(H2O)63+ yang
sering disingkat Al3+. Pada larutan yang keasamannya berkurang Al(H2O)63+
akan mengalami deprotonisasi menjadi Al(OH)2+ dan Al(OH)2+. Pada larutan
netral menyebabkan Al(OH)3 mengendap dan larut kembali pada larutan basa
dengan membentuk formasi tetrahedral Al(OH)4-(Delhaize & Ryan 1995;
Marschner 1995).
Keracunan Al merupakan hambatan produksi pertanian di tanah asam. Keracunan Al ini mampu menurunkan produksi tanaman 25% sampai 85% (Herrera-Estrella 2003). Rendahnya produktivitas menyebabkan tanah asam yang cukup luas masih belum dimanfaatkan sebagai lahan pertanian.
Beberapa hasil penelitian menunjukkan bahwa target utama keracunan Al adalah jaringan akar tanaman (Sasaki et al. 1992; Ryan et al. 1993, Delhaize & Ryan 1995). Tingkat keracunan ini tergantung pada aktivitas ion Al3+ dalam media. Gejala pertama yang tampak dari keracunan Al adalah sistem perakaran yang tidak berkembang (pendek dan tebal) sebagai akibat penghambatan perpanjangan sel. Kontak dengan Al pada daerah rizosfer juga menyebabkan kerusakan membran akar, akar menebal, menggulung dan memendek (Delhaize & Ryan 1995). Pengaruh buruk yang lain yaitu terjadinya gangguan penyerapan mineral, penggabungan Al dengan dinding sel, dan penghambatan pembelahan sel (Matsumoto 1991). Selanjutnya dikatakan bahwa pada kondisi tanah asam, Al berada dalam bentuk Al3+ yang sangat toksik karena dapat mengkelat unsur hara
sehingga menghambat penyerapan unsur terkelat itu oleh akar tanaman. Akibatnya tanaman kekurangan unsur hara dan pertumbuhannya terhambat. Keracunan Al juga dapat menurunkan dan merusak sistem perakaran yang menyebabkan tanaman rentan terhadap stres kekeringan dan mengalami defisiensi nutrien mineral.
Ion Al yang masuk ke dalam jaringan akar akan terikat pada protein dan fosfolipid pada membran sel, sehingga membran menjadi kaku (rigid) dan fluiditasnya menurun. Terikatnya Al pada protein membran juga menyebabkan terganggunya sirkulasi Ca2+ dan berbagai senyawa hara penting (Kochian 1995). Matsumoto (1991) menyatakan bahwa pada dinding sel, penghambatan terjadi karena Al menggantikan kedudukan Ca2+ pada lamela tengah. Ca2+ merupakan second messenger dalam aktivitas H+-ATPase dengan bantuan protein regulator calmodulin. Digantikannya Ca2+ yang melekat pada calmodulin akan terjadi perubahan aktivitas enzim. Selain itu, Ryan et al. (1997) melaporkan hasil penelitiannya bahwa Al juga berhubungan dengan membran lipid bilayer pada sel dimana Al memblok saluran Ca2+ dan K+ sehingga mengganggu proses penyerapan hara. Ion Al juga reaktif dengan asam lemak dan menyebabkan meningkatnya peroksidasi asam lemak membran sel (Ono et al. 1995).
Aluminium dapat terikat kuat pada asam nukleat dan mengganggu replikasi DNA dalam pembelahan sel serta transkripsi dalam ekspresi gen (Aniol et al. 1984). Silva et al. (2000) memperlihatkan terhambatnya pembelahan sel di daerah meristimatis ujung akar kedelai disebabkan oleh akumulasi aluminium pada inti sel. Reaktivitas Al juga berpengaruh terhadap mitokondria (De Lima & Coveland 1994), sitoskeleton (Kochian 1995) dan aktin kerangka sel. Adanya ikatan Al terhadap senyawa-senyawa penyusun komponen sel itulah yang menyebabkan perubahan struktur dan fisiologi tanaman. Kelainan akar juga menyebabkan terhambatnya penyerapan NH4 dan NO3 serta terganggunya aktivitas enzim nitrat
reduktase (Cumming & Taylor 1990).
Aluminium juga berpengaruh terhadap metabolisme tanaman selain organ akar, misalnya terhambatnya asimilasi CO2 karena kerusakan struktur tilakoid
penurunan kandungan glukosa, sorbitol, dan karbohidrat pada daun tanaman persik (Prunus persica).
Efek utama stres Al pada tanaman rye dan gandum adalah menginduksi peningkatan Ca2+ sitoplasma pada sel-sel apikal akar. Peningkatan ini mengganggu proses metabolisme yang membutuhkan Ca2+, seperti regulasi pembelahan dan pemanjangan sel, yang akhirnya akan menghambat pertumbuhan akar (Ma et al. 2002).
Doncheva et al. (2005) telah melakukan penelitian pengaruh jangka pendek (5-180 menit) 50 M Al terhadap pembelahan sel di ujung akar dua varietas jagung yang berbeda resistensinya terhadap Al. Mereka menggunakan bromodeoxyuridine dan pewarnaan immunofluorescence. Bagi tanaman yang peka, waktu 5 menit sudah cukup untuk menghambat pembelahan sel pada meristim proksimal (250-800 M dari ujung akar). Pewarnaan hematoxilin menunjukkan bahwa pada bagian ujung akar dari varietas yang sensitif lebih banyak mengakumulasi Al dari pada yang toleran. Selain itu, varietas yang resisten Al menampakkan pertumbuhan akar lateral yang abnormal. Perubahan perkembangan akar tersebut bisa terjadi karena Al mengikat nukleotida yang kaya unsur atau gugus bermuatan negatif seperti fosfat (PO4-)(Schetinger et al. 2003).
Ikatan Al dengan grup karboksil akan menimbulkan ikatan yang kuat sehingga sel tidak dapat membesar (Marschner 1995). Pada inti sel, Al berasosiasi dengan DNA sehingga menghentikan proses pembelahan sel meristem apikal. Al dalam bentuk polimer memiliki muatan positif yang besar serta memiliki banyak situs pengikatan. Polimer Al ini dapat mengikat fosfat yang ada pada kedua utas DNA, mengakibatkan gagalnya utas ganda DNA berpisah (Matsumoto 1991).
Secara biologi, yang memainkan peranan penting dalam keracunan Al pada tanaman adalah tingginya konsentrasi H+. Pertama, H+ yang tinggi atau pH yang sangat rendah mempengaruhi struktur membran plasma serta menginduksi perubahan konformasi molekul penyusun dinding sel, membran plasma dan sitoskeleton. Kedua, tingkat keasaman ekstraseluler meningkatkan permeabilitas membran plasma terhadap H+, menurunkan pH intraseluler dan dengan demikian meningkatkan daya saing Al terhadap ligan seluler. Ketiga, ada hubungan antara keracunan Al dan H+ (Vitorello et al. 2005).
Mekanisme Toleransi Tanaman Terhadap Cekaman Aluminium Mekanisme fisiologi dan biokimia tanaman terhadap cekaman Al berbeda-beda antar spesies dan varietas (Yahya & Setiyati 1988). Tanaman yang toleran terhadap cekaman Al memiliki kemampuan untuk menekan pengaruh buruk keracunan Al tersebut.
Kriteria tanaman yang toleran terhadap keracunan Al antara lain: (a) akar sanggup tumbuh terus dan ujung akar tidak rusak, (b) mengurangi absorbsi Al, (c) memiliki berbagai cara untuk menetralkan pengaruh toksik Al setelah diserap tanaman, (d) sanggup menciptakan keadaan yang kurang asam di daerah perakaran, (e) translokasi ion Al ke bagian atas tanaman sedikit, karena sebagian besar ditahan di akar, (f) karena suatu mekanisme tertentu maka ion Al tidak sanggup menghambat serapan Ca, Mg, dan K (Suparto 1999).
Menurut Marschner (1995) mekanisme resistensi tanaman terhadap tanah asam meliputi mekanisme toleransi dan penghindaran (avoidance). Mekanisme toleransi terhadap cekaman atau stres dapat dilakukan oleh tanaman dengan membiarkan stres memasuki jaringannya asalkan tanaman dapat mengurangi atau menghilangkan pengaruh stres terhadap tanaman. Sedangkan mekanisme penghindaran dilakukan tanaman dengan mencegah atau mengurangi penetrasi stres ke dalam jaringannya. Berdasarkan akumulasi Al di dalam tajuk, adaptasi tanaman terhadap cekaman Al dibagi menjadi tiga kelompok, yaitu: pertama, kelompok yang tidak mengakumulasi Al di tajuk dan akar tidak menyerap Al (disebut mekanisme penghindaran). Mekanisme ini dapat terjadi karena tanaman mengeksudasi senyawa asam organik. Senyawa asam organik tersebut dapat mengkelat Al sehingga Al tidak diserap tanaman. Kedua, kelompok dengan kondisi Al di tajuk lebih rendah dari pada di akar karena Al di tahan dan diakumulasi di akar terutama di korteks dan epidermis akar. Pada jaringan muda yang belum mempunyai endodermis, Al bisa lolos ke tajuk melalui jaringan meristem akar dan pembuluh akar (stele). Pada tanaman gandum, bila sudah melebihi ambang batas yang bisa ditolerir oleh sitoplasma, maka Al yang akan diakumulasi di akar dan akan dikeluarkan. Ketiga, kelompok yang mengakumulasi Al di tajuk (Al akumulator) seperti Camelia sinensis (teh), Pinus
sp., Rhyzophora spp. (bakau), dan Melastoma malabathtricum L (Watanabe et al. 2001).
Taylor (1991) membagi mekanisme ketahanan tanaman menjadi dua bagian. Mekanisme pertama adalah eksklusi, yaitu mengeluarkan Al atau senyawa organik dari ujung akar sehingga ion Al tidak mencapai daerah metabolik atau protoplasma. Mekanisme ini dikenal juga dengan mekanisme eksternal atau eksudasi. Mekanisme kedua adalah inklusi, yaitu detoksifikasi atau inaktivasi Al yang telah mencapai sel dan kemudian ditimbun. Mekanisme ini juga dikenal dengan mekanisme internal.
Mekanisme eksklusi dilakukan dengan tiga cara. Pertama, dengan meningkatkan selektivitas membran, terutama terhadap ion logam berat dapat dilakukan dengan mengatur permeabilitas membran yaitu melalui perubahan tingkat kejenuhan asam lemak dan fosfolipid penyusun membran (Cumming &Taylor 1990). Kedua, dengan mengatur effluks ion logam, pada gandum baik yang toleran maupun yang sensitif apabila diberi perlakuan sikloheksamida maka akan kehilangan toleransinya, diduga toleransi ini terkait dengan produksi protein membran (Zhang & Taylor 1989). Ryan et al. (1997) juga mengamati bahwa Al menginduksi pembentukan kanal ion pada protoplas yang diisolasi dari akar gandum. Ketiga, dengan memodifikasi rizosfer akar. Modifikasi dilakukan dengan melepaskan asam organik ke permukaan akar. Menurut Li et al. (2000) asam organik yang dikeluarkan melalui akar akan mengikat Al3+ untuk menghindari pengaruh Al terhadap sistem yang ada di dalam dan ruang antar sel. Asam organik tersebut di antaranya adalah asam oksalat (Ma et al. 1997;), asam sitrat pada jagung (Pellet et al. 1995), asam sitrat dan malat pada triticale (Ma et al. 2000), asam sitrat, suksinat dan malat (Miyasaka et al. 1991). Kasim et al. (2000) juga mengamati adanya peningkatan produksi asam sitrat dan malat pada akar tanaman kedelai yang toleran Al. Modifikasi juga dilakukan dengan melepaskan ion posfat (Larsen et al. 1998).
Modifikasi rizosfer juga dilakukan melalui pembentukan gradien redoks atau pH pada permukaan akar. Degenhardt et al. (1998) melihat adanya peningkatan influks H+ dan eksudasi asam organik pada ujung akar gandum mutan Alr104. Peningkatan pH dapat terjadi jika malat mengalami protonasi pada
larutan eksternal sehingga mengurangi toksisitas Al3+ melalui peningkatan pH yang pengaruhnya sama dengan kelatisasi Al oleh malat. Bentuk modifikasi rizosfer lainnya dengan cara immobilisasi Al di permukaan dinding sel. Al akan terikat pada senyawa pektin atau komponen dinding sel yang bermuatan negatif pada jaringan epidermis dan tudung akar (Delhaize et al. 1993). Larsen (1996) menyatakan bahwa Al akan menginduksi pembentukan musilag pada ujung akarnya dan pengeluaran senyawa tertentu seperti kalosa (polisakarida -1,3-glucan) untuk mencegah masuknya Al. Menurut Larsen et al. (1996) melihat kalosa hanya terbentuk pada Arabidopsis yang sensitif. Sivaguru et al. (2000) juga menegaskan bahwa pembentukan kalosa menyebabkan penurunan penyerapan air dan penutupan plasmodesmata.
Mekanisme ketahanan secara inklusi dilakukan dengan cara mendetoksifikasi Al yang telah masuk jaringan, kemudian diekskresikan atau ditranslokasi dan ditimbun dalam vakuola (kompartementasi). Detoksifikasi dilakukan dengan pembentukan kompleks Al dengan senyawa-senyawa pengikat (chelator). Selain untuk inaktivasi Al, pembentukan kompleks Al-chelator juga untuk meningkatkan mobilitas ion Al sehingga mudah ditranslokasikan.
Respon seluler pada tanaman sebagai respon terhadap keracunan Al berupa perubahan ekspresi gen. Beberapa protein, yang ekspresinya diinduksi oleh cekaman keracunan Al, yang berhasil diidentifikasi meliputi phenilalanine ammonialyase methallothionein like proteins, inhibitor proteinase, asparagine synthetases (Snowden et al. 1995) serta protein TaMDR1 (Sasaki et al. 2002). Milla et al. (2002) melaporkan 13 gen novel yang ekspresinya juga diregulasi oleh cekaman keracunan Al, yaitu protein yang terlibat dalam pemanjangan dan pembelahan sel (aquaporin tonoplas dan ubiquitin-like protein SMT3), stres oksidatif (glutathionin peroxidase, gukose-6-phosphate-dehidrogenase dan ascorbate peroxidase), metabolisme besi (Iron Defisiensi-Spesific proteins = IDS3a, IDS3b, dan IDS1; S-adenosyl methionine synthase dan methionine synthase dan methionine synthase) dan mekanisme seluler lainnya (phatogenesis-related proteins 1.2, heme oxygenase dan epoxide hydrolase).
Salah satu mekanisme toleransi tanaman terhadap cekaman Al adalah dengan memodifikasi rizosfer akar. Adanya Al dapat menginduksi sekresi asam
organik pada tanaman (Li et al. 2000). Pada tanaman padi, Irfan (2008) menyatakan bahwa cekaman Al yang diberikan, menimbulkan respon yang berbeda pada peningkatan kandungan asam malat antara varietas padi yang peka dan toleran terhadap cekaman keracunan Al dalam larutan hara pertumbuhannya. Hasil tersebut ditunjukkan dari percobaannya bahwa varietas Hawarabunar yang toleran terhadap cekaman keracunan Al, menunjukan peningkatan jumlah asam malat yang cukup tinggi pada konsentrasi Al 15 ppm, periode cekaman 24 jam hingga 72 jam, dimana jumlah asam malat pada varietas Hawarabunar tiga kali lebih banyak dibandingkan dengan IR64 sebagai varietas yang peka terhadap cekaman Al.
Ma et al. (2002) menyatakan bahwa cekaman Al juga menginduksi sekresi asam sitrat pada padi. Selanjutnya dikatakan bahwa respon peningkatan sekresi asam sitrat mengalami peningkatan baik pada varietas yang sensitif maupun toleran cekaman Al sehingga sekresi asam sitrat tidak membedakan secara nyata antara varietas yang sensitif dan toleran cekaman Al.
Pewarisan Sifat Toleransi Aluminium pada Tanaman
Mekanisme keracunan Al pada tanaman belum diketahui secara pasti (Vitorello et al. 2005). Keracunan akibat kandungan Al yang tinggi pada tanah masam dapat diatasi dengan memodifikasi lingkungan pertumbuhan tanaman seperti menggunakan kapur, gipsum atau menggunakan asam organik. Namun metode ini tidak efisien dan ekonomis. Metode yang dapat dilakukan adalah dengan menyeleksi dan dengan menggunakan genotipe-genotipe yang bersifat toleran terhadap cekaman Al di tanah masam.
Mekanisme toleransi cekaman Al berbeda antar tanaman dan antar varietas dalam spesies. Keanekaragaman genetika toleransi tanaman terhadap Al telah dilaporkan pada beberapa spesies tanaman pertanian terutama tanaman sereal dari famili Triticeae (Vitorello et al. 2005). Pada tanaman gandum (Triticum aestivum L.) dan rye (Secale cereale L.), sifat toleransi Al ditentukan oleh satu atau beberapa gen. Sebaliknya, pada tanaman padi atau jagung (Zea mays L.), toleransi cekaman Al bersifat multigen dan kuantitatif. Tanaman rye lebih toleran terhadap cekaman Al dibanding dengan gandum. Walaupun demikian, tanaman gandum
merupakan spesies tanaman pertanian yang diteliti secara komprehensif untuk mempelajari mekanisme toleransi tanaman terhadap Al baik secara morfologi, fisiologi, maupun secara molekuler.
Mekanisme kontrol secara genetik untuk sifat-sifat yang terpaut toleransi Al pada tanaman-tanaman pertanian telah banyak diketahui. Demikian pula pada tanaman padi, tetapi diduga dikontrol oleh beberapa gen (Wu et al. 2000; Nguyen et al. 2001). Pada barley (Hordeum vulgare L.) menurut Minella dan Sorrells (1992) dikontrol oleh gen tunggal. Pada wheat (Triticum aestivum L.) dikontrol oleh gen mayor dan gen minor serta pada rye (Secale cereale L.) yang merupakan tanaman sereal yang paling toleran Al terletak pada kromosom 3R, 4R dan 6RS (Aniol & Gustafson 1984).
Toleransi Al pada tanaman rye (Secale cereale L) dikendalikan oleh gen tunggal Alt3 yang terletak pada kromosom 4RL. Gen Alt3, AltBH pada gandum dan Alp pada barley, yang semuanya mengendalikan toleransi cekaman Al sangat terpaut dengan penanda molekuler BCD1230 (Miftahudin et al. 2002). Berdasarkan hubungan homeologous di antara anggota Triticeae, Miftahudin et al. (2002) menduga bahwa gen-gen toleran cekaman Al tersebut kemungkinan memiliki fungsi yang sama dalam mengendalikan sifat toleransi cekaman Al.
Studi pewarisan toleransi Al pada tanaman gandum pada umumnya menunjukkan bahwa sifat toleransi Al dikendalikan oleh satu atau beberapa gen utama dan kemungkinan interaksi dari beberapa faktor (Budzianowski & Wos 2004). Toleransi Al nampaknya lebih merupakan sifat yang multigenik, walaupun hingga saat ini belum ada gen toleransi Al yang berhasil diklon (Vitorello et al. 2005).
Penelitian tentang keragaman dan model aksi gen toleransi cekaman Al pada kultivar padi pada dataran tinggi dan rendah pertama kali dilakukan oleh Khatiwada et al. (1996). Dari 62 kultivar yang diuji, 3 kultivar sensitif terhadap keracunan Al dan 11 kultivar padi lainnya sangat toleran. Sepuluh dari kultivar yang sangat toleran tersebut berasal dari Kalimantan Selatan dan Sumatera Selatan, Indonesia, yang biasa tumbuh baik di tanah dengan kandungan asam sulfat tinggi dan telah dikoleksi oleh IRRI. Hasil tersebut menunjukkan bahwa kultivar tradisional yang berasal dari dataran rendah dan tumbuh baik pada tanah
asam sulfat tinggi merupakan sumber terbaik tanaman yang toleran terhadap cekaman Al.
Mao et al. (2004) menggunakan padi varietas IR1552 yang sensitif Al dan varietas Azucena (toleran Al) untuk pemetaan QTL untuk toleran Al. Tiga QTL untuk relatif panjang akar (RPA) dideteksi secara berturut-turut pada kromosom 1, 9, dan 12. Satu QTL untuk panjang akar yang dicekam Al pada kromosom 1 setelah 1 minggu dan 2 minggu cekaman. Mao et al. (2004) mengindikasikan bahwa cekaman Al dapat menginduksi biosintesis dari lignin dan komponen-komponen lain dinding sel dari akar. Dua gen yang berhasil dipetakan yaitu satu protein yang belum diketahui fungsinya dan 1 ubiquitin-like protein untuk cekaman Al pada kromosom 1.
Dengan menggunakan populasi Backcross Inbred Lines (BILs) dari persilangan Koshihikari dan Kasalath, Ma et al. (2002) mendeteksi tiga QTL yang diduga mengontrol toleransi Al ditemukan secara berturut-turut pada kromosom 1, 2 dan 6. Alel-alel QTL pada kromosom 1 dan 2 pada varietas Kasalath menurunkan kemampuan toleransi Al tetapi meningkatkan kemampuan toleransi Al pada kromosom 6.
Wu et al. (2000) melakukan penelitian pada populasi Recombinan Inbred Lines (RIL) persilangan antara padi indica varietas IR1552 dengan padi japonica varietas Azucena dengan menggunakan larutan kultur hara. Dengan pemetaan molekuler secara bersama-sama yaitu 104 Amplified Fragment Length Polymorphism (AFLP), 103 Restriction Fragment Length Polymorphism (RFLP), telah membuat peta QTL dan lokus epistasis karakter toleransi Al untuk relatif panjang akar (Relative Root Length/RRL) setelah cekaman Al 2 dan 4 minggu. Dua QTL didapatkan pada perlakuan 2 dan 4 minggu tanpa perlakuan cekaman Al pada kromosom 1 dan 12. Sementara QTL pada kromosom 1 hanya dideteksi pada perlakuan 2 minggu cekaman Al.
Nguyen et al. (2001) telah menemukan 5 QTL untuk toleransi Al pada 5 kromosom, dimana QTL mayor terletak pada kromosom 1. Nguyen et al. (2002) melakukan pemetaan pautan genetik dengan menggunakan 280 marka DNA (RFLP, AFLP, SSR) untuk menggambarkan posisi dan QTL toleransi terhadap cekaman Al. Tiga karakter yaitu kontrol panjang akar (Control Root
Length/CRL), panjang akar saat tercekam Al (Al-Stressed Root Length/SRL), dan rasio panjang akar (Root Length Ratio/RR) telah dievaluasi pada populasi Doubled Haploid (DH) dari persilangan CT9993 x IR62266 dan tetuanya pada waktu perkecambahan dengan menggunakan larutan hara. Total dari 20 QTL yang mengontrol panjang akar di bawah cekaman Al dan kondisi kontrol (tanpa cekaman Al) ditemukan menyebar pada 10 dari 12 kromosom padi, dan dikontrol oleh banyak gen (multigenik).
Dua gen mayor toleransi Al, Alm1 dan Alm2 telah ditemukan secara berturut-turut pada kromosom 6 dan 10 pada jagung (Sibov et al. 1999). Alm1 letaknya sekitar 20,1 cM dari UMC130 yang bersegregasi bersama dengan RZ141 (Wilson et al. 1999) dipetakan di padi pada kromosom 11 (Causse et al. 1994). Alm2 yang terletak pada kromosom 6 jagung, terletak disekitar 18,5 cM dari CSU70 yang sangat terpaut pada CDO580 (Wilson et al. 1999), dipetakan di padi pada kromosom 5. Pada penelitian yang dilakukan Nguyen et al. (2002), tidak ditemukan adanya QTL pada kromosom 5 dan 11 di padi.
Menurut Nguyen et al. (2003), dari 5 QTL untuk RRL, 2 QTL sangat konsisten dengan yang dilaporkan sebelumnya. Selanjutnya dikatakan bahwa QTL pada kromosom 1 lokasinya sama dengan yang dilaporkan Wu et al. (2000) dan Nguyen et al. (2001; 2002). QTL pada kromosom 9 sama dengan yang dilaporkan Wu et al. (2000) dan Nguyen et al. (2002). Menurut Nguyen et al. (2003), QTL pada kromosom 3 memiliki efek yang paling besar tapi menurut Wu et al.(2000) memiliki efek yang kecil, ortolog dengan gen utama toleransi Al di group 4 Triticeae (Tang et al. 2000).
Prasetiyono et al. (2003) melakukan identifikasi yang terpaut dengan sifat toleransi Al pada padi hasil persilangan Dupa dengan ITA131. Hasil analisis dengan menggunakan analisis marka tunggal mendapatkan 2 marka mikrosatelit pada kromosom 7 (RM248 dan RM445) yang diduga terpaut dengan sifat toleransi terhadap cekaman Al. Hasil analisis menggunakan analisis marka interval belum mendapatkan marka-marka yang secara nyata menunjukkan posisi QTL.
Meskipun keanekaragaman sifat toleransi Al telah dilaporkan pada tanaman padi (Oryza sativa) (Khatiwada et al. 1996; Jagau 2000), namun belum ada gen
yang berhasil diisolasi dan diklon baik yang berasal dari tanaman padi maupun tanaman serealia lainnya guna menunjang program pemuliaan tanaman pertanian toleran cekaman Al.
Tanaman padi yang mempunyai ukuran genom terkecil dalam anggota keluarga tanaman serealia, yaitu 430 juta nukleotida, telah disekuensing guna memetakan gen-gen padi (Shen et al. 2004). Galur padi yang digunakan adalah Nipponbare (japonica) yang biasa ditanam di Jepang dan negara yang beriklim temperate lainnya seperti di Eropa. Mengingat ukuran kromosom padi yang kecil dibandingkan dengan serealia lainnya, maka padi menjadi tumpuan untuk dapat diisolasi dan diklon gen toleran cekaman Al. Pendekatan yang diambil untuk menentukan gen toleran cekaman Al tersebut meliputi (a) studi genetika untuk untuk mengidentifikasi lokus toleran Al seperti pemetaan molekuler guna mengidentifikasi penanda DNA toleran cekaman Al; (b) isolasi dan karakterisasi gen-gen yang diinduksi selama keracunan Al; (c) produksi dan evaluasi tanaman mutan; dan (d) penggunaan berbagai tanaman transgenik dalam studi toleransi Al. Pendekatan tersebut berperan besar untuk memahami mekanisme toleransi Al pada tanaman (Samac & Tesfaye 2003).
Pemanfaatan Marka Molekuler dalam Proses Seleksi Pemuliaan Tanaman Pemanfaatan marka DNA sebagai alat bantu seleksi (Marker Assisted Selection/MAS) lebih menguntungkan dibandingkan dengan seleksi secara fenotipik (Azrai 2005). Seleksi berdasarkan karakter fenotipik tanaman di lapang memiliki beberapa kelemahan. Menurut Lamadji et al. (1999) beberapa kelemahannya diantaranya (a) memerlukan waktu yang cukup lama; (b) kesulitan memilih dengan tepat gen-gen yang menjadi target seleksi untuk diekspresikan pada sifat-sifat morfologi atau agronomi; (c) rendahnya frekuensi individu yang diinginkan yang berada dalam populasi yang besar; dan (d) fenomena pautan gen dengan sifat yang tidak diinginkan sulit dipisahkan saat melakukan persilangan.
Menurut Azrai (2005), pada saat ini telah ditemukan tiga tipe marka DNA yaitu (a) marka yang berdasarkan pada hibridisasi DNA seperti Restriction Fragment Length Polymorphism (RFLP); (b) marka yang berdasarkan pada reaksi rantai polimerase (Polymerase Chain Reaction/PCR) dengan menggunakan
sekuen-sekuen nukleotida sebagai primer, seperti Randomly Amplified Polymorphic DNA (RAPD), dan Amplified Fragment Length Polymorphism (AFLP); dan (c) marka yang berdasarkan pada PCR dengan menggunakan primer yang menggabungkan sekuen komplementer spesifik dalam DNA sasaran, seperti Sequence Tagged Sites (STS), Sequence Characterized Amplified Regions (SCARs), Simple Sequence Repeats (SSRs) atau mikrosatelit (microsatellites) dan Single Nucleotide Polymorphism (SNPs).
Marka mikrosatelit atau SSR merupakan sekuen DNA bermotif pendek dan diulang secara tandem dengan 2-5 unit nukelotida yang tersebar dan meliputi seluruh genom terutama pada organisme eukariotik (Azrai 2005). Akhir-akhir ini mikrosatelit banyak untuk karakterisasi dan pemetaan genetik tanaman termasuk padi (Powell et al. 1996). Menurut Powell et al. (1996) beberapa pertimbangan untuk penggunaan marka mikrosatelit dalam studi genetik di antaranya (a) marka terdistribusi secara melimpah dan merata dalam genom, variabilitasnya sangat tinggi (banyak alel dalam lokus), sifatnya kodominan dan lokasi genom dapat diketahui; (b) merupakan alat uji yang memiliki reproduksibilitas dan ketepatan yang sangat tinggi; (c) merupakan alat bantu yang sangat akurat untuk membedakan genotipe, evaluasi kemurnian benih, pemetaan dan seleksi genotipe untuk karakter yang diinginkan; (d) studi genetik populasi dan analisis diversitas genetik. Kelemahan teknik ini adalah marka SSR tidak tersedia pada semua spesies tanaman, sehingga untuk merancang primer baru membutuhkan waktu yang lama dan biaya yang cukup mahal.
METODOLOGI
Waktu dan Tempat
Penelitian ini dilakukan dua tahap yaitu penanaman padi dan analisis fisiologi dan marka molekuler. Penanaman padi secara gogo pada tanah masam dilakukan di rumah kaca Cikabayan Institut Pertanian Bogor untuk pengamatan parameter jumlah anakan maksimum dan umur berbunga. Analisis fisiologi yaitu RRG dan analisis marka molekuler dilaksanakan di Laboratorium Fisiologi dan Biologi Molekuler Tumbuhan, Departemen Biologi, FMIPA, IPB, Bogor dan Laboratorium Biologi Molekuler, Balai Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian Bogor. Penelitian dilakukan selama 19 bulan, dimulai dari bulan Mei 2007 sampai dengan bulan November 2008. Jadwal penelitian dan alokasi waktu dapat dilihat pada Lampiran 1.
Bahan Tanaman
Bahan tanaman yang digunakan dalam penelitian ini adalah tetua 1 (IR64) yang sensitif Al dan tetua 2 (Hawarabunar) yang toleran Al, F1 sebanyak 10
tanaman dan populasi F2 hasil persilangan tetua IR64 dan Hawarabunar sebanyak
379 tanaman (Gambar 1). Biji-biji padi kedua tetua, F1 dan F2 diperoleh dari
Laboratorium Fisiologi dan Biologi Molekuler, Departemen Biologi, FMIPA, IPB, Bogor.
Gambar 1 Bahan tanaman : (a) Tetua IR64; (b) tetua Hawarabunar, dan (c) F1
(IRxHawarabunar)
Metode Penelitian Alur Penelitian
Perlakuan Cekaman Al
Biji padi tetua 1 (IR64), tetua 2 (Hawarabunar), F1 dan F2 direndam dalam
larutan NaOCl (byclean) 0,5 %(v/v) selama 15 menit. Setelah dicuci dengan air destilata, biji direndam selama 24 jam dalam air destilata pada suhu ruang dan dalam keadaan gelap. Selanjutnya benih dikecambahkan pada kertas merang yang lembab selama 3-4 hari pada suhu ruang. Setelah berkecambah, dipilih benih dari kedua tetua, F1dan F2 untuk setiap perlakuan, lalu ditanam di net plastik yang
diapungkan di atas media kultur hara minimum tanpa Al dengan pH 4,0 (Miftahudin et al. 2002) untuk adaptasi selama 24 jam dan diberikan aerasi (Gambar 2a).
Benih padi tetua, F1
dan F2
PCR
Isolasi DNA dari daun tetua, daun populasi F1 dan F2
Populasi F2
Analisis marka molekular
Kultur Hara dan Cekaman Al
Penanaman di tanah masam dan tidak masam
Pengamatan jumlah anakan maksimum dan
umur berbunga
Analisis Root Regrowth Tanaman F1 hasil persilangan
IR64 x Hawarabunar
Interpretasi parameter fisiologi, analisis keterpautan dan marka molekuler
Perlakuan Al dilakukan dengan pemberian Al3+ dalam bentuk AlCl3.6H2O
kepada semua galur yang diuji dengan konsentrasi 15 ppm (penelitian pendahuluan) selama 72 jam (Quarrie et al. 2006) dalam larutan hara sebanyak masing-masing 10 ml pada tabung sentrifuge 15 ml (Corning Incorporated, USA) untuk setiap individu (Gambar 2b).
Setelah perlakuan cekaman Al 72 jam dilanjutkan dengan recovery pada larutan hara minimum tanpa Al selama 48 jam (Miftahudin et al. 2002) untuk analisis RRG (Gambar 2c). Tanaman dalam tabung kemudian digoyang dengan menggunakan shaker untuk aerasi dan pH larutan dipertahankan setiap hari dengan penambahan 1 N HCl atau 1 N NaOH. Media kultur hara minimum terdiri dari unsur dengan komposisi mengikuti Miftahudin et al. (2002) (Lampiran 2).
(a) (b) (c)
Gambar 2 Kultur hara dan cekaman Al 15 ppm dan pH 4,0 pada populasi F2. (a)
Adaptasi selama 24 jam; (b) perlakuan cekaman Al 15 ppm selama 72 jam; (c) kondisi kecambah setelah recovery selama 48 jam
Perlakuan adaptasi, cekaman Al dan recovery dilakukan di ruang kultur hara dengan suhu ruang dan pencahayaan 300 PPFD (photo proton fluk density) selama 12 jam setiap hari.
Analisis Parameter Fisiologi Cekaman Al
Analisis parameter fisiologi cekaman Al meliputi analisis Root Regrowth (RRG), jumlah anakan maksimum dan umur berbunga.
Analisis RRG. Pengukuran RRG dari tanaman yang telah diberi perlakuan cekaman Al dilakukan dengan mengukur panjang akar pada saat akhir perlakuan cekaman Al dan pada saat akhir recovery. Selisih antara panjang akar pada saat
akhir recovery dengan pengukuran akhir perlakuan cekaman Al adalah parameter RRG tersebut (Miftahudin et al. 2005).
Pengamatan terhadap parameter jumlah anakan maksimum dan umur berbunga dilakukan saat penanaman di rumah kaca. Populasi tetua 1 (IR64), tetua 2 (Hawarabunar), F1 dan F2 ditanam di rumah kaca secara gogo. Tanah asam
podsolik merah kuning diambil dari Jasinga Bogor. Sebelum digunakan, tanah dikeringkan dan diaduk-aduk hingga bercampur secara merata. Hasil analisis kandungan tanah dapat dilihat pada Lampiran 3.
Pemeliharaan tanaman padi dilakukan dengan menyiram tanaman padi sesuai dengan kebutuhan. Pemupukan setiap bulan dengan menambahkan pupuk NPK secara berimbang pada setiap tanaman pada semua populasi dan penyemprotan dengan menggunakan insektisida dilakukan untuk mencegah serangan hama dan penyakit.
Pengamatan jumlah anakan maksimum. Perhitungan terhadap jumlah anakan maksimum per rumpun dihitung pada saat usia tanaman berkisar 2,5 bulan atau sekitar 50% populasi berbunga. Perhitungan dilakukan baik pada tetua 1 (IR64) dan tetua 2 (Hawarabunar) yang ditanam pada tanah masam (perlakuan) dan tidak masam (kontrol), pada F1 serta F2 yang ditanam pada tanah masam.
Analisis umur berbunga. Perhitungan terhadap umur berbunga dihitung semenjak tanaman dipindahkan dari persemaian ke ember. Perhitungan dilakukan pada saat masing-masing individu membentuk malai pertama secara sempurna. Perhitungan dilakukan baik pada tetua 1 (IR64) dan tetua 2 (Hawarabunar) yang ditanam pada tanah masam (perlakuan) dan tidak masam (kontrol), pada F1 serta
F2 yang ditanam pada tanah masam.
Analisis data fenotipe. Analisis pola pewarisan dilakukan dengan menggunakan Uji Khi-Kuadrat pada taraf = 5% terhadap data parameter fisiologi cekaman Al (Miftahudin et al. 2005).
Analisis Marka Molekuler
Isolasi DNA tanaman padi. DNA diisolasi dari daun muda tanaman padi kedua tetua, F1 dan F2 yang berumur 3-4 minggu. Isolasi DNA dilakukan dengan
segar digerus dengan menambahkan nitrogen cair dan dimasukkan dalam tabung 15 ml ditambahkan buffer yang terdiri dari 2% (w/v) CTAB, 100 mM Tris HCl pH 7,5, 0,2% 10 mM -mercaptoethanol, 20 mM EDTA pH 8,0 dan 1,4M NaCl sampai volume 9 ml dan dipanaskan pada suhu 65o C. Larutan tersebut dibolak balik dan dimasukkan dalam waterbath pada suhu 65o C selama 60-90 menit, digoyang perlahan-lahan setiap 10 menit. Larutan didinginkan selama 4-5 menit, ditambahkan 4,5 ml kloroform / isoamil alkohol (CIAA) dengan perbandingan 24:1, digoyang dengan perlahan selama 10 menit dan disentrifugasi selama 30 menit dengan kecepatan 4000 rpm pada suhu ruang (28oC). Fase cair diambil dan dimasukkan dalam tabung baru 15 ml. Fase cair tersebut kemudian ditambahkan lagi 4,5 ml CIAA (24:1), kemudian di goyang perlahan-lahan selama 10 menit dan disentrifugasi 4000 rpm selama 30 menit suhu ruang. Fase atas diambil dan dimasukkan dalam tabung baru 15 ml dan larutan ditambahkan 1 volume isopropanol dingin dan digoyang secara perlahan sampai muncul benang-benang DNA. Benang-benang DNA diambil dengan glass-hook steril dan dikeringkan selama 45 menit pada suhu ruang. Glass-hook yang mengandung DNA tersebut ditempatkan di tabung 2 ml yang sudah berisi 1 ml TE pH 8 (10 mM Tris HCl pH 8,0, dan 1 mM EDTA pH 8,0) dan dibiarkan selama 5 menit dan goyang-goyang glass-hook hingga DNA lepas. Selanjutnya ke dalam tabung, ditambahkan 50 µl RNAse 10 mg/mldan diinkubasi pada suhu 37o C selama minimal 18 jam. Bolak-balik tabung selama 10 menit hingga DNA benar-benar larut. Satu mililiter fenol ditambahkan dalam tabung dan disentrifugasi 14000 rpm selama 10 menit suhu ruang. Setelah selesai sentrifugasi, fase cair diambil dan dimasukkan ke dalam tabung ependorf 2 ml yang baru. CIAA 1 ml ditambahkan dalam tabung dan disentrifugasi selama 10 menit 12000 rpm suhu ruang. Dengan menggunakan pipet, fase cair diambil dan dimasukkan dalam tabung baru 15 ml ditambahkan 50
µl NaCl 5 M dan 2,5 ml EtOH absolut dan dibolak balik. Mengambil benang-benang DNA dengan glass-hook steril dimasukkan ke dalam tabung yang berisi 3-4 ml WASH 1 (76% (v/v) EtOH, 0,2 M NaOAc) dibiarkan selama 20 menit agar DNA bersih. Ditambahkan lagi 1-2 ml WASH 2 (76%(v/v) EtOH, 10 mM NH4Oac) untuk membilas glass-hook. DNA yang ada di glass-hook dikeringkan
selama 5 menit. DNA yang ada di glass-hook dipindahkan ke dalam tabung efendorf dan ditambahkan 300 ml TE pH 8 dan dapat disimpan suhu 40C.
Marka molekuler. Marka molekuler yang digunakan diambil dari marka molekuler untuk tanaman padi yang dapat diperoleh dari situs
http://www.gramene.org. Marka molekuler tersebut merupakan marka SSR (Simple Sequence Repeats) atau mikrosatelit. Primer-primer yang digunakan dalam penelitian ini sebanyak 17 pasang primer (F/R) yang terdiri atas 10 pasang primer pada kromosom 1 dan 7 pasang primer pada kromosom 3 (Lampiran 4). PCR (Polymerase Chain Reaction). Komposisi reaksi PCR yang digunakan terdiri dari 2,5 mM 10x buffer(+Mg), 2,0 mM dNTP, 3 µmol primer SSR (F dan R) serta 100 ng DNA dari tanaman populasi F2. Reaksi PCR dilakukan pada
Thermocycle ESCO Swift Maxi (Gambar 3).
Gambar 3 Thermocycle ESCO Swift Maxi
Kondisi PCR yang digunakan adalah 5 menit pada suhu 94oC untuk denaturasi permulaan (pra-PCR), pada suhu 94oC selama 45 detik untuk denaturasi, pada suhu 55oC selama 45 detik untuk penempelan primer (annealing), pada suhu 72oC selama 1.5 menit untuk proses pemanjangan (extension) dan dilakukan sebanyak 35 siklus. Pasca PCR pada suhu 72oC selama 10 menit serta 4o C inkubasi selama 59 menit.
Produk amplifikasi dipisahkan dengan elektroforesis pada 3 % (w/v) gel Super Fine Resolution (SFR) menggunakan buffer TBE 1X (0,89M Tris, 0,89M Boric Acid, dan 20 mM EDTA). Visualisasi pita DNA dilakukan pada gel pada larutan etidium bromida 0,5 µg/ml dan diamati di atas UV transiluminator dan
kemudian difoto dengan menggunakan foto gel WiseDoc©Gel Documentation System.
Analisis Polimorfisme
Produk PCR dari kedua tetua dan F1 dianalisis dan dibandingkan untuk
mengidentifikasi keberadaan polimorfisme di antara kedua tetua dengan menggunakan marka SSR. Marka-marka yang menunjukkan polimorfisme selanjutnya digunakan dalam analisis segregasi dan keterpautan.
Untuk analisis segregasi, pola pita pada tetua, F1 dan populasi F2 yang
diberi skor dengan ketentuan sebagai berikut:
1 = pola pita sama dengan pita dari tetua sensitif (homozygous sensitive). 2 = pola pita sama dengan pita dari tetua toleran (homozygous tolerant). 3 = pola pita mengandung pita kedua tetua (heterozygous).
Analisis Segregasi
Untuk mengetahui apakah pola segregasi marka molekuler pada populasi F2
mengikuti pola segregasi gen tunggal (1:2:1) untuk rasio genotipe IR64:Heterozigot:Hawarabunar, pola-pola pita pada populasi F2 dianalisis dengan
menggunakan Uji Khi-Kuadrat pada taraf = 5% (Miftahudin et al. 2005).
Analisis Keterpautan
Hasil skoring pada semua marka yang polimorfis untuk seluruh individu F2,
digunakan untuk menganalisis keterpautan antara data genotipe dengan data parameter fisiologi. Analisis keterpautan dilakukan dengan menggunakan 38 marka SSR yaitu 17 marka yang berasal dari penelitian ini dan 21 marka dari Hariyanto (2009) yang polimorfis pada kromosom 1, 2, dan 3 padi dengan metode Marka Tunggal menggunakan software QTL Cartografer Ver.2,0 (Wang 2003).
HASIL DAN PEMBAHASAN
Analisis Parameter Fisiologi
Berdasarkan hasil pengamatan yang telah dilakukan terhadap parameter fisiologi dari respon tanaman padi terhadap cekaman Al pada kedua tetua, F1 dan
populasi F2 diperoleh nilai rata-rata seperti pada Tabel 1.
Tabel 1 Nilai rata-rata parameter fisiologi dari respon tanaman padi terhadap cekaman Al
Kontrol Perlakuan cekaman Al Parameter fisiologi
IR64 HB IR64 HB F1 F2
RRG (mm) - - 13,21 28,22 8,06 14,60
Jumlah anakan maksimum
(batang) 12,75 4,00 9,25 4,75 11,33 7,97
Umur berbunga (HST) 52,00 59,00 51,00 62,00 59,00 51,88
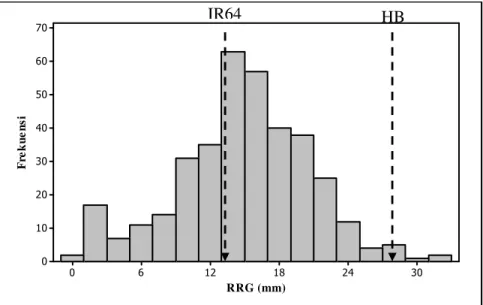
RRG. RRG adalah kemampuan akar untuk tumbuh kembali setelah diberi cekaman Al (Miftahudin et al. 2005). Sebaran data RRG dari 364 benih padi pada populasi F2 yang diamati menyebar secara normal (Gambar 4), dengan nilai
rata-rata sebesar 14,60 dan stándar deviasi 5,88.
.
Gambar 4 Distribusi nilai RRG pada populasi F2 hasil persilangan padi varietas
IR64 dan Hawarabunar.
IR64 HB RRG (mm) F re k u e n s i IR64 HB
Berdasarkan percobaan menggunakan kultur hara didapatkan rata-rata RRG pada tetua 1 (IR64) dan tetua 2 (Hawarabunar) berturut-turut sebesar 13,21 dan 28,22 mm (Tabel 1). Hasil ini menunjukkan bahwa IR64 yang bersifat sensitif terhadap cekaman Al memiliki kemampuan yang rendah untuk memulihkan kembali (recovery) pertumbuhan akarnya setelah mengalami cekaman Al selama 72 jam. Sebaliknya pada Hawarabunar yang bersifat toleran Al memiliki kemampuan yang tetap tinggi dalam pertumbuhan akarnya setelah mengalami cekaman Al selama 72 jam.
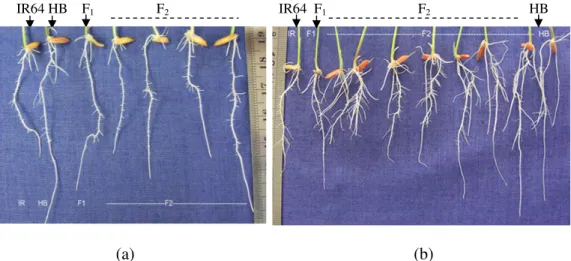
Secara visual, pengaruh perlakuan cekaman Al selama 72 jam dan recovery selama 48 jam terhadap pertambahan panjang akar dapat dilihat pada Gambar 5. Pada Gambar 5(a) terlihat bahwa akar tetua 1 (IR64) tampak pendek, kaku dan tebal dibandingkan dengan akar tetua 2 (Hawarabunar) yang tampak lurus dan panjang. Hasil tersebut sesuai dengan pendapat Marschner (1995) yang menyatakan bahwa akumulasi Al yang tinggi pada inti sel tudung akar yang menghambat pertumbuhan akar (pendek dan tebal) merupakan akibat dari kerusakan sel tudung akar yang berfungsi sebagai sensor terhadap cekaman
IR64 HB F1 F2 IR64 F1 F2 HB
(a) (b)
Gambar 5 (a) Panjang akar setelah perlakuan cekaman Al selama 72 jam; (b) panjang akar setelah recovery selama 48 jam.
lingkungan. Hal ini menyebabkan permukaan akar berwarna cokelat kekuningan, berbintik dan mudah patah. Sementara menurut Ryan et al. (1995a) bahwa pada tanaman yang peka, pertumbuhan akar dihambat oleh Al dalam waktu 24 jam walaupun Al hanya terdeteksi pada lapisan rizodermis dari korteks. Jones dan
Kochian (1995) menyatakan bahwa akar yang diperlakukan secara cepat dengan Al menghambat pemanjangan sel-sel akar dan mengakibatkan ujung-ujung akar membengkak, namun ketika tanaman diperlakukan dengan Al lebih lama (lebih dari 24 jam) terjadi penghambatan pemanjangan dan pembelahan sel-sel akar.
Tanaman yang toleran terhadap keracunan Al memiliki kemampuan untuk menekan pengaruh buruk keracunan Al sehingga akar dapat tumbuh terus dan ujung akar tidak rusak. Hal tersebut dapat dilihat pada akar tetua 2 (Hawarabunar) pada Gambar 5(a) dan 5(b) yang memiliki pertumbuhan akar yang normal pada cekaman Al selama 72 jam dan recovery selama 48 jam.
Kisaran nilai RRG tertinggi pada tetua 1 (IR64) dan RRG terendah pada tetua 2 (Hawarabunar) yang mengalami cekaman Al dijadikan batas pembeda antara padi sensitif dan toleran Al. Dari data hasil pengamatan terhadap RRG (Lampiran 4) nilai RRG tertinggi pada tetua 1 adalah 21,5 mm dan nilai RRG terendah pada tetua 2 adalah 22 mm dengan nilai tengah 21,75 mm sehingga diperoleh nilai 22 mm sebagai pembatas tanaman padi digolongkan sensitif atau toleran terhadap cekaman Al. Jika nilai RRG di bawah 22 mm maka digolongkan dalam kelompok tanaman padi yang sensitif terhadap cekaman Al, tetapi jika nilai RRG sama atau di atas 22 mm maka digolongkan dalam kelompok tanaman padi yang toleran terhadap cekaman Al. Untuk tanaman rye, nilai RRG untuk tanaman yang sensitif terhadap cekaman Al adalah kurang dari 25 mm sedangkan di atas atau sama dengan 25 mm adalah termasuk tanaman toleran Al (Miftahudin et al. 2005). Hal itu menunjukkan bahwa RRG dapat digunakan sebagai parameter fisiologis untuk sifat toleransi cekaman Al.
Pola segregasi RRG pada populasi F2 menunjukkan bahwa 137 tanaman
memiliki nilai RRG mengikuti nilai RRG tetua 1 (IR64), sedangkan 228 tanaman mengikuti nilai RRG tetua 2 (Hawarbunar) (Tabel 2). Untuk mengetahui apakah rasio fenotipe mengikuti pola pewarisan gen tunggal (3:1) maka dilakukan Uji Khi-Kuadrat. Berdasarkan uji tersebut didapatkan bahwa nilai χ23:1hitung (29,97)
lebih dari χ23:1tabel (3,811) pada df=1 dan =5%. Hal ini menunjukkan bahwa
segregasi RRG pada populasi F2 tidak mengikuti pola pewarisan gen tunggal.
Dengan demikian karakter RRG dikendalikan oleh lebih dari satu gen atau bersifat poligen. Hal ini sesuai dengan pendapat Jusuf (2001) bahwa suatu sifat yang
Tabel 2 Uji Khi-Kuadrat dari pola segregasi parameter fisiologi pada populasi F2. Jumlah tanaman dengan fenotipe Jumlah total Parameter fisiologi IR64 HB tanaman χ23:1 hitung χ 2 3:1 tabel RRG 137 228 365 29.,7 3,811 Jumlah anakan maksimum 301 78 379 3,95 3,811 Umur berbunga 192 187 379 126,6 3,811
dalam segregasi F2 menunjukkan penyebaran fenotipe yang sesuai dengan model
monohibrid, maka disimpulkan bahwa karakter tersebut dikendalikan oleh satu gen. Sebaliknya jika dalam segregasi F2 tidak menunjukkan penyebaran fenotipe
yang sesuai dengan model monohibrid maka disimpulkan bahwa karakter tersebut dikendalikan oleh lebih dari satu gen.
Jumlah anakan maksimum. Pengamatan terhadap parameter jumlah anakan maksimum dilakukan pada saat penanaman dilakukan di rumah kaca. Populasi padi tetua 1, tetua 2, F1 dan F2 ditanam secara gogo dalam ember dan
masing-masing ember ditanami satu individu dengan menggunakan tanah masam Podsolik Merah Kuning yang diambil dari Jasinga Bogor. Hasil analisis kandungan tanah yang dilakukan di Balai Penelitian Tanah, Jl. Ir. H. Juanda No. 98 Bogor ditunjukkan pada Lampiran 3.
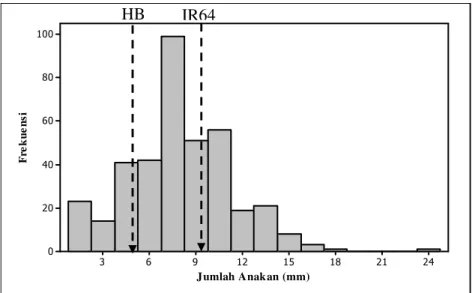
Sebaran data jumlah anakan maksimum dari 379 tanaman padi pada populasi F2 yang diamati menunjukkan sebaran normal dengan nilai rata-rata 7,97
dan stándar deviasi 3,37 (Gambar 6).
Hasil pengamatan pada Tabel 1 menunjukkan bahwa rata-rata jumlah anakan maksimum pada tetua 1 dan tetua 2 berturut-turut adalah 9,25 dan 4,75 batang. Jika dibandingkan dengan kontrol, jumlah anakan maksimum tetua 1 (12,75) turun sebesar 27, 45% dan tetua 2 (4,0) naik sebesar 17,5% menunjukkan bahwa tetua 1 (sensitif Al) tetap memiliki jumlah anakan yang lebih banyak dibanding tetua 2 (toleran Al) yang ditanam di tanah masam. Hal ini dibuktikan juga oleh Rubiyo et al. (2005), dari 14 galur yang diuji dan 2 varietas sebagai pembanding pada tanah tidak masam, menunjukkan bahwa IR64 memiliki jumlah anakan maksimum terbanyak yaitu 25 batang per rumpun, berbeda nyata