PENGENDALIAN PENYAKIT BUSUK PANGKAL BATANG
(Phytophthora capsici LEONIAN) PADA LADA (Piper nigrum L.)
DENGAN EKSTRAK PINANG, GAMBIR, SIRIH, DAN
KAPUR SIRIH
DEDEK KUSVIANTI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2011
ABSTRAK
DEDEK KUSVIANTI. Pengendalian Penyakit Busuk Pangkal Batang (Phytophthora capsici Leonian) pada Lada (Piper Nigrum L.) dengan Ekstrak Pinang, Gambir, Sirih, dan Kapur Sirih. Dibimbing oleh WIDODO dan DJOKO PRIJONO.
Lada merupakan komoditas ekspor penting penghasil devisa Indonesia. Faktor pembatas produksi di antaranya patogen Phytophthora capsici penyebab penyakit busuk pangkal batang (BPB). Penelitian ini bertujuan mengetahui keefektifan ekstrak pinang, gambir, sirih, dan kapur sirih sebagai bahan pengendali penyakit BPB. Penelitian secara in vitro disusun dalam rancangan acak lengkap dua faktor dengan faktor pertama jenis ekstrak dan faktor kedua konsentrasi ekstrak. Isolat P. capsici berumur 4 hari dan berdiameter 5 mm ditumbuhkan pada media V8 yang sebelumnya telah dicampur dengan ekstrak uji. Perlakuan yang diuji yaitu ekstrak pinang 0,01%; 0,02%; dan 0,04%, gambir 0,01%; 0,02%; dan 0,04%, pinang + gambir 0,005%; 0,01%; dan 0,02%, campuran pinang + gambir + sirih + kapur sirih 0,0025%; 0,005%; dan 0,01%, ditambah kontrol (tanpa perlakuan ekstrak). Setiap perlakuan diulang 3 kali. Pengamatan dilakukan selama 6 hari dengan peubah yang diamati yaitu perkembangan diameter miselium terhadap waktu inkubasi. Pengujian secara in vivo disusun dalam rancangan acak lengkap dengan 5 ulangan dan 4 unit perlakuan. Pengujian dilakukan dengan mencelupkan daun lada pada ekstrak uji, kemudian diteteskan sebanyak 0,1 ml zoospora P. capsici 9 x 104 sel/ml pada 4 titik di bawah permukaan daun. Perlakuan yang diuji yaitu ekstrak campuran pinang + gambir + sirih + kapur sirih 0,005%; ekstrak campuran pinang + gambir + sirih + kapur sirih 0,01%; ekstrak pinang 0,04%; fungisida berbahan aktif propineb 70% konsentrasi 0,2%; dan kontrol. Pengamatan dilakukan selama 11 hari dengan peubah yang diamati yaitu kemunculan dan perkembangan diameter gejala terhadap waktu inkubasi. Ekstrak campuran pinang + gambir + sirih + kapur sirih 0,005%; campuran ekstrak pinang + gambir + sirih + kapur sirih 0,01%; dan pinang 0,04% secara in vitro cukup efektif menghambat perkembangan diameter koloni P. capsici. Selain itu, ekstrak campuran pinang + gambir + sirih + kapur sirih 0,01% secara in vivo efektif dalam menghambat keparahan penyakit dan memiliki daya efikasi yang menyamai daya efikasi fungisida propineb 0,2%.
PENGENDALIAN PENYAKIT BUSUK PANGKAL BATANG
(Phytophthora capsici LEONIAN) PADA LADA (Piper nigrum L.)
DENGAN EKSTRAK PINANG, GAMBIR, SIRIH, DAN
KAPUR SIRIH
DEDEK KUSVIANTI
Skripsi
Sebagai salah satu syarat untuk memperoleh
gelar Sarjana Pertanian
di Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2011
Judul : Pengendalian Penyakit Busuk Pangkal batang (Phytophthora capsici Leonian) pada Lada (Piper nigrum L.) dengan
Ekstrak Pinang, Gambir, Sirih, dan Kapur Sirih
Nama Mahasiswa : Dedek Kusvianti
NRP : A34063036 Menyetujui, Mengetahui, Tanggal lulus: Dosen Pembimbing I Dr. Ir. Widodo, MS. NIP 19591115 198503 1 003 Dosen Pembimbing II
Ir. Djoko Prijono, MAgrSc. NIP 19590827 198303 1 005
Ketua Departemen Proteksi Tanaman Dr. Ir. Dadang, MSc. NIP 19640204 19902 1 002
RIWAYAT HIDUP
Penulis dilahirkan di Tanjungpandan, Provinsi Bangka Belitung pada tanggal 22 Agustus 1989. Penulis merupakan anak kedua dari dua bersaudara keluarga Bapak Sahani Saleh dan Ibu Asmara.
Penulis menyelesaikan pendidikan menengah atas di SMA Negeri I Tanjungpandan pada tahun 2006. Pada tahun yang sama penulis melanjutkan pendidikan di Institut Pertanian Bogor melalui jalur Seleksi Penerimaan Mahasiswa Baru dan diterima di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB).
Selama di IPB penulis aktif sebagai pengurus di UKM (Unit Kegiatan Mahasiswa) Kepecintaalaman Lawalata-IPB periode 2006-2007 hingga 2009-2010. Selain itu, penulis juga aktif sebagai pengurus Ikatan Keluarga Pelajar Belitung periode 2007-2008. Pada tahun 2010 penulis mengikuti kegiatan training tropical ecology dan pendugaan keragaman hayati secara cepat bersama mahasiswa Austria di Kepulauan Krakatau dan Taman Nasional Ujung Kulon.
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT, yang atas limpahan Rahmat dan Karunia-Nya penulis dapat menyelesaikan penyusunan skripsi ini. Skripsi dengan judul “Pengendalian Penyakit Busuk Pangkal Batang (Phytophthora capsici Leonian) pada Lada (Piper Nigrum L.) dengan Ekstrak Pinang, Gambir, Sirih, dan Kapur Sirih” merupakan salah satu syarat untuk memperoleh gelar Sarjana di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Dr. Ir. Widodo, MS. dan Ir. Djoko Prijono, MAgrSc. yang telah banyak memberikan bimbingan dan pengarahan selama penelitian dan penulisan skripsi.
2. Dr. Ir. Purnama Hidayat, MSc. yang telah bersedia menjadi dosen penguji tamu dalam seminar tugas akhir dan ujian sarjana.
3. Dr. Ir. Kikin H. Mutaqin, MSi. sebagai dosen pembimbing akademik yang telah membimbing dan memotivasi penulis selama ini.
4. Bapak, Umak, dan Abang tercinta yang tanpa lelah menyemangati penulis dalam menyelesaikan skripsi ini.
5. Saudara-saudara di Lawalata-IPB yang selalu mendukung penulis baik suka maupun duka.
6. Teman-teman seangkatan penulis di Departemen Proteksi Tanaman, khususnya teman-teman seperjuangan di Laboratorium Mikologi Tumbuhan, Bapak Dadang Surachman, Sdri Ita Novrita, dan semua pihak yang tidak dapat penulis sebutkan satu per satu.
Semoga hasil penelitian ini bermanfaat bagi masyarakat secara umum maupun perkembangan iptek khususnya dalam bidang proteksi tanaman.
Bogor, Maret 2011
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix DAFTAR LAMPIRAN ... x PENDAHULUAN ... 1 Latar Belakang ... 1 Tujuan Penelitian ... 2 Manfaat Penelitian ... 2 TINJAUAN PUSTAKA ... 3 Tanaman Lada ... 3
Daerah Asal dan Persebaran di Indonesia ... 3
Ciri Botani ... 3
Lingkungan Tumbuh ... 4
Penyakit Busuk Pangkal Batang (Phytophthora capsici L.) ... 4
Bahan Uji ... 6
Gambir ... 6
Pinang ... 7
Sirih ... 7
Kapur Sirih ... 8
BAHAN DAN METODE ... 9
Tempat dan Waktu ... 9
Bahan Tanaman Uji ... 9
Bahan Sumber Ekstrak ... 9
Ekstraksi ... 9
Perbanyakan Isolat P. capsici ... 10
Perbanyakan Zoospora P. capsici ... 10
Metode Pengujian ... 11
Uji Penghambatan Pertumbuhan Koloni secara In Vitro ... 11
Uji Penghambatan Kemunculan dan Diameter Gejala BPB secara In Vivo ... 11
Rancangan Percobaan ... 13
Analisis Data ... 13
HASIL DAN PEMBAHASAN ... 14
Pengaruh Perlakuan terhadap Pertumbuhan Diameter Koloni Phytophthora capsici secara In Vitro ... 14
Pengaruh Perlakuan terhadap Perkembangan Gejala BPB oleh Phytophthora capsici secara In Vivo ... 18
SIMPULAN DAN SARAN ... 22
Simpulan ... 22
vii
Halaman DAFTAR PUSTAKA ... 23 LAMPIRAN ... 27
DAFTAR TABEL
Halaman 1 Nilai skala dan kategori serangan yang digunakan untuk menghitung
keparahan penyakit (KP) penyakit pada tanaman lada ... 13 2 Pengaruh perlakuan empat jenis ekstrak (0,01%) terhadap
pertumbuhan koloni P. capsici pada 6 hari setelah inokulasi ... 14 3 Pengaruh perlakuan jenis ekstrak terhadap pertumbuhan diameter
koloni P. capsici pada 6 hari setelah inokulasi ... 17 4 Pengaruh perlakuan ekstrak uji terhadap persentase keparahan
DAFTAR GAMBAR
Halaman 1 Perkembangan koloni P. capsici akibat perlakuan dengan (a) ekstrak
pinang, (b) ekstrak gambir, (c) ekstrak pinang+gambir, dan (d) ekstrak campuran pinang + gambir + sirih + kapur sirih.
HSI: hari setelah inokulasi ... 16
2 Pengaruh perlakuan terhadap kemunculan gejala (a) dan keparahan penyakit (b) BPB oleh P. capsici secara in vivo. K: tanpa perlakuan (kontrol), F: fungisida berbahan aktif propineb 0,2%, C2: ekstrak campuran pinang + gambir + sirih + kapur sirih 0,005%, C4: ekstrak campuran pinang + gambir + sirih + kapur sirih 0,01%, dan
P4: ekstrak pinang 0,04% ... 20 3 Gejala serangan P. capsici pada 7 HSI. (a) ekstrak pinang 0,04%,
(b) ekstrak campuran pinang + gambir + sirih + kapur sirih
0,005%, (c) ekstrak campuran pinang + gambir + sirih + kapur sirih 0,01%, (d) perlakuan fungisida propineb 0,2%, dan (e) perlakuan
DAFTAR LAMPIRAN
Halaman 1 Diameter koloni Phytophthora capsici pada perlakuan ekstrak sirih
dan kapur sirih (0,01%) pada 6 hari setelah inokulasi ... 28 2 Diameter koloni Phytophthora capsici pada perlakuan ekstrak uji
pada 6 hari setelah inokulasi ... 28 3 Persentase keparahan penyakit BPB akibat perlakuan pada 11 hari
setelah inokulasi ... 29 4 Analisis ragam pengaruh perlakuan terhadap pertumbuhan koloni
P. capsici pada 6 hari setelah inokulasi ... 30 5 Analisis ragam pengaruh perlakuan ekstrak uji terhadap persentase
1
PENDAHULUAN
Latar Belakang
Lada (Piper nigrum L.) merupakan produk tertua dan terpenting di antara rempah-rempah yang diperdagangkan di dunia (Wahid 1996a). Lada diproduksi oleh 11 negara yang terbagi dalam dua kelompok, yaitu anggota International Pepper Community (IPC) yang terdiri atas Brasil, India, Indonesia, Malaysia, Srilanka, Vietnam dan bukan anggota IPC seperti China, Thailand, Madagaskar, Kambodia, dan Ekuador. Volume ekspor lada Indonesia pada tahun 2009 mencapai 50,642 ton, dengan nilai 140,3 juta dollar AS (Ditjenbun 2010). Di pasar internasional, lada Indonesia mempunyai kekuatan dan daya jual tersendiri karena cita rasanya yang khas. Lada Indonesia dikenal dengan nama Muntok white
pepper untuk lada putih dan Lampong black pepper untuk lada hitam (Yuhono
2007).
Faktor pembatas produksi lada Indonesia di antaranya serangan
Phytophthora capsici, penyebab penyakit busuk pangkal batang (BPB). Kasim (1990) memperkirakan kerusakan tanaman lada akibat penyakit BPB di Indonesia setiap tahunnya berkisar dari 10% sampai 15%. Gejala khas penyakit BPB ialah kelayuan tanaman apabila patogen tersebut menyerang pangkal batang atau akar. Infeksi pada pangkal batang menyebabkan terjadinya perubahan warna kulit
menjadi hitam. Pada keadaan lembap, gejala hitam tersebut tampak seperti
berlendir berwarna agak biru. Serangan pada akar menyebabkan tanaman layu dan daun-daun menjadi berwarna kuning. Daun-daun yang layu sering tetap tergantung dan berubah warna menjadi cokelat sampai hitam. Serangan patogen pada daun menyebabkan terjadinya bercak daun. Sepanjang tepi bercak terdapat bagian gejala hitam bergerigi seperti renda yang akan tampak jelas bila daun diarahkan ke cahaya, sedangkan serangan pada buah menyebabkan buah berwarna hitam dan menjadi busuk. Umumnya serangan terjadi pada buah yang letaknya dekat permukaan tanah (Manohara & Kasim 1996).
Pengendalian BPB secara kimia merupakan usaha pengendalian yang sudah dilakukan sejak lama di era usaha perbaikan budi daya lada dibandingkan dengan upaya pengendalian lainnya. Beberapa senyawa kimia sintetik telah dicoba dan
2
diketahui efektif untuk menekan BPB baik in vitro maupun di lapangan. Fungisida dengan bahan aktif bersifat sistemik cenderung lebih efektif dan banyak digunakan oleh petani, khususnya saat harga lada tinggi (Manohara et al. 2005). Namun demikian, penggunaan fungisida sintetik yang berlebihan dapat berdampak buruk bagi lingkungan, terjadinya resistensi dan terbentuknya strain baru patogen tanaman (Agrios 2005). Selain itu, kecenderungan permintaan produk yang bebas residu membuat pengendalian yang ramah lingkungan sangat dibutuhkan untuk mendukung sistem pertanian yang berkelanjutan dan menekan penggunaan pestisida.
Penelitian yang pernah dilakukan menunjukkan bahwa sediaan gambir (Uncaria gambir Roxb.) dengan formulasi 30% cukup efektif mengendalikan penyakit bercak daun (Fusarium sp.) pada serai wangi (Andropogon nardus L.)
(Idris 2007). Ekstrak etanol daun sirih (Piper betle L.) pada konsentrasi 2,25% dan 1,5% dilaporkan dapat menghambat pertumbuhan cendawan Aspergillus
niger, Aspergillus oryzae, dan Penicillium sp. hingga 100% (Wanchaitanawong et al. 2005). Biji pinang (Areca cathecu L.) dilaporkan memiliki aktivitas anticacing,
antifungi, antibakteri, antiinflamasi, antioksidan, insektisida, dan larvasida (Wetwitayakyung et al. 2006). Ravinshanker & Subba (2009) melaporkan bahwa pasta Vitapex yang mengandung 30% kapur sirih Ca(OH)2 cukup efektif menghambat pertumbuhan koloni bakteri Enterococcus faecalis secara in vitro. Oleh karena itu, penggunaan gambir, pinang, sirih, dan kapur sirih perlu dilakukan untuk mengetahui potensinya dalam mengendalian penyakit BPB pada lada.
Tujuan Penelitian
Penelitian ini bertujuan mengetahui keefektifan ekstrak pinang, gambir, sirih, dan kapur sirih sebagai bahan pengendali penyakit busuk pangkal batang pada lada yang disebabkan oleh P. capsici.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi tentang potensi ekstrak pinang, gambir, sirih, dan kapur sirih sebagai alternatif pengendalian penyakit busuk pangkal batang pada lada yang disebabkan oleh P. capsici.
3
TINJAUAN PUSTAKA
Tanaman Lada Daerah Asal dan Persebaran di Indonesia
Tanaman lada (Piper nigrum) berasal dari pantai barat Ghats, Malabar, India. Lada dibawa oleh para pendatang Hindu ke Pulau Jawa antara tahun 100 SM dan 600 M. Daerah awal pemasukan tanaman lada di Indonesia tidak diketahui dengan jelas, namun diperkirakan bahwa tanaman lada pertama kali ditanam di daerah Karesidenan Banten (Wahid 1996a).
Penyebaran tanaman lada dari daerah Banten mula-mula mengarah ke timur Pulau Jawa. Di daerah Banten, Jakarta, Cirebon, Jepara, Surakarta dan Yogyakarta, lada pada mulanya diusahakan dalam bentuk perkebunan sampai dengan abad ke-18. Bersamaan dengan itu pengusahaannya dalam bentuk perkebunan rakyat dimulai di Sumatera (Aceh, Bengkulu, Bangka, Lampung, Sumatera Barat, Sumatera Timur, dan Jambi) serta ke Kalimantan (Pontianak, Banjarmasin, dan Pangkalan Bun di Kalimantan Tengah) (Wahid 1996a).
Daerah pengembangan lada saat ini adalah Lampung yang terkenal dengan lada hitamnya (Lampong black pepper), dan Bangka yang lebih dikenal dengan lada putihnya (Muntok white pepper). Selain itu, banyak pengembangan pertanaman lada baru di Kalimantan Barat, Kalimantan Tengah dan Kalimantan Timur, serta Sulawesi Selatan dan Sulawesi Tenggara (Manohara et al. 2005).
Ciri Botani
Tanaman lada merupakan tanaman tahunan yang memanjat dan memiliki batang yang berbuku-buku dan silindris. tinggi tanaman dapat mencapai 10 m dan tajuk dapat mencapai diameter 1,5 m bila dibudidayakan dengan baik. Tanaman lada berakar tunggang dengan akar utama dapat melakukan penetrasi pada tanah sampai kedalaman 1-2 m. Akar yang tumbuh dari buku di atas tanah tidak memanjang dan hanya digunakan untuk menempel pada tiang pemanjat. Batang lada berbentuk sulur dan dikelompokkan menjadi empat macam, yaitu sulur gantung, sulur panjat, sulur buah, dan sulur tanah. Daun lada duduk tunggal berseling dan tumbuh pada setiap buku. Daun tua berwarna hijau mengkilat pada
4
permukaan atas, sedangkan daun muda bervariasi (hijau muda, ungu, cokelat muda), bergelombang atau rata. Bunga-bunga terdapat pada cabang plagiotrophic yang tersusun dalam bulir (spica) atau untai (amentum). Buah lada temasuk buah buni atau buah batu. Buah berbentuk bulat dan pada waktu masak berwarna merah. Biji lada memiliki permukaan yang licin dan berwarna putih cokelat (Wahid 1996b).
Lingkungan Tumbuh
Lada merupakan tanaman memanjat dari keluarga Piperaceae yang dalam pertumbuhannya dipengaruhi oleh faktor lingkungan. Batang tanaman lada berbuku-buku dan berbentuk sulur. Sulur panjat tumbuh lebih baik dalam keadaan nisbi udara kurang cahaya (fototrof negatif) sedangkan sulur buah dalam keadaan cukup cahaya (fototrof positif). Intensitas cahaya yang dibutuhkan berkisar dari 50% sampai 75%. Lada dapat tumbuh dengan baik di daerah dengan ketinggian 0-500 m dpl. Curah hujan yang paling baik untuk tanaman lada adalah 2000 - 3000 mm/tahun dengan hari hujan 110-170 hari, dan musim kemarau 2-3 bulan/tahun. Kelembapan nisbi udara yang sesuai dari 70% sampai 90% dengan kisaran suhu 25-35 0C. Tanaman lada dapat tumbuh pada semua jenis tanah, terutama tanah berpasir dan gembur dengan unsur hara yang cukup. Tingkat kemasaman tanah (pH) yang sesuai berkisar 5-6.5 (Balittri 2007).
Penggunaan tiang panjat hidup (tajar) dalam budi daya lada akan membantu mengurangi intensitas cahaya yang berlebihan dan akan membuat tanaman berumur lebih panjang karena tanaman tidak didorong berproduksi lebih sementara input yang diberikan terbatas. Penanaman tanaman penutup tanah akan mengurangi cekaman kekeringan akibat kemarau dan menghambat penyebaran Phytophthora capsici selama musim hujan. Pembuatan saluran drainase yang cukup dan terasering yang disesuaikan dengan kondisi lahan diperlukan untuk menghindari genangan air selama musim hujan (Wahyuno 2009).
Penyakit Busuk Pangkal Batang (Phytophthora capsici L.)
Penyakit busuk pangkal batang (BPB) yang disebabkan oleh Phytophthora capsici pertama kali dilaporkan terjadi di pertanaman lada di Sumatera Selatan
5
pada tahun 1885. Sejak saat itu dilaporkan penyebaran semakin meluas ke berbagai daerah pertanaman lada, yaitu Lampung, Bangka, Aceh, Bengkulu, Jawa Barat, Jawa Tengah, Kalimantan Selatan, Kalimantan Timur, dan Pulau Laut (Manohara 2000). Kerusakan akibat penyakit tersebut di Lampung pada tahun 1970 diperkirakan mencapai 52%. Kasim (1990) memperkirakan kerusakan tanaman lada akibat penyakit BPB di Indonesia setiap tahunnya berkisar dari 10% sampai 15% dari total tanaman lada. Saat ini serangan penyakit BPB terus meluas hingga tidak hanya ditemukan di sentra produksi lada, yaitu Bangka dan Lampung, tetapi telah tersebar hampir di semua pertanaman lada di Jawa, Kalimantan, dan Sulawesi (Manohara et al. 2005).
Cendawan P. capsici dapat menyerang semua fase pertumbuhan tanaman, mulai pembibitan sampai tanaman produktif. Gejala kelayuan mendadak terjadi apabila terjadi serangan patogen pada pangkal batang. Pangkal batang yang terserang menjadi berwarna hitam dan pada keadaan lembap akan tampak lendir yang berwarna kebiruan. Serangan pada akar menyebabkan tanaman layu dan daun-daun menjadi berwarna kuning. Serangan pada daun menyebabkan gejala bercak daun pada bagian tengah atau tepi daun. Bercak berwarna hitam dengan tepi bergerigi seperti renda yang akan tampak jelas apabila daun diarahkan ke cahaya. Serangan pada buah menyebabkan buah berwarna hitam dan busuk; gejala ini biasanya banyak ditemukan pada buah yang letaknya dekat permukaan tanah (Manohara & Kasim 1996).
Penyebaran cendawan P. capsici selain oleh air dan angin pada saat hujan, juga dapat terbawa oleh ternak peliharaan, siput/keong, manusia, alat pertanian bekas dipakai pada tanaman sakit, dan dapat terbawa pada bibit lada sehingga menjadi sumber inokulum bagi daerah pengembangan lada yang baru (Mulya et a.l 1986 dalam Manohara et al. 2005).
Pada dasarnya cendawan P. capsici merupakan patogen yang sulit dikendalikan, tetapi kerugian akibat penyakit ini dapat ditekan dengan melakukan budi daya lada yang tepat dan benar. Pengendalian terpadu penyakit BPB meliputi pengendalian secara kimia, kultur teknis dan hayati. Wahyuno (2009) menyatakan bahwa hanya Lampung Daun Kecil dan Chunuk yang merupakan varietas toleran terhadap BPB dan sampai saat ini belum ada varietas yang tahan BPB.
6
Pengendalian secara kimia dengan menggunakan fungisida berbahan aktif sistemik cenderung lebih efektif dan banyak digunakan oleh petani, khususnya saat harga lada tinggi (Manohara et al. 2005). Fungisida sistemik berbahan aktif aluminium fosetil 80%, asam fosfit 400g/l, atau menaburkan mefenoksam ke tanah sekeliling bawah tajuk tanaman dapat mencegah terjadinya penularan penyakit (Manohara & Kasim 1996). Namun, pemakaian fungisida hendaknya merupakan pilihan terakhir. Selain karena permintaan produk yang bebas residu juga harga lada yang relatif tidak stabil, fungisida menjadi input yang mahal bagi petani (Wahyuno 2009).
Pengendalian secara kultur teknis meliputi penggunaan bibit yang sehat, penanaman tanaman penutup tanah, penggunaan tiang panjat hidup, pemupukan yang berimbang, pembuatan drainase dan parit keliling, pemangkasan tajar, pembuangan sulur cacing dan sulur gantung, penyiangan terbatas, serta pemangkasan cabang lada yang ada di bagian bawah. Penanaman tanaman kelompok Liliaceae dilaporkan akan menekan terjadinya gejala BPB karena eksudat akar tanaman tersebut dapat menghambat perkecambahan zoospora P. capsici (Wahyuno 2009).
Pengendalian secara hayati dapat dilakukan dengan menggunakan sisa tanaman seperti padi, palawija, dan serasah tajar yang dibenamkan ke dalam tanah. Pengaplikasian bahan organik berupa alang-alang, jagung atau Arachis yang telah diinfestasi Trichoderma diketahui dapat menurunkan serangan P. capsici (Wahyuno 2009).
Bahan Uji Gambir
Gambir merupakan ekstrak kering dari ranting dan daun tanaman Uncaria gambir Roxb. (Rubiaceae). Gambir telah sejak lama digunakan sebagai pelengkap menyirih yang dikunyah dan dipercaya dapat menguatkan gigi (Lucida et al. 2007). Tanaman gambir merupakan tanaman perdu yang memiliki nilai ekonomi tinggi, yaitu ekstrak (getah) daun dan ranting mengandung asam kateku tanat (tanin), katekin, pirokatekol, florisinlilin, dan lemak (Dhalimi 2006). Selain itu,
7
gambir juga mengandung sedikit kuarsetin yaitu bahan pewarna kuning (Hayani 2003).
Pambayun et al. (2006) melaporkan bahwa kandungan fenol dari ekstrak etil asetat gambir menunjukkan sifat antibakteri pada bakteri gram positif, yaitu Streptococcus mutans, Staphylococcus aureus, dan Bacillus subtilis. Selain itu, Idris (2007) melaporkan bahwa formulasi gambir 30% cukup efektif menekan perkembangan diameter koloni cendawan Fusarium sp. penyebab penyakit bercak daun serai wangi sebesar 41,02% dan keparahan penyakit sebesar 28,81% pada pengujian di rumah kaca. Pada penelian lain, Kresnawaty & Zainuddin (2009) menyatakan bahwa terdapat aktivitas antioksidan dan antibakteri dari derivate metil ekstrak etanol daun gambir.
Pinang
Tanaman pinang (Areca catechu, Palmaceae) merupakan tanaman penting di Asia yang dimanfaatkan sebagai obat herbal dan bahan campuran menyirih. Biji pinang mengandung alkaloid, tanin, polifenol, gula, dan lemak. Alkaloid utama pinang yaitu arekolina sedangkan arekeidina, guvasina, guvakolina, dan arekolidina sebagai alkaloid minor (Awang 1986). Biji pinang memiliki sifat anticacing, antifungi, antibekteri, antiinflamasi, dan antioksidan (Wetwitayaklung et al. 2006).
Nonaka (1989) melaporkan bahwa biji buah pinang mengandung proantosianidin, yaitu suatu tanin terkondensasi yang termasuk dalam golongan flavonoid. Proantocyanidin merupakan senyawa fenol spesifik yang terkandung di dalam biji pinang dan memiliki struktur seperti katekin dan epikatekin. Proantosianidin mempunyai efek antibakteri, antivirus, antikarsinogenik, antiinflamasi, antialergi, dan pelebaran pembuluh darah (vasodilatasi) (Fine 2000).
Sirih
Tanaman sirih (Piper betle, Piperaceae) telah lama dikenal masyarakat sebagai tumbuhan obat tradisional. Bagian tanaman yang digunakan sebagai obat adalah daun, akar, dan biji. Daun sirih banyak dimanfaatkan untuk menghentikan
8
pendarahan, mengobati sariawan, gatal-gatal, obat batuk, dan antijamur pada kulit (Parwata et al. 2009). Sari & Isadiartuti (2006) dalam penelitiannya melaporkan bahwa ekstrak daun sirih memiliki aktivitas antiseptik yang dapat menghilangkan mikroorganisme pada tangan.
Daun sirih mengandung minyak atsiri dengan aroma yang khas. Minyak atsiri sirih mengandung kavibetol yang membentuk karakter dalam komponen-komponen minyak atsiri. Selain itu juga terkandung eugenol, kavikol, eugenol metil eter, kineole, kariophilen, dan kadinen. Sirih banyak dimanfaatkan sebagai bahan karminatif, stimulan, anticacing, ekspektoran, antiseptik, mengobati dyspepsia, demam, kembung, dan filiriasis. Minyak atsiri memiliki aktivitas antibakteri dan antioksidan yang efektif (Daniel 2006).
Minyak atsiri daun sirih dengan dosis optimum 2,5 µL/ cawan dilaporkan memberikan hambatan pertumbuhan terhadap cendawan Candida albicans dan Trichophyton mentagrophytes dengan diameter penghambatan sebesar 15,3 dan 21 mm (Adnan et al. 2003).
Kapur Sirih
Kapur berasal dari kulit kerang laut atau cangkang dari kerang yang telah dibakar. Kapur sirih biasa ditemukan berwarna putih baik dalam bentuk kering dan basah. Saat kering kapur sirih berumus molekul CaO, sedangkan saat basah/larutan berumus molekul Ca(OH)2 (Bayani 2009). Kapur sirih (Ca(OH)2)
yang dilarutkan dalam air akan terionisasi membentuk ion OH- yang bersifat basa dan dapat menetralkan suasana asam (Ismadi 1993).
Barthel et al. (2002) melaporkan bahwa pasta Ca(OH)2 efektif menghambat pertumbuhan koloni bakteri Enterococcus faecalis hingga 100% setelah 1 dan 2 minggu masa inkubasi. Selain itu, Ravinshanker & Subba (2009) juga melaporkan bahwa pasta Vitapex yang mengandung 30% Ca(OH)2 cukup efektif menghambat pertumbuhan koloni E. faecalis secara in vitro.
9
BAHAN DAN METODE
Tempat dan Waktu
Penelitian ini dilaksanakan di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB), dari bulan Februari hingga November 2010.
Bahan Tanaman Uji
Daun lada yang digunakan dalam pengujian secara in vivo diambil dari tanaman lada varietas Lampung Daun Kecil (LDK) yang berasal dari perkebunan lada masyarakat Membalong, Belitung.
Bahan Sumber Ekstrak
Bahan yang digunakan sebagai sumber ekstrak ialah biji pinang, gambir, daun sirih, dan kapur sirih yang dibeli dari kios obat tradisional di Bogor.
Ekstraksi
Sumber ekstrak yaitu biji pinang, gambir, daun sirih, dan kapur sirih masing-masing ditumbuk dengan menggunakan mortar. Setelah halus, bahan tersebut dilarutkan dalam air dengan perbandingan 1 g bahan/100 ml aquades untuk mendapatkan konsentrasi larutan 1%. Larutan tersebut kemudian disaring menggunakan corong kaca berdiameter 6 cm beralaskan filter membran Whatman 0,2 µm. Hasil saringan ditampung dalam labu erlenmeyer dan disimpan sebagai stok. Ekstrak stok pinang dan gambir kemudian diencerkan hingga didapat konsentrasi masing-masing 0,5%. Kedua ekstrak tersebut kemudian dicampurkan dan didapat ekstrak pinang + gambir dengan konsentrasi masing-masing komponen 0,5%. Ekstrak pinang, gambir, sirih, dan kapur sirih kemudian diencerkan lagi agar didapat ekstrak dengan konsentrasi 0,25 %. Ekstrak tersebut kemudian dicampurkan dan didapat ekstrak campuran dengan konsentrasi masing-masing komponen 0,25%.
10
Perbanyakan Isolat P. capsici
Isolat murni P. capsici diperoleh dari Balai Penelitian Tanaman Obat dan Aromatika, Bogor dan diperbanyak di Laborium Mikologi Tumbuhan, Fakultas Pertanian, IPB. Isolat tersebut diperbanyak pada media V8.
Pembuatan media V8 memerlukan bahan V8, aquades, agar, dan CaCO3. Sebanyak 800 ml aquades dan 15 g agar, dipanaskan dengan api sedang, kemudian 200 ml V8 yang telah disaring dimasukkan ke dalam campuran dan diaduk-aduk rata. Setelah campuran tersebut mendidih, api dikecilkan dan dimasukkan sebanyak 3,5-5 g CaCO3. Campuran tersebut diaduk-aduk kembali hingga rata. Setelah rata, V8 dimasukkan ke dalam erlenmeyer dan disterilisasi menggunakan autoklaf dengan menggunakan uap air jenuh bertekanan 1atm selama 15 menit pada suhu 121 0C (Shurtleff & Awerre 1997).
Media V8 yang telah disterilisasi kemudian dituang ke dalam cawan petri sebanyak 15 ml tiap cawan. Setelah media pada cawan petri mengeras, isolat P. capsici dari agar miring diambil secukupnya dan dipindahkan ke dalam cawan menggunakan jarum inokulasi. Selanjutnya isolat diinkubasi selama 1 minggu dalam suhu ruang.
Perbanyakan Zoospora P. capsici
Isolat patogen berdiameter 7 mm dipindahkan ke dalam media V8 dalam cawan petri dan diinkubasi selama 4 hari dengan penyinaran lampu secara terus menerus. Setelah 4 hari, biakan dibagi menjadi empat bagian dengan menggunakan pisau steril. Setiap bagian dipindahkan ke dalam cawan petri baru dan dipotong-potong menjadi blok-blok kecil dengan panjang sisi 0,5 cm2 (Wang 2000).
Air steril ditambahkan ke dalam cawan petri yang berisi agar blok hingga menutupi permukaan blok dan diinkubasi pada suhu ruang selama 1 jam. Setelah itu, air dibuang dan diganti dengan 18 ml air steril hingga menutupi permukaan agar blok. Agar blok kemudian diinkubasi pada suhu 28 0C selama 24 jam dengan penyinaran lampu terus menerus untuk menghasilkan sporangia. Selanjutnya, agar dipindahkan ke dalam inkubator suhu 4 0C selama 2 jam untuk menginisiasi
11
pembentukan zoospora. Agar kembali dipindahkan ke suhu 28 0C dengan penyinaran lampu selama 1 jam untuk pelepasan zoospora (Wang 2000).
Suspensi zoospora yang dihasilkan dituang ke dalam erlenmeyer. Penghitungan jumlah zoospora dilakukan dengan menggunakan hemasitometer. Sampel suspensi sebanyak 0,1 ml diambil dan dipindahkan ke dalam hemasitometer dan dipanaskan pada suhu 50 0C selama 1 menit. Hal ini dilakukan untuk menghentikan pergerakan zoospora agar mudah dihitung. Suspensi zoospora yang diperoleh disimpan dalam keadaan dingin. Suspensi diencerkan dengan air dingin terlebih dahulu sebelum digunakan untuk inokulasi (Wang 2000).
Metode Pengujian
Uji Penghambatan Pertumbuhan Koloni secara In Vitro
Isolat P. capsici yang berumur 4 hari diambil dengan menggunakan alat pelubang gabus berdiameter 5 mm. Isolat tersebut diinokulasikan ke dalam media V8 yang telah dicampur dengan bahan ekstrak. Isolat yang telah diinokulasikan diinkubasi pada suhu ruang selama 6 hari.
Perlakuan yang diberikan yaitu kontrol (K, tanpa perlakuan bahan ekstrak), ekstrak pinang 0,01%; 0,02%; dan 0,04% dalam media V8, ekstrak gambir 0,01%; 0,02%; dan 0,04% dalam media V8, ekstrak pinang + gambir 0,005%; 0,01%; dan 0,02% dalam media V8, dan ekstrak campuran pinang + gambir + sirih + kapur sirih 0,0025%; 0,005%; dan 0,01% dalam media V8. Inokulasi dilakukan di laminar air flow agar perlakuan terhindar dari kontaminan. Pengamatan dilakukan setiap hari setelah inokulasi (HSI). Peubah yang dicatat yaitu perkembangan diameter miselium terhadap waktu inkubasi.
Uji Penghambatan Kemunculan dan Diameter Gejala BPB secara In Vivo Daun lada varietas LDK dibersihkan dengan air mengalir dan dibiarkan kering udara. Daun kemudian dicelupkan ke dalam cairan perekat dan dikeringanginkan. Setelah itu, daun dicelupkan ke larutan ekstrak sesuai perlakuan dan dibiarkan kering udara. Jumlah zoospora yang didapat dalam suspensi yaitu 9 x104 sel/ml. Inokulasi dilakukan dengan meneteskan zoospora P. capsici ke
12
permukaan bawah daun lada dengan menggunakan pipet mikro. Suspensi zoospora sebanyak 0,1 ml diteteskan ke empat titik di permukaan bawah daun.
Perlakuan bahan celup yang diberikan yaitu kontrol (K, tanpa perlakuan bahan ekstrak); fungisida berbahan aktif propineb 70% konsentrasi 0,2% dalam larutan (F); ekstrak campuran gambir + pinang + sirih + kapur sirih konsentrasi total 0,005% dalam larutan (C2); ekstrak campuran pinang + gambir + sirih + kapur sirih konsentrasi total 0,01% dalam larutan (C4); dan ekstrak pinang 0,04% dalam larutan (P4).
Tiap perlakuan diletakkan pada satu baki yang beralas tisu lembap, kemudian sedotan plastik diletakkan di atas tisu tersebut untuk menyangga agar permukaan daun tidak mengenai tisu. Daun disusun secara berjajar dengan permukaan bawah daun menghadap ke atas. Daun yang telah diberi perlakuan kemudian disungkup dengan plastik transparan. Penyungkupan dilakukan dengan tujuan menciptakan kondisi lingkungan yang lembap agar zoospora patogen dapat beradaptasi dan berpenetrasi ke dalam jaringan daun (Wahyuno et al. 2009).
Daun diinkubasi selama 24 jam di ruang gelap dan kemudian diinkubasi pada kondisi normal laboratorium selama 10 hari. Peubah yang digunakan yaitu peluang kemunculan gejala dan perkembangan diameter terhadap waktu inkubasi. Penghitungan peluang terjadinya penyakit didasarkan pada kemunculan gejala pada titik-titik inokulasi. Gejala yang muncul menunjukkan keberhasilan patogen menginfeksi daun tanaman. Persentase kemunculan gejala dihitung dengan rumus:
Jumlah titik yang bergejala pada tiap daun Kemunculan gejala (%) =
Jumlah titik inokulasi pada tiap daun
Keparahan penyakit (KP) didefinisikan sebagai persentase luas jaringan tanaman yang terserang patogen dari total luasan yang diamati (Heuberger & Townsend 1943 dalam Sinaga 2006).
∑ ni x vi
KP = x 100% Z x N
KP = keparahan penyakit (%)
N = jumlah daun yang terserang dengan nilai skala tertentu vi = nilai skala
13
ni = jumlah daun yang diamati
Nilai skala dari 0 hingga 4 digunakan untuk menghitung KP (Tabel 1) mengacu pada Pudjihartati et al. (2006) dalam menentukan gejala nekrosis pada daun kacang tanah.
Tabel 1 Nilai skala dan kategori serangan yang digunakan untuk menghitung keparahan penyakit (KP) BPB pada tanaman lada
Nilai skala Persentase luas bercak nekrosis terhadap luas daun per titik inokulasi (x) 0 x = 0 1 1% < x ≤ 10% 2 10% < x ≤ 25% 3 25% < x ≤ 50% 4 > 50% Rancangan Percobaan
Rancangan percobaan yang digunakan pada penelitian ini adalah rancangan acak lengkap. Pengujian pengaruh bahan ekstrak secara in vitro dilakukan dengan 12 perlakuan ekstrak ditambah 1 kontrol. Masing-masing perlakuan diulang sebanyak tiga kali dengan inokulasi isolat patogen pada media sebagai ulangan. Pengujian pengaruh bahan ekstrak secara in vivo dilakukan dengan 3 perlakuan ekstrak, 1 kontrol, dan 1 kontrol negatif. Pengulangan sebanyak lima kali dengan daun sebagai ulangan dan empat titik inokulasi pada daun sebagai unit perlakuan.
Analisis Data
Data pengaruh perlakuan ekstrak terhadap pertumbuhan koloni P.capsici secara in vitro dan pengaruh perlakuan ekstrak terhadap perkembangan gejala BPB secara in vivo dianalisis dengan sidik ragam menggunakan program Microsoft Excel 2007 dan Statistical Analysis System (SAS) untuk Windows versi 9.1. Pembandingan nilai tengah antar perlakuan dilakukan dengan uji selang berganda Duncan pada taraf nyata 5%.
14
HASIL DAN PEMBAHASAN
Pengaruh Perlakuan terhadap Pertumbuhan Diameter Koloni P. capsici secara In Vitro
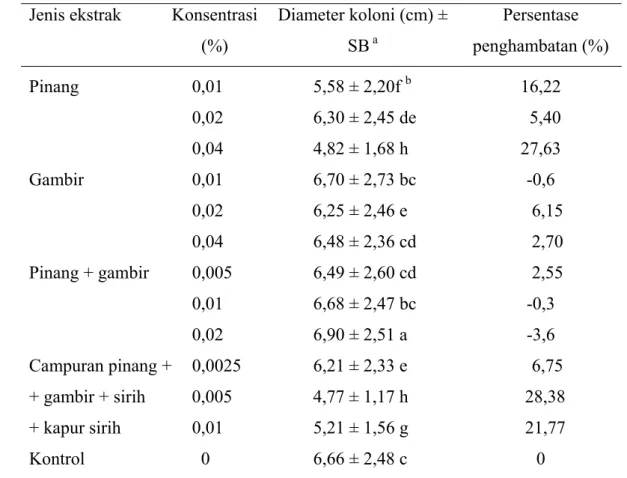
Pengujian pengaruh jenis ekstrak terhadap pertumbuhan koloni P. capsici secara in vitro pada awalnya menggunakan empat jenis ekstrak tunggal, yaitu pinang, gambir, sirih, dan kapur sirih pada konsentrasi 0,01%; 0,02%; dan 0,04%. Namun, pada pengujian ekstrak sirih dan kapur sirih pada 0,01%, koloni patogen tumbuh sangat cepat dan jauh melebihi pertumbuhan kontrol (Tabel 2). Hal ini menunjukkan bahwa ekstrak sirih dan kapur sirih 0,01% tidak efektif menghambat pertumbuhan koloni. Oleh karena itu, pada pengujian lanjutan dengan konsentrasi 0,02% dan 0,04% penggunaan ekstrak sirih dan kapur sirih ditiadakan. Pengujian ekstrak pada konsentrasi 0,02% dan 0,04% hanya diarahkan pada pinang dan gambir. Sementara itu, pengujian ekstrak pinang + gambir dilakukan pada konsentrasi total 0,005%; 0,01%; dan 0,02% dan campuran empat bahan uji yang terdiri atas pinang, sirih, gambir, dan kapur sirih dengan konsentrasi total 0,0025%; 0,005%; dan 0,01%.
Tabel 2 Pengaruh perlakuan empat jenis ekstrak (0,01%) terhadap pertumbuhan koloni P. capsici pada 6 hari setelah inokulasi
a SB: simpangan baku.
Purnomo & Asmarayan (2005) menyatakan bahwa sirih dan lada mempunyai kekerabatan morfologi yang dekat. Sirih juga diketahui memiliki sifat ketahanan yang sama dengan lada terhadap P. capsici (Wahyuno et al. 2010). Priyono & Praptiwi (2006) melaporkan bahwa buah Piper sp. asal Papua
Jenis ekstrak Diameter koloni (cm) ± SBa Persentase penghambatan
Pinang 5,58 ± 2,20 16,2 Gambir 6,70 ± 2,73 -0,6 Sirih 6,85 ± 2,51 -2,8 Kapur sirih 6,99 ± 2,53 -4,9 Kontrol 6,66 ± 2,48 0
15
mengandung minyak atsiri, lemak dan asam lemak, emodol, tanin, gula pereduksi, antrasenoid, poiluronida, glukosida, dan glikosida steroid. Adanya kandungan senyawa kimia yang sama antara sirih dan lada menyebabkan tidak adanya penghambatan pertumbuhan koloni pada pengujian dengan ekstrak sirih.
Perlakuan dengan kapur sirih 0,01% tidak menghambat pertumbuhan koloni patogen karena kapur sirih yang terlarut dalam air dapat menciptakan suasana basa. Erwin & Ribeiro (1996) melaporkan bahwa penambahan 3 g CaCO3 pada pembuatan media V8 menjadikan pH media sebesar 7,5. Adanya penambahan kapur sirih pada media membuat tingkat keasaman media menjadi berkurang dan mendukung pertumbuhan patogen. Sementara itu, Manohara (1988) melaporkan bahwa pH yang sesuai untuk pertumbuhan P. capsici pada media V8 cair adalah 3-7 dengan pH optimum 4.
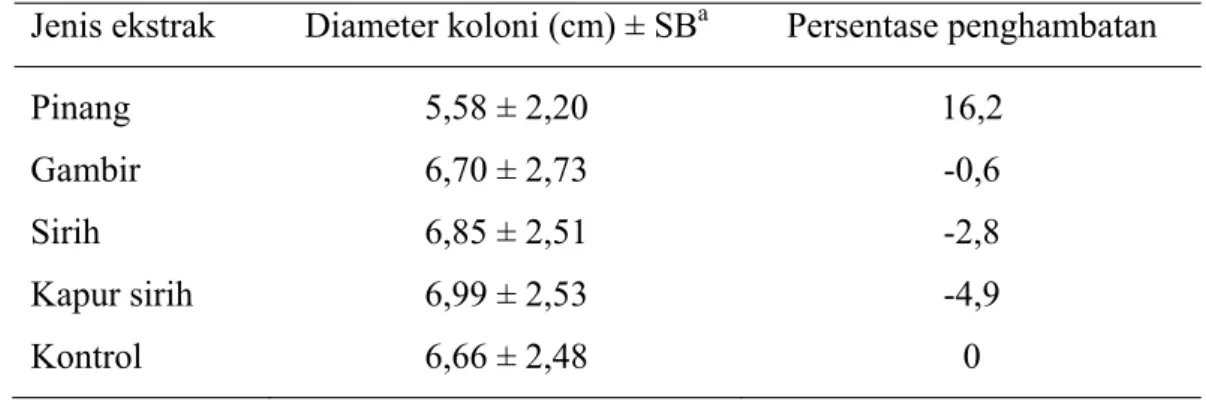
Perlakuan dengan ekstrak pinang 0,01%; 0,02%; dan 0,04% masing-masing dapat menghambat pertumbuhan koloni patogen (Gambar 1.a, Tabel 3), sementara itu pada pengujian ekstrak gambir diketahui tidak terjadi penghambatan pertumbuhan koloni pada konsentrasi 0,01% (Gambar 1.b, Tabel 3). Pada saat kedua ekstrak tersebut dicampur terjadi penghambatan pada konsentrasi 0,005%, sedangkan pada konsentrasi 0,01% dan 0,02% tidak (Gambar 1.c, Tabel 3). Namun demikian, ketika keempat ekstrak, yaitu pinang, gambir, sirih, dan kapur sirih dicampurkan, penghambatan pertumbuhan koloni patogen terjadi pada semua tingkat konsentrasi. Penghambatan tertinggi ditunjukkan oleh konsentrasi campuran 0,005% (Gambar 1.d, Tabel 3).
Wetwitayakyung (2006) menyatakan bahwa aktivitas antioksidan biji pinang tidak hanya ditentukan oleh kadar tanin dan fenol total yang terkandung, tetapi juga ditentukan oleh senyawa-senyawa fenolik lainnya. Nonaka (1989) menyatakan bahwa proantocyanidin merupakan senyawa fenol spesifik yang terkandung di dalam biji pinang dan memiliki struktur seperti katekin dan epikatekin. Penelitian sebelumnya (Takahashi et al. 1999) menyebutkan bahwa proantocyanidin memiliki sifat antimikroba, pelindung tanaman terhadap sinar ultraviolet, antioksidan, antimutagenetik, antitumor, antifungi, dan sebagai pelindung kapiler. Oleh karena itu, adanya penghambatan pertumbuhan koloni
16 0 2 4 6 8 10 1 2 3 4 5 6 Diam eter koloni (cm )
Waktu pengamatan (HSI)
0,01% 0,02% 0,04% Kontrol 0 2 4 6 8 10 1 2 3 4 5 6 Diam eter koloni (cm )
Waktu pengamatan (HSI)
0,01% 0,02% 0,04% Kontrol 0 2 4 6 8 10 1 2 3 4 5 6 Diam eter kolonni (cm )
Waktu pengamatan (HSI)
0,005% 0,01% 0,02% Kontrol 0 2 4 6 8 10 1 2 3 4 5 6 Diam eter koloni (cm )
Waktu pengamatan (HSI)
0,0025% 0,005% 0,01% Kontrol a b c d
patogen diduga merupakan aktivitas dari proantocyanidin yang terkandung dalam ekstrak.
Gambar 1 Perkembangan koloni P. capsici akibat perlakuan dengan (a) ekstrak pinang, (b) ekstrak gambir, (c) ekstrak pinang + gambir, dan (d) ekstrak campuran pinang + gambir + sirih + kapur sirih. HSI: hari setelah inokulasi.
17
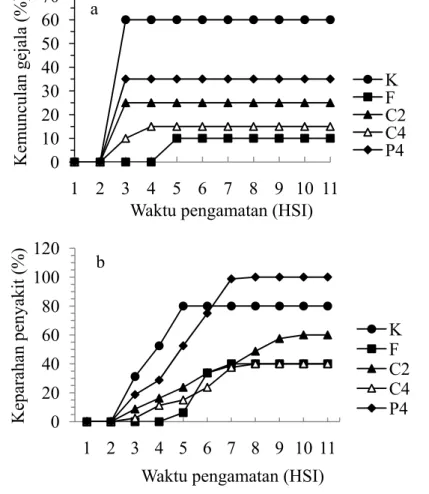
Tabel 3 Pengaruh perlakuan empat jenis ekstrak terhadap pertumbuhan diameter koloni P. capsici pada 6 hari setelah inokulasi
a SB: simpangan baku
b Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji selang berganda Duncan pada taraf nyata 5%.
Katekin merupakan zat aktif utama yang terkandung di dalam ekstrak gambir. Penelitian sebelumnya menunjukkan bahwa kadar katekin dari produk gambir Indonesia bervariasi dari 2,5 sampai dengan 95% per berat bobot (Amos 2010). Katekin pada daun strawberi menunjukkan aktivitas antifungi dengan menghambat infeksi Alternaria alternata dengan memblok pembentukan haustoria walaupun telah terjadi perkecambahan spora dan terbentuk apresoria (Yamamoto et al. 2000), formulasi gambir 30% dilaporkan cukup efektif terhadap cendawan Fusarium sp. penyebab penyakit bercak daun serai wangi (Idris 2007). Sementara itu, aktivitas antibakteri juga ditunjukkan ekstrak etil asetat gambir terhadap bakteri Streptococcus mutans, Staphylococcus aureus, dan Bacillus subtilis (Pambayun et al. 2007). Namun demikian, sifat antifungi dan antibakteri yang dimiliki katekin tidak mampu menghambat pertumbuhan koloni P. capsici. Jenis ekstrak Konsentrasi
(%) Diameter koloni (cm) ± SB a Persentase penghambatan (%) Pinang 0,01 5,58 ± 2,20f b 16,22 0,02 6,30 ± 2,45 de 5,40 0,04 4,82 ± 1,68 h 27,63 Gambir 0,01 6,70 ± 2,73 bc -0,6 0,02 6,25 ± 2,46 e 6,15 0,04 6,48 ± 2,36 cd 2,70 Pinang + gambir 0,005 6,49 ± 2,60 cd 2,55 0,01 6,68 ± 2,47 bc -0,3 0,02 6,90 ± 2,51 a -3,6 Campuran pinang + 0,0025 6,21 ± 2,33 e 6,75 + gambir + sirih 0,005 4,77 ± 1,17 h 28,38 + kapur sirih 0,01 5,21 ± 1,56 g 21,77 Kontrol 0 6,66 ± 2,48 c 0
18
Ekstrak pinang + gambir yang digunakan pada pengujian merupakan campuran dari bahan ekstrak pinang dan gambir dengan perbandingan volume dan konsentrasi 1:1. Hasil pengujian menunjukkan bahwa penghambatan pertumbuhan koloni patogen hanya ditunjukkan oleh konsentrasi 0,01% sementara konsentrasi 0,02% dan 0,04% tidak (Gambar 1.c, Tabel 3). Hal ini terjadi karena bahan aktif yang terkandung dalam masing-masing ekstrak tidak saling kompatibel dalam menghambat pertumbuhan patogen.
Hasil pengujian bahan campuran yang terdiri atas ekstrak pinang, gambir, sirih, dan kapur sirih dengan perbandingan volume dan konsentrasi tiap ekstrak 1:1:1:1 dapat dilihat pada gambar 1.d. Aktivitas penghambatan pertumbuhan koloni patogen ditunjukkan oleh setiap konsentrasi yang diberikan yaitu 0,0025%; 0,005%; dan 0,01%. Keefektifan ekstrak campuran dalam menghambat pertumbuhan koloni patogen erat kaitannya dengan kompatibelitas bahan aktif yang dikandung masing-masing bahan. Belum diketahui dengan pasti penyebab kompatibelnya bahan aktif campuran terhadap penghambatan pertumbuhan koloni.
Pengujian pengaruh perlakuan terhadap pertumbuhan diameter koloni menunjukkan beberapa jenis ekstrak yang berpotensi menghambat pertumbuhan P. capsici. yaitu pinang 0,04%, campuran 0,005% dan campuran 0,01%. Ketiga ekstrak tersebut memberikan pengaruh nyata terhadap pertumbuhan diameter koloni patogen bila dibandingkan dengan kontrol. Namun, ketiga ekstrak tersebut harus di uji secara in vivo untuk mengetahui tingkat keefektifannya pada jaringan tanaman
Pengaruh Perlakuan terhadap Perkembangan Gejala BPB oleh P. capsici secara In Vivo
Hasil dari pengujian menunjukkan bahwa persentase kemunculan gejala tiap perlakuan memberikan nilai yang berbeda. Kemunculan gejala tertinggi ditunjukkan oleh ekstrak pinang 0,004% disusul oleh ekstrak campuran 0,005%, ekstrak campuran 0,01%, dan fungisida 0,2% berbahan aktif propineb 70%. Agrios (2005) menyatakan bahwa keberhasilan suatu infeksi ditentukan oleh beberapa hal, yaitu varietas tanaman yang di uji bersifat rentan terhadap patogen,
19
patogen dalam tingkat patogenik, serta suhu dan kelembapan lingkungan yang menguntungkan patogen.
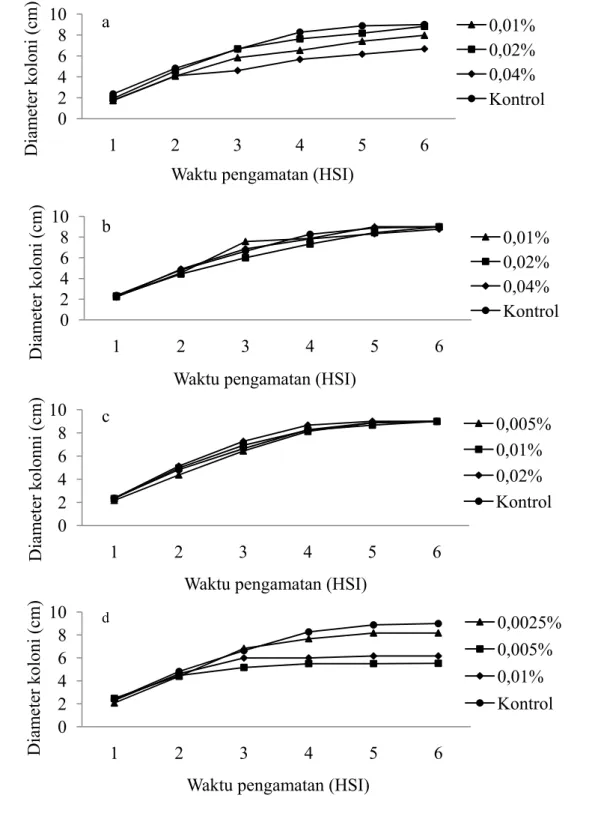
Semua perlakuan yang diberikan menunjukkan kemunculan gejala pada hari ke-3, kecuali pada perlakuan fungisida. Persentase kemunculan gejala dari hari ke-3 dan seterusnya menunjukkan nilai yang tetap. Perlakuan C4 menunjukkan peningkatan persentase kemunculan gejala pada hari ke-3 dan ke-4. Perlakuan fungisida baru menunjukkan gejala pada hari ke-4. Kemunculan gejala perlakuan fungisida dari hari ke-4 dan seterusnya menunjukkan nilai yang tetap (Gambar 2.a).
Infeksi P. capsici lebih mudah terjadi pada permukaan bawah daun, penetrasi terjadi antara 4-6 jam setelah inokulasi dan gejala mulai tampak setelah 18 jam setelah inokulasi yang berupa titik coklat di permukaan atas daun (Manohara & Kasim 1996). Gejala pada permukaan bawah daun meluas hingga terlihat dengan jelas pada pengamatan hari ke tiga setelah inokulasi.
Perlakuan fungisida menunjukkan persentase kemunculan gejala terendah, yaitu sebesar 10%. Fungisida berbahan aktif propineb 70% yang digunakan merupakan fungisida yang bersifat racun kontak dan sangat cocok untuk mengendalikan Phytophthora spp. dan Alternaria untuk sayur-sayuran (Anonim 2010)
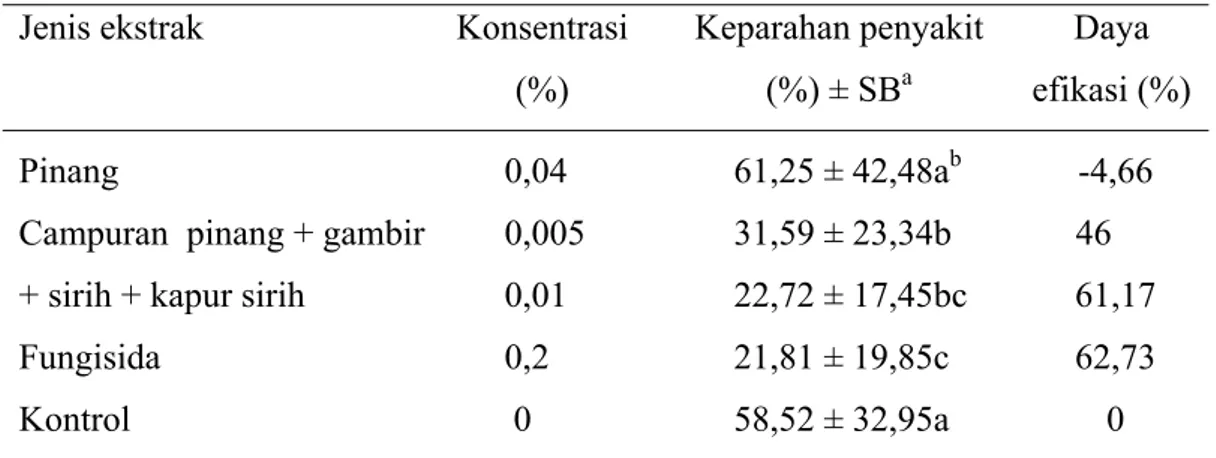
Perkembangan keparahan penyakit BPB berbanding lurus dengan waktu inkubasi. Semakin lama inkubasi, maka keparahan penyakit akan semakin tinggi yang ditandai dengan semakin luasnya diameter gejala. Perlakuan ekstrak pinang konsentrasi 0,04% menunjukkan keparahan penyakit tertinggi dibandingkan perlakuan lain. Perlakuan ekstrak campuran 0,005% menunjukkan keparahan penyakit yang lebih rendah dibandingkan kontrol dan perlakuan ekstrak campuran 0,01% menunjukkan keparahan penyakit yang tidak berbeda nyata dengan fungisida 0,2% (Tabel 4).
Ekstrak campuran 0,01% dan fungisida 0,2% menunjukkan nilai keparahan penyakit yang tidak berbeda nyata. Ekstrak campuran 0,01% juga memiliki daya efikasi yang tinggi yaitu sebesar 61,17% dan hampir menyamai daya efikasi fungisida yaitu sebesar 62,73%. Besarnya daya efikasi ekstrak campuran 0,01% terhadap keparahan penyakit menunjukkan bahwa ekstrak tersebut efektif dalam
20 0 10 20 30 40 50 60 70 1 2 3 4 5 6 7 8 9 10 11 Kem unculan gejala (%)
Waktu pengamatan (HSI)
K F C2 C4 P4 0 20 40 60 80 100 120 1 2 3 4 5 6 7 8 9 10 11 Keparahan penyakit (%)
Waktu pengamatan (HSI)
K F C2 C4 P4 a b
mengendalikan penyakit BPB. Keefektifan ekstrak campuran 0,01% tersebut menyamai keefektifan fungisida 0,2%. Oleh karena itu, ekstrak campuran 0,01% berpotensi untuk menggantikan fungisida dalam pengendalian P. capsici.
Gambar 2 Pengaruh perlakuan terhadap kemunculan gejala (a) dan keparahan penyakit (b) BPB oleh P. capsici secara in vivo. K: tanpa perlakuan (kontrol), F: fungisida berbahan aktif propineb 0,2%, C2: ekstrak campuran pinang + gambir + sirih + kapur sirih 0,005%, C4: ekstrak campuran pinang + gambir + sirih + kapur sirih 0,01%, dan P4: ekstrak pinang 0,04%.
Ekstrak campuran memiliki potensi yang cukup baik untuk digunakan sebagai salah satu alternatif pengendalian P. capsici. Bahan-Bahan untuk membuat ekstrak campuran juga mudah ditemukan di berbagai daerah di Indonesia sehingga pemanfaatan ekstrak campuran sebagai fungisida botani dapat dilakukan secara luas. Namun demikian, agar ekstrak campuran lebih efektif dalam mengendalikan P. capsici diperlukan formulasi ekstrak yang lebih tinggi konsentrasinya agar penekanan penyakit lebih optimal.
21
c
b
a
e
d
Tabel 4 Pengaruh perlakuan ekstrak uji terhadap persentase keparahan penyakit BPB pada 11 hari setelah inokulasi
Jenis ekstrak Konsentrasi (%) Keparahan penyakit (%) ± SBa Daya efikasi (%) Pinang 0,04 61,25 ± 42,48ab -4,66
Campuran pinang + gambir 0,005 31,59 ± 23,34b 46 + sirih + kapur sirih 0,01 22,72 ± 17,45bc 61,17
Fungisida 0,2 21,81 ± 19,85c 62,73
Kontrol 0 58,52 ± 32,95a 0
a SB: simpangan baku
b Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji selang berganda Duncan pada taraf nyata 5%.
Berikut gambar perkembangan gejala penyakit BPB setelah diinokulasikan zoospora P. capsici pada 7 HSI. Gejala yang nampak sesuai dengan penelitian Manohara et al. (2005) bahwa serangan pada daun menyebabkan gejala bercak daun pada bagian tengah atau tepi daun. Bercak berwarna hitam dengan tepi bergerigi seperti renda yang akan nampak jelas bila daun diarahkan ke cahaya.
Gambar 3 Gejala serangan P. capsici pada 7 HSI. (a) ekstrak pinang 0,04%, (b) ekstrak campuran pinang + gambir + sirih + kapur sirih 0,005%, (c) ekstrak campuran pinang + gambir + sirih + kapur sirih 0,01%, (d) perlakuan fungisida propineb 0,2%, dan (e) perlakuan kontrol.
22
SIMPULAN DAN SARAN
Simpulan
Perlakuan ekstrak campuran pinang + gambir + sirih + kapur sirih 0,005%; campuran pinang + gambir + sirih + kapur sirih 0,01%; dan pinang 0,04% secara in vitro menghambat perkembangan diameter koloni P. capsici masing-masing sebesar 28,4%; 21,8%; dan 27,6%. Pada pengujian secara in vivo, penghambatan kemunculan gejala ditunjukkan oleh perlakuan campuran pinang + gambir + sirih + kapur sirih 0,005%; campuran pinang + gambir + sirih + kapur sirih 0,01%; dan pinang 0,04%. Namun, potensi penghambatan keparahan penyakit hanya ditunjukkan oleh perlakuan campuran pinang + gambir + sirih + kapur sirih 0,005% dan 0,01%. Perlakuan ekstrak campuran pinang + gambir + sirih + kapur sirih 0,01% memiliki daya efikasi sebesar 61,2% dan hampir menyamai daya efikasi fungisida propineb 0,2%, yaitu sebesar 62,7%.
Saran
Perlu dilakukan penelitian tentang konsentrasi formulasi yang lebih efektif untuk menekan pertumbuhan patogen. Selain itu, perlu juga dilakukan penelitian lebih lanjut di lapangan untuk mempelajari pengaruh langsung adanya penghambatan penyakit BPB oleh formulasi campuran pinang + gambir + sirih + kapur sirih.
23
DAFTAR PUSTAKA
Adnan ZA, Marlina, Kasmi K. 2003. Uji antimikroba minyak atsiri sirih (Piper betle L.). Jurnal Sains Tekhnologi Farmasi 8(1): 31-34.
Agrios GN. 2005. Plant Pathology. Edisi ke-5. Amsterdam: Elsevier.
Amos. 2010. Kandungan katekin gambir sentra produksi di Indonesia. Jurnal Standardisasi 12(3): 149-155.
Anonim. 2010. Propineb. http://www.bayercropscience.com/ BCSWeb/ CropProtection.nsf/ id / propineb.htm?open&l=EN &ccm=200020 [20 Februari 2011].
Awang M N. 1986. Estimation of arecoline contents in commersial Areca (betel) nuts and its relation to oral precancerous lesions. Singapore Medicine Journal 27(4).
[Balittri] Balai Penelitian Tanaman Rempah dan Aneka Tanaman Industri. 2007. Teknologi unggulan tanaman lada. http://balittri.litbang.deptan.go.id/ database/unggulan/bookletlada.pdf [27 Januari 2011].
Barthel et al. 2002. In situ antimicrobial effectiveness of chlorhexidine and calcium hydroxide: gel and paste versus gutta-percha points. Journal of Endodontics 28(6): 427-430.
Bayani RN. 2009. Kanker rongga mulut disebabkan oleh kebiasaan menyirih (laporan kasus) [skripsi]. Medan: Fakultas Kedokteran Gigi, Universitas Sumatera Utara.
Daniel M. 2006. Medicinal Plants: Chemistry and Properties. USA: Science Publisher.
Dhalimi A. 2006. Permasalahan gambir (Uncaria gambir L.) di Sumatera Barat dan alternative pemecahannya. Perspektif 5(1): 46-59.
[Ditjenbun] Direktorat Jenderal Perkebunan. 2010. Lada. http://ditjenbun.deptan.go.id/ cigraph/ index.php/viewstat/ exportimport/10-Lada [27 Januari 2011].
Erwin DC, Ribeiro OK. 1996. Phytophthora Diseases Worldwide. St. Paul: APS Press.
Fine AM. 2000. Oligomeric proanthocyanidin complexes: history, structure, and phytopharmaceutical applications. Alternative Medicine Review 5(2): 144-151.
Guo LY, Ko WH. 1993. Two widely accessible media for growth and reproduction of Phytophthora and Pythium speciest. Journal Series Article 3787 of the Hawaii Institute of Tropical 59(7): 2323-2325.
Hayani E. 2003. Analisis kadar catechin dari gambir dengan berbagai metode. Buletin Teknik Pertanian 8(1): 31-33.
24
Idris H. 2007. Pemakaian fungisida gambir terhadap penyakit bercak Fusarium sp. pada daun serai wangi. Jurnal Ilmu-Ilmu Pertanian Indonesia 3: 379-385.
Ismadi M. 1993. Biokimia: Suatu Pendekatan Berorientasi Kasus. Yogyakarta: Gadjah Mada University Press.
Jamsari, Yaswendri, Kasim M. 2007. Fenologi perkembangan bunga dan spesies Uncaria gambir. Biodiversitas 8(2): 141-146.
Kasim R. 1990. Pengendalian penyakit busuk pangkal batang secara terpadu. Buletin Penelitian Tanaman Industri 1:16-20.
Kresnawaty I, Zainuddin A. 2009. Aktivitas antioksidan dan antibakteri dari derivat metil ekstrak etanol daun gambir (Uncaria gambir). Jurnal Littri 15(4): 145-151.
Lucida H, Bakhtiar A, Putri WA. 2007. Formulasi sediaan antiseptik mulut dari katekin gambir. Jurnal Sains Tekhnologi Farmasi 12(1).
Manohara D. 1988. Ekologi Phytophthora palmivora (Butler) penyebab penyakit busuk pangkal batang (Piper nigrum) [disertasi]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Manohara D. 2000. Penyakit Busuk Pangkal Batang dan Agen Pengendalinya. Departemen Kehutanan dan Perkebunan, Direktorat Jenderal perkebunan Manohara D, Kasim R. 1996. Penyakit busuk pangkal batang dan
pengendaliannya. Monograf Tanaman Lada 1: 115-128.
Manohara D, Wahyuno D, dan Noveriza R. 2005. Penyakit busuk pangkal batang lada dan strategi pengendaliannya. Perkembangan Teknologi Tanaman Rempah dan Obat 17: 41-51.
Marlinda B. 2008. Analisis Daya Saing Lada Indonesia di Pasar Internasional [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Nonaka. 1989. Isolation and structure elucidation of tannins. Pure and Applied Chemistry 61(3): 357-360.
Pambayun R, Gardjito M, Sudarmadji S, Kuswanto KR. 2007. Kandungan fenol dan sifat antibakteri dari berbagai jenis ekstrak produk gambir (Uncaria gambir Roxb.). Majalah Farmasi Indoesia 18(3): 141-146.
Parwata OA, Rita WS, Yoga R. 2009. Isolasi dan uji antiradikal bebas minyak atsiri pada daun sirih (Piper betle Linn.) secara spektroskopi ultra violet-tampak. Jurnal Kimia 3(1): 7-13.
Priyono SH, Praptiwi. 2006. Identifikasi senyawa kimia dan aktivitas antibakteri ekstrak Piper sp. asal Papua. Laporan Teknis Pusat Penelitian Biologi LIPI 332(2): 3 – 6.
Pudjihartati E, Ilyas S, Sudarsono. 2006. Aktivitas pembentukan secara cepat spesies oksigen aktif, peroksidase, dan kandungan lignin kacang tanah terinfeksi Sclerotium rolfsii. Hayati 13(4): 166-172.
25
Purnomo, Asmarayan R. 2005. Hubungan kekerabatan antar spesies Piper berdasarkan sifat morfologi dan minyak atsiri daun di Yogyakarta. Biodiversitas 6(1): 12-16.
Ravishanker P, Subba RC. 2009. Antimicrobial of four calcium hydroxide formulations and chlorhexidine gel using agar diffusion model. The Internet Journal of Dental Science 8(1). http://www.ispub.com /journal/the_internet_journal_of_dental_science/ volume_8_number_1_19/ article/ antimicrobial-efficacy-of-four-calcium-hydroxide-formulations-and-chlorhexidine-gel-using-agar-diffusion-model.html.
Ristaino JB, Johnston SA. 1999. Ecologically based approaches to management of Phytophthora blight on bell pepper. Plant Disease 83(12): 1080-1089. Ronald D, Jones JB, Roberts PD. 2006. Characterization of Phytophthora
capsici associated with roots of weeds on Florida vegetable farms. Plant Disease 90(3): 345-350.
Sanogo S. 2007. Asexual reproduction of Phytophthora capsici as affected by extracts from agricultural and nonagricultural soils. Phytopathology 97: 873-878.
Sari R, Isadiartuti D. 2006. Studi efektifitas sediaan gel antiseptik tangan ekstrak daun sirih (Piper betle Linn.). Majalah Farmasi Indonesia 17(4): 163-169. Setiyono RT. 2003. Status pemuliaan tanaman lada. Perkembangan Teknologi
TRO 15(2): 1-10.
Staples GW, Bevacqua RF. 2006. Areca catechu (betel nut palm) species profiles for Pacific Island agroforestry ver. 1.3. www.traditionaltree.org.
Shurtleff MC, Awere III CW. 1997. The Plant Disease Clinic and Field Diagnosis of Abiotic Diseases. St. Paul: APS Press.
Sinaga MS. 2006. Dasar-dasar Ilmu Penyakit Tumbuhan. Jakarta: Penerbit Swadaya.
Takahashi T, Kamiya T, Hasegawa A, Yokoo Y. 1999. Procyanidin oligomers selectively and intensively promote proliferation of mouse hair epithelial cells in vitro and active hair follicle growth in vivo. The Journal of Investigative Dermatology 112(3): 310-316.
Wahid P. 1996a. Sejarah perkembangan dan daerah perkembangan tanaman lada. Monograf Tanaman Lada 1:1-11.
Wahid P. 1996b. Identifikasi tanaman lada. Monograf Tanaman Lada 1: 27-32. Wahyono D, Manohara D. 1995. Pembentukan oospora Phytophthora capsici
pada jaringan lada. Hayati :46-48.
Wahyuno D. 2009. Pengendalian terpadu busuk pangkal batang lada. Perspektif 8: 17-29.
Wahyono D, Manohara D, Setiyono RT. 2009. Ketahanan beberapa lada hasil persilangan terhadap Phytophthora capsici asal lada. Jurnal Penelitian Tanaman Industri 15(2): 77-83.
26
Wahyuno D, Manohara D, Ningsih SD, Setijono RT. 2010. Pengembangan varietas unggul lada tahan penyakit busuk pangkal batang yang disebabkan oleh Phytophthora capsici. Jurnal Litbang Pertanian 29(3):86-95.
Wang TC. 2000. Method of assessing Phytophthora blight ( P. capsici) reaction of pepper. AVRDC Mycology: 1-2.
Wanchaitanawong P, Chaungwanit P, Poovarodom N, Nitisinprasert S. 2005. In vitro antifungal activity of Thai herbs and spice extracts against food spoilage fungi. Kasetsart Journal of Natural Science 39: 400–405.
Wetwitayakyung P, Phaechamud T, Limmatvapirat C, Keokitichai S. 2006. The study of antioxidant capacity in various parts of Areca cathecu L. Naresuan University Journal 14 (1): 1-14.
Yamamoto M, Nakatsuka S, Otani H, Kohmoto K, Nishimura S. 2000. Catechin acts an infection-inhibiting factor in strawberry leaf. Phytopathology 90(6): 595-600.
Yuhono JT. 2007. Sistem agribisnis lada dan strategi pengembangannya. Jurnal Penelitian dan Pengembangan Pertanian 26(2): 76-81.
30
LAMPIRAN
28
Lampiran 1 Diameter koloni Phytophthora capsici pada perlakuan ekstrak sirih dan kapur sirih (0,01%) pada 6 hari setelah inokulasi
Lampiran 2 Diameter koloni Phytophthora capsici pada perlakuan ekstrak uji pada 6 hari setelah inokulasi
Jenis ekstrak Diameter koloni (cm)
1 2 3 4 5 6
Sirih 2,67 5,23 6,93 8,3 9 9
Kapur sirih 2,67 5,43 7,17 8,67 9 9
Jenis ekstrak Konsentrasi (%) Diameter koloni (cm)/ HSI
1 2 3 4 5 6 Pinang 0,01 1,73 4,07 5,83 6,53 7,4 7,97 0,02 1,93 4,57 6,67 7,63 8,17 8,83 0,04 1,77 4,1 4,6 5,67 6,17 6,67 Gambir 0,01 2,23 4,53 7,57 7,87 9 9 0,02 2,3 4,43 6 7,33 8,43 9 0,04 2,2 4,9 6,87 7,83 8,33 8,77 Pinang + gambir 0,005 2,17 4,37 6,43 8,13 8,87 9 0,01 2,33 4,97 6,93 8,23 8,67 9 0,02 2,37 5,13 7,27 8,67 9 9 Campuran 0,0025 2,07 4,4 6,83 7,67 8,17 8,17 0,005 2,47 4,47 5,17 5,5 5,5 5,53 0,01 2,3 4,63 6 6 6,17 6,17 Kontrol 0 2,36 4,82 6,64 8,27 8,88 9
29
Lampiran 3 Persentase keparahan penyakit BPB akibat perlakuan pada 11 hari setelah inokulasi
Perlakuan Konsentrasi (%) Keparahan penyakit (%) 1 2 3 4 5 6 7 8 9 10 11 Pinang 0,04 0 0 18,75 28,75 52,5 75 98,75 100 100 100 100 Campuran 0,005 0 0 8,75 16,25 23,75 33,75 38,75 48,75 57,5 60 60 0,01 0 0 2,5 11,25 15 23,75 37,5 40 40 40 40 Fungisida 0,2 0 0 0 0 6,25 33,75 40 40 40 40 40 Kontrol 0 0 0 31,25 52,5 80 80 80 80 80 80 80
30
Lampiran 4 Analisis ragam pengaruh perlakuan terhadap pertumbuhan koloni P. capsici pada 6 hari setelah inokulasi
Sumber keragaman DB JK KT F Pr > F Jenis Ekstrak 3 70,3123611 23,4374537 413,86 <0,0001 Dosis Ekstrk 2 7,0489815 3,5244907 62,23 <0,0001 Jenis*Dosis 6 37,2191667 6,2031944 109,54 <0,0001 r(jenis*dosis) 24 5,4785185 0,2282716 4,03 <0,0001 w 5 942,0290156 188,4058031 3326,84 <0,0001 r(w) 10 0,8058879 0,0805888 1,42 0,1782 jenis*w 15 32,7001389 2,1800093 38,49 <0,0001 dosis*w 10 10,0937963 1,0093796 17,82 <0,0001 jenis*dosis*w 30 18,2225000 0,6074167 10,73 <0,0001 Model 105 1246,655010 11,032345 194,81 <0,0001 Galat 128 6,795840 0,056632 Total 233 1253,450850
Lampiran 5 Analisis ragam pengaruh perlakuan ekstrak uji terhadap persentase keparahan penyakit BPB pada 11 hari setelah inokulasi
Sumber keragaman DB JK KT F Pr > F Perlk 4 1,46888941 0,36722235 16,41 <0,0001 r(t) 44 0,51461555 0,01169581 0,52 0,9936 perlk*t 40 0,39404315 0,00985108 0,44 0,9985 Model 88 4,55438803 0,04647335 2,08 <0,0001 Galat 186 3,93827047 0,02237654 Total 274 8,49265850