LAPORAN PRAKTIKUM BIOTEKNOLOGI “PEMBUATAN MEDIA“
Nama : Choirun Nisa’ NIM : 125040200111015 Kelompok : Selasa, 07.30 (Minggu I) Asisten : Mukhih Bathul Husna
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS BRAWIJAYA MALANG
BAB I PENDAHULUAN 1.1 Pendahuluan
Media adalah faktor penentu dalam perbanyakan dengan kultur jaringan. Media eksplan terdiri dari berbagai macam campuran bahan yakni unsur mineral baik mikronutrient dan makronutrient, zat pengatur tumbuh, senyawa organik, vitamin, dan masih banyak lainnya. Namun perlu diingat, bahan-bahan dalam suatu media eksplan memiliki fungsi yang berbeda sehingga setiap tanaman yang akan dikulturkan komposisi bahan untuk media eksplan pun berbeda. Kita juga harus memahami jenis kontaminasi dan teknik pencegahan kontaminasi pada media eksplan, serta ciri-ciri media yang sesuai untuk perkembangan eksplan agar hasil kultur jaringan yang dilakukan berhasil.
Dalam pembuatan media dibutuhkan kesterilan alat maupun orang yang melakukan pembuatan media agar media kultur tidak terkontaminasi dengan bakteri dan jamur sehingga dalam pembuatan media kultur tidak berhasil.
1.2 Tujuan
Mengetahui proses pembuatan media untuk media kultur jaringan dan;
mengetahui komposisi bahan untuk pembuatan media kultur jaringan.
BAB II
TINJAUAN PUSTAKA
2.1 Pengartian Media MS
Media MS merupakan perbaikan komposisi media skoog terutama kebutuhan garam anorganiknya. Media MS mengandung NH4+. Kandungan N ini, 5 kali lebih tinggi dari N total yang terdapat pada media Miller,15 kali lebih tinggi dari media tembakau Hildebrant,dan 19 kali lebih tinggi dari media White. Kalium juga ditingkatkan sampai 20 mM, sedangkan P, 1.25 mM. Unsur makro lainnya konsentrasinya dinaikkan sedikit. Pertama kali unsur-unsur makro dalam media MS dibuat untuk kultur kalus tembakau,tetapi komposisi MS ini sudah umum digunakan untuk kultur jaringan jenis tanaman lain. Media MS paling banyak digunakan untuk berbagai tujuan kultur pada tahun-tahun sesudah penemuan media MS (Hendaryono, 1994). 2.2 Komposisi Media MS serta Fungsi
Media dalam kultur jaringan tanaman umumnya terdiri dari komponen-komponen sebagai berikut:
Senyawa mg/l Fungsi
NH4NO3 1650,000 Berfungsi membentuk protein, lemak, dan berbagai senyawa organik lain, morfogenesis
dan tunas), pertumbuhan dan pembentukan embrio, pembentukan embrio zigotik dan pertumbuhan vegetatif. KNO3 1900,000
CaCl2.2H2O 440,000 Berfungsi untuk pemanjangan sel tanaman, memperkuat tubuh tanaman, memperlancar metabolisme dan penyerapan
makanan, ion kalsium ditransfer secara cepat menyebrangi membran sel dan mengatur pH dan tekanan osmotik di antara sel.
MgSO4.7H2O 370,000 Berfungsi untuk meningkatkan kandungan fosfat, pembentukan protein. KH2PO4 170,000 Berfugsi untuk metabolisme energi, sebagai stabilitor membran sel, pengaturan
metabolisme
tanaman, pengaturan produksi pati/ amilum, pembentukan
karbohidrat, sangat penting dalam transfer energi, protein, dan sintesis asam amino serta konstribusi terhadap struktur dan asam nukleat.
KI 0,8300
H3BO3 6,2000
MnSO4.4H2O 22,300 Mengatur oksidasi auksin
ZnSO4.7H2O 8,600 Menjadi kofaktor ensim, biosintesis klorofil
Na2MoO4.2H2O 0,250 Kofaktor ensim, komponen dari nitrat reduktase
CuSO4.5H2O 0,025 Mengontrol jamur CoCl2.6H2O 0,025 Komponen dari
beberapa vitamin Na2EDTA 37,300 Mencegah koagulasi
dengan cara
mengikat atau mengkhelasi kalsium. FeSO4.7H2O 27,800 Berfungsi untuk
membantu asilmilasi nitrogen
Thiamin 1000 Mempercepat laju pembelahan sel Asam Nikotinat 0,500 Berfungsi penting
dalam reaksi-reaksi enzimatis.
Pyridoxin HCl (vitamin B6)
0,500
Glycine 2000 Glisin dalam media dengan konsentrasi tertentu dapat melengkapi vitamin sebagai sumber bahan organic
Asam sistein 50,000 Berfungsi sebagai antioksidan untuk mencegah atau mengurangi pencoklatan atau penghitaman eksplan. Asam pantotenat 3000
Myo- inositol 100,000 Terbukti bersinergis dengan zat pengatur tumbuh merangsang pertumbuhan jaringan yang dikulturkan Sukrosa 30.000,00 Sebagai sumber
energi
Agar 7.000,00 Sebagai pemadat media
pH 5,6-5,8 Menjaga kestabilan
sitoplasma Membantu
penyerapan unsur hara,
Mengatur sifat padat pada agar (dalam media padat)
(Marlina,2004) 2.3 Teknik aseptik Dalam Pembuatan Media
Pada prinsipnya sterilisasi dapat dilakukan dengan 3 cara yaitu secara mekanik, fisik dan kimiawi.
a. Sterilisai secara mekanik (filtrasi) menggunakan suatu saringan yang berpori sangat kecil (0.22 mikron atau 0.45 mikron) sehingga mikroba tertahan pada saringan tersebut. Proses ini ditujukan untuk sterilisasi bahan yang peka panas,misalnya larutan enzim dan antibiotik. (Machmud, 2008)
b. Sterilisasi secara fisik dapat dilakukan dengan pemanasan dan penyinaran.
Pemanasan
Pemijaran (dengan api langsung) yaitu membakar alat pada api secara langsung contoh alatnnya yaitu inokulum,pinset,batang L. Panas kering: sterilisasi dengan oven kira-kira 60-1800C. Sterilisasi panas kering cocok untuk alat yang terbuat dari kaca misalnnya erlemenyer tabung reaksi dll. Uap air panas, konsep ini mirip dengan mengukus. Bahan yang mengandung air lebih tepat menggungakan metode ini supaya tidak
terjadi dehidrasi. Uap air panas yang bertekanan dapat menggunakan autoklaf. (Machmud, 2008) Penyinaran dengan UV
Sinar Ultra Violet juga dapat digunakan untuk proses sterilisasi, misalnya untuk membunuh mikroba yang menempel pada permukaan interior Safety Cabinet dengan disinari lampu UV (Machmud, 2008).
c. Sterilisasi secara kimiawi biasannya menggunakan senyawa desinfektan antara lain alkohol (Miller et al, 1956)
Sterilisasi dengan panas
unit operasi dimana bahan dipanaskan dengan suhu yang cukup tinggi dan waktu yang cukup lama untuk merusak mikrobia dan aktivitas enzim. Sebagai hasilnya, bahan yang disterilkan akan memiliki daya simpan lebih dari enam bulan pada suhu ruang. Contoh proses sterilisasi adalah produk olahan dalam kaleng seperti kornet, sarden dan sebagainya. Perkembangan teknologi prosesing yang memiliki tujuan mengurangi kerusakan nutrien dan konponen sensoris dan juga mengurangi waktu prosesing menjadikan teknik serilisasi terus dikembangkan. Lamanya waktu sterilisasi yang dibutuhkan bahan dipengaruhi oleh:resistensi mikroorganisme dan enzim terhadap panas, kondisi pemanasan, pH bahan, ukuran wadah atau kemasan yang disterilkan, keadaan fisik bahan (Yunita, 2003) Sterilisasi dengan udara kering
Alat yang umum digunakan adalah oven. Alat ini dipakai untuk mensterilkan alat – alat gelas seprti
erlenmeyer,petridish,tabung reaksi dan alat gels lainnya (Wood,1961).
Sterilisasi dengan uap air panas
Bahan yang mengandung cairan tidak dapat disterilkan dengan oven sehingga menggunakan alat ini,alat ini disebut Arnold steam sterilizer dengan suhu 1000C dalam keadaan lembab (Yunita, 2003).
Sterilisasi dengan uap air panas bertekanan
Alat ini disebut autoklaf (autoclave) untuk sterilisasi alat ini dilengkapi dengan katup pengaman. Alat diisi dengan air kemudian bahan dimasukkan (Yunita, 2003).
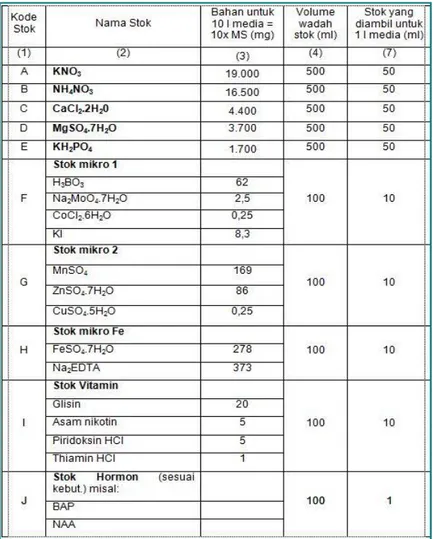
2.4 Rumus Perhitungan Larutan Stock
Cara perhitungan kebutuhan media dan larutan stok disajikan dibawah ini dan hasilnya secara lengkap pada Tabel 1 berikut ini. Tabel 1 menyajikan macam-macam larutan stok yang sebaiknya ada pada pembuatan media MS, pengelompokan bahan-bahan penyusun larutan stok, perhitungan kebutuhan bahan-bahan untuk pembuatan larutan stok per 10 liter media, ukuran volume wadah untuk tempat larutan stok, perhitungan konsentrasi masing-masing stok, dan banyaknya pengambilan (volume) larutan stok yang diambil untuk keperluan pembuatan media 1 liter (Wardiyanti, 1998).
Tabel 1. Kebutuhan Bahan Larutan Stok untuk 10 liter Media MS (10 kali pembuatan, masing-masing pembuatan 1 liter). Wardiyanti (1998) menyatakan perhitungan kebutuhan mMMedia dan larutan stok untuk melengkapi tabel di atas adalah sebagai berikut:
a) Kebutuhan bahan-bahan untuk 10 liter media MS (kolom 2) = 10 x bobot bahan-bahan media MS (mg/l) pada Tabel 1. Contoh: KNO3 = 1900 mg x 10 = 19.000 mg
b) Volume pengambilan stok untuk setiap pembuatan media 1 liter menggunakan rumus:
Keterangan :
V1 = Volume yang akan dibuat
M1 = Banyak/kebutuhan senyawa dalam media MS V2 = Volume larutan stok yang akan diambil
M2 = Banyaknya senyawa dalam larutan stok 2.5 Jenis Kontaminasi Media
Kontaminasi merupakan salah satu gangguan yang umum terjadi pada kultur jaringan. Menurut Santoso dan Nursandi (2003) tingkat kontaminasi media berbanding lurus dengan tingkat kekayaan unsur hara dalam media yaitu semakin diperkaya suatu media maka tingkat kontaminasinya juga semakin besar,demikian pula sebaliknya semakin sederhana suatu media maka tingkat kontaminasinya juga semakin kecil . Pada umumnya, kontaminasi karena jenis media disebabkan karena kontaminasi mikroorganisme dari lingkungan luar dan yang berasal dari eksplan. Oleh karena itu, jika mikroorganisme dari lingkungan luar dan eksplan tidak ada maka tidak akan terjadi kontaminasi media dan eksplan. Adapun sumber-sumber kontaminan menurut Santoso dan Nursandi (2003) dapat berasal dari :
1. Udara : kontaminan yang ada di udara dapat berupa spora bakteri atau cendawan dan umumnya banyak terdapat pada daerah yang berkelembaban tinggi.
2. Bahan tanam (eksplan) : untuk eksplan yang berasal dari tanah umumnya lebih banyak mengandung bahan kontaminan dibanding eksplan yang ada di permukaan atau pucuk. Kontaminan yang berada di permukaan eksplan dapat dibersihkan menggunakan air dan larutan pensteril. Sedangkan untuk kontaminan yang berasal dari dalam eksplan ditangani dengan penggunaan antibiotika.
3. Manusia atau pekerja : kontaminan yang berasal dari manusia dapat terbawa melalui pakaian yang dikenakan, anggota badan dan pernapasan.
4. Alat-alat yang digunakan : kontaminan dapat berasal dari peralatan yang digunakan dalam kegiatan penanaman karena proses sterilisasi yang kurang sempurna sehingga kontaminan masih melekat dalam peralatan.
5. Aquades (air steril)
Menurut Gunawan (2007) untuk mengurangi kontaminasi yang berhubungan dengan media maka sebaiknya menggunakan media ½ MS. Kontaminasi sangat beragam mulai dari jenis kontaminannya (bakteri, jamur, virus, yeast, kapang),waktu terjadinya kontaminasi (cepat, dalam hitungan jam; sedang, dalam hitungan hari; lambat, dalam hitungan minggu dan bulan), dan apa yang terkontaminasi (media atau eksplan).
Jenis kontaminasi ada dua yaitu kontaminasi eksternal dan kontaminasi internal. Kontaminasi eksternal dapat disebabkan oleh jamur dan bakteri, sedangkan kontaminasi internal umumnya disebabkan oleh bahan eksplan itu sendiri. Untuk mengatasi kontaminasi internal dapat digunakan HgCl2 karena dapat menurunkan laju kontaminasi bakteri internal tanpa merusak jaringan. Selain itu juga dapat dilakukan dengan penggunaan fungisida, HgCl2 dan klorin karena dengan penggunaan kombinasi bahan sterilan tersebut merupakan upaya sterilisasi berlapis untuk mereduksi resiko kontaminasi baik yang berasal dari cendawan, bakteri maupun kotoran-kotoran lain yang menempel pada permukaan eksplan.Sedangkan untuk pencegahan kontaminasi eksternal dapat dilakukan dengan sterilisasi kontak (Gunawan, 1987).
Gunawan (1987) menyatakan bahwa setiap bahan tumbuhan memiliki tingkat kontaminasi permukaan yang berbeda tergantung dari :
1. Jenis tumbuhannya
2. Bagian tumbuhan yng dipergunakan
3. Morfologi permukaan (misalnya berbulu atau tidak) 4. Lingkungan tumbuhnya (Green house atau lapang) 5. Musim waktu pengambilan (musim penghujan atau
musim kemarau)
6. Umur tumbuhan (seedling atau tumbuhan dewasa) 7. Kondisi tumbuhannya (sehat atau sakit)
Menurut Gunawan (1987) kontaminasi dapat berasal dari sterilisasi yang kurang sempurna, lingkungan kerja dan pelaksanaan, eksplan, serangga
atau hewan kecil yang berhasil masuk ke dalam botol kultur setelah diletakkan di ruang kultur. Beberapa hal yang dapat menyebabkan terjadinya kontaminasi yaitu proses sterilisasi yang kurang sempurna, lingkungan kerja dan pelaksanaan atau cara kerja saat penan aman, eksplan, molekul-molekul atau benda-benda asing berukuran kecil yang jatuh atau masuk ke dalam botol kultur jaringan setelah penanaman dan ketika diletakkan di ruang kultur. Adapun dari semua jenis sumber kontaminan Gunawan (1987) berpendapat bahwa kontaminan yang berasal dari eksplanlah yang paling sulit diatasi karena untuk menanggulanginya diperlukan metode sterilisasi yang selektif yaitu hanya mengeliminasi organisme mikro yang tidak diinginkan dengan gangguan seminimal mungkin terhadap bahan tanaman.
2.6 Ciri-Ciri Media yang Sesuai untuk Pertumbuhan Eksplan
Menurut Sriyanti (2002), media merupakan faktor penentu dalam perbanyakan dengan kultur jaringan. Komposisi media yang digunakan tergantung dengan jenis tanaman yang akan diperbanyak. Media yang cocok mempengaruhi pertumbuhan eksplan yang telah ditanam untuk menjadi plantet (tanaman kecil). Media yang baik, harus memenuhi syarat nutrisi yang diperlukan eksplan untuk tumbuh dan berkembang. Oleh karena itu, di dalam media kultur jaringan ditambahkan berbagai macam zat. Zat-zat organik yang biasanya ditambahkan dalam media kultur jaringan adalah sukrosa, mio inositol, asam amino, dan zat pengatur tumbuh. Zat pengatur tumbuh (hormon) yang ditambahkan juga bervariasi, baik jenisnya maupun jumlahnya, tergantung dengan
tujuan dari kultur jaringan yang dilakukan. Media yang sudah jadi ditempatkan pada tabung reaksi atau botol-botol kaca. Media yang digunakan juga harus disterilkan dengan cara memanaskannya dengan autoklaf. Sedangkan sebagai tambahan biasanya diberi zat organik lain seperti air kelapa, ekstrak ragi, pisang, tomat, toge dan lain-lain. (Sriyanti, 2002).
Menurut (Yuniastuti, 2008) Untuk memenuhi factor pertumbuhan tanaman, maka factor – factor yang harus diperhatikan dalam pembuatan media kultur jaringan yang baik adalah media yang mengandung:
1. Hara anorganik
Ada 12 hara mineral yang penting untuk pertumbuhan tanaman dan beberapa hara yang dilaporkan mempengaruhi pertumbuhan in vitro. Untuk pertumbuhan normal dalam kultur jaringan, unsur – unsur penting ini harus dimasukkan dalam media kultur.
2. Hara organik
Tanaman yang tumbuh dalam kondisi normal bersifat autotrof dan dapat mensintesa semua kebutuhan bahan organiknya. Meskipun tanaman in vitro dapat mensintesa senyawa ini, diperkirakan mereka tidak menghasilkan vitamin dalam jumlah yang cukup untuk pertumbuhan yang sehat dan satu atau lebih vitamin mesti ditambahkan ke media. Thiamin merupakan vitamin yang penting, selain itu asam nikotin, piridoksin dan inositol biasanya ditambahkan. Selain bahan organik tersebut, bahan kompleks seringkali ditambahkan, termasuk ekstrak ragi, casein hydrolysate, air kelapa, jus jeruk, jaringan pisang, dan lain – lain. Penambahan bahan kompleks ini menghasilkan media yang tak terdefinisi.
3. Sumber karbon
Tanaman dalam kultur jaringan tumbuh secara heterotrof dan karena mereka tidak cukup mensintesa kebutuhan karbonnya, maka sukrosa harus ditambahkan ke dalam media. Sumber karbon ini menyediakan energy bagi pertumbuhan tanaman dan juga sebagai bahan pembangun untuk memproduksi molekul yang lebih besar yang diperlukan untuk tumbuh. Biasanya sukrosa pada konsentrasi 1 – 5% digunakan sebagai sumber karbon tapi sumber karbon lain seperti glukosa, maltosa, galaktosa dan laktosa juga digunakan. Ketika sukrosa diautoklaf, terjadi hidrolisis untuk menghasilkan glukosa dan fruktosa yang dapat digunakan lebih efisien oleh tanaman dalam kultur.
4. Agar
umumnya jaringan dikulturkan pada media padat yang dibuat seperti gel dengan menggunakan agar atau pengganti agar sperti Gelrite atau Phytagel. Konsentrasi agar yang digunakan berkisar antara 0.7 – 1.0%. Pada konsentrasi tinggi agar menjadi sangat keras, sedikit sekali air yang tersedia, sehingga difusi hara ke tanaman sangat buruk. Agar dengan kualitas tinggi seperti Difco BiTek mahal harganya tapi lebih murni, tidak mengandung bahan lain yang mungkin mengganggu pertumbuhan. Pengganti lain seperti gelatin kadang – kadang digunakan pada lab komersial. Gel sintetis diketahui dapat menyebabkan hyperhidration (vitrifikasi) yang merupakan problem fisiologis yang terjadi pada kultur.
5. pH
media biasanya diatur pada kisaran 5.6 – 5.8 tapi tanaman yang berbeda mungkin memerlukan pH yang berbeda untuk
pertumbuhan optimum. Jika pH lebih tinggi dari 6.0, media mungkin menjadi terlalu keras dan jika pH kurang dari 5.2, agar tidak dapat memadat.
6. Zat Pengatur Tumbuh
Pada media umumnya ditambahkan zat pengatur tumbuh.
7. Air
distilata biasanya digunakan dalam kultur jaringan, dan banyak lab menggunakan aquabides (air destilata ganda).
8. Pemilihan Media
Jika tidak ada informasi awal, biasanya mulai dengan media MS (Murashige dan Skoog 1962). Media ini mengandung konsentrasi garam dan nitrat yang lebih tinggi dibandingkan media lain, dan telah sukses digunakan pada berbagai tanaman dikotil. Untuk inisiasi kalus, 2.4-D ditambahkan ke media dengan konsentrasi 1 – 5 mgL-1. Untuk multiplikasi tunas, sitokinin seperti BAP ditambahkan dan juga diberi auksin, seperti NAA pada konsentrasi yang rendah. Untuk inisiasi akar, IBA pada konsentrasi 1 – 2 mgL-1 ditambahkan.
BAB III METODOLOGI 3.1 Alat dan Bahan Fungsi
3.1.1 Alat
Indikator pH : untuk mengukur kadar pH larutan Beaker Glass : sebagai tempat larutan
Botol Kultur : sebagai tempat media kultur Microwave : mensterilkan larutan
Plastik : penutup botol kultur
Karet : untuk membantu dalam proses penutupan botol kultur
Timbangan : untuk mengukur berat bahan yang diperlukan
Pipet : untuk mengambil larutan Gelas ukur : sebagai alat untuk mengukur
volume larutan
Magnetik stirer : sebagai pengaduk larutan saat dihomogenkan
Autoclave : mensterilkan media tanam Kertas label : untuk menandai informasi botol
kultur 3.1.2 Bahan
Hara Makro : bahan nutrisi pada media tanam Hara Mikro : bahan nutrisi pada media tanam Vitamin : Sumber vitamin pada media tanam FeEDTA : bahan media tanam
HCl : menetralkan pH yang terlalu basa NaOH : meetralkan pH yang terlalu masam
Sukrosa : sumber energi bagi tanaman Agar-agar : memadatkan larutan
Aquades : melarutkan bahan 3.2 Langkah Kerja
Siapkan alat dan bahan
Pipet larutan stock (Makro: 25 ml,Mikro:2,5
ml,Vitamin: 2,5 ml, dan Fe-Na-EDTA: 2,5 ml
Dimasukkan dalam beaker gelas dan ditambahkan
aquades hingga 250 ml
Dimasukkan magnet stirer ke dalam beaker gelas
dan diletakkan pada plate magnetic stirer
Diukur pH larutan dengan ketentuan (5,8)
menggunakan kertas pH Universal,apabila pH asam
ditambahkan dengan NaOH dan apabila pH basa
ditambahkan dengan HCl
Ditambahkan agar 1,75 gram sukrosa lalu distirer
Dimasukkan microvave selama 7 menit
Distirer lagi agar lebih homogen
Dituangkan ke botol media kultur menjadi 15 botol
dan tutup botol dengan plastik ikat dengan karet
3.3 Analisa Perlakuan
Pada praktikum Bioteknologi Tanaman tentang media tanam yang harus dilakukan yaitu menyiapkan alat dan bahan. Pipet larutan makro 25 ml,mikro -2,5 ml,Fe-Na-EDTA 25 ml dan vitamin 2,5 ml dan dimasukkan ke dalam beaker gelas. Setelah itu tambahkan aquades hingga 250 ml. Kemudian di stires dan ditambahkan sukrose 7,5 gram, sukrose ini berfungsi sebagai bahan pertumbuhan, setelah homogen diukur pH nya dengan kertas lakmus. Apabila larutan asam ditambahkan NaOH, jika larutan basa ditambahkan HCl. Kemudian ditambahkan agar 1,75 ke dalam larutan, agar disini berfungsi untuk memadatkan media,
Kemudian dicampur dan dimasukkan dalam larutan dan di stirer supaya tercampur rata (homogen). Gelas tersebut ditutup dengan plastik wrap dan dilubangi setelah itu di oven dalam microwave selama 7 menit. Setelah itu langsung tuang ke dalam botol kultur yang telah bersih untuk 15 botol tiap botolnya dan ditutup dengan plastik Kemudian di masukkan autoclave selama 20 menit untuk sterilisasi dan diangkat dimasukkan dalam ruang tiga untuk diamati 2 hari sekali.
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil
No Dokumentasi Tgl pengamatan Keadaan media Keterangan 1 21 November 2013 Steril Media berbentuk padat 2 21 November 2013 Steril Media berbentuk padat 3 21 November 2013 Steril Media berbentuk padat 4 21 November 2013 Steril Media berbentuk padat 5 21 November 2013 Steril Media berbentuk padat 1 26 November 2013 Steril Media berbentuk padat2 26 November 2013 Steril Media berbentuk padat 3 26 November 2013 Steril Media berbentuk padat 4 26 November 2013 Steril Media berbentuk padat 5 26 November 2013 Steril Media berbentuk padat
BAB V KESIMPULAN
Dalam praktikum pembuatan media kultur jaringan ini didapatkan dari hasil pengamatan bahwa tidak terjadi kontaminasi pada botol berisi media. Media juga cukup baik wujudnya, yaitu padat. Wujud media yang padat merupakan media yang baik bagi penanaman khususnya tegaknya eksplan yang ditanam. Media yang tidak terkontaminasi ini berwarna putih bening dan tidak berwarna kecoklatan. Kondisi media yang steril disebabkan karena pemberian Clorox yang berfungsi mampu membersihkan mikroorganisme yang terikut dalam bahan tanam, menghilangkan pertikel-partikel tanah, debu dan lain-lain (Rismayani dan Faisal, 2010). Jika media tersebut terkontaminasi bakteri maka akan berwarna orange atau kuning (George dan de Klerk, 2008).
DAFTAR PUSTAKA
George, E.F. dan G.J. de Klerk. 2008. The Component of Plant Tissue Culture Media I: Macro and Micro Nutrients. Plant Propagation Tissue Culture 3rd Edition. Vol. 1. The Background. George, E.F, Michael A. Hill and Geert- Jan De Klerk (ed.). Springer. Netherlands.
Gunawan I. 2007. Perlakuan sterilisasi eksplan anggrek kuping gajah (Bulbophyllum beccarii Rehb.f) dalam kultur in vitro [skripsi]. Bogor : Fakultas Kehutanan IPB
Gunawan, L.W. 1987. Teknik Kultur Jaringan Tumbuhan. Laboratorium Kultur Jaringan PAU Bioteknologi. Institut Pertanian Bogor. Bogor.
Hendaryono,Daisy P.Sriyanti; dan Ari Wijayani. 1994. Teknik Kultur Jaringan. Kanisius. Yogyakarta Machmud, M. 2008. Teknik Penyimpanan dan
Pemeliharaan Mikroba. Balai Penelitian Bioteknologi Tanaman Pangan, Bogor. http://anekaplanta.wordpress.com/2008/03/02/tek nik-penyimpanan-dan-pemeliharaan-mikroba/. Diakses pada tanggal 20 November 2013.
Marlina, Nina. 2004. Teknik Modifikasi Media Murashige dan Skoog (Ms) untuk Konservasi In Vitro Mawar (Rossa spp.). Bandung : Balai Penelitian
Miller et al,1956 dalam Gunawan, 1988. Teknik dan metode dasar dalam mikrobiologi.Yogyakarta : Kanisius
Rismayani dan Faisal Hamzah. 2010. Pengaruh Pemberian Clorox (NaOCl) Pada Sterilisasi Permukaan Untuk Perkembangan Bibit
Aglaonema (Donna carmen) Secara In Vitro. Prosiding Seminar Ilmiah dan Pertemuan Tahunan PEI dan PFI XX Komisariat Daerah Sulawesi Selatan
Santoso, U. dan F. Nursandi. 2003. Kultur Jaringan Tanaman. Universitas Muhammadiyah Malang. Malang. 191 hal
Sriyanti, Daisy P. dan Ari Wijayani. 2002. Teknik Kultur Jaringan : Pengenalan dan Petunjuk Perbanyakan Tanaman Secara Vegetatif- Modern. Yogyakarta: Kanisius
Wardiyanti. 1998. Teknik kultur jaringan tumbuhan. PAU bioteknologi IPB. Bogor.
Wood & Braun,1961 dalam Gunawan, 1988.Teknik dan metode dasar dalam mikrobiologi.Yogyakarta : Kanisius
Yuniastuti, Endang. 2008. Buku Petunjuk Praktikum Kultur Jaringan . Surakarta: UNS Press.
Yunita. 2003. Cara memperbanyak tanaman secara efisien. Jakarta: Agro media.