BAGIAN PROYEK PENGEMBANGAN KURIKULUM
DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN
DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH
DEPARTEMEN PENDIDIKAN NASIONAL
KATA PENGANTAR
Pendidikan Menengah Kejuruan sebagai penyedia tenaga kerja terampil tingkat menengah dituntut harus mampu membekali tamatan dengan kualifikasi keahlian standar serta memiliki sikap dan prilaku yang sesuai dengan tuntutan dunia kerja. Sejalan dengan itu maka dilakukan berbagai perubahan mendasar di dalam penyelenggaraan pendidikan kejuruan. Salah satu perubahan tersebut adalah penerapan Sistem Pendidikan dan Pelatihan Berbasis Kompetensi.
Dalam rangka mengimplementasikan kebijakan tersebut, maka dirancang kurikulum yang didasarkan pada jenis pekerjaan dan uraian pekerjaan yang dilakukan oleh seorang analis dan teknisi kimia di dunia kerja. Berdasarkan hal itu disusun kompetensi yang harus dikuasai dan selanjutnya dijabarkan ke dalam deskripsi program pembelajaran dan materi ajar yang diperlukan yang disusun ke dalam paket-paket pembelajaran berupa modul.
Modul-modul yang disusun untuk tingkat I di SMK program keahlian Kimia Analisis dan Kimia Industri berjumlah dua belas modul yang semuanya merupakan paket materi ajar yang harus dikuasai peserta didik untuk memperoleh sertifikat sebagai laboran. Judul-judul modul dapat dilihat pada peta bahan ajar yang dilampirkan pada setiap modul.
BANDUNG, DESEMBER 2002
TIM KONSULTAN KIMIA FPTK UPI
DESKRIPSI
Modul sistem periodik ini adalah modul nomor ke enam yang harus dikuasai di Tingkat I baik untuk Analisis Kimia maupun Analisis Kimia Industri. Dalam modul ini dibahas mengenai dasar penyusunan sistem periodik unsur serta sifat keperiodikan unsur. Pembahasan materi tersebut dibagi ke dalam dua kegiatan yaitu kegiatan ke 1 membahas mengenai dasar penyusunan sistem periodik dan kegiatan ke 2 mengenai sifat keperiodikan
unsur. Di samping penjelasan mengenai konsep-konsep yang berkaitan dengan sistem
periodik, juga disajikan mengenai lembar kegiatan untuk membantu memahami konsep-konsep tersebut. Waktu untuk mempelajari modul ini, dialokasikan sebanyak 60 jam.
PRASYARAT
Untuk mempelajari modul ini, prasyarat yang harus dikuasai meliputi pengetahuan nomor atom, nomor massa , model atom, aturan penulisan konfigurasi elektron, dan elektron valensi.
PERISTILAHAN/GLOSARY
Periode : menunjukkan jumlah kulit atom unsur yang ditempati elektron
dan setiap periodik terjadi perubahan elektron secara teratur.
Golongan : kumpulan unsur-unsur yang mempunyai sifat yang sama dan
menunjukkan jumlah elektron terluar.
Jari-jari Atom : merupakan jarak antara pusat inti dengan lintasan (kulit terluar). Jari-jari Ion : jarak antara inti sampai kulit terluar pada senyawa ion.
Potensial Ionisasi : merupakan energi yang diperlukan untuk menjelaskan sebuah
elektron yang terikat paling lemah dari suatu atom netral/ion dalam keadaan gas.
Afinitas Elektron : merupakan besarnya energi yang dilepaskan bila suatu atom netral
dalam keadaan gas menerima elektron.
Keelektron Negatifan : kecenderungan atom netral dalam molekul yang stabil untuk menarik elektron.
Energi Ionisasi : energi minimum yang diperlukan untuk melepaskan satu elektron yang terikat paling lemah dari atom netral dalam keadaan gas
DAFTAR ISI
Kata Pengantar ...………… i
Deskripsi Judul ...……….. ii
Peta Kedudukan Modul ...………. iii
Prasyarat ...………. iv
Glosary ...………. vi
Daftar Isi ...………. v
Petunjuk Penggunaan Modul ...………. 1
Tujuan a. Tujuan Akhir ………. b. Tujuan Antara ……….. 1 Kegiatan Belajar 1 : Dasar Penyusunan Sistem Periodik Unsur ...……… 2
Kegiatan Belajar 2 : Sifat Keperiodikan Unsur………. 15
Lembar Evaluasi ...………… 23
Lembar Kunci Jawaban ...……….. 27
Daftar Pustaka ...……….. 28
PETUNJUK PENGGUNAAN MODUL
1. Pelajarilah matert dalam modul ini hingga benar-benar faham dan mengerti
2. Jawablah latihan-latihan yang ada, kemudian cocokkan hasil latihan Anda dengan kunci jawaban
3. Ukurlah kemampuan Anda dengan mengerjakan evaluasi, bila jawaban Anda banyak yang salah (kurang 75%), bacalah lagi modul ini dan kerjakan lagi soal-soalnya
4. Bila mengalami kesulitan dalam melakukan kegiatan mintalah bimbingan
TUJUAN
Tujuan Akhir
Setelah mempelajari modul ini, diharapkan Anda mampu menerapkan konsep unsur dan sifatnya dalam menggunakan bahan kimia.
Tujuan Antara
Setelah melaksanakan kegiatan belajar diharapkan Anda mampu: 1. Mengelompokkan unsur sampai dengan tabel periodik menurut IUPAC 1985
berdasarkan pada nomnor massa dan nomor atom
2. Menjelaskan letak unsur-unsur dalam sistem periodik berdasarkan pada konfigurasi elektron.
3. Menggolongkan unsur-unsur ke dalam logam, metaloid, dan non logam berdasarkan pada penggolongan unsur dalam tabel periodik.
KEGIATAN BELAJAR 1
DASAR PENYUSUNAN SISTEM PERIODIK UNSUR
Tujuan :
Setelah mempelajari kegiatan belajar 1 ini diharapkan Anda dapat:
1. Mengelompokkan unsur sampai dengan tabel periodik IUPAC 1985 berdasarkan pada nomnor massa dan nomor atom
2. Menjelaskan letak unsur-unsur dalam sistem periodik berdasarkan pada konfigurasi elektron
3. Menggolongkan unsur-unsur ke dalam logam, metaloid, dan non logam berdasarkan pada penggolongan unsur dalam tabel periodik
Unsur yang telah dikenal sampai saat ini sekitar 109 unsur. Untuk mempermudah dalam mempelajarinya, unsur –unsur dikelompokkan berdasarkan persamaan sifat kimianya. Penyusunan unsur-unsur yang dipelajari sekarang adalah berdasarkan sistem periodik unsur yang dikenal dengan sistem periodik panjang. Sistem periodik yang disusun Moseley merupakan pengembangan dari sistem periodik yang dikemukakan oleh Lothar Meyer dan Mendeleyef. Penjelasan mengenai sistem periodik panjang, dasar penyusunan sistem periodik panjang dan hubungan sistem periodik unsur dengan konfigurasi elektron, serta sifat – sifat keperiodikan akan diuarikan dalam modul ini.
Lembar informasi
1. Dasar Penyusunan Sistem Periodik Unsur
Gambar 1.1 Sistem Periodik Unsur
Kolom (deret) horisontal menyatakan periode dan kolom vertikal menyatakan golongan. Sistem periodik unsur terdiri atas periode dan golongan.
1.1 Periode
Periode menunjukkan jumlah kulit atom unsur yang ditempati elektron dan setiap periode terjadi perubahan elektron secara teratur.
Sistem periode unsur terdiri atas tujuh (7) periode, dengan perincian sebagai berikut.
Periode pertama terdiri atas 2 unsur, yaitu unsur hidrogen dan helium (He). Hidrogen
adalah gas yang membentuk molekul H2, sedangkan He tidak membentuk molekul, tetapi
berada sebagai atom He. He dalam keadan biasa tidak membentuk senyawa.
Periode kedua mengandung 8 unsur dari litium (Li) sampai Neon (Ne). Li merupakan logam yang sangat elektropositf, dan mudah membentuk senyawa elektropositif dan masih mempunyai sifat logam, Unsur boron tidak mempunyai sifat logam dan dapat membentuk oksida asam dengan rumus B2O3. Unsur berikutnya karbon, nitrogen, oksigen,
dan fluor merupakan unsur yang semakin elektronegatif. Unsur terakhir adalah Ne yang merupakan gas mulia.
periode 2, misalnya Na sama dengan Li bersifat logam dan Mg sama dengan Be. Periode 1, 2 , dan 3 disebut periode pendek.
Periode 4 dan 5 masing – masing terdiri atas 18 unsur. Periode 4 adalah unsur kalium (K) dan kalsium (Ca) merupakan unsur logam dan sangat elektropositif. Unsur Zn, Cu, Sc, Ti,V, Cr, Mn, Fe, Co, dan Ni merupakan unsur transisi dan bersifat logam. Unsur Ga, Ge, As, Se, Br, dan Kr merupakan unsur bukan logam dan sifat elektronegativannya semakin besar. Periode 5 adalah unsur Rb sampai Xe. Unsur Rb dan Sr bersifat logam dan elektropositif. Unsur Y sampai Cd merupakan unsur transisi, sedangkan unsur In sampai Xe adalah non logam dan sifat elektronegatifnya semakin besar. Sifat kimia dan fisika periode 3 dan 4 mempunyai sifat yang mirip.
Periode 6 terdiri atas 32 unsur, yaitu unsur Cs, La , Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg, Tl, Pb, Bi, Po, At, dan Rn. Unsur La (lantanida) terdiri atas 14 unsur. Periode 7 adalah unsur Fr sampai Bc. Unsur –unsur aktinida termasuk dalam priode ini.
1.2 Golongan
Sistem periodik terdiri atas 8 golongan A (utama) dan 8 golongan B (transisi). Unsur - unsur yang mempunyai persamaan sifat kimia diletakkan dalam satu golongan dan setiap satu golongan mempunyai elektron terluar sama (elektron valensi unsur).
Golongan IA (alkali) merupakan unsur logam kecuali hidrogen dan Fr (radioaktif). Unsur golongan IA merupakan unsur elektropositif dan sangat reaktif, sehingga unsur golongan IA tidak diperoleh dalam keadaan bebas di alam, tetapi sebagai senyawa. Golongan IA meliputi H, Li, Na, K, Rb, Cs, dan Fr.
Golongan VIIA atau halogen merupakan unsur non logam dan bersifat elektronegatif serta reaktif. Unsur gol VIIA meliputi, fluor, klor, brom, iod, dan astatin (At). Unsur golongan VIIA membentuk molekul diatomik sebagai F2, Cl2, Br2, dan I2.
Golongan gas mulia meliputi He, Ne, Ar, Kr, Xe, dan Ra. Unsur gas mulia sukar bereaksi dengan unsur lain pada suhu biasa, sehingga di alam dapat dijumpai sebagai atom unsur gas mulia.
Ø jumlah elektron di kulit terluar sama
Ø titik lebur dan titi didih tinggi
Ø jari-jari atom yang hampir sama
Ø energi potensialnya sedikit bertambah besar dengan bertambahnya nomer
atomnya
Selain itu, umumnya senyawa dari unsur transisi mempunyai warna , baik dalam
keadaan padat maupun larutan. Berikut merupakan contoh warna larutan yang mengandung ion dari unsur transisi;
Kuning : Fe 3+, CrO42- , Cr2O72-,, Au 3+, Au +
Ungu : MnO4- , Ti 3+
Biru : Cu 2+ , Cr 2+
Hijau : Fe 2+ , Ni 2+
2. Hubungan Sistem Periodik Unsur dengan Konfigurasi Elektron
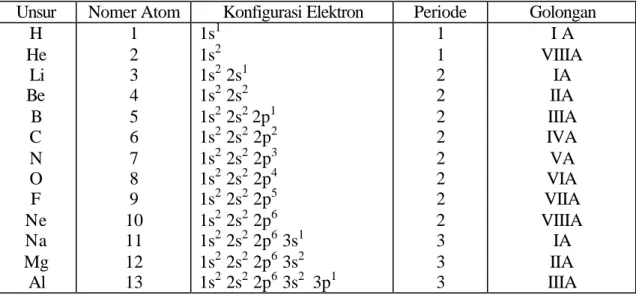
Unsur - unsur dalam sitem periodik dapat dijelaskan berdasarkan konfigurasi elektron. Penggolongan unsur pada sistem periodik dapat dubedakan berdasarkan pada pengisian elektron terakhir. Perhatikan tabel 1.1. di bawah ini.
TABEL 1.1 KONFIGURASI ELEKTRON UNSUR H SAMPAI Al
Unsur Nomer Atom Konfigurasi Elektron Periode Golongan
Berdasarkan contoh di atas dapat disimpulkan
Ø untuk golongan utama (A) jumlah kulit elektron menunjukkan periode
Ø jumlah elektron di kulit terluar (elektron valensi) atom unsur menunjukkan
golongan unsur tersebut.
Ø elektron terluar berakhir pada orbital s menunjukkan golongan IA dan IIA
kecuali He
Ø elektron terluar berakhir pada orbital p menunjukkan golongan IIIA dan VIIIA Konfigurasi elektron unsur golongan transisi (B) mempunyai konfigurasi elektron yang berbeda dengan golongan utama (A), yaitu elektron terluar sudah mulai mengisi orbital d. Sebagai contoh konfigurasi elektron unsur golongan transisi ditunjukkan pada tabel 1.2
TABEL 1.2 KONFIGURASI ELEKTROM UNSUR GOLONGAN TRANSISI
Unsur Nomer
Atom
Konfigurasi Elektron Periode Golongan
Sc Ti V Cr Mn Fe Co Ni Cu Zn Y Mo 21 22 23 24 25 26 27 28 29 30 39 42 1s2 2s2 2p6 3s2 3p6 4s2 3d1 1s2 2s2 2p6 3s2 3p6 4s2 3d2 1s2 2s2 2p6 3s2 3p6 4s2 3d3 1s2 2s2 2p6 3s2 3p6 4s1 3d5 1s2 2s2 2p6 3s2 3p6 4s2 3d5 1s2 2s2 2p6 3s2 3p6 4s2 3d6 1s2 2s2 2p6 3s2 3p6 4s2 3d7 1s2 2s2 2p6 3s2 3p6 4s2 3d8 1s2 2s2 2p6 3s2 3p6 4s1 3d10 1s2 2s2 2p6 3s2 3p6 4s2 3d10 1s2 2s2 2p6 3s2 3p6 4s2 3d104p6 5s2 4d1 1s2 2s2 2p6 3s2 3p6 4s2 3d104p6 5s2 4d4 4 4 4 4 4 4 4 4 4 4 5 5 IIIB IVB VB VIB VIIB VIIIB VIIIB VIIIB IB IIB IIIB VIB
Berdasarkan konfigurasi elektron unsur transisi (golongan B), bahwa elektron sudah mulai mengisi orbital d. Secara umum konfigurasi elektron transisi adalah . . . ns2 (n-1)d
1-10
. ; dengan n = bilangan kuantum utama . Beberapa unsur golongan B mempunyai konfigurasi yang tidak mengikuti aturan seperti Cr dengan nomer atom 24 dengan konfigurasi elektron : 1s2 2s2 2p6 3s2 3p6 4s1 3d5 , dalam sistem periodik terletak pada periode 4 golongan VIB.
mempunyai konfigurasi elektron berakhir pada orbital 4f dan unsur Aktinida mempunyai konfigurasi elektron berakhir pada orbital 5f. Sebagai contoh:
Pm (nomer atom 61) ; (Inti Xe) 6s2 4f6 5d1 , periode 6 golongan Lantanida U (nomer atom 92) : (Inti Rn) 7s2 5f3 6d1, periode 7, golongan Aktinida
Secara keseluruhan hubungan konfigurasi elektron dengan siatem periodik unsur dapat disimpulkan:
Ø Unsur golongan IA dan IIA ,konfigurasi elektron berahkir pada orbital s,
sehingga disebut blok s
Ø Unsur golongan IIIA dan VIIIA, konfigurasi elektron berahkir pada orbital p,
sehingga disebut blok p
Ø Unsur golongan transisi (B), elektron mulai mengisi orbital d, sehingga disebut blok d
Ø Unsur golongan La dan Aktinida, elektron mulai mengisi orbital f, sehingga
disebut blok f.
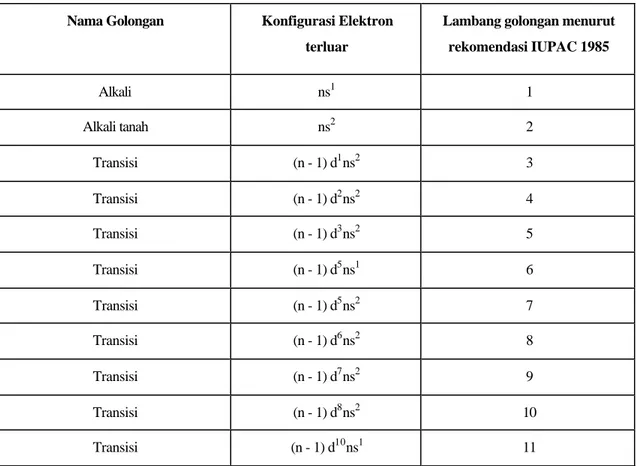
TABEL 1.3 PENGGOLONGAN UNSUR BERDASARKAN IUPAC 1985 Nama Golongan Konfigurasi Elektron
terluar
Nama Golongan Konfigurasi Elektron terluar
Lambang golongan menurut rekomendasi IUPAC 1985 Transisi (n - 1) d10ns2 12 Boron, Alumunium ns2np1 13 Karbon, Silikon ns2np2 14 Nitrogen, Fosfor ns2np3 15 Oksigen, Belerang ns2np4 16 Halogen ns2np5 17 Gas Mulia ns2np6 18
Berdasarkan pengisian elektron terakhir dari konfigurasi elektron suatu unsur, maka dapat dibedakan pula menjadi 4 blok, yaitu :
2.1. Unsur-unsur blok s, yaitu unsur-unsur yang pengisian elektronnya diakhiri pada orbital s ( Unsur-unsur blok s : n s 1,2 )
2.2 Unsur-unsur blok p, yaitu unsur-unsur dengan pengisian elektron terakhir pada orbital p ( unsur-unsur blok p : n s 2 n p 1……6 )
2.3 Unsur-unsur blok d, yaitu unsur - unsur yang pengisian elektronnya berakhir pada orbital d ( Unsur-unsur blok d : (n - 1) d 1-10 )
2.4 Unsur-unsur blok f, yaitu unsur-unsur yang pengisian elektronnya berakjir pada orbital f ( Unsur-unsur blok f : ( n-2 ) f 1…….14 (n-1) d1 n s2
Secara diagram dalam sitem periodik, digambarkan seperti gambar 1. 2. dibawah ini.
Gambar 1.2 Diagram Blok Unsur dalam Sistem Periodik
Pembagian blok unsur-unsur adalah sebagai berikut.
TABEL 1.4 PEMBAGIAN BLOK-BLOK UNSUR
Blok Golongan ( IUPAC lama ) Golongan (IUPAC
1985/baru)
S I A dan IIA 1,2
P IIIA,IVA,VA,VIA,VIIA,VIIIA 3,4,5,6,7,8,9,10
D IIIB,IVB,VB,VIB,VIIB,VIIIB,IB,IIB 11,1213,14,15,16,17,18
F Lantanida dan aktinida
3. Unsur logam , metaloid dan bukan logam
Berdasarkan berbagai sifat fisika dan kimia dari unsur-unsur dapat dikelompokan sebagai logam dan bukan logam ( perhatikan gambar 3.2). Logam mepunyai sifat seperti mengkilap, rapat, dapat ditempa, dapat dibengkokkan , dan tahan terhadap tarikan serta sebagai penghantar panas dan listrik yang baik. Logam mempunyai titik leleh tinggi, kecuali Hg yang berbentuk cair pada suhu ruang, Cs, Ga, dan Fr mempunyai titik leleh antara 25 – 30 0C.
Bukan logam mempunyai kerapatan rendah dan getas bila berda dalam keadaan padat, dan merupakan penghantar panas dan listrik yang jelek. Sebagian besar unsur bukan logam mempunyai titik leleh rendah dan berbentuk gas pada suhu ruang. Semua unsur gas mulia adalah gas. Oksigen, hidrogen, klor, nitrogen, dan fluor adalah gas.
LEMBAR KERJA 1
Tujuan : berlatih menentukan letak unsur berdasarkan konfigurasi elektronnya.
1. Perhatikan sistem periodik panjang berikut ini!
Pertanyaan 1
Berdasarkan sistem periodik di atas, lengkapi tabel berikut dan jawab pertanyaannya Lambang atom Nomor atom Konfigurasi elektron KLM Jumlah kulit Elektron
valensi Golongan Periode
Berdasarkan data pada tabel tersebut, jelaskan pengertian golongan dan periode!
Golongan : __________________________________________________________
Periode : ________________________________________
2. Konfigurasi Elektron
A. Susunlah konfigurasi electron dari unsure-unsur yang terdapat di dalam tabel berikut: Lambang Unsur Konfigurasi Elektron Elektron Valensi Lambang Unsur Konfigurasi Elektron Elektron Valensi 3Li 11Na 19K 37Rb 55Cs (He)2s1 _________ _________ _________ _________ _________ _________ _________ _________ _________ 4Be 12Mg 20Ca 38Sr 56Ba (He)2s2 _________ _________ _________ _________ _________ _________ _________ _________ _________ 9F 17Cl 35Br 53I (He) 2s22p5 _________ _________ _________ _________ _________ _________ _________ 21Sc 22V 23Ti 24Cr (Ar)4s23d1 _________ _________ _________ _________ _________ _________ _________ .
B. Pertanyaan:
1. Apakah gas yang komposisinya paling besar di atmosfer ? 2. Unsur apakah yang terkandung dalam pasta gigi?
3. Gas apakah yang diperlukan untuk pernapasan?
4. Unsur apakah yang menyebabkan air sumur menjadi keruh?
5. Senyawa apakah yang diperlukan oleh tubuh untuk keseimbangan tubuh? 6. apakah zat yang ini dipergunakan dalam pengobatan luka?
7. Unsur apakah yang dipergunakan di dalam batu batere? 8. Unsur apakah yang banyak terdapat pada batu kapur? 9. Zat apakah yang digunakan di dalam termometer?
10. Zat apakah yang bisa digunakan sebagai pembunuh kuman di kolam renang? 11. Senyawa unsur apakah yang digunakan di dalam fografi?
12. Senyawa unsur apakah yang digunakan di dalam racun tikus? 13. Logam apakah yang banyak digunakan sebagai alat rumah tangga? 14. Unsur apakah yang banyak terdapat di gunung berapi?
15. Zat apakah yang digunakan di dalam sirkuit alat-alat listrik? 16. Gas apakah yang digunakan sebagai nama lampu?
17. Unsur apakah yang diperlukan untuk petumbuhan tulang? 18. Unsur apakah yang digunakan untu pelapis logam?
19. Logam berat apakah yang merupakan pencemar dari bahan bakar bensin? 20. Logam apaka yang banyak digunakan sebagai perhiasan?
21. Senyawa unsur apakah yang digunakan sebagai perhiasan? 22. Gas apakah yang dapat digunakan untuk pengisi balon udara? 3. Blok-blok pada Sistem Periodik
Keterangan: Blok s = warna ………. Blok p = warna ………. Blok d = warna ………. Blok f = warna ………..
1. Lengkapi tabel berikut! No.
Atom
Lambang Konfigurasi Elektron Perioda Golongan Blok
KEGIATAN BELAJAR 2 SIFAT KEPERIODIKAN UNSUR
Tujuan
Mendeskripsikan sifat keperiodikkan unsur berdasarkan pada konfigurasi elektron
Lembar Informasi
Sifat unsur – unsur dalam sitem periodik terutama ditentukan berdasarkan:
Ø jumlah muatan inti dan muatan elektron
Ø jumlah kulit elektron, jarak elektron dalam berbagai kulit dan jarak antara
elektron dengan inti
Ø jumlah elektron pada kulit terluar yang sering disebut dengan elektron valensi
1. Jari – jari atom
Jari – jari atom merupakan jarak antara pusat inti dengan lintasan (kulit) terluar. Jarijari atom ini dapat ditentukan dengan sinar X, mengukur jarak inti antara dua atom yang terikat dalam ikatan kovalen tunggal, dengan jari – jari atomnya sama dengan setengah jarak antara dua inti. Unsur dalam sistem peridik, unsur pada periode sama jari – jari atom semakin ke kanan makin kecil. Hal ini disebabkan jumlah elektron berrtambah, berarti muatan inti juga bertambah, mengakibatkan tarikan inti terhadap elektron makin besar dalam kulit (lintasan elektron ) yang sama. Jadi jarak inti dengan elektron semakin dekat. Dalam satu golongan, unsur-unsur mempunyai jari – jari atom semakin besar dengan bernmabahnya nomor atom atau dari atas ke bawah.
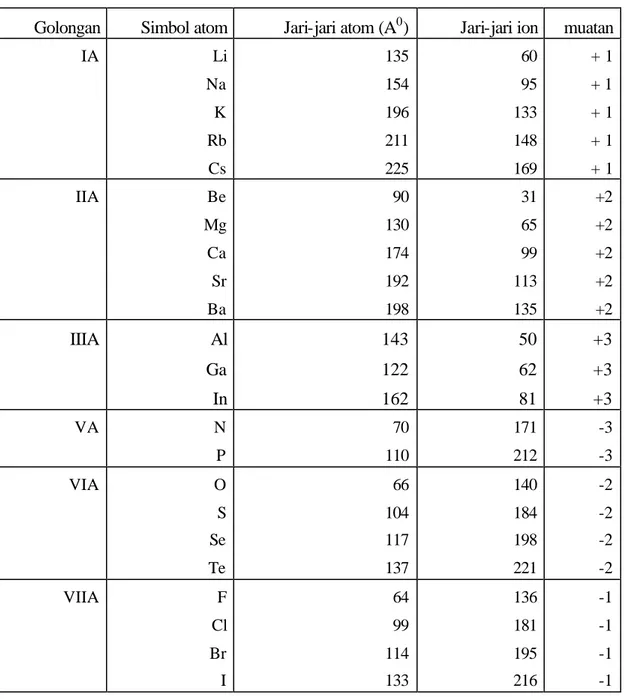
2. Jari – jari ion
TABEL 2.1 JARI-JARI ATOM DAN ION
Golongan Simbol atom Jari-jari atom (A0) Jari-jari ion muatan
IA Li Na K Rb Cs 135 154 196 211 225 60 95 133 148 169 + 1 + 1 + 1 + 1 + 1 IIA Be Mg Ca Sr Ba 90 130 174 192 198 31 65 99 113 135 +2 +2 +2 +2 +2 IIIA Al Ga In 143 122 162 50 62 81 +3 +3 +3 VA N P 70 110 171 212 -3 -3 VIA O S Se Te 66 104 117 137 140 184 198 221 -2 -2 -2 -2 VIIA F Cl Br I 64 99 114 133 136 181 195 216 -1 -1 -1 -1 3. Potensial ionisasi
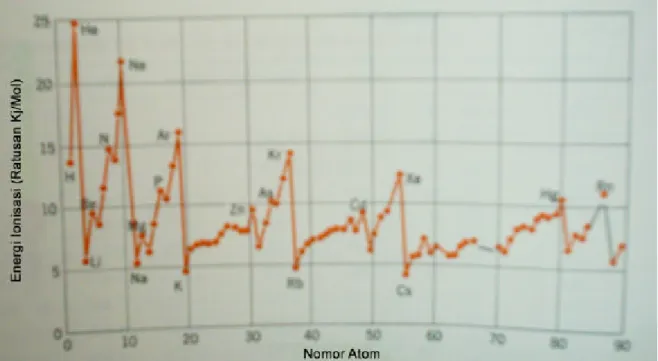
Potensial ionisasi merupakan energi yang diperlukan untuk melepaskan sebuah elektron yang terikat paling lemah dari suatu atom netral/ion dalam keadaan gas. Sebagai contoh:
Gambar 2.1 Energi Ionisasi Pertama dengan Nomor Atomnya
Gambar 2.2 Harga potensial ionsisasi
Berdasarkan gambar 2.2 dapat dijelaskan bahwa potensial ionisasi unsur dalam satu golongan makin kecil semakin ke bawah, berarti makin mudah mengion. Hal ini disebabkan gaya tarik inti terhadap elektron terluar makin lemah dengan bertambahnya jumlah kulit. Dalam satu periode makin ke kanan makin besar potensial ionisasinya. Hal ini disebabkan jarak antara inti dengan elektron terluar semakin dekat, sehingga daya tariknya semakin kuat.
4. Affinitas elektron
Affinitas elektron merupakan besarnya energi yang dilepaskan, bila suatu atom netral dalam keadaan gas menerima elektron. Sebagai contoh:
Cl (g) + e à Cl (g) - A = 349 Kj/mol
Umumnya, dalam satu periode makin ke kanan adalah makin besar affinitasnya, dan dalam satu golongan adalah makin kecil semakin ke bawah.
5. Keelektronegativitas
Keelektronegativitas adalah suatu kecenderungan atom netral dalam molekul yang stabil untuk menarik elektron. Karena elektronegativitas merupakan sifat periodik unsur, maka elektronegativitas juga bergantung pada nomer atom unsur. Daftar elektronegativitas unsur-unsur ditunjukkan pada tabel 3.4.
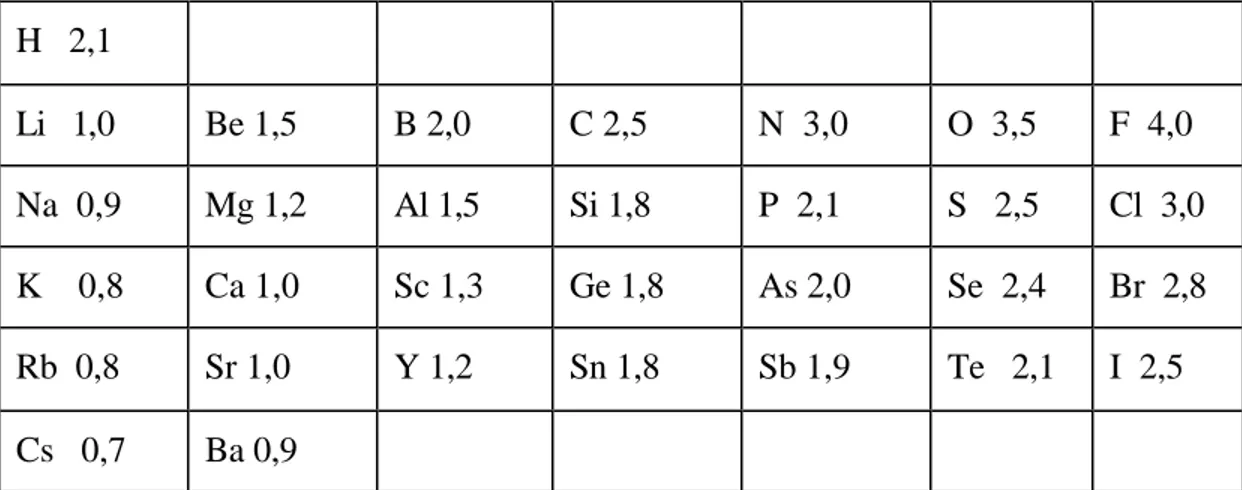
TABEL 2.2 DAFTAR ELEKTRONEGATIVITAS UNSUR H 2,1 Li 1,0 Be 1,5 B 2,0 C 2,5 N 3,0 O 3,5 F 4,0 Na 0,9 Mg 1,2 Al 1,5 Si 1,8 P 2,1 S 2,5 Cl 3,0 K 0,8 Ca 1,0 Sc 1,3 Ge 1,8 As 2,0 Se 2,4 Br 2,8 Rb 0,8 Sr 1,0 Y 1,2 Sn 1,8 Sb 1,9 Te 2,1 I 2,5 Cs 0,7 Ba 0,9
antara dua atom yang bersenyawa > 1,5, senyawa yang terbentuk berikatan ion atau elektrovalen, sedangkan perbedaan elektronegativitas < 1,5 senyawa yang terbentuk berikatan kovalen.
Umumnya, unsur logam mempunyai elektronegativitas lebih kecil daripada unsur bukan logam. Hal ini berarti atom unsur logam mudah melepaskan elektron (membentuk ion positif) dan atom unsur bukan logam lebih mudah menerima elektron atau membentuk ion negatif.
Lembar Kerja 2 1. Jari-Jari Atom
Jarak antara inti atom dengan elektron terluar disebut jari atom. Penentuan jari-jari atom, yaitu dengan mengukur jarak antara inti-inti dalam senyawa kovalen menggunakan difraksi sinar X. Untuk mengetahui keperiodikan jari-jari atom dari unsur-unsur dalam sistem periodik, amati grafik 2.2 di bawah ini!
Jari-jari atom bergantung pada jumlah kulit elektron, jumlah muatan inti, gaya tarik-menarik antara inti dengan kulit elektron terluar.
Pertanyaan
Berdasarkan gambar di atas jelaskan keperiodikan jari-jari dalam satu periode:
_________________________________________________________________________ ___________________________________________________________________
Keperiodikan dalam satu golongan:
_________________________________________________________________________ ___________________________________________________________________
2. Energi Ionisasi
Energi ionisasi pertama adalah energi minimum yang diperlukan untuk melepaskan satu elektron yang terikat paling lemah dari atom netral dalam keadaan gas. Energi ionisasi dinyatakan dalam kJ per mol. Energi ionisasi unsur-unsur dalam satu periode atau dalam satu golongan dapat kamu pelajari berdasarkan grafik energi ionisasi pertama terhadap nomor atom
Pertanyaan
Penyelesaian
Berdasarkan gambar energi ionisasi, jelaskan bagaimana perubahan energi ionisasi pertama dari unsur-unsur dalam satu periode!
___________________________________ ___________________________________ ___________________________________ ___________________________________ Jelaskan pula perubahan energi ionisasi
unsur-unsur dalam satu golongan!
3. Afinitas Elektron
Jika suatu atom netral dalam bentuk gas menangkap elektron sehingga terbentuk ion negatif, maka atom tersebut akan melepaskan energi. Contoh, atom fluor menangkap satu elektron membentuk ion fluorida akan melepaskan energi sebesar 328 kJ/mol.
F + e- F- ; ∆H = -328 kJ mol -1
Perubahan energi yang digunakan untuk penambahan elektron pada atom netral dalam keadaan gas sehingga terbentuk ion negatif, disebut afinitas elektron. Perubahan energi ini dinyatakan dengan tanda negatif karena pada proses tersebut energi dilepaskan.
Untuk mempelajari afinitas elektron, perhatikan tabel di bawah ini!
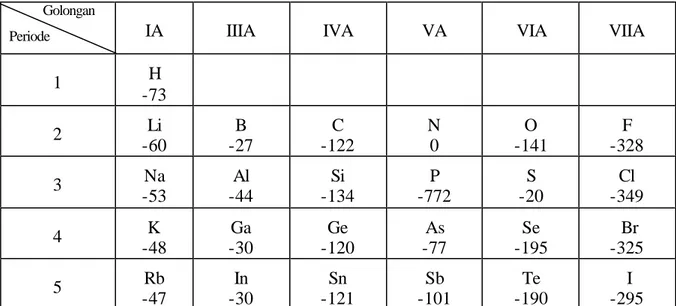
TABEL 2.3 PERUBAHAN ENERGI SUATU UNSUR
Golongan
Periode IA IIIA IVA VA VIA VIIA
1 H -73 2 Li -60 B -27 C -122 N 0 O -141 F -328 3 Na -53 Al -44 Si -134 P -772 S -20 Cl -349 4 K -48 Ga -30 Ge -120 As -77 Se -195 Br -325 5 Rb -47 In -30 Sn -121 Sb -101 Te -190 I -295 Pertanyaan
a. Berdasarkan tabel di atas, bagaimana kecenderungan harga afinitas elektron unsur-unsur dakam satu golongan?
4. Keelektronegatifan
Skala keelektronegatifan menunjukkan kecenderungan dari atom netral dalam molekul yang stabil menarik elektron untuk digunakan bersama. Skala ini dikenal dengan besaran elektronegatifitas atau keelektronegatifan. Perhatikan tabel keelektronegatifan
a. Berdasarkan data tabel di atas besaran keelektronegatifan dalam 1) Satu periode ___________________________________________________________________ ___________________________________________________________________ ___________________________________________________________________ 2) Satu golongan ___________________________________________________________________ ___________________________________________________________________ ___________________________________________________________________ ___________________________________________________________________
b. Jika unsur A lebih elektronegatif daripada unsur B, tentukan ke arah mana pasangan elektron akan tertarik dalam senyawa AB
LATIHAN 2
1. Pasangan unsur berikut tunjukkan unsur yang mempunyai: jari-jari atom terbesar, energi ionisasi terbesar.
a. Na dan P b. Li dan Cs c. As dan F d. Sr dan Si e. Fe dan Br f. Ca dan Mg g. Al dan F h. Pb dan N
2. Pasangan unsur berikut tunjukkan yang mempunyai elektronegativitas lebih besar a. Na dan Cl b. Fe dan Br c. Ca dan O d. Br dan F
LEMBAR EVALUASI
1. Dalam sistem periodik, unsur-unsur transisi dalam mulai dijumpai sejak peride ke….
A. 3 D. 6
B. 4 E. 7 B. 5
2. Bertambahnya kereaktifan unsur-unsur alkali menurut urutan Li, Na, K, Rb dan Cs disebabkan oleh bertambahnya
A. jumlah elektron D. massa atom
B. nomor atom
C. jari-jari atom E. jumlah proton
3. Dalam urutan unsur-unsur 15P 16S 17Cl harga energi ionisasi akan….
A. naik D. naik lalu turun
B. turun E. turun lalu naik
C. sama besar
4. Unsur dengan struktur elektron [Xe] 6s2 4f14 5d10 6p3 termasuk golongan
A VA B. VB C. IIIA D. IIIB E. lantanoida
5.Di bawah ini tercantum harga jari-jari aton unsur alkali dari Li sampai Cs. Manakah harga jari-jari atom natrium?
A. 135 pm B. 211 pm C 196 pm D. 225 pm E. 154 pm
Untuk menjawab soal nomor 7 sampai 12, pergunakanlah sisitem periodik di bawah ini, di mana unsur-unsur ditandai dengan kode-kode huruf.
IA IIA IIIA IVA VA VIA VIIA VIIIA Periode ke-2 H I … K L M N O P Periode ke-3 Q R … S T U V W X Periode ke-4 Y Z … A B C D E F
6.Unsur yang memiliki tiga elektron di kulit terluar adalah
7. Unsur yang termasuk logam alkali adalah
A K B. Q C. I D X E. L
8. Unsur yang paling mudah menarik elektron adalah
A. P B. F C. O D. Y E. H
9. Energi ionisasi terbesar dimiliki oleh unsur
A. P B. F C. H D O E Y 10. Dua unsur yang memiliki sifat yang sama adalah ….
A. O dan F D. N dan P
B. H dan I E M dan C
C. R dan S
11.Unsur dengan konfigurasi elektron
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d8 5s2 terletak dalam periode dan golongan ….
A. 4 dan IIA D. 5 dan IIA
B. 5 dan II B E. 5 dan VIIIB
C. 4 dan IIB
12. 15,6 gram logam monovalen (bervalensi satu) dilarutkan dalam larutan HCl, menghasilkan 4,48 liter gas (STP).
Jika atom logam tersebut mengandung 20 netron, kedudukan logam itu dalam sistem periodik adalah periode dan golongan ke ….
A. 3 dan IA D. 4 dan IB
B. 4 dan IA E. 4 dan IIA
C. 3 dan IB
13.Jika seandainya satu orbital dapat menampung tiga elektron, manakah konfigurasi elektron gas mulia?
A. 1s3 2s3 2p9 C. 1s3 2s3 2p3
B. 1s3 2s3 2p4 D. 1s3 2s3 2p6 E 1s3 2s3 2p6
14. Atom dengan susunan elektron manakah yang mempunyai energi ionisasi paling tinggi?
a. 1s1 D. 1s2 2s2
b. 1s2 E 1s2 2s2 2p1
15.Sifat berikut yang tidak merupakan sifat periodik adalah
A. energi ionisasi D. warna
B. titik lebur E. keelektronegatifan
b. jari-jari atom
16. Nomor atom salah satu unsur golongan VIA adalah
A. . 6 B. 12 C. 18 D. 20 E. 34
17. Manakah unsur-unsur berikut yang tersusun berdasarkan naiknya harga keelektronegatifan? A. F, Cl, Br D. Br, F, Cl B. F, Br, Cl E. Cl, Br, F C. Br, Cl, F 18. VIA VIIA Periode ke-3 Periode ke-4 S Se Cl Br Unsur-unsur yang tersusun menurut naiknya jari-jari atom adalah
A. S, Cl, Se D. Cl, Br, S
B. Cl, S, Se
C. Se, Br, Cl E. S, Cl, Br
19. Kelompok unsur di bawah ini yang paling baik menggambarkan perubahan sifat dari logam ke bukan logam adalah….
A. F, Cl, Br, I, At D. Be, Mg, Ca, Sr, Ba
B. Li, Na, K, Rb, Cs E. He, Ne, Ar, Kr, Xe
C. Mg, Al, Si, P, S
20. Sifat logam yang paling kuat di antara unsur-unsur berikut dimiliki oleh ….
A. alumunium D.. kalsium
B. natrium E. kalium
21. Letak golongan unsur dalam sistem periodik ditentuklan oleh jumlah
a. jumlah elektron valensi d. jumlah kulit elektron
b. struktur elektron valensi e. massa atom unsur
c. bilangan kuantum elektron valensi
22. Suatu unsur dengan nomor atom 13 mempunyai sifat kimia yang sama dengan unsur yang bernomor atom
a. 21 b. 24 c. 28 d. 31 e. 35
23. Diketahui nomor atom F, Ne, dan Na masing-masing adalah 9, 10, dan 11. Manakah pernyataan di bawah ini yang benar?
a. Jari-jari atom fluor lebih besar dari jari-jari ion F -b. Jari-jari atom natrium lebih kecil dari jari-jari ion F -c. Jari-jari ion Na+ lebih besar dari jari-jari atom natrium a. Jari-jari atom fluor lebih kecil dari jari-jari atom neon b. Jari-jari atom neon lebih besar dari jari-jari ion Na+ 24. Penggolongan unsur di bawah ini yang tidak benar adalah
a. natrium termasuk logam alkali b. besi termasuk unsur transisi c. radium termasuk gas mulia d. brom termasuk halogen
e. stronsium termasuk logam alkali tanah 25. Periode kelima sistem periodik terdiri dari
a. 2 unsur d. 32 unsur
b. 8 unsur e. 50 unsur
DAFTAR PUSTAKA
Brady, James E , 1990, General Chemistry, Principle & Structur, Fifth Edition. New York : John Willy & Son
Moris Jane, 1986, GCSE Chemistry, Deel & Hymon
Petrucci Ralph, 1982, General Chemistry, Principles and Modern Application Third Edition, London: Macmillan Publishing Co .