LAPORAN PRAKTIKUM
KIMIA ORGANIK
Acara:
II
Karbohidrat
Disusun oleh:
Nama
: Yunisha Febriani
No. Mhs
: 140801460
Hari/Tanggal
: Jumat, 27 Maret 2015
Asisten
: Elviena Novita Wibowo
LABORATORIUM TEKNOBIO PANGAN
FAKULTAS TEKNOBIOLOGI
KREDIT NILAI LAPORAN
Lembar Pengesahan - -
-PENDAHULUAN
III HASIL DAN PEMBAHASAN 40
I. PENDAHULUAN
A. Judul Karbohidrat
B. Tujuan
II. TINJAUAN PUSTAKA
1. Karbohidrat
Karbohidrat adalah salah satu dari tiga substansi penghasil energi utama yang kita konsumsi, sedangkan dua lainnya adalah lemak dan protein. Tanpa karbohidrat, kita akan kelaparan dan mati. Pada makhluk hidup, hampir 90 persen terdiri dari karbohidrat, dan diperkirakan 70 hingga 80 persen dari semua kalori yang dikonsumsi manusia di seluruh dunia adalah karbohidrat ini (Hyman, 2006). Menurut Suhardjo dan Kusharto (1992), fungsi utamanya adalah menyediakan keperluan energi tubuh, selain itu karbohidrat juga mempunyai fungsi lain yaitu karbohidrat diperlukan bagi kelangsungan proses metabolisme lemak.
Nama karbohidrat dikemukakan pertama kali oleh para ahli kimia Perancis. Nama tersebut diberikan untuk golongan senyawa-senyawa organik yang tersusun atas unsur karbon, hidrogen, dan oksigen; dalam senyawa-senyawa ini, dua unsur yang terakhir mempunyai perbandingan 2:1, seperti perbandingan hidrogen dan oksigen pada air. Mereka menganggap senyawa-senyawa ini merupakan hidrat dari karbon yang mempunyai rumus perbandingan Cn(H2O)m;
n=m atau kelipatan urutan bilangan bulat seterusnya, misalnya glukosa adalah C6H12O6 atau laktosa adalah C12H22O11. Akhirnya, pada tahun 1880-an disadari
bahwa anggapan “hidrat dari karbon” merupakan anggapan yang keliru, dan karbohidrat sebenarnya adalah polihidroksi aldehida atau polihidroksi keton atau turunan dari keduanya. Sakarida atau zat gula adalah nama yang sering dipakai sebagai pengganti nama karbohidrat. (Sumardjo, 2009).
2. Pengelompokkan Karbohidrat a. Monosakarida
Menurut Campbell, dkk. (2002), monosakarida (dari bahasa Yunani monos, berarti “tunggal”, dan sacchar, berarti “gula”) umumnya memiliki rumus molekul yang merupakan beberapa kelipatan CH2O. Gula
paling umum, memiliki peran penting utama dalam kimia kehidupan. Sifat umum dari monosakarida adalah larut air, tidak berwarna, dan berbentuk padat kristal. Berikut adalah gambar contoh golongan monosakarida:
Gambar 1. Struktur Gula Aldosa dan Ketosa b. Disakarida
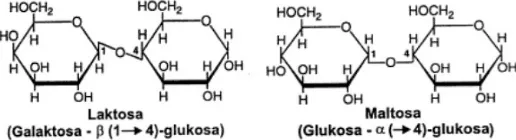
Menurut Marks, dkk. (2000), suatu disakarida mengandung dua monosakarida yang disatukan oleh sebuah ikatan O-glikosidat. Disakarida yang paling sering dijumpai adalah maltosa, laktosa, dan sukrosa. Disakarida mempunyai sifat larut dalam air, sedikit larut dalam alkohol dan praktis tak larut dalam eter dan pelarut organik non-polar. Maltosa terdiri dari 2 unit glukosa yang disatukan ikatan α (1-4). Pada laktosa, terdapat penyatuan sebuah galaktosa dan sebuah glukosa oleh ikatan β (1-4). Berikut adalah gambar struktur kimia maltosa dan laktosa:
c. Oligosakarida
Oligosakarida adalah polimer sederhana yang terdiri dari dua sampai enam monosakarida (Stansfield, dkk. 2006). Oligosakarida termasuk karbohidrat sederhana, yang banyak dikonsumsi dalam bentuk minuman ringan, biskuit, gula-gula/bonbon, dan produk susu (Silalahi, 2010). Oligosakarida tersusun atas sedikit (“oligos”) satuan atau unit monosakarida. Unit-unit penyusun oligosakarida dapat sama, tetapi dapat juga berbeda dan umumnya tersusun atas 2-6 satuan monosakarida. Oligosakarida berupa zat padat berbentuk kristal yang dapat larut dalam air. Oligosakarida yang terdapat di alam adalah disakarida, trisakarida, dan tetrasakarida. (Sumardjo, 2009).
d. Polisakarida
Polisakarida adalah polimer yang tersusun atas sejumlah besar monosakarida yang bertautan melalui ikatan glikosidik. Fungsi utamanya adalah sebagai komponen struktural atau sebagai bentuk penyimpanan energi (Kuchel dan Ralston, 2006). Pada umumnya polisakarida mempunyai molekul besar dan lebih kompleks daripada monosakarida dan disakarida. Biasanya tidak larut dalam air, dalam larutan biasa berbentuk koloid, serta tidak mempunyai rasa manis. Umumnya polisakarida berupa senyawa berwarna putih dan tidak berbentuk kristal, tidak mempunyai rasa manis, dan tidak mempunyai sifat mereduksi. Beberapa polisakarida yang penting adalah amilum, glikogen, dan selulosa (Marzuki, dkk. 2010).
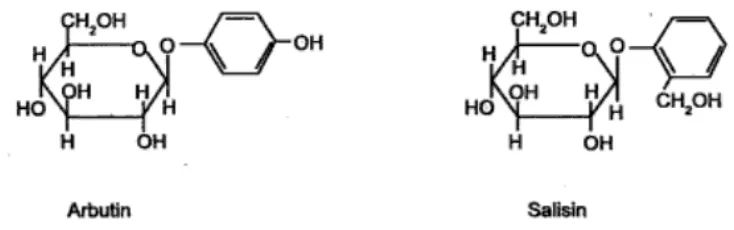
e. Glikosida
glikon dan aglikon penyusunnya. Beberapa glikosida telah banyak dikenal, seperti arbutin, salisin, amigdalin, indikan, dan floridzin. Berikut adalah contoh gambar struktur kimia arbutin dan salisin:
Gambar 3. Struktur Arbutin dan Salisin
3. Sampel yang Diujikan a. Sukrosa
Menurut Marzuki, dkk. (2010), disakarida sukrosa adalah gula pasir yang kita kenal sehari-hari. Selain terdapat pada tebu dan bit, sukrosa juga ditemukan pada tumbuhan lain seperti buah nanas dan wortel. Hidrolisis dengan enzim sukrase, sukrosa akan terpecah dan menghasilkan satu molekul glukosa dan satu molekul fruktosa. Sukrosa digunakan sebagai zat pemanis secara langsung dan untuk mengawetkan buah dalam kaleng. Berikut adalah gambar senyawa kimia dari sukrosa:
Gambar 4. Struktur Sukrosa b. Fruktosa
termanis yang terdapat dalam madu dan buah-buahan bersama glukosa. Fruktosa dapat terbentuk dari hidrolisis suatu disakarida yang disebut sukrosa. Sama halnya seperti glukosa, fruktosa adalah suatu gula pereduksi. Berikut adalah gambar struktur kimia dari fruktosa:
Gambar 5. Struktur Fruktosa c. Glukosa
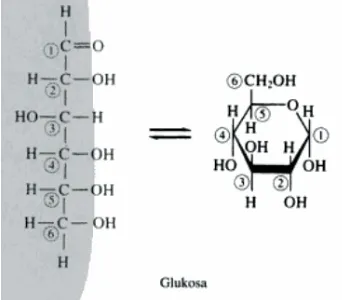
Glukosa adalah monosakarida berkarbon enam (heksosa) yang digunakan sebagai sumber dasar energi oleh kebanyakan sel heterotrofik (Kuchel dan Ralston, 2006). Glukosa merupakan pusat dari semua metabolisme. Glukosa adalah bahan bakar universal bagi sel manusia dan merupakan sumber karbon untuk sintesis sebagian besar senyawa lainnya (Marks, dkk., 2000). Menurut Fried dan Hademenos (2006), berikut adalah gambar struktur kimia dari glukosa:
d. Maltosa
Maltosa merupakan suatu disakarida yang dibentuk melalui penyatuan dua molekul glukosa. Juga dikenal sebagai gula malto, maltosa merupakan bahan untuk pembuatan bir (Campbell, dkk., 2002). Maltosa terbentuk ketika pati terhidrolisis oleh enzim amilase atau diastase. Gula malt yang digunakan secara komersial mengandung maltosa yang pada proses hidrolisis asam akan menghasilkan dua molekul D-glukosa (Talwar dan Srivastava, 2006).
e. Amilum
Pati atau amilum adalah karbohidrat kompleks yang tidak larut dalam air, berwujud bubuk putih, tawar dan tidak berbau. Pati merupakan bahan utama yang dihasilkan oleh tumbuhan untuk menyimpan kelebihan glukosa (sebagai produk fotosintesis) dalam jangka panjang. Pati adalah suatu polisakarida yang mengandung amilosa dan amilopektin. Amilosa merupakan polisakarida berantai lurus bagian dari butir-butir pati yang terdiri atas molekul-molekul glukosa yang terikat satu sama lain melalui ikatan α-1,4-glikosidik (Nasution, 2011).
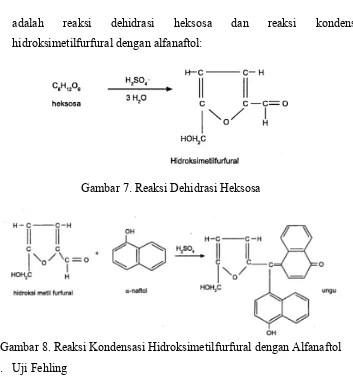
4. Uji Kualitatif Karbohidrat a. Uji Molisch
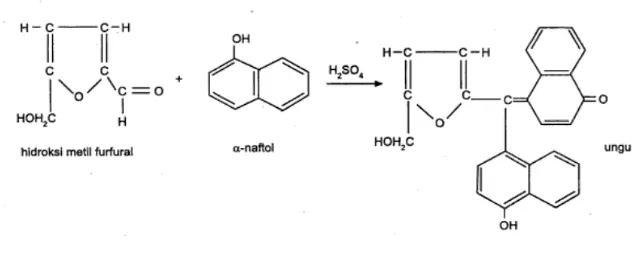
adalah reaksi dehidrasi heksosa dan reaksi kondensasi hidroksimetilfurfural dengan alfanaftol:
Gambar 7. Reaksi Dehidrasi Heksosa
Gambar 8. Reaksi Kondensasi Hidroksimetilfurfural dengan Alfanaftol b. Uji Fehling
Gambar 9. Reaksi Karbohidrat Pereduksi dengan Pereaksi Fehling
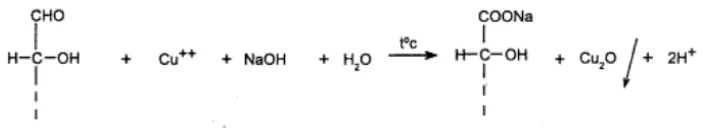
Dalam reaksi ini, karbohidrat pereduksi akan diubah menjadi asam onat, yang membentuk garam karena adanya basa, sedangkan pereaksi Fehling akan mengalami reduksi sehingga tembaga bermartabat dua berubah menjadi tembaga bermartabat satu.
c. Uji Iod
Pati yang berikatan dengan Iodine (I2) akan menghasilkan warna biru.
Sifat ini dapat digunakan untuk menganalisis adanya pati. Hal ini disebabkan oleh struktur molekul pati yang bentuknya spiral, sehingga akan mengikat molekul iodine dan terbentuklah warna biru (Winarno, 1984). Menurut Febrianti, dkk. (2013), mekanisme iodium dan amilum membentuk kompleks amilum-iodium yang ditandai dengan terbentuknya warna biru adalah sebagai berikut:
Amilum + I2 → I-amilum (biru)
(Febrianti, dkk., 2013) Percobaan uji iodium ini bertujuan untuk memisahkan antara polisakarida, monosakarida dan disakarida. Iodium memberikan warna kompleks dengan polisakarida. Amilum memberikan warna biru pada iodium, sedangkan glikogen dan tepung yang sudah dihidrolisis sebagian (eritrodekstrin) memberikan warna merah sampai coklat dengan iodium. (Zubaidah, 2013). d. Uji Moore
Uji Moore bertujuan untuk mengetahui adanya gugus aldehid. Reaksi ini disebut juga reaksi pendamaran. Uji moore menggunakan NaOH (alkali/basa) yang berfungsi sebagai sumber ion OH- (alkali) yang akan
e. Hidrolisa
Menurut Keenan, dkk. (1984). pemecahan (hidrolisis) molekul gula, pati, dan selulosa yang kompleks menjadi molekul monosakarida mudah dilakukan dalam laboratorium dengan mendidihkan larutan atau suspensi karbohidrat tersebut dengan larutan encer asam disebut hidrolisa. Berikut adalah gambar contoh reaksi hidrolisa dari disakarida:
Gambar 10. Reaksi Hidrolisa Disakarida f. Uji Luff
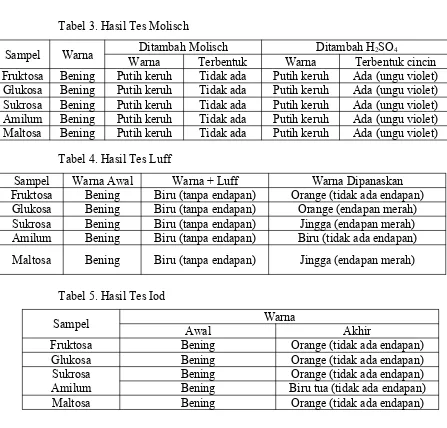
Uji ini digunakan untuk membedakan mana yang termasuk monosakarida, oligosakarida, dan polisakarida dan untuk mengetahui kemampuan mereduksi sakarida terhadap ion. Pada fruktosa dan laktosa akan terjadi reduksi Cu2+ menjadi Cu+ membentuk Cu
2O. Larutan Luff
III. METODE
1. Cara Kerja Uji Fehling
NaOH 10% sebanyak 4 tetes. Larutan sampel kemudian dipanaskan hingga mendidih, kemudian diamati dan dicatat bila ada perubahan warna atau terbentuk endapan.
2. Cara Kerja Uji Moore
Diambil lima sampel (fruktosa, glukosa, sukrosa, maltosa, amilum) kemudian masing-masing dimasukkan ke dalam tabung reaksi sebanyak 5ml. Setiap sampel kemudian ditambah dengan larutan NaOH 10% sebanyak 5ml. Sampel kemudian dipanaskan. Diamati dan dicatat perubahan warna yang terjadi dan terbentuk endapan atau tidak. 3. Cara Kerja Hidrolisa
Diambil lima sampel (fruktosa, glukosa, sukrosa, maltosa, amilum) kemudian masing-masing dimasukkan ke dalam tabung reaksi sebanyak 5ml. Masing-masing sampel ditambahkan dengan larutan H2SO4 10%
sebanyak 1ml, kemudian dipanaskan dan didinginkan. Setelah didinginkan, setiap sampel ditambahkan dengan larutan NaOH 10% sebanyak 2ml serta indikator PP sebanyak 2 tetes. Sampel juga
ditambahkan dengan larutan Fehling A dan B masing-masing sebanyak 2ml. Sampel kembali dipanaskan dan diamati perubahan warna serta endapan yang terbentuk.
4. Cara Kerja Uji Iod
Diambil lima sampel (fruktosa, glukosa, sukrosa, maltosa, amilum) kemudian masing-masing dimasukkan ke dalam tabung reaksi sebanyak 5ml. Setiap sampel kemudian ditambah dengan larutan iod sebanyak 5 tetes. Sampel diamati dan dicatat perubahan warnanya.
5. Cara Kerja Uji Molisch
Diambil lima sampel (fruktosa, glukosa, sukrosa, maltosa, amilum) kemudian masing-masing dimasukkan ke dalam tabung reaksi sebanyak 5ml. Setiap sampel ditambahkan dengan Reagen Molisch sebanyak 2ml, kemudian divortex. Masing-masing sampel yang telah divortex
lewat dinding tabung reaksi. Diamati dan dicatat perubahan warna serta terbentuk cincin atau tidak.
6. Cara Kerja Uji Luff
Diambil lima sampel (fruktosa, glukosa, sukrosa, maltosa, amilum) kemudian masing-masing dimasukkan ke dalam tabung reaksi sebanyak 5ml. Setiap sampel ditambahkan dengan Reagen Luff sebanyak 2ml. Sampel kemudian dipanaskan dan diamati perubahan warna serta terbentuk endapan atau tidak.
IV. HASIL DAN PEMBAHASAN
A. Hasil
Berdasarkan percobaan yang dilakukan, berikut di bawah ini adalah tabel hasil Tes Fehling pada tabel 1, Tes Moore pada tabel 2, tes Molisch pada tabel 3, Tes Luff pada tabel 4, Tes Iod pada tabel 5, dan Tes Hidrolisa pada tabel 6:
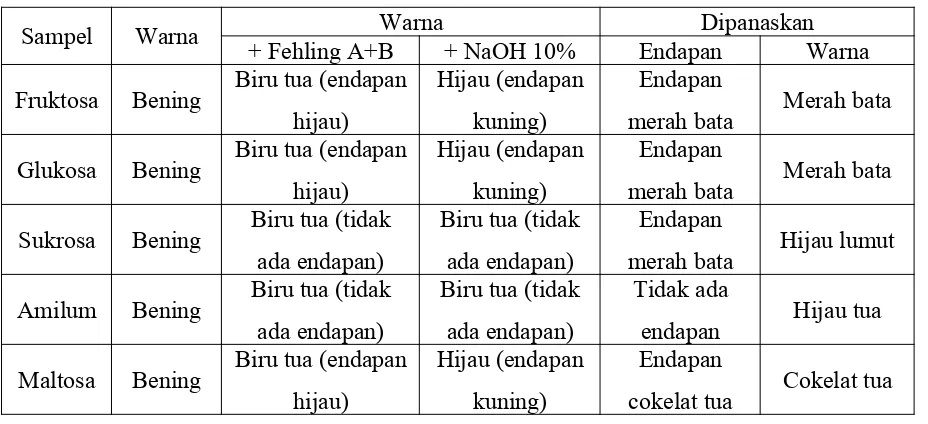
Tabel 1. Hasil Tes Fehling
Sampel Warna + Fehling A+BWarna+ NaOH 10% EndapanDipanaskanWarna
Fruktosa Bening Biru tua (endapan hijau)
Hijau (endapan kuning)
Endapan
merah bata Merah bata
Glukosa Bening Biru tua (endapan hijau)
Hijau (endapan kuning)
Endapan
merah bata Merah bata
Sukrosa Bening Biru tua (tidak ada endapan)
Biru tua (tidak ada endapan)
Endapan
merah bata Hijau lumut
Amilum Bening Biru tua (tidak ada endapan)
Biru tua (tidak ada endapan)
Tidak ada
endapan Hijau tua
Maltosa Bening Biru tua (endapan hijau)
Hijau (endapan kuning)
Endapan
cokelat tua Cokelat tua
Tabel 2. Hasil Tes Moore
Sukrosa Bening Tanpa endapan (bening) Tidak ada Kuning muda Amilum Bening Tanpa endapan (bening) Tidak ada Kuning pekat Maltosa Bening Tanpa endapan (bening) Tidak ada Orange kemerahan
Tabel 3. Hasil Tes Molisch
Sampel Warna Ditambah Molisch Ditambah H2SO4
Warna Terbentuk Warna Terbentuk cincin Fruktosa Bening Putih keruh Tidak ada Putih keruh Ada (ungu violet) Glukosa Bening Putih keruh Tidak ada Putih keruh Ada (ungu violet) Sukrosa Bening Putih keruh Tidak ada Putih keruh Ada (ungu violet) Amilum Bening Putih keruh Tidak ada Putih keruh Ada (ungu violet) Maltosa Bening Putih keruh Tidak ada Putih keruh Ada (ungu violet)
Tabel 4. Hasil Tes Luff
Sampel Warna Awal Warna + Luff Warna Dipanaskan Fruktosa Bening Biru (tanpa endapan) Orange (tidak ada endapan)
Glukosa Bening Biru (tanpa endapan) Orange (endapan merah) Sukrosa Bening Biru (tanpa endapan) Jingga (endapan merah) Amilum Bening Biru (tanpa endapan) Biru (tidak ada endapan) Maltosa Bening Biru (tanpa endapan) Jingga (endapan merah)
Tabel 5. Hasil Tes Iod
Sampel Warna
Awal Akhir
Fruktosa Bening Orange (tidak ada endapan) Glukosa Bening Orange (tidak ada endapan) Sukrosa Bening Orange (tidak ada endapan) Amilum Bening Biru tua (tidak ada endapan) Maltosa Bening Orange (tidak ada endapan)
Warna
Hidrolisa + Fehling A + Fehling B
+ NaOH 10%
Fruktosa Bening Cokelat Hijau
kekuningan Bening Merah bata Orange
Glukosa Bening Hitam Hijau
kekuningan Bening Merah bata Orange Sukrosa Bening Abu-abu Kuning Bening Merah bata Orange
Amilum Bening Biru
keunguan Biru tua Bening Tidak ada Orange Maltosa Bening Hitam Hijau Bening Merah bata Orange
B. Pembahasan 1. Karbohidrat
Karbohidrat disebut juga zat pati atau zat tepung atau zat gula yang tersusun dari unsur Karbon (C), Hidrogen (H), dan Oksigen (O). Di dalam tubuh karbohidrat akan dibakar untuk menghasilkan tenaga atau panas. Satu gram karbohidrat akan menghasilkan empat kalori. Menrurt besarnya molekul karbohidrat dapat dibedakan menjadi tiga, yaitu: monosakarida, disakarida, dan polisakarida (Sigit, 2012).
2. Sampel
Menurut Marzuki, dkk. (2010), disakarida sukrosa adalah gula pasir yang kita kenal sehari-hari. Selain terdapat pada tebu dan bit, sukrosa juga ditemukan pada tumbuhan lain seperti buah nanas dan wortel. Hidrolisis dengan enzim sukrase, sukrosa akan terpecah dan menghasilkan satu molekul glukosa dan satu molekul fruktosa. Sukrosa digunakan sebagai zat pemanis secara langsung dan untuk mengawetkan buah dalam kaleng.
sukrosa. Sama halnya seperti glukosa, fruktosa adalah suatu gula pereduksi.
Glukosa adalah monosakarida berkarbon enam (heksosa) yang digunakan sebagai sumber dasar energi oleh kebanyakan sel heterotrofik (Kuchel dan Ralston, 2006). Glukosa merupakan pusat dari semua metabolisme. Glukosa adalah bahan bakar universal bagi sel manusia dan merupakan sumber karbon untuk sintesis sebagian besar senyawa lainnya (Marks, dkk., 2000).
Maltosa merupakan suatu disakarida yang dibentuk melalui penyatuan dua molekul glukosa. Juga dikenal sebagai gula malto, maltosa merupakan bahan untuk pembuatan bir (Campbell, dkk., 2002). Maltosa terbentuk ketika pati terhidrolisis oleh enzim amilase atau diastase. Gula malt yang digunakan secara komersial mengandung maltosa yang pada proses hidrolisis asam akan menghasilkan dua molekul D-glukosa (Talwar dan Srivastava, 2006).
Pati atau amilum adalah karbohidrat kompleks yang tidak larut dalam air, berwujud bubuk putih, tawar dan tidak berbau. Pati merupakan bahan utama yang dihasilkan oleh tumbuhan untuk menyimpan kelebihan glukosa (sebagai produk fotosintesis) dalam jangka panjang. Pati adalah suatu polisakarida yang mengandung amilosa dan amilopektin. Amilosa merupakan polisakarida berantai lurus bagian dari butir-butir pati yang terdiri atas molekul-molekul glukosa yang terikat satu sama lain melalui ikatan α-1,4-glikosidik (Nasution, 2011).
3. Tes Fehling
serta warna laurtan yang kemerahan saat pereaksi fehling ditambah gula pereduksi dan dipanaskan. Berikut adalah reaksi kimia yang terjadi:
Gambar 4.1 Reaksi Positif Uji Fehling
Larutan NaOH 10% ditambahkan ke dalam masing-masing tabung reaksi. Penambahan ini menyebabkan perubahan warna pada fruktosa, glukosa, dan maltosa menjadi hijau, sedangkan sukrosa dan amilum masih berwarna biru tua. Fungsi dari penambahan larutan NaOH 10% adalah sebagai pereaksi untuk fehling B, karena larutan fehling B yang ada terbentuk dari kalium natrium tartarat, dan untuk membentuk garam Rochelle diperlukan penambahan NaOH.
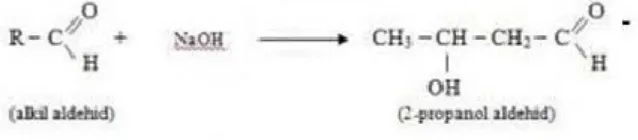
4. Tes Moore
Pada Tes Moore, warna awal dari tiap sampel adalah bening. Penambahan larutan NaOH ini bertujuan untuk memberikan sumber ion OH- yang akan berikatan dengan rantai aldehid dan membentuk aldol
aldehid yang berwarna kekuningan sebelum dipanaskan (Siswoyo, 2009). Setiap sampel dalam tabung reaksi dipanaskan hingga mendidih. Pemanasan ini berfungsi untuk membuka ikatan karbon dengan hidrogen dan menggantikannya dengan gugus OH- membentuk asam karboksilat.
Gambar 4.2 Reaksi Glukosa pada Uji Moore Reaksi antara glukosa yang bergugus aldosa + NaOH adalah:
CH2OH + NaOH CH2OH + H2O
Pada fruktosa dan maltosa terbentuk warna orange hingga orange kemerahan serta tidak ada endapan. Warna larutan yang orange hingga kemerahan mengindikasi bahwa fruktosa dan maltosa juga memiliki sedikit gugus alkali. Sukrosa dan amilum membentuk larutan berwarna kuning muda dan kuning pekat serta tidak berendapan. Hal ini menunjukkan bahwa sukrosa dan amilum memiliki gugus alkali, karena hasil positif menunjukkan warna kekuningan tak berendapan.
5. Tes Molisch
Pada Tes Molisch, larutan karbohidrat dicampur dengan pereaksi Molisch, yaitu larutan 5% α-naftol dalam alkohol, kemudian ditambah asam sulfat pekat dengan hati-hati. Warna violet yang terbentuk menunjukkan adanya karbohidrat. Dasar uji ini adalah heksosa atau pentosa mengalami dehidrasi oleh pengaruh asam sulfat pekat menjadi hidroksimetilfurfural atau furfural dan kondensasi aldehida yang terbentuk ini dengan α-naftol membentuk senyawa yang berwarna khusus untuk polisakarida dan disakarida (Sumardjo, 2009).
Larutan H2SO4 10% ditambahkan ke dalam masing-masing sampel
dalam tabung reaksi. Hal ini bertujuan agar larutan H2SO4 tidak bercampur
Molisch, semuanya menghasilkan cincin berwarna ungu dan bereaksi positif. Reaksi yang terjadi adalah:
Gambar 4.3 Reaksi Uji Molisch yang Menghasilkan Cincin Ungu
6. Tes Luff
Tes Luff bertujuan untuk membedakan monosakarida dan disakarida. Pada kelima sampel terdapat dua disakarida, yakni sukrosa dan maltosa. Hasil positif uji Luff tampak dari warna larutan yang berubah menjadi jingga dan terdapat endapan merah. Uji luff juga dilakukan untuk melihat manakah disakarida yang bersifat gula pereduksi (aldosa) (Astuti, 2014).
Berikut adalah reaksi kimianya:
Gambar 4.4 Reaksi Reagen Luff
Reagen Luff (mengandung CuSO4 dan HNO3) ditambahkan ke dalam
tiap sampel dalam tabung, serta HNO3 berfungsi untuk mengasamkan
sedangkan CuSO4 untuk memutuskan ikatan. Glukosa, fruktosa, sukrosa,
menunjukkan bahwa keempat sampel tersebut mengandung gugus aldehid. Amilum berwarna biru yang artinya negatif dan sesuai dengan teori. 7. Tes Iod
Pada tes iod tidak dilakukan pemanasan karena pemanasan akan merenggangkan spiral pada struktur amilum, sehingga molekul-molekul iod terlepas dan warna biru hilang. Amilum akan merefleksikan warna biru bila berupa polimer glukosa yang lebih besar dari 20, misal molekul amilosa. Bila polimer kurang dari 20 seperti amilopektin, maka akan dapat dihasilkan warna merah sedangkan dekstrin dengan polimer 6, 7, 8 membentuk warna coklat. Polimer yang lebih kecil dari 5 tidak akan memberikan warna dengan iodin (Winarno, 1984).
Keempat sampel yaitu glukosa, fruktosa, sukrosa, dan maltosa bereaksi negatif karena tidak mengandung amilum dan hanyalah gula monosakarida/oligosakarida saja. Amilum bereaksi positif pada uji ini karena memiliki lebih dari 20 polimer. Tes ini ditujukan untuk golongan polisakarida, dan pada bahan percobaan hanya amilum saja yang termasuk polisakarida. Reaksi kimia yang terjadi adalah sebagai berikut:
Polisakarida (Amilum) + I2 Poliodida
8. Hidrolisa
Uji hidrolisa bertujuan untuk melihat sudah atau belum terbentuknya monosakarida dari suatu sampel. Sampel yang berupa polisakarida maupun oligosakarida akan diubah menjadi monosakarida, melalui sebuah reaksi: Karbohidrat + H2SO4 pemutusan ikatan glikosidik + NaOH
Perubahan warna – Fehling test gugus aldehid mengendap. Fungsi dari penambahan larutan H2SO4 adalah untuk memutus ikatan glikosidik pada gula
non-monosakarida. Larutan dipanaskan tujuannya agar ikatan glikosidik lebih cepat diuraikan.
Larutan didinginkan tujuannya agar ketika ditambahkan NaOH 10%, larutan NaOH tersebut tidak bereaksi dengan larutan H2SO4 sehingga tidak terjadi
aldehid dalam sampel. Ketika ditambahkan larutan Fehling, warna dari sampel berubah menjadi hijau kekuningan hingga biru tua. Setelah dipanaskan, terjadi perubahan warna pada 4 sampel (glukosa, fruktosa, laktosa, maltosa) menjadi berwarna oranye serta terdapat endapan merah bata, sedangkan pada amilum warnanya tetap biru tua dan tidak ada endapan.
V. KESIMPULAN
Setelah dilakukan percobaan, maka dapat ditarik kesimpulan sebagai berikut:
1. Sifat dari monosakarida adalah larut air, tidak berwarna, dan berbentuk padat kristal. Sifat dari disakarida adalah larut dalam air, sedikit larut dalam alkohol dan praktis tak larut dalam eter dan pelarut organik non-polar. Sifat dari polisakarida adalah punya molekul besar, biasanya tidak larut dalam air, dalam larutan biasa berbentuk koloid, serta tidak mempunyai rasa manis.
DAFTAR PUSTAKA
Astuti, I.M. 2014. Kadar Protein, Gula Total, Total Padatan, Viskositas dan Nilai pH Es Krim dengan Substitusi Inulin Umbi Gembili (Dioscorea esculenta).
http://eprints.undip.ac.id/
44221/1/617_INDAH_MEGA_ASTUTI.pdf. Diakses tanggal 25 Maret 2015.
Budiman, M.S. 2009. Monosakarida.
http://kimia.upi.edu/utama/bahanajar/kuliah_web/2009/0606811/ monosak
arida.html. Diakses tanggal 22 Maret 2015.
Campbell, N.A., Reece, J.B., dan Mitchell, L.G. 2002. Biologi Edisi Kelima Jilid 1. Erlangga, Jakarta.
Febrianti, S., Hermin, S. dan Atikah. 2013. Penentuan Kadar Iodida Secara
Spektrofotometri Berdasarkan Pembentukan Kompleks Amilum-Iodium
Menggunakan Oksidator Iodat. Jurnal Kimia, 1(1): 50-56.
Hyman, Mark. 2006. Ultra Metabolisme: 7 Langkah Sehat Mengurangi Berat Badan Anda Secara Otomatis. B-First, Yogyakarta.
Keenan, C. W., Kleinfelter, D. C. dan Wood, J. H. 1984. Ilmu Kimia untuk Universitas. Erlangga, Jakarta
Kuchel, P. dan Ralston, B. 2006. Schaum’s Easy Outlines: Biokimia. Erlangga, Jakarta.
Marks, D.B., Marks, A.D., dan Smith, C.M. 2000. Biokimia Kedokteran Dasar. Buku Kedokteran EGC, Jakarta.
Marzuki, I., Amirullah, dan Fitriana. 2010. Kimia dalam Keperawatan. Pustaka As Salam, Sulawesi Selatan.
Nasution, H.D.U. 2011. Pemanfaatan Limbah Biji Mangga Arumanis.
http://repository.usu.ac.id/bitstream/handle/123456789/22586/Chapter%20 pdf;jsessionid=29E7B07B15A7D55A3EABB4FA1033F6F0? sequence=.
Diakses tanggal 24 Maret 2015.
Sigit, L. 2012. Gizi. http://eprints.uny.ac.id/8842/2/bab2%20-09604227098.pdf. Diakses tanggal 25 Maret 2015.
Silalahi, J. 2010. Makanan Fungsional. Kanisius, Yogyakarta. Siswoyo, R. 2009. Kimia Organik. Erlangga, Jakarta.
Suhardjo dan Kusharto, C.M. 1992. Prinsip-prinsip Ilmu Gizi. Kanisius, Yogyakarta.
Sumardjo, D. 2009. Pengantar Kimia: Buku Panduan Kuliah Mahasiswa Kedokteran dan Program Strata I Fakultas Bioeksakta. Buku Kedokteran
EGC, Jakarta.
Stansfield, W.D., Colome, J.S., dan Cano, J.R. 2006. Schaum’s Easy Outlines: Biologi Molekuler dan Sel. Erlangga, Jakarta.
Talwar, G.P. dan Srivastava, L.M. 2006. Textbook of Biochemistry and Human Biology. Prentice-Hall, India.
Winarno, F. G. 1984. Kimia Pangan dan Gizi. Gramedia, Jakarta. Zubaidah, N.S. 2013. Karbohidrat.
http://siti-nurul- fst12.web.unair.ac.id/artikel_detail-79177-Umum-karbohidrat.html.
LAMPIRAN
Gambar sampel awal (sebelum di tes) Gambar uji Fehling
Gambar hasil uji Moore Gambar uji Molisch
Gambar larutan ditambah reagen Molisch Gambar Hidrolisa + Fehling A