BAB III
METODE PENELITIAN
Metode penelitian yang digunakan adalah penelitian eksperimental (experimental research). Penelitian eksperimental dimaksudkan untuk mengetahui pengaruh atau hubungan antara variabel bebas dengan variabel terikat. Dalam penelitian ini yang termasuk variabel bebas adalah konsentrasi ekstrak etanol, etilasetat, n-heksana tempe dengan konsentrasi 500, 400, dan 300 mg/ml, sedang variabel terikat adalah diameter daerah hambat dalam satuan milimeter (mm).
3.1 Desain Penelitian
Penelitian yang dilakukan meliputi pengambilan dan pengolahan bahan penelitian (tempe), pembuatan ekstrak etanol, ekstrak n-heksana, ekstrak etilasetat tempe dan uji antibakteri terhadap bakteri patogen biakan murni yang disimpan di Laboratorium Mikrobiologi Fakultas Farmasi USU Medan dengan metode difusi agar menggunakan kertas cakram, bakteri yang digunakan adalah bakteri Gram positif (Bacillus subtilis ATCC 6633 dan Staphylococcus aureus ATCC 29737).
3.2 Tempat dan Waktu Penelitian
3.3 Alat dan Bahan
3.3.1 Alat-Alat yang Digunakan
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas, autoklaf (Fisons), blender (National), bola karet, eksikator, Freeze dryer (Modulio) pada lampiran 16, inkubator (Fiber Scientific), jangka sorong, jarum ose, kompor gas (Sharp), Laminar Air Flow Cabinet (Astec HLF 1200L), lemari pendingin (Toshiba), neraca kasar (Sun), neraca listrik (Vibra AJ), oven listrik (Fisher scientific), penangas air (Yenaco), pencadang kertas, petri dish, pinset, pipet mikro (Eppendorf), rotary evaporator (Buchi 461) pada lampiran 15, spektrofotometer visibel (Dynamica), dish blank (oxoid).
3.3.2 Bahan-Bahan yang Digunakan
Bahan yang digunakan pada penelitian ini adalah tempe. Bahan kimia yang digunakan kecuali dinyatakan lain adalah berkualitas pro analisis yaitu air suling dari laboratorium Analitik Kualitatif Farmasi USU, dimetilsulfoksida, etanol, etilasetat, n-heksana, kertas cakram berisi amoksisilin 30 µg/ml (Oxoid).
3.4 Penyiapan Bahan Penelitian
3.4.1 Pengambilan Bahan
Pengambilan bahan penelitian dilakukan secara purposif, yaitu tanpa membandingkan dengan bahan serupa dari tempat lain. Bahan penelitian yang digunakan ialah tempe yang diambil dari Pasar Tradisional Pringgan, Medan, Sumatera Utara pada bulan Agustus 2011, pada lampiran 1.
3.4.2 Pengolahan Bahan Penelitian
alu porselen, kemudian ditimbang beratnya. Tempe disimpan dalam wadah tertutup baik, terlindung dari cahaya matahari dan terhindar dari panas.
3.5 Pembuatan Ekstrak Tempe
Pembuatan ekstrak etanol tempe, ekstrak etilasetat tempe dan ekstrak n-heksan tempe masing-masing dilakukan sebanyak 300 g tempe yang dimemarkan dengan lumpang dan stamfer. Kemudian masing-masing dimaserasi di dalam wadah kaca berwarna gelap dengan pelarut etanol 96%, n-heksana dan etilasetat sampai seluruh tempe terendam, ditutup dan disimpan pada suhu kamar selama 5 hari dan terlindung dari cahaya, sambil sering diaduk. Kemudian disaring sehingga didapat maserat. Maserat didiamkan selama 2 hari, lalu cairan dienaptuangkan kemudian dipekatkan dengan bantuan alat rotary evaporator pada temperatur tidak lebih dari 50°C sampai diperoleh ekstrak kental, kemudian dikeringkan dengan freeze dryer (Ditjen POM, 1979).
3.6 Pengujian Antibakteri
Pengujian aktivitas antibakteri ekstrak etanol, ekstrak n-heksana dan ekstrak etilasetat tempe dengan metode difusi agar menggunakan pencadang kertas. Bakteri yang digunakan ialah bakteri Gram positif (Bacillus subtilis ATCC 6633 dan Staphylococcus aureus ATCC 29737).
3.6.1 Pembuatan Konsentrasi Ekstrak Etanol, Etilasetat, dan n-Heksana Tempe
3.6.2 Sterilisasi Alat
Alat-alat dan bahan-bahan untuk pemeriksaan mikrobiologi harus disterilkan terlebih dahulu sebelum dipakai. Alat-alat gelas disterilkan di oven pada suhu 170oC selama 1-2 jam dan alat-alat jenis lainnya disterilkan di autoklaf pada suhu 121o
3.6.3 Pembuatan Media
C selama 15 menit, jarum ose dibakar dengan lampu spiritus.
3.6.3.1 Media Nutrient Agar (NA)
Komposisi: Ekstrak daging 3 g
Pepton 5 g
Agar 15 g
Air suling sampai 1 L
Sebanyak 23 g media NA yang sudah jadi dilarutkan dalam air suling steril kemudian volumenya dicukupkan hingga 1 liter dengan bantuan pemanasan sampai semua bahan larut. Kemudian disterilkan dalam autoklaf pada suhu 121 Cara pembuatan:
o
3.6.3.2 Media Nutrient Broth (NB)
C selama 15 menit (Difco Laboratories, 1977).
Komposisi: Enzim sari gelatin 5 g Ekstrak daging 3 g Air suling sampai 1 L
disterilkan di autoklaf pada suhu 121°C selama 15 menit (Difco Laboratories, 1977).
3.6.3.3 Media Mueller Hinton Agar (MHA)
Komposisi: Ekstrak daging 3 g Asam bacto-casamino5 g
Pati 1,5 g
Bacto agar 17 g Air suling sampai 1 L
Sebanyak 38 g media MHA yang sudah jadi dilarutkan ke dalam air suling steril sedikit demi sedikit kemudian volumenya dicukupkan hingga 1 L dengan bantuan pemanasan sampai semua bahan larut, disterilkan dalam autoklaf pada temperatur 121°C selama 10 menit (Difco Laboratories, 1977).
Cara pembuatan:
3.6.3.4 Pembuatan Agar Miring
Sebanyak 3 ml media NA steril dimasukkan kedalam tabung reaksi steril, didiamkan pada temperatur kamar sampai sediaan memadat pada posisi miring kira-kira 45°. Kemudian disimpan dalam lemari pendingin pada suhu 5°C (Ditjen POM, 1995).
3.6.4 Peremajaan Bakteri
3.6.5 Pembuatan Inokulum
Koloni bakteri diambil dari stok kultur dengan jarum ose steril lalu disuspensikan dalam tabung reaksi yang berisi 10 ml larutan Nutrient Broth. Kemudian diukur kekeruhan larutan pada panjang gelombang 580 nm sampai diperoleh transmitan 25% (konsentrasi bakteri 1x106
3.6.6 Pengujian Antibakteri
cfu/ml) (Ditjen POM, 1995).
Pengujian antibakteri dilakukan terhadap ekstrak etanol, ekstrak n-heksana, ekstrak etilasetat dengan metode difusi agar menggunakan kertas cakram.
Sebanyak 0,1 ml inokulum bakteri dicampur homogen dengan 15 ml MHA di cawan petri steril, kemudian dibiarkan sampai media memadat. Pada media yang telah padat diletakkan kertas cakram (oxoid) yang sudah berisi masing-masing ekstrak berbagai konsentrasi, dan untuk pembanding kontrol positif dipakai kertas cakram yang sudah berisi antibiotik amoksisilin 30 µg/ml (Oxoid). Kemudian diinkubasi di dalam inkubator pada suhu 36-37o
3.7 Karakterisasi Tempe
C selama 18-24 jam. Selanjutnya masing-masing petri diukur diameter daerah bening di sekitar kertas cakram menggunakan jangka sorong. Pengujian masing-masing dilakukan sebanyak 3 kali (Ditjen POM, 1995).
3.7.1 Kadar Air
dalam oven selama 30 menit lalu didinginkan dalam desikator dan ditimbang. Perlakuan ini dilakukan sampai didapat berat yang konstan (AOAC, 1984). Pengurangan berat merupakan banyaknya air yang diuapkan dari bahan dengan perhitungan:
Berat Awal – Berat Akhir
Kadar Air = ——————————— x 100% Berat Awal
3.7.2 Penentuan Total Asam
Bahan ditimbang sebanyak 10 g dan ditambahkan air sebanyak 90 g, kemudian disaring dengan kertas saring Whatman No. 42, diambil ekstraknya sebanyak 50 g dimasukkan ke dalam beaker glass. ke dalam cairan diletakkan pH meter, kemudian dititrasi dengan NaOH 0,1 N sampai pH 8,1 (AOAC, 1984).
ml NaOH x N NaOH Total Asam = —————————— x FP
Berat Bahan
3.7.3 Kadar Protein
sampai terjadi perubahan warna, dilakukan perlakuan yang sama untuk blanko (tanpa bahan) (Sudarmadji, 1989). Kadar protein dihitung dengan rumus:
(ml titrasi blanko - ml titrasi contoh) x N NaOH x 0,014 x fk
Kadar Protein = ————————————————————————— x 100% Berat Contoh
Dimana fk = Faktor konversi = 6,25
3.7.4 Kadar Lemak
Penentuan kadar lemak dilakukan dengan metode soxhlet. Dengan alat ekstraksi soxhlet diambil labu lemak yang ukurannya sesuai, dikeringkan dalam oven dan didinginkan dalam desikator dan ditimbang. Bahan ditimbang 5 gram dalam bentuk tepung langsung dalam selongsong kertas saring. Dalam alat ekstraksi soxhlet diletakkan kertas saring yang berisi bahan tersebut, kemudian dipasang alat kondensor diatasnya dan labu lemak dibawahnya. Pelarut heksan dituangkan ke dalam labu lemak secukupnya, sesuai dengan ukuran soxhlet yang digunakan. Refluks dilakukan selama minimum 5 jam sampai pelarut yang turun kembali ke dalam labu lemak berwarna jernih. Pelarut didestilasi yang ada dalam lemak dan ditampung pelarutnya, kemudian labu lemak yang berisi hasil ekstraksi dipanaskan dalam oven pada suhu 105o
Berat Lemak (g)
C. Hasil ektraksi dikeringkan sampai berat konstan dan didinginkan dalam desikator, kemudian ditimbang labu beserta lemaknya tersebut (Apriyantono, dkk., 1989).
% Kadar Lemak = ——————— x 100% Berat Sampel (g)
3.7.5 Kadar Serat Kasar
0,255 H2SO4) dan ditutup dengan pendingin balik, didihkan selama 30 menit dengan kadang kala digoyang-goyangkan. Suspense disaring melalui kertas saring dan residu yang tertinggal dalam erlenmeyer dicuci dengan akuades mendidih. Residu di cuci dalam kertas saring sampai air cucian tidak bersifat asam lagi (diuji dengan kertas lakmus). Secara kualitatif residu dipindahkan kembali dari kertas saring ke dalam erlenmeyer dengan spatula, dan sisanya dicuci dengan larutan NaOH mendidih (1,25 gram NaOH dalam 100 ml akuades = 0,313 N NaOH) sebanyak 200 ml sampai semua residu masuk ke dalam erlenmeyer. Residu didihkan dengan pendingin balik sambil kadang kala digoyang-digoyangkan selama 30 menit. Sambil dicuci dengan larutan K2SO4 10% disaring dengan kertas saring yang diketahui beratnya. Residu dicuci lagi dengan akuades mendidih dan kemudian dengan lebih kurang 15 ml alkohol 95%, kemudian dikeringkan dengan kertas saring dengan isinya pada suhu 110o
Berat Serat Kasar (g)
C sampai berat konstan (1-2 jam), dinginkan dalam desikator dan ditimbang. Berat residu merupakan berat serat kasar (Sudarmadji, dkk., 1989).
% Serat Kasar = ————————— x 100% Berat Sampel (g)
3.7.6 Kadar Abu Total
didinginkan dalam desikator selama 15 menit lalu ditimbang beratnya (Sudarmadji, dkk., 1989). Kadar abu dihitung dengan rumus:
Berat Setelah Dikeringkan (g)
Kadar Abu = ————————————— x 100% Berat Sebelum Dikeringkan (g)
3.7.7 Kadar Karbohidrat
Kandungan karbohidrat kasar dapat dikira dengan jalan menjumlahkan semua kandungan (%) air, abu, protein, lemak dan serabut kasar, yang mana jumlah ini adalah sama dengan 100 - % karbohidrat, atau % karbohidrat = 100 - % (air + abu + protein + lemak + serabut kasar) (Nitisewono, 1988).
3.7.8 Pemeriksaan Flavonoid
Sebanyak 0,5 gram ekstrak ditambahkan 10 ml metanol, direfluks selama 10 menit, disaring panas melalui kertas saring. Filtrat diencerkan dengan 10 ml air. Setelah dingin ditambahkan 5 ml eter minyak tanah, dikocok hati-hati, lalu didiamkan sebentar. Kemudian diambil lapisan metanol, diuapkan pada suhu 40oC, sisanya dilarutkan dalam 5 ml etil asetat, disaring.
a. Sebanyak 1 ml filtrat diuapkan sampai kering, sisa dilarutkan dalam 2 ml etanol 96% lalu ditambahkan serbuk 0,5 gram serbuk seng dan 2 ml asam kloroda 2 N, didiamkan selama 1 menit. Kemudian ditambahkan 10 tetes asam klorida pekat, jika dalam waktu 2-5 menit terjadi warna merah intensif menunjukkan adanya flavonoid.
Filtratnya digunakan untuk flavonoid dengan cara berikut:
jingga sampai merah ungu menunjukkan adanya flavonoid (Farnsworth, 1966).
3.8 Analisis Data
Analisis data menggunakan software program komputer SPSS versi 14. Data diameter hambat dari masing-masing bahan uji dianalisis dengan menggunakan uji Kolmogorov-Smirnov untuk melihat apakah data terdistribusi normal atau tidak normal. Selanjutnya uji dilanjutkan dengan menggunakan uji Homogeneity of Varian untuk mengetahui apakah varian dari data homogen atau tidak homogen.
BAB IV
HASIL DAN PEMBAHASAN
4.1 Ekstraksi
Hasil ekstraksi yang diperoleh dari tempe yang telah dikeringkan sebanyak 300 g dimaserasi dengan pelarut etanol 96%, etilasetat dan n-heksana masing-masing diperoleh 19,375 g, 15,360 g dan 13,100 g ekstrak setelah di freeze dryer. Penggunaan pelarut etanol bertujuan agar senyawa kimia yang terkandung di dalamnya dapat tersari sempurna, pelarut n-heksana digunakan untuk menarik senyawa kimia non polar dan etilasetat digunakan agar senyawa kimia yang bersifat semipolar dan agak polar tersari di dalamnya.
4.2 Komposisi Kandungan Tempe
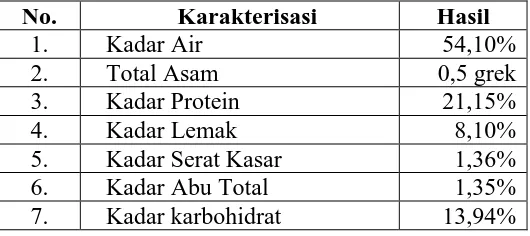
Komposisi kandungan tempe dapat dilihat pada Tabel 4.1 di bawah ini. Tabel 4.1. Komposisi kandungan tempe
No. Karakterisasi Hasil
1. Kadar Air 54,10%
2. Total Asam 0,5 grek
3. Kadar Protein 21,15%
4. Kadar Lemak 8,10%
5. Kadar Serat Kasar 1,36%
6. Kadar Abu Total 1,35%
7. Kadar karbohidrat 13,94%
4.3 Uji Antibakteri Ekstrak Etanol, Etilasetat dan n-Heksana Tempe terhadap Bacillus Subtilis
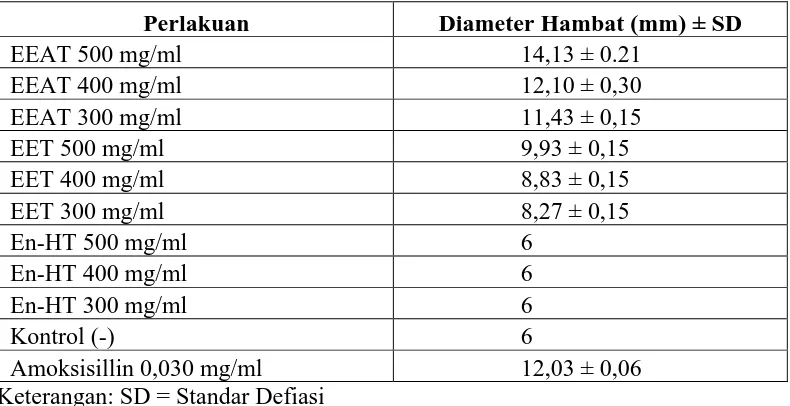
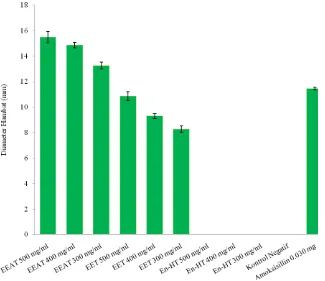
Hasil pengujian antibakteri ekstrak etanol, etilasetat dan n-Heksana tempe pada Tabel 4.2 terhadap bakteri Gram positif B. subtilis memberikan daya hambat pada konsentrasi 500 mg/ml (50%), 400 mg/ml (40%) dan 300 mg/ml (30%), sedang pada ekstrak n-heksana tempe tidak memberikan daya hambat (Gambar 4.1).
Tabel 4.2 Diameter hambat ekstrak etilasetat, etanol dan n-Heksana terhadap Bacillus subtilis.
Perlakuan Diameter Hambat (mm) ± SD
EEAT 500 mg/ml 14,13 ± 0.21
EEAT 400 mg/ml 12,10 ± 0,30
EEAT 300 mg/ml 11,43 ± 0,15
EET 500 mg/ml 9,93 ± 0,15
EET 400 mg/ml 8,83 ± 0,15
EET 300 mg/ml 8,27 ± 0,15
En-HT 500 mg/ml 6
En-HT 400 mg/ml 6
En-HT 300 mg/ml 6
Kontrol (-) 6
Amoksisillin 0,030 mg/ml 12,03 ± 0,06
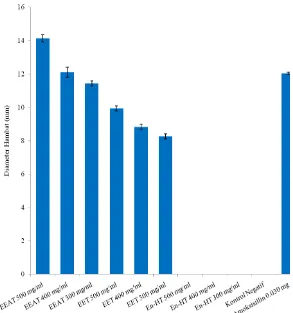
Gambar 4.1. Daya hambat antibakteri ekstrak etilasetat, etanol dan n-heksana tempe terhadap bakteri Bacillus subtilis.
Keterangan: - EEAT : Ekstrak Etil Asetat Tempe - EET : Ekstrak Etanol Tempe - En-HT : Ekstrak n-Heksan Tempe
(Lampiran 2) yang menunjukkan bahwa diameter hambat ekstrak etilasetat, etanol dan n-heksana tempe terhadap Bacillus subtilis homogen dengan nilai signifikansi 0,083. Oleh karena itu dilanjutkan dengan analisis varian yang dilanjutkan dengan uji beda rata-rata lanjutan Duncan pada Lampiran 2 yang menunjukkan adanya perbedaan dengan melihat perbedaan antara satu dengan lain.
Terlihat pada Gambar 4.1 bahwa daya hambat ekstrak etilasetat tempe lebih besar daripada ekstrak etanol tempe pada konsentrasi 500 mg/ml (50%), 400 mg/ml (40%) dan 300 mg/ml (30%) untuk bakteri Gram positif (B. subtilis), sedang untuk blanko memakai dimetilsulfoksida (DMSO) tidak memberikan daya hambat pada bakteri Gram positif (B. subtilis). Hasil penelitian sebelumnya yang telah dilaporkan (Bintari, et al., 2008) diketahui bahwa selama fermentasi tempe dengan bantuan Rhizopus sp. dihasilkan zat antibakteri yang berupa glikoprotein. Hal tersebut membuktikan bahwa pertumbuhan bakteri Gram positif Micrococcus luteus yang merupakan salah satu kontaminan pada tempe menjadi terhambat.
kemampuan membran plasma sel bakteri sebagai penghalang (barrier) osmosis dan mengganggu sejumlah proses biosintesis yang diperlukan dalam membran. Antibiotik yang bersifat merusak membran plasma umum terdapat pada antibiotik golongan polipeptida yang bekerja dengan mengubah permeabilitas membran plasma sel bakteri.
4.4 Uji Antibakteri Ekstrak Etanol, Etilasetat dan n-Heksana Tempe Terhadap Bakteri Staphylococcus aureus
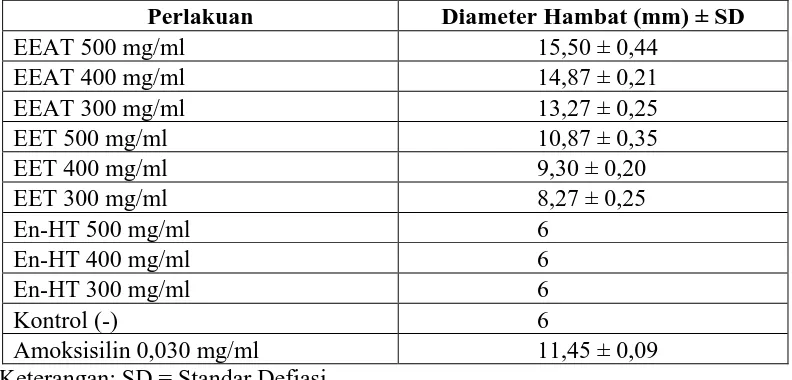
Hasil pengujian antibakteri ekstrak etanol, etilasetat dan n-heksana tempe terhadap bakteri S. aureus pada Tabel 4.3 menunjukkan daya hambat pada konsentrasi 500 mg/ml (50%), 400 mg/ml (40%) dan 300 mg/ml (30%), sedang pada ekstrak n-heksana tempe tidak memberikan daya hambat (Gambar 4.2). Tabel 4.3 Diameter hambat ekstrak etilasetat, etanol dan n-Heksana terhadap
Staphylococcus aureus.
Perlakuan Diameter Hambat (mm) ± SD
EEAT 500 mg/ml 15,50 ± 0,44
Amoksisilin 0,030 mg/ml 11,45 ± 0,09
Keterangan: SD = Standar Defiasi
tempe terhadap S. aureus adalah normal dengan nilai signifikansi 0,304 (P < 0,05), selanjutnya untuk melihat homogenitas diameter hambat ekstrak etilasetat, etanol dan n-heksana tempe terhadap S. aureus digunakan uji homogeneity analysis of varian (Lampiran 2) yang menunjukkan bahwa diameter hambat
ekstrak etilasetat, etanol dan n-heksana tempe terhadap Staphylococcus aureus tidak homogen, dengan demikian tidak memenuhi kriterian parametrik, oleh sebab itu digunakan uji Kruskal-Wallis (Lampiran 3) yang menunjukkan nilai signifikansi sebesar 0,001 (P < 0,05, taraf kepercayaan 95%), berarti terdapat perbedaan antar kelompok bahan uji sedangkan untuk melihat perbedaan antar kelompok dapat digunakan uji Mann-Withney (Lampiran 3).
Gambar 4.2. Daya hambat antibakteri ekstrak etilasetat, etanol dan n-heksana tempe terhadap bakteri Staphylococcus aureus
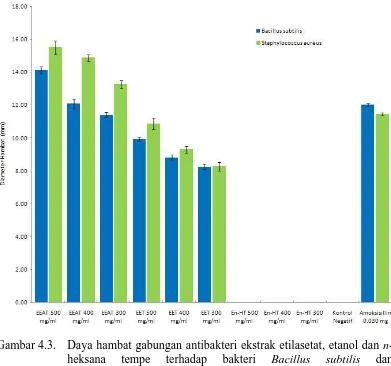
bakteri Gram positif (S. aureus) menyebabkan ekstrak etilasetat lebih mudah masuk kedalam membran dinding sel bakteri Gram positif, seperti yang terlihat pada Gambar 4.3 di mana terlihat bahwa efek antibakteri ekstrak etilasetat lebih besar daripada ekstrak etanol, sedang untuk ekstrak n-heksana tidak menunjukkan efek antibakteri. Senyawa glikoprotein (Bintari, et al., 2008), golongan protein (amina) yang telah diisolasi media yang diinokulasikan biakan R. oligosporus (Saraswaty, et al., 2002) dan senyawa flavonoid (isoflavon) merupakan beberapa senyawa golongan antimikroba yang telah diteliti.
Gambar 4.3. Daya hambat gabungan antibakteri ekstrak etilasetat, etanol dan n-heksana tempe terhadap bakteri Bacillus subtilis dan Staphylococcus aureus.
positif (B. subtilis dan S. aureus). Hasil ini dipengaruhi kandungan golongan senyawa kimia yang terdapat pada ekstrak n-heksana yang berupa senyawa non polar yang ditarik pelarut n-heksana dengan jumlah yang lebih besar daripada di dalam ekstrak etanol terhadap sifat lapisan membran luar (outer wall layer) bakteri Gram positif yang membran luarnya terdiri dari lapisan peptidoglikan yang lebih banyak dan bersifat polar, karena perbedaan kepolaran antara senyawa kimia yang ditarik pelarut n-heksana dengan dinding sel bakteri Gram positif (B. subtilis dan S. aureus), maka senyawa kimia yang tertarik dalam pelarut
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Ekstrak etanol dan etilasetat tempe bersifat antibakteri terhadap bakteri Gram positif Bacillus subtilis dan Staphylococcus aureus pada konsentrasi 500 mg/ml dan 400 mg/ml.
2. Ekstrak etilasetat tempe 500 mg/ml memiliki diameter hambat paling besar terhadap S. aureus sebesar 15,50 ± 0,44 mm (P > 0,05) dan B. subtilis sebesar 14,13 ± 0,21 mm (P > 0,05). Sedangkan ekstrak
n-heksan tempe tidak memiliki diameter hambat yang ditunjukkan tidak berbeda signifikan dibanding kontrol terhadap bakteri B. subtilis dan S. aureus.
5.2 Saran