LAPORAN RESMI PRAKTIKUM KIMIA FISIKA-I
Nama/NIM : Muhamad syaiful ampri / 652015011 Kelompok : 1 (siang)
Tgl. Praktikum : 26 Oktober 2016
JUDUL : Kinetika Reaksi Pemutihan Pewarna Krital Violet
DASAR TEORI
Pewarna tekstil seperti bahan-bahan yang lain, tidak melekat / menempel untuk selamanya. Pakaian yang masih baru dengan warna cerah setelah terkena udara luar, sinar matahari, keringat, detergen serta pemutih/pengelantang ; akan banyak kehilangan warna aslinya bahkan akan menjadi pudar.Hal ini di karenakan pewarna merupakan bahan organik tak jenuh yang dapat diserang oleh senyawa kimia yang reaktif dan di ubah menjadi produk yang tidak berwarna. Pemutih merupakan spesifikasi agen oksidasi yang kuat untuk menghancurkan molekul organik dari pewarna dengan mengoksidasi ikatan rangkapnya.
Pada percobaan kali ini, kita akan mempelajari reaksi dari pewarna yang sering disebut Crystal Violet (CV+). Pewarna ini memiliki struktur yang hampir mirip
dengan pewarna lain seperti Malachite Green ( MG+) dan Metil Violet Struktur.
Crystal Violet dan Metil Violet merupakan bahan pewarna yang biasanya ada sebagai kation ( ion positif ) di gunakan sebagai indikator asam-basa, pewarna tekstil dan sebagai agen anti bakteri. Ion hidroksidasi pada kosentrasi tinggi akan menyerang kation dari Crystal Violet pada atom karbon pusat dimana ketiga cincinnya akan diikat. Ketika ion OH- berikatan / terikat pada atom karbon, produk tidak berwarna
akan terbentuk.
CV+ + OH- CV – OH
Violet tidak berwarna
Reaksi dari Crystal Violet dengan Sodium Hidroksida ( NaOH )mengikuti persamaan / hukum kecepatan secara umum, yaitu :
Kecepatan = k [ CV+ ]x [OH]y
Pada persamaan di atas, k disebut konstanta kecepatan. Nilai ini konstan hanya pada tekanan dan temperatur tertentu. [CV+] merupakan konsetrasi dari CV+ dalam mol per
liter. Eksponen x dan y menunjukan bergantungnya kecepatan terhadap konsetrasi dari senyawa [CV+] dan [OH-] secara berturut turut.
Jumlah dari x + y merupakan orde kinetik dari suatu reaksi. Nilai x dan y tidak dapat diprediksikan secara umum dengan reaksi stokiometri tetapi harus ditentukan melalui percobaan.
Dengan melakukan percobaan dimana dilakukan pencampuran antara CV+dan
OH- yang memiliki konsetrasi yang berbeda. Kita dapat mengukur kecepatan awal
dari suatu reaksi dan menurunkan hukum kecepatan serta konstanta kecepatan k Absorbabsi dari CV+ sebagai fungsi waktu akan diukur dengan
spektrofotometer pada panjang yang telah ditetapkan. Hukum Beer di gunakan untuk menentukan hubungan antara konsetrasi terhadap absorbansi dan hasil plot A terhadap waktu sebenarnya menunjukan hubungan konsetrasi terhadap waktu atau kemiringan (slope ) dari kecepatan reaksi.
Slope / kemiringan : - A = - konsetrasi
waktu waktu
Spektrofotometri dapat digunakan untuk menganalisis konsentrasi suatu zat dialam larutan berdasarkan absorbansi terhadap warna dari larutan pada panjang gelombang tertentu. Metode spektrofotometri memerlukan larutan standar yang telahdiketahui konsentrasinya. Larutan standarnya terdiri dari beberapa tingkat konsentrasi tinggi. (Khopkar, 2003)
memiliki hubungan dengan konsentrasi sampel. Studi spektrofotometri dianggap sebagai perluasan suatu pemeriksaan visual yang lebih mendalam dari absorbsi energi. Hukum Beer menyatakan absorbansi cahaya berbanding lurus dengan dengankonsentrasi dan ketebalan bahan/medium (Miller J.N 2000)
TUJUAN
1. Menentukan hukum laju reaksi pemutihan kristal violet
2. Manentukan orde reaksi dengan menggunakan metode grafis
3. Menentukan pengaruh ion dalam proses pemutihan
BAHAN DAN METODE Alat dan Bahan:
1. NaOH 4. NaNO3
2. Crystal Violet 5. Spektrofotometer
3. Etanol 6. Aquades
Metode:
Pembuatan Larutan
1. Crystal Violet 0,0025 % dari 0,05 % M1 x V1 = M2 x V2
0,05 % x V1 = 0,0025 % x 100
V1 = 5 ml
Diambil 5 ml crystal violet kemudian dimasukkan dalam labu ukur 100 ml dan diencerkan dengan aquades sampai garis tera.
Diencerkan 10 kali
Diambil 5 ml crystal violet kemudian dimasukkan dalam labu ukur 100 ml dan diencerkan dengan aquades sampai garis tera.
Diambil 5 ml larutan diatas dan ditambahkan hingga 50 ml.
2. NaOH 0,008 M dan 0,016 M
M =
massa
Mr ×
0,016 =
Jadi diambil 0,0064 gram NaOH padat, kemudian dimasukkan dalam labu ukur 100 ml dan diencerkan dengan aquades sampai garis tera. M1 x V1 = M2 x V2
0,008 x 50 = 0,0016 x V2
V2 = 25 ml
Jadi diambil 50 ml NaOH 0,0016 M, kemudian dimasukkan dalam labu ukur 250 ml dan diencerkan dengan aquades sampai garis tera.
3. 50 ml NaNO3 0,1 M
diencerkan dengan aquades sampai garis tera. 50 ml NaNO3 0,05 M
M1.V1= M2.V2
0,1. V1 = 0,05. 50
V1 = 25 ml
Jadi untuk membuat 50 ml NaNO3 0,05 M, diambil 25 ml larutan
NaNO3 0,1 M yang telah dibuat, kemudian dimasukkan dalam labu
ukur 50 ml dan diencerkan dengan aquades sampai garis tera.
1. Dibuat larutan kristal violet 0,0025 %; NaOH 0,008 dan 0,0016 M; NaNO3
0,1 M dan 0,05 M.
3. Spektrofotometer dikalibrasi untuk mengukur kristal violet pada panjang 590 nm (diatur dari posisi 0% transmitan tanpa ada sempel dan 100% transmitan dengan blanko aquades pada kuvet)
4. Diatur transmitan dari pewarna kristal violet untuk masing-masing seri pengenceran (dimulai dari konsentrasi yang paling encer kemudian nilai transmitan diubah menjadi absorbansi)
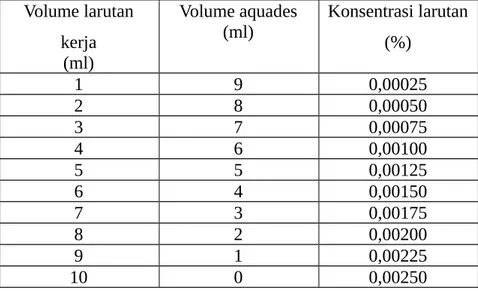
5. Dibuat grafik kurva standar antara konsentrasi dan absorbansi latutan.
Penentuan orde reaksi
1. Spektrofotometer dikalibrasi untuk mengukur kristal violet pada panjang 590 nm (diatur dari posisi 0% transmitan tanpa ada sempel dan 100% transmitan dengan blanko aquades pada kuvet)
2. Diukur transmitan dari pewarna kristal violet dengan mencampurkan 10 ml larutan kerja kristal violet dengan 10 ml NaOH larutan a. Dalam glass beaker dan perhitungan waktu dimulai.
3. Ditambahkan 5ml aquades dalam dicampurkan dan dicampurkan dengan baik.
4. Larutan dipindah dalam kuvet, bagian luar kuvet dibersihkan kemudian dibaca transmitan dan dibaca panjang gelombang pada pada panjang gelombang pada 590 nm.
5. Diukur nilai trnsmitan dan diulangi setiap 30 detik, pengukuran dilakukan sebanyak 10 kali.
6. Masing-masing nilai transmitan diubah dalam bentuk nilai absorbansi untuk diolah pada laporan resmi.
7. Diulangi langkah-langkah diatas dengan mengganti 5 ml aquades dengan 5 ml NaNO3 0,1 M dan 0,05 M.
8. Diulangi langkah-langkah diatas dengan mengganti 10 ml aquades dengan 5 ml larutan NaOH 0,008 M dan 0,016 M
HASIL
A. Pembuatan kurva standart kristal violet Volume larutan
B. Penentuan Orde Reaksi Waktu
1. Bandingkan hasil praktikum anda tentang penentuan orde reaksi dengan literatur!
Jawab :
maka konsentrasinya pun semakin besar, dan konsentrasi tersebut mempengaruhi laju reaksi suatu larutan maka laju reaksinya pun juga besar. Dalam percobaan penentuan ordo yang dilakukan ada data yang tidak sesuai dengan literatur, hal ini dapat terjadi karena kemungkinan NaNO3 yang ditambahkan tidak bereaksi sehingga laju reaksinya tidak berpengaruh.
2. Bagaimana reaksi yang terjadi antara pewarna dan NaOH setelah dilakukan penambahan NaNO3 ?
Jawab :
C25H30ClN3 + NaOH NaCl + C25H30N3O NaNO3 2NaOH + C25H30N3Cl
H 2O/H+
Yang terjadi reaksi akan kembali menjadi netral.
3. Dari hasil pengamatan yang anda lakukan, apakah pengaruh penambahan NaNO3 terhadap reaksi pemutihan?
Jawab :
NaNO3 memiliki ion anion yang bereaksi dengan ion kation monovalen pada
kristal violet. Pengaruh reaksi yang terjadi yaitu mempercepat jalannya reaksi antara kristal violet dengan NaOH sehingga proses pemutihan semakin cepat.
4. Bandingkan hasil praktikum anda tentang pengaruh penambahan NaNO3 dengan literatur!
Jawab :
Menurut literatur penambahan NaNO3 dapat mempengaruhi proses pemutihan yaitu dapat mempercepat jalannya reaksi. Dan pada hasil percobaan yang dilakukan telah sesuai dengan literatur. Hal ini ditunjukkan dengan bertambahnya orde reaksi pada saat ditambahkannya NaNO3. Semakin bertambahnya orde reaksi makan semakin bertambah pula laju reaksinya sehingga reaksi akan berlangsung secara cepat.
PEMBAHASAN
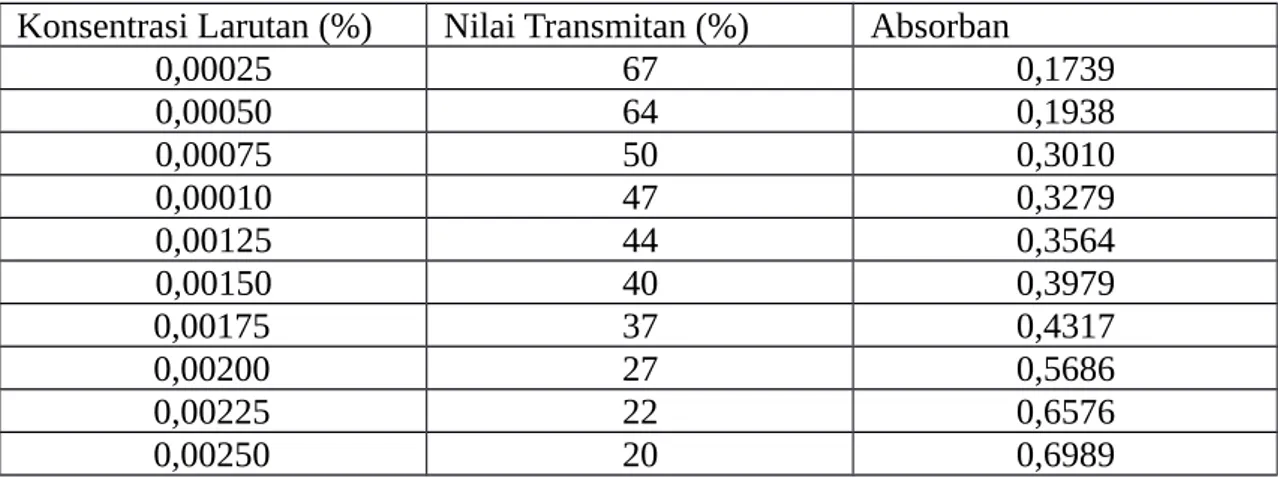
A = 2 – log transmitan%
Dari hasil percobaan didapatkan absorban sebagai berikut:
Konsentrasi Larutan (%) Nilai Transmitan (%) Absorban
0,00025 67 0,1739
Kemudian dibuat kurva standar antara konsentrasi larutan dengan absorban
0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8
grafik absorban terhadap konsentrasi
grafik absorban
Dapat disimpulkan dari tabel maupun grafik bahwa semakin besar konsentrasi kristal violet yang ditambahkan maka semakin besar pula nilai absorbannya (besarnya sinar radiasi yang terserap oleh zat) dari zat yang diukur), namun transmitan
Sedangkan dalam percobaan yang kedua, pengamatan kinetika reaksi antara kristal violet dan natrium hidroksida. Persamaan untuk reaksi yang ditampilkan di sini:
Gb. Reaksi Kristal violet dengan OH-.
reaksi tersebut dapat digunakan untuk menentukkan orde reaksi dari OH-. Caranya
dengan menggunakan metode grafis, yaitu membuat kurva antara A dengan waktu sebagai penunjuk orde 0, antara log A dengan waktu sebagai orde 1 dan antara 1/A dengan waktu sebagai orde 2. Penentuan orde dipilih apabila R2 dari ketiga grafik
tersebut mendekati 1.
Dari pembuatan kurva didapatkan data:
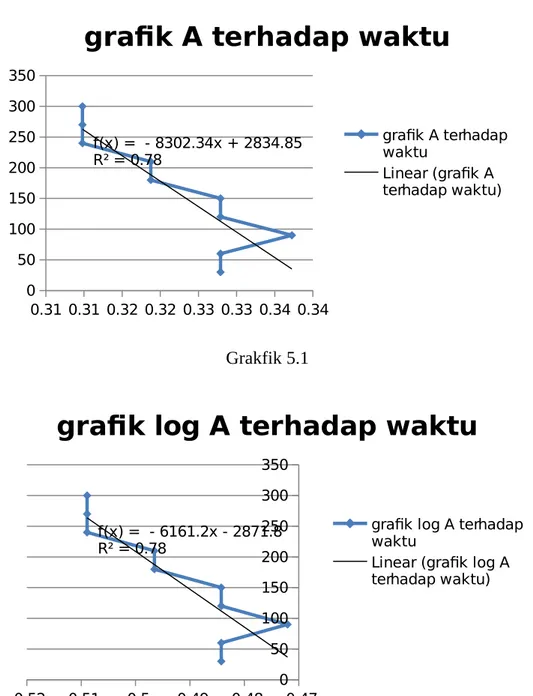
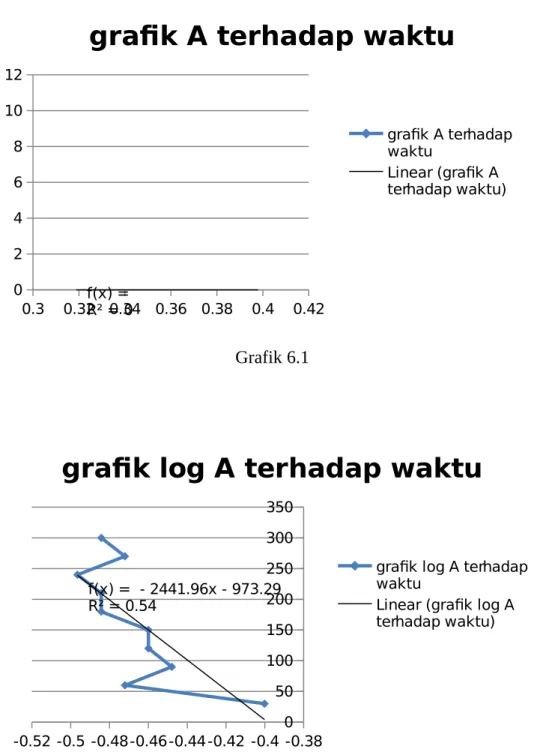
o Untuk grafik (NaOH 0,016 M + NaNO3 0,1 M) sbg fungsi waktu (interval 30
detik) dapat dilihat bahwa R2 pada grafik log A paling mendekati 1. Jadi orde
reaksi yang tepat adalah orde 1
o Untuk grafik (NaOH 0,016 M + aquades) sbg fungsi waktu (interval 30 detik) dapat dilihat bahwa R2 pada grafik A lebih mendekati 1. Jadi orde reaksi yang
tepat adalah orde 0
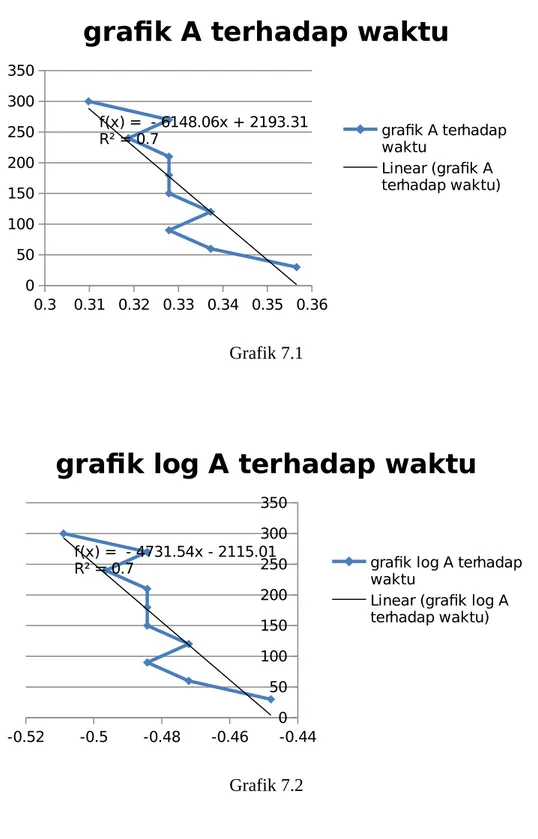
o Untuk grafik (NaOH 0,016 M + NaNO3 0,05 M) sbg fungsi waktu (interval 30
detik) dapat dilihat bahwa R2 pada grafik 1/A lebih mendekati 1. Jadi orde reaksi
yang tepat adalah orde 2
o Untuk grafik (NaOH 0,008 M + NaNO3 0,05 M) sbg fungsi waktu (interval 30
detik) dapat dilihat bahwa R2 pada grafik 1/A mendekati 1. Jadi orde reaksi yang
tepat adalah orde 2
o Untuk grafik (NaOH 0,008 M + NaNO3 0,05 M) sbg fungsi waktu (interval 30
detik) dapat dilihat bahwa R2 pada grafik 1/A mendekati 1. Jadi orde reaksi yang
o Untuk grafik (NaOH 0,008 M + aquades) sbg fungsi waktu (interval 30 detik) dapat dilihat bahwa R2 pada grafik A mendekati 1. Jadi orde reaksi yang tepat
adalah orde 1
Dengan diketahuinya orde reaksi makan dapat ditentukan kecepatan laju reaksinya karena semakin besar orde reaksi maka laju reaksinya semakin cepat. Sehingga penambahan NaNO3 dalam percobaan ini dapat mempercepat laju reaksi antara CV
dengan NaOH. Dan juga ion dari NaNO3 yang beraksi dengan ion CV menyebabkan
cepatnya laju reaksi menuju pH7 atau netral karena pada umumnya garam yang menandung ion logam alkali dan basa konjungat suatu asam kuat seperti NO3 tidak
mengalami hidrolisis dalam jumlah yang banyak dan larutannya akan dianggap netral. Jadi bila NaNO3 , suatu garam yang terbentuk oleh reaksi NaOH dengan HNO3 akan
larut dalam air dan akan menakibatkan garam terurai sempurna menjadi :
NaNO3(s) + H2O Na+(aq) + NO3-(aq)
Ion Na+ terhidrasi tidak memberikan ataupun tidak juga menerima ion H+. ion NO 3
adalah basa konjugat dari asam kuat HNO3 dan tidak memiliki afinitas untuk ion H+.
Akibatnya, suatu larutan yang mengandung ion Na+ dan NO
3- akan netral, dengan pH
7. Selain itu konsentrasi dari tiap larutan pun juga mempengaruhi kecepatan laju reaksi.
KESIMPULAN
1. Semakin bertambah besarnya konsentrasi maka absorbansinya pun semakin besar. Hal tersebut juga mempengaruhi laju reaksinya menjadi lebih cepat.
2. Orde reaksi NaOH + akuades adalah 1 sedangkan NaOH + NaNO3 mempunyai
orde reaksi 2.
3. Pengaruh ion pada NaNO3 dapat mempercepat jalannya reaksi antara kristal violet
dengan NaOH sehingga proses pemutihan semakin cepat
Andy. 2009. http://andykimia03.wordpress.com/tag/konstanta-laju-reaksi/ diakses 25/10/2016 jam 23.29 WIB
Khopkar, S.M, 1990, Konsep Dasar Kimia Analitik, Universitas Indonesia (UI-Press), Jakarta, Hal 215-216.
LAMPIRAN
1. Tugas Awal
2. Laporan Sementara 3. Grafik penentuan orde
Penentuan orde reaksi NaOH 0,008 M + akuades
Waktu (detik) A Log A 1/A
30 0,356547 -0,44788 2,804677
60 0,366532 -0,43589 2,728278
90 0,356547 -0,44788 2,804677
120 0,356547 -0,44788 2,804677
150 0,337242 -0,47206 2,965228
180 0,337242 -0,47206 2,965228
210 0,346787 -0,45994 2,88361
240 0,346787 -0,45994 2,88361
270 0,337242 -0,47206 2,965228
300 0,337242 -0,47206 2,965228
0 50 100 150 200 250 300 350
kurva A terhadap waktu
kurva A terhadap waktu
Linear (kurva A terhadap waktu)
-0.48 -0.47 -0.46 -0.45 -0.44 -0.43
grafik log A terhadap waktu
grafik log A terhadap waktu
Linear (grafik log A terhadap waktu)
grafik 1/A terhadap waktu
grafik 1/A terhadap waktu
Linear (grafik 1/A terhadap waktu)
Grafik 2.3
Penentuan orde reaksi NaOH 0,008 M + NaNO3 0,1 M
Waktu (detik) A Log A 1/A
30 0,387216 -0,41205 2,582537
60 0,356547 -0,44788 2,804677
90 0,366532 -0,43589 2,728278
120 0,356547 -0,44788 2,804677
150 0,337242 -0,47206 2,965228
180 0,346787 -0,45994 2,88361
210 0,337242 -0,47206 2,965228
240 0,337242 -0,47206 2,965228
270 0,346787 -0,45994 2,88361
0.33 0.34 0.35 0.36 0.37 0.38 0.39 0.4 0
50 100 150 200 250 300 350
f(x) = - 4442.76x + 1724.13 R² = 0.64
grafik A terhadap waktu
grafik A terhadap waktu
Linear (grafik A terhadap waktu)
Grafik 3.1
-0.48 -0.46 -0.44 -0.42 -0.4 0 50 100 150 200 250 300 350
f(x) = - 3685.28x - 1512.48 R² = 0.64
grafik log A terhadap waktu
grafik log A terhadap waktu
Linear (grafik log A terhadap waktu)
2.5 2.6 2.7 2.8 2.9 3 0
50 100 150 200 250 300 350
f(x) = 575.03x - 1476.62 R² = 0.65
grafik 1/A terhadap waktu
grafik 1/A terhadap waktu
Linear (grafik 1/A terhadap waktu)
Grafik 3.3
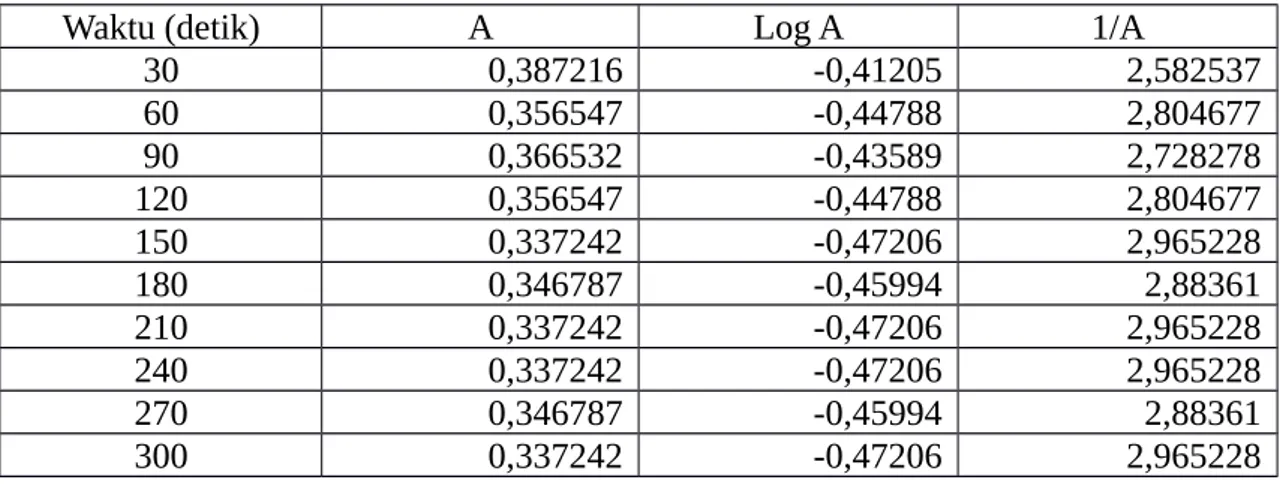
Penentuan orde reaksi NaOH 0,008 M + NaNO3 0,05 M
Waktu (detik) A Log A 1/A
30 0,346787 -0,45994 2,88361
60 0,366532 -0,43589 2,728278
90 0,356547 -0,44788 2,804677
120 0,356547 -0,44788 2,804677
150 0,346787 -0,45994 2,88361
180 0,346787 -0,45994 2,88361
210 0,346787 -0,45994 2,88361
240 0,346787 -0,45994 2,88361
270 0,337242 -0,47206 2,965228
0.34 0.34 0.35 0.35 0.36 0.36 0.37 0.37 0
50 100 150 200 250 300 350
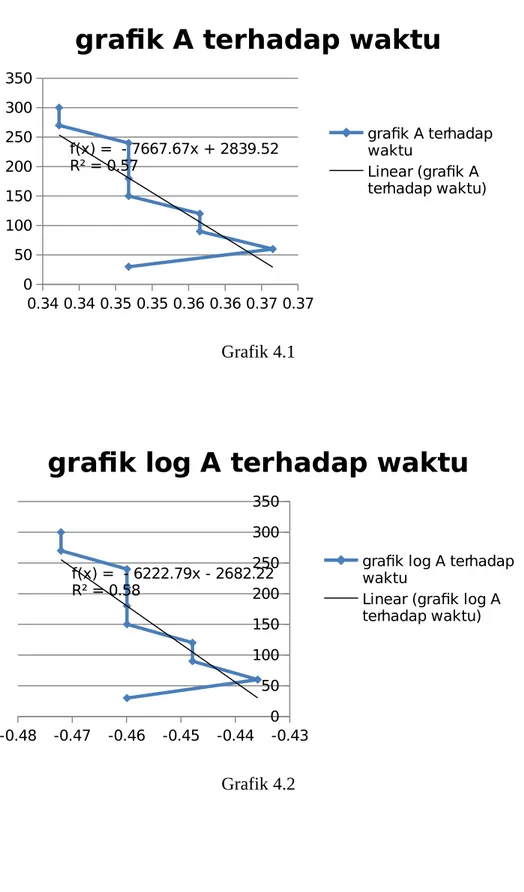
f(x) = - 7667.67x + 2839.52 R² = 0.57
grafik A terhadap waktu
grafik A terhadap waktu
Linear (grafik A terhadap waktu)
Grafik 4.1
-0.48 -0.47 -0.46 -0.45 -0.44 -0.43 0 50 100 150 200 250 300 350
f(x) = - 6222.79x - 2682.22 R² = 0.58
grafik log A terhadap waktu
grafik log A terhadap waktu
Linear (grafik log A terhadap waktu)
2.7 2.75 2.8 2.85 2.9 2.95 3 0
50 100 150 200 250 300 350
f(x) = 951.89x - 2565.62 R² = 0.58
grafik 1/A terhadap waktu
grafik 1/A terhadap waktu
Linear (grafik 1/A terhadap waktu)
Grafik 4.3
Penentuan orde reaksi NaOH 0,016 M + akuades
Waktu (detik) A Log A 1/A
30 0,327902 -0,48426 3,04969
60 0,327902 -0,48426 3,04969
90 0,337242 -0,47206 2,965228
120 0,327902 -0,48426 3,04969
150 0,327902 -0,48426 3,04969
180 0,318759 -0,49654 3,137169
210 0,318759 -0,49654 3,137169
240 0,309804 -0,50891 3,227848
270 0,309804 -0,50891 3,227848
0.31 0.31 0.32 0.32 0.33 0.33 0.34 0.34 0
50 100 150 200 250 300 350
f(x) = - 8302.34x + 2834.85 R² = 0.78
grafik A terhadap waktu
grafik A terhadap waktu
Linear (grafik A terhadap waktu)
Grakfik 5.1
-0.52 -0.51 -0.5 -0.49 -0.48 -0.47 0 50 100 150 200 250 300 350
f(x) = - 6161.2x - 2871.8 R² = 0.78
grafik log A terhadap waktu
grafik log A terhadap waktu
Linear (grafik log A terhadap waktu)
2.95 3 3.05 3.1 3.15 3.2 3.25 0
50 100 150 200 250 300 350
f(x) = 861.35x - 2515.69 R² = 0.79
grafik 1/A terhadap waktu
grafik 1/A terhadap waktu
Linear (grafik 1/A terhadap waktu)
Grafik 5.3
Penentuan orde reaksi NaOH 0,016 M + NaNO3 0,1 M
Waktu (detik) A Log A 1/A
30 0,39794 -0,40018 2,512942
60 0,337242 -0,47206 2,965228
90 0,356547 -0,44788 2,804677
120 0,346787 -0,45994 2,88361
150 0,346787 -0,45994 2,88361
180 0,327902 -0,48426 3,04969
210 0,327902 -0,48426 3,04969
240 0,318759 -0,49654 3,137169
270 0,337242 -0,47206 2,965228
0.3 0.32 0.34 0.36 0.38 0.4 0.42 0
2 4 6 8 10 12
f(x) = R² = 0
grafik A terhadap waktu
grafik A terhadap waktu
Linear (grafik A terhadap waktu)
Grafik 6.1
-0.52 -0.5 -0.48-0.46-0.44-0.42 -0.4 -0.38 0 50 100 150 200 250 300 350
f(x) = - 2441.96x - 973.29 R² = 0.54
grafik log A terhadap waktu
grafik log A terhadap waktu
Linear (grafik log A terhadap waktu)
2.4 2.5 2.6 2.7 2.8 2.9 3 3.1 3.2 0
50 100 150 200 250 300 350
f(x) = 380.28x - 949.28 R² = 0.55
grafik 1/A terhadap waktu
grafik 1/A terhadap waktu
Linear (grafik 1/A terhadap waktu)
Grafik 6.3
Penentuan orde reaksi NaOH 0,016 M + NaNO3 0,05 M
Waktu (detik) A Log A 1/A
30 0,356547 -0,44788 2,804677
60 0,337242 -0,47206 2,965228
90 0,327902 -0,48426 3,04969
120 0,337242 -0,47206 2,965228
150 0,327902 -0,48426 3,04969
180 0,327902 -0,48426 3,04969
210 0,327902 -0,48426 3,04969
240 0,318759 -0,49654 3,137169
270 0,327902 -0,48426 3,04969
0.3 0.31 0.32 0.33 0.34 0.35 0.36 0
50 100 150 200 250 300 350
f(x) = - 6148.06x + 2193.31 R² = 0.7
grafik A terhadap waktu
grafik A terhadap waktu
Linear (grafik A terhadap waktu)
Grafik 7.1
-0.52 -0.5 -0.48 -0.46 -0.44 0 50 100 150 200 250 300 350
f(x) = - 4731.54x - 2115.01 R² = 0.7
grafik log A terhadap waktu
grafik log A terhadap waktu
Linear (grafik log A terhadap waktu)
2.7 2.8 2.9 3 3.1 3.2 3.3 0
50 100 150 200 250 300 350
f(x) = 684.87x - 1913.49 R² = 0.7
grafik 1/A terhadap waktu
grafik 1/A terhadap waktu
Linear (grafik 1/A terhadap waktu)
Grafik 7.3
DAFTAR PUSTAKA
Pudjatmaka A. H, 2003, Kamus Kimia, Jakarta: Balai Pustaka
Smith Henk, 2000, Petunjuk Praktikum Kimia Fisika 1, Suliyono, UKSW
LAMPIRAN
1. Laporan sementara 2. Tugas Awal