EISSN 2443-3462 DOI: 10.18343/jipi.24.2.160
Karakteristik Isolat Bakteri Penghasil Dekstran dari Batang Tebu
(
Saccharum officinarum
L
.)
(Characteristic of Dextran Producing Bacteria Isolated from Sugar Cane
(
Saccharum officinarum
L
.))
Sitti Rahbiah Akram1, Titi Candra Sunarti2, Anja Meryandini3*
(Diterima Februari 2018/Disetujui Maret 2019)
ABSTRAK
Dekstran merupakan rantai panjang polimer karbohidrat yang disintesis oleh enzim dekstransukrase dengan substrat sukrosa. Kondisi fisik, kimia, suhu, dan konsentrasi sukrosa dalam media pertumbuhan isolat bakteri berperan penting dalam produksi dekstran. Penelitian ini bertujuan untuk mengisolasi dan mengkarakterisasi bakteri penghasil dekstransukrase. Bakteri diisolasi dari tebu. Isolat tebu batang tengah (TBT) 3,2 memiliki viskositas
tertinggi (1,48 cP) dan produksi dekstran kasar (7,87 g/L). Isolat TBT 3,2 diidentifikasi sebagai Paenibacillus polymyxa
dengan tingkat kemiripan 99%. Paenibacillus polymyxa TBT 3,2 memiliki kondisi pertumbuhan optimum untuk
produksi dekstran pada pH 7, suhu 30C dengan konsentrasi sukrosa 20%. Aktivitas dekstransukrase dan aktivitas spesifik tertinggi diperoleh setelah inkubasi 25 menit, yaitu 29,41 mU/mL dan 0,46 U/mg pada menit ke-25.
Berdasarkan hasil penelitian ini Paenibacillus polymyxa TBT 3,2 dapat digunakan sebagai bakteri penghasil dekstran.
Kata kunci: dekstran, dekstransukrase, Paenibacillus polymyxa, tebu
ABSTRACT
Dextran is a long chain of carbohydrate polymers synthesized by dextransucrase enzyme with sucrose as a substrate. The physical, chemical conditions, temperature, and the concentration of sucrose in the isolate bacterial growth media play an important role in dextransucrase production. This study aims to isolate and characterize the dextransucrase producing bacteria. The bacteria were isolated from sugar cane. TBT 3.2 Isolate which had the highest viscosity (1.48 cP) and crude dextran (7.87 g/L) production was selected. TBT 3.2 Isolate was identified as
Paenibacillus polymyxa with 99% similar identity. The Paenibacillus polymyxa TBT 3.2 was characterized based on their ability to produce dextran and cell number. The bacteria had the optimum growth conditions on the media for producing dextran at pH 7, temperature 30C, and concentration of 20% sucrose. The highest dextransucrase activity and the highest specific activity were obtained after 25 minutes of incubation, with the activities of 29.41 mU/mL and
0.46 U/mg. Based on the results of this study, the Paenibacillus polymyxa TBT 3.2 can be used as a dextran producing
bacteria.
Keywords: dextran, dextransucrase, Paenibacillus polymyxa, sugar cane
PENDAHULUAN
Dekstran merupakan rantai panjang polimer karbohidrat (ikatan α-1,6-glukosidik) yang disintesis oleh enzim dekstransukrase (Zohra et al. 2013). Dekstransukrase mensintesis glukosa dari sukrosa menghasilkan dekstran dan fruktosa dari reaksi katalitik (Miyagawa et al. 2012). Pada industri gula tebu, dekstran biasanya banyak ditemukan pada tebu yang terlambat giling atau penanganan pascapanen
yang kurang baik. Kadar dekstran yang tinggi dalam nira tebu (cairan perasaan tebu) dapat mengganggu pembuatan gula, terutama pada tahap kristalisasi dan pemisahan gula (Baktir et al. 2005). Kondisi tebu di lapangan, transportasi, dan kondisi pabrik dapat mem-buat tebu mudah terinfeksi mikrob.
Dekstran yang dihasilkan oleh galur yang berbeda memiliki perbedaan dalam ikatan glikosidiknya, tingkat dan jenis percabangan, serta semua karakter fisik dan kimiawinya (Zahnley & Smith 1995).Berdasarkan pe-nelitian Aman et al. (2012), Leuconostoc mesenteroides AA1 adalah calon potensial untuk produksi dekstran di skala industri. Dekstran yang dihasilkan Leuconostoc mesenteroides AA1 memiliki bobot molekul tinggi sehingga dapat digunakan dalam industri pengeboran minyak sebagai kompleks dekstran-aldehida. Selain itu, dekstran dapat terkon-jugasi dengan besi dan bahan kimia lainnya untuk menghasilkan turunan berbeda yang dapat digunakan untuk berbagai keperluan farmasi. Dekstran yang
1 Sekolah Pascasarjana, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor, Kampus IPB Darmaga, Bogor 16680
2 Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor, Kampus IPB Darmaga, Bogor 16680
3 Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor, Kampus IPB Darmaga, Bogor 16680
dihasilkan oleh Leuconostoc mesenteroides CMG713 memiliki bobot molekul yang sangat tinggi (Sarwat et al. 2008).
Menurut Lee dan Fox (1985), jus tebu yang diperoleh dari tebu dalam kondisi panas lembap dan telah ditumbuhi spesies Leuconostoc menimbulkan berbagai masalah serius, yaitu kehilangan jumlah sukrosa, terjadinya peningkatan viskositas dalam pro-ses pembuatan sirup, dan penghambatan kristalisasi sukrosa (Khalikova et al. 2005).
Walaupun dekstran mengganggu produksi gula, dekstran sangat diperlukan dalam berbagai bidang, terutama bidang analitik dan kedokteran. Secara komersial dekstran digunakan untuk berbagai produk pangan, seperti stabilisator, bounding agent, dan produk permen karet (Lawford et al. 1979), preparasi medium kromatografi seperti sephadex, industri farmasi, dan iron-dextran (Pennell & Barker 1992). Menurut Yang et al. (2015) dekstran yang dihasilkan oleh Leuconostoc citreum NM105 adalah dekstran dalam bentuk glukooligosakarida (GOS) dengan cabang α-(1→2) sehingga dapat digunakan dalam formulasi makanan dalam bentuk asli atau dalam bentuk GOS yang diperoleh dengan hidrolisis asam parsial untuk meningkatkan kesehatan manusia sebagai prebiotik. Selain itu, dekstransukrase dari L. citreum NM105 berpotensi untuk digunakan dalam produksi oligosakarida prebiotik. Dekstran yang dihasilkan juga memiliki kelarutan air dan retensi yang tinggi sehingga dimanfaatkan sebagai agen pengikat air. Oleh karena itu, perlu dilakukan isolasi bakteri yang memiliki enzim dekstransukrase yang dapat mensin-tesis sukrosa menjadi dekstran dan karakterisasi isolat tersebut dalam menghasilkan dekstran. Penelitian ini bertujuan untuk mengisolasi dan mengkarakterisasi bakteri penghasil dekstran dari batang tebu.
METODE PENELITIAN
Pengambilan Sampel Sumber Isolat Bakteri Penghasil Dekstran
Sampel yang digunakan berasal dari batang tebu
Saccharum officinarumL. yang dibiarkan selama 3 hari setelah panen dari tebu tebang hijau yang diperoleh dari Cimahpar, Bogor, Jawa Barat. Bagian batang yang digunakan adalah tebu batang bawah (TBB) dan tebu batang tengah (TBT) masing-masing berjumlah 3 batang tebu yang kulitnya telah dibuang dan bagian yang digunakan adalah bagian yang dekat dengan kulit.
Isolasi Bakteri Penghasil Dekstran
Isolasi bakteri penghasil dekstran dilakukan berdasarkan metode Dimic (2006). Sampel dipotong (2 x 2 cm2) dan dimasukkan ke dalam media selektif yang
mengandung 10% sukrosa (10 mL), kemudian diin-kubasi selama 24 jam pada suhu 25C dan diamati perubahan kekentalan pada media sebagai indikasi pembentukan dekstran. Isolat yang menunjukkan perubahan kekentalan media tertinggi dan tercepat,
selanjutnya dimurnikan dengan cara isolat digores pada media padat selektif dan digunakan untuk uji selanjutnya. Media selektif mengandung (g/L) sukrosa 100 g; ekstrak khamir 2,5 g; K2HPO4 5 g; (NH4)2SO4
0,2 g; MgSO4; 7H2O 0,2 g; dan NaCl 0,6 g.
Seleksi Isolat
Seleksi bakteri hasil isolasi dilakukan melalui produksi dekstran pada media dengan kandungan 10% sukrosa. Koloni bakteri positif menghasilkan dekstran ditandai dengan adanya senyawa dekstran pada permukaan media sukrosa, yaitu koloni dengan lendir berwarna kekuningan dan permukaan mengkilap (Nuryadi et al. 2013). Selanjutnya, dilakukan penga-matan morfologi untuk mengetahui warna, bentuk, tekstur koloni, dan jenis pewarnaan Gram. Isolat terpilih kemudian diinokulasikan pada media cair yang mengandung sukrosa untuk dijadikan kultur cair. Sebanyak 100 µL tiap isolat diinokulasikan pada 10 mL media cair sukrosa yang kemudian diamati proses pembentukan dekstran setiap satu jam selama 24 jam dan selanjutnya dilakukan pengukuran viskositas dan perhitungan rendemen dekstran. Isolat yang menun-jukkan pembentukan dekstran tercepat, kekentalan tertinggi, dan rendemen dekstran tertinggi dijadikan isolat terpilih untuk karakterisasi isolat.
Penentuan Aktivitas dan Aktivitas Spesifik Dekstransukrase Isolat Terpilih
Satu ose kultur cair diinokulasikan pada 5 mL media cair yang mengandung 10% sukrosa, diinkubasi pada suhu 30C selama 24 jam. Inokulum diambil sebanyak 200 µL, ditambahkan ke dalam 20 mL media yang mengandung sukrosa dengan konsentrasinya dari karakterisasi isolat, diinkubasi pada suhu 30C selama 48 jam. Kultur biakan diambil sebanyak 3 mL kemudian dipindahkan ke-2 microtube masing-masing 1,5 mL, selanjutnya disentrifus pada 12.000 rpm selama 10 menit sehingga membentuk supernatan yang diguna-kan sebagai sumber dekstransukrase untuk uji akti-vitas dan aktivitas spesifik dekstransukrase (Padmanabhan & Kim 2002). Pengukuran aktivitas dekstransukrase dilakukan dengan mencampurkan 100 µL supernatan dengan 500 µL larutan sukrosa, 200 µL bufer asam sitrat (pH 5,4), dan 200 µL CaCl2
dengan 3 kali ulangan. Campuran reaksi dengan dekstransukrase diinkubasi selama 5 menit pada suhu 30C. Setiap interval 5 menit, 100 µL sampel diambil dari campuran reaksi dan ditambahkan ke dalam 100 µL DNS. Sampel ditempatkan dalam water bath
selama 5 menit, selanjutnya didinginkan selama 15 menit, ditambahkan 1,5 mL akuades dan absorbansi diukur pada 540 nm. Percobaan dilakukan sebanyak 3 kali ulangan dan dibuat kurva aktivitas dekstran-sukrase versus waktu untuk menentukan aktivitas enzim dekstransukrase tertinggi. Aktivitas enzim di-hitung menggunakan kurva standar fruktosa. Aktivitas enzim dinyatakan dalam unit, satu unit didefinisikan sebagai satu mikromol fruktosa yang dihasilkan dalam setiap menit (1 unit = 1 µmol fruktosa/mL enzim/menit). Aktivitas spesifik enzim dinyatakan dalam unit/mg
protein. Pengukuran protein terlarut pada sampel dila-kukan dengan cara mencampurkan 400 µL supernatan dengan 4 mL Bradford reagen, kemudian divorteks dan diukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 595 nm. Perhitungan kan-dungan protein menggunakan kurva standar Bovine Serum Albumin (BSA) dengan metode Bradford (1976).
Produksi Dekstran dari Isolat Terpilih
Karakteristik isolat dilakukan untuk mengetahui pengaruh waktu inkubasi, pH, suhu, dan konsentrasi sukrosa pada media pertumbuhan pada produksi dekstran dari isolat terpilih. Pengaruh waktu inkubasi ditentukan dengan cara mengukur viskositas dengan menggunakan viskometer ostwald, total gula sisa dengan metode fenol-sulfat, bobot ekstrak kasar dekstran dengan metode presipitasi dengan etanol dan
Total Plate Count (TPC) isolat setiap 12 jam pada 100 mL media yang mengandung sukrosa 30% (Karthikeyan et al. 1996). Pengaruh pH ditentukan dengan cara mengukur viskositas, total gula sisa, bo-bot ekstrak kasar dekstran dan TPC isolat pada 25 mL media yang mengandung sukrosa 30% dengan variasi pH 7,0; 7,5; 8,0; dan 8,5 pada suhu 30C. Pengaruh suhu ditentukan dengan cara mengukur viskositas, total gula sisa, bobot ekstrak kasar dekstran dan TPC isolat pada media yang mengandung sukrosa 30% pada pH optimum, dan diinkubasi pada variasi suhu 30 dan 40C. Pengaruh konsentrasi sukrosa ditentukan dengan cara mengukur viskositas, total gula sisa, bobot ekstrak kasar dekstran, dan TPC isolat pada variasi konsentrasi substrat sukrosa, yaitu 10, 20, dan 30% pada media dan diinkubasi dengan suhu op-timum.
Identifikasi Molekuler Isolat Terpilih
Identifikasi molekuler gen 16S rRNA dimulai dari tahap isolasi DNA genom menggunakan Presto Mini gDNA Bacteria Kit (GeneaidnGBB 100). DNA genom yang diperoleh diamplifikasikan menggunakan mesin PCR dengan primer 63f (5’-CAGGCCTAACACATG CAAGTC-3’) dan 1387r (5’-GGGCGGWGTGTACAA GGC-3’). Kondisi PCR meliputi tahap pre-denaturation
(94C, 4 menit), denaturation (94C, 30 detik),
annealing (55C, 30 detik), elongation (72C, 1 menit),
dan post-elongation (72C, 7 menit), dan amplifikasi dilakukan sebanyak 30 siklus. Produk PCR, selan-jutnya dielektroforesis dan dilakukan visualisasi di atas UV transluminator menggunakan pewarna Ethidium Bromida (EtBr). Analisis sekuensing dilakukan oleh perusahaan jasa sekuensing. Hasil sekuensing DNA dibandingkan dengan GenBank database pada media
Online NCBI.
HASIL DAN PEMBAHASAN
Isolat Bakteri Penghasil Dekstransukrase
Isolasi bakteri dilakukan berdasarkan metode Dimic (2006). Isolat pada tabung yang menunjukkan keken-talan media tertinggi dan tercepat, yaitu tabung isolat TBB 1, TBB 5, TBT 3, dan TBT 2 yang kemudian diinokulasikan pada media selektif padat dengan metode gores untuk memperoleh koloni-koloni tunggal. Koloni-koloni yang terpilih adalah koloni yang menun-jukkan adanya senyawa dekstran pada permukaan media sukrosa, yaitu terdapat lendir di sekitarnya (Yang et al. 2015). Hasil seleksi ini didapatkan 6 koloni isolat murni, yaitu TBT 2; TBT 3,1; TBT 3,2; TBB 1,1; TBB 1,2; dan TBB 5 yang memiliki ciri-ciri koloni yang dinyatakan pada Tabel 1. Penelitian yang dilakukan Dimic (2006) berhasil mengisolasi bakteri penghasil dekstran dari berbagai sayuran sebanyak 59 isolat yang merupakan spesies L. mesenteroides dengan ciri koloni permukaan cembung, dengan tepi datar, halus, mengkilap, dan semitransparan. Ciri-ciri koloni tersebut mirip dengan koloni dari isolat TBT 3,2. Menurut Zahnley dan Smith (1995), dekstran yang dihasilkan oleh galur yang berbeda memiliki perbedaan dalam karakter fisik dan kimiawinya. Begitupula menurut Tahir (2012), struktur yang berbeda dari setiap jenis dekstran bergantung pada jenis asal mikrob dan karakteristiknya.
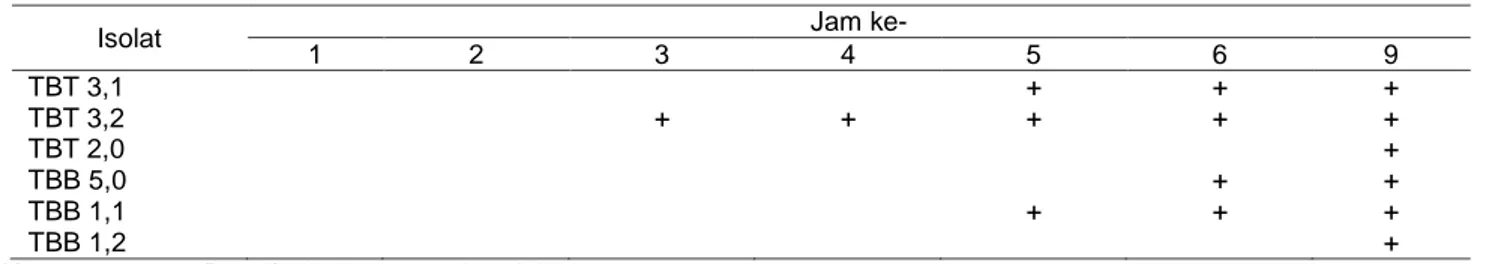
Isolat-isolat hasil isolasi diseleksi dengan cara pengamatan terbentuknya dekstran, pengukuran vis-kositas, dan bobot dekstran. Pengamatan pemben-tukan dekstran dilakukan dengan cara mengamati pembentukan gumpalan-gumpalan dekstran setiap jam selama 24 jam. Hasil pengamatan menunjukkan isolat TBT 3,2 mulai membentuk dekstran pada jam ke-3, sedangkan pada isolat lain terbentuk pada jam ke-5,
Tabel 1 Morfologi Koloni Isolat
Isolat Warna koloni Permukaan koloni Tepi koloni Gram Bentuk bakteri TBT 3,1 Krem Cembung mengkilap dan
berlendir Rata Negatif (-) Basil
TBT 3,2 Krem transparan
Cembung mengkilap dan
berlendir Rata Positif (+) Basil
TBT 2 Krem Agak Cembung mengkilap dan
berlendir Tidak Rata Negatif (-) Coccus
TBB 5 Krem Cembung mengkilap dan
berlendir Tidak Rata Negatif (-) Coccus
TBB 1,2 Krem Cembung mengkilap dan
berlendir Rata Negatif (-) Coccus
TBB 1,1 Krem Cembung mengkilap dan
berlendir Rata Negatif (-) Coccus
6, dan 9 (Tabel 2). Hal ini menunjukkan bahwa isolat TBT 3,2 memiliki adapatasi yang lebih cepat pada media yang mengandung sukrosa 10% dibanding dengan isolat bakteri lainnya dalam hal memproduksi dekstran. Pembentukan dekstran pada penelitian Sarwat et al. (2008) terjadi pada jam ke-6 dan terus meningkat hingga jam ke-20. Hal ini berbeda dari penelitian yang dilakukan oleh Hasan (1999) di mana pembentukan dekstran membutuhkan waktu yang sangat lama, yaitu baru terjadi pada hari ke-3 setelah inokulasi.
Berdasarkan hasil pada Tabel 3 diperoleh isolat terpilih yang memiliki hasil pengukuran viskositas tertinggi, yaitu isolat TBT 3,2 (1,48 cP) dan TBT 2 (1,46 cP) sehingga kedua isolat tersebut terpilih untuk diseleksi lebih lanjut. Adanya sukrosa dalam medium akan menyebabkan bakteri menghasilkan dekstran yang menyebabkan viskositas larutan meningkat. Selain itu, konsentrasi sukrosa, ekstrak khamir, K2HPO4, dan ekstrak beef ternyata berpengaruh
secara signifikan pada produksi dekstran oleh L. mesenteroides NRRL B-640. Komposisi medium optimal sukrosa 30 g/L, ekstrak khamir 18,9 g/L; K2HPO4 19,4 g/L; dan ekstrak beef 15 g/L dengan nilai
maksimum aktivitas dekstransukrase sebesar 10,9 U/ml (Purama & Goyal 2008).
Perhitungan rendemen dekstran dilakukan ber-dasarkan metode presipitasi menggunakan etanol (Tabel 4). Presipitasi dengan menggunakan etanol dari dua isolat terpilih dilakukan untuk melihat ekstrak kasar dekstran tertinggi yang dihasilkan setelah inkubasi 24 jam pada suhu ruang dengan media yang mengandung 10% sukrosa dan diperoleh isolat TBT 3,2 (7,87 g/L) sebagai isolat terpilih. Penelitian yang dilakukan oleh Aman et al. (2012), bobot dekstran yang dihasilkan oleh L. mesenteroides AA1 pada media yang mengandung 10% sukrosa ialah 4,89 g/L. Isolat TBT 2 menghasilkan bobot dekstran yang jauh lebih sedikit dibandingkan TBT 3,2 walaupun viskositas larutan tidak berbeda. Hal ini dimungkinkan jenis dekstran yang dihasilkan TBT 2 memiliki bobot molekul yang kecil sehingga tidak terendapkan sehingga perlu dilakukan pengukuran dekstran dengan metode lain. Salah satu pengukuran dekstran yang sering digu-nakan adalah proses tanpa pengendapan, yaitu dengan metode kabut (Pontoh et al. 2012). Dekstran memiliki bobot molekul dari 6.000191.500 Da (Falconer et al. 2011). Berdasarkan data pada Tabel 4 maka isolat TBT 3,2 terpilih untuk dikarakterisasi lebih lanjut.
Aktivitas dan Aktivitas Spesifik Dekstransukrase Isolat Terpilih
Aktivitas dekstransukrase dan aktivitas spesifik tertinggi yang diperoleh adalah 29.419 mU/mL dan 0,461 U/mg (Protein 0,063 mg/mL) (Gambar 1). Aktivitas dekstransukrase pada menit ke-30 menga-lami penurunan sebesar 50% dari aktivitas sebelum-nya dan terus menurun. Hal ini menunjukkan bahwa aktivitas dekstransukrase stabil pada waktu inkubasi reaksi selama 25 menit. Dekstransukrase mengkata-lisis polimerisasi dari bagian glukosil sukrosa untuk membentuk dekstran (Olcer & Tanriseven 2010). Ter-jadinya penurunan aktivitas diakibatkan oleh keterse-diaan substrat mulai berkurang. Proses pembentukan dekstran oleh dekstransukrase terus berjalan selama persediaan substrat masih ada. Peningkatan produksi dekstran menunjukkan bahwa dekstran yang disintesis oleh enzim dekstransukrase diperlukan untuk pemben-tukan kapsul pada bakteri (Hassan 1999). Kapsul bak-teri adalah lapisan luar membran plasma dan berkon-tribusi untuk menjaga integritas seluler yang terdiri atas polisakarida dan protein (Gao et al. 2013). Pemben-tukan kapsul di sekitar permukaan bakteri dapat melin-dungi bakteri dari efek pengeringan yang berbahaya. Pengeringan mengubah osmolaritas eksternal se-hingga memicu peningkatan biosintesis kapsul yang sejalan dengan sintesis dektran oleh dekstransukrase (Roberts 1996).
Optimasi Produksi Dekstran dari Isolat Terpilih
Kondisi pertumbuhan setiap jenis mikroorganisme berbeda-beda seperti waktu inkubasi, kondisi pH, suhu inkubasi, dan konsentrasi substrat dalam menghasil-kan suatu produk tertentu. Berdasarmenghasil-kan Tabel 5 hasil pengukuran viskositas, kadar gula sisa, bobot
Tabel 2 Pengamatan pembentukan gumpalan dekstran pada masing-masing isolat
Isolat Jam ke-
1 2 3 4 5 6 9 TBT 3,1 + + + TBT 3,2 + + + + + TBT 2,0 + TBB 5,0 + + TBB 1,1 + + + TBB 1,2 +
Keterangan: + = Positif adanya gumpalan dekstran.
Tabel 3 Viskositas beberapa isolat pada media sukrosa 10% setelah inkubasi 24 jam
Isolat Viskositas (cP) TBT 3,1 1,07 ± 0,01 TBT 3,2 1,48 ± 0,01 TBT 2,0 1,46 ± 0,01 TBB 5,0 1,08 ± 0,01 TBB 1,2 1,12 ± 0,01 TBB 1,1 1,10 ± 0,01
Tabel 4 Rendemen dekstran
Isolat Bobot dekstran (g/L)
TBT 3,2 7,87 ± 0,07
dekstran, dan jumlah mikroba penentuan waktu produksi dekstran isolat TBT 3,2 pada media yang mengandung sukrosa 30% ditentukan pada jam ke-48. Peningkatan viskositas dekstran menunjukkan pening-katan bobot yang berarti bahwa waktu inkubasi memengaruhi bobot rata-rata dekstran. Peningkatan inkubasi lebih lanjut juga dapat menyebabkan pem-bentukan oligosakarida yang bukan produk samping yang diinginkan selama produksi dekstran (Aman et al. 2012). Menurut Purama dan Goyal (2008), selain mengkatalisis sintesis dekstran dari sukrosa, dekstran-sukrase juga mengkatalisis transfer D-glukopiranosil dari sukrosa ke molekul akseptor lainnya yang meng-hasilkan generasi oligosakarida seperti maltooli-gosakarida, isomaltoolimaltooli-gosakarida, dan galaktoo-ligosakarida.
Berdasarkan data pada Tabel 5 tampak bahwa peningkatan viskositas terus terjadi dari jam ke-24 hingga jam ke-60. Peningkatan viskositas pada penelitian ini sangat kecil bila dibandingkan dengan penelitian yang dilakukan oleh Han et al. (2014). Viskositas kultur cair dari fermentasi oleh L. mesenteroides BD1710, yaitu sebesar 451 cP pada akhir fermentasi dengan peningkatan yang luar biasa dari 1224 jam, yang juga menunjukkan bahwa sintesis eksopolisakarida mencapai puncak. Menurut Son et al. (2008), produksi dekstran dengan bobot molekul tinggi, dapat bertanggung jawab atas tingginya viskositas
kultur cair. Peningkatan viskositas kultur cair dengan hasil dekstran juga menunjukkan bahwa polimer tersebut memiliki sifat meningkatkan viskositas, yang mencerminkan polimer dengan struktur kimia khusus, misalnya tingkat percabangan yang bervariasi (Han et al. 2014).
Kondisi fisik, kimia, suhu, dan jumlah sukrosa memainkan peran penting tidak hanya dalam produksi tetapi juga dalam penentuan bobot molekul dekstran. Sukrosa adalah satu-satunya substrat yang tersedia yang menginduksi produksi dekstran (Aman et al. 2012). Media pertumbuhan isolat TBT 3,2 yang baik dalam produksi dekstran adalah media dengan pH 7 (Tabel 6). Hal ini sesuai dengan penelitian Sarwat et al. (2008) yang menemukan bahwa kondisi pH optimum
L. mesenteroides CMGC713 dalam menghasilkan dekstran adalah pH 7. Seiring dengan peningkatan pH, terjadi penurunan dekstran yang dihasilkan.
Isolat TBT 3,2 pada suhu inkubasi 30C meng-hasilkan dekstran yang lebih tinggi dibanding suhu 40C yang sejalan dengan jumlah sel (Tabel 7). Hal yang sama dilaporkan oleh Sarwat et al. (2008), L. mesenteroides CMG713 memiliki suhu optimum dalam menghasilkan dekstran, yaitu 30C dan terus menurun seiring dengan peningkatan suhu inkubasi. Ketika suhu inkubasi tinggi, suhu tidak mendukung multiplikasi sel sehingga menyebabkan produksi enzim dan dekstran lebih sedikit dibandingkan dengan suhu optimum, yaitu
Gambar 1 Aktivitas dekstransukrase isolat TBT 3,2 dalam media cair yang mengandung sukrosa 20%.
Tabel 5 Penentuan waktu produksi dekstran oleh isolat TBT 3,2 pada 100 mL media sukrosa 30% Waktu inkubasi
(jam) Viskositas (cP) Bobot dekstran (g/L)
Jumlah gula yang
dikonsumsi (g/L) Log sel (CFU/mL)
24 2,47 ± 0,01 13,33 ± 0,06 123,83 ± 11,05 8,11 ± 0,07
36 2,63 ± 0,01 27,87 ± 0,10 156,56 ± 15,39 8,50 ± 0,14
48 2,78 ± 0,01 44,50 ± 0,12 208,20 ± 4,73 8,14 ± 0,23
60 2,87 ± 0,01 11,00 ± 0,01 156,42 ± 26,6 8,23 ± 0,26
Tabel 6 Pengaruh pH pada produksi dekstran oleh isolat TBT 3,2 pada 25 mL media sukrosa 30%
pH Viskositas (cP) Bobot dekstran (g/L) Jumlah gula yang
dikonsumsi (g/L) Log cell (cfu/mL)
7,0 3,14 ± 0,11 61,16 ± 0,19 286,39 ± 5,80 8,30 ± 0,11 7,5 2,84 ± 0,12 55,83 ± 0,18 276,15 ± 1,77 8,18 ± 0,13 8,0 2,54 ± 0,04 54,00 ± 0,24 272,12 ± 3,94 8,26 ± 0,08 8,5 2,42 ± 0,02 59,08 ± 0,14 270,61 ± 3,56 8,30 ± 0,08 0 5 10 15 20 25 30 35 0 0,1 0,2 0,3 0,4 0,5 5 15 25 30 35 40 U nit a k tiv it as (m U /m L) Ak tiv it as s pes if ik (U /m g) Waktu (menit)
Aktivitas Spesifik (U/mg) Unit Aktivitas (mU/mL)
30C. Berdasarkan data jumlah gula yang dikonsumsi, dapat dilihat bahwa pemakaian gula berbading lurus dengan hasil bobot dekstran, dan tertinggi diperoleh pada waktu inkubasi 48 jam, pH 7, dan suhu 30C.
Hasil dekstran maksimum diperoleh pada kon-sentrasi sukrosa 20% dan terjadi penurunan produksi dekstran pada peningkatan jumlah sukrosa. Bobot dekstran yang dihasilkan Leuconostoc mesenteroides
AA1 pada konsentrasi sukrosa 20% lebih kecil dibanding dengan penelitian ini, yaitu 4,89 g/L (Aman
et al. 2012). Menurut Sarwat et al. (2008) dan Kim et al. (2003), konsentrasi sukrosa yang lebih tinggi pada media fermentasi memiliki efek penghambatan yang menurunkan produksi dekstran. Hal ini disebabkan karena terjadinya denaturasi enzim (Robyt et al. 2008), struktur sukrosa dalam larutan berubah pada saat kadar air menjadi terbatas (Martinez-espindola & Iopez-munguia 1985).
Berdasarkan data pada Tabel 8 menunjukkan bahwa perbedaan konsentrasi sukrosa pada media tidak memengaruhi jumlah bakteri yang tumbuh, namun memengaruhi jumlah dekstran yang dihasilkan. Menurut Moulis et al. (2006) reaksi polimerisasi dengan dekstransukrase terjadi terutama pada akhir fase pertumbuhan dan dekstran merupakan metabolit se-kunder. Sarwat et al. (2008) menegaskan bahwa enzim tersebut mempolimerisasi sukrosa menjadi dekstran tanpa memerlukan penambahan pertumbuhan sel. Begitupula menurut Belder (2003), sel tidak berkem-bang pada konsentrasi sukrosa >2025%. Jumlah pemakaian gula tertinggi terjadi pada konsentrasi sukrosa 30% namun dekstran yang dihasilkan sedikit. Hal ini diduga terjadi karena gula yang dikonsumsi digunakan dalam metabolisme lain dalam meng-hasilkan energi. Konsentrasi dekstran tertinggi diper-oleh pada perlakuan konsentrasi sukrosa 20%, namun pada konsentrasi sukrosa 30% viskositas cairan sama dengan viskositas cairan dari konsentrasi sukrosa 20%. Hal ini diduga dipengaruhi oleh bobot molekul
dekstran yang dihasilkan. Menurut Falconer et al.
(2011) bobot molekul dekstran yang disintesis akan meningkat ketika konsentrasi sukrosa meningkat.
Identitas Molekuler Isolat Terpilih
Berdasarkan analisis sekuens gen 16S rRNA isolat TBT 3,2 menggunakan BLAST (Tabel 9), diperoleh bahwa isolat TBT 3,2 berkerabat dekat dengan
Paenibacillus polymyxa strain CF05 dengan tingkat kemiripan 99%.
Berdasarkan morfologi isolat TBT 3,2 pada Tabel 1 maka isolat TBT 3,2 merupakan bakteri Gram positif berbentuk basil yang sesuai dengan penelitian Lal dan Tabacchioni (2009) yang menyebutkan bahwa bakteri
P.s polymyxa berbentuk basil dan termasuk dalam bakteri Gram positif. Sifat pembentuk lendir dari ekstrak Bacillus mesentericus pertama kali diamati pada tahun 1910. Penelitian selanjutnya menunjukkan bahwa dekstran dapat dibentuk oleh beberapa galur bakteri Gram positif, secara fakultatif anaerobik (Tahir 2012). P. polymyxa (sebelumnya dikenal sebagai
Bacillus polymyxa) telah menarik minat besar karena potensi bioteknologi yang hebat dalam berbagai proses industri dan dalam pertanian berkelanjutan. Genus Paenibacillus ditemukan oleh Ash et al. (1993).
KESIMPULAN
Isolat terpilih TBT 3,2 merupakan isolat yang dapat menghasilkan dekstransukrase dan mampu mensin-tesis glukosa dari sukrosa menjadi dekstran tertinggi dan berkerabat dekat dengan spesies Paenibacillus polymyxa strain CF05. Aktivitas dekstransukrase tertinggi diperoleh sebesar 29.419 mU/mL dan aktivitas spesifik sebesar 0,461 U/mg pada inkubasi 25 menit. Kondisi optimum pertumbuhan isolat TBT 3,2 adalah pada media yang mengandung sukrosa 20%, pH 7, dan inkubasi pada suhu 30C selama 48 jam.
Tabel 7 Pengaruh suhu pada produksi dekstran oleh isolat TBT 3,2 pada 25 mL media sukrosa 30%
Suhu Viskositas (cP) Bobot dekstran (g/L) Jumlah gula yang
dikonsumsi (g/L) Log cell (cfu/mL) 30C 2,52 ± 0,08 52,33 ± 0,13 276,10 ± 3,54 8,10 ± 0,07 40C 1,88 ± 0,01 39,48 ± 0,14 190,22 ± 21,40 6,55 ± 0,11 Tabel 8 Pengaruh konsentrasi sukrosa pada produksi dekstran oleh isolat TBT 3,2
Konsentrasi
sukrosa Viskositas (cP) Bobot dekstran (g/L)
Jumlah gula yang
dikonsumsi (g/L) Log cell (cfu/mL)
10% 1,96 ± 0,02 71,75 ± 0,04 121,06 ± 4,22 8,14 ± 0,11
20% 2,54 ± 0,06 90,62 ± 0,15 252,02 ± 4,02 8,27 ± 0,03
30% 2,55 ± 0,03 30,62 ± 0,01 280,57 ± 12,31 8,13 ± 0,03
Tabel 9 Hasil analisis sekuens gen 16S rRNA isolat TBT 3,2 Strain pembanding
(GenBank)
Nilai
maks. Total nilai
Query cover
(%) E-value
Identitas
maks. (%) No. Aksesi Paenibacillus polymyxa strain
DAFTAR PUSTAKA
Aman A, Siddiqui NN, Qader SA. 2012. Characterization and potential applications of high molecular weight dextran produced by Leuconostoc mesenteroides AA1. Carbohydrate Polymers. 87: 91015. https://doi.org/10.1016/j.carbpol.2011.08. 094
Ash C, Priest FG, Collins MD. 1993. Molecular identifi cation of rRNA group 3 bacilli (Ash, Farrow, Wallbanks and Collins) using a PCR probe test.
Antonie Van Leeuwenhoek. 64: 253260. https:// doi.org/10.1007/BF00873085
Baktir A, Koiriyah Z, Rohman A. 2005. A thermophilic microbe producing dextranase from heated sugar cane. Indonesian Journal of Chemistry. 5(3): 224227.
Belder AN. 2003. Dextran. Handbook from Amersham Biosciences. Sweden (SE): Uppsala University. Dimic GR. 2006. Characteristics of the Leuconostoc
mesenteroides subsp. mesenteroides strains from fresh vegetables. APTEFF. 37: 311. https:// doi.org/10.2298/APT0637003D
Falconer DJ, Mukerjea R, Robyt JF. 2011. Biosynthesis of dextrans with different molecular weights by selecting the concentration of Leuconostoc mesenteroides B-512FMC dextransucrase, the sucrose concentration, and the temperature.
Carbohydrate Research. 346: 280284. https://doi.org/ 10.1016/j.carres.2010.10.024 Gao S, Lewis GD, Ashokkumar M, Hemar Y. 2013.
Inactivation of microorganisms by low-frequency high-power ultrasound: 1. Effect of growth phase and capsule properties of the bacteria. Ultrason Sonochem. 2013: 18.
Han J, Hang F, Guo B, Liu Z, You C, Wu Z. 2014. Dextran synthesized by Leuconostoc mesenteroides BD1710 in tomato juice supplemented with sucrose. Carbohydrate Polymers. 112: 556562. https://doi.org/ 10.1016/j.carbpol.2014. 06.035
Hasan Z. 1999. Isolasi dan karekterisasi dekstransukrase dari isolat bakteri batang tebu.
[Tesis]. Bogor (ID): Institut Pertanian Bogor. Karthikeyan RS, Rakshit SK, Baradarajan A. 1996.
Optimization of batch fermentation condition for dextran production. Bioprocess Engineering. 15: 247251. https://doi.org/10.1007/BF02391585 Khalikova E, Susi P, Korpela T. 2005. Microbial
dextran-dydrolyzing enzymes: fundamentals and applications. Microbiology and Molecular Biology Reviews. 69(2): 306324. https://doi.org/ 10.1128/MMBR.69.2.306-325.2005
Kim D, Robyt JF, Lee SY, Lee JH, Kim YM. 2003. Dextran molecular size and degree of branching as
a function of sucrose concentration, pH, and temperature of reaction of Leuconostoc mesenteroides B-512FMCM dextransucrase.
Carbohydrate Research. 338: 11831189. https:// doi.org/10.1016/S0008-6215(03)00148-4
Lal S, Tabacchioni S. 2009. Ecological and Biotechnological Potencial of Paenibacillus polymyxa: a minireview. Indian of Journal Microbiology. 49: 210. https://doi.org/10.1007/ s12088-009-0008-y
Lawford GG, Kligerman A, Williams T. 1979. Dextranbiosynthesis of dextransucrase production by continous culture of Leuconostoc mesenteroides. Biotechnology and Bioengineering. 21: 11211131. https://doi.org/10.1002/bit.26021 0704
Lee JM, Fox PF. 1985. Purification and characterization of Paecilomyces lilacinus
dextranase. Enzyme Microbiology Technology. 7: 573577. https://doi.org/10.1016/01410229(85) 90103-6
Martinez-espindola JP, Iopez-munguia CA. 1985. On the kinetics of dextransucrase and dextran synthesis in batch reactors. Biotechnology Letters. 7(7): 483486. https://doi.org/10.1007/BF01199863 Moulis C, Gilles J, David H, Emeline F, Gabrielle PV, Pierre M, Magali RS. 2006. Understanding the polymerization mechanism of glycoside-hydrolase family 70 glucansucrases. Journal of Biological Chemistry. 281(42): 31.25431.267.
Miyagawa Y, Seto H, Ohto K, Kawakita H. 2012. Giant dextran partivles formed by dextransucrase immobilized on a tube surface in laminar flow.
Biochemical Engineering Journal. 64: 1721. https://doi.org/ 10.1016/j.bej.2012.02.008
Nuryadi MM, Istiqomah T, Faizah R, Uabidillah S, Mahmudi Z. 2013. Isolasi dan identifikasi bakteri asam laktat asal youghurt. Journal University of Jember. 1(5): 111.
Olcer z, Tanriseven A. 2010. Co-immobilization of dextransucrase and dextranase in alginate. Process Biochemistry. 45:1.6451.651.
Padmanabhan PA, Kim DS. 2002. Production of insoluble dextran using cell-bound dextransucrase of Leuconostoc mesenteroides NRRL B-523.
Carbohydrate Research. 337: 15291533. https://doi.org/ 10.1016/S0008-6215(02)00214-8 Pennell RD, Barker PE. 1992. The production of the
enzyme dextransucrase using unaerated continous fermentation. Journal of Chemical Technology and Biotechnology. 53: 2127. https://doi.org/10.1002/ jctb.280530104
Pontoh J, Mirah G, Karundeng P, Kamuh V. 2012. Metode analisa dextran dalam nira dan gula aren.
Purama RK, Goyal A. 2008. Screening and optimization of nutritional factors for higher dextransucrase production by Leuconostoc mesenteroides NRRL B-640 using statistical approach. Bioresource Technology. 99: 7.1087.114. https://doi.org/10.1016/j.biortech. 2008.01.032
Roberts IS. 1996. The biochemistry and genetics of capsular polysaccharide production in bacteria.
Annuak Review of Microbiology. 50: 285315. https://doi.org/ 10.1146/annurev.micro.50.1.285 Robyt JF, Yoon SH, Mukerjea R. 2008. Dextransucrase
and the mechanism for dextran biosynthesis.
Carbohydrate Research. 343: 3.0393.048. https:// doi.org/ 10.1016/j.carres.2008.09.012
Sarwat F, Qader SA, Aman A, Ahmed N. 2008. Production & characterization of a unique destran from an indigenous Leuconostoc mesenteroides
CMG713. International Journal of Biological Sciences. 4: 379386. https://doi.org/10.7150/ ijbs.4.379
Son MJ, Jang EK, Kwon OS, Seo JH, Kim IJ, Lee IS. 2008. Characterization of dextran produced from
Leuconostoc citreum S5 strain isolated from Korean fermented vegetable. European Food Research and Technology. 226(4): 697706. https:// doi.org/10.1007/s00217-007-0579-y
Tahir MN. 2012. Alkynyl ethers of dextrans as intermediates for new functional biopolymers. [Disertasi]. Braunschweig (DE): Technische Universität Braunschweig.
Yang Y, Peng Q, Guo Y, Han Y, Xiao H, Zhou Z. 2015. Isolation and characterization of dextran produced by Leuconostoc citreum NM105 from manchurian sauerkraut. Carbohydrate Polymers. 133: 365372. https://doi.org/10.1016/j.carbpol.2015.07.061 Zahnley JC, Smith MR. 1995. Insoluble glucan
formation by Leuconostoc mesenteroides NRRL B-1355. Applied and Environmental Microbiology. 61: 1.1201.123.
Zohra RR, Aman A, Zohra RR, Ansari A, Ghani M, Qader SAU. 2013. Dextranase: hyper production of dextran degrading enzyme from newly isolated strain of Bacillus licheniformis. Carbohydrate Polymers. 92: 2.1492.153. https://doi.org/10.1016/ j.carbpol.2012.11.044