TUGAS KIMIA ORGANIK III
REAKSI SUBSTITUSI BROMOBENZENA
Disusun Oleh :
Riza Gustia
(A1C109020)
Janharlen P
(A1C109044)
Zunarta Yahya
(A1C109027)
Slamat
(A1C109019)
Dosen Pengampu
: Afrida, S.Si, M.Si
PENDIDIKAN KIMIA
FAKULTAS KEGURUAN DAN ILMU PENDIDIKAN
UNIVERSITAS JAMBI
Reaksi Subtitusi Bromobenzena
(Brominasi Benzena)
a. Reaksi Substitusi pertama pada cincin benzene
Tanpa adanya asam Lewis dalam campuran reaksinya, benzena tidak dapat bereaksi
dengan brom. Bila ada asam Lewis maka benzena dengan cepat bereaksi dengan brom, dan
menghasilkan bromobenzena .
Asam Lewis yang paling umum digunakan pada reaksi klorinasi dan brominasi adalah:
FeCl3, FeBr 3, dan AlCl3.
Mekanisme brominasi benzena dapat dituliskan sebagai berikut:
Tahap 1 pembentukan elektrofil
ion bromonium +
Br Br + FeBr3 FeBr
3 +
Br
Br Br+ Br
FeBr3
-
-panas FeCl3 Br2
+
+ Br
HBr
Tahap 2 substitusi elektrofil ke benzene
Tahap 3 pelepasan ion hydrogen
Asam Lewis berfungsi dalam pembentukan kompleks dengan Br2 yang selanjutnya
terurai membentuk ion bromonium dan FeBr4-. Pada tahap 2 ion Br+ menyerang inti benzena
membentuk ion benzonium. Pada tahap 3 ion benzenonium memberikan proton kepada FeBr-4
dan hasil akhir yang diperoleh adalah bromobenzena dan hidrogen bromida. Pada akhir reaksi
katalis FeBr3 terbentuk kembali.
b. Reaksi substitusi kedua pada cincin benzene
Hubungan antara struktur substrat dan kereaktifannya dalam substitusi elektrofilik senyawa
aromatik.
Hasil monosubstitusi benzena pada reaksi substitusi elektrofilik, maka substituen yang
telah ada tersebut akan berpengaruh pada laju reaksi dan arah serangan. Berlangsungnya proses
substitusi tersebut dapat lebih cepat atau lebih lambat daripada benzena. Sedangkan gugus baru
mungkin diarahkan pada posisi orto, meta, atau para.
Gugus-gugus yang meningkatkan laju reaksi dinamakan gugus pengaktif sedangkan gugus yang memperlambat laju reaksi disebut gugus pendeaktif. Gugus-gugus yang termasuk kelompok pengarah orto-para sebagian bersifat pengaktif dan sebagian lainnya bersifat
pendeaktif, sedangkan gugus-gugus pengarah meta semuanya termasuk dalam kelompok
pendeaktif. Jika suatu gugus dikatakan sebagai pengaruh orto-para tidak mutlak diartikan bahwa
gugus yang baru seluruhnya diarahkan keposisi orto dan para
Halogen termasuk kelompok gugus pengarah orto-para, tetapi gugus ini mendeaktifkan
inti. Kekhususan pada halogen ini dapat dijelaskan dengan asumsi bahwa efek induksinya
mempengaruhi kereaktifan dan efek resonansinya menentukan orientasi. Pada senyawa
klorobenzena, karena atom klor sangat elektronegatif maka diperkirakan terjadi penarikan
elektron pada inti benzena dan karena itu mendeaktifkan inti benzena dalam reaksi subtitusi
elektrofilik.
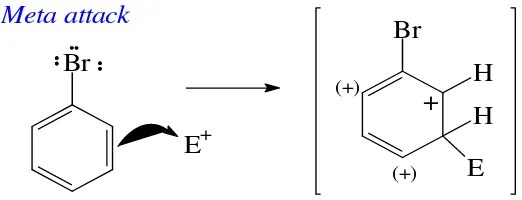
Ada 3 buah posisi pada benzene :
tidak terjadi ion bromonium pada serangan posisi meta.
Tabel 5.2 Efek substituen pada substitusi elektrofilik senyawa aromatik
Pengarah Orto-Para Pengarah Meta
Pengaktif kuat
Contoh substitusi ke 2 pada bromobenzene :
Mekanisme reaksi :
1. Pembentukan elektrofil
2. Penyerangan elektrofil pada orto
Br Br
Br
+
H +
Br Br
H
+
Br Br
H
+
Br Br
sangat stabil Br+
Br Br
H
Br Br
3. Penyerangan pada meta.
4. Penyerangan pada para.
Benzena
Benzena merupakan sikloheksena yaitu senyawa siklik yang memiliki ikatan rangkap dua
aromatik dengan rumus struktur C6H12. Benzena dilambangkan dalam dua bentuk, yang pertama
adalah struktur Kekulé dan yang lainnya adalah heksagon dengan lingkaran di dalamnya untuk
menggambarkan adanya resonansi ikatan ʋ atau distribusi elektron yang tersebar merata didalam cincin benzena. Kedua struktur ini disederhanakan pada gambar berikut.
Gambar. Struktur Kekulé dan heksagonal benzena
Adanya ikatan rangkap dua pada senyawa sikloheksena ini menunjukkan bahwa benzena
termasuk hidrokarbon tidak jenuh, namun pada umumnya benzena tidak berperilaku seperti
senyawa tak jenuh.
a.
Sejarah
Benzena ditemukan pada tahun 1825 oleh seorang ilmuwan Inggris, Michael Faraday,
yang mengisolasikannya dari gas minyak dan menamakannya bikarburet dari hidrogen. Pada tahun 1833, kimiawan Jerman, Eilhard Mitscherlich menghasilkan benzena melalui distilasi
asam benzoat (dari benzoin karet/gum benzoin) dan kapur. Mitscherlich memberinya nama
benzin. Pada tahun 1845, kimiawan Inggris, Charles Mansfield, yang sedang bekerja di bawah August Wilhelm von Hofmann, mengisolasikan benzena dari tir (coal tar). Empat tahun kemudian, Mansfield memulai produksi benzena berskala besar pertama menggunakan metode
b.
Sifat- Sifat
Sifat Fisik:
Zat cair tidak berwarna
Memiliki bau yang khas
Mudah menguap
Tidak larut dalam pelarut polar seperti air air, tetapi larut dalam pelarut yang kurang polar atau nonpolar, seperti eter dan tetraklorometana
Titik Leleh : 5,5 derajat Celsius
Titik didih : 80,1derajat Celsius
Densitas : 0,88
Sifat Kimia:
Bersifat kasinogenik (racun)
Merupakan senyawa nonpolar
Tidak begitu reaktif, tapi mudah
terbakar dengan menghasilkan banyak jelaga
Lebih mudah mengalami reaksi substitusi dari pada adisi. (untuk mengetahui beberapa reaksi subtitusi pada benzene
c.
Kegunaan
Benzena, juga dikenal dengan nama C6H6, dan benzol, adalah senyawa kimia organik
yang berupa cairan tak berwarna dan mudah terbakar serta mempunyai bau yang khas. Benzena
adalah sejenis karsinogen. Benzena adalah salah satu komponen dalam bensin dan merupakan
pelarut yang penting dalam dunia industri. Benzena juga adalah bahan dasar dalam produksi
obat-obatan, plastik, bensin, karet buatan, dan pewarna. Selain itu, benzena adalah kandungan
alami dalam minyak bumi, namun biasanya diperoleh dari senyawa lainnya yang terdapat dalam
minyak bumi.
Massa molar 78,1121 g/mol
Penampilan Cairan tak berwarna
Densitas 0,8786 g/mL, zat cair
Titik leleh 5,5 °C (278,6 K)
Titik didih 80,1 °C (353,2 K)
Kelarutan dalam air 0,8 g/L (25 °C)
Viskositas 0,652 cP pada 20 °C
Brom (Br)
a.
Sejarah
Ditemukan oleh Balard pada tahun 1826, tapi belum dapat dipisahkan secara kuantitatif
hingga 1860.
b.
Sumber
Brom termasuk ke dalam golongan halogen. Diperoleh air garam alamiah dari sumber mata
air di Michigan dan Arkansas. Brom juga diekstrak dari air laut, dengan kandungan hanya
sebesar 82 ppm.
c.
Sifat-sifat
Brom adalah satu-satunya unsur cair non logam. Sifatnya berat, mudah bergerak, cairan
berwarna coklat kemerahan, mudah menguap pada suhu kamar menjadi uap merah dengan bau
yang sangat tajam., menyerupai klor, dan memiliki efek iritasi pada mata dan tenggorokan. Brom
mudah larut dalam air atau karbon disulfida, membentuk larutan berwarna merah, tidak sekuat
klor tapi lebih kuat dari iod. Dapat bersenyawa dengan banyak unsur dan memiliki efek pemutih.
Ketika brom tumpah ke kulit, akan menimbulkan rasa yang amat pedih. Brom mengakibatkan
bahaya kesehatan yang serius, dan peralatan keselamatan kerja harus diperhatikan selama
menanganinya.
d.
Produksi
Banyak brom yang dihasilkan Amerika Serikat digunakan dalam produksi etilen dibromida,
bensin merusak lingkungan, berarti hal ini akan mempenngaruhi produksi brom di masa yang
akan datang.
e.
Kegunaan
Brom digunakan untuk desinfektan, zat tahan api, senyawa pemurni air, pewarna, obat,
pembersih sanitasi, bromida anorganik untuk fotografi dan lain-lain. Bromida organik juga sama
Bromobenzena
Bromobenzene adalah aril halida , C6H5Br, yang dapat dibentuk oleh substitusi aromatik
elektrofilik dari benzena menggunakan brom . Ini adalah cairan kuning jernih, tidak berwarna
atau pucat. Zat ini larut dalam metanol dan dietil eter.
a.
Kegunaan
Bromobenzene dapat digunakan untuk
mempersiapkan reagen yang sesuai pereaksi
Grignard , bromida phenylmagnesium . Ini dapat
digunakan, misalnya dalam reaksi dengan karbon
dioksida untuk mempersiapkan asam benzoat .
Bromobenzene digunakan sebagai bahan dalam
pembuatan phencyclidine .
b.
Farmakologi
Ini adalah zat beracun dan dapat menyebabkan
kerusakan hati dan sistem saraf jika terhirup,
tertelan, atau terserap melalui kulit.
Bromobenzene
Penampilan Yang jelas, berwarna agak kuning cair , Menenangkan, bau aromatik